鳀鱼(Engraulis japanicus)是一种小型中上层低值鱼类,平均体长约8~12 cm,在我国的东海区、黄海区资源丰富。鳀鱼营养价值较高,但其个体小,容易腐烂,不适合鲜食,捕捞后常制成鱼干,后加工成调味鱼制品[1]。杀菌工艺对调味鱼制品是必要的,可以保证产品的安全性并使其具有一定的货架期,但高温条件下发生的褐变反应,影响调味鱼的感官品质。
美拉德反应是食品加工过程中广泛存在的一种非酶褐变反应,是游离氨基酸,肽或蛋白质的氨基与还原糖的羰基之间的复杂反应,最终生成黑色素[2]。调味鱼制品由于含有丰富的蛋白质、氨基酸和糖类,高温杀菌过程中容易发生美拉德反应,导致鱼肉制品颜色加深。添加褐变抑制剂是食品工业中抑制褐变最广泛采用的方法,可以通过添加活性氨基物质、有机酸、抗氧化剂等对食品中的美拉德反应进行控制,减缓反应带来的不必要的颜色变化[3]。半胱氨酸是含有巯基的氨基酸,可以抑制食品中的多种褐变反应,在罐头、饮料以及鲜切果蔬类食品中均有应用[4]。柠檬酸是食品工业中常用的酸化剂和螯合剂,减缓饮料及罐头类食品中的美拉德等褐变反应[5]。D-异抗坏血酸钠是稳定性较高的天然抗氧化剂,常用作休闲肉制品的护色剂[6]。王进勉[7]的研究表明柠檬酸可以抑制鱿鱼丝浸提液的褐变反应。黄梅桂[8]的研究表明半胱氨酸可以显著抑制大豆肽美拉德反应体系的颜色,适量的VC对美拉德褐变也有一定的抑制作用。
因此,本实验以调味鳀鱼为研究对象,通过添加L-半胱氨酸、柠檬酸、D-异抗坏血酸钠3种护色剂对杀菌过程中的颜色变化进行控制。利用A420、A294、荧光强度表征美拉德反应程度,结合pH、还原糖、5-HMF指标的分析,以期阐明护色剂对杀菌后改善调味鱼颜色的原因,为调味水产食品的褐变控制提供理论依据。
1 材料与方法
1.1 材料与试剂
鳀鱼干原料购于无锡天蓬食品城,质量(2.0±0.5) g,体长(5.0±1.0) cm,水分含量44%;
三氯乙酸、无水乙醇、草酸、2-硫代巴比妥酸、葡萄糖、5-HMF均为分析纯,国药集团化学试剂有限公司。
L-半胱氨酸、柠檬酸、D-异抗坏血酸钠均为食品级,浙江一诺生物科技有限公司。
1.2 仪器与设备
LE438 pH计,梅特勒-托利多仪器有限公司;UltraScan Pro1166高精度分光测色仪,美国Hunterlab公司; UV-1800紫外可见分光光度计,日本岛津公司;Waters 1525EF 高效液相色谱仪-示差折光检测器,美国Waters公司;F-7000荧光分光光度计,日本Hitachi公司。
1.3 试验方法
1.3.1 实验设计
根据GB 2760—2014,L-半胱氨酸、柠檬酸、D-异抗坏血酸钠可在各类食品中按需添加。参考王进勉[7]、黄梅桂[8]的研究结果,确定护色剂的添加量均为0.1%~0.5%(质量分数)。添加护色剂到拌料鱼中,用高聚合尼龙复合聚乙烯袋真空封口,110 ℃,35 min杀菌后取样,-20 ℃冰箱保存。对样品的色差、pH、还原糖和5-HMF含量、荧光强度、A294、A420的变化进行测定分析。
1.3.2 色差分析
采用高精度分光测色仪对调味鱼表面的亮度(L*)、红度(a*)、黄度(b*)值进行测定。再根据公式(1)计算总色差ΔE [9]:
(1)
式中:L*,亮度;a*,红度;b*,黄度。
1.3.3 pH值的测定
参照GB 5009.237—2016。
1.3.4 还原糖的测定
参照GENG等[10]的方法并加以改进。将2.5 g搅碎的样品用10 mL无水乙醇均质,然后在4 ℃,1 000×g下离心5 min。用5 mL 80%(体积分数)乙醇水溶液重复萃取3次,合并上清液并用双层滤纸过滤。
提取液通过0.45 μm滤膜,通过HPLC分析。使用条件为:色谱柱:Waters Sugar-pak1 6.5 mm×300 mm;柱温:40 ℃;检测:示差折光检测器;进样体积:15 μL;流动相:0.1 mol/L NaNO3;流速:0.3 mL/min。
1.3.5 5-HMF的测定
参照LAMBERTS等[11]的方法并加以改进。将2 g搅碎的样品用9 mL 0.15 mol/L的草酸溶液均质,振荡提取30 min,与6 mL 40%(体积分数)三氯乙酸溶液混合,静置10 min。在4 ℃,4 000×g下离心15 min,取4 mL上清液与1 mL 0.05 mol/L 2-硫代巴比妥酸溶液混合,40 ℃水浴30 min,冷却后测定443 nm处吸光值。
1.3.6 吸光值的测定
参照GENG等[12]的方法并加以改进。将3 g搅碎的样品用10 mL预冷的去离子水均质,然后与10 mL冷的20%三氯乙酸溶液匀浆混合。将混合物在 4 ℃,10 000×g下离心10 min,提取液用滤纸过滤后测定荧光强度(激发波长370 nm;发射波长440 nm)及在294 nm、420 nm处吸光值。
1.3.7 数据处理
色差测定重复5次,其余实验重复3次,取平均值。采用SPSS 22.0对数据进行统计分析,采用Duncan’s多重分析进行组间显著性检验, P<0.05表示差异显著。并用Origin 9.0软件作图。
2 结果与分析
2.1 护色剂对调味鱼颜色变化的影响
由表1可知,杀菌后,调味鱼的L*、a*、b*、ΔE 值分别下降了12.4%、26.3%、28.6%、17.7%,整体颜色变暗,这与TANG等[13]的研究结果一致。鱼罐头中含有的糖类和蛋白质在杀菌过程中因受热发生美拉德反应,造成L*值的降低,调味鱼颜色变暗。a*和b*值的降低可能是调味鱼中色素降解等因素与美拉德反应综合作用的结果[13]。
表1 杀菌过程对调味鱼颜色变化及美拉德反应关联值的影响
Table 1 Effect of sterilization process on color change and correlation value of Maillard reaction of seasoned fish
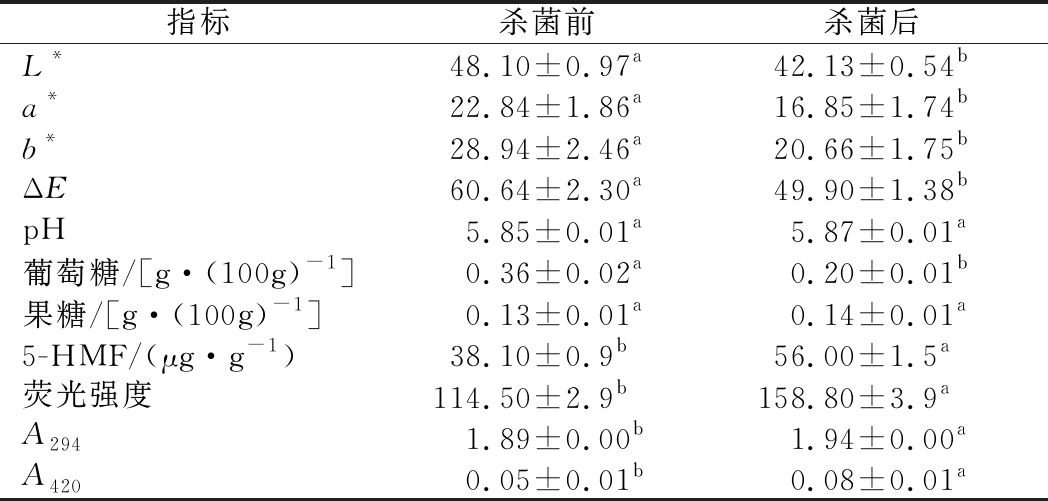
指标杀菌前杀菌后L*48.10±0.97a42.13±0.54ba*22.84±1.86a16.85±1.74bb*28.94±2.46a20.66±1.75bΔE60.64±2.30a49.90±1.38bpH5.85±0.01a5.87±0.01a葡萄糖/[g·(100g)-1]0.36±0.02a0.20±0.01b果糖/[g·(100g)-1]0.13±0.01a0.14±0.01a5-HMF/(μg·g-1)38.10±0.9b56.00±1.5a荧光强度114.50±2.9b158.80±3.9aA2941.89±0.00b1.94±0.00aA4200.05±0.01b0.08±0.01a
注:表中数值均为平均值±标准差;不同的上标字母表示不同列存在显著性差异(P<0.05)
由表2可知,随着L-半胱氨酸添加量的增加,调味鱼的L*、a*、b*、ΔE值先增加后趋于平稳,相比于空白组均有显著提高(P<0.05),这与WEI等[14]的研究结果一致。添加柠檬酸后,调味鱼的L*、b*、ΔE 值相比于空白组有显著提高,但a*值没有显著性差异。添加D-异抗坏血酸钠后,调味鱼的L*、ΔE 值相比于空白组有显著提高,但不同添加量之间没有显著性差异,a*、b*值与空白组没有显著性差异。由此可见,适量添加3种护色剂可以提高杀菌后调味鱼的整体明亮度。以总色差为依据,L-半胱氨酸、柠檬酸、D-异抗坏血酸钠的最适添加量(质量分数)分别为0.3%、0.4%、0.1%。整体来看,半胱氨酸作为护色剂的效果最好。
表2 不同添加量的护色剂对杀菌后调味鱼颜色变化的影响
Table 2 Effect of color protectant on color change of seasoned fish after sterilization

处理组添加量(质量分数)/%L*a*b*ΔE对照组0.042.13±0.54d16.85±1.74c20.66±1.75d49.90±1.38d0.144.69±1.11c17.63±1.56bc22.50±1.99c53.09±1.79c0.246.20±0.97b18.03±1.42abc24.68±1.68ab55.42±1.39bL-半胱氨酸0.347.31±1.07a18.89±1.02ab26.11±1.66a57.26±1.68a0.446.33±0.89ab19.40±0.82a25.78±1.28ab56.47±1.16ab0.546.57±0.94ab17.98±0.67abc24.21±1.18bc55.49±1.30b0.042.13±0.54b16.85±1.74a20.66±1.75d49.90±1.38c对照组0.144.17±1.19a17.04±1.50a22.44±1.19c52.42±1.54ab0.243.91±1.12a17.14±1.10a22.30±1.66ab52.17±1.78ab柠檬酸0.343.99±1.22a16.73±2.20a21.59±2.95a51.86±2.59abc0.444.78±1.00a18.24±2.24a23.98±2.59ab54.03±2.49a0.542.54±0.97b16.87±1.22a20.72±1.33bc50.26±1.31bc对照组0.042.13±0.54b16.85±1.74ab20.66±1.75a49.90±1.38b0.144.87±0.64a16.13±1.64ab21.57±2.24a52.38±1.71a0.244.70±1.27a17.44±1.36ab22.48±2.08a53.02±2.15aD-异抗坏血酸钠0.344.53±0.91a17.36±1.37ab22.09±1.80a52.68±1.67a0.444.60±1.84a15.92±1.33b20.33±2.50a51.59±2.29ab0.544.06±1.12a17.70±1.69a21.68±2.04a52.23±1.96a
注:表中数值均为平均值±标准差,不同的上标字母表示不同行存在显著性差异(P<0.05)
2.2 pH值的变化
pH是美拉德反应的重要影响因素,主要作用于美拉德反应初始阶段的羰氨缩合和高级阶段Amadori产物的降解。pH在3~10时,美拉德反应速率随着pH的增加而增加。pH通过影响还原糖的结构以改变其美拉德反应性。当pH≤7时,Amadori产物更容易发生1,2-烯醇化反应[15-16]。由表1和图1可知,杀菌后调味鱼体系pH几乎不变,在5.9左右,呈微酸性。半胱氨酸的加入对体系的pH影响不大,添加D-异抗坏血酸钠使pH略有升高。随着柠檬酸添加量的增加,调味鱼pH呈线性降低,体系pH从5.87降至5.50。
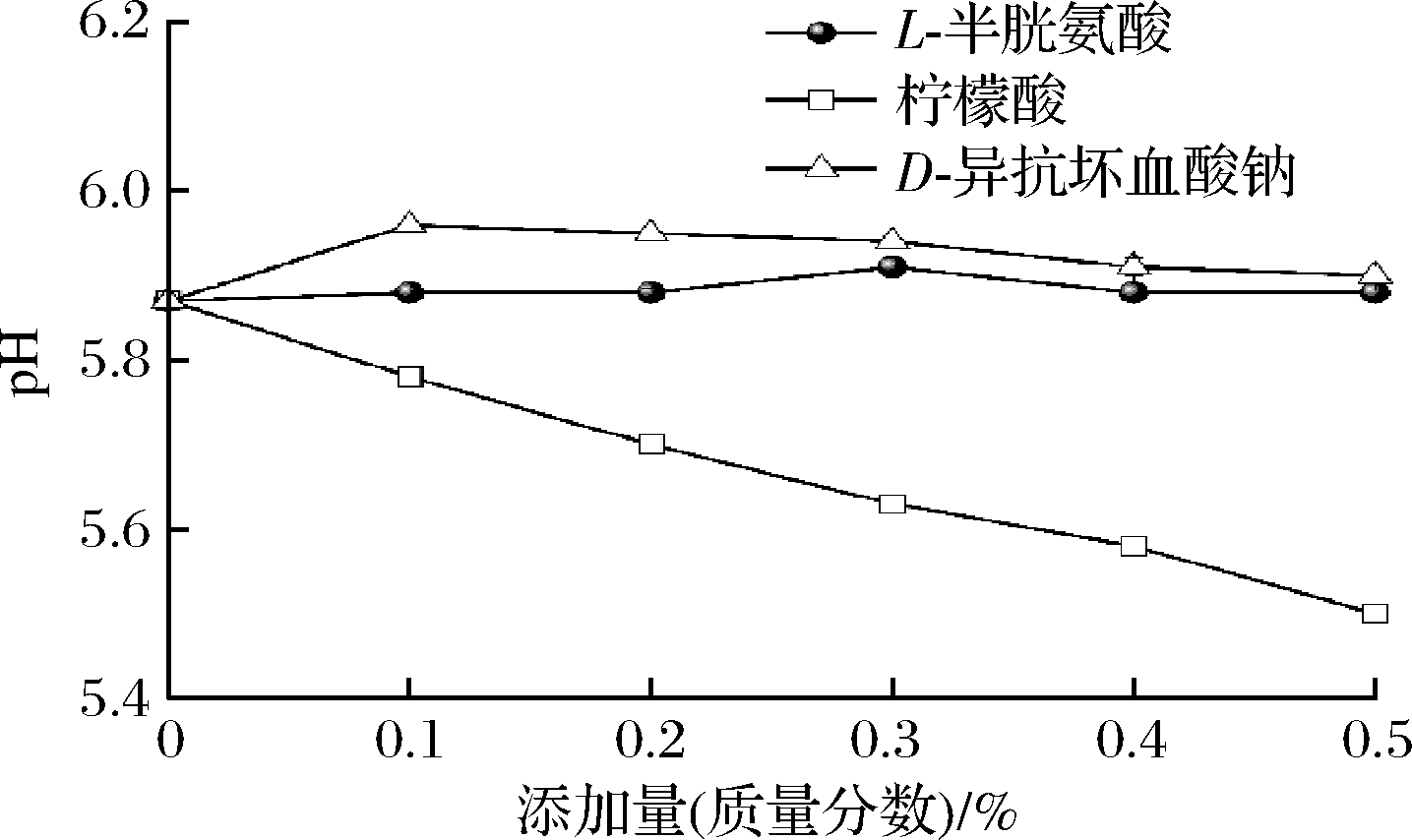
图1 不同添加量的护色剂对杀菌后调味鱼pH的影响
Fig.1 Effect of color protectant on pH of seasoned fish after sterilization
2.3 护色剂对调味鱼还原糖含量的影响
还原糖是美拉德反应的羰基供体,高温杀菌过程中引起其含量变化的反应主要有多糖水解、已糖脱水及美拉德反应[15, 17]。由表1可知,调味鱼中主要的还原糖是葡萄糖和果糖,且葡萄糖含量高于果糖。杀菌后葡萄糖含量降低了44.4%,果糖含量几乎不变。由于醛糖容易形成Amadori重排产物,褐变速度快;酮糖更易形成Heyns重排产物,褐变速度相对较慢,且调味鱼中葡萄糖含量高,所以,杀菌过程中参与美拉德褐变的还原糖主要是葡萄糖。由图2可知,随着L-半胱氨酸添加量的增加,葡萄糖含量先增加后迅速降低,各添加量均显著高于空白组(P<0.05)。果糖含量相比葡萄糖变化幅度较小。有研究表明,氨基酸促进了多糖的水解,造成还原糖含量的增加[2]。同时半胱氨酸作为还原性氨基酸,可能低添加量时,主要与Amadori产物反应,不会引起还原糖的额外消耗;过量的半胱氨酸会作为初始反应物消耗还原糖,导致葡萄糖含量的减少 [8, 18]。随着柠檬酸添加量的增加,葡萄糖含量先平稳再增加至显著高于空白组。果糖含量先稳定后略增加。美拉德初始阶段可逆,酸促进羰氨缩合产物的解离,而且酸减少了还原糖的开链式结构,降低了糖的反应性,从而减少还原糖的利用,造成还原糖含量的增加[16, 19]。随着D-异抗坏血酸钠添加量的增加,葡萄糖含量先增加后趋于平稳,各添加量均显著高于空白组。果糖含量变化幅度较小。D-异抗坏血酸钠可以清除美拉德反应中的自由基,并且可以和中间产物反应,抑制美拉德反应的进行;同时部分以其异构体抗坏血酸形式存在,抗坏血酸的性质类似于糖,但不需要氨基即可发生自氧化,产物可进入美拉德反应,减少葡萄糖的消耗[19-20]。葡萄糖含量及美拉德反应活性高,所以护色剂的添加主要引起了葡萄糖含量的变化。果糖含量及反应活性相对较低,变化幅度较小。但果糖的美拉德反应常伴随着果糖的焦糖化,可能会造成果糖的消耗[17]。
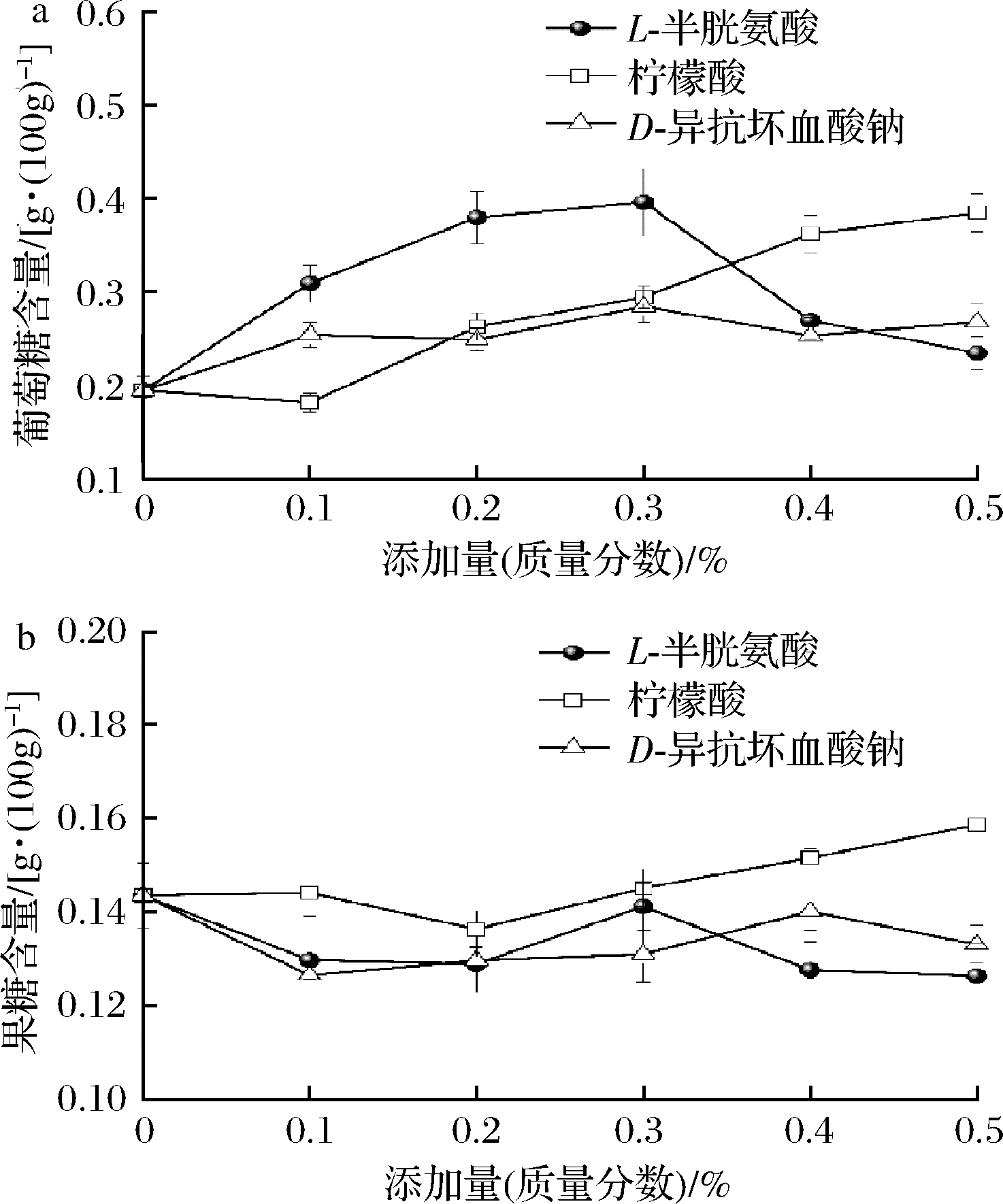
a-葡萄糖含量;b-果糖含量
图2 不同添加量的护色剂对杀菌后调味鱼葡萄糖和果糖含量的影响
Fig.2 Effect of color protectant on glucose and fructose content of seasoned fish after sterilization
2.4 护色剂对调味鱼5-HMF含量的影响
5-HMF是一种具有呋喃环的糠醛化合物,是美拉德反应高级阶段的重要产物,同时是已糖脱水和抗坏血酸氧化的共同产物[21]。在美拉德反应中主要由Amadori产物通过1,2-烯醇化途径生成,果糖在酸性环境中脱水可直接生成5-HMF,而葡萄糖需先转化为果糖再进行脱水反应[22]。由表1可知,杀菌后,5-HMF含量增加了47.4%,表明调味鱼中积累了一定量的美拉德中间产物。随着L-半胱氨酸添加量的增加,5-HMF的含量先降低后缓慢增加,各添加量均显著低于空白组(P<0.05)。由图3可知,半胱氨酸可以和其他氨基酸的Amadori产物反应,进而阻止其通过1,2-烯醇化途径生成5-HMF。添加量过高时,可能会形成自身的Amadori产物,造成5-HMF的积累,但半胱氨酸相比于其他氨基酸生成的5-HMF含量较低[8, 23]。随着柠檬酸添加量的增加,5-HMF含量先迅速降低后缓慢增加至与空白组持平。酸可以促进羰氨缩合产物N-葡萄糖胺水解,减少进一步生成5-HMF;但使更大比例的Amadori产物通过1,2-烯醇化途径生成5-HMF,且果糖可直接脱水生成5-HMF,可能造成了5-HMF的增加[7, 22]。随着D-异抗坏血酸钠添加量的增加,5-HMF含量先迅速降低再增加至显著高于空白组。可能低添加量时,还原作用占主导,抑制美拉德反应。高添加量时,在密封包装的缺氧条件下,抗坏血酸与水反应生成2,3-二酮古洛糖酸,再进一步脱羧脱水生成呋喃醛等物质,造成5-HMF含量的持续增加[21]。
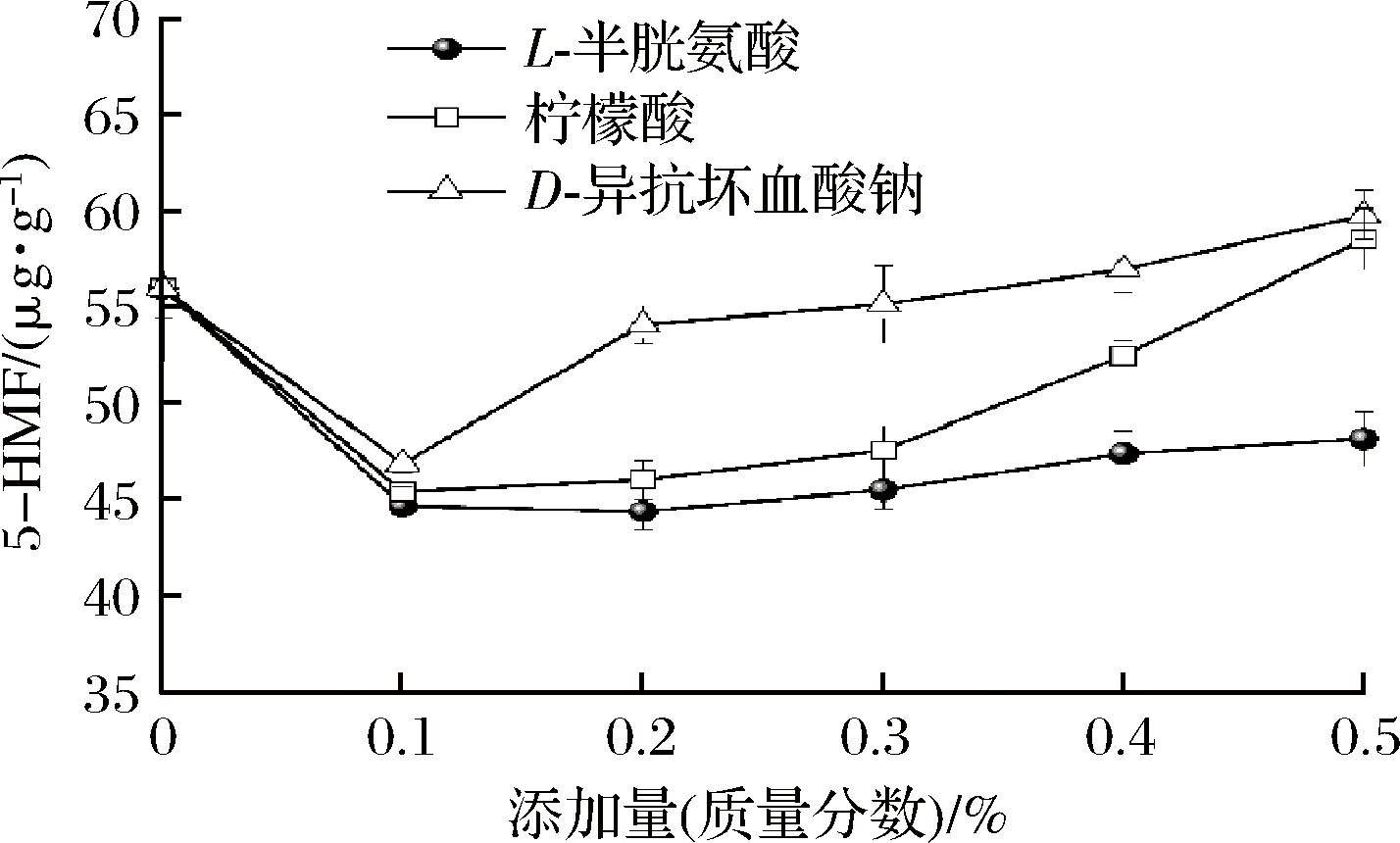
图3 不同添加量的护色剂对杀菌后调味鱼5-HMF含量的影响
Fig.3 Effect of color protectant on 5-HMF content of seasoned fish after sterilization
2.5 护色剂对调味鱼美拉德反应程度的影响
荧光物质主要由还原性化合物重组或氨基化合物Strecker降解形成,反映了美拉德反应的早期过程[16]。由表1可知,杀菌后荧光强度增加了38.7%,表明美拉德反应中间产物的积累。随着L-半胱氨酸添加量的增加,荧光强度降低后趋于平稳,各添加量均显著低于空白组(P<0.05)。半胱氨酸作用于Amadori产物,阻止其进一步生成脱氧还原酮及环化,从而影响荧光化合物的产生[8]。随着柠檬酸添加量的增加,荧光强度下降至显著低于空白组后缓慢回升。酸抑制了美拉德反应初始阶段的羰氨缩合,并使Amadori产物更易发生1,2-烯醇化,减少2,3-烯醇化途径生成的还原酮类物质,从而影响荧光强度,这与GENG等[12]的研究结果相似。随着D-异抗坏血酸钠添加量的增加,荧光强度先降低后持续增加至显著高于空白组。可能是低浓度的异抗坏血酸钠还原作用占主导,而高浓度时自身氧化促进了美拉德反应,导致荧光强度的增加。这与刘红[24]的研究结论相似,其研究表明美拉德反应产物的荧光强度随着抗氧化剂浓度的增加而增加。
在波长294 nm处的吸光值与美拉德反应过程中产生的无色中间产物有关,如糖、醛、小分子酮等[15]。由表1可知,杀菌后A294略有增加。随着L-半胱氨酸添加量的增加,A294降低后趋于平稳,且均显著低于空白组(P<0.05)。半胱氨酸具有还原性,可以和共轭系统发生加成反应,改变中间产物的结构,也可以通过与Amadori产物反应影响中间产物的生成,从而改变294 nm处的吸光值 [3]。添加柠檬酸后,A294显著低于空白组,但各添加量之间没有显著性差异。低pH可以抑制美拉德反应的初始阶段,同时柠檬酸根可以螯合金属离子,减少其对Amadori产物自氧化的催化作用,从而减少中间产物的生成[3]。随着D-异抗坏血酸钠的添加量增加,A294呈增加后降低再增加的波动趋势。D-异抗坏血酸钠可以对甲基乙二醛等活性羰基化合物进行修饰,同时自身氧化可以产生还原酮等美拉德中间产物[20, 25]。A294的波动趋势可能是这2种反应综合作用的结果。
在波长420 nm处的吸光值表示褐变度,与美拉德反应最终阶段生成的褐变产物(类黑精)有关[15]。由表1可知,杀菌后A420增加了60.0%,调味鱼发生了较明显的褐变。随着L-半胱氨酸添加量的增加,A420先稳定后增加至显著高于空白组(P<0.05)。低浓度时半胱氨酸与其他氨基酸的Amadori产物反应减少褐变物质的生成,高浓度时可能生成了自身的美拉德反应产物,导致呈色物质积累。不同氨基酸的美拉德反应产物具有不同的颜色特征,且半胱氨酸的加入改变了调味鱼中糖和氨基酸的比例,也会对褐变度造成影响[26]。随着柠檬酸添加量的增加,A420降低趋于平缓后缓慢增加,但均显著低于空白组。酸抑制美拉德反应初始阶段,且使Amadori产物更容易发生1,2-烯醇化。有研究表明,2,3-烯醇化是美拉德反应色素物质生成的主要途径 [16]。这与GENG等[12]的研究结果一致,其研究表明pH 6.0 的鱿鱼褐变度显著高于pH 5.5。但也有研究表明,柠檬酸具有一定缓冲能力,可以加速褐变[24]。随着D-异抗坏血酸钠添加量的增加,A420先降低至显著低于空白组,后增加至显著高于空白组。添加量较低时,主要通过对活性羰基化合物等的修饰减少呈色物质的积累,抑制体系的褐变反应。添加量较高时,自身氧化产物进入美拉德反应,导致褐变度增加[25]。
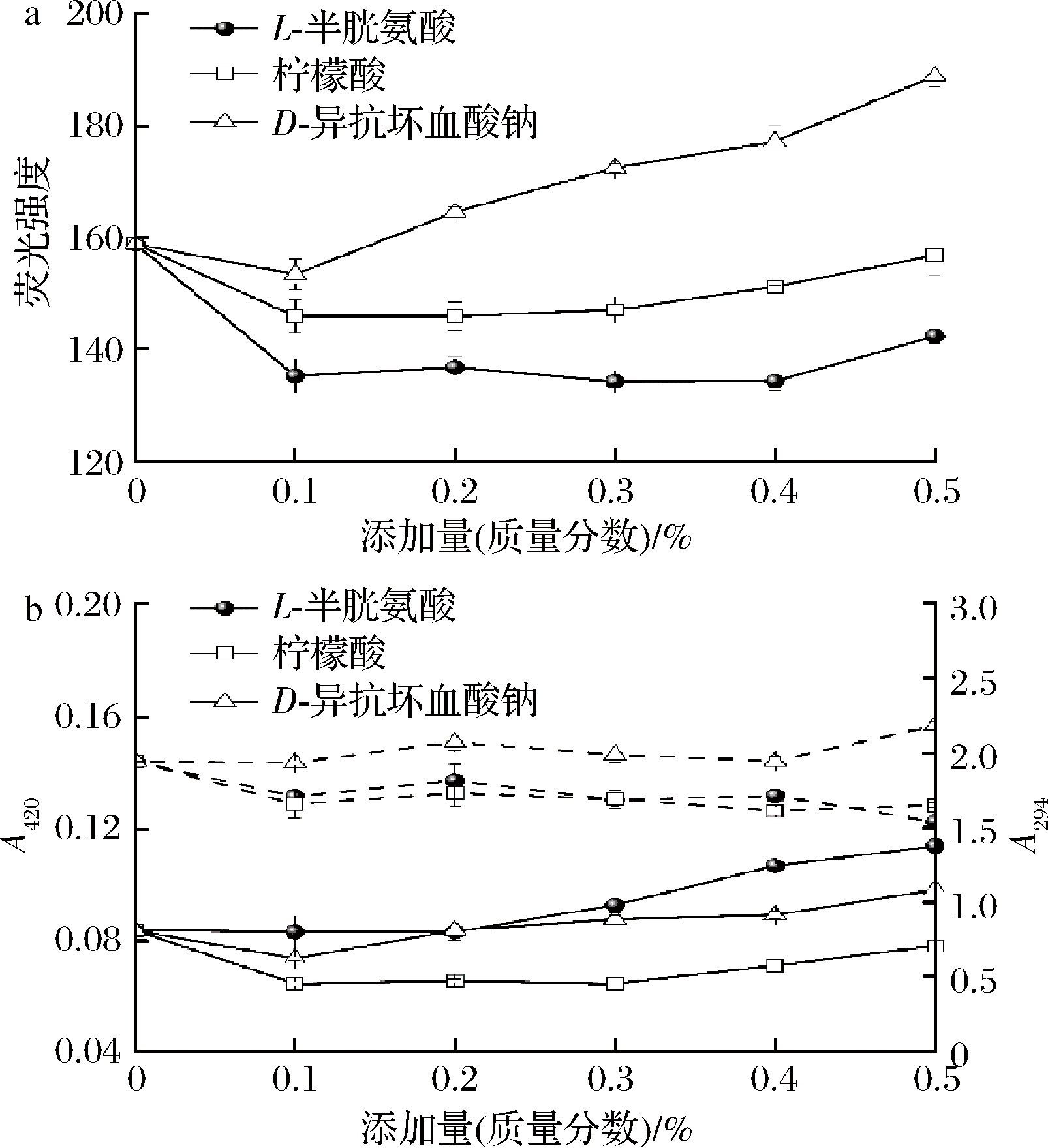
a-荧光强度;b- A420(实线)和A294(虚线)
图4 不同添加量的护色剂对杀菌后调味鱼美拉德反应程度的影响
Fig.4 Effects of color protectants on the reaction degree of seasoned fish Maillard after sterilization
3 结论
杀菌后,调味鱼的L*、a*、b*、ΔE 值均降低,调味鱼颜色变暗。适量添加L-半胱氨酸、柠檬酸、D-异抗坏血酸钠可以提高杀菌后调味鱼色差值,最适添加量分别为0.3%、0.4%、0.1%。其中,L-半胱氨酸作为护色剂的效果最好。杀菌过程发生了美拉德反应,消耗了葡萄糖,生成了5-HMF,增加了荧光强度、A294和A420。半胱氨酸可以和还原糖或中间产物反应,降低了5-HMF含量、荧光强度和A294,但高浓度时导致A420增加。柠檬酸减少葡萄糖的利用,降低了5-HMF含量、荧光强度、A294和A420。D-异抗坏血酸钠低浓度时抑制,高浓度时促进美拉德反应,5-HMF含量、荧光强度、A294和A420随添加量的增加先降后增。添加护色剂,影响了美拉德反应物的利用和产物的生成,从而改变了调味鱼的颜色,但不排除色素降解等其他因素对颜色变化影响的可能性,还有待进一步研究。
[1] 蒋定文,林梦,沈先荣,等.鳀鱼的营养分析与评价[J].中国海洋药物,2010,29(4):50-54.
[2] LIU P,LU X,LI N, et al.Effects and mechanism of free amino acids on browning in the processing of black garlic[J].J Sci Food Agric,2019,99(10):4 670-4 676.
[3] LUND M N,RAY C A.Control of Maillard reactions in foods: Strategies and chemical mechanisms[J].J Agric Food Chem,2017,65(23):4 537-4 552.
[4] 刘玉婷,吴宏伟,尹大伟,等.半胱氨酸在食品中的应用研究[J].中国调味品,2009(12):33-36.
[5] 陈效兰,雷钢铁.柠檬酸在食品工业中的应用[J].食品研究与开发,2000(3):30-31.
[6] 宋忠祥,夏延斌,付浩华,等.异抗坏血酸钠在肉制品中的应用研究[J].农产品加工(学刊),2014(1):76-78.
[7] 王进勉.秘鲁鱿鱼(Dosidicus gigas)丝贮藏过程中褐变的研究[D].青岛:中国海洋大学,2007.
[8] 黄梅桂.大豆肽美拉德反应体系中色泽抑制及其机理研究[D].无锡:江南大学,2012.
[9] 白家玮.碱性条件下亚硫酸盐抗褐变替代物的筛选[D].杭州:浙江大学,2018.
[10] GENG J T,KAIDO T,KASUKAWA M,et al.Mechanism study of high browning degree of mantle muscle meat from Japanese common squid Todarodes pacificus during air-drying[J].Food Chem,2015,176:158-166.
[11] LAMBERTS L,ROMBOUTS I,BRIJS K,et al.Impact of parboiling conditions on Maillard precursors and indicators in long-grain rice cultivars[J].Food Chem,2008,110(4):916-922.
[12] GENG J T,TAKAHASHI K,KAIDO T,et al.Relationship among pH, generation of free amino acids, and Maillard browning of dried Japanese common squid Todarodes pacificus meat[J].Food Chem,2019,283:324-330.
[13] TANG F,XIA W,XU Y,et al.Effect of thermal sterilization on the selected quality attributes of sweet and sour carp[J].International Journal of Food Properties,2014,17(8):1 828-1 840.
[14] WEI C K,NI Z J,THAKUR K,et al.Color and flavor of flaxseed protein hydrolysates Maillard reaction products: Effect of cysteine, initial pH, and thermal treatment[J].International Journal of Food Properties,2019,22(1):84-99.
[15] LUO F,FEI X.Maillard reaction derived from oil-tea camellia seed through roasting[J].J Sci Food Agric,2019,99(11):5 000-5 007.
[16] 李世伟.秘鲁鱿鱼丝贮藏过程中色泽风味变化机制及控制技术研究[D].大连:渤海大学,2014.
[17] 童彦.鳙鱼资源增值化开发技术基础研究[D];杭州:浙江大学,2013.
[18] KWAK E J,LIM S I.The effect of sugar, amino acid, metal ion, and NaCl on model Maillard reaction under pH control[J].Amino Acids,2004,27(1):85-90.
[19] ECHAVARR A A P,PAG
A A P,PAG N J,IBARZ A.Melanoidins formed by maillard reaction in food and their biological activity[J].Food Engineering Reviews,2012,4(4):203-223.
N J,IBARZ A.Melanoidins formed by maillard reaction in food and their biological activity[J].Food Engineering Reviews,2012,4(4):203-223.
[20] 董霞,王芳,庞美霞,等.酸菜贮藏期间褐变机理的探讨[J].食品与发酵工业,2016,42(12):222-226.
[21] 陈俊.5-羟甲基糠醛参与的非酶褐变研究[D].广州:暨南大学,2018.
[22] 高茜.功能性饮料中有害物质形成规律的研究[D].天津:天津科技大学,2015.
[23] 钱敏,白卫东,赵文红,等.不同氨基酸和糖对美拉德反应产物的影响[J].食品科学,2016,37(13):31-35.
[24] 刘红.抗氧化剂对美拉德反应的影响[D].广州:暨南大学,2007.
[25] DIVINE R D,RANKIN S A.Short communication: Reducing agents attenuate methylglyoxal-based browning in Parmesan cheese[J].J Dairy Sci,2013,96(10):6 242-6 247.
[26] 李伶俐.美拉德反应体系中影响烤肉风味形成的因素研究[D].无锡:江南大学,2011.