发酵米粉是我国南方一种传统食品,目前发酵米粉多采用自然发酵方式生产,即利用原料和 “续渣液”中的微生物在自然条件下完成大米浸泡发酵,再经过磨浆、蒸煮、挤压成型等工序制成米粉[1]。大米在浸泡发酵过程中,由于微生物代谢产生的有机酸和酶等代谢产物作用使大米化学成分以及保水力、糊化特性、热特性、老化特性等大米(粉)淀粉特性发生改变,从而改善了成品米粉的蒸煮品质、质构特性、食味品质等食用品质[2]。
自然发酵过程中微生物组成复杂,其种群易受环境影响,发酵时间随季节变化差异较大,使产品工艺参数、生产过程难以实现规范化和标准化,造成产品质量不稳定[3]。有学者分离鉴定米粉发酵过程中的优势微生物是乳酸菌和酵母菌[4-5],近年来有许多研究认为籼米中淀粉结构、蛋白质和脂肪含量影响米粉的峰值黏度、凝胶强度和口感等[6-9],发酵过程中微生物产生的淀粉酶改变大米淀粉中直/支比例,提高米粉糊化和凝胶特性[10];蛋白酶不仅为微生物提供自身生长所需的氮源,还减少大米蛋白质,使米粉食味品质更好[11];脂肪酶将脂肪分解为游离脂肪酸,增加米粉香气,提升米粉感官品质[12]。微生物胞外酶是微生物代谢过程中的次级代谢产物,其活性强弱是判断菌株是否具有制备成发酵剂的关键[13]。然而,目前以产酸、产酶活力为考核指标进行发酵米粉中优良菌株筛选的报道较少。因此,本试验以大米发酵液中菌株的产酸和产酶活力为综合考核指标,进行菌株分离筛选,获得适合米粉发酵的优良菌株,为实现发酵环节的合理控制,推进发酵米粉从传统自然发酵向标准化转型,提高产品质量并保证品质稳定,制备纯种发酵菌剂奠定基础。
1 材料与方法
1.1 材料与试剂
试验材料为湖南常德鲜湿米粉加工厂发酵3 d大米浸泡发酵液;MRS琼脂培养基、MRS肉汤,广东环凯微生物科技有限公司;珍桂矮1号籼米,阳春市宏兴粮食加工厂;试验试剂为Na2CO3、三氯乙酸、NaOH、干酪素、酪氨酸、葡萄糖、淀粉、柠檬酸钠、柠檬酸、福林酚试剂、苯酚、3,5-二硝基水杨酸、对硝基苯酚、异丙醇、Tris-HCl、对硝基苯酚棕榈酸酯,国药集团化学试剂有限公司。
1.2 仪器与设备
SW-CJ-1FD单人单面净化工作台,苏州净化设备有限公司; SPX-250BⅢ恒温培养箱,上海新苗医疗器械制造有限公司; FE28-PH计,梅特勒-托利多仪器有限公司; LDZX-50KBS立式高压蒸汽灭菌锅,上海申安医疗器械有限公司;GF-M3000酶标仪,山东高密彩虹分析仪器有限公司; TG16-WS 台式高速离心机,湖南湘仪实验室仪器开发有限公司。
1.3 试验方法
1.3.1 菌株的分离纯化
采用稀释平板分离法将样品按倾注法接种于MRS培养基上培养后挑取菌落形态不同的单菌落转移至MRS斜面培养基,进行编号后置于4 ℃冰箱保藏。
1.3.2 菌株的筛选
将试管斜面菌株活化后按1%接种量接种于初始pH为6.66大米液体培养基中,适当培养后用pH计测定上清液pH,初筛出产酸能力较强菌株。
将初筛菌株分别采用3,5-二硝基水杨酸比色法[14]、福林酚法[15]、对硝基苯酚法[16]测定淀粉酶、蛋白酶和脂肪酶活性,进行发酵米粉优良菌株的复筛。淀粉酶活定义为1 mL发酵液在40 ℃,pH 5.6条件下5 min内水解1% 淀粉产生1 μg葡萄糖所需酶量为1个酶活力单位(U);蛋白酶活定义为在40 ℃, 一定pH值条件下, 1 min内催化酪蛋白水解产生1 g酪氨酸所需酶量为1个蛋白酶活力单位 (U);脂肪酶活定义为在 37 ℃、 pH 8.0条件下,以1 μmol/min释放对硝基苯酚所需酶量为1个酶活单位(U)。
1.3.3 形态特征及生理生化鉴定
分别将筛选得到的优良菌株划线接种在MRS琼脂培养基上,适当条件培养后,观察菌落大小、颜色、形态、质地、光泽、隆起度、透明度和边缘结构等群体形态特征;进一步革兰氏染色,显微镜下观察革兰氏染色显色反应、细胞形态和排列方式等菌体形态特征;并对照《伯杰细菌鉴定手册》[17]《常见细菌鉴定手册》[18]和API试剂盒检测进行菌属初步鉴定。
1.3.4 分子生物学鉴定
采用Bacteria Genomic DNA kit 试剂盒进行菌株基因组DNA提取,采用16S rDNA通用引物序列27F/1492R进行PCR扩增。PCR扩增达到纯化要求的产物割胶回收,送往杭州金唯智生物科技有限公司测序。将获得的序列与NCBI的GeneBank数据库进行BLAST比对和分析,利用MEGA-X 软件构建菌株系统发育进化树。
1.3.5 数据处理及分析
采用SPSS 18.0 对试验数据进行统计学分析,数据平行3 次,结果用平均值±标准偏差表示,用软件Origin 8.0绘图。
2 结果与分析
2.1 菌株筛选结果
2.1.1 菌株产酸能力
从MRS平板培养基上获得118株产酸菌株保藏于斜面试管。以pH<4.5为指标,筛选出35株产酸能力较强菌株,如表1所示。由于产酸能力与菌株的生长能力有关,生长速率与所测发酵液pH值呈负相关,因而测定菌株发酵液pH值可反映乳酸菌的发酵性能。表中发酵液中pH最小值为4.12,与初始培养基中pH 6.66相比,发酵液中pH值下降了2.52,pH变化值较大,说明初筛出的菌株具有良好的产酸性能。
表1 不同菌株2 d发酵液pH值
Table 1 Different strains in 2 d′s pH value of fermentation broths
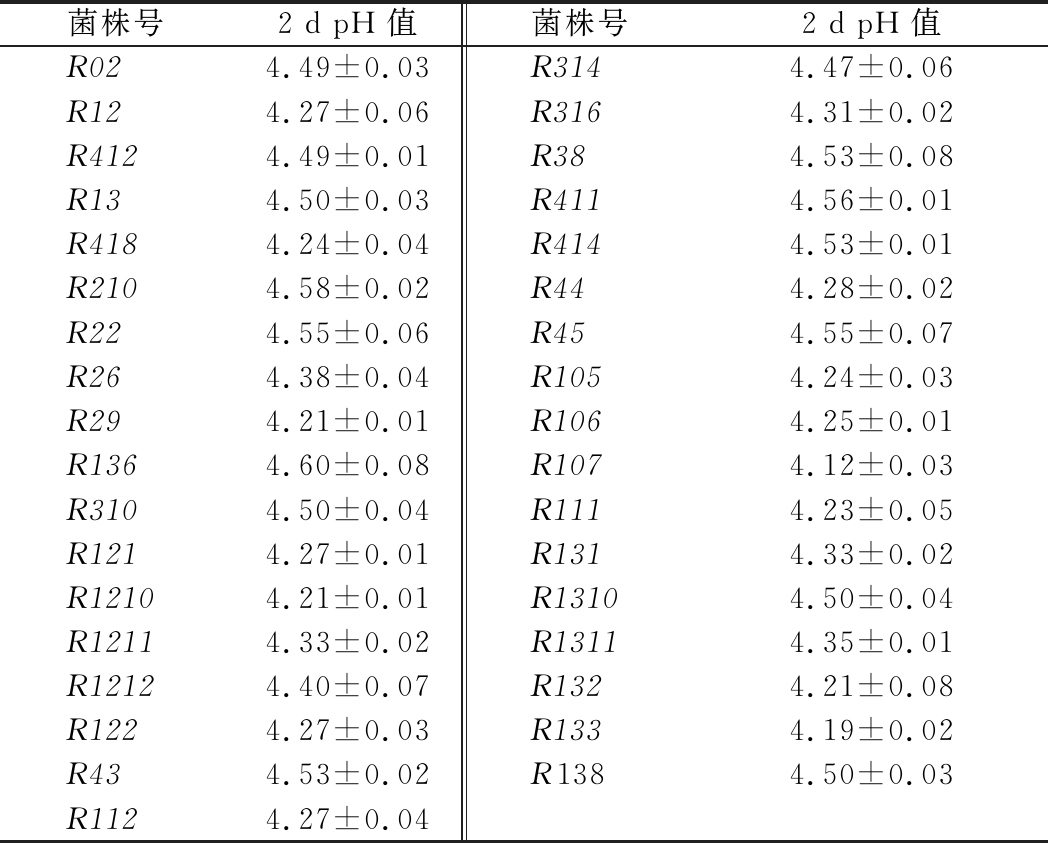
菌株号2 d pH值菌株号2 d pH值R024.49±0.03R3144.47±0.06R124.27±0.06R3164.31±0.02R4124.49±0.01R384.53±0.08R134.50±0.03R4114.56±0.01R4184.24±0.04R4144.53±0.01R2104.58±0.02R444.28±0.02R224.55±0.06R454.55±0.07R264.38±0.04R1054.24±0.03R294.21±0.01R1064.25±0.01R1364.60±0.08R1074.12±0.03R3104.50±0.04R1114.23±0.05R1214.27±0.01R1314.33±0.02R12104.21±0.01R13104.50±0.04R12114.33±0.02R13114.35±0.01R12124.40±0.07R1324.21±0.08R1224.27±0.03R1334.19±0.02R434.53±0.02R1384.50±0.03R1124.27±0.04
2.1.2 菌株产酶活力
35株菌株淀粉酶、蛋白酶和脂肪酶活性如图1、图2所示。试验结果表明,不同菌株产淀粉酶、蛋白酶、脂肪酶活力不同,35株菌株中R112淀粉酶、脂肪酶活性最高分别为210.43、2.15 U/mL,R1212蛋白酶活性最高为9.34 U/mL。所有菌株淀粉酶活性在17.57 ~210.43 U/mL,菌株间淀粉酶活性极差为192.86 U/mL,差异性显著。但35株菌株中只有27株检测到了蛋白酶活性,占77.14%,14株检测到了脂肪酶活性,只占40%。值得注意的是菌株R1212蛋白酶活性最高为9.34 U/mL,淀粉酶活性也具有较高水平为179.71 U/mL,但未检测到脂肪酶活性,这说明单一菌株产酶能力各有不同,发酵米粉优良菌株的获得需要结合其他分析方法进一步筛选。

图1 不同菌株淀粉酶活性
Fig.1 Amylase activity of different strains

图2 不同菌株蛋白酶、脂肪酶活性
Fig.2 Protease and lipase activity of different strains
2.1.3 菌株酶活力主成分分析
根据各菌株产淀粉酶、蛋白酶、脂肪酶活性结果,利用SPSS进行主成分分析,并利用Origin绘图,得到各个菌株主成分得分图(图3)。第1主成分方差累积贡献率为57.09%,主要反映了淀粉酶活性;第2主成分方差累积贡献率为22.52%主要反映了蛋白酶和脂肪酶活性。得分较高的菌株编号分别为R02、R1212、R29,、R1310、R133、R112、R13。这些菌株相较于其他菌株有较强的淀粉酶、蛋白酶和脂肪酶活性。因此最终筛选出发酵性能较好的这7株菌株进行鉴定,为后续试验奠定基础。
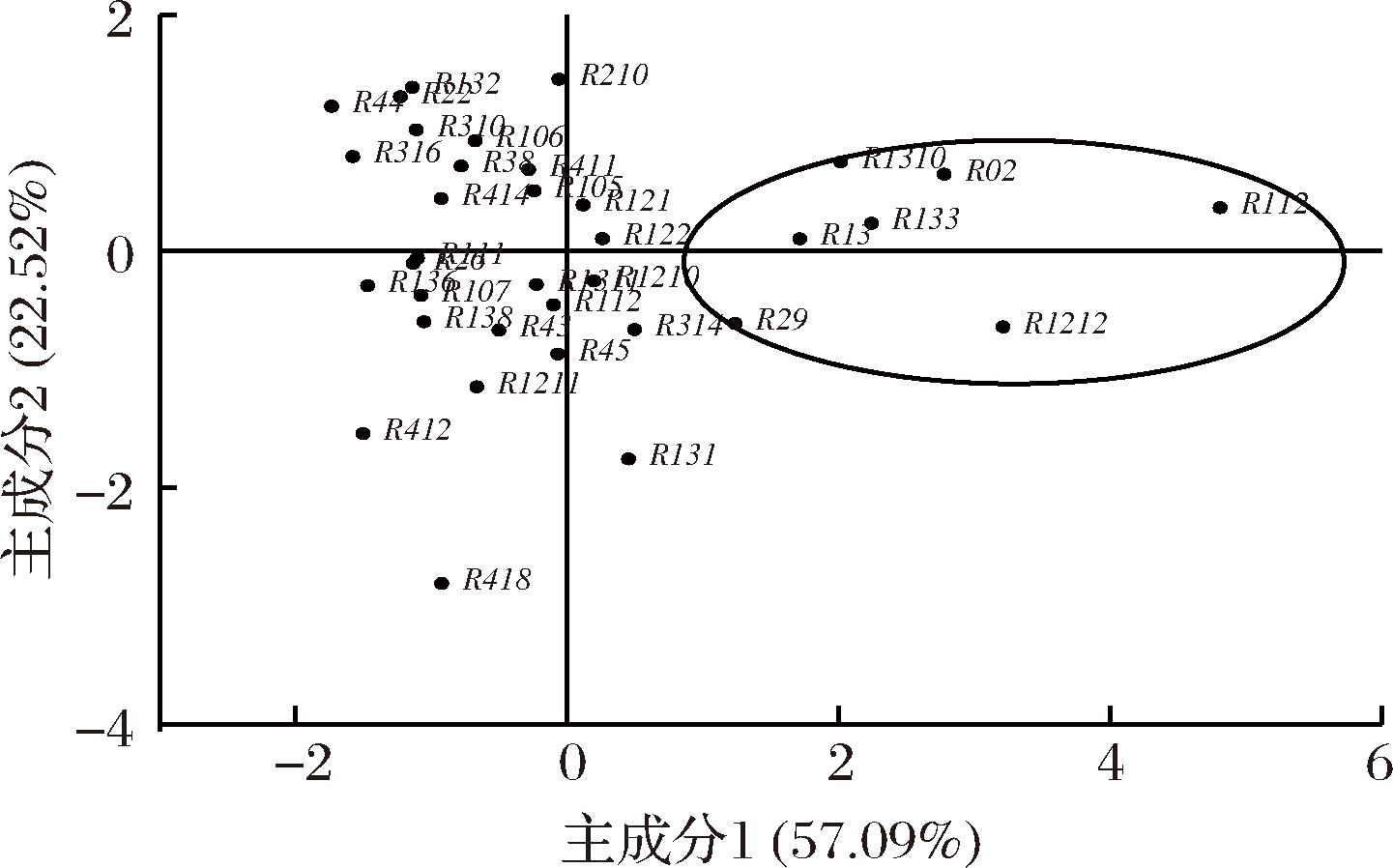
图3 菌株筛选主成分得分图
Fig.3 Score of principal components in strain screening
2.2 菌株鉴定
2.2.1 菌株形态学鉴定
部分典型菌株形态学鉴定结果如图4所示,7个菌株分为3种类型。R13、R1212、R02、R1310、R133五个菌株菌落呈圆形、乳白色、表面光滑、凸起、边缘整齐、不透明,革兰氏染色为G+、球菌,成对排列或形成四联状,无芽孢;菌株R29菌落呈圆形、白色,略有光泽,隆起,边缘整齐,不透明,革兰氏染色为G+、杆菌;R112菌落呈圆形,灰白色,不透明,边缘不整齐,表面粗糙,无光泽,革兰氏染色为G+、杆菌。
2.2.2 菌株生理生化鉴定
根据各菌株的群体形态和个体形态特点,将疑似乳酸菌的菌株R13、R1212、R02、R1310、R133、R29用API50CHL乳酸菌鉴定系统试剂条辅助进行生理生化鉴定,检验菌株对49种碳源的利用能力,将对照作为阴性,底物被利用的反应结果为阳性。在法国梅里埃公司官网上利用API LAB Plus自动判读系统对试纸条判定结果进行鉴定(表2)。菌株R13、R1212、R02、R1310、R133鉴定为戊糖片球菌,R29鉴定为发酵乳杆菌。将疑似芽孢杆菌菌株R112参照《伯杰氏细菌鉴定手册》(第八版)和《常见细菌系统鉴定手册》中有关芽孢杆菌的主要生理生化指标进行鉴定,结果如表3所示。根据芽孢杆菌的主要生理生化试验结果初步判定R112为枯草芽孢杆菌。

A~C-R133、R29和R112菌落形态;D~F-R133、R29和
R112显微镜检图
图4 典型菌落形态及显微镜镜检图(×100)
Fig.4 Typical colony morphology and microscopic examination
表2 乳酸菌生理生化鉴定
Table 2 Physiological and biochemical characteristics of 6 strains
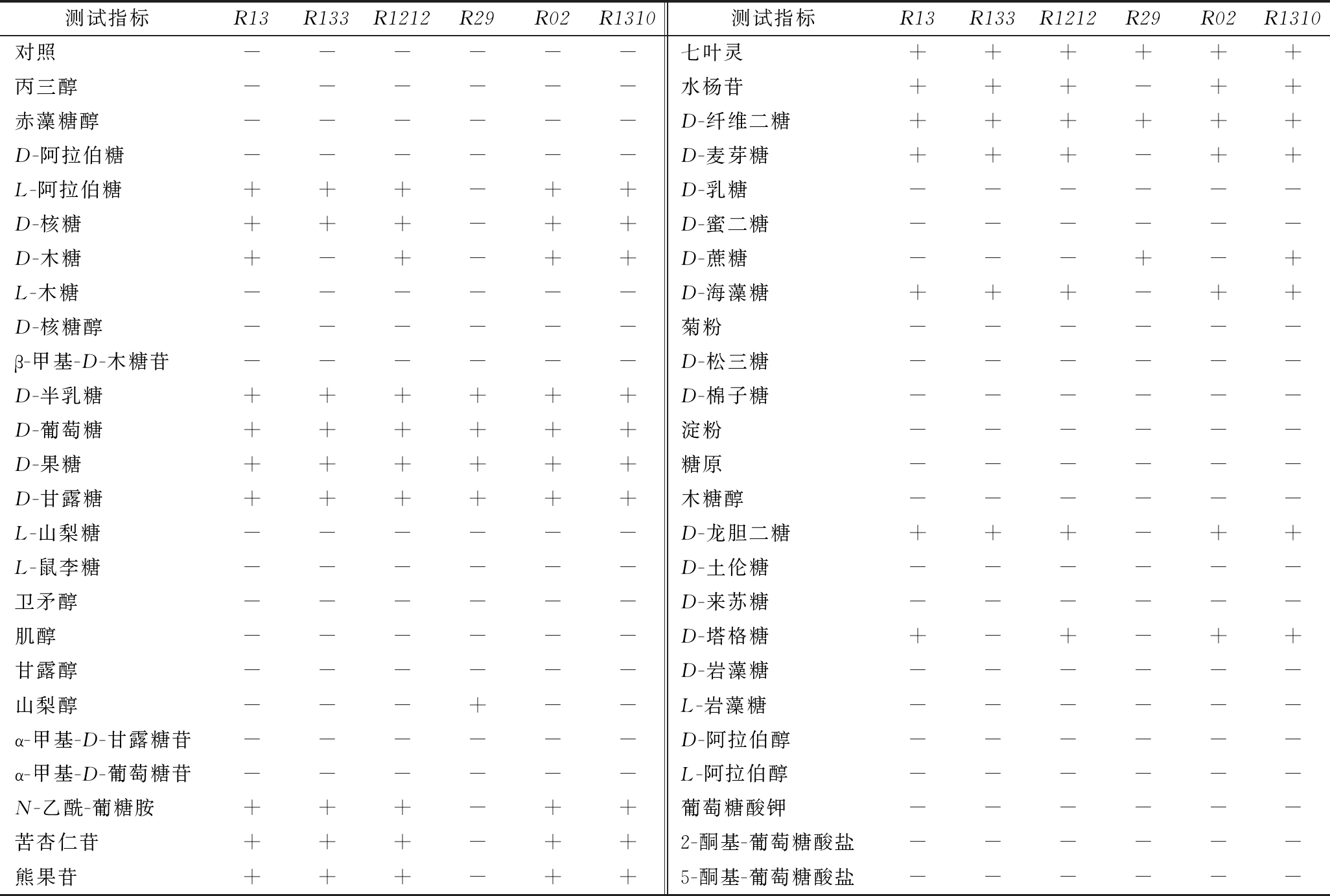
测试指标R13R133R1212R29R02R1310测试指标R13R133R1212R29R02R1310对照------七叶灵++++++丙三醇------水杨苷+++-++赤藻糖醇------D-纤维二糖++++++D-阿拉伯糖------D-麦芽糖+++-++L-阿拉伯糖+++-++D-乳糖------D-核糖+++-++D-蜜二糖------D-木糖+-+-++D-蔗糖---+-+L-木糖------D-海藻糖+++-++D-核糖醇------菊粉------β-甲基-D-木糖苷------D-松三糖------D-半乳糖++++++D-棉子糖------D-葡萄糖++++++淀粉------D-果糖++++++糖原------D-甘露糖++++++木糖醇------L-山梨糖------D-龙胆二糖+++-++L-鼠李糖------D-土伦糖------卫矛醇------D-来苏糖------肌醇------D-塔格糖+-+-++甘露醇------D-岩藻糖------山梨醇---+--L-岩藻糖------α-甲基-D-甘露糖苷------D-阿拉伯醇------α-甲基-D-葡萄糖苷------L-阿拉伯醇------N-乙酰-葡糖胺+++-++葡萄糖酸钾------苦杏仁苷+++-++2-酮基-葡萄糖酸盐------熊果苷+++-++5-酮基-葡萄糖酸盐------
注:-表示阴性反应;+表示阳性反应(下同)
表3 菌株R112生理生化鉴定
Table 3 Physiological of biochemical characteristics of Bacillus

生化项目结果生化项目结果淀粉水解+D-甘露醇+接触酶试验+甲基红(MR)试验+明胶液化+葡萄糖产酸+硝酸盐还原+葡萄糖产气-V-P试验+pH 5.7生长+7.5% NaCl生长+利用柠檬酸盐+
2.2.3 16S rDNA基因序列同源性比对与系统发育分析
7菌株16S rDNA PCR扩增产物均为1 000~2 000 bp,条带清晰明亮(图5),其序列测定结果提交GenBank,与已知序列进行比对,并利用软件MEGA.X进行系统发树的构建(图6)。结果表明,菌株R29与发酵乳杆菌(Lactobacillus fermentum)位于同一分支,自展值为100%;菌株R133、R02、R1212、R1310、R13与戊糖片球菌(Pediococcus pentosaceus)位于同一分支,自展值为65%;菌株编号R112与枯草芽孢杆菌(Bacillus subtilis)位于同一分支,自展值为63%。各分支自展值均高于50%,根据16S rDNA鉴定结果,并结合形态学、生理生化结果得到各个菌株分子鉴定结果如表4所示,菌株R29为发酵乳杆菌,R133、R02、R1212、R1310、R13为戊糖片球菌,菌株R112为芽孢杆菌属,并根据生化试验可以判定为属于芽孢杆菌属中第一群中的枯草芽孢杆菌。
表4 菌株同源性分析结果
Table.4 Homological analysis of strains
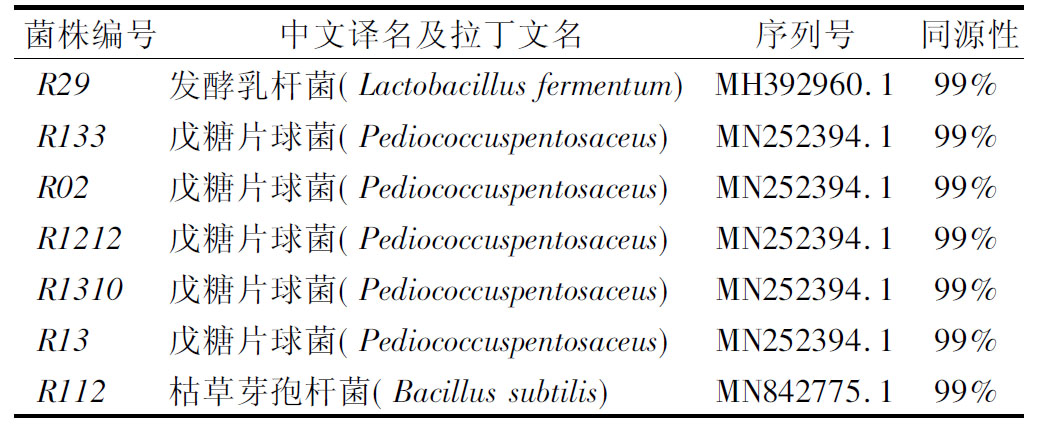
菌株编号中文译名及拉丁文名序列号同源性R29发酵乳杆菌(Lactobacillus fermen-tum)MH392960.199%R133戊糖片球菌(Pediococcuspentosa-ceus)MN252394.199%R02戊糖片球菌(Pediococcuspentosa-ceus)MN252394.199%R1212戊糖片球菌(Pediococcuspentosa-ceus)MN252394.199%R1310戊糖片球菌(Pediococcuspentosa-ceus)MN252394.199%R13戊糖片球菌(Pediococcuspentosa-ceus)MN252394.199%R112枯草芽孢杆菌(Bacillus subtilis)MN842775.199%
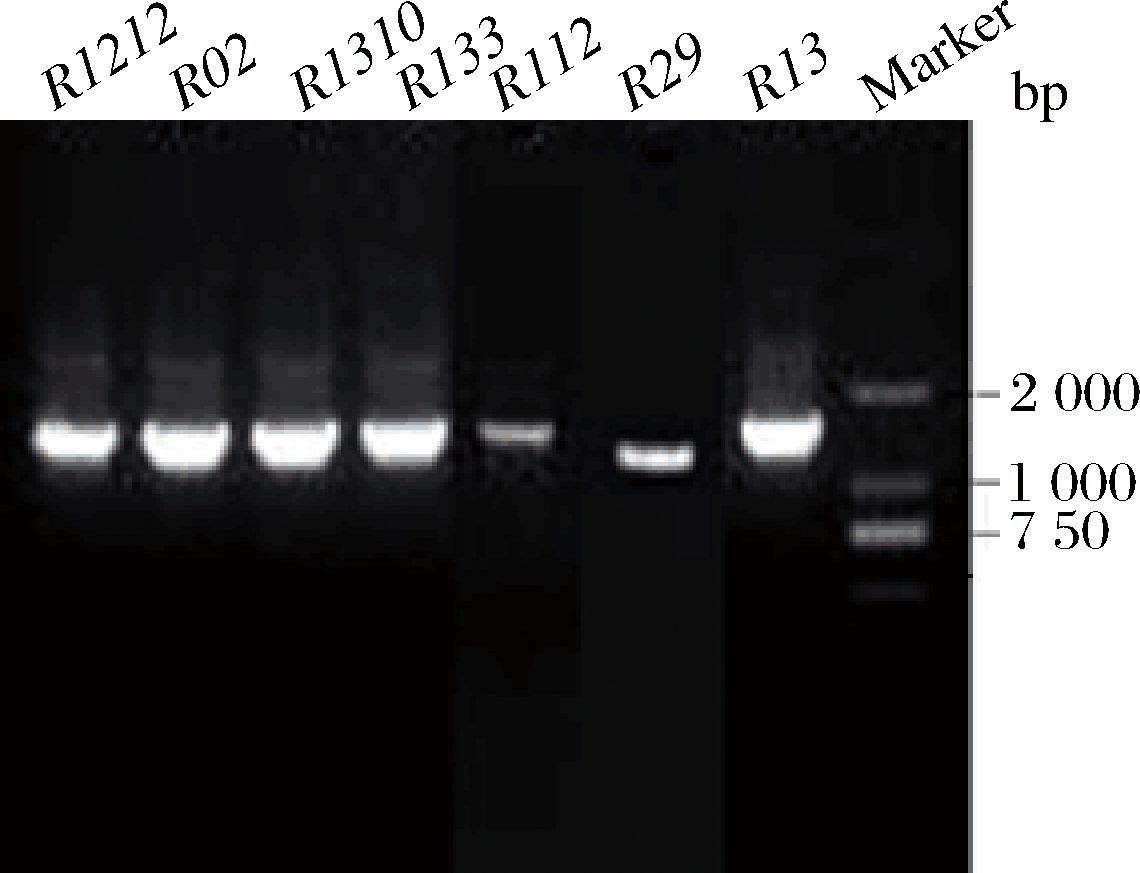
图5 七菌株16S rDNA PCR产物凝胶电泳图
Fig.5 Seven strains′ gel electrophoresis of 16S rDNA PCR products
3 讨论
米粉发酵过程中乳酸菌利用大米中碳水化合物产生乳酸、柠檬酸等有机酸,促进大米中部分蛋白质溶出,使大米淀粉得到纯化,提高米粉的力学性质和食用品质;同时有机酸显著降低大米发酵液pH,抑制其他杂菌生长,提高米粉生产安全性。然而,闵伟红等[19]研究发现乳酸菌发酵米粉的品质较乳酸大米处理后制成的米粉品质改善更显著,这说明发酵米粉品质改善不仅是有机酸起作用,可能还与微生物生长代谢的其他产物及其分泌的胞外酶所催化的生化反应等有关。为此,本研究将从样品中分离得到的118株菌株以产酸能力为首选指标进行发酵米粉优良菌株筛选后获得35株产酸能力良好的菌株,随后在考核菌株产酸能力的基础上以淀粉酶、蛋白酶、脂肪酶活力为指标进行菌株复筛,并通过主成分分析进行综合评价,获得了7株优良菌株,经鉴定为戊糖片球菌、发酵乳杆菌、枯草芽孢杆菌3类。

a-乳杆菌16SrDNA基因序列系统发育树;b-片球菌16SrDNA基因
序列系统发育树;c-芽孢杆菌16SrDNA基因序列系统发育树
图6 七株菌株系统发育进化树
Fig.6 Phylogenetic tree of 7 isolated strains based on 16S rDNA sequence
枯草芽孢杆菌是芽孢杆菌属,能发酵葡萄糖产酸并产内生孢子的一群芽孢菌。枯草芽孢杆菌生境多样,可利用营养物质种类十分丰富,其产生的淀粉酶、蛋白酶在食品工业得到广泛应用[20-21],另有研究表明枯草芽孢杆菌通过三羧酸或丙酮酸循环代谢能产生乳酸、丙酮酸等有机酸[22],已经应用于饲料、食品发酵等多个领域[23];戊糖片球菌因其益生功能已在发酵蔬菜、乳制品、肉制品领域得到广泛应用[24], 发酵乳杆菌和枯草芽孢杆菌已有应用于大米发酵中的相关报道[25],与本研究筛选出的优良菌株一致,但是鲜见开展相关酶活性的研究。本研究筛选出的枯草芽孢杆菌R112产酶活力较强,蛋白酶活性为8.35 U/mL,高于李芸[26]筛选出的枯草芽孢杆菌蛋白酶活力(3.15 U/mL),且具有良好的产酸能力和芽孢杆菌抗逆性能抵抗不良外界因素;乳酸菌同时具有淀粉酶、蛋白酶、脂肪酶多种酶活力,在米粉专用发酵剂研发中有重要价值。
4 结论
本研究从大米发酵液样品中分离获得7株具有良好产酸能力以及淀粉酶、蛋白酶和脂肪酶活性的菌株。通过生理生化试验和16S r DNA分子鉴定得出R133、R02、R1310、R1212、R13共5个菌株为戊糖片球菌(Pediococcus pentosaceus),R29为发酵乳杆菌(Lactobacillus fermentum),R112为枯草芽孢杆菌(Bacillus subtilis)。R02、R29等均可以作为米粉专用发酵剂开发的基础菌株,但是为了适应于工厂化米粉发酵生产,需要进一步采用育种技术对菌株进行改良研究。
[1] 席慧婷,江平屿,陈星光,等.复合菌发酵米粉的制作工艺优化及其香气成分[J].食品工业科技,2019,40(11):204-210;217.
[2] 周显青,李亚军,张玉荣.发酵对大米粉及其制品品质影响研究进展[J].粮食与饲料工业,2010(3):14-17.
[3] 林叶新,林润国.我国南方传统食品——米粉质量安全管理的研究进展[J].食品安全质量检测学报,2016,7(9):3 077-3 084.
[4] LU Z H, PENG H H, CAO W, et al. Isolation, characterization and identification of lactic acid bacteria and yeasts from sour mifen, a traditional fermented rice noodle from China[J]. Journal of applied Microbiology, 2008, 105(3): 893-903.
[5] LI Y, ZHENG X W, CHEN J Y, et al. Lactic acid bacteria diversity of fresh rice noodles during the fermentation process, revealed by culture-dependent and culture-independent methods[J]. Biotechnology & Biotechnological Equipment, 2015, 29(5):915-920.
[6] LU Z H, SASAKI T, LI Y, et al. Effect of amylose content and rice type on dynamic viscoelasticity of a composite rice starch gel[J]. Food Hydrocolloids, 2009, 23(7):1 712-1 719.
[7] 易翠平,杨有望,高文明.蛋白组分对籼米粉糊化特性的影响机理探讨[J].现代食品科技,2016,32(7):97-102.
[8] 贺萍,陈竞适,张喻,等.大米蛋白质和脂肪含量对鲜湿米粉品质的影响[J].湖南农业科学,2017(1):73-76;80.
[9] SATMALEE P, SUROJANAMETAKUL V, PHOMKAIVORN N,et al. Removal of soluble proteins during fermentation process for improving textural properties of traditional Thai rice noodles, kanom-jeen[J]. Jarq-Japan Agricultural Research Quarterly,2017,51(4), 327-331.
[10] SHOMPOOSANG S, MARUI J, YODIN K, et al. Effect of proteolytic bacteria on texture and colour quality of khanom-jeen, traditional Thai fermented rice noodles[J]. Letters in applied microbiology, 2019, 69(5): 339-345.
[11] LI N, ZHANG B, ZHAO S, et al. Influence of lactobacillus/candida fermentation on the starch structure of rice and the related noodle features[J]. International journal of biological macromolecules, 2019, 121: 882-888.
[12] KEATKRAI J, JIRAPAKKUL W. Volatile profile of khanomjeen, Thai fermented rice noodles, and the changes during the fermentation process[J]. Scienceasia, 2010, 36(1):46-51.
[13] BEVILACQU A A,CORBO M R,SINIGAGLIA M,et al.Selection of yeasts as starter cultures for table olives: A step-by-step procedure[J]. Frontiers in Microbiology, 2012, 3:194.
[14] 马晓梅,赵辉.淀粉酶产生菌MSP13筛选及其产酶条件初步优化[J].食品科学,2015,36(11):177-181.
[15] 中国国家标准化管理委员会.SB/T 10317—1999蛋白酶活力测定法[S].北京:中国标准出版社, 1999.
[16] 王乐,刘松,尹艳丽,等.一株酸性脂肪酶高产菌株的筛选与鉴定[J].食品安全质量检测学报,2017,8(12):4 509-4 515.
[17] 布坎南 R E, 吉本斯 N E. 伯杰细菌鉴定手册(8版)[M]. 北京: 科学出版社, 1995: 797-810.
[18] 蔡妙英, 东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社, 2001:25-28.
[19] 闵伟红,李里特,刘平.乳酸菌发酵对米粉物性影响的研究[J].食品科学,2005,26(1):97-99.
[20] 张宇军,曹慧,徐斐,等.枯草芽孢杆菌中性蛋白酶的固定化研究[J].食品与生物技术学报,2019,38(10):98-104.
[21] 陈翔,曾朝玮,申瑾,等.中温结合乙醇处理对枯草芽孢杆菌芽孢皮层裂解酶活性及结构的影响[J].食品与发酵工业,2019,45(23):37-42.
[22] 王寅,冯海霞.益生菌的产酸性能评价研究[J].中国畜牧杂志,2016,52(12):43-47.
[23] 史改玲,许女,贾瑞娟,等.山西老陈醋源优良芽孢杆菌菌株的鉴定及筛选[J].中国酿造,2018,37(5):22-27.
[24] XING X L, SUO B, YANG Y, et al. Application of Lactobacillus as adjunct cultures in wheat dough fermentation[J]. Journal of food science, 2019, 84(4): 842-847.
[25] YI C, YANG Y, ZHOU S, et al. Role of lactic acid bacteria in the eating qualities of fermented rice noodles[J]. Cereal Chemistry, 2017, 94(2): 349-356.
[26] 李芸. 发酵米粉生产过程中的菌相变化及发酵对米粉品质的影响[D].北京:中国农业大学,2015.