番石榴(Psidium guajava Linn.),俗称芭乐、鸡屎果,原产于南美洲,在中国华南各地均有栽培,是一种营养价值较高的热带水果[1-3]。番石榴的VC含量明显高于其他水果,可达1 000 mg/100g[4]。番石榴还具备药用效果,可以起到止血、止痢、止痒、清肝等功效[5-6]。番石榴含有的活性成分主要有多酚、黄酮、鞣质类、萜类、甾体类等,其活性物质具有降血糖、抗氧化、抑菌及预防慢性病等作用[7-8]。ALMULAIKY等[9]对2种品种的番石榴进行研究,发现2种番石榴均显示抗氧化活性。FLORES等[10]对7种番石榴多酚化合物进行抗氧化活性研究,结果表明不同品种番石榴的抗氧化活性有很大差异。
植物多酚具备抗氧性,抗炎性和抗菌性等生物特性。比如茶多酚可以促进动物的顺利生产,还能通过调节动物的肠道状况提高其免疫能力,在兽医学方面有应用前景[11]。苹果多酚作为天然安全活性物质,不仅可以保护肝细胞,还对小鼠的糖尿病有明显的改善作用[12]。植物多酚的提取有多种方法,其中溶剂萃取法是最为原始的方法,但是因为耗时长,且得率不稳定,所用的有机溶剂易污染环境,已逐渐被新方法所淘汰。微波提取相对于溶剂萃取提取率高,无环境污染,且设备便宜,被广泛应用,但是使用时要注意安全问题。超临界流体萃取是新型的现代高效环保的提取方法,但是成本昂贵,不适宜用于工业化生产植物多酚[13]。相比之下,超声波辅助提取因为操作方便,提取时间短且得率高稳定等优点,得到广泛应用。本文采用超声波辅助技术提取番石榴多酚,通过试验优化其提取的最佳工艺及条件,选用AB-8大孔树脂纯化,将纯化后的番石榴多酚进行抑菌活性研究,为番石榴多酚的综合开发提供理论依据。
1 材料与方法
1.1 材料与试剂
番石榴,湖光农贸市场;没食子酸、福林酚试剂、Na2CO3、无水乙醇(均为分析纯),广州左克生物科技发展有限公司;营养琼脂、马铃薯葡萄琼脂(PDA),北京陆桥技术股份有限公司;AB-8大孔树脂,廊坊圣泉化工有限公司。
1.2 仪器与设备
超声波清洗器(KQ-500E),昆山市超声仪器有限公司;真空冷冻干燥机(LGJ-12),广州吉迪仪器有限公司;旋转蒸发器(RE-3000B),巩义市宏华仪器设备工贸有限公司;循环水真空泵(SHZ-Ⅲ),上海亚荣生化仪器厂;紫外可见分光光度计(U3900H),天美科技有限公司;立式压力蒸汽灭菌器(LDZX-50KBS),上海申安医疗器械厂。
1.3 标准曲线的绘制
按照文献[14]报道的,称取没食子酸标准品0.025 g,加入蒸馏水溶解,用500 mL容量瓶定容得质量浓度为0.05 mg/mL没食子酸标准溶液。准确吸取0、0.5、1、2、3、4、5、6、7、8 mL没食子酸标准溶液分别置于50 mL棕色容量瓶中,加入4 mL福林酚试剂,摇匀,加入4 mL的10% Na2CO3溶液,充分混匀后定容,室温静置反应1 h,于760 nm波长处测吸光度,不加没食子酸标准溶液为空白对照组。以吸光度值(y)为纵坐标,反应体系中没食子酸的质量浓度(x)为横坐标,绘制标准曲线,为y=0.120 4x-0.002 3,R2=0.998 5。
1.4 番石榴多酚含量的测定
选取新鲜番石榴切块打浆并进行真空冷冻干燥。干燥后,将其粉碎并过60目筛获得所需的番石榴粉。准确称取番石榴粉1 g于100 mL带塞锥形瓶中,在一定提取条件下,用一定浓度的乙醇浸提番石榴多酚,提取液过滤,5 000 r/min离心7 min,吸上清液用一定浓度的乙醇定容到100 mL,再吸取1 mL定容后的溶液按照没食子酸标准曲线的绘制方法测定番石榴多酚含量。根据公式(1)计算番石榴多酚得率:
多酚得率![]()
(1)
式中:C1,被测溶液中多酚的质量浓度,mg/mL;V1,被测溶液的体积,mL;N,稀释的倍数;M,番石榴粉质量,g。
1.5 番石榴多酚提取单因素试验
1.5.1 料液比的选择
准确称取1 g番石榴粉于带塞100 mL锥形瓶中,按料液比1∶15、1∶20、1∶25、1∶30、1∶35、1∶40 (g∶mL)加入50%(体积分数)乙醇溶液,在50 ℃超声提取40 min。考察料液比对番石榴多酚得率的影响。
1.5.2 超声提取温度的选择
准确称取1 g番石榴粉于100 mL带塞锥形瓶中,按料液比1∶20 (g∶mL)加入50%乙醇溶液,分别在30、40、50、60、70 ℃下超声提取40 min。考察超声提取温度对番石榴多酚得率的影响。
1.5.3 超声提取时间的选择
准确称取1 g番石榴粉于100 mL带塞锥形瓶中,按料液比1∶20 (g∶mL)加入50%乙醇溶液,在50 ℃下分别超声提取30、40、50、60、70 min。考察超声提取时间对番石榴多酚得率的影响。
1.5.4 乙醇体积分数的选择
准确称取1 g番石榴粉于100 mL带塞锥形瓶中,按料液比1∶20 (g∶mL)分别加入30%、40%、50%、60%、70%、80%乙醇,在50 ℃下超声提取40 min。考察乙醇体积分数对番石榴多酚得率的影响。
1.6 番石榴多酚提取响应面试验设计
在单因素实验的基础上,选取乙醇体积分数、超声温度、料液比和超声提取时间为试验因素,设计4因素3水平试验,结果见表1。
表1 响应面因素水平表
Table 1 Response surface factor level table

水平因素乙醇体积分数(A)/%料液比(B)(g∶mL)提取时间(C)/min提取温度(D)/℃-1401∶2550400501∶3060501601∶357060
1.7 番石榴多酚分离纯化
采样AB-8大孔树脂湿法装柱(柱子规格20 mm×600 mm,柱体积100 mL),将番石榴多酚粗品配成1.2 mg/mL的上样液过柱子进行纯化。纯化条件:样液pH为4,样液流速1 mL/min,蒸馏水除杂,80%乙醇洗脱,洗脱流速2 mL/min,直至流出液体不含有多酚类化合物[15]。将纯化后收集的溶液浓缩干燥成粉末,测定番石榴多酚含量,根据公式(2)计算番石榴多酚纯度:
多酚纯度![]()
(2)
式中:C2,为纯化后收集液多酚的浓度,μg/mL;V2,为纯化后收集液多酚的体积,mL;W多酚物干重,g。
1.8 番石榴多酚抑菌活性的测定
按照文献[16]报道的,在无菌工作台中从斜面培养基上挑取1环已活化好的金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、黑曲霉以及假丝酵母菌体,分别接入30 mL生理盐水中,充分摇匀,使各菌悬液的菌细胞数达到106~107 CFU/mL备用,且菌悬液当天使用。
将纯化后的番石榴多酚用60%乙醇配制成质量浓度为6 mg/mL溶液,利用二倍稀释法配成6、3、1.5、0.75、0.375 mg/mL共5个浓度梯度的番石榴多酚溶液。将直径为6 mm的无菌圆形滤纸片分别浸泡在不同浓度的多酚溶液,以及灭菌后的生理盐水和60%乙醇溶液中120 min以上。
在无菌环境下,往培养皿中倒入10 mL培养基,培养基凝固成平板后,取1 mL菌悬液加入到平板中(细菌加入到营养琼脂培养基,酵母和霉菌加入到PDA固体培养基),用涂布棒使菌液均匀分布,不同菌种做好标记。用无菌镊子取出浸泡后圆形滤纸片,贴于平板中,把分别浸泡于不同浓度番石榴多酚溶液,生理盐水和乙醇溶液的滤纸片做好标记。将标记好的平板在一定温度下培养一段时间(金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌于37 ℃下培养24 h,黑曲霉和假丝酵母在28 ℃下培养48 h),观察菌体的生长状况,测量并记录抑菌圈的直径大小,每个样品平行实验3次。根据抑菌圈的大小判断抑菌活性的好坏,无抑菌圈的多酚浓度为其最低抑菌浓度(minimum inhitory concentration,MIC),生理盐水为空白组,60%乙醇溶液为对照组。
1.9 数据处理
单因素试验数据采用OrigingPro 8进行处理,带标准偏差作图。响应面试验数据采用Design Expert 10中Box-Behnken组合法进行处理分析。
2 结果与分析
2.1 番石榴多酚提取单因素试验结果与分析
2.1.1 料液比对番石榴多酚提取率的影响
由图1可知,随着料液比的增大,多酚得率先上升后下降。可能是增大料液比,番石榴粉与溶剂的接触面增大,多酚得率增加。当料液比为1∶30(g∶mL)时多酚得率最高,然后随着料液比的增大多酚得率下降。可能是当料液比为1∶30(g∶mL)时多酚物质已经基本被提取出来,再增加溶剂会让番石榴多酚中其他杂质被释放出来,且料液比过大会浪费溶剂。因此选用料液比为1∶25、1∶30、1∶35 (mg∶mL)做响应面优化试验。

a-水作溶剂;b-乙醇作溶剂
图1 料液比对多酚得率的影响
Fig.1 Effect of feed-to-liquid ratio on polyphenol yield
2.1.2 提取时间对番石榴多酚提取率的影响
由图2可知,随着提取时间的延长,番石榴多酚得率上升。当提取时间为60 min时,番石榴多酚得率达到最大值,然后随着提取时间的延长,番石榴多酚得率下降。可能是开始随着提取时间延长,番石榴多酚逐渐从组织中被释放出来,但随着提取时间的不断延长,多酚物质已经基本被提取出来,且在提取过程中多酚与空气接触,被氧化破坏,多糖等其他物质也会被提取出来,导致多酚得率降低。因此选择提取时间为50、60、70 min做响应面优化试验。

a-水作溶剂;b-乙醇作溶剂
图2 提取时间对多酚得率的影响
Fig.2 Effect of extraction time on multi-part yield
2.1.3 提取温度对番石榴多酚提取率的影响
由图3可知,随着提取温度的升高,番石榴多酚得率升高。当温度提取为50 ℃时番石榴多酚得率达到最大值,然后随着提取温度的继续上升,番石榴多酚得率下降。可能是随着提取温度的升高可促使多酚与蛋白质等物质结合稳定性下降,从细胞中释放出来,但是温度过高也会导致多酚被氧化或者降解[17]。因此选择提取温度为40、50、60 ℃做响应面优化试验。
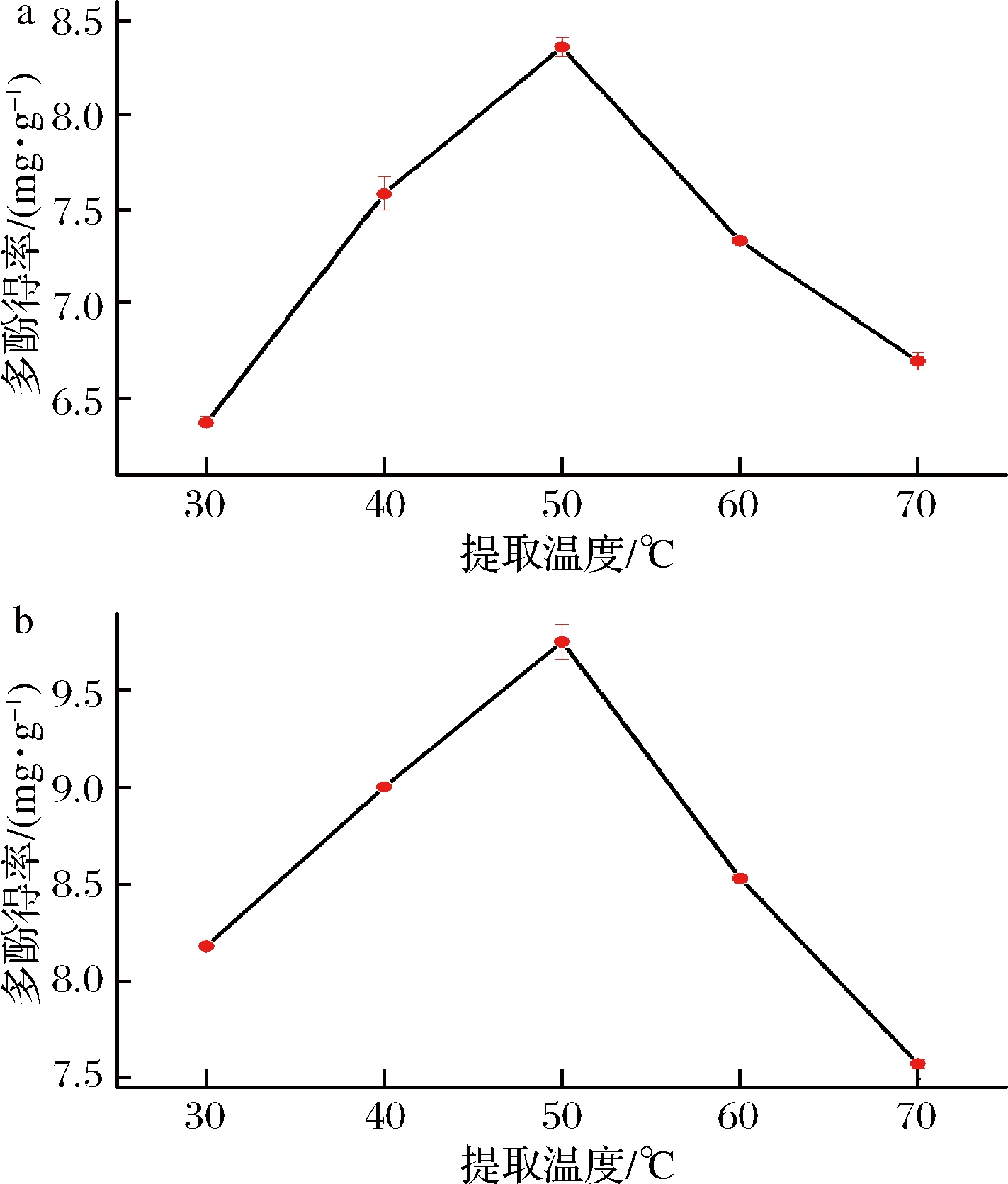
a-水作溶剂;b-乙醇作溶剂
图3 提取温度对多酚得率的影响
Fig.3 Effect of extraction temperature on polyphenol yield
2.1.4 乙醇体积分数对番石榴多酚提取率的影响
由图4可知,随着乙醇体积分数的增加,番石榴多酚得率上升。乙醇体积分数为50%时番石榴多酚提取率最高,然后随着乙醇体积分数的继续增加,多酚得率下降。推测是体积分数为50%的乙醇与番石榴组织内多酚极性相近,有利于番石榴多酚被提取出细胞外,当乙醇体积分数继续增加,溶剂极性增大,叶绿素等杂质更容易被释放,导致多酚得率降低[18]。因此选择乙醇体积分数为40%、50%、60%做响应面优化试验。
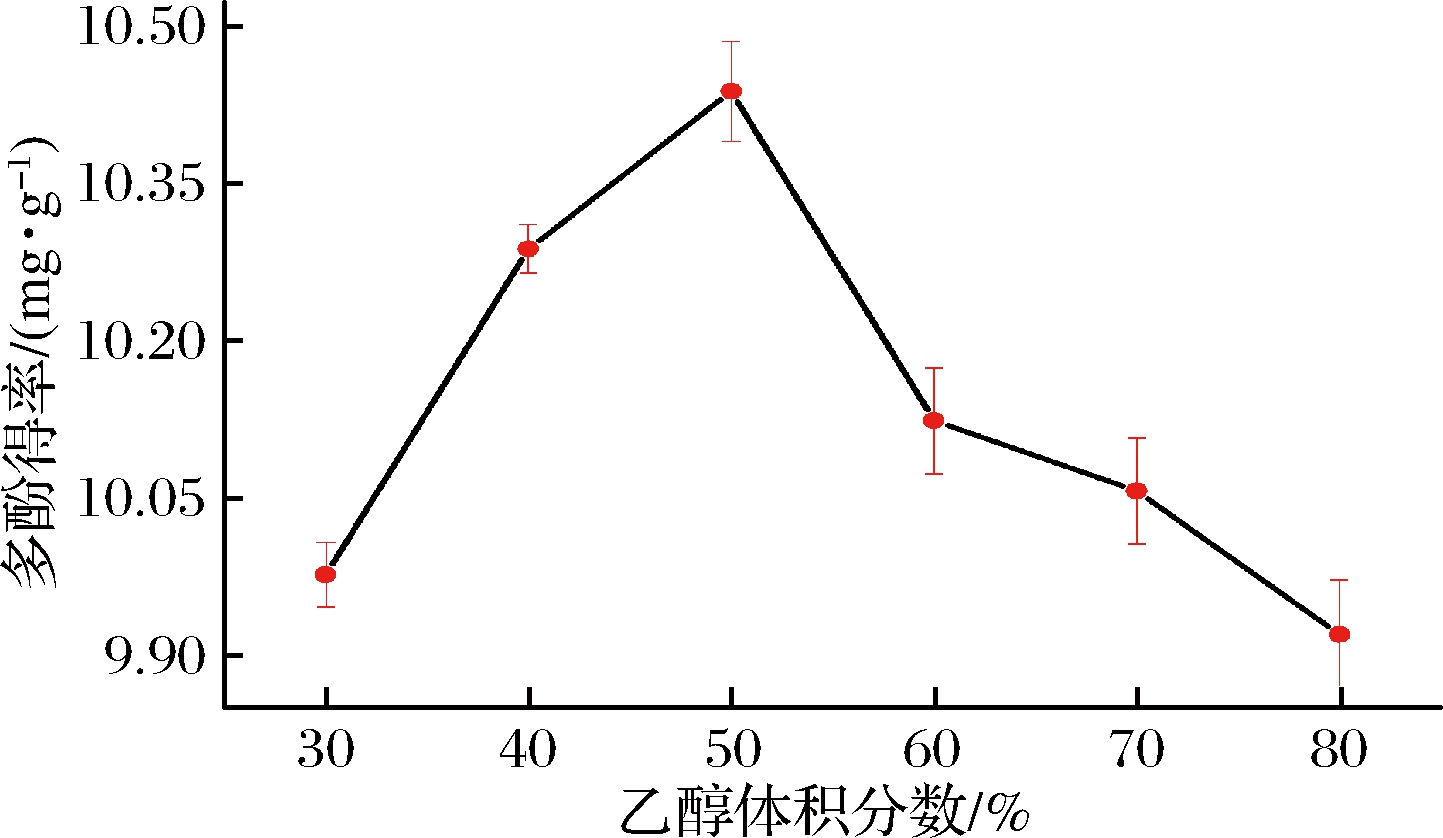
图4 乙醇体积分数对多酚得率的影响
Fig.4 Effect of ethanol concentration on polyphenol yield
综合以上分析可知,在单因素试验中,水与乙醇分别作为提取溶剂,其他提取条件相同,乙醇作为提取溶剂实验组多酚得率最大值均高于水提取溶剂实验组,因此选择乙醇作提取溶剂进行响应面试验。
2.2 番石榴多酚提取响应面优化试验结果与分析
2.2.1 响应面试验结果与分析
对表2数据进行分析处理,得到番石榴多酚得率(Y)对自变量乙醇体积分数(A),料液比(B),提取时间(C),提取温度(D)四个因素的二次多项回归方程为:
表2 响应面结果
Table 2 the results of response surface
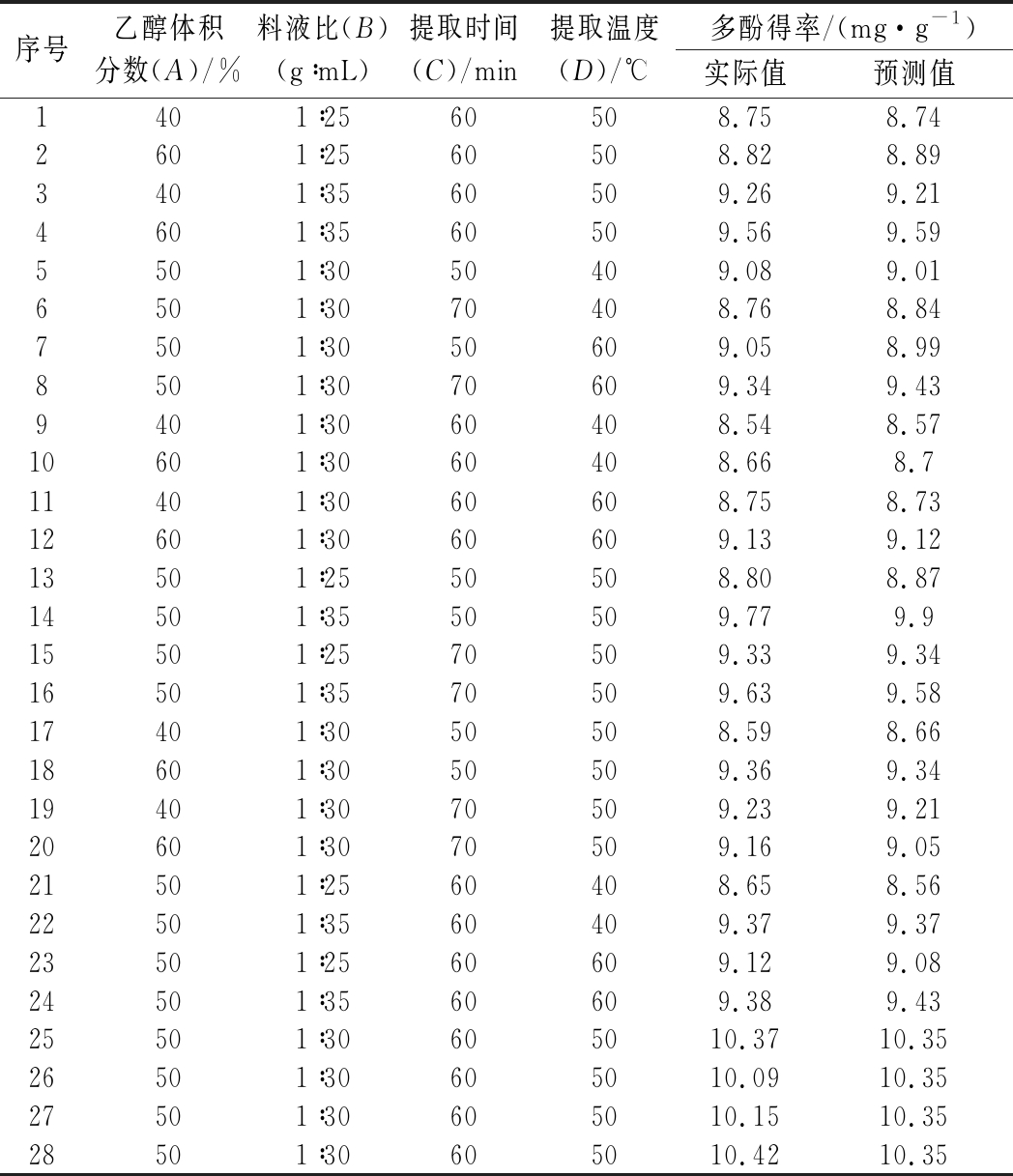
序号乙醇体积分数(A)/%料液比(B)(g∶mL)提取时间(C)/min提取温度(D)/℃多酚得率/(mg·g-1)实际值预测值1401∶2560508.75 8.742601∶2560508.82 8.893401∶3560509.26 9.214601∶3560509.56 9.595501∶3050409.08 9.016501∶3070408.76 8.847501∶3050609.05 8.998501∶3070609.34 9.439401∶3060408.54 8.5710601∶3060408.66 8.711401∶3060608.75 8.7312601∶3060609.13 9.1213501∶2550508.80 8.8714501∶3550509.77 9.915501∶2570509.33 9.3416501∶3570509.63 9.5817401∶3050508.59 8.6618601∶3050509.36 9.3419401∶3070509.23 9.2120601∶3070509.16 9.0521501∶2560408.65 8.5622501∶3560409.37 9.3723501∶2560609.12 9.0824501∶3560609.38 9.4325501∶30605010.37 10.3526501∶30605010.09 10.3527501∶30605010.15 10.3528501∶30605010.42 10.35
Y=-74.450 8+0.855 9A+1.409 0B+0.733 0C+0.740 6D+0.001 2AB-0.002 1AC+0.000 6AD-0.003 4BC-0.002 3CD+0.001 5BD-0.007 8A2-0.018 2B2-0.005 0C2-0.007 8D2
该回归模型的显著性分析以及方差分析结果见表3,该模型的F值为30.43,P<0.000 1,达到极显著水平。![]() 说明模型的拟合度良好,预测值与实际值相关性良好,可以用这个模型预测和分析番石榴多酚提取实验的结果。
说明模型的拟合度良好,预测值与实际值相关性良好,可以用这个模型预测和分析番石榴多酚提取实验的结果。
根据方差分析表3中F值和P值可以判断各因素对番石榴多酚得率的影响:料液比(B)>提取温度(D)>乙醇浓度(A)>提取时间(C)。各因素中A、B、D对番石榴多酚得率影响达到极显著水平,自变量C以及交互项AB、AD、BD、CD对番石榴多酚得率影响不显著,交互项AC、BC对番石榴多酚得率影响显著,二次项A2、B2、C2、D2均对多酚得率影响极显著。
表3 响应面回归模型方差分析表
Table 3 Response surface regression model variance analysis table
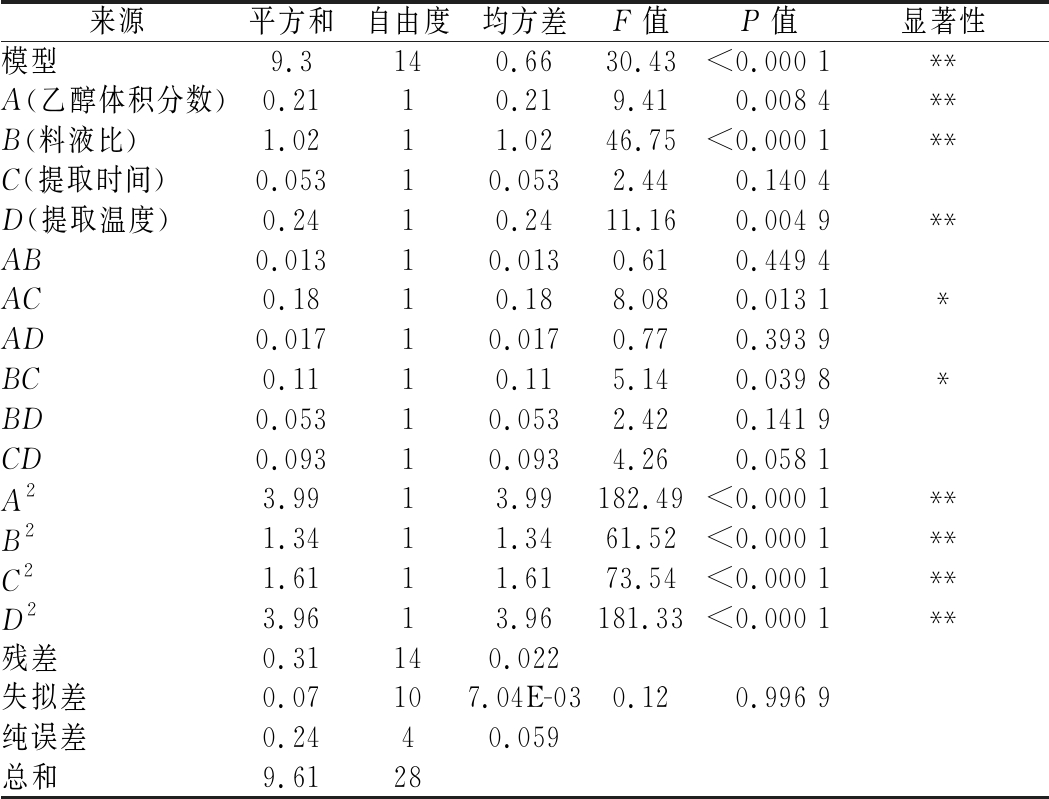
来源平方和自由度均方差F值P值显著性模型9.3140.6630.43<0.000 1**A(乙醇体积分数)0.2110.219.410.008 4**B(料液比)1.0211.0246.75<0.000 1**C(提取时间)0.05310.0532.440.140 4D(提取温度)0.2410.2411.160.004 9**AB0.01310.0130.610.449 4AC0.1810.188.080.013 1*AD0.01710.0170.770.393 9BC0.1110.115.140.039 8*BD0.05310.0532.420.141 9CD0.09310.0934.260.058 1A23.9913.99182.49<0.000 1**B21.3411.3461.52<0.000 1**C21.6111.6173.54<0.000 1**D23.9613.96181.33<0.000 1**残差0.31140.022失拟差0.07107.04E-030.120.996 9纯误差0.2440.059总和9.6128
注:**P<0.01,表示差异极显著;*P<0.05,表示差异显著
2.2.2 响应面试验各因素交互作用分析
各因素对番石榴多酚得率影响的响应面曲线图和等高线图如图5所示。由图5-a和图5-b可知,响应面图中乙醇体积分数和料液比曲线比较陡且存在最高点,此外,其等高线呈椭圆形,这说明乙醇体积分数和料液比对多酚得率都有较大的影响,两者之间的交互作用对多酚得率的影响较大。图5-c和图5-d为乙醇体积分数和提取时间交互作用对番石榴多酚得率影响的响应面曲线图和等高线图。随着乙醇体积分数和提取时间的增加,乙醇体积分数和提取时间曲线比较陡且存在最高点,等高线为椭圆形,说明乙醇体积分数和提取时间对多酚得率都有较大的影响,两者之间的交互作用对多酚得率的影响较大。如图5-e和图5-f所示,响应面图中乙醇体积分数和提取温度曲线存在顶点,但等高线为圆形,这说明乙醇体积分数和提取时间的交互作用对多酚得率的影响不大。料液比和提取时间对番石榴多酚得率影响的响应面曲线和等高线如图5-g和图5-h所示,曲线比较陡且存在最高点,等高线呈椭圆形,说明料液比和提取时间对多酚得率都有较大的影响,两者之间的交互作用对多酚得率的影响较大。图5-i和图5-j为料液比和提取温度对番石榴多酚得率影响的响应面曲线图和等高线图,由图可知,曲线比较陡且存在最高点,等高线呈椭圆形,说明料液比和提取温度对多酚得率都有较大的影响,两者之间的交互作用对多酚得率的影响较大。由图5-k和图5-l可知,响应面中提取时间和提取温度曲线比较陡,存在最高点,并且等高线呈椭圆形,这说明提取时间和提取温度对多酚得率都有较大的影响,两者之间的交互作用对多酚得率的影响较大。

图5 各因素交互作用对番石榴多酚得率的等高线和响应面
Fig.5 Contour line and response surface of guava polyphenol yield by interaction of various factors
利用Design Expert 10.0 预测得到番石榴多酚提取的最佳工艺条件为:乙醇体积分数为50.98%,料液比为1∶31.59,提取时间为60.05 min,提取温度为50.73 ℃。在此工艺条件下,番石榴多酚得率为10.40 mg/g。
2.3 最佳提取工艺及验证实验结果
通过整理分析得出的番石榴多酚最佳工艺条件将最佳提取工艺条件确定为乙醇体积分数51%,料液比1∶32,提取时间60 min,提取温度51 ℃。对最佳提取工艺条件进行实验验证,重复实验3次,得到番石榴多酚平均得率为10.31 mg/g,与模型预测值误差为0.865%,说明该模型较准确地预测番石榴多酚实际得率。
2.4 大孔树脂纯化结果与分析
番石榴多酚粗品纯度为1.2%,经AB-8大孔树脂纯化后番石榴多酚纯度达到33.2%,尝试将番石榴多酚液体过XAD-16大孔树脂纯化[19],尝试结合金属离子沉淀法[20]以及利用聚酰胺树脂进行二次纯化[21],均不能提高番石榴多酚纯度,原因可能是番石榴多酚进行一次纯化后被提取出来,进行二次纯化暴露时间过长,难免与空气中氧气接触,番石榴多酚被氧化降解。
2.5 抑菌活性测定结果
番石榴多酚表现出抑菌效果可能因为多酚抑制菌体体内某些酶的合成,影响其代谢,也可能是多酚物质与蛋白质结合,或者与其他微生物生长必须物质结合,导致微生物死亡等[22]。由表4可知,番石榴多酚对枯草芽孢杆菌、金黄色葡萄球菌以及大肠杆菌有抑菌作用,且高浓度多酚溶液抑菌效果更强。番石榴多酚对金黄色葡萄球菌抑菌效果最好,在同浓度多酚溶液中抑菌圈最大,其次是枯草芽孢杆菌,对大肠杆菌的抑制效果相对于前2种较弱。枯草芽孢杆菌以及金黄色葡萄球菌的MIC为1.5 mg/mL,对应抑菌圈分别为(7.54±0.06) mm,(7.87±0.05) mm。大肠杆菌MIC为3 mg/mL,对应抑菌圈大小为(7.68±0.04) mm。然而,6 mg/mL的番石榴多酚对黑曲霉和假丝酵母没有抑菌作用,可能的原因是6 mg/mL的浓度未达到它们的最低抑菌浓度,当实验浓度超过它们的最低抑菌浓度时,也会有一定的抑菌作用。孔阳等[23]的研究显示,当石榴皮粗提物的质量浓度为20 mg/mL时,黑曲霉和假丝酵母的抑菌圈分别为6.0 mm 和16.0 mm。
表4 番石榴多酚抑菌活性测定结果 单位:mm
Table 4 Results of determination of antibacterial activity of pomegranate polyphenols
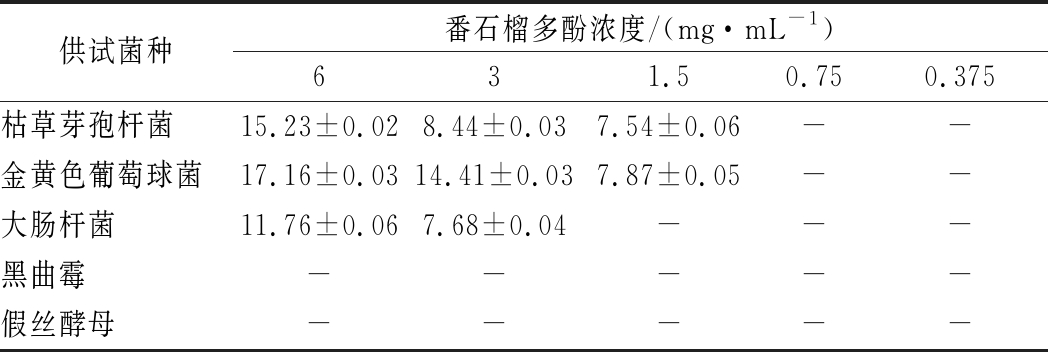
供试菌种番石榴多酚浓度/(mg·mL-1)631.50.750.375枯草芽孢杆菌15.23±0.028.44±0.037.54±0.06--金黄色葡萄球菌17.16±0.0314.41±0.037.87±0.05--大肠杆菌11.76±0.067.68±0.04---黑曲霉-----假丝酵母-----
注:-表示此实验组没有观察到抑菌圈,即无抑菌效果体积分数
通常情况下,番石榴多酚对革兰氏阳性(G+)菌的抑制作用比对革兰氏阴性(G-)菌的抑制作用强。邝高波[24]的研究发现番石榴多酚对G+菌的抑制作用明显高于对G-的抑制作用。梁清蓉[25]研究发现番石榴叶酚类对G+菌的抑制作用明显比G-菌的抑制作用强。本研究的结果与以上两个研究小组的结果相似,番石榴多酚对2株G+菌的MIC为1.5 mg/mL,对1株G-菌的MIC为3 mg/mL,说明番石榴多酚对G+菌的抑菌作用优于G-菌。这归因于番石榴多酚能特异性地凝固细菌蛋白、破坏细菌细胞膜结构,与细菌遗传物质DNA结合,从而抑制细菌的生长[26-27]。
3 结论
通过单因素和响应面优化试验探索番石榴多酚提取工艺,得到其最佳提取工艺条件:乙醇体积分数为51%,料液比为1∶32(g∶mL),提取时间为60 min,提取温度为51 ℃。在此工艺条件下,番石榴多酚得率为10.31 mg/g。利用AB-8大孔树脂对番石榴多酚粗品进行分离纯化,番石榴多酚纯度由1.2%提高到33.2%,提高了27.7倍。通过番石榴多酚抑菌活性测定分析,发现番石榴多酚对大肠杆菌,枯草芽孢杆菌及金黄色葡萄球菌具有抑制作用,它们的MIC分别为3、1.5、1.5 mg/mL,但是对假丝酵母和黑曲霉无抑菌作用。研究表明,番石榴多酚具有抑菌作用的药效物质基础,下一步将研究番石榴多酚对食品的保鲜应用。本文可为番石榴的开发利用拓展范围,以及提高番石榴的综合利用率,增加番石榴的综合利用价值,同时为研发天然多酚的抑菌药物提供理论基础。
[1] 刘建林, 夏明忠, 袁颖. 番石榴的综合利用现状及发展前景[J]. 中国林副特产, 2005(6): 60-62.
[2] ZHANG Z, KONG F, NI H, et al. Structural characterization, α-glucosidase inhibitory and DPPH, scavenging activities of polysaccharides from guava[J]. Carbohydrate Polymers, 2016, 144: 106-114.
[3] ALAMAR P D, ELEM T S CARAM S, POPPI R J, et al. Quality evaluation of frozen guava and yellow passion fruit pulps by NIR spectroscopy and chemometrics[J]. Food Research International, 2016, 85: 209-214.
S, POPPI R J, et al. Quality evaluation of frozen guava and yellow passion fruit pulps by NIR spectroscopy and chemometrics[J]. Food Research International, 2016, 85: 209-214.
[4] 周浓, 莫日坚, 闫协民, 等. 不同加工工艺对番石榴果粉品质的影响及对其褐变的抑制[J]. 食品与发酵工业, 2019, 45(10): 129-134.
[5] 温靖, 徐玉娟, 肖更生, 等. 番石榴果实的营养价值和药理作用及其加工利用[J]. 农产品加工(学刊), 2009(6): 11-13.
[6] 傅予, 王宏, 张岩, 等. Box-Behnken设计-响应面法优化番石榴叶总黄酮提取工艺及总黄酮对糖尿病小鼠糖耐量的影响研究[J]. 中国药房, 2018, 29(1): 49-53.
[7] 贾桂云, 吴凌志, 羊传慧, 等. 芒果和番石榴的果皮、果肉多酚含量测定及抗氧化性比较分析[J]. 海南师范大学学报(自然科学版), 2018, 31(1): 38-43.
[8] 白丽丽, 周紫梦, 戴华. 番石榴果实中总黄酮的提取及含量测定[J].中国现代中药, 2017, 19(2): 260-262;265.
[9] ALMULAIKY Y, ZEYADI M, SALEH R, et al. Assessment of antioxidant and antibacterial properties in two types of Yemeni guava cultivars[J]. Biocatalysis and Agricultural Biotechnology, 2018, 16: 90-97.
[10] FLORES G, WU S B, NEGRIN A, et al. Chemical composition and antioxidant activity of seven cultivars of guava (Psidium guajava) fruits Food Chemistry, 2015, 170: 327-355.
[11] 周佳. 茶多酚在动物生产中的应用及研究进展[J]. 广东饲料, 2019, 28(3): 27-29.
[12] 王峰, 李新明, 李群, 等. 苹果多酚及其活性单体对糖尿病小鼠肾中与糖代谢相关基因表达的影响[J]. 中国医药指南, 2018, 16(17): 1-2.
[13] 董科, 冷云, 何方婷, 等. 植物多酚及其提取方法的研究进展[J]. 食品工业科技, 2019, 40(2): 326-330.
[14] 陈金玉, 曾健, 李春美. 龙眼核多酚提取工艺的正交试验优化及其分离纯化与结构表征[J].食品科学, 2015, 36(16): 31-37.
[15] 曹增梅, 黄和. 大孔树脂纯化番石榴多酚的工艺优化[J]. 食品工业科技, 2013, 34(7): 215-218.
[16] 张帅, 程昊. 百香果壳粗多糖的提取及其抑菌性检测[J]. 中国食品添加剂, 2018(11): 182-187.
[17] 徐金瑞, 侯方丽, 黄建蓉, 等.番石榴叶多酚的提取及其抗氧化作用研究[J]. 食品研究与开发, 2016, 37(23): 38-41;55.
[18] 楠极, 李远志. 响应面法优化番石榴叶多酚的超声提取工艺[J]. 食品工业科技, 2016, 37(22): 300-304.
[19] 张倩茹, 尹蓉, 段泽敏, 等. 5种大孔树脂分离苹果多酚的比较研究[J]. 山西农业科学, 2017, 45(4): 538-543.
[20] 朱宇惠, 张继.沉淀-柱层析法纯化茶多酚及儿茶素含量测定[J]. 食品研究与开发, 2013, 34(7): 110-114.
[21] 颜栋美, 李仁菊. 膜分离和聚酰胺吸附对金花茶多酚的纯化[J]. 食品与机械, 2010, 26(1): 42-43;91.
[22] 严守雷. 莲藕多酚提取分离鉴定及生物活性研究[D]. 武汉: 华中农业大学, 2003.
[23] 孔阳, 马养民, 李彦军, 等. 石榴皮粗提物抗菌活性的研究[J]. 食品科技, 2008, 33(9): 199-201.
[24] 邝高波. 番石榴多酚提取及抗氧化和抑菌活性研究[D]. 湛江: 广东海洋大学, 2014.
[25] 梁清蓉. 番石榴叶中酚类物质的研究[D]. 无锡: 江南大学, 2005.
[26] 费鹏, 赵胜娟, 陈曦, 等. 植物多酚抑菌活性、作用机理及应用研究进展[J]. 食品与机械, 2019, 35(7): 226-230.
[27] 陈琛, 徐尤美, 蔺蓓蓓, 等. 秦岭绿茶茶多酚抑菌活性及其机理研究[J]. 四川农业大学学报, 2019, 37(6): 821-827.