蒙阴黄桃因味道鲜美、香气宜人且富含VC、胡萝卜素,果胶以及锌、硒等多种微量元素,深受国内外消费者的喜爱[1]。由于桃(Prunus persica L.)为呼吸跃变型果实,采后存在果实变软、耐贮运变差,直接影响桃产业的发展[2-3]。不同品种黄桃采后的硬度存在明显差异性[4],黄桃的软化是黄桃果实成熟重要标志之一,会影响采后黄桃外观、抗病能力及商品价值等。可溶性固形物含量(soluble solids content,SSC)也是评价水果口感及成熟度重要的品质指标之一[5-6],检测黄桃的硬度及SSC,对黄桃采后贮藏、运输具有重要的意义[7-8]。
目前,传统测定黄桃硬度和SSC,虽测定结果相对准确,但操作复杂,耗时耗力;且需破坏样品,一般需要无法满足大批量黄桃在线分选检测的需求。近红外光谱技术具有无损、快速、易操作等特点[9-11],目前已广泛应用于农产品的内部品质检测[12-14]。王铭海等[15]采用近红外漫反射光谱技术实现对多品种桃SSC含量的无损检测。BETEMPS等[16]采用近红外光谱技术实现桃子硬度检测。NASCIMENTO等[17]利用近红外光谱技术建立部分最小二乘(partial least squares,PLS)模型,预测‘极光-1’桃子果实的SSC和硬度。
利用近红外在线分选来检测到更多果品的品质,从而提高果品经济价值。为了满足在线快速检测中移动速度的需要,研究移动速度对黄桃SSC在线检测模型特征的影响是十分必要的。而目前国内对果品在线分选大都基于质量,在线无损分选设备对果品品质分级价格昂贵且大都依赖于国外进口。国内研究中的大都处于实验室阶段,暂时无法技术成果商业应用,并且对于移动速度下对黄桃品质模型影响的研究少。
本文基于可见光-近红外光谱技术自发研制可移动式果品在线快速分选系统,研究在动态运动下速度对黄桃SSC和硬度品质预测模型影响,有助于黄桃采后贮藏及运输,推动黄桃品质的在线分级检测,提高水果产业的经济效益。
1 材料与方法
1.1 材料
黄桃采摘山东蒙阴野店镇某果园,品种为中蟠17号,采摘后于冷藏车运回实验室,挑选大小均匀、无病虫害和无机械损伤样品后入冷藏库(3~4 ℃)。
1.2 近红外漫透射光谱在线检测装置
如图1所示,黄桃在线光谱采集由自行研发的在线分级装置完成。在线检测分级系统采取主控分选单元与分布式测量单元联网应用模式,将待测果品置于智能载样托盘,托盘内置近场通讯模块,可实现检测数据的高速无线传输,托盘依托回转流体传送平台传送,分别经过光谱检测单元、图像检测单元、称重单元等检测单元,各个测量单元采取“查询测量+延时分析”的测量模式独立运行,测量结果通过千兆网络上传至主控分选单元,随后根据预设的分级条件对果品进行分级筛选。

图1 在线检测系统示意图
Fig.1 Online detection system
包括硬件系统和软件系统,其中硬件系统包括近红外光谱检测单元、机器视觉图像检测单元、自动称重单元、品级分选单元和回转输送平台。软件系统包括系统主控软件、光谱测量软件、化学计量软件和图像分析软件。由于本试验只采集黄桃的近红外光谱,不进行图像采集。
试验采用的在线动态检测系统主要包括海洋光学(Ocean Optics Inc., USA)USB2000+光纤光谱仪,波长为600~1 000 nm,配有SMA905标准光纤接口,通过USB接口与计算机相连,光源为12V/50W卤素灯,共有4个,分别位于近红外检查箱内部的4个角;光谱仪光纤探头固定于传动链条的下方,采取水平照射底部测量模式,光源水平照射果品,果品置于果托之上,果托中心呈2 cm空心圆洞(图3),近红外测量探头置于下方,有效避免果品非测量部位造成的漫反射光干扰。

1-光源;2-传感器;3-光纤传感器;4-光谱仪
图2 近红外光谱检测模块结构图
Fig.2 NIR detection module structure

图3 光源套件实物及效果图
Fig.3 Rendering of light source modules
1.3 光谱采集
采用海洋光学(Ocean Optics Inc., USA)USB2000+光纤光谱仪,在线采集光谱,波长600~1 000 nm参比积分时间为5 ms,参比平均数为100次,样品积分时间为10 ms,样品平均次数为3次。选取120个蒙阴黄桃,从冷库取出后,置于室温下12 h,待样品与室温一致,沿着果品赤道部位进行标记,对标记区域进行光谱采集,每个样品采集3次,采集平均光谱用于后续的数据处理分析。
1.4 理化指标测定
1.4.1 硬度测定
采用TA5探头在质构仪TMS-PRO(美国,FTC)上进行TPA(texture profile analysis)测试。沿着标记区域进行测试,设置测前速率 120 mm/s;测中及测后速率120 mm/s;压缩程度5%,起始力0.75 N。得到评价黄桃果肉状况硬度特征曲线,其参数包括:硬度。硬度是以双峰曲线第1个峰的最大值表示;典型硬度特征曲线如图4所示。
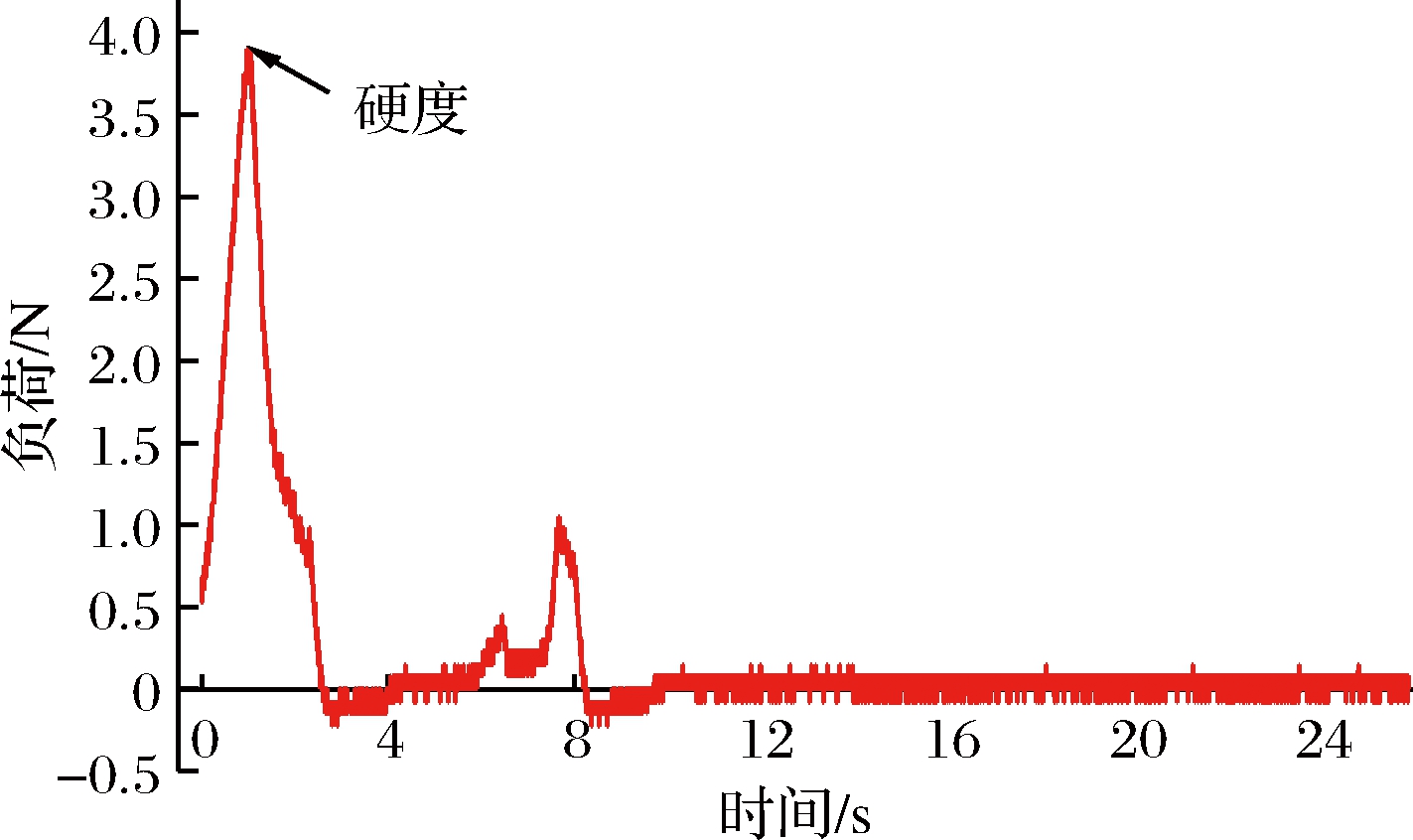
图4 黄桃TPA 试验模式图及特征曲线
Fig.4 Yellow peach TPA test mode figure and characteristic curves
1.4.2 SSC测定
按照 NY/T 2637—2014 规定的方法测定。采集完光谱后,将黄桃放入研钵中研磨成匀浆,用纱布滤后得到滤液后滴在Atago(日本,Atago)数显SSC计上,记录读数,测定3次,取平均值为黄桃的SSC值。
1.5 光谱处理与建模方法
由于采集的原始近红外原始光谱除含有样品信息外,受自身仪器状态、外界环境温湿度、测试条件基线漂移等诸多干扰因素影响,需对采集黄桃原始近红外光谱进行预处理,来提高模型的稳健性和适用能力。利用SG-平滑(savitzky-golay smooth)(窗口宽度为5点、拟合3次)、SG卷积导数(窗口宽度为5点、拟合3次)、多元矫正散射(multiplicative scatter correction,MSC)和标准正态能量变换(standard normal variate,SNV)等多种光谱预处理方法对采集光谱图进行预处理,来提高预测黄桃品质模型的精度和使用能力。采用偏最小二乘回归法建立黄桃品质的PLS预测模型。所建立预测模型采用校正集相关系数(correlation coefficient of calibration, rc)、验证集相关系数(correlation coefficient of validation, rp)、校正集均方根误差(root mean square error of calibration, RMSEC)和验证集均方根误差(root mean square error of validation, RMSEP)进行评定,相关系数越高,均方根误差越低,建立的预测模型越好。
采集黄桃的近红外光谱利用北京伟创英图科技有限公司ChemoStudio 2018化学计量学软件及matlab 8.0,进行光谱图预处理,将建好模型导入到在线动态检测系统,实现对黄桃无损快速分级。
2 结果与分析
2.1 光谱图预处理
采集黄桃的原始近红外光谱如图5所示,在685 nm和978 nm处各有吸收峰且差异明显,在685 nm处可能是红色素的吸收,赋予黄桃代表性绿色的绿色素;978 nm处的吸收峰,可能是由糖类和水的吸收,对分析黄桃的近红外光谱由较大影响。本文的有效全光谱为600~1 000 nm,由于978 nm的吸收峰由水分吸收引起,将光谱区间分为600~750 nm,750~900 nm,900~1 000 nm三个波段范围,对3个区间波段及全波长,分别采用SG-平滑、SG导数等光谱进行预处理,采用PLS建立校正模型。
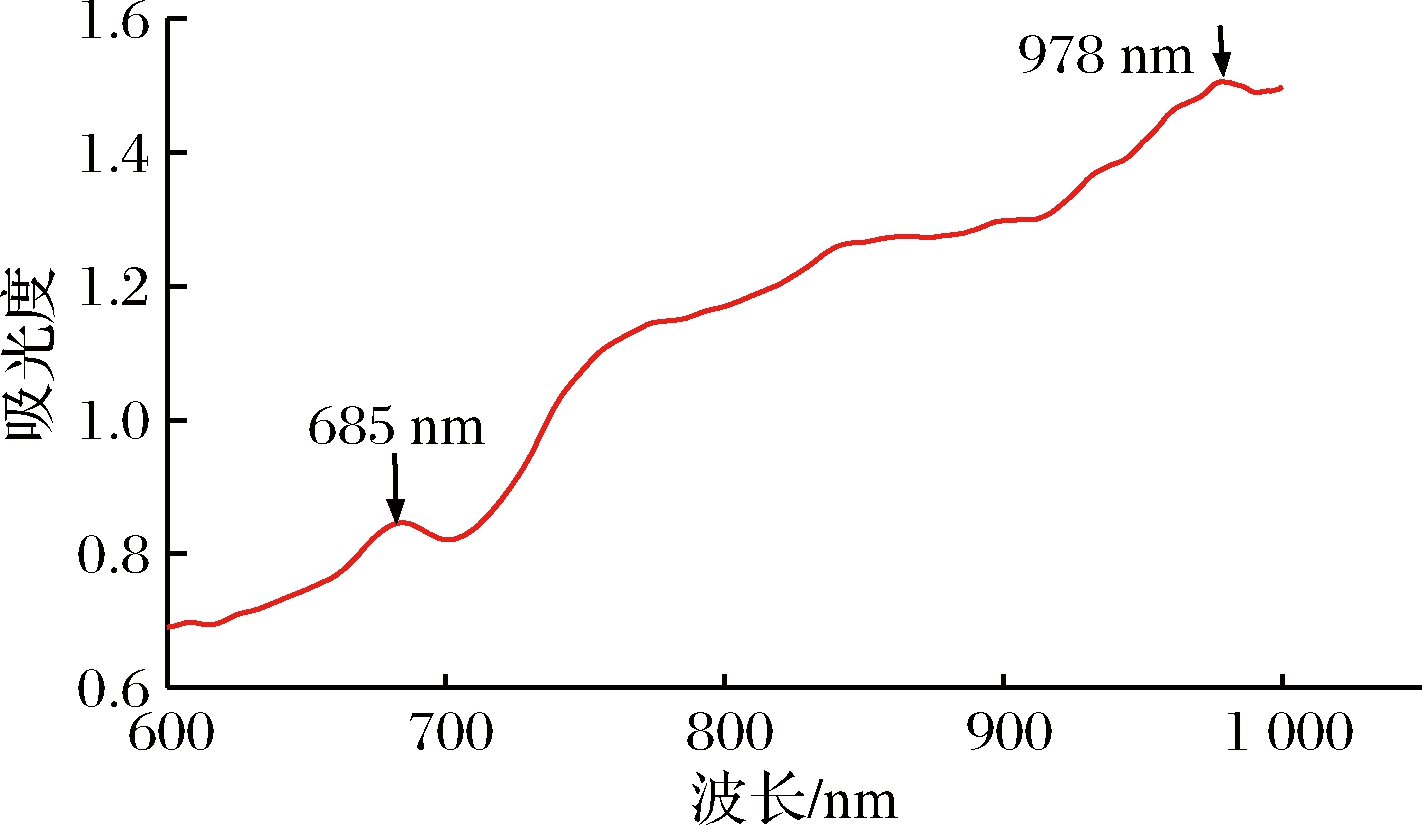
图5 黄桃近红外光谱原始图
Fig.5 Original NIR spectrum of yellow peaches
利用在线动态检测系统采集黄桃光谱图,本次试验共采集120张光谱图,采用Kennard-Stone分类方法对采集的光谱进行按照3∶1进行分类,校正光谱为90张,验证光谱为30张;黄桃的SSC和硬度校正集和验证集的统计分布如表1所示。校准集和预测集的SSC在6.2%~15.4%和6.4%~15.0%,硬度的校正集和预测集为2.78~7.92 N和2.64~7.85 N。为了消除黄桃的大小及质量影响,选取校准集的质量为278.93~325.56 g,预测集的质量为285.63~319.23 g。
表1 黄桃物理参数的校正与预测集统计
Table 1 Physical parameters statistics of yellow peach samples in calibration and prediction sets
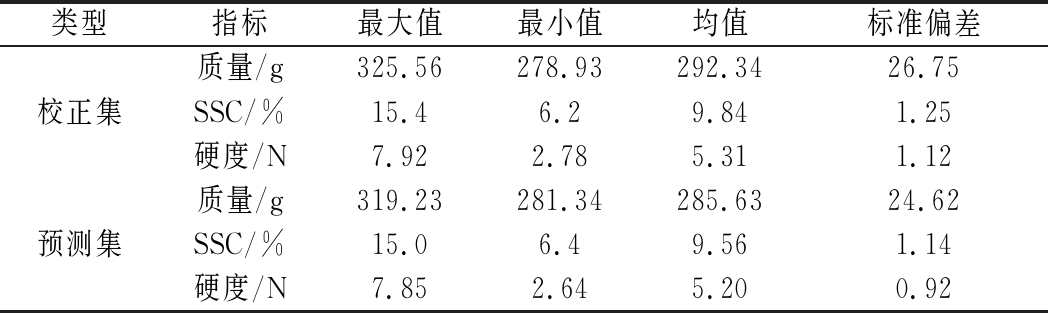
类型指标最大值最小值均值标准偏差质量/g325.56278.93292.3426.75校正集SSC/%15.46.29.841.25硬度/N7.922.785.311.12质量/g319.23281.34285.6324.62预测集SSC/%15.06.49.561.14硬度/N7.852.645.200.92
2.2 黄桃SSC在线检测模型的建立
由表2可知,在移动速度为5个/s时,在不同波段范围,采用不同预处理方法,用PLS建立SSC预测模型性能也不一样。900~1 000 nm区间建立SSC预测模型最差,而全波长建立SSC预测模型优于3个独立区间建立模型。混合波段(600~750 nm和750~900 nm)建立SSC模型优于全波长3个区间[(600~1 000 nm)和(600~750 nm),(750~900 nm),(900~1 000 nm)]建立预测模型。因此,建模波段选择(600~750 nm和750~900 nm)。3种预处理方法中,采用SG-DER预处理建立模型预测性能最好。其校正集和验证集相关系数分别为和0.919和0.863,均方根误差分别为0.735%和0.764%。
表2 采用不同预处理方法建立PLS模型预测黄桃样品的SSC
Table 2 SSC results for yellow peaches sampled by PLS modeling using different preprocessing methods
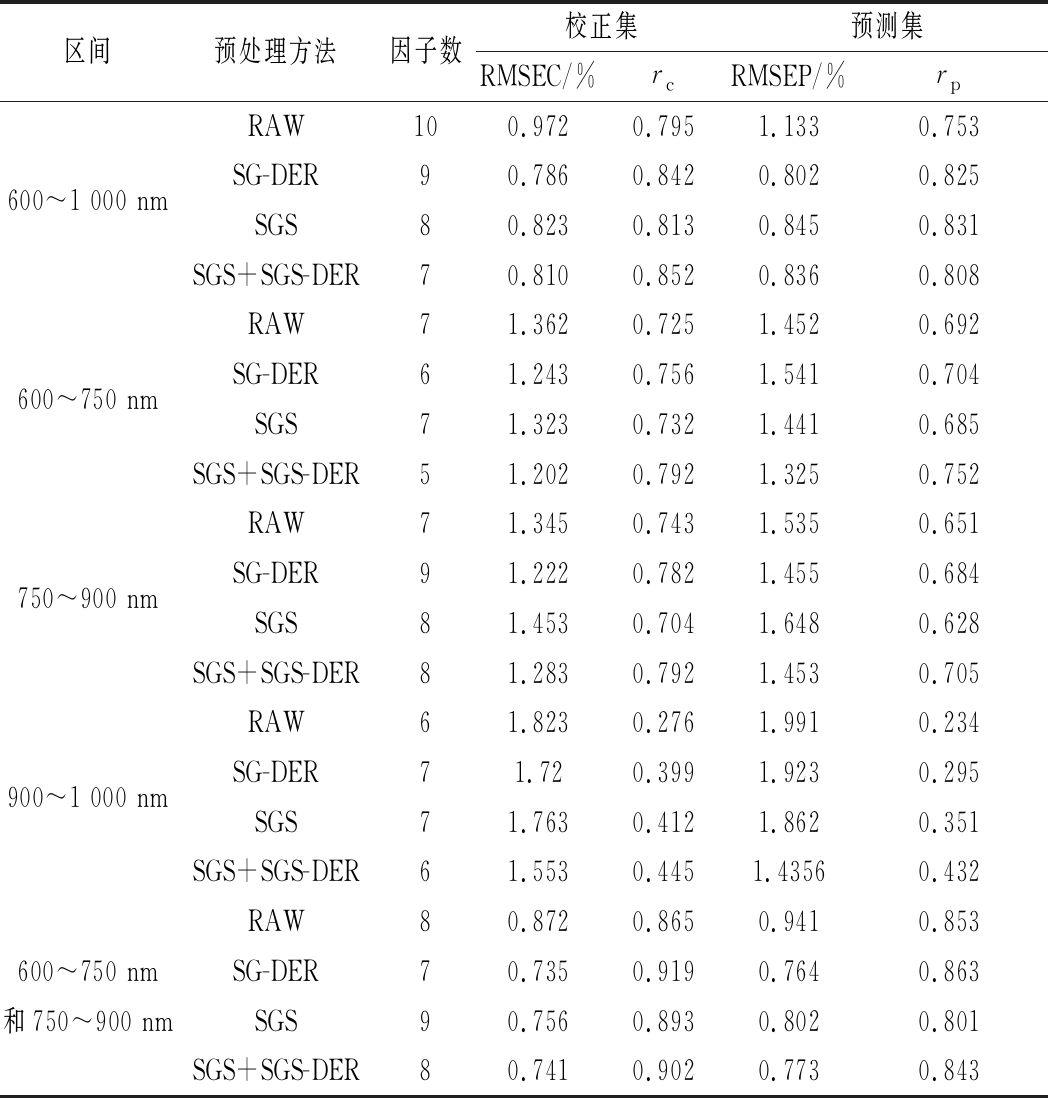
区间预处理方法因子数校正集预测集RMSEC/%rcRMSEP/%rpRAW100.9720.7951.1330.753600~1 000 nmSG-DER90.7860.8420.8020.825SGS80.8230.8130.8450.831SGS+SGS-DER70.8100.8520.8360.808RAW71.3620.7251.4520.692600~750 nmSG-DER61.2430.7561.5410.704SGS71.3230.7321.4410.685SGS+SGS-DER51.2020.7921.3250.752RAW71.3450.7431.5350.651750~900 nmSG-DER91.2220.7821.4550.684SGS81.4530.7041.6480.628SGS+SGS-DER81.2830.7921.4530.705RAW61.8230.2761.9910.234900~1 000 nmSG-DER71.720.3991.9230.295SGS71.7630.4121.8620.351SGS+SGS-DER61.5530.4451.43560.432RAW80.8720.8650.9410.853600~750 nmSG-DER70.7350.9190.7640.863和750~900 nmSGS90.7560.8930.8020.801SGS+SGS-DER80.7410.9020.7730.843
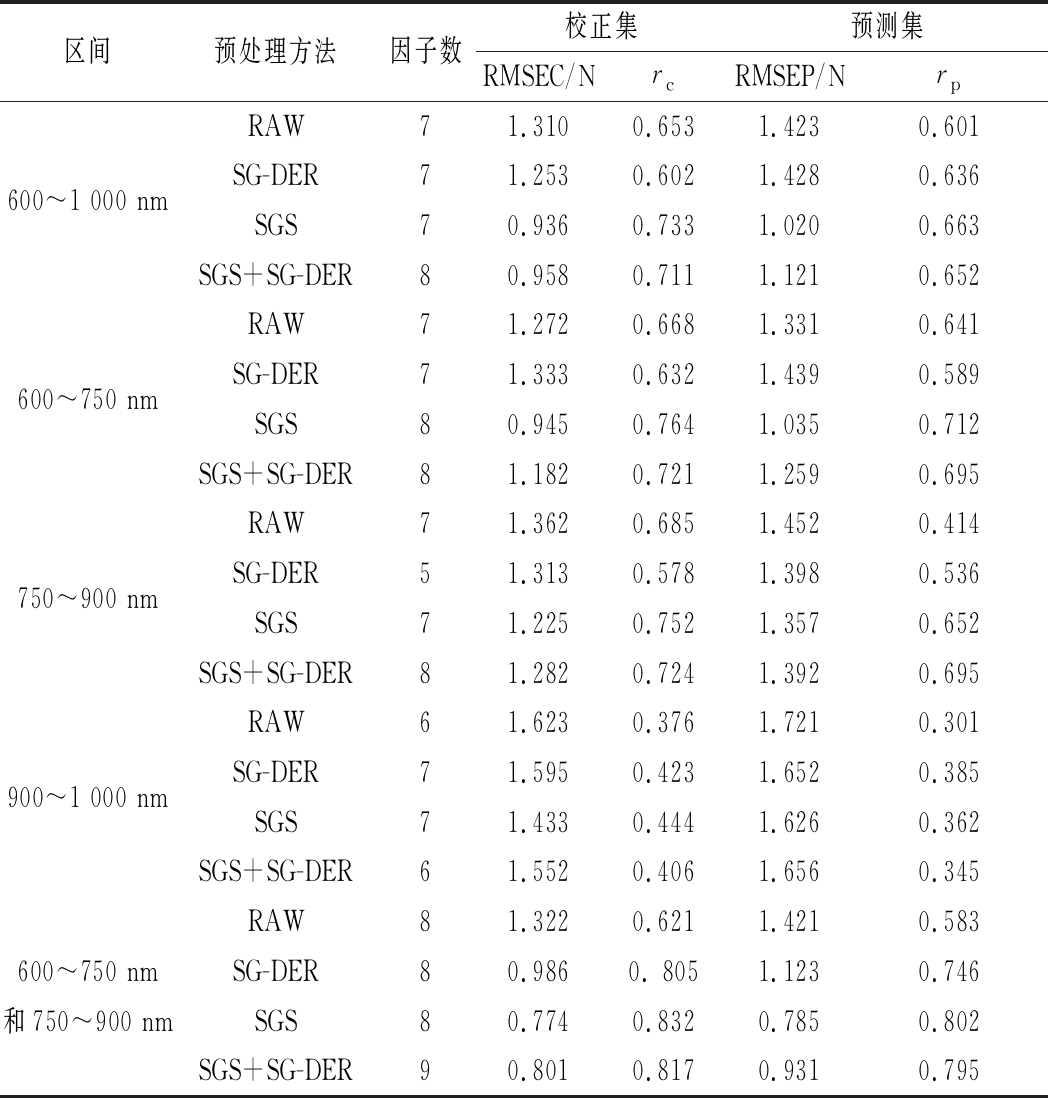
2.3 黄桃硬度在线检测模型的建立
由表3知,在移动速度为5个/s时,在不同波段,采用不同预处理方法,用PLS建立硬度预测模型性能不一样。采用全波长(600~1 000 nm),建立硬度模型性能优于600~750 nm,750~900 nm,900~1 000 nm三个区间建立预测模型;而3个波长区间独立建立预测模型中,900~1 000 nm波段建立预测模型性能最差。可能是由于该段范围是其他干扰波段混杂的影响。混合波段(600~750 nm和750~900 nm)建立SSC模型优于全波长(600~1 000 nm)和600~750 nm,750~900 nm,900~1 000 nm三个区间建立预测模型。因此,建模波段选择600~750 nm和750~900 nm。3种预处理方法中,采用SGS模型效果最好。其校正集和验证集相关系数分别为0.832和0.746,方根误差分别为0.774 N和0.785 N。
表3 采用不同预处理方法建立PLS模型预测黄桃的硬度
Table 3 Firmness results for yellow peaches sampled by PLS modeling using different preprocessing methods
区间预处理方法因子数校正集预测集RMSEC/NrcRMSEP/NrpRAW71.3100.6531.4230.601600~1 000 nmSG-DER71.2530.6021.4280.636SGS70.9360.7331.0200.663SGS+SG-DER80.9580.7111.1210.652RAW71.2720.6681.3310.641600~750 nmSG-DER71.3330.6321.4390.589SGS80.9450.7641.0350.712SGS+SG-DER81.1820.7211.2590.695RAW71.3620.6851.4520.414750~900 nmSG-DER51.3130.5781.3980.536SGS71.2250.7521.3570.652SGS+SG-DER81.2820.7241.3920.695RAW61.6230.3761.7210.301900~1 000 nmSG-DER71.5950.4231.6520.385SGS71.4330.4441.6260.362SGS+SG-DER61.5520.4061.6560.345RAW81.3220.6211.4210.583600~750 nmSG-DER80.9860. 8051.1230.746和750~900 nmSGS80.7740.8320.7850.802SGS+SG-DER90.8010.8170.9310.795
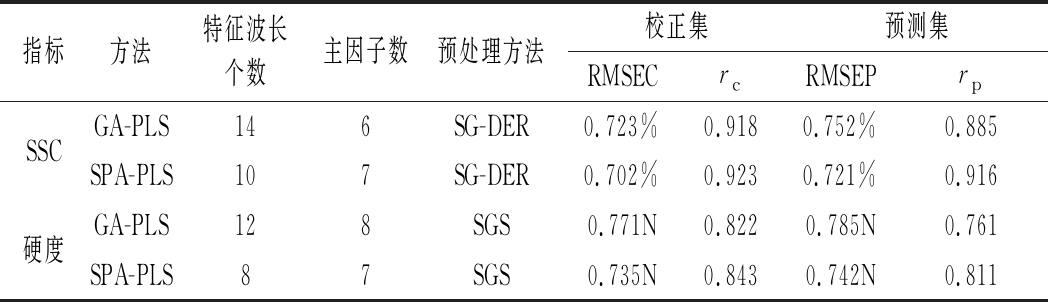
2.4 特征变量选取
连续投影算法(successive projections algorithm,SPA)是采用向量投影分析,从采集的中光谱信息提取有效信息,消除光谱中众多变量间的共线性影响,使光谱共线性最小化[18]。遗传算法(genetic algorithm, GA)起源于对生物系统所进行的计算机模拟研究,是一种全局、高效、并行搜索的方法,能在搜索过程中自动获取和积累有关搜索空间的知识,并自适应地控制搜索过程以求得最佳解[19]。本文基于SPA和GA算法,从600~750 nm和750~900 nm选择特征变量,采用SG-DER处理光谱,建立SSC的预测模型;采用SGS处理光谱,建立硬度预测模型。
由表4可知,采用SPA和GA算法使得建模的波长数量显著降低,说明这2种方法都可剔除噪声过大和去除不相关变量的变量,这与郭志明和田潇瑜的研究类似[20-21]。不同品质指标,采用相同的算法,所选的特征变量不相同。从建模效果来说。对于SSC预测模型,采用SPA对黄桃近红外光谱数据进行特征变量选取,其中从全波长301个光谱中筛选出10个变量,建立了SSC SPA-PLS模型,从全波长301个光谱中筛选出7个变量,建立了SSC SPA-PLS模型。其rp和RMSEP分别为0.916、0.721%。对于硬度模型,采用SPA算法建立预测模型更稳健一些,从600~900 nm 301个光谱中筛选出8个变量,建立了硬度SPA-PLS模型,其rp和RMSEP分别为0.811、0.742 N。
表4 建模效果比较
Table 4 Comparison of model effectiveness
指标方法特征波长个数主因子数预处理方法校正集预测集RMSECrcRMSEPrpSSCGA-PLS146SG-DER0.723%0.9180.752%0.885SPA-PLS107SG-DER0.702%0.9230.721%0.916硬度GA-PLS128SGS0.771N0.8220.785N0.761SPA-PLS87SGS0.735N0.8430.742N0.811
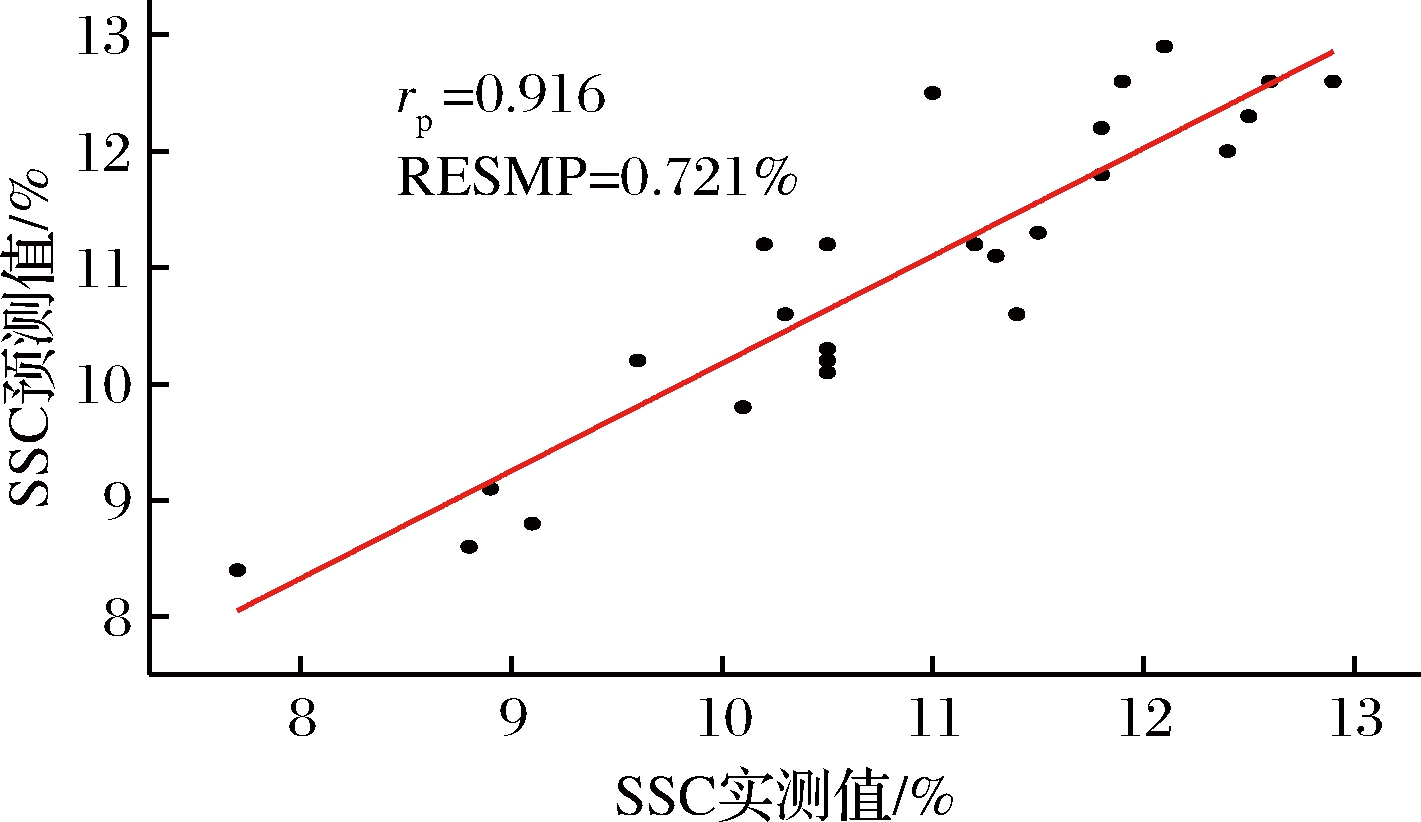
图6 SPA-PLS SSC的预测值和实际值散点图
Fig.6 Plots of actual versus predicted yellow peach SSC values obtained with SPA-PLS
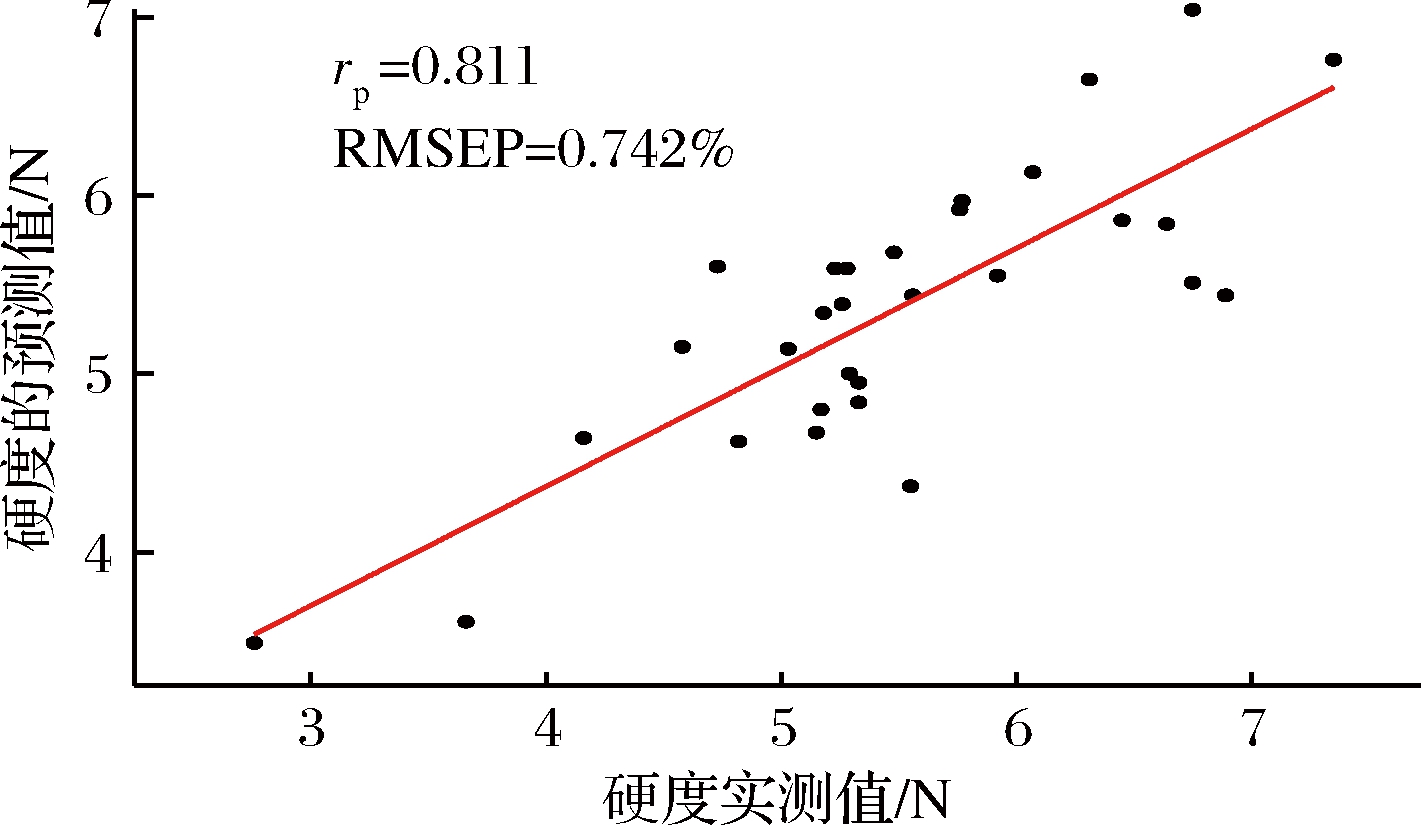
图7 SPA-PLS 硬度的预测值和实际值散点图
Fig.7 Plots of actual versus predicted yellow peach firmness values obtained with SPA-PLS
3 结论
本实验基于近红外光谱漫透射技术,在移动速度为5个/s下,对黄桃硬度和SSC进行了分析,采用多种预处理方法,对全波长区间和3个独立波长区间及混合波段区间进行建模,发现600~750 nm和750~900 nm建立模型最好,其中采用SG-DER预处理方法效果建立SSC预测模型最好,其校正集和验证集相关系数分别为0.919和0.863,均方根误差分别为0.735%和0.764%;采用SGS处理光谱,建立硬度模型性能最好,其校正集和验证集相关系数分别为0.832和0.746,方根误差分别为0.774 N和0.785 N。后采用GA和SPA算法进行特征向量提取,发现两种算法都可有效减少建模波长数量,从建模效果来说,SPA-PLS建立黄桃的SSC和硬度模型最好,其rp和RMSEP分别为0.916、0.721%和0.811、0.742 N。试验结果表明,近红外漫反射光谱在线检测黄桃的SSC和硬度是可行,但预测精度有待一步提高。
[1] ZHANG F, DONG P, FENG L, et al. Textural changes of yellow peach in pouches processed by high hydrostatic pressure and thermal processing during storage[J]. Food & Bioprocess Technology, 2012, 5(8):3 170-3 180.
[2] ZHANG F, ZHAO J, CHEN F, et al. Effects of high hydrostatic pressure processing on quality of yellow peaches in pouch[J]. Transactions of the Chinese Society of Agricultural Engineering, 2011, 27(6):337-343.
[3] 吴剑, 褚伟雄, 王晖. 热处理-冷藏对锦绣黄桃生理生化的影响及感官评价[J]. 食品科技, 2015(10):314-319.
[4] 余意,张鑫,张丽平,等.采收成熟度和贮藏温度对锦绣黄桃完熟品质的影响[J].食品工业科技,2015,36(4):334-338.
[5] SUN X, LIU Y , LI Y , et al. Simultaneous measurement of brown core and soluble solids content in pear by on-line visible and near infrared spectroscopy[J]. Postharvest Biology & Technology, 2016, 116(7):80-87.
[6] ZUDE M, HEROLD B, ROGER J M, et al. Non-destructive tests on the prediction of apple fruit flesh firmness and soluble solids content on tree and in shelf life[J]. Journal of Food Engineering, 2006, 77(2):254-260.
[7] HOBSON G E. The firmness of tomato fruit in relation to polygalacturonase activity[J]. Journal of Pomology & Horticultural Science, 2015, 40(1):66-72.
[8] GUO W C, DONG J L. Nondestructive detection on firmness of peaches based on hyperspectral imaging and artificial neural networks[J]. Optics & Precision Engineering, 2015, 23(6):1 530-1 537.
[9] KAR S, TUDU B, JANA A, et al. FT-NIR spectroscopy coupled with multivariate analysis for detection of starch adulteration in turmeric powder[J]. Food Additives & Contaminants Part A, 2019,36(6):863-875.
[10] BLANCO M, VILLARROYA I. NIR spectroscopy: A rapid-response analytical tool[J]. Trac Trends in Analytical Chemistry, 2002, 21(4):240-250.
[11] JIE D , XIE L , RAO X , et al. Using visible and near infrared diffuse transmittance technique to predict soluble solids content of watermelon in an on-line detection system[J]. Postharvest Biology & Technology, 2014, 90(4):1-6.
[12] 李跑,申汝佳,李尚科,等.一种基于近红外光谱与化学计量学的绿茶快速无损鉴别方法[J].光谱学与光谱分析,2019,39(8):2 584-2 589.
[13] 马文强,张漫,李源,等.核桃仁脂肪含量的近红外光谱无损检测[J].农业机械学报,2019,50(S1):374-379.
[14] 邹小波,张俊俊,黄晓玮,等.基于音频和近红外光谱融合技术的西瓜成熟度判别[J].农业工程学报,2019,35(9):301-307.
[15] 王铭海,郭文川,商亮,等.基于近红外漫反射光谱的多品种桃可溶性固形物的无损检测[J].西北农林科技大学学报(自然科学版),2014,42(2):142-148.
[16] BETEMPS D L, FACHINELLO J C, GALARÇA S P, et al. Spectroscopy of the visible and near infrared to evaluate soluble solids and flesh firmness in peach according to harvest season[J]. Semina Ciências Agrárias, 2014, 35(3):1 257-1 266.
[17] NASCIMENTO P A M, CARVALHO L C D, ![]() L C C, et al. Robust PLS models for soluble solids content and firmness determination in low chilling peach using near-infrared spectroscopy (NIR)[J]. Postharvest Biology & Technology, 2016, 111:345-351.
L C C, et al. Robust PLS models for soluble solids content and firmness determination in low chilling peach using near-infrared spectroscopy (NIR)[J]. Postharvest Biology & Technology, 2016, 111:345-351.
![]() M C U, SALDANHA T C B, GALV
M C U, SALDANHA T C B, GALV O R K H, et al. The successive projections algorithm for variable selection in spectroscopic multicomponent analysis[J]. Chemometrics & Intelligent Laboratory Systems, 2001, 57(2):65-73.
O R K H, et al. The successive projections algorithm for variable selection in spectroscopic multicomponent analysis[J]. Chemometrics & Intelligent Laboratory Systems, 2001, 57(2):65-73.
[19] ARSLAN M, ZOU X, TAHIR H E, et al. Near-infrared spectroscopy coupled chemometric algorithms for prediction of antioxidant activity of black goji berries (Lycium ruthenicum Murr.)[J]. Journal of Food Measurement & Characterization, 2018, 12(4):1-11.
[20] 郭志明, 黄文倩, 陈全胜,等. 近红外光谱的苹果内部品质在线检测模型优化[J]. 现代食品科技, 2016(9):147-153.
[21] 田潇瑜, 黄星奕, 白竣文, 等. 基于近红外光谱技术的紫薯贮藏期间花青素含量检测[J]. 农业机械学报, 2019, 50(2):357-362.