马铃薯是当今世界第四大粮食作物,在贮藏中,受光照、温度等因素的影响,马铃薯易变绿或发芽,在这一过程中产生了以茄啶为糖苷配基构成的一类生物碱[1],俗称为龙葵素,其成分为α-茄碱、β-茄碱、γ-茄碱、α-卡茄碱、β-卡茄碱、γ-卡茄碱,其中α-茄碱和α-卡茄碱的含量占总的糖苷生物碱的95%。龙葵素有较强的毒性[2-15],当一次摄入量超过200 mg时就会引起急性中毒,摄入量更高时就会导致舌头发麻、腹泻、呕吐、发热、头痛、血压下降,甚至耳鸣、昏迷、抽搐、瞳孔放大,呼吸中枢麻痹而死亡。长期食用龙葵素含量较高的马铃薯还会致畸和脊柱裂。科学、准确地分析马铃薯中的α-茄碱、α-卡茄碱的含量关联着每一个人的身体健康。
目前已报道的马铃薯中主要糖苷生物碱α-茄碱、α-卡茄碱的分析监测方法有比色法[16]、液相色谱法[17-28]、液相色谱-质谱联用法[29-35],后2种方法研究得比较多。邵慧凯等[17]用异丁醇萃取马铃薯中的α-茄碱,在210 nm波长处检测。赵丹青等[18]用乙醇-乙酸溶液提取茄碱后过SPE NH2小柱,用甲醇-二氯甲烷洗脱,液相色谱检测。张舵[23]用无水乙醇-乙酸溶液提取后液相色谱检测。王建凤等[29]用V(1%甲酸)∶V(乙醇)=1∶1提取,采用液相-质谱法检测。刘红河等[30]用V(甲酸)∶V(乙醇)=1∶1作为溶剂提取,并且用MCX固相萃取柱萃取后用高液相色谱串联质谱法检测马铃薯及制品中α-茄碱。戴超等[32] 用V(乙酸)∶V(乙醇)=1∶10混合溶剂振荡提取后运用液质联法分析贮藏对马铃薯中α-茄碱含量的影响。张春娇等[33]采用10%乙酸提取后并且经C18 SPE小柱净化后用液-质法检测。现有的液相色谱法和液相-质谱联用法普遍存在的问题是前处理提取繁琐、提取效果不理想,分析的色谱和质谱条件没有达到最佳。
本研究创新了前处理方法,样品用酸化甲醇提取后,用无水硫酸钠和无水乙酸镁吸收水分后离心,以期改善提取效果优化液相和质谱条件,对马铃薯中主要糖苷生物碱α-茄碱和α-卡茄碱进行高效快捷的分析和监测。
1 材料与方法
1.1 材料与试剂
马铃薯,市购。
甲醇、乙腈(均为色谱纯),默克股份两合公司;甲酸(色谱纯),天津市科密欧化学试剂有限公司;无水硫酸钠、无水乙酸镁、无水硫酸镁、无水乙酸钠、乙酸、乙醇、异丁醇(分析纯),天津市科密欧化学试剂有限公司;KH2PO4、甲酸铵、乙酸铵(均为色谱纯),天津市科密欧化学试剂有限公司;α-茄碱(C45H73NO15,CAS号:20562-02-1,纯度≥99.9%),多伦多研究化学公司;α-卡茄碱(C45H73NO14,CAS号:20562-03-2,纯度≥99.9%),ChromaDex公司。
1.2 仪器与设备
Agilent 1290高效液相色谱仪、Agilent 6460电喷雾-串联四极杆质谱仪,美国Agilent公司;艾柯Advanced-Ⅱ-12型高纯水机,成都唐氏康宁科技发展有限公司;宁波新芝SB25-12DTD型超声波清洗机,宁波新芝生物科技有限公司;长沙英泰TG16型离心机,长沙英泰仪器有限公司;IKA MS3型涡旋混合器,IKA公司;赛多利斯SQP型电子天平,赛多利斯科学仪器(北京)有限公司;梅特勒PL602E/02便携式天平,梅特勒-托利多仪器(上海)有限公司。
1.3 试验方法
1.3.1 液相色谱条件
Agilent Eclipse Plus C18色谱柱(100 mm×2.1 mm,1.8 μm);流动相A为1 mmol/L酸化甲酸铵溶液,流动相B为乙腈。梯度洗脱0.0~4.0 min,90%A; 4.0~5.0 min,10%A; 5.0~7.0 min,90%A。流速为0.4 mL/min;柱温为40 ℃,进样量为5 μL。
1.3.2 质谱条件
电喷雾电离正离子模式,电喷雾电压4 000 V,离子源温度350 ℃,雾化器压力20 psi。
1.3.3 标准曲线溶液的配制
分别称取10 mg α-茄碱和α-卡茄碱于10 mL容量瓶中,用甲醇溶解并定容,配制成1 mg/mL的标准储备液;用甲醇逐级稀释成1、2、5、10、20、50、100 ng/mL的混合标准系列溶液。
1.3.4 样品预处理
用均质器将样品充分打碎混匀,放入分装容器中,密封并标记,于-20 ℃以下冷冻存放。
称取试样1.0 g(精确至0.001 g)于50 mL具塞离心管中,加入3.0 mL水涡旋混匀1 min,再准确加入25.0 mL酸化甲醇(1%甲酸+99%甲醇),涡旋1 min。之后,向离心管中加入2.0 g 无水硫酸钠,1.0 g 无水乙酸镁。手动剧烈摇动1 min后涡旋1 min。再将离心管置于离心机中,在室温条件下以10 000 r/min的速度,离心5 min。取50 μL上清液于10 mL容量瓶中,加入甲醇水溶液(40%甲醇)定容至刻度,过微孔滤膜(0.22 μm,尼龙)后上机测定。
1.3.5 定性、定量方法
以α-茄碱和α-卡茄碱保留时间定性,以外标法对α-茄碱和α-卡茄碱进行定量分析。
2 结果与分析
2.1 提取方式的选择
马铃薯中α-茄碱、α-卡茄碱的文献报道提取方法主要有乙酸水溶液法、乙醇法、乙醇-乙酸混合剂法、异丁醇萃取法、乙酸-乙腈、乙醇-乙腈等,通过实验验证均能不同程度的提取,可是提取效果均不理想,达不到完全提取。本研究先加入少量水溶后再用酸化甲醇提取,加入无水硫酸钠、无水乙酸镁吸收多余的水,最后在高速离心机上离心。通过对不同方法的试验对比得出酸化甲醇能够最大限度的提取茄碱,无水硫酸钠、无水乙酸镁有很强的吸水性。在酸性、含水量少的环境中α-茄碱、α-卡茄碱易溶于甲醇,酸化甲醇、无水硫酸镁、无水乙酸钠同时作用为α-茄碱、α-卡茄碱的提取创造了最佳的环境。对一样品均质后等量称取7份分别用本方法及文献报道效果较好的方法处理提取后分析,测定2次的平均含量情况,如图1所示。由图1可以看出本法的前处理方法比文献报道的前处理方法提取效果更好。
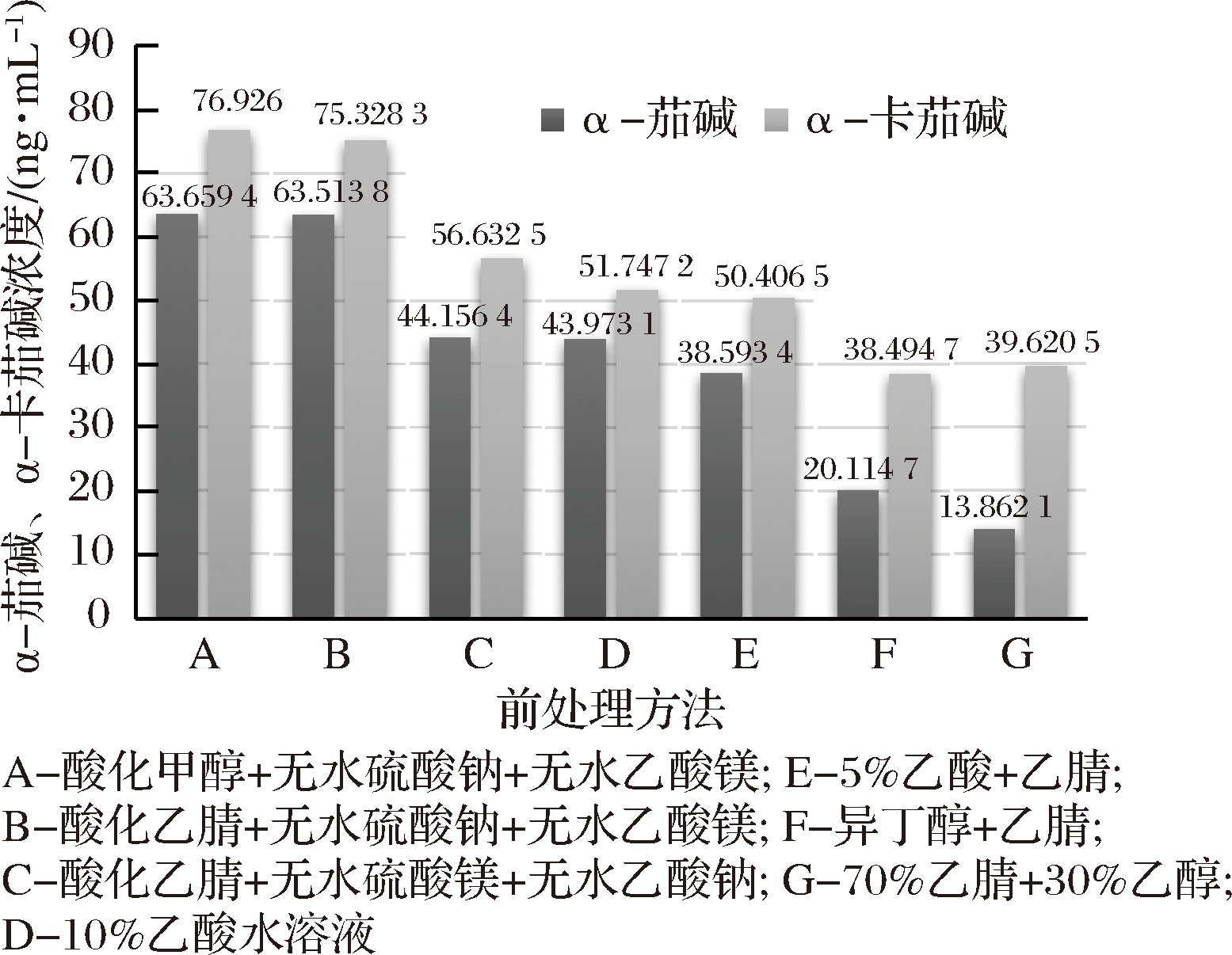
图1 不同前处理试剂的提取效果图
Fig.1 Extraction effect of different pretreatment reagents
2.2 仪器条件的选择
2.2.1 质谱条件的选择
在正离子模式下,对α-茄碱、α-卡茄碱进行母离子和子离子扫描,优化的质谱参数见表1。
表1 α-茄碱和α-卡茄碱的质谱参数
Table 1 Mass spectral parameters of α-solanine and α-chaconine
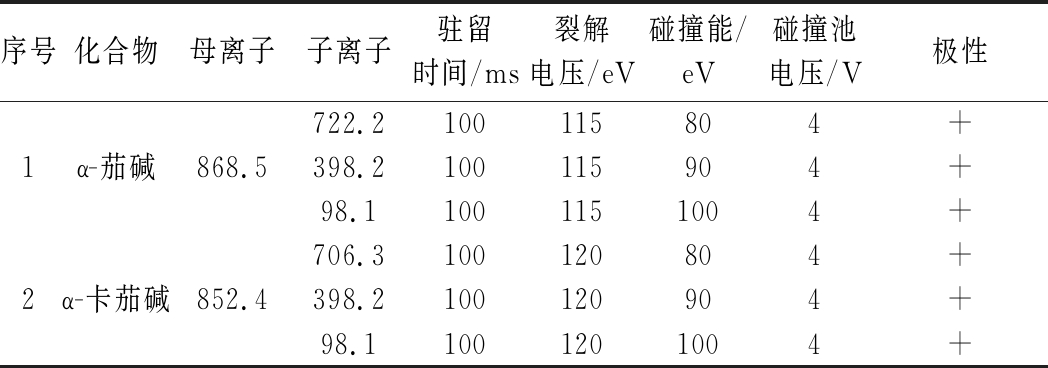
序号化合物母离子子离子驻留时间/ms裂解电压/eV碰撞能/eV碰撞池电压/V极性722.2100115804+1α-茄碱868.5398.2100115904+98.11001151004+706.3100120804+2α-卡茄碱852.4398.2100120904+98.11001201004+
2.2.2 色谱柱的选择
对Agilent Eclipse Plus C18色谱柱(100 mm×2.1 mm,1.8 μm)与OmniBond HPLC Hubble C18(100 mm×2.1 mm,1.8 μm)、BEH C18 (50 mm×2.1 mm,1.8 μm)、Allure PFP Propyl C18 (100 mm×2.1 mm,5 μm)4种色谱柱进行了对比,α-茄碱和α-卡茄碱在Agilent Eclipse Plus C18色谱柱上分离效果最好,柱效高,选择性高,pH稳定性好,峰型对称尖锐。
2.2.3 流动相体系的选择
分别考察了检测α-茄碱和α-卡茄碱的流动相体系乙腈-水、甲醇-水、1 mmol/L乙酸-乙酸铵溶液+甲醇、1 mmol/L甲酸-甲酸铵溶液+甲醇、1 mmol/L乙酸-乙酸铵溶液+乙腈、1 mmol/L甲酸-甲酸铵溶液+乙腈等流动相体系的对α-茄碱和α-卡茄碱的分离效果,发现当流动相体系为1 mmol/L甲酸-甲酸铵溶液+乙腈时分离效果最佳。
2.2.4 流动相淋洗方式的选择
对流动相采用等度淋洗和梯度淋洗时的效果进行了对比,发现梯度淋洗的效果更好一些,设置不同梯度洗脱程序进行效果验证,当梯度洗脱程序为0.0~4.0 min,90%A; 4.0~5.0 min,10%A; 5.0~7.0 min,90%A时,洗脱效果最优。
2.2.5 流动相流速的选择
分别对流速为0.10、0.20、0.30、0.35、0.40、0.45、0.50、0.60 mL/min时的分离效果进行了比对。结果表明,随着流速的增大,保留时间缩短,α-茄碱和α-卡茄碱的保留时间越接近。综合保留时间、响应值、分离度等因素,流动相流速为0.4 mL/min时适宜。在此优化的质谱和液相条件下,α-茄碱和α-卡茄碱的标准谱图见图2和图3,样品中α-茄碱和α-卡茄碱的谱图见图4和图5。
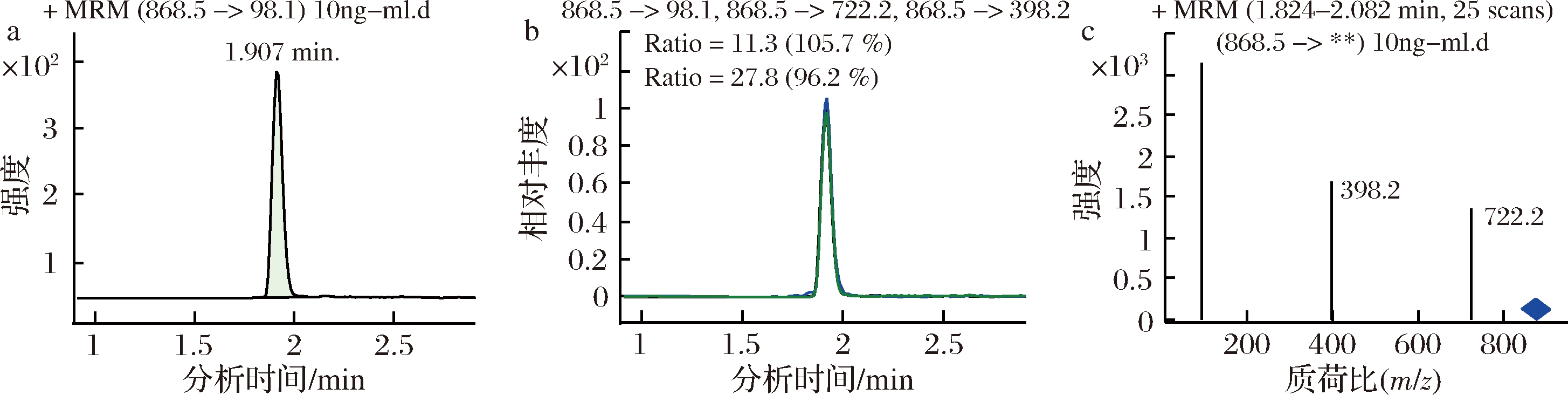
图2 10.0 ng/mL α-茄碱标准溶液的MRM色谱图
Fig.2 MRM chromatogram of 10.0 ng/mL α-solanine standard solution
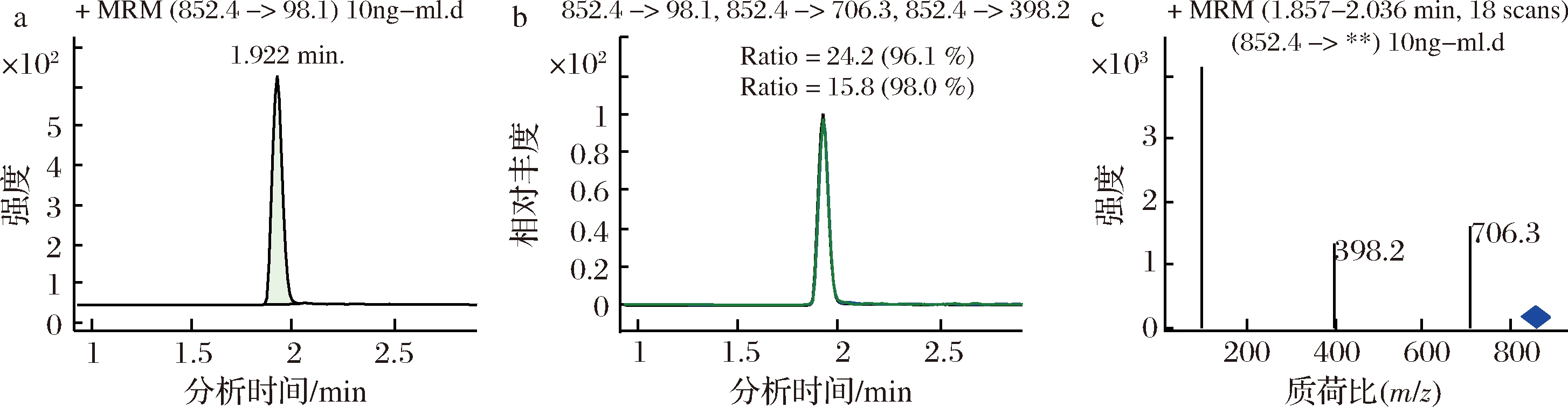
图3 10.0 ng/mLα-卡茄碱标准溶液的MRM色谱图
Fig.3 MRM chromatogram of 10.0 ng/mL α-chaconine standard solution

图4 样品中α-茄碱的MRM色谱图
Fig.4 MRM chromatogram of α-solanine in sample
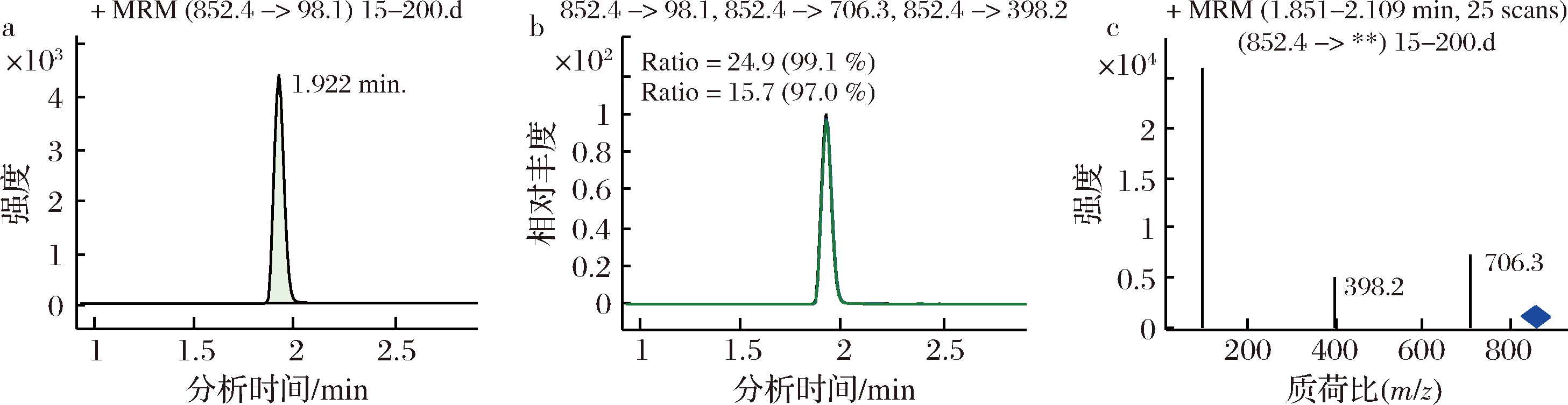
图5 样品中α-卡茄碱的MRM色谱图
Fig.5 MRM chromatogram of α-chaconine in sample
2.3 标准曲线与检出限
分别以质量浓度(X, ng/mL)为横坐标、响应值(Y)为纵坐标绘制标准曲线,α-茄碱和α-卡茄碱的线性方程及其相关系数见表2,可以看出在浓度为1.0~100 ng/mL时,2种茄碱的线性关系良好,相关系数(R2)为0.999 3~0.999 5,满足定量分析的要求。
表2 α-茄碱和α-卡茄碱的线性方程、相关系数(R2)、及其方法检出限
Table 2 Linear equation, correlation coefficient (R2) and detection limit of α-solanine and α-chaconine

化合物保留时间线性方程相关系数(R2)检出限/(mg·kg-1)α-茄碱1.907y=124.195 025x+19.341 0970.999 30.3α-卡茄碱1.922y=199.008 902x+45.042 5410.999 50.3
以不含茄碱的新鲜马铃薯肉作为空白基质,在其中加入低浓度α-茄碱和α-卡茄碱,按照本研究的上述方法进行前处理和分析检测,以3倍、10倍信噪比计算得到本方法中α-茄碱和α-卡茄碱的检出限均为0.3 mg/kg,定量限均为1.0 mg/kg。比对文献报道的同类分析检测的情况,本方法的灵敏度较高。
2.4 回收率和精密度
选用已分析α-茄碱和α-卡茄碱含量的马铃薯芽,分别添加10.0、50.0、100.0 ng/mL低、中、高3个浓度水平的α-茄碱和α-卡茄碱混合标准溶液,配成加标样品,按照上述方法进行前处理,每个加标水平的样品平行分析6次,结果加标回收率为98.9%~101.6%,相对标准偏差为0.18%~1.41%,具体数据见表3,说明本方法有较高的准确度和精密度,完全适合马铃薯中α-茄碱和α-卡茄碱的分析监测。
表3 α-茄碱和α-卡茄碱的回收率和精密度
Table 3 Recoeries and RSDs of α-solanine and α-chaconine
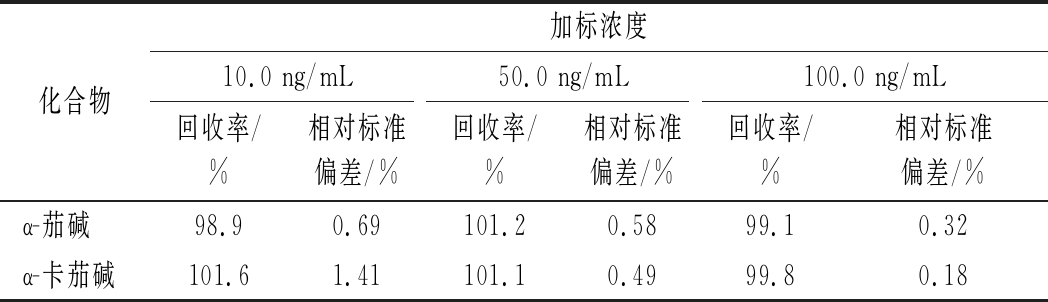
化合物加标浓度10.0 ng/mL50.0 ng/mL100.0 ng/mL回收率/%相对标准偏差/%回收率/%相对标准偏差/%回收率/%相对标准偏差/%α-茄碱98.90.69101.20.5899.10.32α-卡茄碱101.61.41101.10.4999.80.18
2.5 马铃薯样品分析
用本方法对任意选取的马铃薯绿芽、绿皮、芽下肉、肉4种样品中α-茄碱和α-卡茄碱总含量进行分析检测,结果马铃薯绿芽中的总含量为8 516 mg/kg, 马铃薯绿皮中的总含量为5 055 mg/kg, 马铃薯芽下肉中的总含量为830 mg/kg, 马铃薯肉中的总含量为166 mg/kg,从检测结果可看出,马铃薯芽中的α-茄碱和α-卡茄碱含量是非常高的,从马铃薯绿芽、绿皮、芽下肉、肉依次降低。
2.6 与补充方法的对比
分别用本方法和补充方法土豆及其制品中α-茄碱和α-卡茄碱含量测定(BJS201806)对马铃薯的白芽、绿芽、绿芽加标进行前处理提取及分析,分析结果见表4,可以看出2种方法的检测结果相对偏差在3.2%~11.2%,采用本方法提取及分析的含量明显比补充方法提取及分析的含量高,同时在马铃薯绿芽添加10 ng/mL浓度水平的α-茄碱和α-卡茄碱标准混合溶液后分析,通过分析结果得出本方法的加标回收率为98.4%~102.8%,BJS201806补充方法的加标回收率为81.6%~90.9%,进一步证明了本方法不论是前处理提取还是分析条件都比补充方法更优。
表4 本方法与补充方法检测结果的对比
Table 4 Comparison between the results of this method and the supplementary method
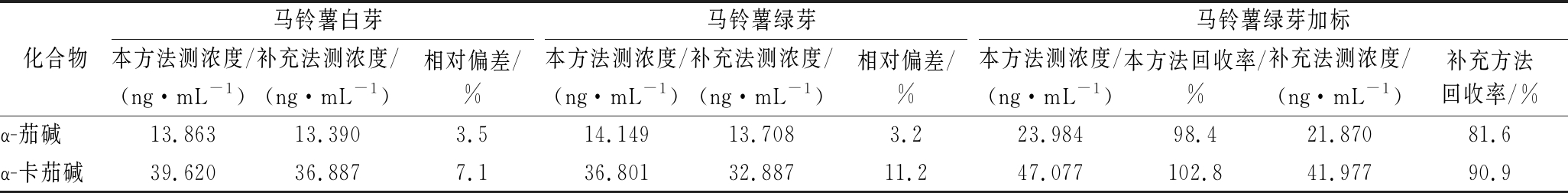
化合物马铃薯白芽马铃薯绿芽马铃薯绿芽加标本方法测浓度/(ng·mL-1)补充法测浓度/(ng·mL-1)相对偏差/%本方法测浓度/(ng·mL-1)补充法测浓度/(ng·mL-1)相对偏差/%本方法测浓度/(ng·mL-1)本方法回收率/%补充法测浓度/(ng·mL-1)补充方法回收率/%α-茄碱13.86313.3903.514.14913.7083.223.98498.421.87081.6α-卡茄碱39.62036.8877.136.80132.88711.247.077102.841.97790.9
3 结论
建立了液相色谱-串联质谱分析监测马铃薯中主要糖苷生物碱α-茄碱和α-卡茄碱的方法。利用酸化甲醇提取,用无水硫酸钠和无水乙酸镁吸收多余的水分后,在电喷雾正离子模式下,采用四级杆质谱仪进行分析检测。与文献报道的方法相比,本法操作简单、重现性好、准确度高,完全满足马铃薯及其制品中α-茄碱和α-卡茄碱的分析监测,对于食用农产品的安全监管提供了强有力的技术支撑,对保障公众食品安全具有重要的社会意义。
[1] MENDEL FRIEDMAN,CAROL E LEVIN. a-Tomatine content in tomato and tomato products determined by hplc with pulsed amperomet-ric detection[J]. J Agric Food Chem, 1995, 43(6):1 507-1 511.
[2] 徐敏慧,刘珂伟,张晓慧,等.马铃薯中龙葵素的研究进展[J].保鲜与加工, 2017, 17(1):112-116.
[3] FRIEDMAN M. Analysis of biologically active compounds in pota-toes (Solanum tuberosum), tomatoes(Lycopersicon esculen-tum), and jimson weed (Datura stramonium) seeds[J]. J. Chro-matogr A, 2004, 1 054(1-2):143-155.
[4] MENDEL FRIEDMAN. Tomato glycoalkaloids: role in the plant and in the diet[J]. J Agric Food Chem, 2002, 50(21): 5 751-5 780.
[5] FRIEDMAN M, MCDONALD G. Potato glycoalkaloids: Chemistry, analysis, safety and plant physiology[J]. Crit Rev Plant Sci, 1997, 16(1):55-132.
[6] CATCHPOLE G S, BECKMANN M, ENOT D P, et al. Hierarchical metabolomics demonstrates substantial compositional similarity between genetically modified and conventional potato crops[J]. Proc Natl Acad Sci USA, 2005, 102(40):14 458-14 462.
[7] FRIEDMAN D, DAO L. Distribution of glycoalkaloids in potato plants and commercial potato products [J]. Journal of Agricultural and Food Chemistry, 2002, 40(3):419-423.
[8] FRIEDMAN M, LEVIN C E. a- tomatine content in tomato and tomato products determined by HPLC with pulsed amperometric detection [J]. Journal of Agricultural and Food Chemistry, 1995, 43 (6):1 507-1 511.
[9] GRUNENFELDER L A,KNOWLES L 0, HILLER L K, et al. Glycoalkaloid development during greening of fresh market potatoes (Solanum tuberosum L) [J]. Journal of Agricultural and Food Chemistry, 2006, 54(16):5 847-5 854.
[10] ROMANUCCI V, PISANTI A, FABIO G D, et al.Toxin levels in different variety of potatoes: Alarming contents of α- chaconine [J].Phytochemistry Letters, 2016, 16:103-107.
[11] 吴延.马铃薯主粮化的关键与种植技术[J].农村新技术, 2015(4):4-6.
[12] 平华,马智宏,李杨,等.不同发芽天数及芽周不同深度马铃薯中a-茄碱含量变化规律[J].食品科技, 2017,42(1):55-59.
[13] 李志文,王娜,刘翔,等.马铃薯中a-茄碱提取工艺优化[J]. 食品与机械,2 (8):167-172.
[14] 赵建宗,申建平.我国马铃薯种薯质量监督控制体系现状、问题与建议[J].种子, 2017,36(12):92-94.
[15] 马全胜.马铃薯中毒的防治措施[J].中兽医学杂志, 2017(5):32.
[16] 王运雷,张辉.马铃薯皮、马铃薯渣、块茎中α-茄碱含量的测定[J].畜牧与饲料科学, 2018,39(5):19-21.
[17] 邵慧凯,丘汾,何佳平,等.异丁醇萃取-高效液相色谱法测定马铃薯中α-卡茄碱[J]. 中国食品卫生杂志, 2015,27(5): 517-520.
[18] 赵丹青,张锋锋,吴燕,等.宁夏不同地区不同品种马铃薯中龙葵素在不同生长期的积累含量测定[J].中国野生植物资源, 2017,36(6):29-31.
[19] 商婷婷,邝梦婷,胡新喜,等. HPLC-ELSD法同时测定马铃薯中α-茄碱和α-卡茄碱含量[J].食品与机械, 2015,31(4):55-58.
[20] 罗爱花,徐美蓉,陆立银,等.利用HPLC法测定不同马铃薯品种茎叶中的α-茄碱含量[J].中国马铃薯, 2014,28(6):331-334.
[21] 王守兰,朱佳.高效液相色谱法测定马铃薯中α-茄碱的含量[J].食品科学,1996,17(6):60-61.
[22] 肖文军,李勤,熊兴耀,等.高效液相色普法分析马铃薯中α-茄碱[J].分析化学, 2011, 39(9):1 459-1 460.
[23] 张舵.反相高效液相色潽法检测马铃薯中龙葵素含量[J].齐齐哈尔大学学报, 2013,29(5):24-25.
[24] 曾凡逵,周添红,康宪学,等. HPLC法测定马铃薯块茎中糖苷生物碱的含量[J].中国马铃薯, 2015, 29(5):263-268.
[25] FANG L, WAN M, PENNACCHIO M, et al. Evaluation of evaporative light- scattering detector for combinatorial library quantitation by reversed phase HPLC[J]. J.Comb Chem, 2000, 2(3):254-257.
[26] ROBERT J HOUBEN, KOMMER BRUNT. Determination of glycoalkα-loids in potato tubers by reversed high-performance liquid chromatography[J]. Journal of Chromatography A, 1994, 661(1-2):169-174.
[27] LAN DAO, MENDEL FRIEDMAN. Comparison of glycoalkaloid content of fresh and freeze-dried potato leaves determined by HPLC and colormetry[J]. Agric Food Chem, 1996, 8:2 287-2 291.
[28] SOTELO A, SERRANO B. High-performance liquid chromatographic determination of the glycoalkaloids alphα-solanine and α-chaconine in 12 commercial varieties of Mexican potato [J]. J Ag ric Food Chem, 2000, 48(6):2 472-2 475.
[29] 王建凤,范筱京,贾丽,等.超高液相色谱串联质谱法检测土豆及土豆制品中α-茄碱[J].食品安全质量检测学报, 2017, 8(7): 2 756-2 761.
[30] 刘红河,康莉,廖仕成,等.超高效液相色谱-质谱法测定食物中毒样品中α-茄碱和α-卡茄碱[J].华南预防医学, 2016, 42(5): 435-442.
[31] 伍慧敏,曾静,李美,等.液相色谱-质谱联用法检测马铃薯中α-茄碱含量[J].食品科学, 2013, 34(24):121-124.
[32] 戴超,郑鹭飞,刘佳萌,等. 液质联用法分析贮藏因素对马铃薯中α-茄碱含量的影响[J].核农学报, 2017, 31(11): 2 200-2 205.
[33] 张春娇, 张秀杰, 潘赛超, 等.高效液相色谱串联质谱法检测马铃薯及马铃薯粉中α-茄碱和α-卡茄碱含量[J].食品工业与科技, 2019, 40(21):225-230.
[34] 王丹,丁颢,程莉,等.超高效液相色谱-三重四级杆串联质谱法测定土豆中α-茄碱与α-卡茄碱含量[J].中国食品卫生杂志, 2014, 26(3):233-237.
[35] 张秀尧,蔡欣欣,张晓艺.超高效液相色谱-三重四极杆质谱联用方法测定血浆和尿液中的α-龙葵碱、α-卡茄碱和茄啶[J].色谱, 2014, 32 (6):586-590.