食物过敏可能引起哮喘、荨麻疹、腹泻等症状,严重时甚至会损坏机体组织并威胁生命安全。作为八大过敏原之一,鱼类引起的过敏现象在全球都很普遍[1-4]。目前国内外针对鱼类过敏的研究主要集中在海水鱼方面。但淡水鱼是中国饮食的主要鱼类蛋白来源,且近年来的消费量日益增多[5],也存在着高致敏隐患。石径等[6]研究表明,草鱼、鲤鱼和鳙鱼的肌浆蛋白和过敏患者血清的阳性率分别为16.00%、8.00%和5.33%。
90%的鱼类致敏反应是由小清蛋白(parvalbumin, PV)导致的。小清蛋白主要存在于肌浆蛋白[7-8],是一种分子质量约为11 k~14 kDa的钙结合蛋白。这些钙结合蛋白的区域与结合鱼过敏患者的构象表位有关[9]。而且,不同鱼类的小清蛋白存在着较高的交叉反应性[2]。除了小清蛋白外,其他肌浆蛋白蛋白条带也被发现有致敏作用,包括原肌球蛋白[10]、烯醇化酶、醛缩酶[11]等。刘楚怡等[12]在研究草鱼、乌鳢、鲇鱼和花鲈时发现每种鱼都存在4~6条蛋白条带与IgE结合时呈阳性。张晶宇等[13]发现耐胃蛋白酶酶解牙鲆鱼的大部分蛋白质是过敏原。国际上对于降低海水鱼蛋白致敏性的研究较多,但在淡水鱼方面鲜有报道。本研究是以中国七大家鱼之一的青鱼(Mylopharyngodon piceus)为研究对象,采用不同的pH和离子强度对鱼致敏蛋白进行处理,并比较致敏蛋白的IgG/IgE结合能力。采用圆二色谱,表面疏水性,内源荧光值等方法测定不同条件下致敏蛋白的结构变化,为以后开发鱼类低敏食品提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜青鱼购自无锡欧尚超市(博大店),敲打头部致晕后宰杀,去除头部鳞片及内脏,在冰盒内于30 min内运往实验室;在室温条件下将鱼类清洗、去皮、取背部白色肌肉备用。
过敏患者血清来自南京医科大学附属儿童医院在过敏原检测报告中对鱼类过敏原检测为阳性的儿童患者。所有血清样本在使用前于-55 ℃下保存。
8-苯胺-1-萘磺酸,鼠抗小清蛋白单克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗人IgE抗体,美国Sigma公司; HPR标记的羊抗鼠IgG抗体,美国Proteintech公司;30% 丙烯酰胺/甲叉丙烯酰胺复合液、1 mol/L Tris-HCl(三羟甲基氨基甲烷-盐酸 pH 6.8)、1.5 mol/L Tris-HCl(三羟甲基氨基甲烷-盐酸 pH 8.8)、过硫酸铵、3,3′,5,5′-四甲基联苯胺、SDS电泳缓冲液(三羟甲基氨基甲烷-甘氨酸 Tris-Gly)、10%十二烷基磺酸钠(10% SDS)、2×蛋白上样缓冲液、彩色预染蛋白分子质量标准,碧云天公司;其余试剂若无特殊说明均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
3 K15冷冻离心,Sigma公司;LE438 pH 计,梅特勒-托利多仪器上海有限公司;SMP500-16295-OBVN酶标仪,美国Molecular Devices公司;电泳仪 Bio-RAD;ChemiDoc XRS+ 化学发光凝胶成像系统,美国伯乐公司;T10 basic ULTRA-TURRAX 均质机,艾卡仪器设备有限公司;F-7000 荧光光度计,日本日立公司;UV-1000 紫外分光光度计,上海天美科学仪器有限公司;MOS-450 分光偏振计,法国Biologic公司。
1.3 实验方法
1.3.1 青鱼肌浆蛋白的制备
参考LIU等[14] 的方法且略作调整。5 g搅碎的鱼肉中加入4倍冷的0.02 mol/L Tris-HCl缓冲液 (pH 7.5)。均质后在4 ℃静置30 min。4 ℃下以10 000×g离心20 min,所得上清液即为肌浆蛋白溶液。蛋白浓度使用双缩脲法检测。使用不同pH的磷酸盐缓冲液得到不同pH实验组。使用不同浓度的NaCl溶液得到离子强度实验组。
1.3.2 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)
参考LIN等[15] 的电泳方法对肌浆蛋白组成进行分析。样品与上样缓冲液以体积比1∶1混合后煮沸4 min。分别取10 μL上样于电泳胶中(分离胶12%,浓缩胶5%)。在80 V电压下跑至两胶分界线。改成120 V跑至离底部5 cm高处后停止。考马斯亮蓝R-250染色液染色2 h后,脱色过夜。
1.3.3 间接酶联免疫吸附测定(indirect-enzyme linked immunosorbent assay, 间接 ELISA)
参照MA等[16]的方法且略作调整。使用包被缓冲液(0.05 mol/L碳酸盐缓冲液)稀释样品至一定浓度后,取100 μL/孔的规格于96孔板并于4 ℃下包被过夜。将PBST洗涤液(含有0.1% Tween-20的0.01 mol/L 磷酸盐缓冲液,pH 7.4)以250 μL/孔的规格进行4次清洗。将B-PBST封闭液(含有1%牛血清蛋白的PBST溶液)以100 μL/孔的规格加入96孔板,37 ℃恒温封闭1.5 h。4次清洗后,加入100 μL/孔的鼠抗小清蛋白单克隆抗体(1∶2 000)或鱼过敏患者血清(1∶5)作为一抗37 ℃恒温孵育1.5 h。4次清洗后,加入100 μL/孔的 HRP标记的羊抗鼠IgG(1∶5 000)或HRP 标记的羊抗人IgE(1∶500)作为二抗37 ℃恒温孵育1.5 h。将显色液A(含有0.2 mol/L乙酸钠、0.017 mol/L柠檬酸,0.06% 体积分数为30%的双氧水)和显色液B(1.1 mmol/L EDTA-1Na、0.01 mol/L柠檬酸、10%甘油)进行1∶1混合,以100 μL/孔的规格加入96孔板中,37 ℃恒温孵育20 min;以50 μL/孔的规格加入2 mol/L H2SO4溶液终止反应,迅速在酶标仪上读取450 nm和630 nm处的OD值,实际OD值=OD450 nm-OD630 nm。
1.3.4 免疫印迹分析
参考LYU等[17]的方法并做适当调整。将不同条件下的肌浆蛋白在SDS-PAGE结束后,用电泳仪将蛋白条带转印到PVDF膜上。转印条件为200 mA恒流,20 min。转膜结束后,用5%的脱脂奶粉37 ℃封1 h。使用TBST[含有0.15 mol/L NaCl、2%(体积分数)1 mol/L Tris-HCl,pH 8.0]洗涤3次,每次10 min。以鼠抗小清蛋白单克隆抗体(1∶5 000)作为一抗4 ℃恒温孵育过夜。洗涤后以HRP标记的羊抗鼠IgG(1∶500)作为二抗室温孵育1 h。清洗后使用显色剂显色并于化学发光凝胶成像系统中拍照。
1.3.5 表面疏水性的测定
将蛋白溶液稀释成质量浓度为0.1、0.2、0.3、0.4、0.5 mg/mL,分别取2 mL稀释好的蛋白溶液和10 μL 8 mmol/L的8-苯胺-1-萘磺酸溶液在暗处反应10 min后,在激发波长 375 nm,发射波长485 nm,狭缝宽度均为 10 nm 的条件下,测定OD值。以蛋白浓度作为x轴,OD值作为y轴,曲线斜率即为表面疏水性。
1.3.6 内源荧光值的测定
将所有样品稀释成1 mg/mL。采用荧光光谱仪测定内源荧光值。激发波长为 290 nm,发射波长为300~380 nm,狭缝宽度为10 nm。
1.3.7 紫外二阶图谱的测定
将所有样品稀释成1 mg/mL。采用紫外分光光度计在190~300 nm进行扫描,读取OD值并进行二阶求导。
1.3.8 圆二色谱的测定
将所有样品稀释成0.1 mg/mL。采用圆二色谱法(circular dichroism,CD)分析不同条件下肌浆蛋白的二级结构变化。扫描波长为190~260 nm。扫描速率为50 nm/min,带宽为1 nm,响应时间为2 s。
1.4 数据分析
采用SPSS 19.0软件对实验数据进行单因素方差分析,用Duncan’s检验法进行多重比较,显著水平为P<0.05。
2 结果与分析
2.1 不同pH对青鱼肌浆蛋白的影响
2.1.1 不同pH对青鱼肌浆蛋白IgG/IgE结合能力的影响
许多食品加工过程往往都存在着pH的改变,例如在酸鱼发酵过程中,鱼制品的pH会从6.5降低到4.5[18]。因此,对于pH和肌浆蛋白致敏能力关系的机理研究对于开发低敏鱼制品是至关重要的。采用间接ELISA法检测不同pH条件下的肌浆蛋白与鼠抗小清蛋白单克隆抗体IgG和鱼过敏患者血清特异性IgE结合能力,结果如图1所示。
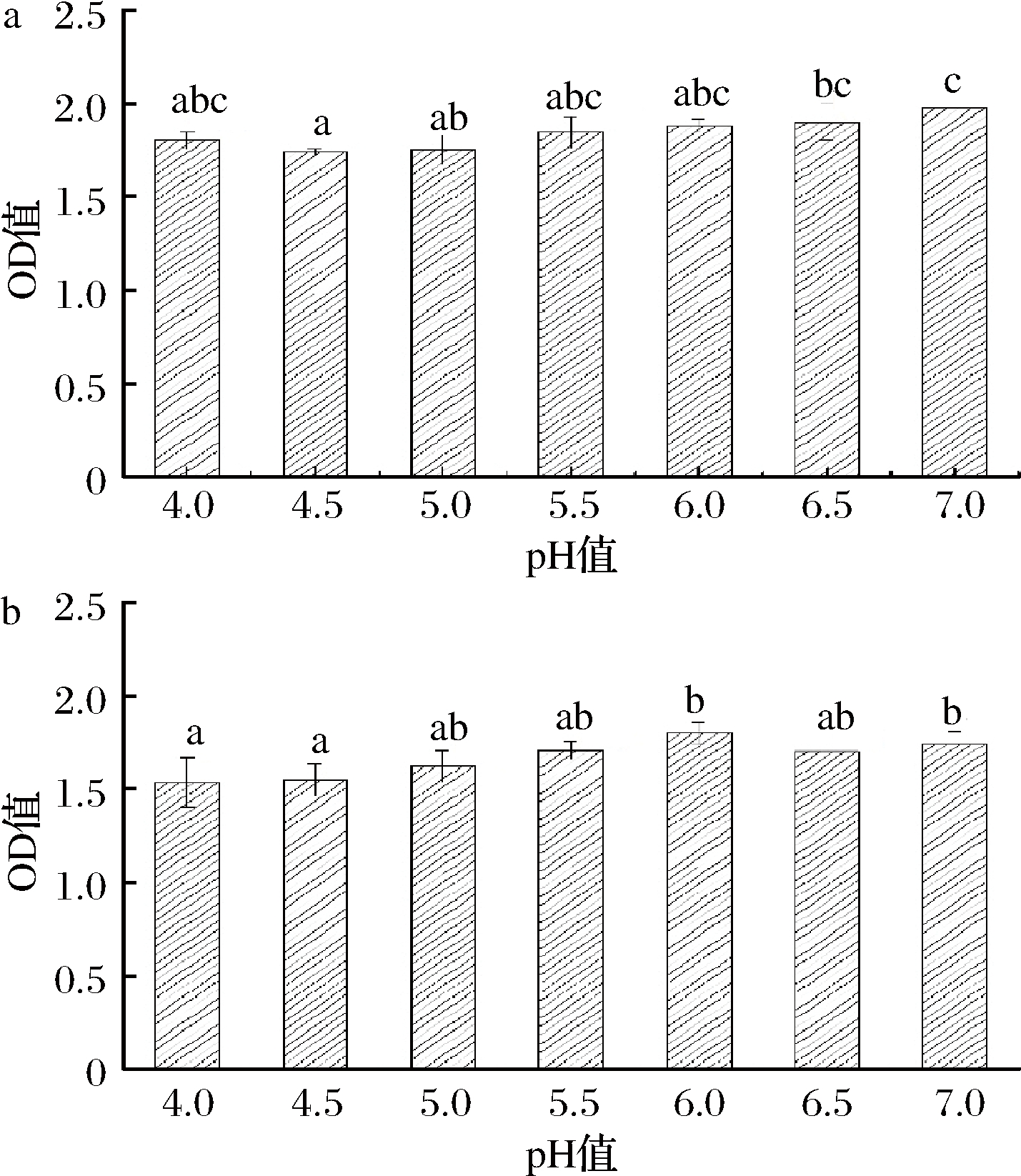
a-IgG-结合能力;b- IgE-结合能力
图1 不同pH处理后的青鱼肌浆蛋白与IgG和IgE的结合能力
Fig.1 Analysis of IgG-binding and IgE-binding of protein from black carp exposed to different pH
注:不同小写字母表示差异显著(下同)
除了主要致敏蛋白小清蛋白外,还存在着其他的致敏蛋白,因而,本文同时分析了肌浆蛋白中的小清蛋白的IgG结合能力和肌浆蛋白的IgE结合能力。总体来看,pH从4.0到7.0,肌浆蛋白和IgG和IgE的结合能力略呈变强的趋势。图1-a中pH<6.5时IgG结合能力变化较小,而在pH达到7.0时呈现较强的结合能力。图1-b显示,在pH为4.0时,IgE的结合能力最低,其吸光值为1.53。在pH为7.0时,IgE的结合能力最高,吸光值为1.74。说明在pH 4.0~7.0,肌浆蛋白的IgG/IgE结合能力随pH的升高而变强。
图2为不同PH处理后的青鱼肌浆蛋白的SDS-PAGE分析和免疫印迹分析,由图2-a可知,在pH 4.0~7.0,肌浆蛋白(包括分子质量为11 kDa左右的小清蛋白)没有发生明显的聚集或沉降,也没有新的蛋白条带产生。LIN等[15]研究发现短颈蛤的致敏蛋白原肌球蛋白在pH 4.0到7.0,IgG和IgE结合能力都比较稳定,仅有小幅度的增长。ZHANG等[19]的研究显示,免疫印迹分析中的煮沸步骤可以展开蛋白使其成为直链,而间接ELISA分析则仍然保持其空间结构。因此,可以通过比较两者的结果来区分肌浆蛋白的致敏能力是由构象表位还是线性表位引起的。不同pH肌浆蛋白的免疫印迹分析如图2-b显示,组间的区别不明显,由此可以推测肌浆蛋白与IgG/IgE结合的作用位点可能为构象表位而非线性表位。
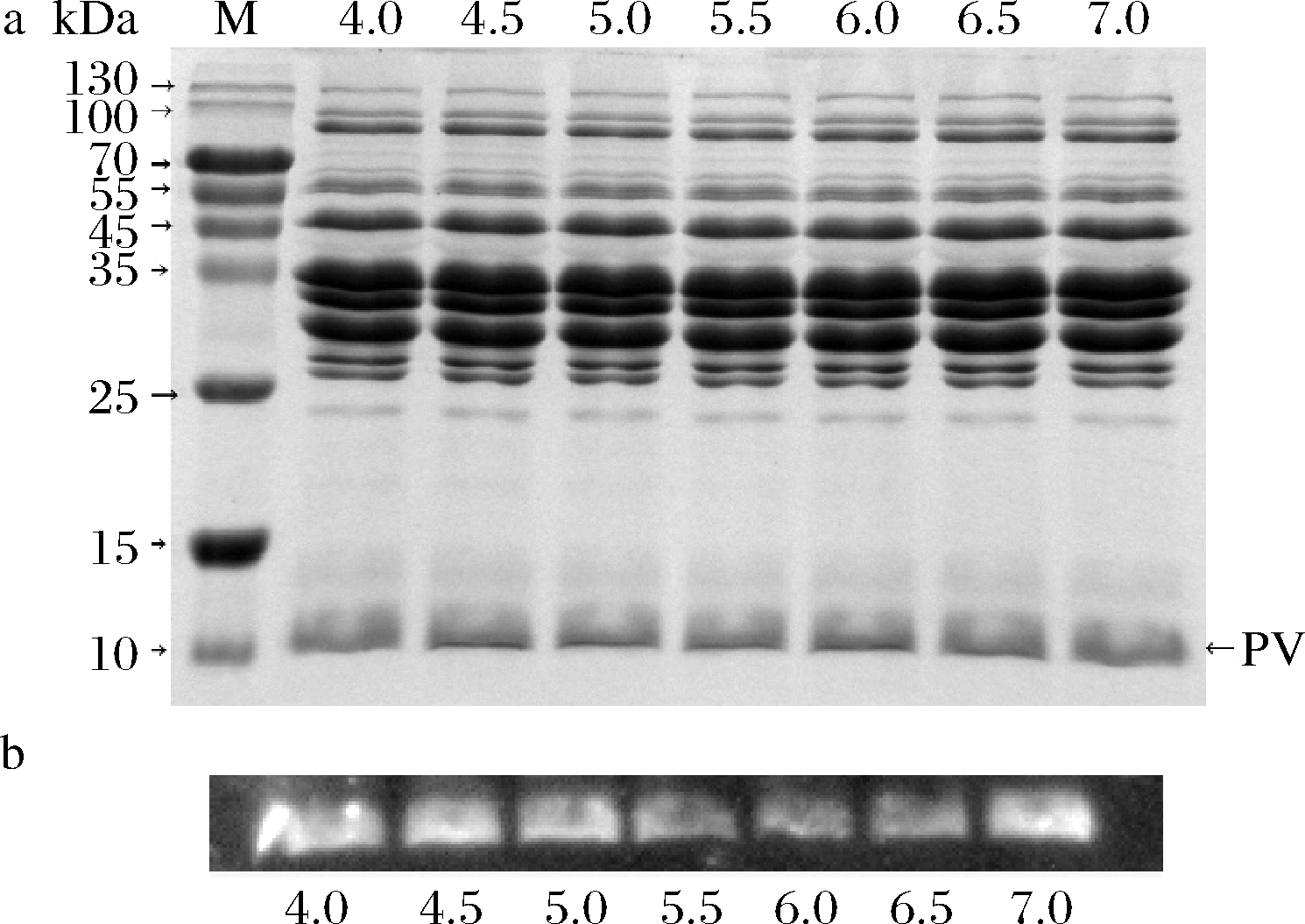
a-SDS-PAGE;b-免疫印迹分析
图2 不同pH处理后的青鱼肌浆蛋白的SDS-PAGE分析和免疫印迹分析
Fig.2 The SDS-PAGE patterns and western blotting profiles of sarcoplasmic protein from black carp exposed to different pH
注:M代表标准蛋白(图5同)
2.1.2 不同pH对青鱼肌浆蛋白结构的影响
不同pH下肌浆蛋白的二级结构改变通过圆二色谱来测定,如图3-a结果显示,pH从4.0增加至7.0时,β-折叠含量变化不显著,而β-螺旋含量逐渐上升,从56.80%增加到67.40%,不规则卷曲含量则逐渐降低,从29.80%到13.40%。肌浆蛋白的表面疏水性随pH的变化如图3-b所示。随着pH的升高,肌浆蛋白表面疏水性显著降低。与pH 4.0相比,pH 4.5到7.0的表面疏水性分别降低了57.65%、74.15%、81.43%、84.93%、91.03%、91.60%。说明在pH升高时,主要发生了蛋白疏水相互作用,造成表面疏水性的下降。肌浆蛋白中的色氨酸、酪氨酸、苯丙氨酸是产生荧光信号的主要基团,且色氨酸因为其灵敏性较高和受干扰较小的特点而常常用于检测蛋白质结构的改变。为得到较强的荧光信号且避免其他氨基酸的干扰,本实验中选用290 nm的激发波长[20]。最大发射波长向长波移动意味着氨基酸残基从天然的疏水腔内向暴露在纯水环境下转变[21-23]。荧光强度的降低表明芳香族残基从蛋白质的疏水腔中逐渐向极性环境暴露[24]。且小清蛋白中色氨酸含量极小,因而可以用来研究除主要致敏蛋白小清蛋白外的其他蛋白的结构变化。由表1也可以看出,pH降低使最大发射波长向长波移动,且内源荧光强度值相应的降低,说明色氨酸残基暴露于极性环境中。这与表面疏水性的升高的结果是一致的。
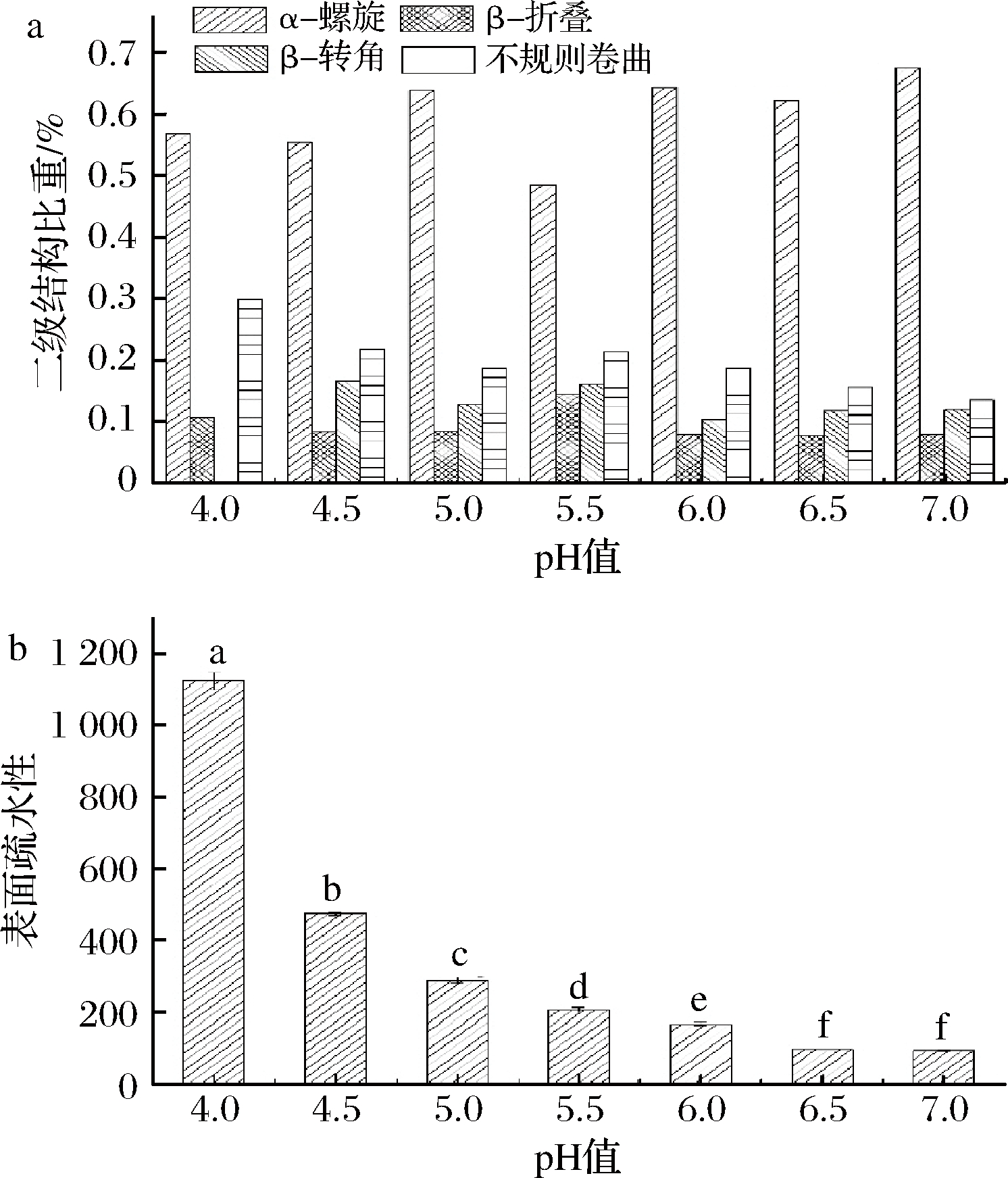
a-二级结构;b-表面疏水性
图3 不同pH对青鱼肌浆蛋白二级结构和表面疏水性的影响
Fig.3 The effect of different pH on the secondary structure and surface hydrophobicity of sarcoplasmic protein from black carp
表1 不同pH对青鱼肌浆蛋白内源荧光强度的影响
Table 1 The effect of different pH on intrinsic fluorescence intensity of sarcoplasmic protein from black carp

pH值最大发射波长/nm内源荧光强度值4.0339.53±0.47a740.27±15.86ab4.5339.53±0.47a740.79±18.37ab5.0340.53±0.53a726.60±2.57ab5.5339.53±0.47a773.33±4.40b6.0337.50±0.47b846.18±2.64c6.5337.30±0.27b859.70±5.50c7.0337.50±0.47b874.74±9.50c
注:表中的数据为平均值±标准误差,每个组别至少做3次平行;同列中上标具有不同字母的数据表示组间差异显著(P<0.05)
2.2 不同离子强度对青鱼肌浆蛋白的影响
2.2.1 不同离子强度对青鱼肌浆蛋白IgG/IgE结合能力的影响
采用间接ELISA法检测不同离子强度条件下的肌浆蛋白与鼠抗小清蛋白单克隆抗体IgG和鱼过敏患者血清特异性IgE结合能力的结果如图4所示。无论是肌浆蛋白与IgG还是IgE的结合,都没有显著性的差异。说明肌浆蛋白和小清蛋白的构象表位结合能力并不会随离子强度的改变而改变。同样地,由图5-a显示,肌浆蛋白的组成和含量也没有改变。由图5-b的免疫印迹显示,离子强度为0.2~1.0时,蛋白条带无明显变化,离子强度为0时则显示出稍强的结合能力,说明该条件下的线性表位结合能力略强。

a-IgG结合能力;b-IgE结合能力
图4 不同离子强度处理后的青鱼肌浆蛋白与IgG和IgE的结合能力
Fig.4 Analysis of IgG-binding and IgE-binding of sarcoplasmic protein from black carp exposed to different ion strength
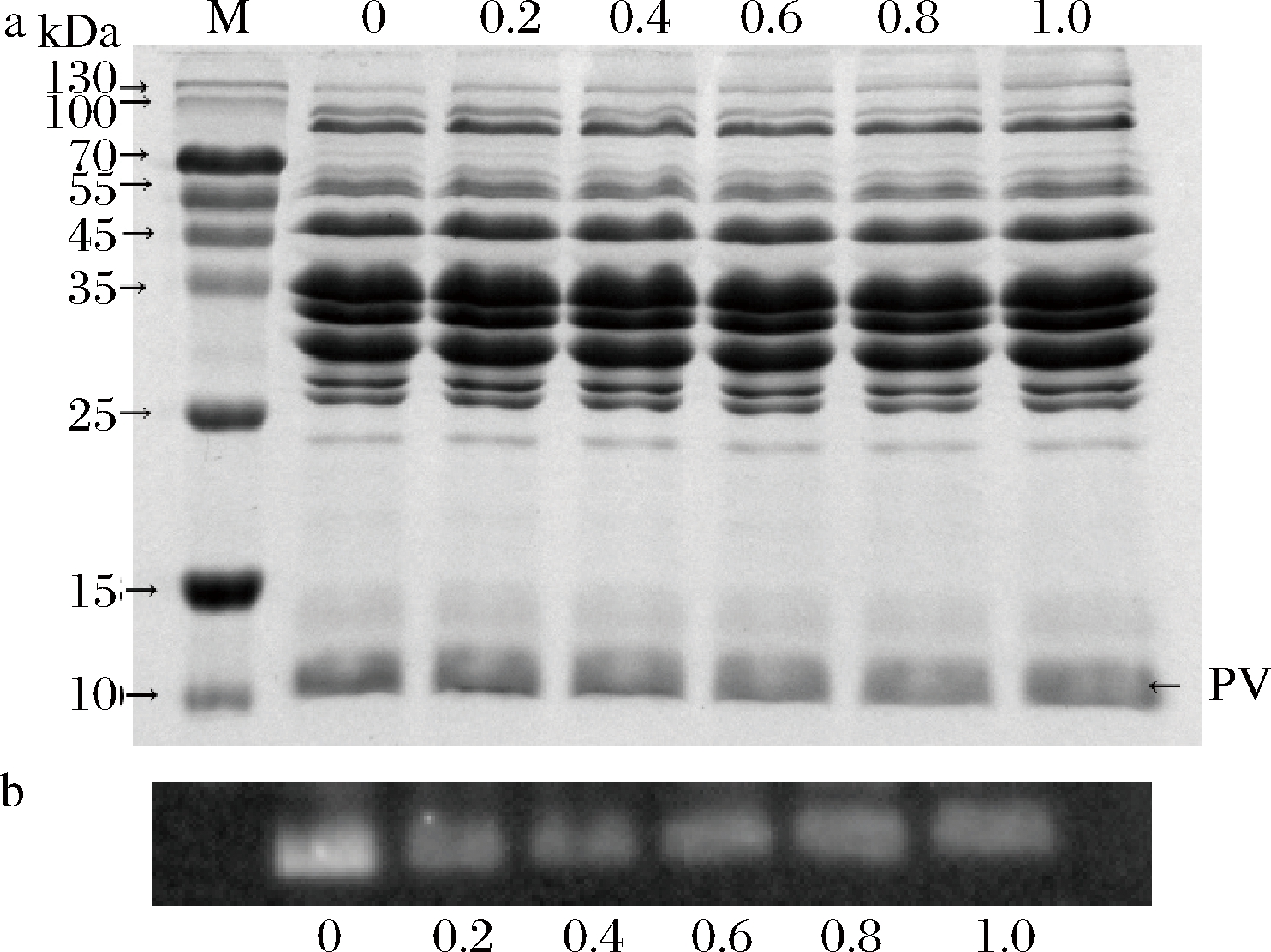
a-SDS-PAGE;b-免疫印迹分析
图5 不同离子强度处理后的青鱼肌浆蛋白的SDS-PAGE分析和免疫印迹分析
Fig.5 The SDS-PAGE patterns and western blotting profiles of sarcoplasmic protein from black carp exposed to different ion strength
2.2.2 不同离子强度对青鱼肌浆蛋白结构的影响
不同离子强度下肌浆蛋白的二级结构的改变通过圆二色谱来测定,如图6-a结果显示,当离子强度为0时,肌浆蛋白的α-螺旋含量显著高于其他组,为40.20%。相应的不规则卷曲含量最小,为15.50%。肌浆蛋白的表面疏水性随离子强度的变化如图6-b所示。离子强度为0时的表面疏水性比离子强度为0.2 时的表面疏水性降低了67.88%。但在离子强度0.4到1.0时则无显著性差异。说明离子的存在暴露了更多的疏水基团。如表2所示,肌浆蛋白的内源荧光强度值在离子强度为0时较小,色氨酸疏水基暴露,这与表面疏水性的结果并不完全一致,推测可能是由于除色氨酸以外的其他基团的结构变化影响了表面疏水性,这需后续实验进一步验证。
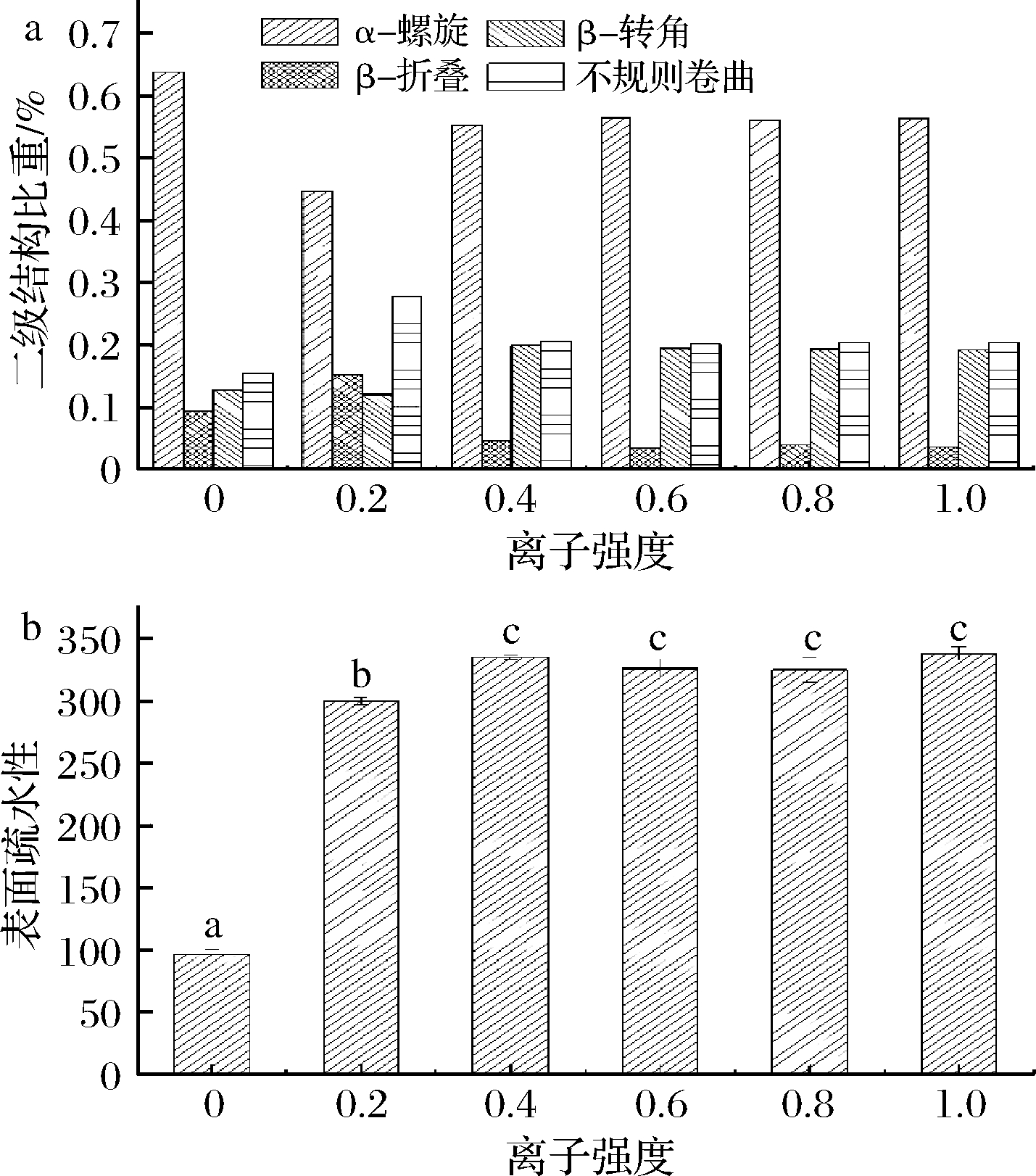
a-二级结构;b-表面疏水性
图6 不同离子强度处理对青鱼肌浆蛋白二级结构和表面疏水性的影响
Fig.6 The effect of different ion strength on the secondary structure and surface hydrophobicity of sarcoplasmic protein from black carp
表2 不同离子强度对青鱼肌浆蛋白内源荧光强度的影响
Table 2 The effect of different pH on intrinsic fluorescence intensity of sarcoplasmic protein from black carp
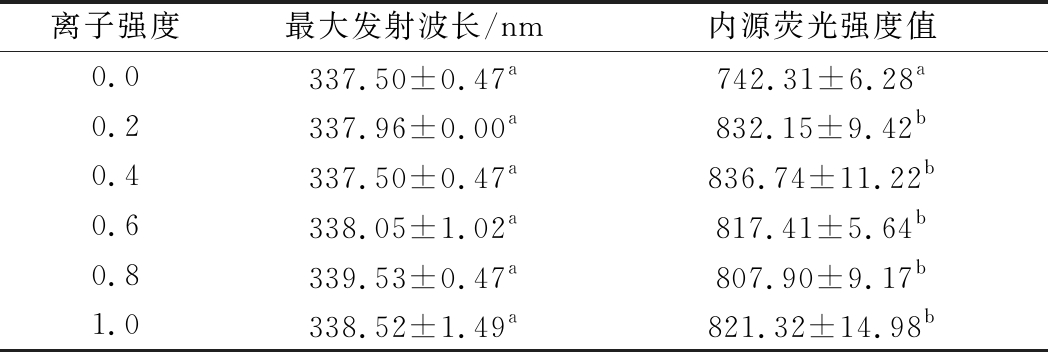
离子强度最大发射波长/nm内源荧光强度值0.0337.50±0.47a742.31±6.28a0.2337.96±0.00a832.15±9.42b0.4337.50±0.47a836.74±11.22b0.6338.05±1.02a817.41±5.64b0.8339.53±0.47a807.90±9.17b1.0338.52±1.49a821.32±14.98b
注:表中的数据为平均值±标准误差,每个组别至少做3次平行;同列中上标具有不同字母的数据表示组间差异显著(P<0.05)
3 结论
不同的pH条件下的青鱼肌浆蛋白的IgG/IgE结合能力不同,在pH 4.0~7.0时,pH越高,肌浆蛋白的IgG/IgE结合能力越强,高pH条件下的肌浆蛋白二级结构中的α-螺旋含量较高,不规则卷曲含量减少。表面疏水性降低,更多的色氨酸疏水基留在疏水腔内。蛋白结构变化趋势与蛋白IgG/IgE结合能力变化趋势相似,说明蛋白IgG/IgE结合能力与构象表位有关。离子强度在0~1.0时对IgG/IgE结合能力没有显著影响。离子强度为0时α-螺旋含量较高,表面疏水性显著减小,色氨酸残基暴露于极性环境,而离子强度大于0.2的组间则无显著差异。推测肌浆蛋白IgG/IgE结合能力的变化主要是由致敏蛋白二级结构的改变引起的,但仍需进一步验证。
[1] FERNANDES T J R, COSTA J, CARRAPATOSO I,et al. Advances on the molecular characterization, clinical relevance, and detection methods of Gadiform parvalbumin allergens[J]. Crit Rev Food Sci Nutr,2017,57(15): 3 281-3 296.
[2] SHARP M F, KAMATH S D, KOEBERL M, et al. Differential IgE binding to isoallergens from Asian seabass (Lates calcarifer) in children and adults[J]. Mol Immunol,2014, 62(1): 77-85.
[3] 陈香梅,张亮,齐立明,等.北京地区3236例过敏性疾病患者血清过敏原的季节差异分析[J].河北医科大学学报,2019,40(10):1 180-1 184.
[4] ZHAO Yongjuan,CAI Qiufeng,JIN Tengchuan,et al. Effect of Maillard reaction on the structural and immunological properties of recombinant silver carp parvalbumin[J]. LWT - Food Science and Technology,2017,75: 25-33.
[5] LIU Rong,KRISHNAN H B,Xue Wenton, et al. Characterization of allergens isolated from the freshwater fish blunt snout bream (Megalobrama amblycephala)[J]. J Agric Food Chem,2011, 59(1): 458-463.
[6] 石径,罗永康,江米足.多种鱼类肌浆蛋白与过敏患者血清特异性IgE结合情况检测与分析[J]. 中国渔业质量与标准, 2017(1):22-28.
[7] KOBAYASHI A,TANAKA H,HAMADA Y, et al.Comparison of allergenicity and allergens between fish white and dark muscles[J]. Allergy,2006, 61(3): 357-363.
[8] SHARP M F, LOPATA A L.Fish allergy: In review[J]. Clinical Reviews in Allergy & Immunology,2013,46(3): 258-271.
[9] BUGAJSKA-SCHRETTER A,GROTE M, VANGELISTA L, et al.Purification, biochemical, and immunological characterisation of a major food allergen: Different immunoglobulin E recognition of the apo- and calcium-bound forms of carp parvalbumin[J]. Gut,2000 46(5): 661-669.
[10] LIU R, HOLCKA L,YANG E, et al.Tropomyosin from tilapia (Oreochromis mossambicus) as an allergen[J].Clinical & Experimental Allergy,2013,43: 365-377.
[11] VOGEL S V, HENTGES F. Identification of enolases and aldolases as important fish allergens in cod,salmon and tuna: Component resolved diagnosis using parvalbumin and the new allergens[J]. Clinical & Experimental Allergy,2013,43: 811-822.
[12] 刘楚怡,刘蓉,薛文通,等.四种淡水鱼致敏蛋白免疫原性研究[J].食品工业科技,2011,32(11):164-165;167.
[13] 张晶宇,翟子扬,顾盼,等.反相液相色谱-串联质谱法筛选牙鲆鱼蛋白质中潜在的过敏原[J].食品安全质量检测学报,2019,10(7):1 797-1 803.
[14] LIU Xiaoyu,LUO Yongkang, LI Zheng. Effects of pH, temperature, enzyme-to-substrate ratio and reaction time on the antigenicity of casein hydrolysates prepared by papain[J]. Food and Agricultural Immunology,2010, 23(1): 69-82.
[15] LIN Haixin,LI Zhenxing,LIN Hong,et al.Effect of pH shifts on IgE-binding capacity and conformational structure of tropomyosin from short-neck clam (Ruditapes philippinarum)[J]. Food Chemistry,2015,188: 248-255.
[16] MA J,PAVASE T R,LI Z,et al.Optimisation of an extraction technique of fish allergens suitable for detection and diagnosis[J]. Czech Journal of Food Sciences,2017,35(1): 24-31.
[17] LYU Liangtao,LIN Hong,LI Zhenxing,et al. Determining the effect of malondialdehyde on the IgE-binding capacity of shrimp tropomyosin upon in vitro digestion[J]. J Sci Food Agric,2017, 97(13): 4 588-4 594.
[18] WANG Weixin,XIA Wenshui,GAO Pei,et al. Proteolysis during fermentation of Suanyu as a traditional fermented fish product of China[J]. International Journal of Food Properties,2017, 20(sup1): S166-S176.
[19] ZHANG Yongxia,CHEN Hengli,MALEKI S J,et al., Purification, characterization, and analysis of the allergenic properties of myosin light chain in procambarus clarkii[J]. J Agric Food Chem, 2015, 63(27): 6 271-6 282.
[20] 杨方.鱼肉内源酶对发酵鱼糜凝胶和抗氧化特性的影响的研究[D].无锡:江南大学,2016.
[21] SKJERVOLD P O, TAYLOR R G, WOLD J P, et al. Development of intrinsic fluorescent multispectral imagery specific for fat, connective tissue, and myofibers in meat[J]. Journal of Food Science, 2003, 68(4): 1 161-1 168.
[22] MORO A, GATTI C, DELORENOI N. Hydrophobicity of whey protein concentrates measured by fluorescence quenching and its relation with surface functional properties[J]. Journal of Agricultural and Food Chemistry, 2001, 49(10): 4 784-4 789.
[23] DUFOUR E, DEVAUX M, FORTIER P, et al. Delineation of the structure of soft cheeses at the molecular level by fluorescence spectroscopy-relationship with texture[J]. International Dairy Journal, 2001, 11(4): 465-473.
[24] LEFEVRE F, FAUCONNEAU B, THOMPSON J W, et al. Thermal denaturation and aggregation properties of Atlantic salmon myofibrils and myosin from white and red muscles[J]. Journal of Agricultural and Food Chemistry, 2007, 55(12): 4 761-4 770.