枯草芽孢杆菌(Bacillus subtilis)为革兰氏阳性杆状细菌,好氧,分布广泛[1],在其生长代谢的过程中能够分泌多种抗菌物质,包括核糖体合成的抗菌蛋白和抗菌肽,如细菌素,和非核糖体合成的脂肽类化合物[2-3],主要有Iturin、Fengycin和Surfactin三大类[4-5]。脂肽类化合物是由疏水脂肪酸尾部和亲水寡肽结构构成的双亲分子[6]。与细菌素相比,脂肽具有耐热性和抗蛋白酶水解等优点,此外,脂肽还具有广谱抗菌、抗支原体、抗肿瘤、抗病毒等生物活性[7]。表面活性素(Surfactin)是由C12~C17的β-脂肪酸链和7个氨基酸构成的环状脂肽,作为一种生物表面活性剂,与化学表面活性剂相比具有毒性低和生物降解性高等特点,并且可以在极端的温度、pH和盐度下保持表面活性[8]。Surfactin是目前已知最有效的生物表面活性剂之一,能显著降低水的表面张力,可有效抑制真菌、细菌等的生长,且乳化和气泡特性显著,在食品加工保藏、饲料养殖、化妆品、生物医药、石油工业等领域具有较高的应用价值,越来越受到人们的关注[9]。
神仙豆是皖北地区民间发酵豆制品,是大豆经浸泡、煮熟、密封后自然发酵而成,其发酵菌种主要为芽孢杆菌属[10]。本研究以从神仙豆中筛选出的芽孢杆菌为研究对象,采用血平板法、排油法、抑菌实验及特定基因检测等方法,对产脂肽类物质的菌株进行筛选与鉴定,并对其所产脂肽的特性及结构进行分析,为该菌株在食品加工及保藏中的应用提供理论基础。
1 材料与方法
1.1 实验材料
待测菌株,分离自皖北特色神仙豆;黑曲霉Aspergillus niger,淮南师范学院食品质量与安全实验室保藏;细菌基因组DNA抽提试剂盒、16S rDNA细菌鉴定试剂盒、PCR反应相关试剂,上海生工;成品血琼脂培养基,国药集团化学试剂有限公司;Surfactin标准品,Sigma公司;乙腈、三氟乙酸、甲醇(均为色谱级),天津科密欧化学试剂有限公司。
1.2 仪器与设备
SW-CJ-2D双人单面垂直净化工作台,苏州博莱尔净化设备有限公司;EX Zone2电子天平,深圳安普特电子科技有限公司;BSC-250恒温恒湿培养箱,上海博讯实业有限公司医疗设备厂;DYY-6C型电泳仪,北京市六一仪器厂; ABI 型PCR仪,美国ABI公司;GEL DOC XR凝胶成像系统,美国Bio-rad;5804R型离心机,Eppendorf公司;HPLC2998高效液相色谱,Waters公司。
1.3 实验方法
1.3.1 菌株筛选与鉴定
1.3.1.1 血平板初筛
在无菌条件下,将活化后的菌株转接到血琼脂平板培养基上,于37 ℃下培养48 h后观察菌落周围有无溶血现象并记录。
1.3.1.2 发酵上清液制备
将活化后的菌株转接到牛肉膏蛋白胨液体培养基中,于37 ℃、140 r/min 的摇床中培养48 h,10 000 r/min离心10 min后,发酵上清液过0.45 μm孔径水系滤膜除菌,进行性质测定。
1.3.1.3 排油活性检测
取60 mL无菌水加入到直径为90 mm玻璃皿中,在水面上加入5 mL液体石蜡,形成油膜后加入0.2 mL无菌发酵上清液,形成排油圈,测量直径,每个处理重复3次。
1.3.1.4 抑黑曲霉活性测定
黑曲霉于28 ℃恒温培养箱中培养5 d后,吸取10 mL生理盐水加入到培养基中,用接种环刮取孢子溶解到生理盐水中,混匀后,采用血细胞计数法进行计数[11],配制孢子浓度为104~105 CFU/mL的孢子悬液,振荡均匀。取100 μL孢子悬液均匀涂布于马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)中,用无菌镊子将无菌牛津杯置于培养基中心,吸取150 μL发酵上清液注入牛津杯中,于28 ℃恒温培养箱中培养2 d后,观察抑菌效果[12]。
1.3.1.5 脂肽合成相关基因检测
将待测菌株接种到牛肉膏蛋白胨液体培养基中,于37 ℃、170 r/min摇床中培养24 h,10 000 r/min离心收集沉淀,按照细菌基因组DNA抽提试剂盒提取待测菌株的总DNA。扩增引物序列参考文献[13],引物sfp (编码Surfactin合成中的4′-phosphopantetheiny transferase,675 bp):sfpF (5′-ATGAAGTTTACGGAAT-TTA-3′),sfpR (5′-TTATAAAAGCTCTTCGTACG-3′);引物ituD(编码ituD synthetase D, 1203 bp): ituDF (5′-ATGAACAATCTTGCCTTTTTA-3′),ituDR (5′-TTATTTTAAAATCCGCAATT-3′);lpa-14 (编码脂肽抗菌素iturin A,675 bp):lpa-14F (5′-GAAAATTTACGGAGTATATATGGACCGC-3′),lpa-14R (5′-TT-ATAACAGCTCTTCATACGTTTTCATCTC-3′)。PCR采用25 μL体系,以待测菌株基因组DNA为模板,反应条件:扩增sfp为94 ℃、5 min;94 ℃、1 min,48 ℃、30 s,72 ℃、1 min,30个循环;72 ℃、10 min;检测ituD和lpa-14为94 ℃、5 min;94 ℃、1 min,58 ℃、30 s,72 ℃、1.5 min,30个循环;72 ℃、10 min。PCR产物经琼脂糖凝胶电泳检验,拍照分析。
1.3.1.6 菌株鉴定
以待测菌株的总DNA为模板进行PCR扩增,采用正向引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物1492R:5′-ACGGCTACCTTGTTACGACTT-3′。PCR采用25 μL体系,反应条件为: 94 ℃、5 min; 94 ℃、30 s,55 ℃、30 s; 72 ℃、1.5 min,共30个循环; 72 ℃、5 min。PCR产物经琼脂糖凝胶电泳检验后送通用生物系统(安徽)有限公司进行测序。所得序列通过BLAST(http://www.ncbi.nlm.nih.gov/blast)进行序列相关性分析,采用MEGA 4.0软件、以Neighbor-joining法构建系统发育树。
1.3.2 脂肽粗提物定性分析
1.3.2.1 Surfactin的制备及傅里叶变换红外光谱分析
将菌株BS6-2接种到牛肉膏蛋白胨液体培养基中,37℃、170 r/min摇床培养2 d,取一定量发酵液10 000r/min离心20 min去除菌体。参考NAIR等[14]的方法,发酵上清液经酸沉、酸洗、碱中和后用冷冻干燥得Surfactin提取物。利用溴化钾压片法对Surfactin提取物进行红外光谱扫描,确定样品中的主要官能团。
1.3.2.2 高效液相色谱定性分析
参考朱震等[15]的条件,略有修改。高效液相色谱(high performance liquid chromatography,HPLC)分析系统Waters Breeze HPLC,色谱柱为Waters RP-C18 Analytical Column(5 μm,4.6 nm×250 nm);检测波长为210 nm,柱温30 ℃;采用等梯度洗脱进行样品分析,所用流动相A为乙腈,流动相B为水(含0.1%三氟乙酸),流动相比例V(A)∶V(B)=70∶30,流速1.0 mL/min,进样量10 μL。
1.3.2.3 超高效液相色谱-电喷雾四级杆-飞行时间质谱(ultra-performance liquid chromatography-electron spray ionization-quadrupole-time-of-flight mass spectrometry,UPLC-ESI/Q-TOF MS)分析
质谱条件:电喷雾离子源(ESI),正离子检测模式;离子源温度为20 ℃;毛细管电压3 000 V;锥孔电压30 V;去溶剂气体流速500 L/h;去溶剂温度500 ℃;锥孔气流50 L/h;范围m/z 100~1 500,检测时间10 min。
1.3.3 Surfactin粗品乳化特性分析
1.3.3.1 乳化指数(E24测定)
参考YADAV等[16]的方法略有修改,取2 mL液体石蜡加入到带刻度的试管,再加入2 mL不同浓度的Surfactin提取物溶液(以吐温-80作对照),振荡混匀2 min后,在室温下静置24 h,按公式(1)计算乳化指数![]()
乳化指数![]()
(1)
式中:h1为乳化层高度;h2为液体总高度。
1.3.3.2 乳化稳定性测定
参考朱震等[15]的方法,将振荡混匀后的乳化液静置96 h,每间隔24 h测量乳化指数,按公式(2)计算乳化稳定性:
乳化稳定性![]()
(2)
式中:E0为静置0 h时溶液的乳化指数,Et为溶液静置t h时的乳化指数。
2 结果与分析
2.1 菌株的分离筛选
从神仙豆中共分离出25株菌株,经血琼脂平板初筛,筛选出5株溶血效果明显的菌株BS6、BS6-2、BS17和BS18和BS19。5株菌株的排油圈直径、抑黑曲霉效果如表1所示,菌株合成Surfactin和Iturin A的相关基因检测结果如图1所示。由表1可知,菌株BS6和BS6-2的排油圈直径最大;BS6-2、BS17和BS18的发酵上清液对黑曲霉的抑制效果最好,说明5株菌均能产生脂肽。由图1可知,菌株BS6、BS6-2中扩增出sfp基因,菌株BS17、BS18、BS19中扩增出sfp和lpa-14基因,5株菌中均没扩增到ituD基因。说明菌株BS6、BS6-2所产脂肽可能为Surfactin,菌株BS17、BS18、BS19所产脂肽可能为Surfactin和Iturin A。进一步对5株菌所产脂肽(1 mg/mL)对黑曲霉的抑制活性进行测定(表1),结果表明,5种脂肽均有抑菌效果,其中菌株BS6-2所产脂肽对黑曲霉的抑制效果最强。综上,BS6-2的排油圈直径和抑菌效果均最佳,因此,挑选该菌株进行后续实验。
表1 菌株的排油能力和对黑曲霉的抑制效果比较
Table 1 Comparison of oil-spread capability and anti-Aspergillus niger activity among screened bacterial strains

菌株 排油圈直径/mm发酵上清液抑制效果脂肽提取物抑制效果BS673.7±6.5a++++BS6-272.7±3.1a++++++BS1763.0±1.7b++++++BS1853.0±9.1c+++++BS1939.0±3.2d++++
注: “+”表示抑菌圈直径≥6 mm;“++”表示抑菌圈直径≥10 mm; “+++”抑菌圈直径≥ 20 mm;不同小写字母表示差异显著
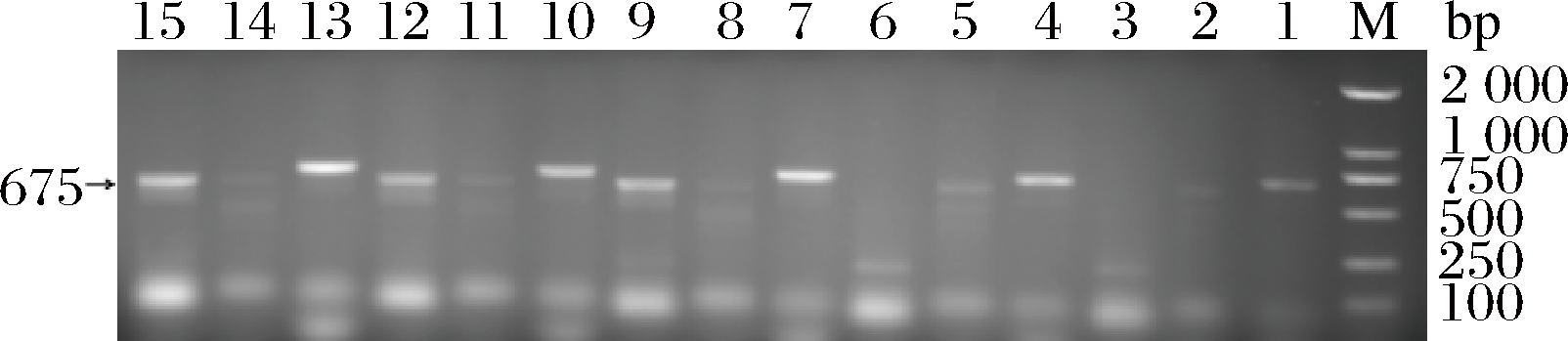
M-DL 2000 Marker;1、4、7、10、13-菌株BS6、BS6-2、BS17、BS18、BS19的sfp基因;2、5、8、11、14-菌株BS6、BS6-2、BS17、BS18、BS19的ituD基因;3、6、9、12、15-菌株BS6、BS6-2、BS17、BS18、BS19的lpa-14基因
图1 脂肽相关基因(sfp、ituD、lpa-14)扩增电泳图谱
Fig.1 Specific amplified results of lipopeptide related genes
(sfp, ituD, lpa-14)
2.2 菌株BS6-2的鉴定
经PCR扩增和序列测定,获得菌株BS6-2的16S rDNA序列片段。进一步经过BLAST在线比对,该序列与B. subtilis strain subtilis (MN611449.1)、B. subtilis (AJ276351.1)、B. subtilis strain 50-1 (MH475924.1)、B. subtilis strain SR2-27 (MN421466.1)的相似性达到99%,与相近种构建系统发育树,如图2所示,初步确定菌株BS6-2为枯草芽孢杆菌B. subtilis。Bacillus属可产生多种抗菌物质和蛋白酶、淀粉酶等酶类,在工业生产中具有重要作用。LEE等[9]从韩国传统发酵豆制品chungkookjang中分离筛选出1株脂肽产生菌Bacillus sp. LM7,经鉴定LM7所产脂肽共包含8种物质,分别为4种芽孢菌霉素D和4种Surfactin 同系物;ZHANG等[17]从番茄根际筛选出1株具有抑真菌活性的菌株B. amyloliquefaciensW10,其抑菌活性物质为Iturin A(C14~C16)、Fengycin A(C14~C15)、Fengycin A(C16~C17)和Surfactin(C13~C16);NAIR等[14]发现海洋绿藻内生菌Bacillus sp.可分泌两大类环状脂肽Surfactin和Fengycin;JEONG等[18]发现B. siamensis 可以产生抗菌物质,其基因序列显示至少存在4个与抗菌物质相关的基因簇,如Iturin、Fengycin、Bacillaene和Difficidin。菌种鉴定的结果表明,菌株BS6-2可能是一种潜在的生物活性物质产生菌。
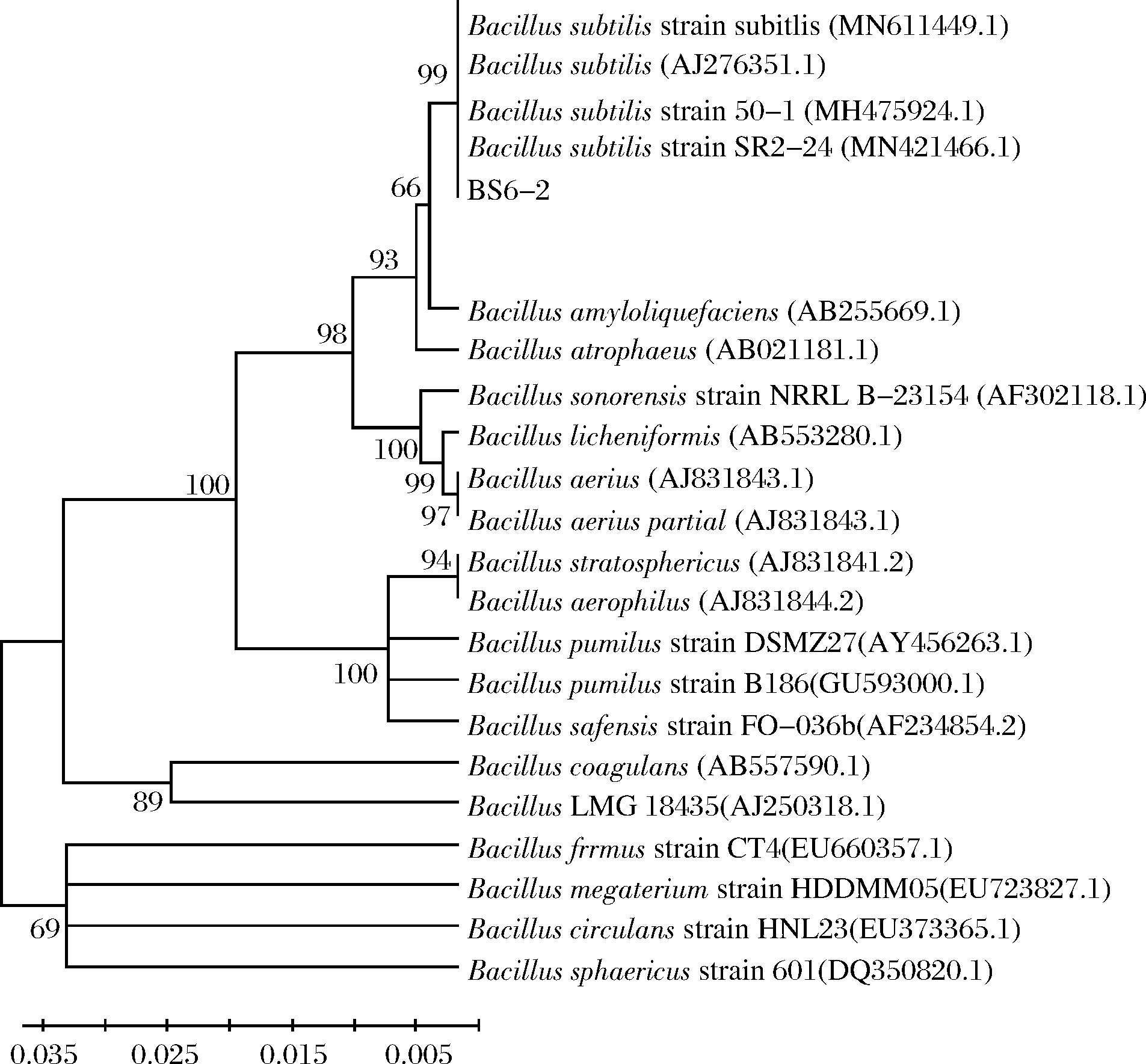
图2 菌株BS6-2的16S rDNA系统发育树
Fig.2 Phylogenetic tree of strain BS6-2 based on the 16S rDNA sequence
2.3 Surfactin提取物的定性分析
图3为菌株BS6-2所产Surfactin的红外图谱,由图3可知,3 299.74 cm-1处的宽展吸收峰是由OH和NH基团伸缩振动引起的[19]。2 960~2 860 cm-1和1 455~1 380 cm-12处窄尖吸收是脂肪酸链的C—H伸缩振动[20]。1 653.47 cm-1和1 547.74 cm-12处窄尖强吸收为酰胺键,说明样品中含有肽链[15]。综上说明该样品为脂肽类物质。

图3 菌株BS6-2所产脂肽物质的傅里叶变换红外光谱
Fig.3 Infrared spectra of crude lipopeptide from strain BS6-2
对提取的脂肽样品经 CH3OH 萃取后采用乙腈和三氟乙酸的水溶液作为流动相进行高效液相色谱分析,与Surfactin标准品进行比对,结果如图4所示。由图4-a可知,Surfactin标准品在保留时间4.00~6.00 min出现4个特征峰。不同色谱条件Surfactin标准品的保留时间会出现差异。LEE等[9]以0.1%的甲酸和含0.1%甲酸的乙腈进行梯度洗脱,Surfactin标准品的保留时间集中在12.00~12.73 min。由图4-b可知,样品在保留时间4.00~6.00 min出现3个特征峰,且3个峰均位于标准峰附近,因此可以推测样品为Surfactin的同系物。
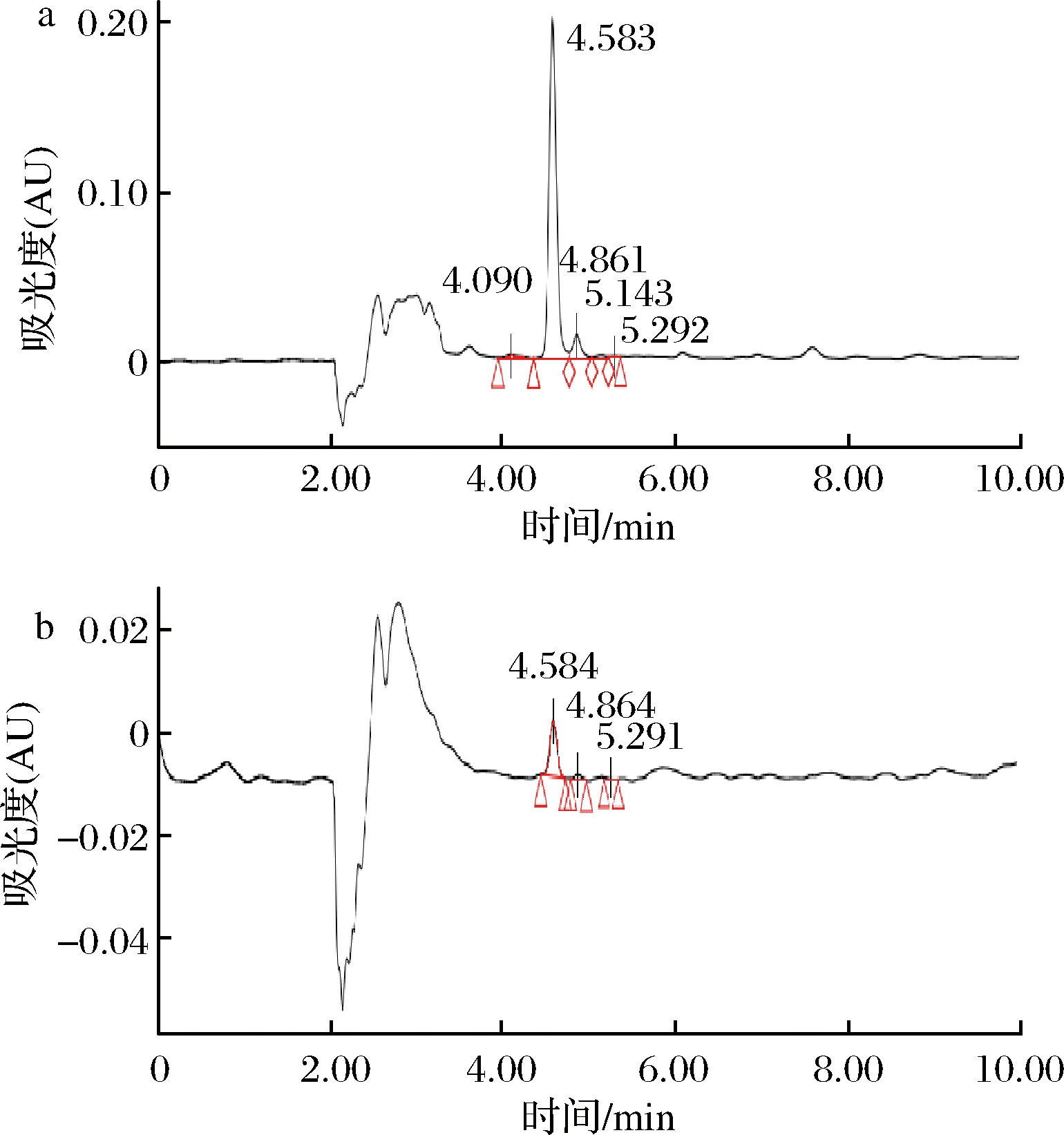
a-Surfactin标准品;b-Surfactin提取物
图4 样品的高效液相色谱图
Fig.4 HPLC fingerprints of samples
Surfactin的典型结构为不同长度的β-羟基脂肪酸链(一般为C12~C15)和L-Glu1-L-Leu2-D-Leu3-L-Val4-L-Asp5-D- Leu6-L- Leu7,通过内置键链接而成的环状结构[21]。另外,Surfactin的同系物还包括一些氨基酸残基的取代物,比如(Val7)Surfactin、(Ile7)Surfactin、(Ala4)Surfactin和(Asp1,Glu5)Surfactin[22],这些氨基酸残基的取代会极大地影响Surfactin的生物活性[23]。研究报道B. coagulans 可以产生2种Surfactin同系物,第7位氨基酸分别为Leu和Val[23];BAUMGART等[24]也鉴定出两种Surfactin同系物,第7位氨基酸上的Leu分别被Val和Ile取代。图5为Surfactin标准品(a)和Surfactin提取物(b)的[M+H]+质谱图,由图5可知,2个样品均出现了1 008、1 022、1 036 m/z 3个 [M+H]+离子峰,之间相隔分子量为14,即CH2—,分子量与Surfactin同系物一致,可判断分别代表C13~C15Surfactin同系物。根据分子量可初步推断菌株BS6-2产Surfactin的3种同系物为β-OH-C13-15-Glu-Leu-Leu-Val-Asp-Leu-Leu(Ile),第7位氨基酸残基具体是哪一个还有待进一步分析。
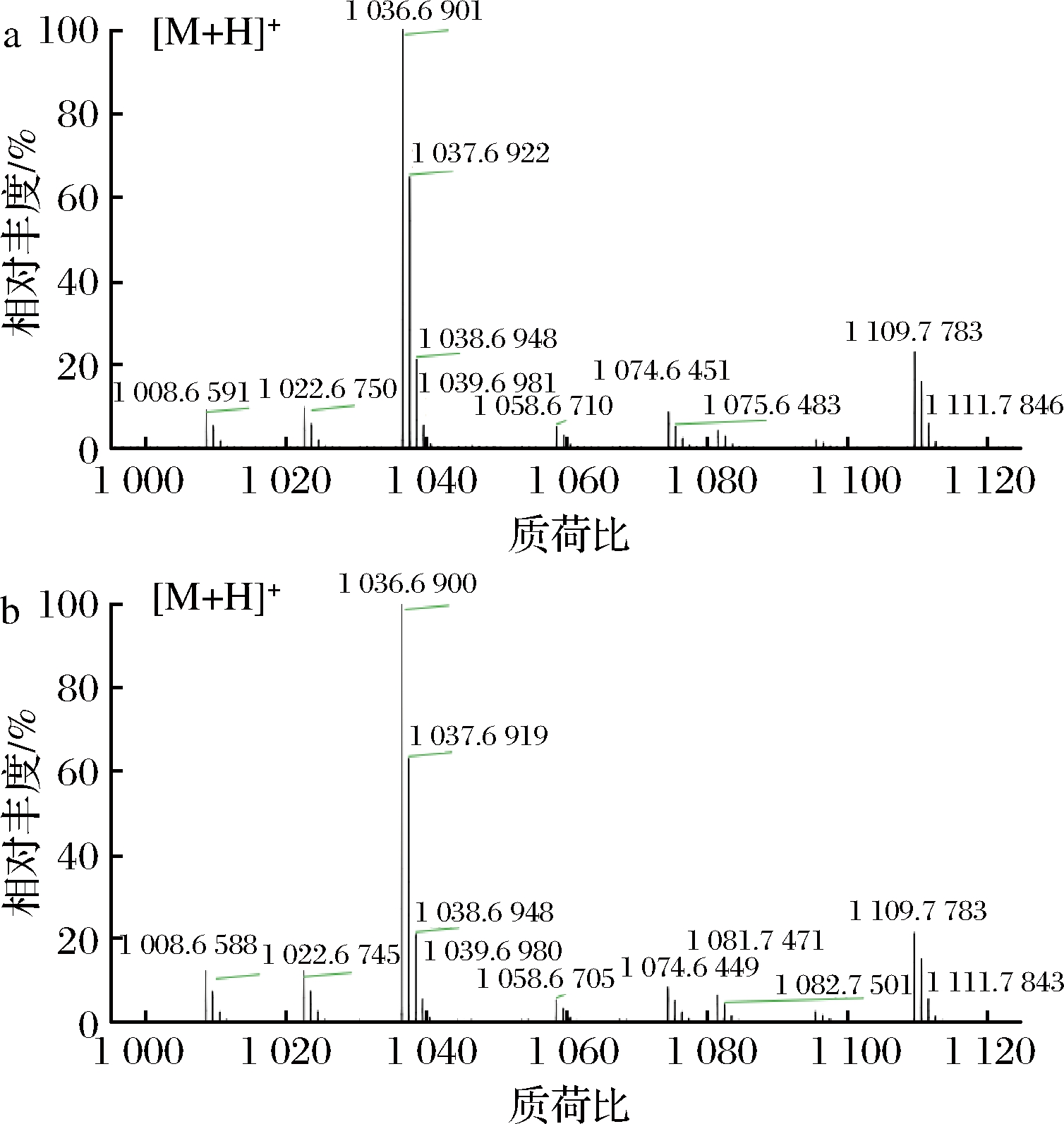
a-Surfactin标准品; b-Surfactin提取物
图5 样品的质谱图
Fig.5 Mass spectrum of samples
2.4 Surfactin提取物的乳化特性分析
微生物表面活性剂是由疏水性和亲水性两个部分组成的两亲性代谢物,可以在不同极性的液相之间的界面上进行分配。脂肽是一种很典型低分子量微生物表面活性剂,可以有效地降低表面张力和界面张力。有大量的研究表明表面活性与乳化活性之间有直接正相关性[16],因此E24经常被用来作为一种有效的筛选方法。图6为菌株BS6-2所产将Surfactin提取物的乳化指数E24(以吐温-80作对照)。结果表明,Surfactin提取物和吐温-80的乳化指数E24均随着溶液浓度增大而升高,且两者乳化指数E24差别不大。当Surfactin提取物溶液浓度高于500 mg/L时,E24达到55%以上,略低于芽孢杆菌ZG0427所产表面活性剂的E24,当其质量浓度为500 mg/L时,E24可达到61.5%[25],一般认为若E24>50%就表明具有很强的乳化能力[26]。图7为不同质量浓度的Surfactin提取物溶液的乳化稳定性随时间的变化规律。由图7可知,不同质量浓度的Surfactin提取物质量溶液在放置的过程中其乳化稳定性均有所下降,特别是在前24 h,稳定性下降幅度比较大,后趋于平稳;Surfactin提取物浓度越高,乳化稳定性越强,当浓度>500 mg/L时,放置96 h后,乳化稳定性下降25%左右,稳定性较好。由此可见,Surfactin提取物溶液具有较好的乳化活性。
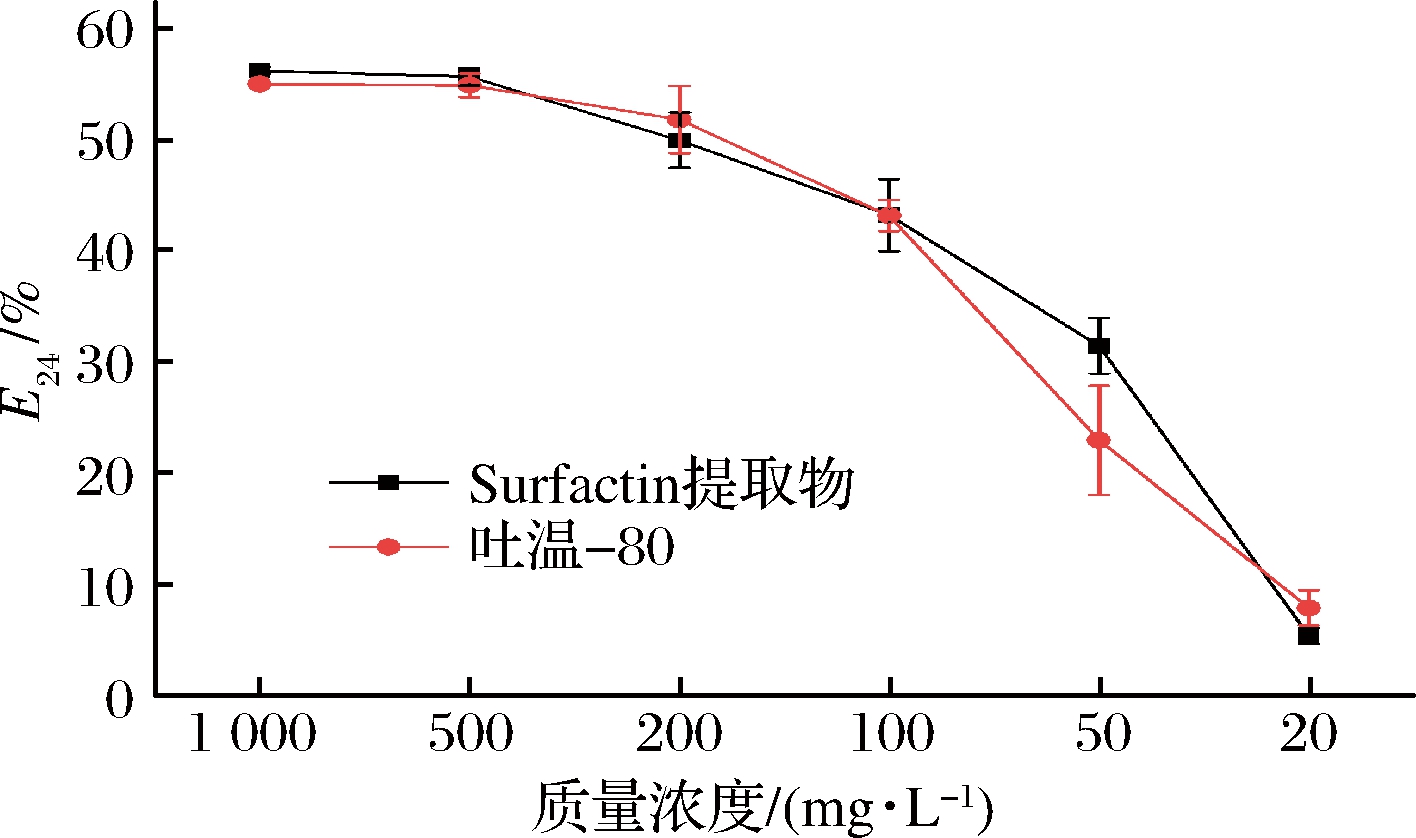
图6 不同质量浓度Surfactin提取物溶液的乳化指数
Fig.6 Emulsification index of Surfactin extract at different concentrations

图7 不同质量浓度Surfactin提取物的乳化稳定性
Fig.7 Emulsification stability of Surfactin extract at different concentrations
3 结论
本研究通过溶血性、排油圈、抑菌试验及其编码基因检测,筛选出1株产Surfactin的菌株BS6-2。经16S rDNA分子生物学鉴定,将菌株BS6-2鉴定为枯草芽孢杆菌Bacillus subtilis。利用傅里叶变换红外光谱、高效液相色谱和UPLC-ESI/Q-TOF MS分析,推测菌株BS6-2所产Surfactin为3种同系物,其可能结构为β-OH-C13-15-Glu-Leu-Leu-Val-Asp-Leu-Leu(Ile)。Surfactin提取物表现出良好的乳化性能和抑黑曲霉活性,但其有效组分仍需进一步分离纯化。
[1] 刘雪. 枯草芽孢杆菌B-332菌株发酵条件及其抗菌物质分离纯化的研究[D]. 北京:中国农业科学院, 2007.
[2] ZHAO X, ZHOU Z J, HAN Y, et al. Isolation and identification of antifungal peptides from Bacillus BH072, a novel bacterium isolated from honey[J]. Microbiological Research, 2013, 168(9): 598-606.
[3] FALARDEAU J, WISE C, NOVISKY L, et al. Ecological and mechanistic insights into the direct and indirect antimicrobial properties of Bacillus subtilis lipopeptides on plant pathogens [J]. Journal of Chemical Ecology, 2013, 39(7): 869-878.
[4] KAWULKA K E, SPRULES T, DIAPER C M, et al. Structure of subtilosin A, a cyclic antimicrobial peptide from Bacillus subtilis with unusual sulfur to α-carbon cross-links: Formation and reduction ofα-thio-α-amino acid derivatives [J]. Biochemistry, 2004, 43: 3 385-3 395.
[5] SHARMA D, MANDAL S M, MANHAS R K. Purification and characterization of a novel lipopeptide from Streptomyces amritsarensis sp. nov. active against methicilli-resistant Staphylococcus aureus[J]. AMB Express, 2014, 4(1): 1-9.
[6] ONGENA M, JACQUES P. Bacillus lipopeptides: Versatile weapons for plant disease biocontrol[J]. Trends in Microbiology, 2007, 16(3): 115-125.
[7] SANSINENEA E, ORTIZ A. Secondary metabolites of soil Bacillus spp[J]. Biotechnology Letters, 2011, 33(8): 1 523-1 538.
[8] SLIVINSKI C T, MALLMANN E, DE ARAUJO J M, et al. Production of surfactin by Bacillus pumilus UFPEDA 448 in solid-state fermentation using a medium based on okara with sugarcane bagasse as a bulking agent[J]. Process Biochemistry, 2012, 47(12): 1 848-1 855.
[9] LEE M H, LEE J, NAM Y D, et al. Characterization of antimicrobial lipopeptides produced by Bacillus sp. LM7 isolated from chungkookjang, a Korean traditional fermented soybean food[J]. International Journal of Food Microbiology, 2016, 221:12-18.
[10] 吴定. 神仙豆发酵菌分离及发酵条件研究[J]. 中国酿造, 2001(2): 17-18.
[11] 白羡钦, 代光辉, 陈佳,等. 合欢皮提取物对黑曲霉抑菌活性的研究[J]. 食品工业科技, 2014, 35(12): 133-136.
[12] 王娣, 许晖, 钱时权. 麝香草酚对食品常见污染菌的抑菌作用[J]. 食品科学, 2013, 34(3): 119-122.
[13] HE C P, FAN L Y, WU W H, et al. Identification of lipopeptides produced by Bacillus subtilis Czk1 isolated from the aerial roots of rubber trees[J]. Genetics and Molecular Research, 2017, 16(1): 1-13.
[14] NAIR D, VANUOPADATH M, NAIR B, et al. Identification and characterization of a library of surfactins and fengycins from a marine endophytic Bacillus sp.[J]. Journal of Basic Microbiology, 2016, 56(11): 1 159-1 172.
[15] 朱震, 罗毅, 张鹏, 等. 产表面活性素和伊枯草菌素A菌株的筛选及其脂肽类产物的特性[J]. 微生物学通报, 2011, 38(10): 1 488-1 498.
[16] YADAV A K, MANNA S, PANDIYAN K, et al.Isolation and characterization of biosurfactant producing Bacillus sp. from diesel fuel-contaminated site[J]. Microbiology, 2016, 85(1): 56-62.
[17] ZHANG Q X, ZHANG Y, SHAN H H, et al. Isolation and identification of antifungal peptides from Bacillus amyloliquefaciens W10[J]. Environmental Science and Pollution Research, 2017, 24(32): 25 000-25 009.
[18] JEONG H, JEONG D E, KIM S H, et al. Draft genome sequence of the plant growth-promoting bacterium Bacillus siamensis KCTC 13613T[J].Journal of Bacteriology, 2012, 194: 4 148-4 149.
[19] 苏增建, 张玉秀, 李敏, 等. 热带海水中生物表面活性剂生产菌的筛选及特性研究[J]. 安全与环境学报, 2018, 18(4): 1 457-1 463.
[20] 罗剑波, 吴卫霞, 张凡, 等. 一株产脂肽类生物表面活性剂菌株的分离及代谢产物分析[J]. 化学与生物工程, 2010, 27(2): 46-49.
[21] DUNLAP C A, SCHISLER D A, PRICE N P, et al. Cyclic lipopeptide profile of three Bacillus subtilis strains; antagonists of Fusarium head blight[J]. Journal of Microbiology, 2011, 49(4): 603-609.
[22] SHAO C, LIU L, GANG H, et al. Structural diversity of the microbial surfactin derivatives from selective esterification approach[J]. International Journal of Molecular Sciences, 2015, 16(1): 1 855-1 872.
[23] POLYMEROPOULOS E E, LÖFFLER S, BRICKMANN J. Surfactin isoforms from Bacillus coagulans[J]. Zeitschrift Für Naturforschung C, 2006, 61(9-10): 727-733.
[24] BAUMGART F, KLUGE B, ULLRICH C, et al. Identification of amino acid substitutions in the lipopeptide surfactin using 2D NMR spectroscopy[J]. Biochemical and Biophysical Research Communications, 1991, 177(3): 998-1 005.
[25] 周敏,陈吉祥,杨智,等.芽孢杆菌ZG0427表面活性剂性质及对石油降解菌的作用[J].安全与环境学报, 2017, 17(6): 2 376-2 381.
[26] FREITAS F, ALYES V, CARVALHEIRA M, et al. Emulsifying behaviour and rheological properties of the extracellular polysaccharide produced by Pseudomonas oleovorans grown on glycerol byproduct[J]. Carbohydrate Polymers, 2009, 78(3): 549-556.