红曲色素,是利用微生物发酵大规模生产的成功典范[1-2]。其中红曲红色素的生产及应用已经相当成熟[3-7]。近年来,人们对红曲黄、橙色素的研究正在不断深入,这包括对红曲黄、橙色素发酵、分离纯化及定性、定量检测方法的研究[8-13]。
红曲色素的分离、定性及定量检测工作,难度极大。原因是,首先,红曲发酵的色素产品,皆是多种色素与发酵基质残余物的混合物,纯色素的制备难度大。其次,红曲色素种类繁多[14-15], 已有94种红曲色素被报导,其中有44种黄色素,8种橙色素以及42种红色素[16]。而且这些色素的分子结构式相近,采用一般的方法无法纯化,故定性及定量也就困难重重。色素含量的检测方法,国内外有研究者[17-18]曾经使用过高效液相色谱法(high performance liquid chromatography,HPLC)法或色素的质量浓度法进行定量测定,但这需要预先获得纯色素,工作量巨大。
红曲产业界普遍采用分光光度计法,在特定波长下检测色素萃取物的OD值,计算色素的色价,并以色价值的大小作为色素含量高低的依据。例如,国家标准中,红曲红是在505 nm下检测;红曲黄在466~486 nm检测[19-21]。天然红曲黄色素,往往又在320~420 nm下测定。如果样品中含有众多红曲色素,分光光度计的检测方法也有缺陷,即在固定的波长下检测色价值,并不能精确地反映色素的种类及定量。因为众多色素的特征波长的数据还未测定过;而且多种色素混合物的扫描图谱中,峰值所对应的波长会发生移动。只有对高纯度的色素样品,才能用分光光度计法进行精确的定性和定量。诚然,用制备型高效液相色谱和质谱联用的方法可以彻底解决问题。但这也需要大量的分离纯化工作及高端仪器为依托。ZHENG等[22]的文献报道,采用HPLC-FD/PAD和MS联用的方法,研究红曲产品指纹特征性物质,据称检测到8种已知色素产品(红、橙色素各2种,黄色素4种),还有2个未知产物。用该法可以确定色素的分子量,显然对于物质定性是有极大帮助的,但有不少红曲色素物质尚未分离纯化,其分子结构式未知,峰值波长也不确定,用HPLC法还是不够的。
本研究采用紫色红曲菌W-2发酵液为研究对象,采用板层析分离及分光光度计扫描检测相结合的方法,对红曲色素进行初步的分离定性和定量的研究,试图找出一种简单而实用的橙、黄色素的定性及定量检测方法,为进一步研究红曲色素的特性打下基础。
1 材料与方法
1.1 实验材料
紫色红曲菌W-2,由江南大学提供;红曲发酵液,由100 L机械搅拌通风罐生产,发酵液中包含菌体且富含各种色素,外观呈橙黄色。如图1所示。乙醇、甲苯、乙酸乙酯、甲酸,皆为分析纯。
1.2 仪器与设备
TGL-16M离心机,湖南湘仪;UV1600紫外-可见比例双光束分光光度计;P-1型 (200×200) cm层析缸,垒固科技有限公司;层析板:60 F254,25 Aluminium sheets (20×20) cm TLC 硅胶,Merck公司。
1.3 实验方法
1.3.1 发酵液的萃取和离心分离
在发酵液中加入其体积15%的脂溶性萃取剂,离心分离,8 000 r/min,20 min;离心后发酵液分为上层相、中间层与水相3个不同层次。
1.3.2 用分光光度计检测红曲色素的特征波长及色价
色价定义为单位质量(g)或单位体积(mL)的色素样品,用合适的溶剂萃取并稀释后,在分光光度计中,用1 cm比色皿,在一定波长下测得的吸光度值(OD)乘以其稀释倍数。色价单位分别是U/g或U/mL。
上层萃取相色素:取上层相1 mL,加49 mL无水乙醇萃取色素,8 000 r/min,离心10 min后,用无水乙醇稀释后在300~600 nm扫描,确定波峰所对应的波长,并计算萃取相色价。
中间层色素:同上层相的方法。
下层水相色素:用移液枪,取离心管下层水相2 mL置于50 mL比色管中,用无水乙醇稀释,8 000 r/min,10 min离心后在300~600 nm扫描,确定波峰值所对应的波长,并计算下层水相色价。
色价的计算如公式(1)、公式(2)所示:
上层/中间层萃取相色价/(U·mL-1)=ODmax×总稀释倍数![]()
(1)
式中:引入萃取相体积/水相体积这个系数,是要将萃取相中的色价统一折算为水相的色价。
水相色价/(U·mL-1)=ODmax×总稀释倍数
(2)
1.3.3 色素萃取液的薄层层析分离方法
乙醇萃取的色素样品,用毛细管点样,层析板置于层析缸中展开,展开剂为甲苯∶乙酸乙酯∶甲酸=7∶3∶1(体积比)。层析板(20×20) cm,展开后,溶剂前沿离层析板顶端2 cm左右时取出层析板,记录展开剂前沿的位置,将板晾干后在可见光下观察。比移值(Rf值)计算方法如公式(3)所示:
Rf值![]()
(3)
2 结果与分析
2.1 发酵液及其离心处理
红曲发酵液外观如图1所示。发酵液稀释后,用分光光度计在300~600 nm扫描,扫描图谱如图2所示。发酵液黄色素的最高色价 531 U/mL(406 nm);橙色素色价(466 nm)439 U/mL。从图2中的2个波峰对应的波长可看出,色素中主要含有黄色素和橙色素。

图1 紫色红曲菌W-2发酵液外观
Fig.1 Fermentation broth of Monascus purpureus W-2

图2 发酵液乙醇提取物的分光光度计扫描图
Fig.2 Scanning curve of ethanol extract of fermentation broth
在发酵液中加入脂溶性萃取剂(占发酵液体积的15%~30%),离心后,呈现上、中、下三相。如图3所示,上部为萃取剂层,色素含量高,为非水溶性色素;下层为水相层,所含色素主要是水溶性色素;中间层含有菌体,其中夹杂有大量的色素。

图3 发酵液离心后的分层情况
Fig.3 Three phases are shown in the fermentation broth after centrifugation
注:上层为萃取相;下层为水相;中间层为菌体及其所含的色素
图4分别是上层萃取相、中间层和下层水相用乙醇稀释后液体的外观。从其颜色来看,上层相的和下层相的乙醇稀释液呈黄色,中间层的则呈橙色。

图4 上层萃取相、中间层和下层水相用乙醇稀释后的外观
Fig.4 Diluted solution of the three phases with ethanol
2.2 三相色素300~600 nm可见光范围内的扫描图及其特征
发酵液离心分离后所展示的3个层相,分别取样,用乙醇萃取或稀释后,用分光光度计在300~600 nm进行扫描,如图5所示。
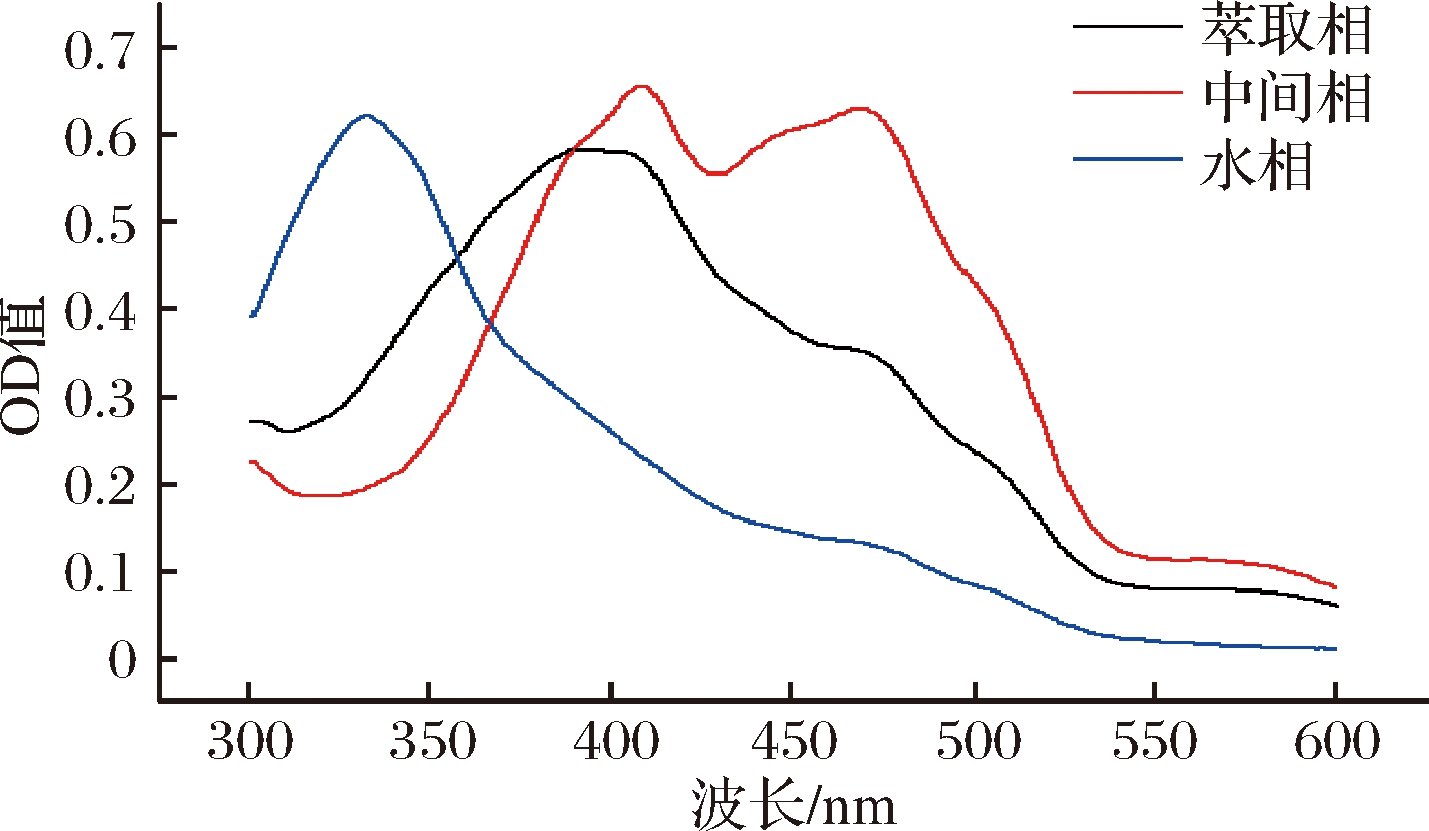
图5 红曲色素提取液在300~600 nm的扫描图
Fig.5 Scanning curves of the ethanol extracts of the pigments from the three phase
注:水相层峰值波长,332 nm; 中间相层峰值波长408、468 nm;萃取相层峰值波长,391、468 nm
由图5可知,上层萃取相层色素的波峰对应波长是391 nm,说明是黄色素;在468 nm处有一转折峰,说明萃取相中有少量橙色素;在中间层,2个峰所对应波长分别是408和468 nm,色价几乎相同,说明中间层相中主要是黄色素和橙色素。下层水相中主要是黄色素,但其波峰所对应波长是332 nm,该色素和上层相及中间层的黄色素有所不同;在468 nm处,有一转折峰,说明水相中也有少量橙色素;据图5扫描图中的3条曲线,可以初步认为,发酵液中至少有3种黄色素:其波峰所对应波长分别在332、 391和408 nm。发酵液中也有橙色素,其特征吸收峰所对应的波长在468 nm处,而且橙色素主要分布在中间层。
图5所显示的3种红曲色素提取液在300~600 nm的扫描图谱的峰值所对应的特征波长,进一步证实了图4所显示的3种红曲色素提取液外观颜色。依据色素产品的外观颜色及扫描图形特征,可以大体上判断其色调的类型(红、黄、橙、紫等色调),即对色素的色调进行初步定性。但从外观颜色及扫描图均无法准确得知是哪种色素。
2.3 色素萃取液的板层析分离
用板层析法对图3所示的三相色素提取液进行了展开。同时做了1种红曲米萃取液。如图6所示,条带1的上层萃取相和条带2的中间相的色素条带很多,橙、黄、红三类色素都有,但主要是橙色素和黄色素。条带3的下层水相主要是黄色素,但相对含量均较低,下层水相中没有红色素,但有水溶性橙色素(未上移)。红曲米的萃取液中含有大量的红色素或紫红色素条带,同时含有橙、黄色素。
纵观层析板上的色带,紫色红曲菌W-2发酵液中至少有橙色素10种,黄色素13种。图6所示的上层萃取相的色素种类最多,在可见光下其肉眼可见的色素条带至少有20种;中间层相的色素条带至少有13种;上层萃取相和中间相,相对含量较多的是2种橙色素,即编号为21和23的色素条带,其Rf值分别为0.604和0.642(表1)。
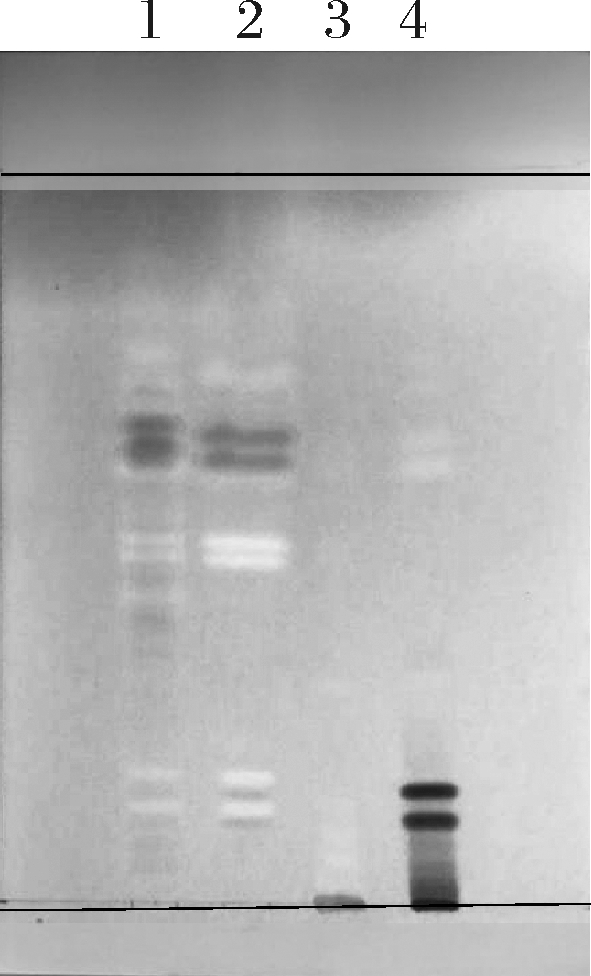
1-上层萃取相色带; 2-中间层相色带;3-下层水相色带;4-红曲米萃取液色带
图6 红曲色素的板层析
Fig.6 Thin layer Chromatography of the Monascus pigments
表1 色素板层析分离的有关数据
Table 1 Rf values of the pigments in the thin layer chromatography
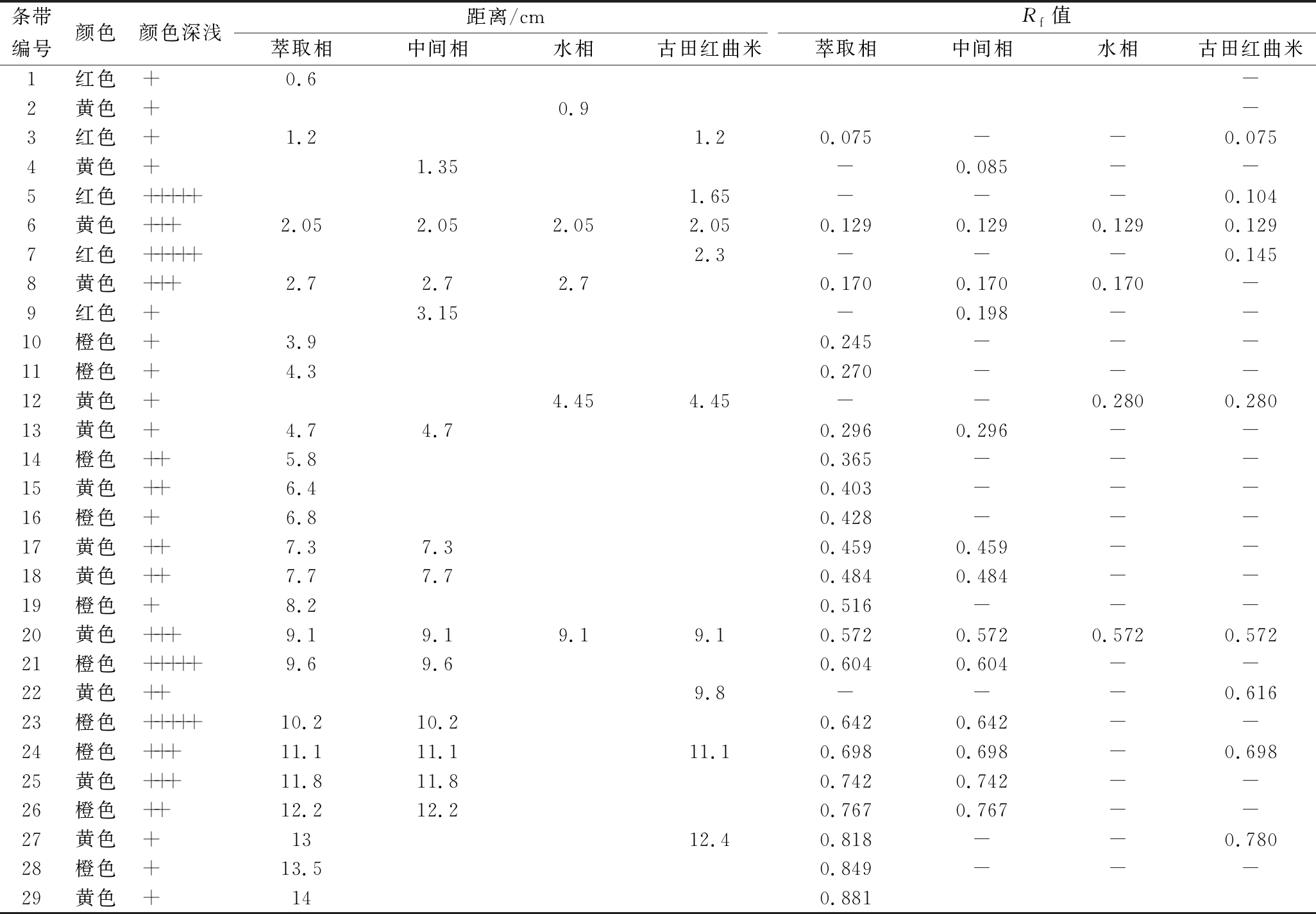
条带颜色颜色深浅距离/cmRf值编号萃取相中间相水相古田红曲米萃取相中间相水相古田红曲米1红色+0.6-2黄色+0.9-3红色+1.21.20.075 -- 0.075 4黄色+1.35- 0.085 --5红色+++++1.65--- 0.104 6黄色+++2.052.052.052.050.129 0.129 0.129 0.129 7红色+++++2.3--- 0.145 8黄色+++2.72.72.70.170 0.170 0.170 -9红色+3.15- 0.198 --10橙色+3.90.245 ---11橙色+4.30.270 ---12黄色+4.454.45-- 0.280 0.280 13黄色+4.74.70.296 0.296 --14橙色++5.80.365 ---15黄色++6.40.403 ---16橙色+6.80.428 ---17黄色++7.37.30.459 0.459 --18黄色++7.77.70.484 0.484 --19橙色+8.20.516 ---20黄色+++9.19.19.19.10.572 0.572 0.572 0.572 21橙色+++++9.69.60.604 0.604 --22黄色++9.8--- 0.616 23橙色+++++10.210.20.642 0.642 --24橙色+++11.111.111.10.698 0.698 - 0.698 25黄色+++11.811.80.742 0.742 --26橙色++12.212.20.767 0.767 --27黄色+1312.40.818 -- 0.780 28橙色+13.50.849 ---29黄色+140.881
注:“+”越多代表颜色越深
3 结论
根据上述实验结果,可以得出以下结论:
(1)无论是固态还是液态发酵,红曲菌产生多种色素。有水溶性色素,更多的则是油溶性色素,本实验紫色红曲菌的发酵液中含有较丰富的黄色素,其次是橙色素,大多是醇溶性。
(2)当色素稀释后可根据肉眼观察色素的颜色,并初步判断其色调(红、橙或黄色)。
(3)根据可见光300~600 nm光谱扫描图的特征,可大致区别色素的种类,并可以对色素的相对含量作出计算,但严格来说想要用分光光度计法来进行准确的定性和定量检测,是不够的。
(4)板层析法可以直接观察到样品中色素的类型(色调)及其种类,并可计算其比移值,从而对每一种色素进行初步的定性,并对每一种色素的相对含量作出评估。
(5)板层析法和分光光度计法相结合,也许是目前对色素进行初步定性及定量的较简便实用方法。
[1] 陈家文.水溶性红曲色素工业性试验研究[J].食品与发酵工业,2000,28(1):21-25.
[2] 刘松青.液体发酵工业化生产红曲色素的研究[J].中国调味品,1996(3):17-19.
[3] 翁照南,方展瑞,张敏,等.液体深层发酵生产红曲红色素的研究[J].现代食品科技,1998,14(1):16-18.
[4] 高玉荣,孙文红,盛艳.玉米固态发酵产红曲红色素补加营养物的优化[J].农业工程学报,2008,24(12):291-294.
[5] 许赣荣,王永辉,张薄博,等.一种不含桔霉素的红曲红色素提取纯化生产工艺:中国,CN201210409242.7 [P].2012-10-24.
[6] 周建建.高色价红曲红色素液态深层发酵工艺的研究[D].济南:齐鲁工业大学,2013.
[7] CHEN Mingjen,WU Mingder,CHEN Ihsheng,et al.Chemical constituents from the fungus Monascus purpureus and their antifungal activity[J].Phytochemistry Letters,2011,4(3):372-376.
[8] 周波,王菊芳,吴振强,等.高产红曲黄色素菌株的选育[J].微生物学通报,2008,35(12):1 909-1 914.
[9] 黄艳,王璐,毛鹏.等.红曲液态发酵生产橙、黄色素及其色调研究[J].食品工业科技,2014,35(19):142-145.
[10] XIONG Xu,ZHANG Xuehong,WU Zhenqiang,et al.Accumulation of yellow Monascus pigments by extractive fermentation in nonionic surfactant micelle aqueous solution[J].Applied Microbiology & Biotechnology,2015,99(3):1 173-1 180.
[11] 李健.水溶性红曲黄色素的分离纯化与结构鉴定[D].福州:福建农林大学,2010.
[12] CHEN Waning,CHEN Runfa,LIU Qingpei,et al.Orange, red, yellow: Biosynthesis of azaphilone pigments in Monascus fungi[J].Chemical Science,2017,8(7):4 917-4 925.
[13] 毛鹏.红曲黄色素液态发酵技术研究 [D].无锡:江南大学,2015.
[14] 许赣荣,顾玉梅,吴苗叶,等.红曲色素的色调及发酵工艺条件对色调的影响[J].食品与发酵工业,2002,28(7):12-16.
[15] 郭东川,吴诚华.红曲色素的两种新结构[J].菌物学报,1993,15(1):65-70.
[16] VANDAMME E J,REVUELTA J L.Industrial Biotechnology of Vitamins, Biopigments, and Antioxidants || Industrial Fermentation of Vitamin C [M].Wiley:VCH Verlag GmbH & Co. KGaA,2016.
[17] 崔莉,胡晓丹,张德权.HPLC法同时测定红曲色素中的红曲素和安卡红曲黄素[J].食品科学,2009,30(8):147-150.
[18] HAJJAJ H,GROUDDAC E,GOMA G,et al.Improvement of red pigmet/citrinin production ratio as a function of environmental conditions by Monascus rubber[J].Biotechnology and Bioengineering,1999,64(4):497-501.
[19] GB 1886181—2016 食品安全国家标准 食品添加剂 红曲红[S].北京:中华人民共和国国家卫生和计划生育委员会,2016.
[20] GB 1886.66—2015 食品安全国家标准 食品添加剂 红曲黄色素[S].北京:中华人民共和国国家卫生和计划生育委员会,2015.
[21] GB 1886.19—2015 食品安全国家标准 食品添加剂 红曲米(粉)[S].北京:中华人民共和国国家卫生和计划生育委员会,2015.
[22] ZHENG Yunquan,XIN Yanwen,GUO Yang.Study on the fingerprint profile of Monascus products with HPLC-FD, PAD and MS[J].Food Chemistry,2009,113(2):705-711.