近年来,可降解和可食性食品包装材料备受关注。其中,多糖和蛋白质等可食用薄膜的优势已有了一定的研究[1-2]。乳清分离蛋白(whey protein isolate,WPI)是一种高质量的动物全价蛋白,易于消化和吸收,具有很高的营养价值,含有多种必需氨基酸和生物活性成分。此外,乳清分离蛋白薄膜具有良好的机械性能和氧气阻隔性能[3]。酪蛋白酸钠(sodium caseinate,NaCas)是一种可溶性的磷酸钙化合物,其中含有人体所需的多种氨基酸和微量元素,具有良好的成膜性和水溶性[4]。普鲁兰多糖(pullulan)是一种水溶性微生物多糖,由金黄色芽孢杆菌发酵产生[5];由普鲁兰多糖制成的薄膜无色透明,具有良好的阻气性[6]、阻油性和热封性,其涂层材料可用于水果和蔬菜的保鲜[7],与其他有机聚合物材料相比,无毒且易于降解[8]。但是,单纯的普鲁兰多糖薄膜易碎,为此,通常会添加混合其他物质改良使用[9]。
美拉德反应是一种非酶褐变,广泛应用于食品工业。它是羰基化合物和氨基化合物之间的反应,经过复杂的过程后,会产生许多美拉德反应产物。美拉德反应产物的功能性一直是研究的热点。如,QIAN等[10]已经研究了美拉德反应产物的DPPH自由基清除活性,以及OH等[11]研究了还原力和Fe2+螯合活性的方法。这些研究均发现蛋白质与糖类发生美拉德反应后抗氧化活性有所增加。KCHAOU等[12]还发现美拉德反应产物能够改善鱼明胶基薄膜的物理化学、感官和生物学特性。
本课题前期研究中,陈桂云等[13]研究了乳清分离蛋白、酪蛋白酸钠和海藻酸钠复合薄膜的包装性能;寻倩男等[14]研究了酪蛋白酸钠和明胶复合薄膜的包装性能。与纯蛋白薄膜相比,海藻酸钠与明胶等多糖的添加,提高了薄膜的柔韧性、透光率等,但因为多糖本身的属性,也增大了薄膜的水溶性,降低了水蒸气及氧气阻隔性,限制了薄膜在食品包装中的广泛应用。
为此,本研究拟通过构建蛋白质-多糖美拉德反应的改性方法,以期提高复合薄膜的疏水性、阻隔性并开发其抗氧化性等功能特性,从而进一步拓展可食性薄膜的应用领域。
1 材料与方法
1.1 材料与仪器
乳清分离蛋白(蛋白质含量>98%),Isopure公司(美国);酪蛋白酸钠(蛋白质含量>99.21%),上海麦克林生化科技有限公司(中国);普鲁兰多糖(多糖含量>98%),萨恩化学技术(上海)有限公司;甘油,上海酷灵精细化工有限公司。
OX-TRAN 2/21氧气透过率测试仪,美国膜康公司;Nicolet iS10傅立叶红外光谱仪,美国赛默飞世尔科技有限公司;S3400N型扫描电镜,日本日立公司;U-3900分光光度计,日本日立公司;CR-400色差仪,日本柯尼卡美能达公司;W-B-31D水蒸气透过率测试仪,广州西唐机电科技有限公司;XLW(EC)型智能电子拉力试验机,济南蓝光机电技术有限公司;DF-101S磁力搅拌器,河南雨花仪器公司;DHG-9045A型恒温鼓风干燥箱,上海一恒科学仪器有限公司;恒温恒湿箱,上海一恒科技有限公司;WGT-S透光率/雾度测试仪,上海精科有限公司。
1.2 试验方法
1.2.1 薄膜的制备
将乳清分离蛋白,酪蛋白酸钠和普鲁兰多糖分别溶解在去离子水中;用磁力搅拌器在室温下连续搅拌2 h,直到完全溶解。将乳清分离蛋白溶液和酪蛋白酸钠溶液置于85 ℃的水浴中搅拌30 min后以体积比1∶1混合,将混合后的蛋白溶液再与普鲁兰多糖溶液分别以体积比1∶3、1∶2、1∶1、2∶1、3∶1混合。在成膜溶液中加入35%(占成膜溶液干物质的质量分数)甘油,并在室温下搅拌60 min。将复合溶液真空脱气,并将等量的溶液倒入平皿中,65 ℃的条件下,在恒温鼓风干燥箱中干燥6~8 h,干燥后,从平皿上揭下薄膜。随后,将薄膜置于95 ℃的恒温鼓风干燥箱中加热24 h,以发生美拉德反应。将薄膜在23 ℃、50% RH的条件下置于恒温恒湿箱内平衡48 h以上,然后进行薄膜的各项性能测试。将1∶1的未经过加热处理的薄膜作为对照组进行研究。
1.2.2 薄膜厚度的测定
在每个薄膜样品上选取5个点,采用螺旋测微器进行测量,取其平均值作为薄膜的厚度值。在计算力学性能、透气性能、透湿性能等性能时,采用该参数值。
1.2.3色度测量
根据KCHAOU等[12]的方法,使用色差仪测量薄膜的色度。获得薄膜的L(亮度),a(红/绿)和b(黄/蓝)值。每个样品测3次,取平均值计算。采用公式(1)计算色差(ΔE):
(1)
式中:L,亮度;a,红绿值;b,黄蓝值;L′、a′、b′为标准白板的色度值(L′=94.16,a′=-0.48,b′=4.59)。
采用公式(2)计算薄膜的褐变指数(browning index,BI):
(2)
式中:L,亮度;a,红绿值;b,黄蓝值。
1.2.4 光学性能测量
用透光率测试仪测量薄膜的透光率及雾度。根据夹样器的尺寸将薄膜切好后放置在测试架上,使得光线垂直透过薄膜。每个样品测3次,取平均值。
1.2.5 交联度的测定
交联度根据KCHAOU等[12]的方法进行测量。其原理是使游离氨基与2,4,6-三硝基苯磺酸(TNBS)反应。具体方法为:在40 ℃的条件下,将约10 mg的薄膜浸入复合溶液中2 h,该复合溶液由1 mL的0.01% TNBS溶液和1 mL 4% NaHCO3溶液组成。然后,将2 mL 6 mol/L的HCl添加到该溶液中。溶液在60 ℃的条件下进一步反应90 min以充分水解。最后,用分光光度计在415 nm处测量溶液的吸光度。交联度由公式(3)计算:
交联度![]()
(3)
式中:A,交联薄膜的吸光度;A′,未交联薄膜的吸光度。
1.2.6 薄膜微观结构
使用扫描电子显微镜观察薄膜的横截面的微观结构。薄膜样品浸入液氮中冷冻破碎,然后断裂面朝上,垂直固定在样品盘,并进行喷金处理10 min。使用6 kV的加速电压观察所有样品。
1.2.7 蛋白质结构变化
采用傅立叶红外光谱仪进行FTIR分析。在测试期间,环境湿度保持在35%RH以下。将薄膜样品制成合适的圆形,然后置于样品架上进行扫描。在400~4 000 cm-1扫描,扫描频率为4 cm-1。
1.2.8 机械性能测量
采用电子拉力试验机测定膜样品的抗拉强度和断裂伸长率。将样品切成15 mm×120 mm的长条,初始距离设置为50 mm,速度为300 mm/min。每种样品薄膜测量6次。通过公式(4)计算抗拉强度:
(4)
式中:TS,抗拉强度,MPa;F,薄膜断裂时的最大拉力,N;S,薄膜的横截面积,mm2。
1.2.9 氧气透过率测定
采用氧气透过率测试仪进行测试。用样品切割器将薄膜切成合适的大小,将气源的压力调节至0.5 MPa,薄膜两侧压力为0.1 MPa,在恒定温度23 ℃下测定薄膜的透氧率。所选的薄膜不应有破损或气泡。
1.2.10 水蒸气透过率测定
薄膜的水蒸气透过率(water vapor permeability,WVP)采用水蒸气透过率测试仪进行测试。用样品切割器将薄膜切成合适的尺寸,样品杯中放适量的氧化钙,将样品固定在样品杯中后放置于测试腔中,采用增重法,相对湿度为90% RH,试验温度为38 ℃。
水蒸气渗透率的计算如公式(5)所示:
(6)
式中:G,质量变化,g;t,时间,h;A,测试面积,m2;T,测试样品的厚度,mm;ΔP,薄膜两侧的水蒸气的分压差。
1.2.11 抗氧化活性的测定
在评估美拉德反应产物的抗氧化活性时,由于这些化合物的复杂性,必须使用多种测定方法[15]。因此,基于WPI-NaCas-Pullulan膜的DPPH自由基清除活性,还原能力和总抗氧化剂活性来确定其抗氧化活性。
1.2.11.1 清除自由基活性(free redical-scavenging activity,FRSA)
如KCHAOU等[12]的方法,在此基础上进行了部分改进,对薄膜的DPPH自由基清除活性进行了测定。将薄膜分别切成小块(m=20 mg),放入离心管中,再分别加入1 000 μL的蒸馏水、750 μL的99.5%(体积分数)乙醇和250 μL的0.02 mmol/L DPPH的99%(体积分数)乙醇溶液。将混合物在室温下避光放置24 h后,采用分光光度计在517 nm处测量。除薄膜样品外,对照组以相同方式进行。FRSA计算如公式(6)所示:
(6)
式中:AC, DPPH溶液的吸光度;AS,包含薄膜样品的DPPH溶液的吸光度;Ab,不添加DPPH溶液的包含膜样品的空白管的吸光度。
1.2.11.2 还原能力
用MATMAROH等[16]的方法,在此基础上进行了部分改进,对薄膜的还原能力进行测定。称约10 μg样品放于离心管中,分别加入0.5 mL蒸馏水、1.25 mL的0.2 mol/L磷酸盐缓冲液和1.25 mL的10 g/100mL铁氰化钾,50 ℃水浴3 h。然后,取1 mL反应溶液,加入500 μL的10 g/100mL三氯乙酸。将混合溶液以3 000 r/min离心10 min,将1.25 mL上清液与1.25 mL蒸馏水和0.25 mL 0.1 g/100mL氯化铁混合。反应10 min后,采用分光光度计在700 nm处测量所得溶液的吸光度值。反应混合物的吸光度越高,还原能力越强。
1.2.11.3 总抗氧化活性
根据PRIETO等[17]的方法测定薄膜的总抗氧化活性。该方法是使用样品在酸性条件下将Mo(Ⅵ)还原为Mo(Ⅴ)并形成绿色磷酸盐/ Mo(Ⅴ)络合物。将薄膜样品切成30 mg的小块放入离心管中,加入0.3 mL蒸馏水和3 mL试剂溶液(0.6 mol/L硫酸,28 mmol/L磷酸钠和4 mmol/L钼酸铵)。然后,将离心管密封并在90 ℃水浴下放置90 min。之后,将样品冷却至室温,并在695 nm下测量其吸光度。按公式(7)将薄膜的总抗氧化活性表示为α-生育酚当量:
A=0.011Ctoc+0.004 9 R2=0.987
(7)
式中:A,薄膜在695 nm处的吸光度;Ctoc,以α-生育酚当量计的浓度,μmol/mL。
1.2.12 统计分析
采用SPSS 22.0软件对数据进行统计处理和分析。数据表示为平均值±标准差,并通过SNK方法进行显著性分析(P<0.05)[18]。Origin 9.0用于图形绘制。
2 结果与分析
2.1 色度和光学特性的变化
经过美拉德反应后的薄膜的颜色从淡黄色变为棕色。棕色的产生与蛋白质和多糖美拉德反应作用有关。整体来看,与对照组薄膜样品相比,经过处理的各组薄膜的L值均有下降;a、b值均有提高。ΔE提高了9.58~13.31倍(表1)。
表1 WPI-NaCas-pullulan薄膜的色度和光学特性
Table 1 Color parameters and optical properties of WPI-NaCas-pullulan films

组别体积比反应时间 /hLabΔEBI透光率/%A1∶10(对照组)91.627±1.121a0.360±0.235d7.857±0.774e4.255±1.200e8.942±0.823e78.800±1.670aB1∶32473.283±2.461d9.797±0.466a56.163±1.026a56.623±0.156a135.461±4.201a62.900±1.947cC1∶22476.537±0.448c6.857±0.385b53.073±0.748b52.107±0.875b113.151±3.650b66.333±3.700cD1∶12482.217±2.175b3.347±1.373c43.347±1.631d40.774±2.115d74.031±6.862d71.900±0.656bE2∶12477.530±0.387c3.697±0.456c48.710±1.949c47.339±1.880c94.871±6.043c62.967±2.329cF3∶12476.327±0.137c5.937±0.251b55.537±0.067a54.358±0.137ab120.705±0.830b55.167±3.355d
注:同列不同字母表示存在显著性差异(P<0.05)
除了色度值外,褐变指数BI值也能表征美拉德反应的程度[19]。与对照组薄膜相比,各组经过处理后的薄膜的BI值提高了8.27~15.15倍。通过颜色变化,可以得知复合蛋白质与普鲁兰多糖比例为1∶3(体积比)时,美拉德反应最为剧烈。
纯的普鲁兰多糖膜无色透明,与乳清分离蛋白和酪蛋白酸钠混合成膜后透光率降低,雾度均提高;经过美拉德反应后,薄膜颜色变为棕色,各组薄膜的透光率进一步降低8.76%~29.99%,产生了避光作用,可应用于需避光保存及易氧化的物品包装。
2.2 交联度变化
图1显示了WPI -NaCas-pullulan薄膜的交联度,该方法基于非交联薄膜和交联薄膜中游离氨基的测定。在美拉德反应的早期,含游离氨基的蛋白质,如赖氨酸的ε-NH2基团,会与普鲁兰多糖的羰基反应,导致游离氨基的损失[20]。这种交联的定量化学方法证实了而后讨论的定性FTIR数据,表明了在热处理后通过还原糖使糖基化。对于1∶3组经处理后的薄膜,交联度达到最大约84.033%。从该结果来看,比例为1∶3、3∶1的膜的交联度高于其他组。这可能是因为多糖与蛋白质分别在反应中过量,可以完全反应。并且过量的多糖可作为增塑剂,这对交联度、机械性能和阻隔性能都有影响。
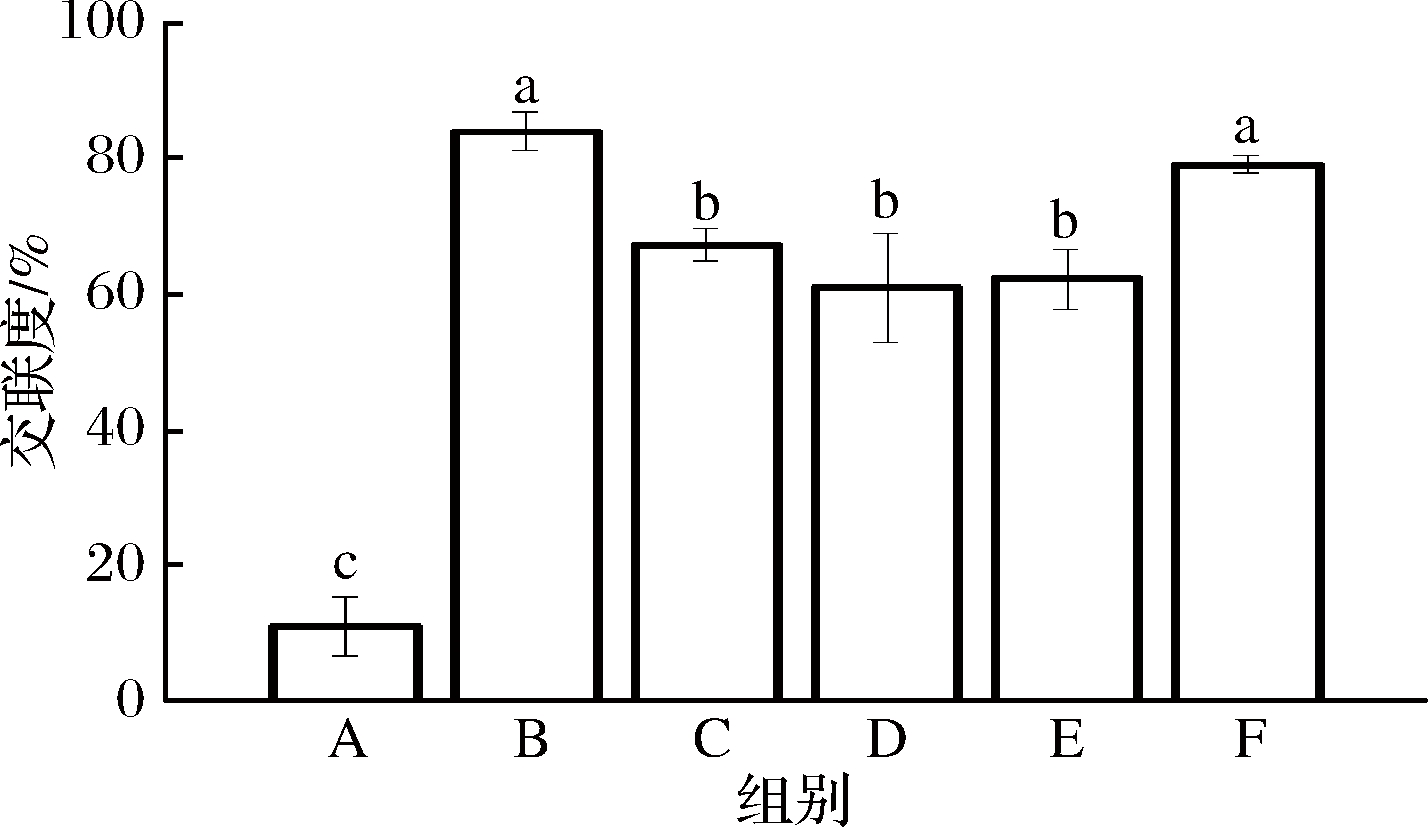
图1 不同比例的WPI -NaCas-pullulan薄膜的交联度
Fig.1 Degree of crosslinking of WPI-NaCas-pullulan-based films of different ratios
注:不同字母表示存在显著性差异(P<0.05)(下同)
2.3 薄膜的微观结构
图2是WPI-NaCas-pullulan薄膜横截面的电镜图。由图2可以看出,图2-a显示的对照组薄膜截面粗糙、有较多褶皱和孔洞;图2-b和图2-c显示的实验组薄膜截面褶皱较少,光滑且致密,孔洞较少。由此可知,经过美拉德反应处理的薄膜截面光滑、致密且孔洞较少。由B、D组间对照,可看出,普鲁兰多糖添加量越多,截面越光滑致密,这与交联度和阻氧性变化的结果相一致。

a-A组薄膜(对照组);b-B组薄膜;c-D组薄膜
图2 不同比例的WPI -NaCas-pullulan薄膜的电镜图
Fig.2 The SEM photograph of WPI-NaCas-pullulan-based films of different ratios
2.4 蛋白质结构变化
采用FTIR光谱法研究了美拉德反应引起的薄膜蛋白质结构的化学变化,如图3所示,所有光谱均显示在1 636、1 535和1 239 cm-1处蛋白质的特征酰胺的吸收,分别对应于酰胺I(C![]() O拉伸/氢键与COO偶联),酰胺II(由NH基团的弯曲振动和CN基团的振动)和酰胺Ⅲ(代表结合酰胺的CN和NH基团在平面上的振动或甘氨酸的CH2基团的振动)[12]。蛋白链和多糖分子间的相互作用通过谱带位置的变化表示。此外,所有薄膜样品均显示在1 046 cm-1处检测到的谱带,该谱带对应于羟基[19]。在实验组的薄膜中,对于1∶3的比例,分别观察到酰胺I和酰胺II峰从1 636~1 629 cm-1和从1 535~1 542 cm-1的微小变化。减少的波数揭示了蛋白质的构象从螺旋到无规卷曲的变化以及分子顺序的减少。由于羟基缩合,形成醚键,其特征吸附在1 050~1 110 cm-1内。醛糖和蛋白质的氨基残基之间的美拉德反应过程诱导了糖胺类糖胺的产生,该产物变成了Amadori重排产物。后者在pH低于7时产生羟甲基糠醛或其他类型糠醛的席夫碱。
O拉伸/氢键与COO偶联),酰胺II(由NH基团的弯曲振动和CN基团的振动)和酰胺Ⅲ(代表结合酰胺的CN和NH基团在平面上的振动或甘氨酸的CH2基团的振动)[12]。蛋白链和多糖分子间的相互作用通过谱带位置的变化表示。此外,所有薄膜样品均显示在1 046 cm-1处检测到的谱带,该谱带对应于羟基[19]。在实验组的薄膜中,对于1∶3的比例,分别观察到酰胺I和酰胺II峰从1 636~1 629 cm-1和从1 535~1 542 cm-1的微小变化。减少的波数揭示了蛋白质的构象从螺旋到无规卷曲的变化以及分子顺序的减少。由于羟基缩合,形成醚键,其特征吸附在1 050~1 110 cm-1内。醛糖和蛋白质的氨基残基之间的美拉德反应过程诱导了糖胺类糖胺的产生,该产物变成了Amadori重排产物。后者在pH低于7时产生羟甲基糠醛或其他类型糠醛的席夫碱。
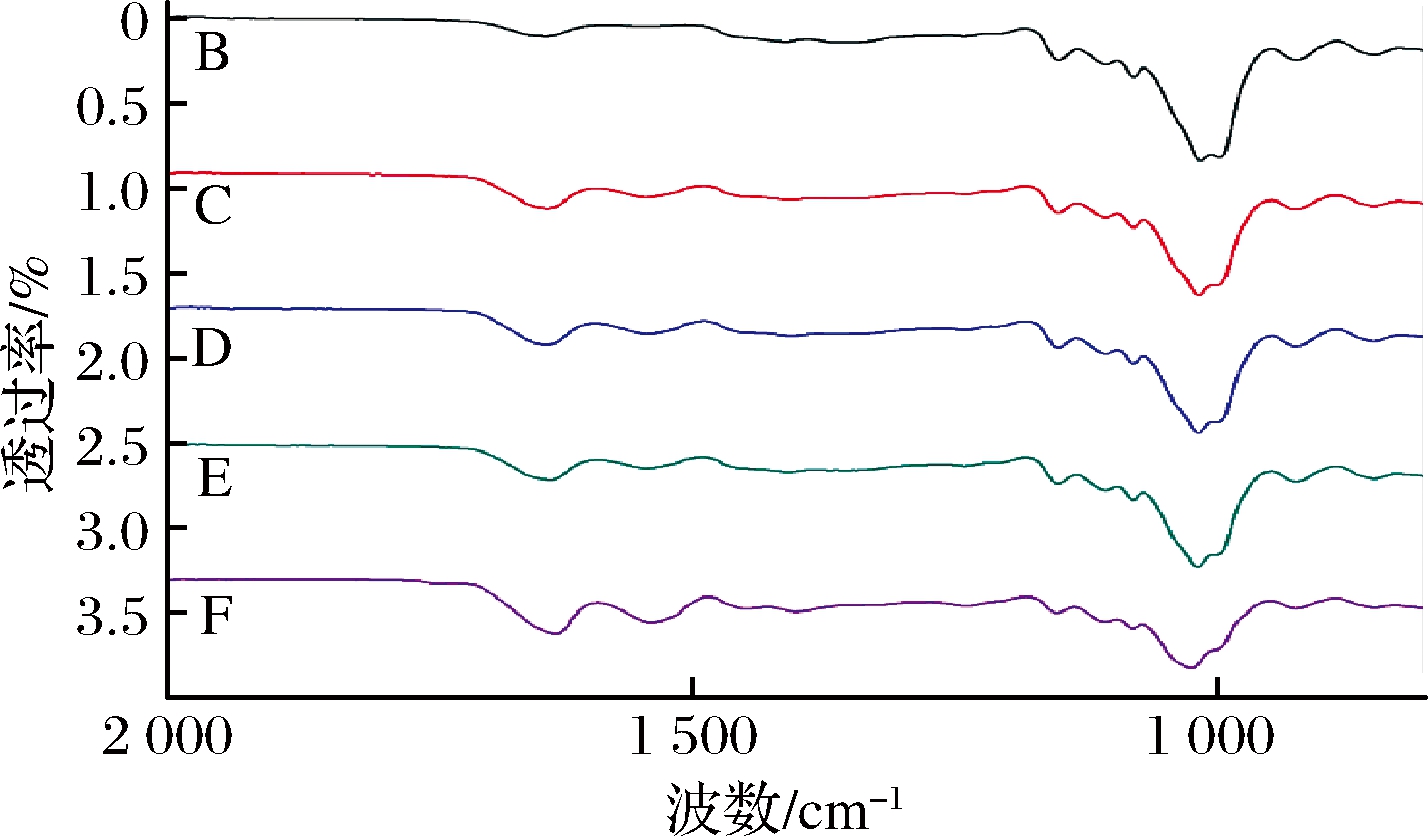
图3 不同比例的WPI-NaCas-pullulan薄膜的FTIR光谱
Fig.3 FTIR spectra of WPI-NaCas-pullulan films of different ratios
2.5 机械性能
由于美拉德反应的作用,各组薄膜的抗拉强度值显著提高(图4)。与未处理薄膜相比,F组薄膜的抗拉强度与对照组相比,提高了约2.42倍;在各组薄膜中,WPI-NaCas主要赋予材料强度硬度,pullulan则赋予材料塑性。实验发现,各组样品中,抗拉强度最大的为F组,这是因为该组的交联度较高,且WPI-NaCas含量较高,pullulan含量低,薄膜的硬度和脆度增大。然而,随着薄膜强度、硬度的提高,其弹塑性下降,因而,美拉德反应导致了薄膜断裂伸长率不同程度的下降。
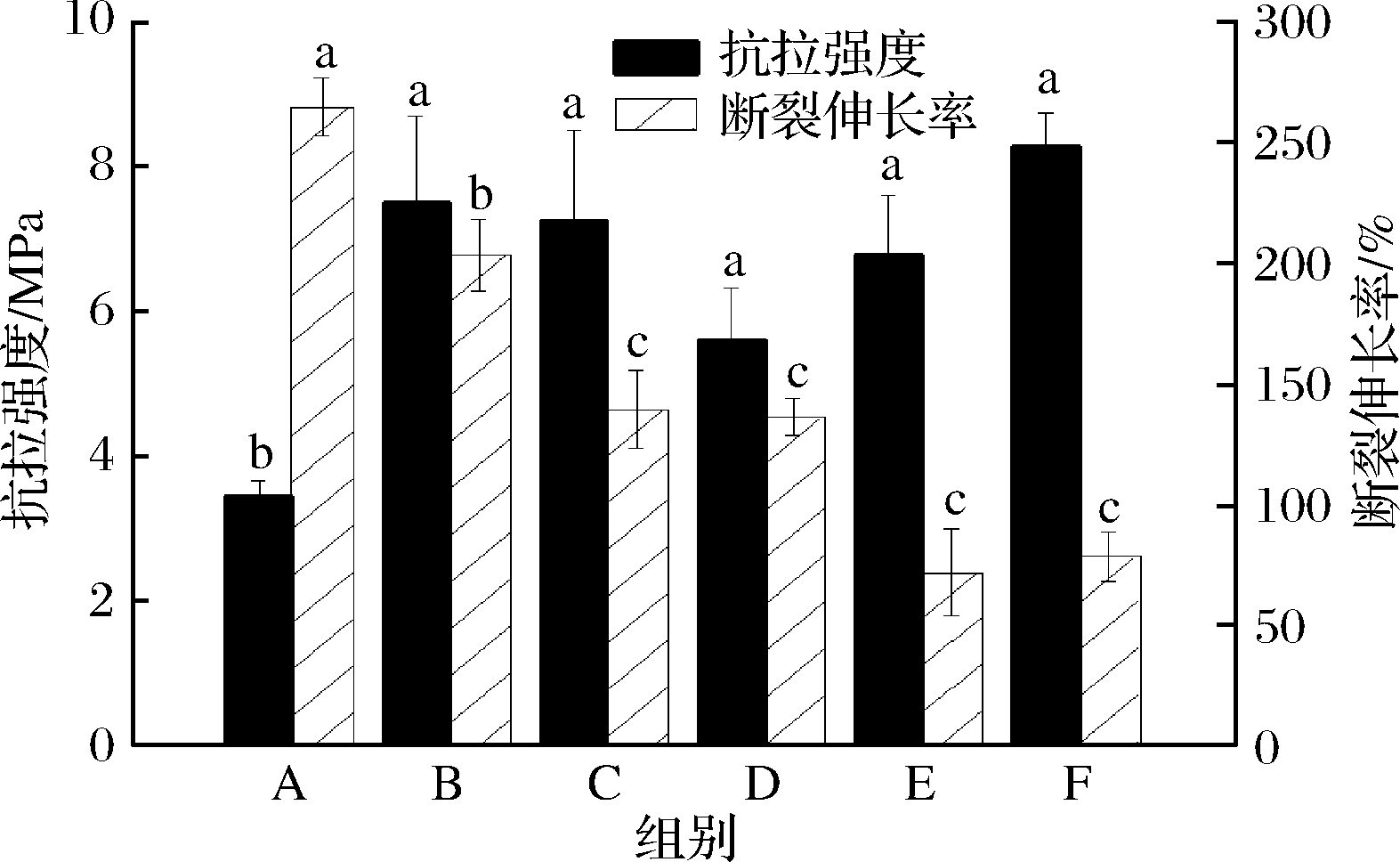
图4 不同比例的WPI-NaCas-pullulan薄膜的机械性能
Fig.4 Mechanical properties of WPI-NaCas-pullulan films of different ratios
2.6 阻氧性能的变化
由图5可以看出,热处理24 h后,由于美拉德反应的交联作用,薄膜的氧气透过率均显著低于对照组薄膜,氧气透过率降低了54.46%~94.19%。其中,B组体现出最优的阻氧性能,这可能是因为足量的多糖充当了交联剂和增塑剂,并通过分子间和分子内折叠产生了异常紧密的结构。
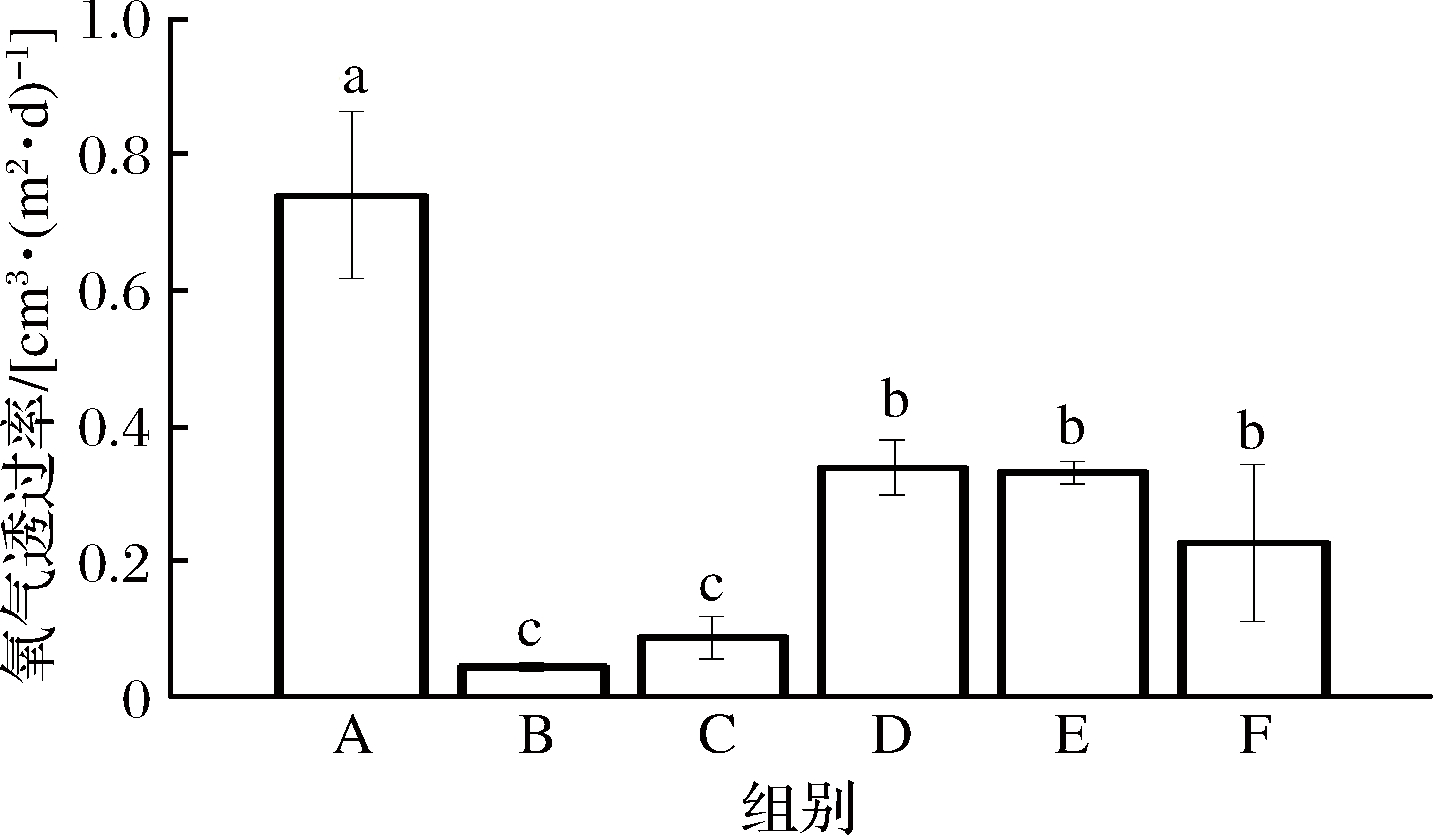
图5 不同比例的WPI-NaCas-pullulan薄膜的氧气透过率
Fig.5 Oxygen transmission rate of WPI-NaCas-pullulan films of different ratios
2.7 水蒸气透过率
复合蛋白膜亲水性导致的高水蒸气透过率一直是限制其应用的因素之一[21]。通过美拉德反应改性,薄膜的水蒸气透过率显著降低了61.07%~94.40%(图6)。美拉德反应使蛋白质分子和多糖分子紧密交联,显著提高了薄膜的疏水性,使得复合蛋白膜的应用前景更为广阔。
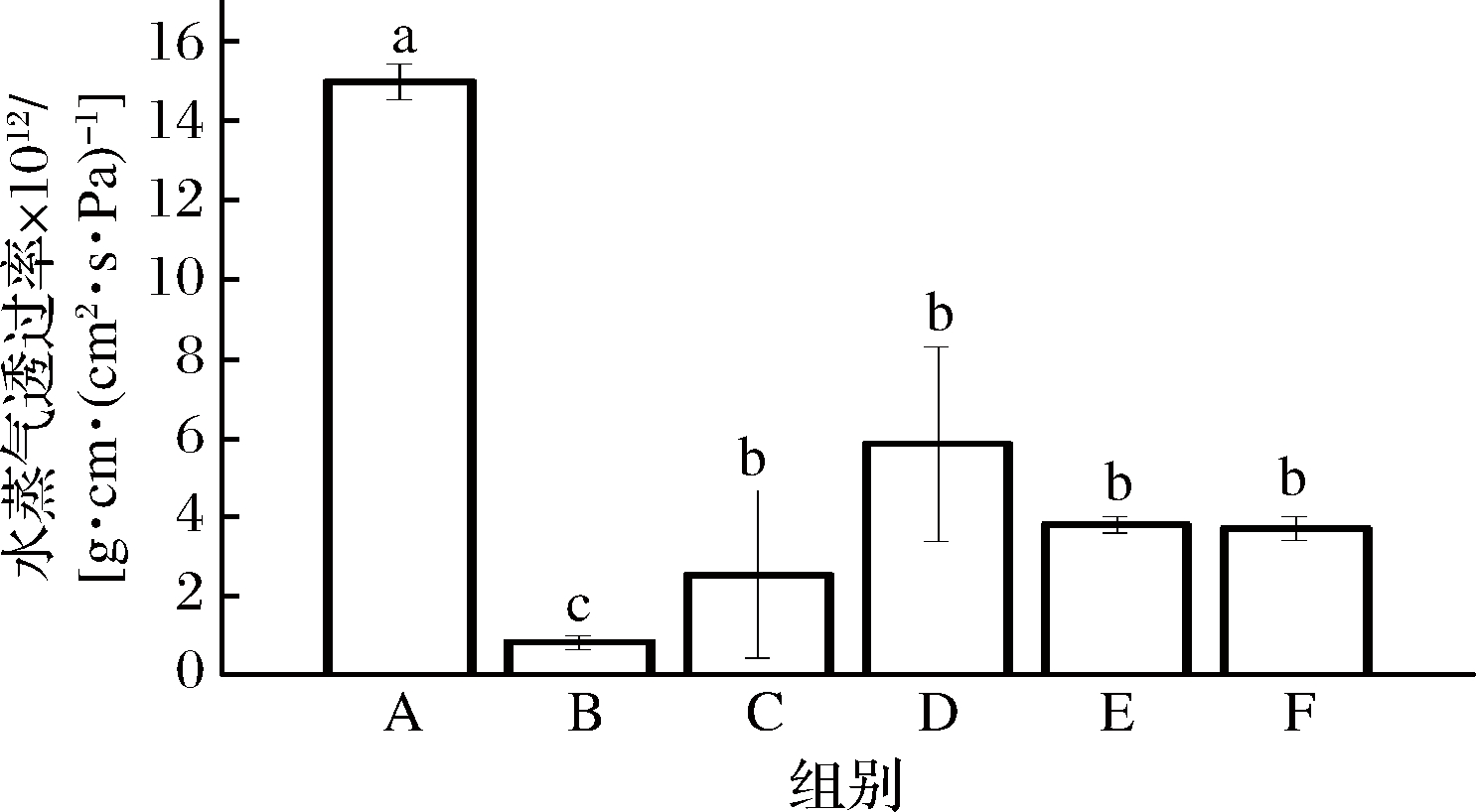
图6 不同比例的WPI-NaCas-pullulan薄膜的水蒸气透过率
Fig.6 Water vapor permeability of WPI-NaCas-pullulan films of different ratios
2.8 美拉德反应活化膜的抗氧化性能
WPI-NaCas-pullulan基薄膜的DPPH自由基清除活性如图7所示。与对照组相比,所有实验组均表现出显著增强的清除自由基活性。薄膜清除DPPH自由基的能力是由于其氢原子转移能力,在经过美拉德反应之后明显增加。B组表现出较高的DPPH自由基清除能力,达到85.613%。实验结果表明,美拉德反应产物具有贡献氢原子的能力,从而稳定了自由基。
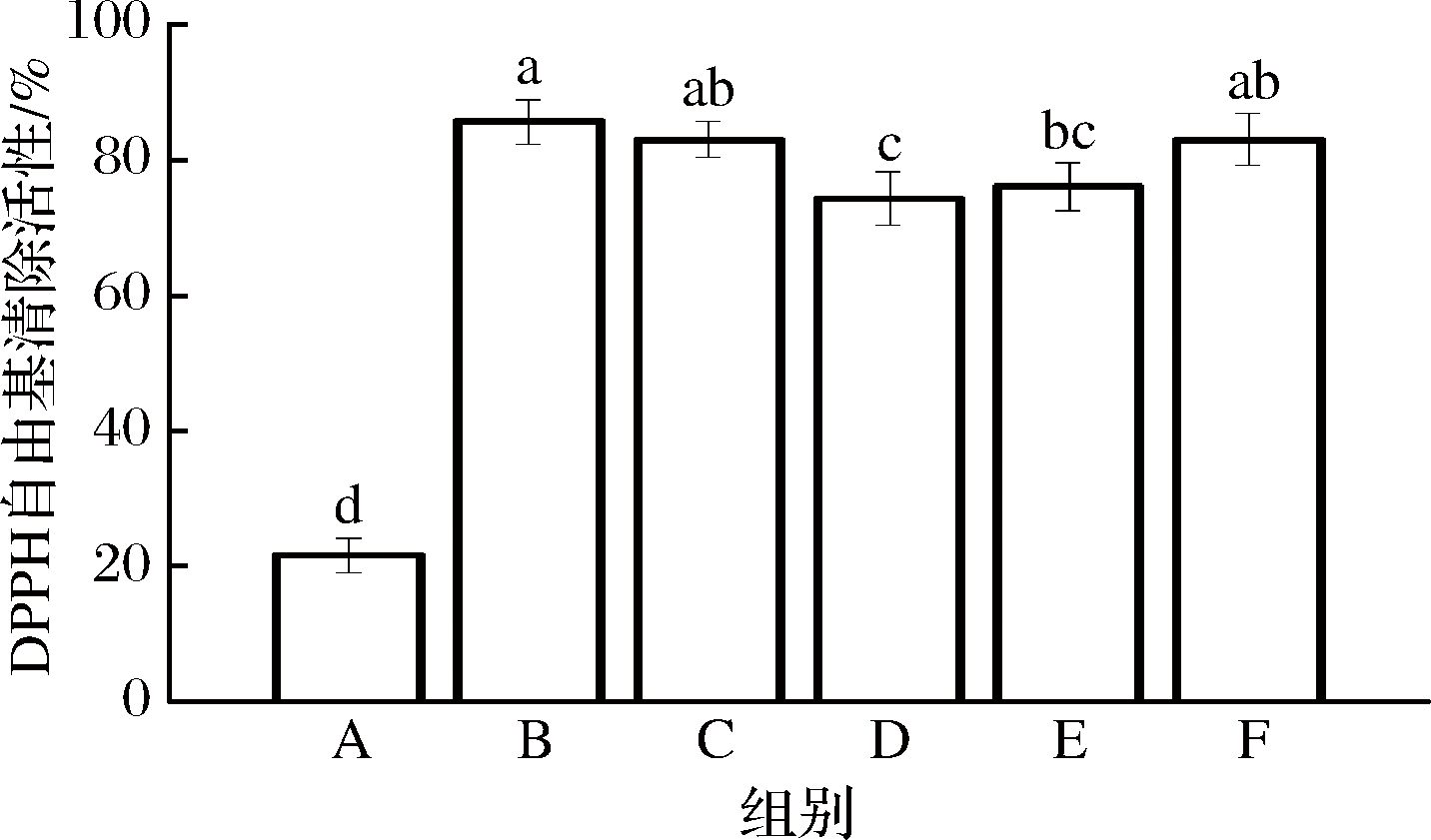
图7 不同比例的WPI-NaCas-pullulan薄膜的DPPH自由基清除能力
Fig.7 DPPH radical scavenging ability of WPI-NaCas-pullulan films of different ratios
WPI-NaCas-pullulan复合膜将三价铁离子转化为亚铁离子的能力如图8所示,结果表明,对照组在700 nm处的吸光度最初分别为1.275,还原能力在美拉德反应后,各组吸光度分别提高到6.853、3.867、3.685、3.715和4.265。图9显示美拉德反应活化处理后的薄膜显示出较高的抗氧化活性,分别达到约489.706、283.524、256.788、261.797和467.433 μmol/mL当量的α-生育酚,抗氧化活性分别为对照组的2.75~5.23倍。
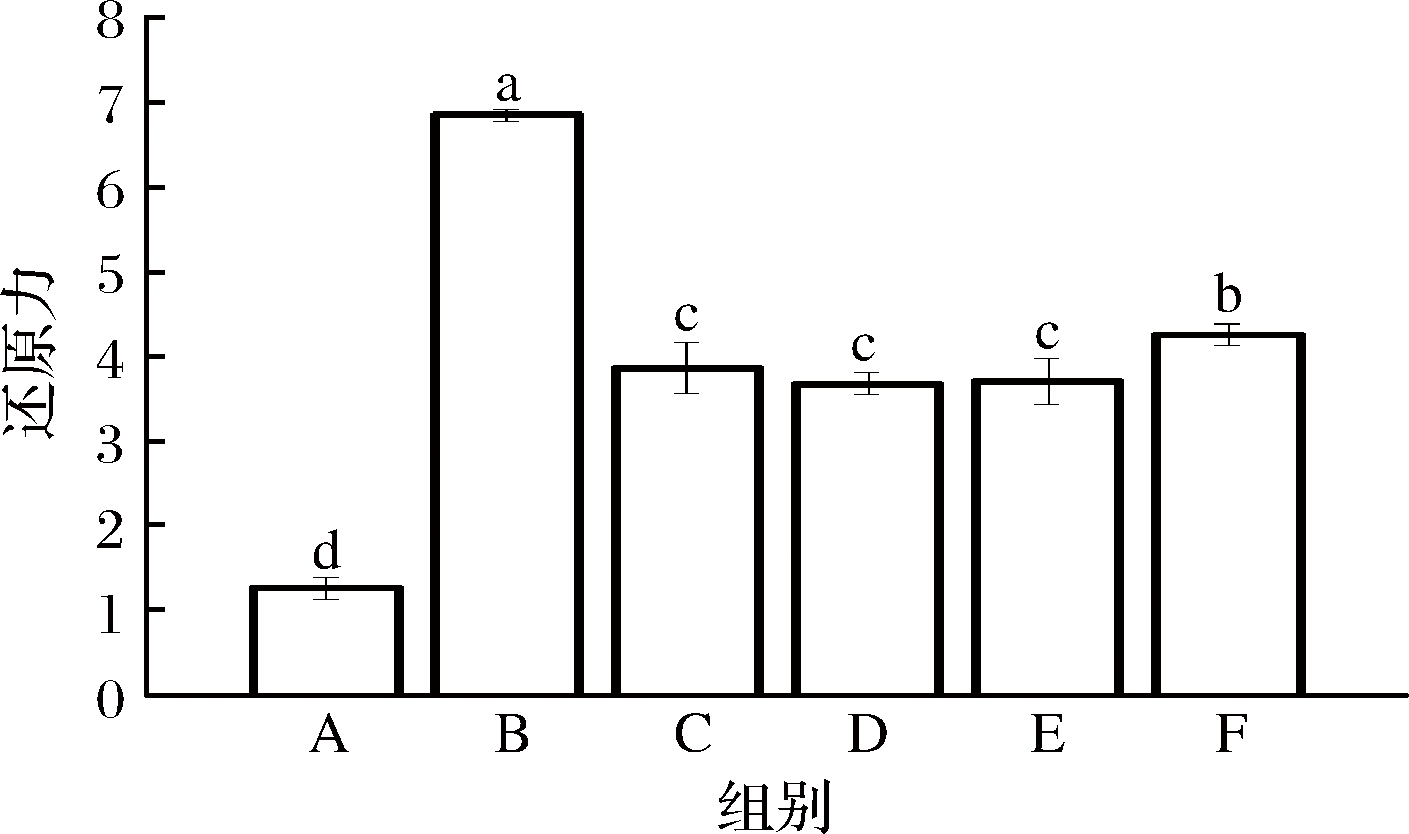
图8 不同比例的WPI-NaCas-pullulan薄膜的还原力
Fig.8 Reducing power of WPI-NaCas-pullulan films of different ratios
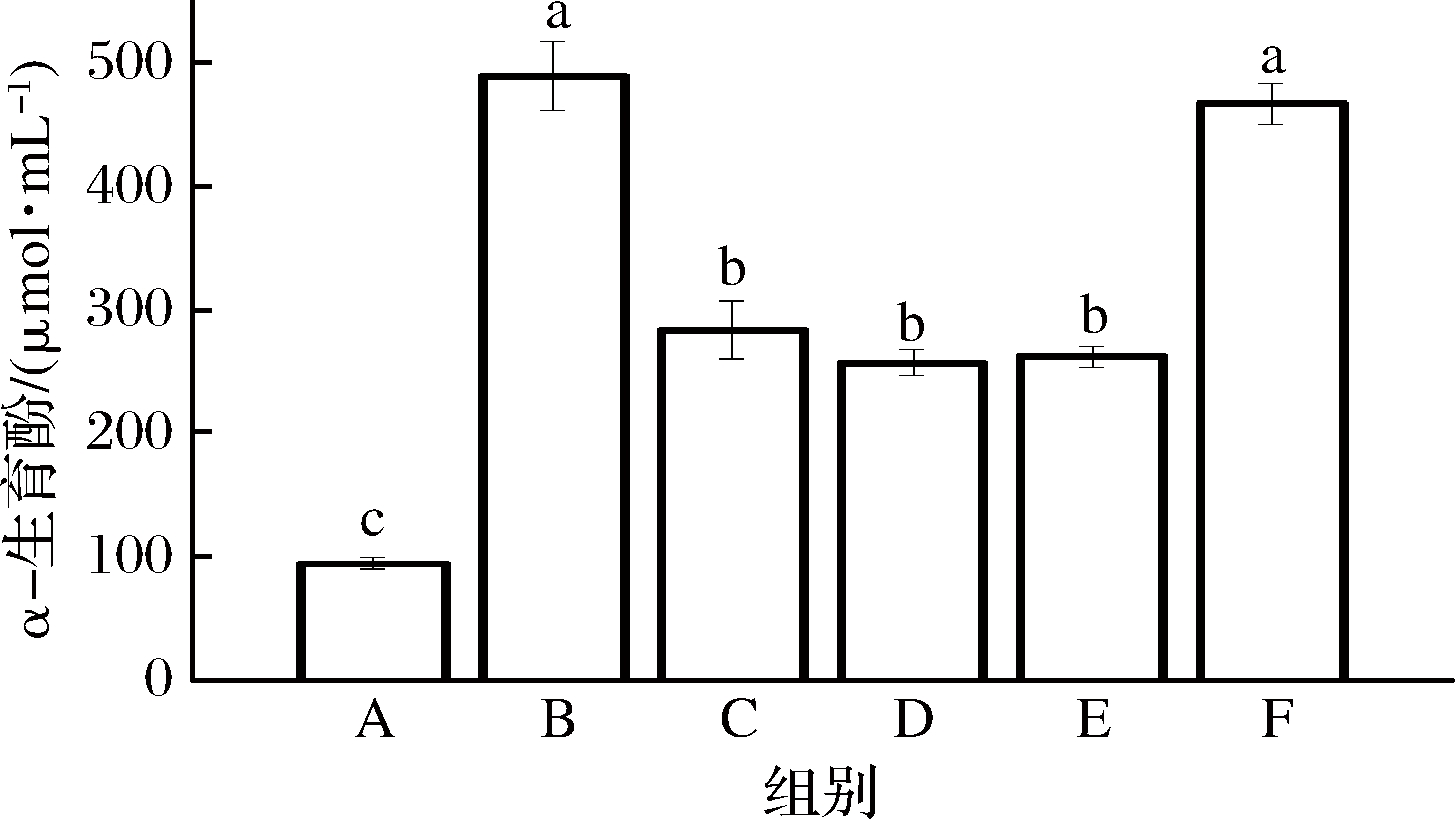
图9 不同比例的WPI-NaCas-pullulan薄膜的总抗氧化活性
Fig.9 Total antioxidant activity of WPI-NaCas-pullulan films of different ratios
实验发现,对照组薄膜样品也存在一定的抗氧化性,这可能是因为在初级薄膜烘干过程中,在较低的温度条件下,已经有微弱的美拉德反应产生。
3 结论
采用热处理诱导美拉德反应活化改性的方法,大大改善了WPI-NaCas-pullulan薄膜的性能,显著提高了薄膜的疏水性、交联度及阻隔性,并赋予了薄膜优良的抗氧化活性。各样品中,当WPI-NaCas/pullulan体积比为1∶3时,薄膜的美拉德反应最为剧烈,改性效果最为显著:交联度达84.033%,氧气透过率为0.043 cm3/(m2·d),水蒸气透过率为8.4×10-13 g·cm/(cm2·s·Pa),DPPH自由基清除率为85.613 %,还原力OD700nm为6.853,总抗氧化活性表现出489.706 μmol/mL当量的α-生育酚。
基于美拉德改性后的WPI-NaCas-pullulan薄膜具有良好的阻氧性及抗氧化性,可应用于包装油脂、肉类以及部分干物料。若将其应用在方便食品调味包内包装中,则既可防止油脂氧化,又由于薄膜有水溶性,极大减少了包装废弃物。为了更好地延长食品的货架期,将其与气调包装相结合,未来将在食品保藏领域发挥更广阔的作用。
[1] MEI J, YUAN Y, WU Y, et al. Characterization of edible starch-chitosan film and its application in the storage of Mongolian cheese[J]. International Journal of Biological Macromolecules, 2013, 57:17-21.
[2] FAKHOURY F M, MARIA M S, CANHADAS B L, et al. Edible films made from blends of manioc starch and gelatin-influence of different types of plasticizer and different levels of macromolecules on their properties[J]. LWT - Food Science and Technology, 2012, 49(1):149-154.
[3] HASSANNIA K M, KHODAIYAN F, SHAHABI G I. Modification of functional properties of pullulan-whey protein bionanocomposite films with nanoclay[J]. Journal of Food Science and Technology,2016, 53(2):1 294-1 302.
[4] LEI Q, PAN J, HUANG Z, et al. Characterization of composite films modified by transglutaminase[J]. Scientific research and essays, 2014, 9(9):391-399.
[5] WU J, ZHONG F, LI Y, et al. Preparation and characterization of pullulan-chitosan and pullulan-carboxymethyl chitosan blended films[J]. Food Hydrocolloids, 2013, 30(1):82-91.
[6] HORINAKA J,HASHIMOTO Y,TAKIGAWA T. Optical and mechanical properties of pullulan films studied by uniaxial stretching[J]. International Journal of Biological Macromolecules, 2018, 118: 584-587.
[7] ![]() A, GNIEWOSZ M, GASZEWSKA M. An attempt to apply a pullulan coating to reduce oxidative changes and mass loss in nuts during storage[J]. Kemiteknik, 2008,58(1):79-84.
A, GNIEWOSZ M, GASZEWSKA M. An attempt to apply a pullulan coating to reduce oxidative changes and mass loss in nuts during storage[J]. Kemiteknik, 2008,58(1):79-84.
[8] CHEN C T, CHEN K I, CHIANG H H, et al. Improvement on physical properties of pullulan films by novel cross-linking strategy[J]. Journal of Food Science,2017, 82(1):108-117.
[9] ISLAM M S, YEUM J H, DAS A K. Effect of pullulan/poly (vinyl alcohol) blend system on the montmorillonite structure with property characterization of electrospun pullulan/poly (vinyl alcohol)/montmorillonite nanofibers[J]. J Colloid Interface Sci,2012, 368(1):273-281.
[10] QIAN L, JING L, KONG B, et al. Antioxidant capacity of maillard reaction products formed by a porcine plasma protein hydrolysate-sugar model system as related to chemical characteristics[J]. Food Science & Biotechnology, 2014, 23(1):33-41.
[11] OH M J,KIM Y, SANG HOON LEE, et al. Prediction of CML contents in the maillard reaction products for casein-monosaccharides model[J]. Food Chemistry, 2017, 267: 271-276.
[12] KCHAOU H, BENBETTA E N, JRIDI M, et al. Enhancement of structural, functional and antioxidant properties of fish gelatin films using maillard reactions[J]. Food Hydrocolloids, 2018, 83:326-339.
[13] 陈桂云,雷桥.海藻酸钠对可食性复合膜性能的影响研究[J]. 食品工业科技,2011,32(12):400-403.
[14] 寻倩男, 雷桥, 包建强.明胶-酪蛋白酸钠可食性膜的包装性能研究[J]. 包装工程, 2013,34(15):40-45.
[15] VHANGANI L N, WYK J V. Antioxidant activity of maillard reaction products (MRPs) in a lipid-rich model system[J]. Food Chemistry,2016, 208(Supplement C), 301-308.
[16] MATMAROH K, BENJAKUL S, TANAKA M. Effect of reactant concentrations on the maillard reaction in a fructose-glycine model system and the inhibition of black tiger shrimp polyphenol oxidase[J]. Food Chemistry, 2006, 98(1):1-8.
[17] PRIETO P, PINEDA M, AGUILAR M. Spectrophotometric quantitation of antioxidant capacity through the formation of a phosphomolybdenum complex: specific application to the determination of vitamin E[J]. Analytical Biochemistry, 1999, 269(2):337-341.
[18] 陈文莹, 杨旭芹, 刘臻, 等. 烹调三种蔬菜对红酸汤中全反式番茄红素含量的影响[J]. 中国调味品, 2019, 44(7): 1-4.
[19] MATIACEVICH S B, BUERA M P. A critical evaluation of fluorescence as a potential marker for the Maillard reaction[J]. Food chemistry, 2006, 95(3):423-430.
[20] SU J F, HUANG Z, YUAN, X Y, et al. Structure and properties of carboxymethyl cellulose/soy protein isolate blend edible films crosslinked by Maillard reactions[J]. Carbohydrate Polymers, 2010,79(1), 145-153.
[21] YIN S W, TANG C H, WEN Q B, et al. Properties of cast films from hemp (Cannabis sativa L.) and soy protein isolates. A comparative study[J]. Journal of Agricultural and Food Chemistry, 2007, 55(18): 7 399-7 404.