果胶是植物性酸性多糖,是重要的膳食纤维来源,其单糖组成、分子质量和分枝结构随植物种类和部位(果、茎、叶和根等)而异[1]。果胶的结构很复杂,特征为: 由α-(1,4)-半乳糖醛酸聚糖构成主干,分为无分枝的同质半乳糖醛酸聚糖(homogalacturonans,HGA)区和分枝区。分枝区有3种分枝片段,第一种为第一型鼠李糖半乳糖醛酸聚糖(rhamnogalacturonan-I,RG-I), 以鼠李糖为分支点键结中性的α-(1,5)-阿拉伯聚糖或β-(1,4)-或β-(1,3; 1,6)-半乳聚糖分枝;第二种为第二型鼠李糖半乳糖醛酸聚糖(rhamnogalacturonan-II,RG-II),含有21~22种糖苷键、6个特殊单糖;第三种为木糖短分枝区(XG) [2-3]。
果胶可作为天然膳食纤维、食品胶凝剂、增稠剂和稳定剂,商业价值高[4]。目前商业果胶主要来自柑橘皮,其次为苹果皮。其他水果加工废弃物也含有丰富果胶, 为了提高果汁加工业的附加价值与减废的目的,提取废弃果皮中的果胶正成为产业增值化的趋势之一。百香果皮含有19%可溶性膳食纤维(以果胶为主)和38%不溶性膳食纤维[5], 所以百香果皮果胶(passion fruit pectin,PFP)的提取与应用研究有重要意义。以商业果胶的酸提法(pH 1~4, 35~97 ℃,10 min-4 h), 可得百香果皮果胶收率为7.5%~25%, 酯化度(degree of esterification,DE)达67%~80%, 属于高甲氧基果胶(high methoxyl pectin,HMP), 收率和DE随着提取的温度、时间、酸液pH值、酸的种类以及辅助处理 (酶、草酸铵、微波和超声波等)而异[5-9]。
然而目前百香果皮果胶的研究大都限于提取条件的优化[5-9]和区分物质的分子特征[9], 尚少有流变性质(如黏度)或食品应用性的研究。已知两价金属离子与果胶的键结作用随果胶分子结构和浓度以及金属离子种类和浓度而异[10-11]。因此,本研究目的在于解析以商业酸提法所得紫色百香果皮果胶的化学与分子特性以及添加Ca2+和Zn2+浓度对PFP溶液黏度特性的影响,以提供百香果皮果胶在特殊流质食品工业应用的理论依据。
1 材料与方法
1.1 材料和设备
材料:紫色百香果果皮,云南猫哆哩集团食品有限责任公司;单糖标准品(阿拉伯糖、葡萄糖、半乳糖、半乳糖醛酸、甘露糖和鼠李糖),Sigma-Aldrich化学公司;KBr(光谱级),上海阿拉丁生化科技股份有限公司;间羟基联苯、CaCl2、ZnCl2,上海源叶生物科技有限公司;HNO3、HCl、NaOH、浓H2SO4、四硼酸钠等分析纯试剂,国药集团化学试剂有限公司;无水乙醇(AR级, Greagent品牌),上海泰坦科技股份有限公司。
分析设备:紫外分光光度计725 型,上海光谱仪器有限公司;DionexTM ICS-5000+ 离子交换色谱系统,美国 Thermo Scientific公司;高效液相色谱联用多角度激光散射(high performance size exclusion chromatography multiangle laser light scattering,HPSEC-MALLS),美国 Wyatt Technology 公司;傅里叶变换红外光谱仪(Fourier transform infrared spectrometer,FTIR),美国Thermo Fisher Scientific公司;TA Discovery HR-3 流变仪,美国 TA 仪器公司。
1.2 实验方法
1.2.1 百香果果皮果胶的提取
参考商业果胶工业上常用的酸提法[4],将百香果果皮烘干、粉碎并过筛(120 目),称取20 g百香果果皮粉末,固定料液比1∶20 (g∶mL),用HNO3调节pH为2.1,静置30 min膨润后,进行提取,提取条件为85 ℃水浴加热3 h。粗提取液经离心(转速6 000 r/min, 20 min)取得上清液, 用旋转真空蒸发仪浓缩到原体积的1/3~1/2,然后加入2倍体积的95%(体积分数)乙醇,搅拌均匀并静置1 h后,以转速6 000 r/min 离心20 min,取下层胶状沉淀物,搅拌细碎化,用乙醇脱水2次后,冷冻干燥,得到百香果皮果胶PFP。2次平行制备。
1.2.2 总糖醛酸(uronic acid,UA)含量的测定
采用间羟基联苯法[12]测定总糖醛酸含量。配制PFP溶液经80 ℃, 30 min加热溶解后定量到质量浓度0.05 mg/mL。另制备半乳糖醛酸标准溶液(0.01~0.06 mg/mL)。各取1 mL于试管中,在冰水浴下加入6 mL四硼酸钠/浓硫酸,摇匀后,沸水浴10 min,取出冷却至室温后,加入0.1 mL 间羟基联苯溶液(1.5 mg/mL),室温下反应20 min,测定525 nm下吸收值。半乳糖醛酸标准检量线为:Y=13.061X-0.001 4 (R2=0.999),其中Y=525 nm下吸光值,X=半乳糖醛酸质量浓度(mg/mL)。由检量得的浓度再计算出总糖醛酸含量(以质量百分比表示),如公式(1)。3次平行测定。
总糖醛酸含量![]()
(1)
1.2.3 酯化度的测定
采用滴定法测定酯化度[7,13], 为降低滴定时使用酸与碱的浓度以增加解析度。称取0.1 g PFP样品于250 mL锥形瓶中,加入2 mL无水乙醇浸湿,加入 100 mL 经煮沸冷却去除二氧化碳的水,用瓶塞塞紧并不断摇动,使样品全部溶解为止。加入 5 滴酚酞指示剂,用 0.02 mol/L NaOH溶液滴定,记录消耗NaOH溶液的体积(V1),即为样品的原始滴定度,向样液中加入20 mL 0.1 mol/L的NaOH溶液,用瓶塞塞紧,经强烈摇动后,静置15 min,加入20 mL 0.1 mol/L HCl溶液,不断摇动使溶液中粉红色消失后,加入3滴酚酞指示剂,用 0.02 mol/L NaOH溶液滴定至样液呈微红色,记录所消耗NaOH溶液的体积(V2),即为样品的皂化滴定度。根据公式(2)计算酯化度。3次平行测定。
酯化度![]()
(2)
式中:V1,第1次消耗NaOH溶液的体积,mL;V2,第2次消耗NaOH溶液的体积,mL。
1.2.4 单糖组成测定
称取PFP样品10 mg于螺盖试管中, 加入2 mL超纯水,80 ℃加热搅拌30 min溶解,再加入0.4 mol/L三氟乙酸水溶液,密封,然后在110 ℃烘箱中反应3 h,反复加入甲醇3次,用氮吹仪吹干,最后加入2 mL的超纯水溶解水解物,稀释5倍,经0.22 μm微孔膜过滤后, 进行高效阴离子交换色谱分析。设备为DionexTM ICS-5000+ 离子交换色谱系统,配备ED1 脉冲电极侦测器和CarboPacTM PA20分析管柱(含保护管柱), 冲提条件为20 mmol/L NaOH、20 min,然后提高醋酸钠浓度梯度50~200 mmol/L、10 min;流速为 0.5 mL/min;管柱温度30 ℃。进样量 25 μL。以软件Chromeleon 7软件进行数据采集、处理和分析。以标准单糖进行单糖组成的定性与定量。2次平行测定。单糖组成含量以摩尔百分比表示。同质半乳糖醛酸聚糖含量的计算如公式(3)所示:
同质半乳糖醛酸聚糖含量/%=半乳糖醛酸含量/%-鼠李糖含量/%
(3)
1.2.5 分子质量、固有黏度与分子粒径的测定
配制1 mg/mL的PFP样品溶液,加热溶解于0.1 mol/L NaNO3,经0.22 μm微孔过滤膜过滤后,进行高效液相色谱联用多角度激光散射(HPSEC-MALLS)系统分析。设备为AligentTM 1260 Infinity II LC,串联3个检测器:多角度激光光散射检测器、黏度检测器和示差折射检测器;串联SB-805 HQ和SB-803 HQ(8 mm×300 mm)2支色谱柱;流动相为 0.1 mol/L 的NaNO3水溶液(含0.02%叠氮化钠),流速0.6 mL/min,管柱温度40 ℃;进样量 100 μL。采用 ASTRA 7.1.3 软件进行数据采集、处理和分析。
1.2.6 流变特性分析
配制30 mg/mL PFP溶液20 mL,添加CaCl2或ZnCl2使最终Ca2+和Zn2+浓度为0.01、0.02、0.05、0.1、0.2、0.3和0.4 mol/L,在60 ℃加热搅拌2 h完全溶解。将制备好的PFP溶液趁热取样置于TA Discovery HR-3 流变仪的Peltier平板正中央, 立刻进行静态稳剪切扫描, 采cone-plate 测定夹具(不锈钢锥板,锥角59′ 53″,直径60 mm,间隙1 000 μm), 温度控制在25 ℃,测定剪切速率0.01~1 000 s-1下剪切应力和表观黏度的变化。采用 TA Instruments Trios 软件对数据进行采集、处理和拟合模式分析。3次平行测定。
根据流变参数变化图, 发现较佳的拟合模型为Power Law模型, 如公式(4)和公式(5)[14]:
σ =Kσγn
(4)
ηa=Kηγn-1
(5)
式中:σ,剪切应力,Pa;γ,剪切速率,s-1;ηa,表观黏度,Pa·s;Kσ和Kη为稠度系数,Pa·sn;n,流体行为指数。
2 结果与分析
2.1 百香果皮果胶化学组成
PFP收率与化学组成列于表1。采用酸提法(酸液pH 2.1,80 ℃,3 h)所得的紫色百香果皮果胶PFP的收率为10.6%,总糖醛酸含量80.5% (半乳糖醛酸当量), 酯化度75.2%,属于高甲氧基果胶(HMP, DE>50%)。单糖组成中含量最多的是半乳糖醛酸(GalA) (78.5%), 其次是阿拉伯糖(8.24%)、葡萄糖(6.19%)和少量的半乳糖、甘露糖和鼠李糖(1.4%~3.7%), 同质半乳糖醛酸聚糖含量占74.3%。
表1 果胶收率、化学组成与化学组成的比较单位:%
Table 1 Comparison in yields and chemical compositions of various pectins
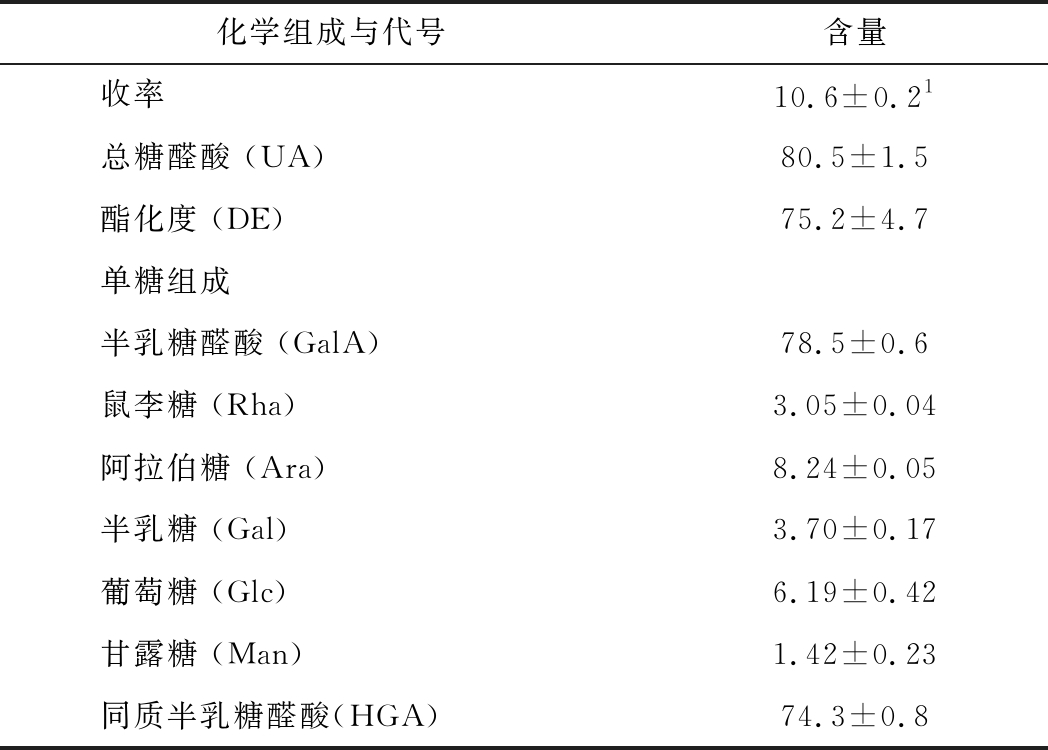
化学组成与代号含量收率10.6±0.21总糖醛酸 (UA)80.5±1.5 酯化度 (DE)75.2±4.7单糖组成半乳糖醛酸 (GalA)78.5±0.6鼠李糖 (Rha)3.05±0.04阿拉伯糖 (Ara)8.24±0.05半乳糖 (Gal)3.70±0.17葡萄糖 (Glc)6.19±0.42甘露糖 (Man)1.42±0.23同质半乳糖醛酸(HGA)74.3±0.8
注:1平均值±标准偏差
GUO等[9]将紫色百香果皮以超声辅助草酸铵萃取(ultrasonic-aided ammonium oxalate extraction,UAOE)条件(pH 2.0、0.6%草酸铵和超声波240 W/cm2、35 ℃、30 min)提取, 所得提取物(PFP)收率为10.1%,UA为51.8%, DE<50%,单糖组成主要为葡萄糖(53.5%), 其次为GalA (25.4%)和少量的阿拉伯糖、半乳糖与鼠李糖,HGA仅20.3%,推测含有等量的聚葡萄糖和果胶[9]。商业柑橘高甲氧基果胶(C-HMP)[15]的UA为80.1%,DE为8.3%,含有中性糖中半乳糖(8.5%)和少量鼠李糖、阿拉伯糖与葡萄糖,HGA占76.5%。本研究PFP单糖组成与C-HMP接近, 但异于UAOE提取的PFP。
比较各种黄色百香果皮果胶,包括以超声波促酸提取的果胶(收率7.5%~12.7%, GalA=66%~76%, DE=60%~80%) [7]、以热酸或原果胶酶促提的果胶(GalA=85%~89%, DE=68%~70%)[8]或是以热柠檬酸液提取的果胶(DE 79%)[5], 本研究的紫色百香果皮果胶PFP收率中等,但UA (或GalA)含量和DE皆高,DE接近于商业柑橘来源的超高甲氧基果胶(ultrahigh methoxy lated pectin,C-UHMP,DE=78%),高于商业C-HMP (DE=58%~64%)[8,15]及柠檬皮果胶(DE=68%~72%)[16]。PFP符合食品安全国家标准GB 25533—2010食品添加剂果胶的要求[GalA (65%)][17]。
2.2 百香果果皮果胶的FTIR结构特征
图1为PFP的傅里叶变换红外光谱。对照已知果胶的图谱特征[9,15]可知, 吸收峰 3 446和2 932 cm-1 为多糖的典型信号峰,分别与O—H键的伸缩振动和C—H键的不对称的伸缩与弯曲振动有关。1 747 cm-1 为甲基酯化的COOMe上C![]() O键伸缩振动信号,1 641 cm-1为半乳糖醛酸上游离羧基COOH的C
O键伸缩振动信号,1 641 cm-1为半乳糖醛酸上游离羧基COOH的C![]() O键伸缩振动信号,1 150 cm-1关于糖苷键上O—C—O不对称的伸缩振动,1 110 cm-1与1 023 cm-1分别与糖环和侧链上的C—C—O伸缩振动有关,为GalA的特征信号,而955 cm-1小肩峰和833 cm-1分别为β-和α-糖苷键C—O弯曲震动的特征信号。
O键伸缩振动信号,1 150 cm-1关于糖苷键上O—C—O不对称的伸缩振动,1 110 cm-1与1 023 cm-1分别与糖环和侧链上的C—C—O伸缩振动有关,为GalA的特征信号,而955 cm-1小肩峰和833 cm-1分别为β-和α-糖苷键C—O弯曲震动的特征信号。

图1 PFP的FTIR光谱
Fig.1 FTIR spectrum of PFP
2.3 百香果果皮果胶的分子质量、固有黏度和分子粒径
图2为PFP在0.1 mol/L硝酸钠溶液中分子质量分布的HPSEC-MALLS色谱图, RI讯号(粗线, 与样品浓度成正比)显示单一分子分布,出峰时间在19~30 min,而LS讯号(细线,与分子粒径和浓度成正比)显示双峰(在20.5和24 min处),显示有两类分子构形密度或粒径存在。透过ASTRA 7.1.3 软件处理取得分子性质数据,结果如表2所示。由Zimm图[18]回归可得重均分子质量(Mw)为(190.5±1.0)kDa,数均分子质量(Mn)为(175.1±1.1)kDa,多分散系数PDI值 (Mw/Mn)为1.09 ±0.01;由DP和RI侦测器讯息测得固有黏度[η]为(6.09±0.00)dL/g,并得到马克-霍温-樱田(Mark-Houwink-Sakurada, MHS)关系式([η]=K×Mwa)[19]参数K=0.016 5,α=0.875。假设果胶分子在0.1 mol/L 硝酸钠溶液中为球状, 将上述所得Mw和[η]值代入Flory-Fox和Einstein-Simha公式[9,18],分别可求得环动半径 (gyration of radius,Rg)为(44.5±0.0) nm和水合动态半径 (hydrodynamic radius,Rh)为(25.6±0.1) nm, 非均向性 (anisotropy)构形参数(ρ=Rg/Rh比值)[20]为1.74。
表2 PFP的分子质量、固有黏度和分子粒径参数
Table 2 Molecular weights, intrinsic viscosity and molecular size parameters of pectin PFP

分子质量黏度与MHS参数粒径参数Mw/kDaMn/kDaPDI[η]/(dL·g-1)K/(mL·g-1)αRg/nmRh/nmρ190.5 ±1.05175.1 ±1.11.09 ±0.016.09 ±0.000.016 5±0.0000.875±0.00044.5 ±0.025.62 ±0.051.74
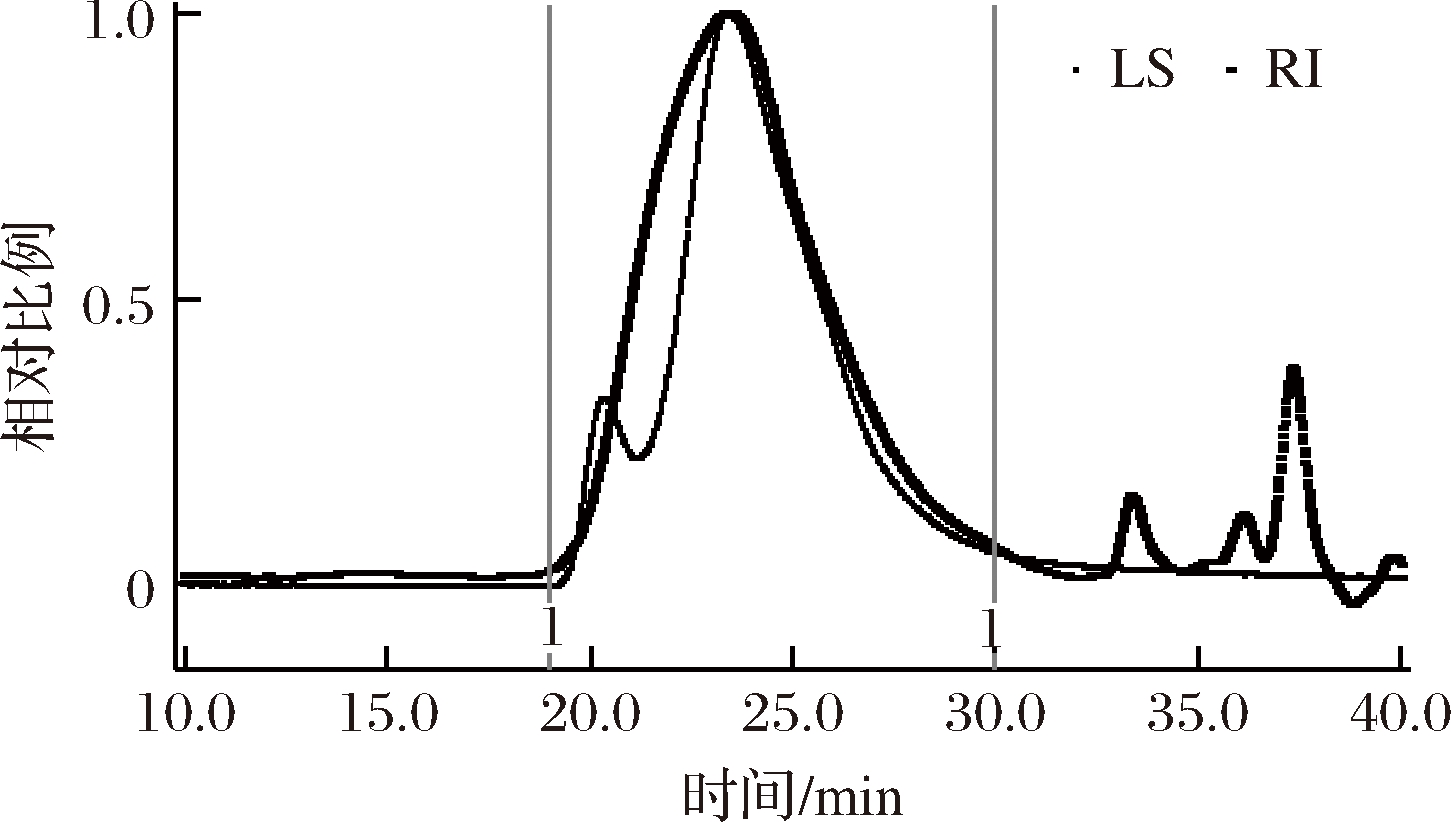
图2 PFP分子质量分布的 HPSEC-MALLS 色谱图谱
Fig.2 HPSEC-MALLS chromatogram for molecular profile of PFP
PFP的Mw值接近于商业柑橘果胶 (Mw=180 kDa)[18]和UAOE法所得紫色百香果胶提取物的10%与15%乙醇区分物PFP-10和PFP-15 (Mw=18.1和20.8 kDa;DPI=1.66和1.73)[9],但PFP的PDI值明显较低。PFP的[η], Rg, Rh和ρ值与PFP-10和PFP-15 ([η]=7.05和5.93 dL/g;Rg=37.7和41.7 nm;Rh=26.6 和23.6 nm;ρ=1.42和1.77)[9]都很接近。PFP的MHS α值(0.875)和商业柑橘果胶 (α=0.822, 在30 ℃下)[18]相近,但比PFP-10和PFP-15 (α=0.55和0.58)[9]高。
已知 MHS指数α为分子链构形参数, 0~0.3时为球状;0.5~0.8时为柔软的无规则线状;> 0.8时为半柔软的伸展链;1.8~2.0时为硬短杆状链[19]。若以整体分子的非均向性的构形参数ρ值观之,0.775时为紧密球状;1.5~1.8时为柔软的无规则线状;≥2时为伸展性分子;ρ值越大链越硬[20]。综合可知,在0.1 mol/L硝酸钠溶液中PFP(MHS α=0.875,ρ=1.74) 分子链半柔软半伸展、整体分子呈无规则线状。
2.4 Ca2+浓度对果胶溶液剪切应力和表观黏度的影响
图3为0.01~0.4 mol/L Ca2+的添加对PFP溶液(30 mg/mL)稳剪切测定(剪切速率γ=0.01~1 000 s-1)的流体行为。图3-a显示空白组(0 mol/L Ca2+)的剪切应力(σ)随γ增加而直线上升,表观黏度 (ηa,等于σ对γ的变化斜率)变化平缓(图3-b)。添加Ca2+大大提高σ值(尤其在γ=0.01~10 s-1下)、屈服应力(σy, 即0.01 s-1下的σ值),并呈现出尖峰化现象, 即σ随γ增加呈两段式, 前段(0.01~0.05 s-1) 快速上升,后段慢速上升。因此ηa值(图3-b) 也呈现先升后降的尖峰化现象,即先剪切稠化的膨胀性流体行为,后剪切稀化的假塑性流体行为[14]。Ca2+引起的σ和ηa增加程度在0.05 mol/L达到最大, 过高的Ca2+浓度 (0.1~0.4 mol/L)反而导致σ和ηa下降。σ或ηa尖峰对应的特征γ值(γ*)由0.1 s-1降到0.04 s-1, 与σy或ηa,0.01呈正相关。
Ca2+添加提高PFP溶液的黏度或稠度系数的情形也见于与橙皮果胶[21]、甜菜果胶[22]、桃子、浆果和胡萝卜的富果胶提取物[23], 也会提高低甲氧基果胶的黏弹性模量[24-25]。Ca2+会透过离子键作用于果胶半乳糖醛酸的游离羧基上,形成Egg-box结构[26]。PFP虽为高甲氧基果胶,含有78.5% GalA和酯化度为75.2%(表1), 有大约19.5%游离羧基的GalA可与Ca2+作用形成具有流动性的微凝胶[27], 或可合理说明Ca2+添加导致0.01 s-1下σy和ηa增加以及低γ区(0.01~0.1 s-1)剪切稠化的现象(图3);而0.1~1 000 s-1区剪切稀化现象可归因于中高剪力导致微凝胶呈顺向性流动后微凝结构瓦解[14,28]。
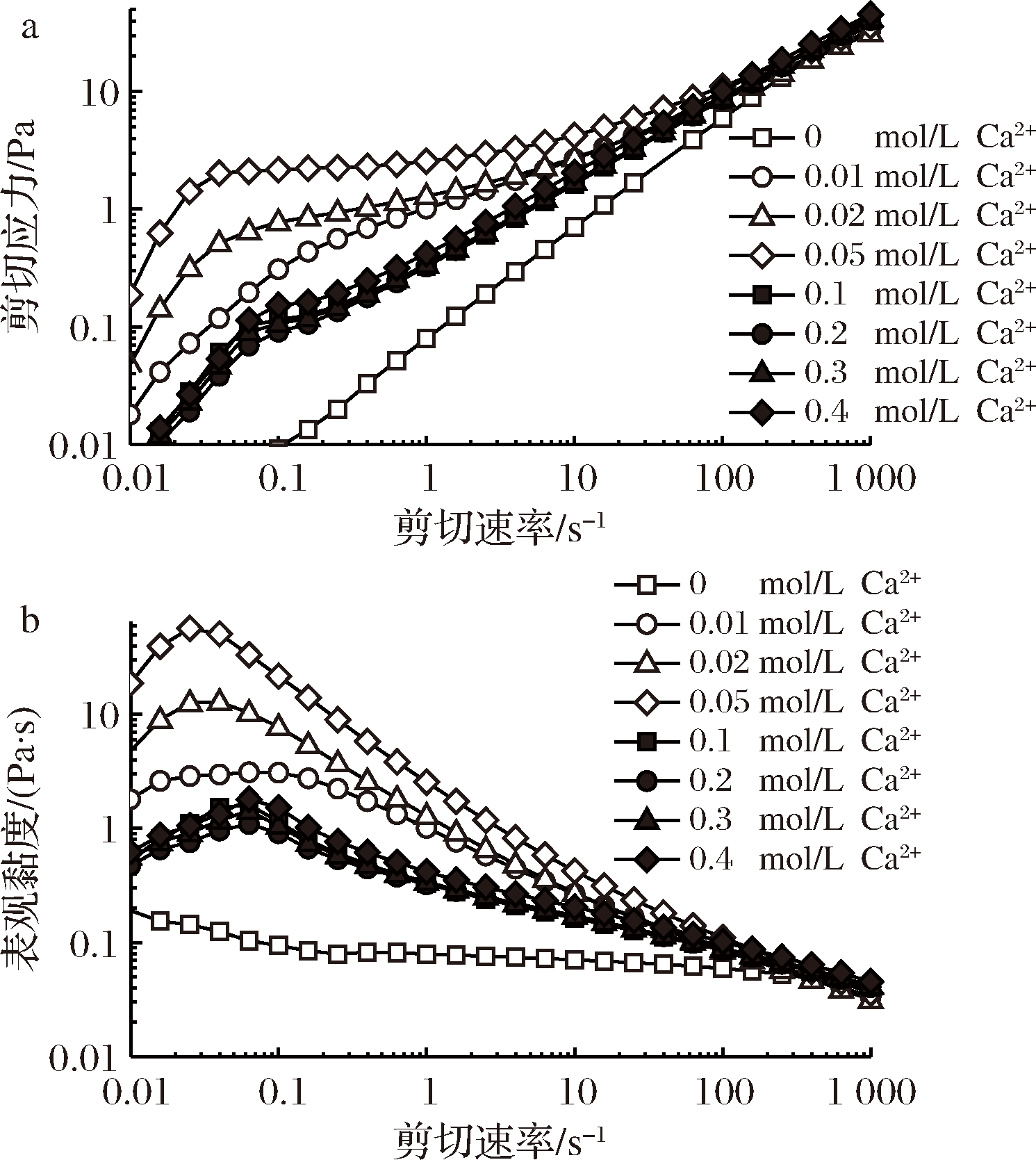
a-剪切应力;b-表观黏度
图3 Ca2+浓度对果胶溶液剪切应力和表观黏度的影响
Fig.3 Effect of Ca2+concentration on shear stress and apparent viscosity of pectin solution
2.5 Zn2+浓度对果胶溶液剪切应力和表观黏度的影响
图4为0.01~0.4 mol/L Zn2+的添加对PFP溶液(30 mg/mL)稳剪切下流体行为的影响。相较于空白组,Zn2+的添加提高了PFP溶液在低剪切速率(0.01~6 s-1)下的剪切应力σ、σy(图4-a) 和表观黏度ηa(图4-b), 尖峰化轻微且较Ca2+的作用不明显。Zn2+引起的σ和ηa增加程度在0.05 mol/L达到最大,与 Ca2+的情况类似。整体而言,在γ=0.03~1 000 s-1下Zn2+-PFP溶液皆呈剪初稀化的假塑性流体行为;γ>20 s-1时, 空白组与含0.01和0.4 mol/L Zn2+的PFP溶液的σ和ηa高于其他组,具有较佳的耐剪切稀化能力。
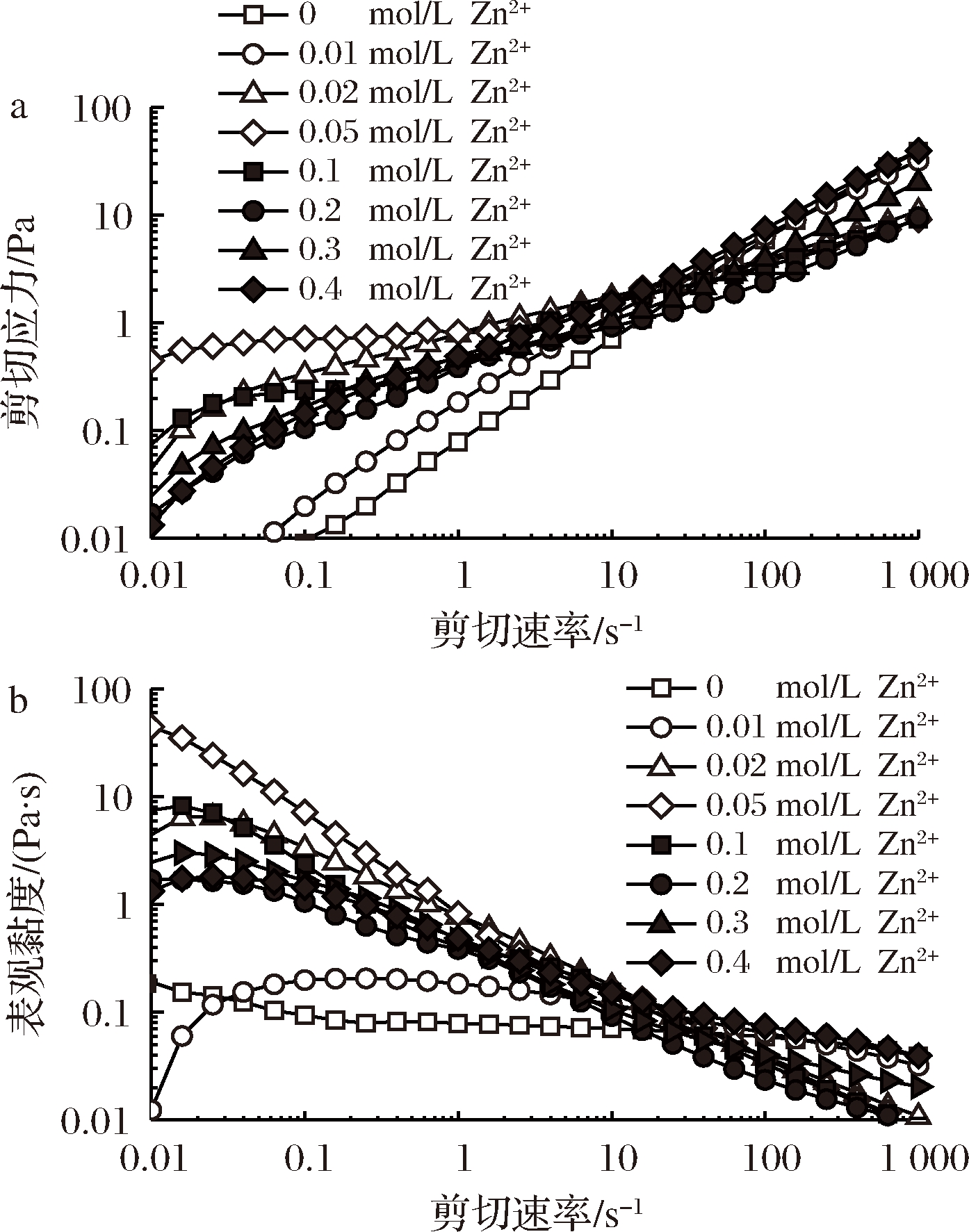
a-剪切应力;b-表观黏度
图4 Zn2+浓度对PFP溶液剪切应力和表观黏度的影响
Fig.4 Effect of Zn2+ concentration on shear stresses and apparent viscosities of PFP solutions
2.6 添加不同浓度离子对果胶溶液体系流变参数的影响
考虑食品胶体应用时最常见的范围为 0.1~1 000 s-1,包括自然流动(0.1~10 s-1)、咀嚼和吞咽 (10~100 s-1)、混合和搅拌 (10~1 000 s-1)[29], 所以将上述Ca2+和Zn2+-PFP溶液在γ= 0.1~1 000 s-1下呈剪切稀化的σ和ηa值进行Power law 模型作拟合,求得稠度系数K和流体行为指数n。
表3比较了Ca2+和Zn2+浓度对PFP溶液的K和n值的影响。整体而言,拟合的相关系数(R2)非常高,σ=Kσ·γn拟合的R2值 (0.989~1.000)比ηa =Kη·γn-1拟合的R2值(0.908~0.999)高。相较于空白组 (Kρ= 0.155 Pa·sn,n=0.802;Kη=0.079 Pa·sn,n=0.924), Ca2+或Zn2+的存在明显提高了Kσ和Kη值,尤其在0.01~0.05 mol/L时 Kσ和Kη值随离子浓度提高而规则地增加,n值反向降低,但在0.1~0.4 mol/L时无此规则现象。除了空白组和0.01 mol/L Zn2+组Kσ> Kη外,0.01~0.05 mol/L离子组的Kσ< Kη,Ca2+组差异较Zn2+组大。综合而言, 2种Power law模型参数随离子浓度变化的趋势一致, 但ηa所得参数 (Kη,n) 差异较σ的(Kσ,n) 大,n值相差0~0.16。
表3 Ca2+和Zn2+浓度对PFP溶液流变参数的影响
Table 3 Effects of Ca2+and Zn2+ concentrations on the rheological parameters of PFP solution
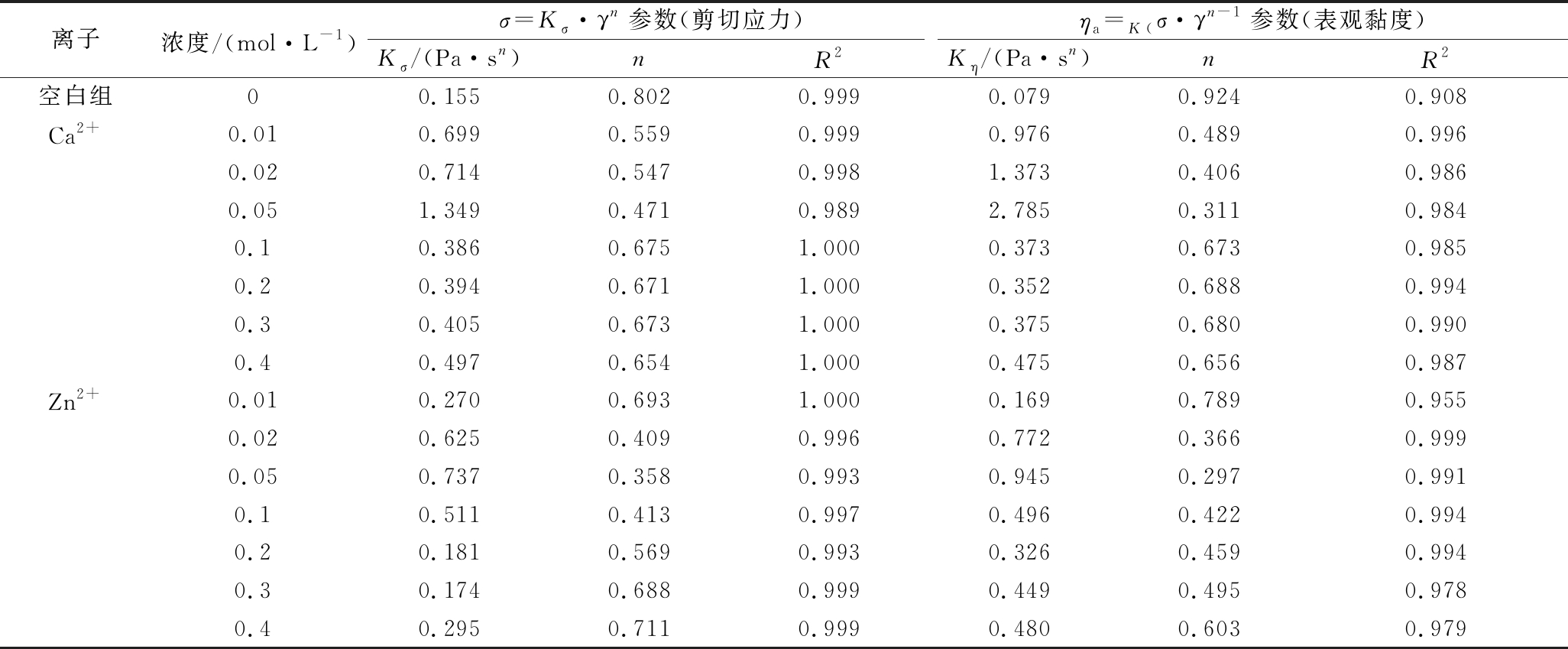
离子浓度/(mol·L-1)σ=Kσ·γn参数(剪切应力)ηa =K(σ·γn-1参数(表观黏度)Kσ/(Pa·sn)nR2Kη/(Pa·sn)nR2空白组00.155 0.802 0.999 0.0790.924 0.908 Ca2+0.010.699 0.559 0.999 0.976 0.489 0.996 0.020.714 0.547 0.998 1.373 0.406 0.986 0.051.349 0.471 0.989 2.785 0.311 0.984 0.10.386 0.675 1.000 0.373 0.673 0.985 0.20.394 0.671 1.000 0.352 0.688 0.994 0.30.405 0.673 1.000 0.3750.680 0.990 0.40.497 0.654 1.000 0.475 0.656 0.987 Zn2+0.010.2700.6931.000 0.1690.7890.955 0.020.625 0.409 0.996 0.772 0.366 0.999 0.050.7370.358 0.993 0.9450.297 0.991 0.10.511 0.413 0.997 0.4960.422 0.994 0.20.181 0.569 0.9930.326 0.459 0.994 0.30.174 0.688 0.999 0.449 0.495 0.978 0.40.295 0.711 0.999 0.480 0.603 0.979
针对表观黏度, PFP溶液(空白组)的K 和n值皆高于柠檬皮果胶的K 和n值[16],但K小于、n大于桃子、浆果和胡萝卜的富果胶提取物的K和n值[23],这些差异与样品结构特性、浓度、流变设备和模具不同有关。Ca2+添加使PFP溶液的K值提高且n值降低的现象也见于甜菜果胶[22]。
2.7 离子对果胶溶液体系的流变特性的影响
Ca2+和Zn2+离子浓度对PFP溶液表观黏度的影响可以由图5-a更清楚地显示,以γ= 1 s-1的表观黏度(ηa,1)代表说明。相较于空白组PFP溶液[ηa,1=(0.068±0.007) Pa·s], Ca2+和Zn2+浓度在0.01 mol/L即可提高PFP溶液的ηa,1分別达 1和0.2 Pa·s。ηa,1值在Ca2+ 0.05 mol/L时最高(2.3 Pa·s), 在Zn2+ 0.02~0.05 mol/L时最高(0.9 Pa·s), ≥0.1 mol/L时大幅度降低且 Zn2+ > Ca2+系统。图5-b显示当γ=10 s-1时Ca2+和Zn2+对PFP表观黏度的增加效果减小,但仍是Ca2+ > Zn2+且0.05 mol/L Ca2+达到最高(0.42 Pa·s),而0.02~0.01 mol/L Zn2+只温和提高黏度。综合可知GalA与Ca2+作用比Zn2+强且敏感,此与游离羧基对金属离子的亲和力有关[10-11]。
因PFP含有HGA 74.3%和游离羧基型态的GalA约24.8% [=1-酯化度(75.2%)], 所以PFP溶液(30 mg/mL)中, Ca2+键结的HGA链段[10]上活性GalA残基数目大约0.031 mol/L (脱水GalA残基的分子质量为176 g/mol)。已知Ca2+和Zn2+等两价金属离子和果胶GalA游离羧基形成接合区依循Egg-box模型[4,10-11,25-26],一个Ca2+(或Zn2+)与4个GalA游离羧基作用形成安定的离子键结。所以0.031 mol/L活性GalA残基可键结的Ca2+(或Zn2+)大约0.008 mol/L,可说明图5所示0.01 mol/L Ca2+(或Zn2+)组即有显著的黏度上升的现象, 然而须0.02~0.05 mol/L才能达到最大黏度。过高离子浓度容易导致微胶结构瓦解,使黏度降低。
0.01~0.05 mol/L Ca2+和0.02~0.05 mol/L Zn2+下PFP溶液 (30 mg/mL)的K值(0.8~2.8 Pa·sn)-n值(0.5~0.3) 组合与商业稠化剂ThickenUp在质量百分率5%下的K-n值组合很相近[30],显示果胶PFP-Ca2+(或Zn2+)系统具有在特殊流质食品的应用潜力, 兼具补充必需矿物质和调控流体特性的优点。
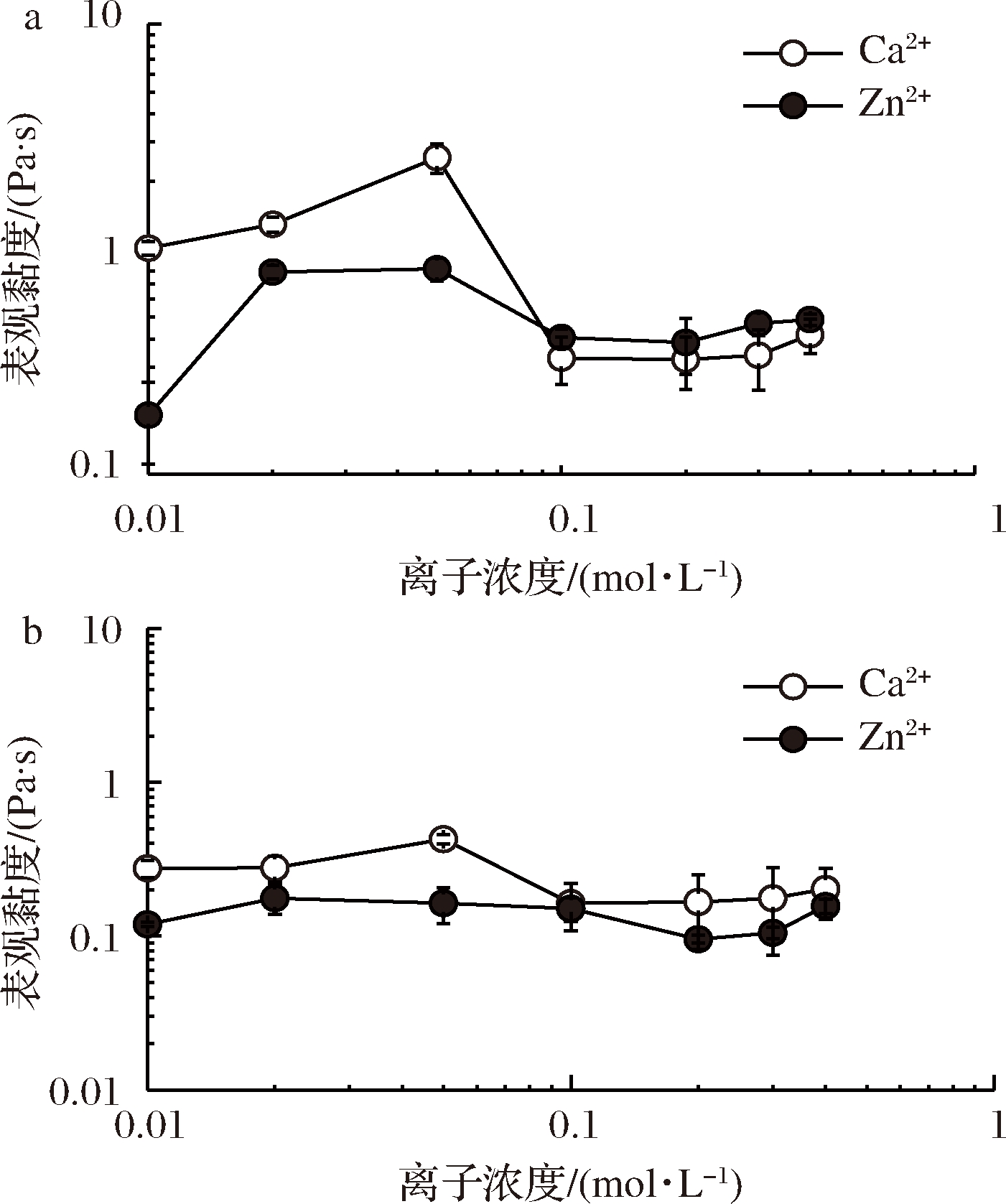
a-剪切速率1 s-1;b-剪切速率10 s-1
图5 Ca2+和Zn2+浓度对PFP溶液在剪切速率1 s-1和10 s-1下表观黏度的影响
Fig.5 Effects of Ca 2+ and Zn2+ on the apparent viscosities of PFP solutions at a shear rate of 1 s-1 and 10 s-1
3 结论
本研究以商业酸提法所得紫色百香果皮果胶PFP, 发现其含有80.5%总糖醛酸, 酯化度75.2%, 单糖组成中GalA占78.5%, 同质半乳糖醛酸聚糖占74.3%;以及Mw 190.5 kDa,与商业柑橘高甲氧基果胶非常相近。0.01~0.05 mol/L Ca2+或Zn2+可显著提高PFP溶液稳剪切测定的剪切应力、表观黏度、稠度系数K和剪切稀化情形(即降低流体行为指数n), 效果最大在 0.05 mol/L Ca2+或0.02~0.05 mol/L Zn2+时, Ca2+的效果大于Zn2+。Ca2+与 Zn2+添加促使PFP溶液产生高屈服应力及高K-低n值组合,接近商业稠化剂的特性, 显示PFP-Ca2+(或Zn2+)系统具有应用于特殊流质食品的潜力。未来值得进一步研究调整PFP-Ca2+或Zn2+浓度配方, 以符合各种特殊流质食品的流变特性要求。
[1] CAFFALL K H, MOHNEN D. The structure, function, and biosynthesis of plant cell wall pectic polysaccharides [J]. Carbohydrate Research, 2009, 344(14):1 879-1 900.
[2] YAPO B M, LEROUGE P, THIBAULT J F, et al. Pectins from citrus peel cell walls contain homogalacturonans homogeneous with respect to molar mass, rhamnogalacturonan I and rhamnogalacturonan II [J]. Carbohydrate Polymers, 2006,69(3):426-435.
[3] AI L, CHUNG Y C, LIN S Y, et al. Active pectin fragments of high in vitro antiproliferation activities toward human colon adenocarcinoma cells: Rhamnogalacturonan II [J]. Food Hydrocolloids, 2018, 83:239-245.
[4] ROLIN C. Pectin. Industrial Gums-Polysaccharides and Their Derivatives [M]. 3rd ed. London: Academic Press, Inc., 1993: 257-293.
[5] PINHEIRO E R, SILVA I M D A, GONZAGA L V, et al. Optimization of extraction of high-ester pectin from passion fruit peel (Passiflora edulis flavicarpa) with citric acid by using response surface methodology [J]. Bioresource Technology, 2008, 99(13):5 561-5 566.
[6] KLIEMANN E, SIMAS K N, AMANTE E R, et al. Optimisation of pectin acid extraction from passion fruit peel (Passiflora edulis flavicarpa) using response surface methodology [J]. International Journal of Food Science and Technology, 2009, 44(3):476-483.
[7] FREITAS DE OLIVEIRA C, GIORDANI D, LUTCKEMIER R, et al. Extraction of pectin from passion fruit peel assisted by ultrasound [J]. LWT - Food Science and Technology, 2016, 71:110-115.
[8] VASCO-CORREA J, ZAPATA ZAPATA A D. Enzymatic extraction of pectin from passion fruit peel (Passiflora edulisf. flavicarpa) at laboratory and bench scale [J]. LWT - Food Science and Technology, 2017, 80:280-285.
[9] GUO R, TIAN S, LI X, et al. Pectic polysaccharides from purple passion fruit peel: A comprehensive study in macromolecular and conformational characterizations[J]. Carbohydrate Polymers, 2020, 229:115 406.
[10] KYOMUGASHO C, GWALA S, CHRISTIAENS S, et al. Pectin nanostructure influences pectin-cation interactions and in vitro-bioaccessibility of Ca2+, Zn2+, Fe2+ and Mg2+-ions in model systems [J]. Food Hydrocolloids, 2017, 62:299-310.
[11] KHOTIMCHENKO M Y, KOLENCHENKO E A, KHOTIMCHENKO Y S. Zinc-binding activity of different pectin compounds in aqueous solutions [J]. Journal of Colloid and Interface Science, 2008, 323(2):216-222.
[12] BLUMENKRANTZ N, ASBOE-HANSEN G. New method for quantitative determination of uronic acids[J]. Analytical Biochemistry, 1973, 54(2), 484-489.
[13] GB 03-090-30900 Food Chemical Codex [S]. Washington: Bibliographic Information,1981.
[14] RAO M A. Rheology of Fluid and Semisolid Foods -Principle and Applications[M]. 2nd Ed. New York: Springer Science+Business Media, 2007:27-28.
[15] FRACASSO A F, PERUSSELLO C A, CARPINÉ D, et al. Chemical modification of citrus pectin: Structural, physical and rheological implications [J]. International Journal of Biological Macromolecules, 2018, 109:784-792.
[16] 刘江, 雷激, 张俊,等. 不同提取方法对柠檬皮渣果胶特性的影响[J]. 食品与发酵工业, 2019, 45(23):199-206.
[17] 中华人民共和国卫生部. GB 25533—2010 食品安全国家标准-食品添加剂果胶[S]. 北京:中国标准出版社, 2011.
[18] MASUELLI M A. Viscometric study of pectin. Effect of temperature on the hydrodynamic properties [J]. International Journal of Biological Macromolecules, 2011, 48(2):286-291.
[19] HARDING S E, ABDELHAMEED A S, MORRIS G A. On the hydrodynamic analysis of conformation in mixed biopolymer systems [J]. Polymer International, 2011, 60 (1):2-8.
[20] TANDE B M, WAGNER N J, MACKAY M E, et al. Viscometric, hydrodynamic, and conformational properties of dendrimers and dendrons[J]. Macromolecules, 2001, 34(24):8 580-8 585.
[21] 张兆琴, 梁瑞红, 刘伟,等. 橙皮果胶流变学性质的影响因素[J]. 食品研究与开发, 2010, 31(1):31-35.
[22] 彭小燕, 木泰华, 张苗等. 超高压下Ca2+与 Na+离子对甜菜果胶结构及流变性质的影响[J]. 中国农业科学, 2015, 48(21):4 335-4 346.
![]() J, CYBULSKA J, ZDUNEK A. Rheological and chemical properties of pectin enriched fractions from different sources extracted with citric acid[J]. Carbohydrate Polymers, 2017, 156:443-451.
J, CYBULSKA J, ZDUNEK A. Rheological and chemical properties of pectin enriched fractions from different sources extracted with citric acid[J]. Carbohydrate Polymers, 2017, 156:443-451.
[24] NORZIAH M H, KONG S S, KARIM A A, et al. Pectin-sucrose-Ca2+ interactions: Effects on rheological properties[J]. Food Hydrocolloids, 2001, 15(14):491-498.
[25] HAN W, MENG Y, HU C, et al. Mathematical model of Ca2+ concentration, pH, pectin concentration and soluble solids (sucrose) on the gelation of low methoxyl pectin [J]. Food Hydrocolloids, 2017, 66:37-48.
[26] MORRIS E, POWELL D, GIDLEY M, et al. Conformations and interactions of pectins: Polymorphism between gel and solid states of calcium polygalacturonate [J]. Journal of Molecular Biology, 1982, 155(4):507-516.
[27] SAAVEDRA ISUSI G I, KARBSTEIN H P, VAN DER SCHAAF U S. Microgel particle formation: influence of mechanical properties of pectin-based gels on microgel particle size distribution [J]. Food Hydrocolloids, 2019, 94:105-113.
[28] WINDHAB E J. Physico-Chemical Aspects of Food Processing[M]. London: Chapman & Hall, 1995: 80-116.
[29] RAO M A. Rheology of Fluid, Semisolid, and Solid Foods, Food Engineering Series[M]. New York: Springer Science+Business Media, 2014: 416-456.
[30] HADDE E K, CHEN J. Shear and extensional rheological characterization of thickened fluid for dysphagia management [J]. Journal of Food Engineering, 2019, 245:18-23.