朝鲜族泡菜是极具民族特色的发酵型泡菜,具有独特浓厚的风味且富含乳酸菌和乳酸[1-3],深受广大消费者喜爱。目前,朝鲜族泡菜的生产方式主要是自然发酵,但存在发酵周期长、产品质量不稳定、亚硝酸盐含量高等缺点[4]。人工接种发酵朝鲜族泡菜是一种趋势,也是发酵技术现代化的标志,而其达到快速、稳定和优质的关键在于菌种[5]。
肠膜明串珠菌(Leuconostoc mesenteroides)是自然发酵产品中的优势菌[6],对人和动物均无毒性和致病作用,具有抗氧化、改善产品风味和拮抗致病菌能力[7-8]。因此,将其应用于朝鲜族泡菜中,对人工接种生产方式进行基础研究具有重要意义。
樱菜是延边朝鲜族人种植的一种特色蔬菜,生长期短且具有季节性,味道适口,营养丰富,以其为原料制成朝鲜族泡菜,不仅提高了营养价值,还改善了其贮藏性[3]。发酵樱菜口感源于发酵过程中微生物代谢而发生的复杂变化,而各种化学成分以及微生物数量变化对发酵樱菜营养品质、口感和贮藏性起着至关重要的作用[9-10]。
本研究将具有降解亚硝酸盐功能的肠膜明串珠菌人工接种制作发酵樱菜,对比体积分数为1%的接种量、体积分数为5%接种量和自然发酵3种发酵条件下发酵第0、7、14、21、28、35、42天的发酵樱菜中亚硝酸盐含量、还原糖含量、氨基酸态氮含量、总酸、pH、菌落总数、大肠菌群、乳酸菌数、酵母菌数变化情况,为人工接种生产朝鲜族泡菜提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 试验原料
樱菜,挑选无腐烂、无病虫害且成熟的樱菜,延边州延吉市农贸市场售。
1.1.2 试验菌株
肠膜明串珠菌(Leuconostoc mesenteroides)JNZB003,由本实验室从延边朝鲜传统发酵樱菜中分离,在中国典型培养物保藏中心保藏,编号为CCTCC No:M 2018129。
1.1.3 试验试剂
MRS固体培养基、MRS液体培养基、平板计数琼脂(plate count agar,PCA)、马铃薯葡萄糖琼脂(potato dextrose agar,PDA),青岛高科园海博生物技术有限公司;结晶紫中性红胆盐琼脂(violet centre red bile agar,VRBA),北京奥博星生物技术有限责任公司;NaCl(分析纯),北京化工厂;亚铁氰化钾、乙酸锌(分析纯),天津光复精细化工研究所;NaNO2(化学纯),天津市化学试剂一厂;对氨基苯磺酸、盐酸萘乙二胺(分析纯),国药集团化学试剂有限公司。
1.1.4 仪器设备
PRESOCLAVE-Ⅱ高压灭菌器,西班牙 SELECTA;BT 124S电子天平,中国赛多利斯科学仪器(北京)有限公司;VF 611超纯水系统,德国SARTORIUS;T6新世纪分光光度计,北京普析通用仪器有限责任公司;DNP-9162BS-Ⅲ电热恒温培养箱,上海新苗医疗器械制造有限公司;S210 pH计,梅特勒-托利多仪器有限公司。
1.2 实验方法
1.2.1 朝鲜族传统发酵樱菜制作
初腌:挑选无腐烂、无病虫害的成熟樱菜,将其在通风良好的室外晾晒,待樱菜变黄,清洗干净,用盐进行初腌,待腌蔫。
备料:将辣椒粉、姜粉、蒜沫、苹果梨块等用少量水拌匀,备用。
自然发酵:每次取少量初腌好的樱菜,用备料涂匀后,放入发酵罐中,盖好盖子,置于冷藏箱(4 ℃)进行发酵。
人工接种发酵:在备料里混匀菌种,接种菌液中活菌数在108 CFU/mL以上,分别以体积分数为1%和5%接种量,放入发酵罐中,盖好盖子,置于冷藏箱(4 ℃)进行发酵。
1.2.2 试验设计
试验分为3组,自然发酵组、体积分数1%接种组、体积分数5%接种组。每组重复3个,其中自然发酵组为对照,均在4 ℃条件下进行发酵,对发酵第0、7、14、21、28、35、42天的发酵樱菜中的亚硝酸盐含量、还原糖含量、氨基酸态氮含量、总酸、pH、菌落总数、大肠菌群、乳酸菌数、酵母菌数进行测定。
1.2.3 测定方法
1.2.3.1 亚硝酸盐含量
根据GB 5009.33—2010《食品中亚硝酸盐和硝酸盐的测定》,采用盐酸萘乙二胺法进行测定[11]。
1.2.3.2 还原糖含量
根据GB/T 5009.7—2008《食品中还原糖的测定》,采用3,5-二硝基水杨酸比色法进行测定[12]。
1.2.3.3 氨基酸态氮含量
根据GB 5009.235—2016《食品中氨基酸态氮的测定》,采用甲醛滴定法进行测定[13]。
1.2.3.4 总酸含量
根据GB/T 12456—2008《食品中总酸的测定》,采用酸碱滴定法进行测定[14]。
1.2.3.5 pH
取发酵罐中多个位置的发酵液进行混合,用pH计测定直至数值稳定,连续测3次,取平均值。
1.2.3.6 菌落总数测定
根据GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》进行测定[15]。
1.2.3.7 大肠菌群测定
根据GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》,采用平板计数法进行测定[16]。
1.2.3.8 乳酸菌测定
根据GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》进行测定[17]。
1.2.3.9 酵母菌测定
根据GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》,采用平板计数法进行测定[18]。
1.3 数据处理
用Excel 和SPSS 17.0进行统计分析。
2 结果与分析
2.1 樱菜发酵过程中亚硝酸盐含量的变化
樱菜发酵过程中亚硝酸盐含量变化趋势见图1。
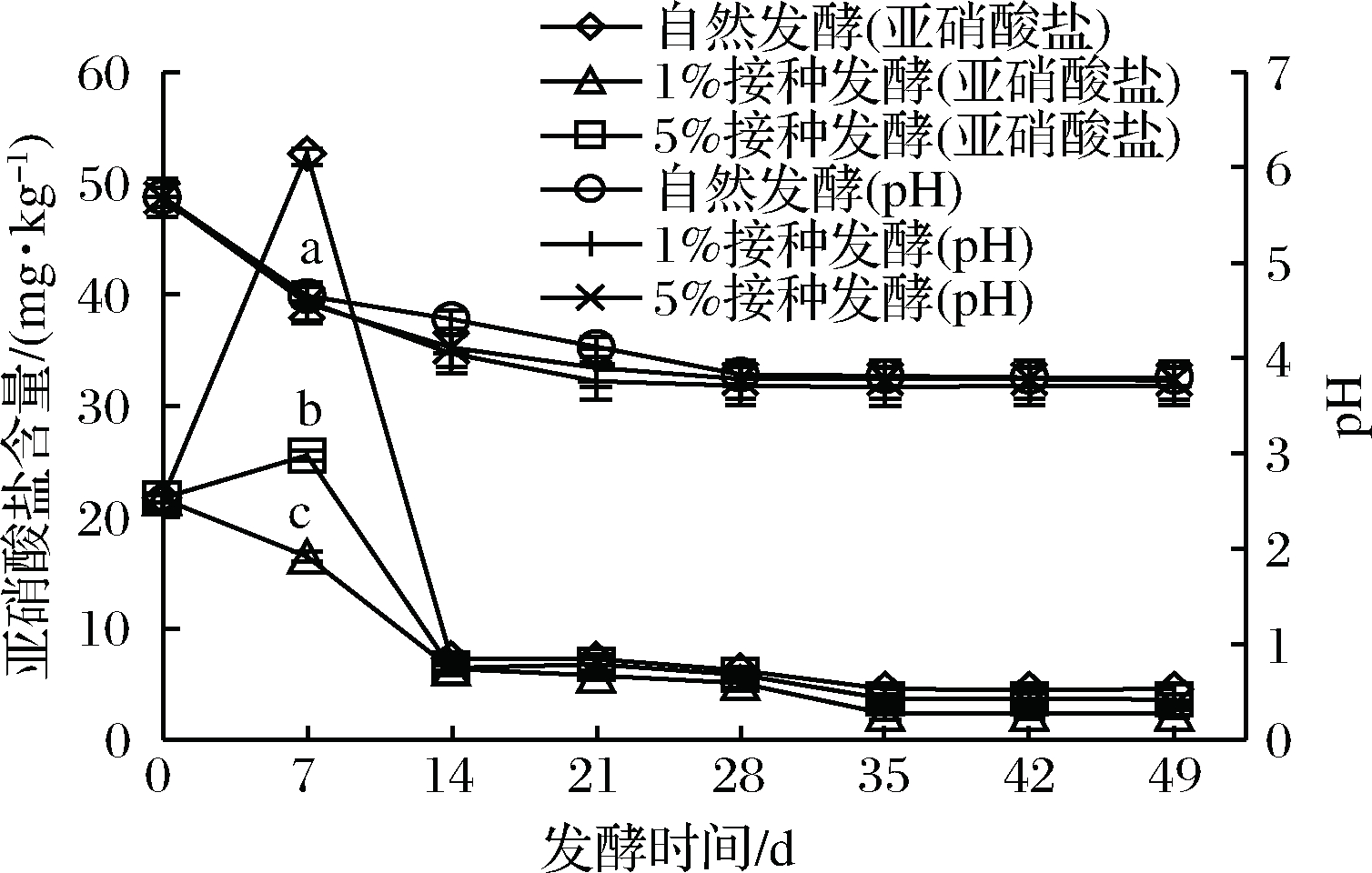
图1 樱菜发酵过程中亚硝酸盐含量和pH的变化
Fig.1 Change of nitrite content and pH value during
the fermentation of L. sativum
注:不同小写字母表示差异显著(下同)
由图1所示,自然发酵组和体积分数5%接种组中亚硝酸盐含量均先增加再降低,并在第7天亚硝酸盐出现明显的高峰,自然发酵组上升的速度与含量显著高于接种组(P<0.05)。而体积分数1%接种组随发酵时间的延长,亚硝酸盐含量逐渐降低并趋于稳定,且在发酵第7天已降至国家标准以下(<20 mg/kg)。同一时间,人工接种量不同,发酵樱菜中亚硝酸盐残留量也不同,整个发酵过程中,以体积分数1%接种组保持含量较低,表明人工接种发酵有利于抑制亚硝酸盐的生成与积累。
自然发酵组在前7 d亚硝酸盐含量快速增加,可能由于蔬菜及发酵器上的革兰氏阴性菌分泌硝酸还原酶,导致大量的硝酸盐还原为亚硝酸盐[19]。人工接种组中的肠膜明串珠菌开始就高于自然发酵组,能立即进行乳酸发酵,产生大量乳酸[20],使pH在5.0以下,此时硝酸还原酶酶活性开始对亚硝酸盐含量变化起作用,因此,接种组亚硝酸盐含量逐渐降低并趋于稳定。本试验亚硝酸盐含量变化规律与何淑玲[21]研究结果一致。
2.2 樱菜发酵过程中pH的变化
pH影响发酵过程中微生物的种类、数量以及代谢产物的变化,进而影响发酵樱菜的品质。
由图1所示,樱菜发酵过程中pH呈规律变化,3组发酵樱菜在0~28 d,pH均逐渐降低,人工接种组pH下降速度快于自然发酵组,但差异不显著(P>0.05),这是由于自然发酵组发酵起始乳酸菌少,而接种组起始接种了肠膜明串珠菌,因此,产酸多于自然发酵组。随着发酵时间的延长,乳酸菌成为优势菌,发酵产生乳酸,pH逐渐降低[22-23]。
28~35 d,pH稳定在3.7~3.8,此时,发酵成熟,pH趋于稳定,这与杜书[24]、马欢欢等[25]和韩宏娇等[10]的研究结果相似。
2.3 樱菜发酵过程中还原糖含量的变化
在发酵过程中,还原糖是发酵底物,可以表征出发酵过程中微生物的生长情况以及代谢产物的量。
樱菜发酵过程中还原糖变化如图2所示,3组发酵樱菜中还原糖含量均呈先增加再降低趋于稳定。

图2 樱菜发酵过程中还原糖含量的变化
Fig.2 Change of reducing sugar during the fermentation
of L. sativum
0~7 d 还原糖质量分数呈上升趋势,分析认为,一是樱菜本身还原糖等营养物质不断溶出,此时,微生物活动弱,对还原糖的利用速度小于生成速度,二是还原糖是发酵环境中酶的主要电子供体,微生物分泌的酶类将多糖降解为还原糖。7~21 d还原糖质量分数呈下降趋势,这是由于随发酵时间的延长,乳酸菌数量增多,活力增强,利用还原糖进行生长代谢所致。21~49 d还原糖质量分数基本趋于稳定略有增加,后期自然发酵组略高于接种组,分析认为随着微生物生长繁殖的主要碳源被消耗而逐渐减少,微生物活力下降;而自然发酵组略高,是因为菌体的数量和活力下降,对还原糖的利用减少所致。这与马艳弘等[26]研究结果类似。
2.4 樱菜发酵过程中总酸含量的变化
总酸是反映樱菜的发酵程度,影响产品的风味和品质的重要指标。由图3可知,3组樱菜发酵过程中,总酸含量均随发酵时间的延长呈持续上升趋势,42 d达到最大值,分析认为,一是由于发酵初期,以肠膜明串珠菌的异型乳酸发酵为主,产生的CO2、CHCOOH、CH3CH2OH导致发酵液中总酸含量升高[27-28],二是随着发酵时间的延长,乳酸菌成为优势菌,利用发酵樱菜中的营养物质发酵产生有机酸,由此创造的酸性环境促进部分抗酸乳酸菌的繁殖,产生大量乳酸。因此,3组总酸含量持续增加。自然发酵组总酸含量在前14 d上升程度不大,是因为蔬菜自身带有的乳酸菌和其他微生物在盐水、低温和密闭缺氧条件下代谢慢,产生的有机酸速度慢[29]。
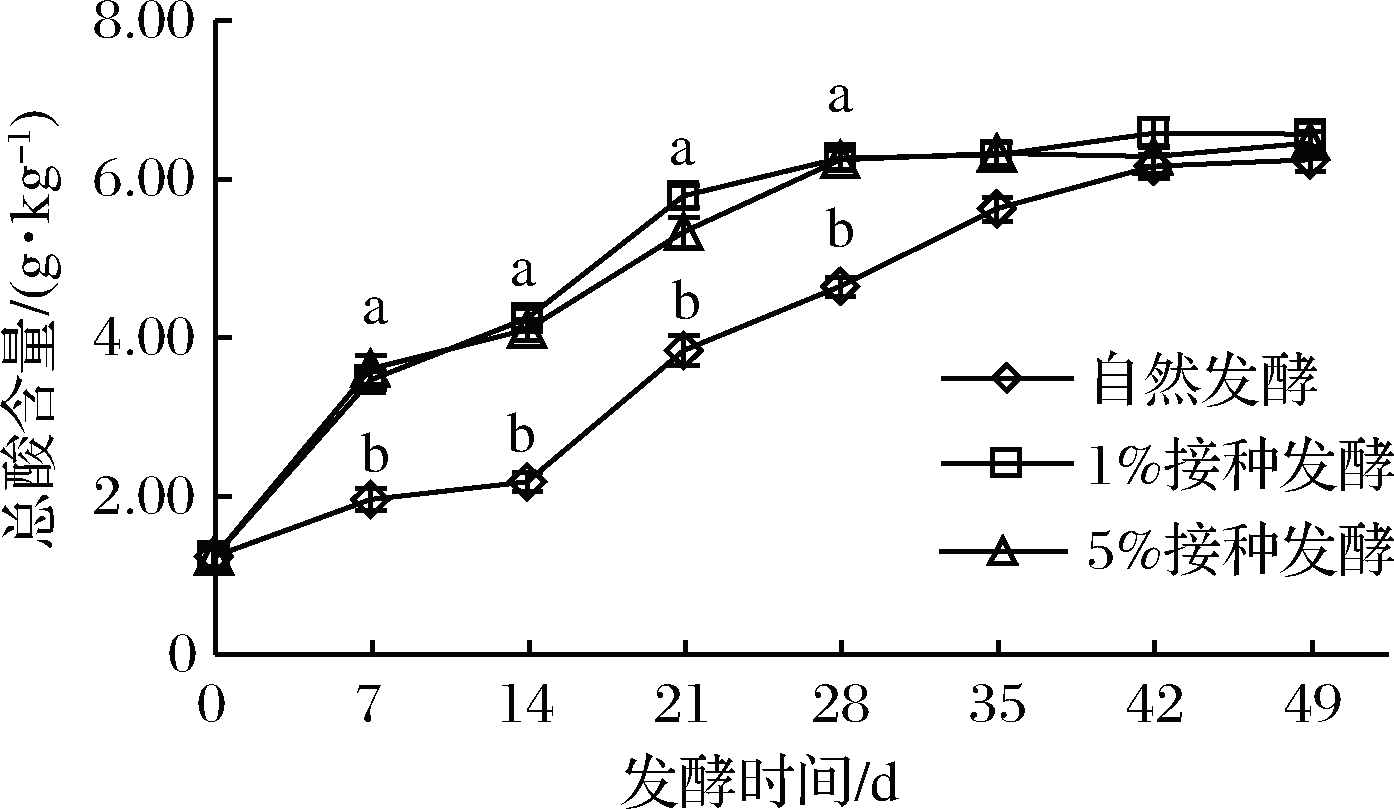
图3 樱菜发酵过程中总酸含量变化
Fig.3 Change of total acid during the fermentation of
L. sativum
人工接种组总酸含量以及上升速度显著高于自然发酵组(P<0.05),表明人工接种发酵利于缩短发酵时间,提高生产效率。
42~49 d,3组总酸含量上升程度趋于稳定,这可能是由于发酵后期,发酵环境中的碳源、氮源被大量消耗而不足,乳酸菌的代谢产酸能力减弱并逐渐停止,发酵环境中总酸含量趋于稳定[30]。
2.5 樱菜发酵过程中氨基酸态氮含量的变化
人工接种与自然发酵樱菜中氨基酸态氮含量与发酵时间关系如图4所示。3组发酵樱菜中氨基酸态氮含量变化趋势基本一致,均先增加后降低,自然发酵组上升速度与含量高于人工接种组。
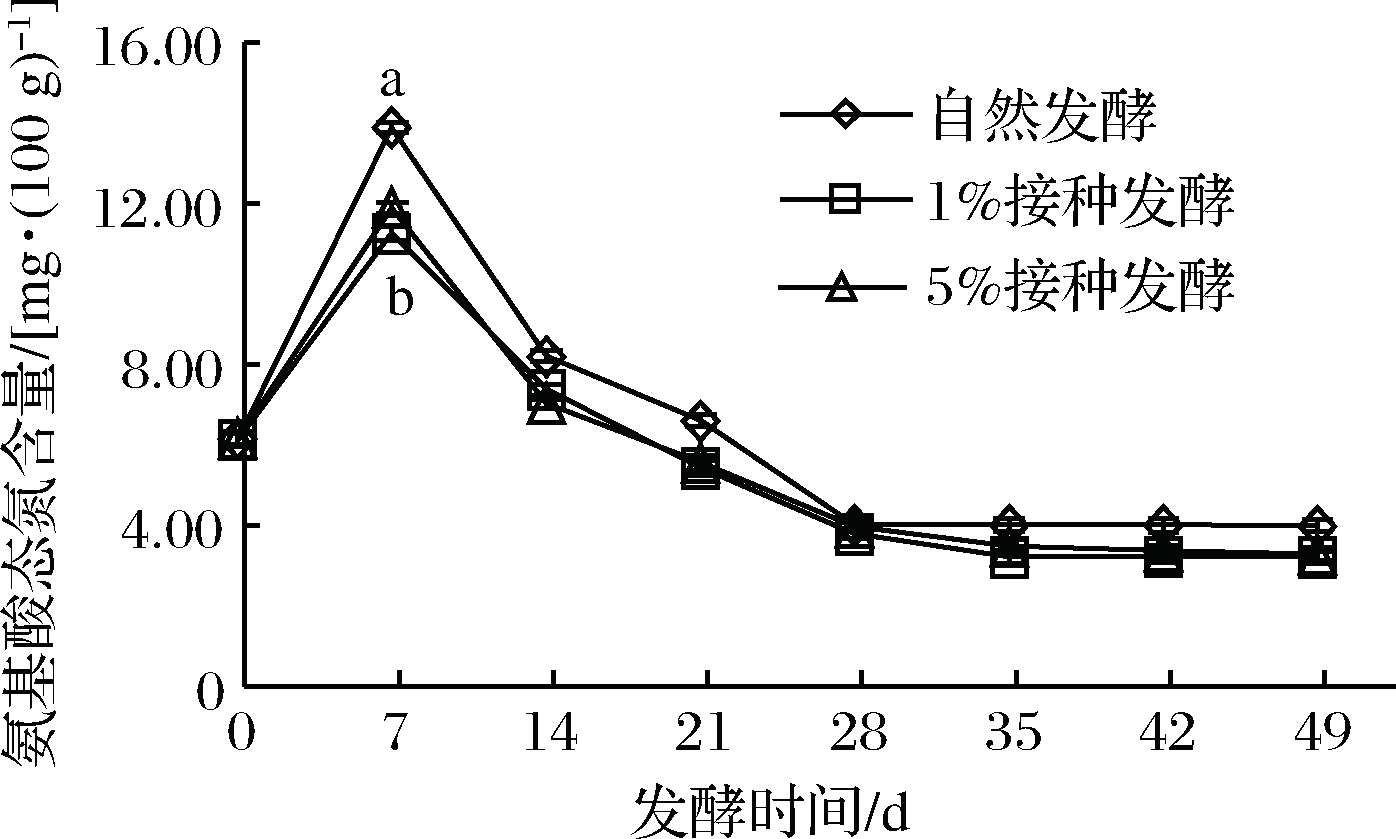
图4 樱菜发酵过程中氨基酸态氮含量变化
Fig.4 Change of amino acid nitrogen during the fermentation
of L. sativum
0~7 d呈现上升趋势,这可能是由于初期微生物数量少、代谢活动弱,但随着发酵时间的延长,微生物数量增多,代谢产生蛋白酶,氨基酸态氮含量逐渐增加。7~28 d整体呈下降趋势,28~49 d基本趋于稳定,可能由于微生物活动,造成酸性发酵环境抑制蛋白酶的活性,同时发酵樱菜中肽、氨基酸等逐渐被微生物利用[31]。
2.6 樱菜发酵过程中菌落总数的变化
菌落总数可直观反映发酵樱菜中杂菌数量,是判断食用安全性的重要指标。由图5可知,3组菌落总数在0~7 d呈上升趋势,7~14 d缓慢下降,14~28 d 下降幅度比较大,28~49 d 趋于平稳,自然发酵组略微升高。
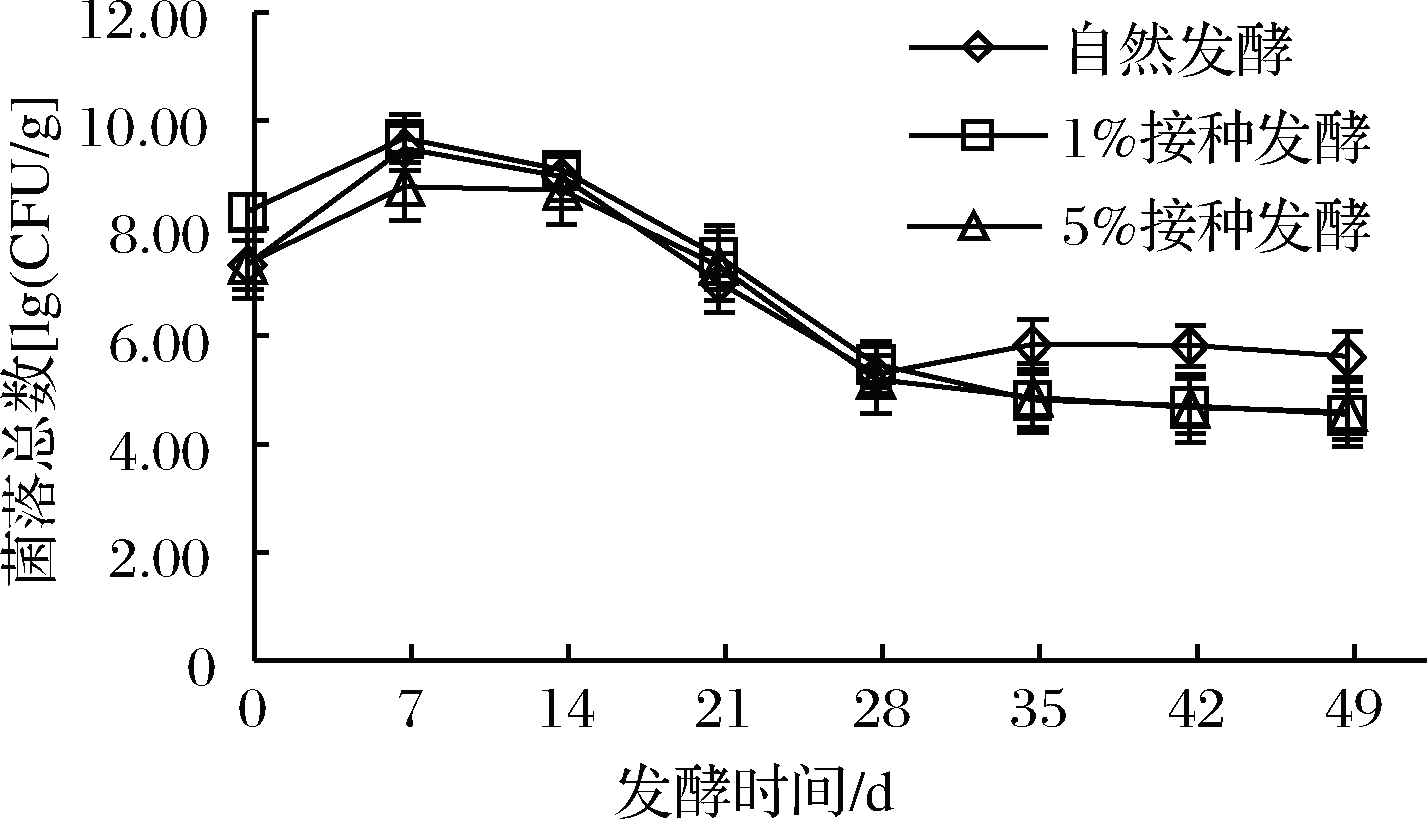
图5 樱菜发酵过程中菌落总数变化
Fig.5 Change of colony count during the fermentation of
L. sativum
发酵初期环境利于杂菌繁殖,随着发酵时间的延长,乳酸菌活力增强,逐渐成为优势菌,代谢产酸抑制杂菌生长,发酵后期自然发酵组菌落总数多于人工接种组,由此可知,人工接种发酵樱菜可提高食用安全性。
2.7 樱菜发酵过程中大肠菌群数的变化
大肠菌群是判断卫生安全的重要指标,由图6可知,3组发酵樱菜随着发酵时间的延长,大肠菌群呈下降趋势。发酵第0天,自然发酵组略高于人工发酵组,从发酵第7~49天,3组均未检出大肠菌群。这是由于大肠菌群对酸性比较敏感,随着乳酸菌发酵产酸,酸性和低氧环境导致大肠菌群生长受到抑制[32]。
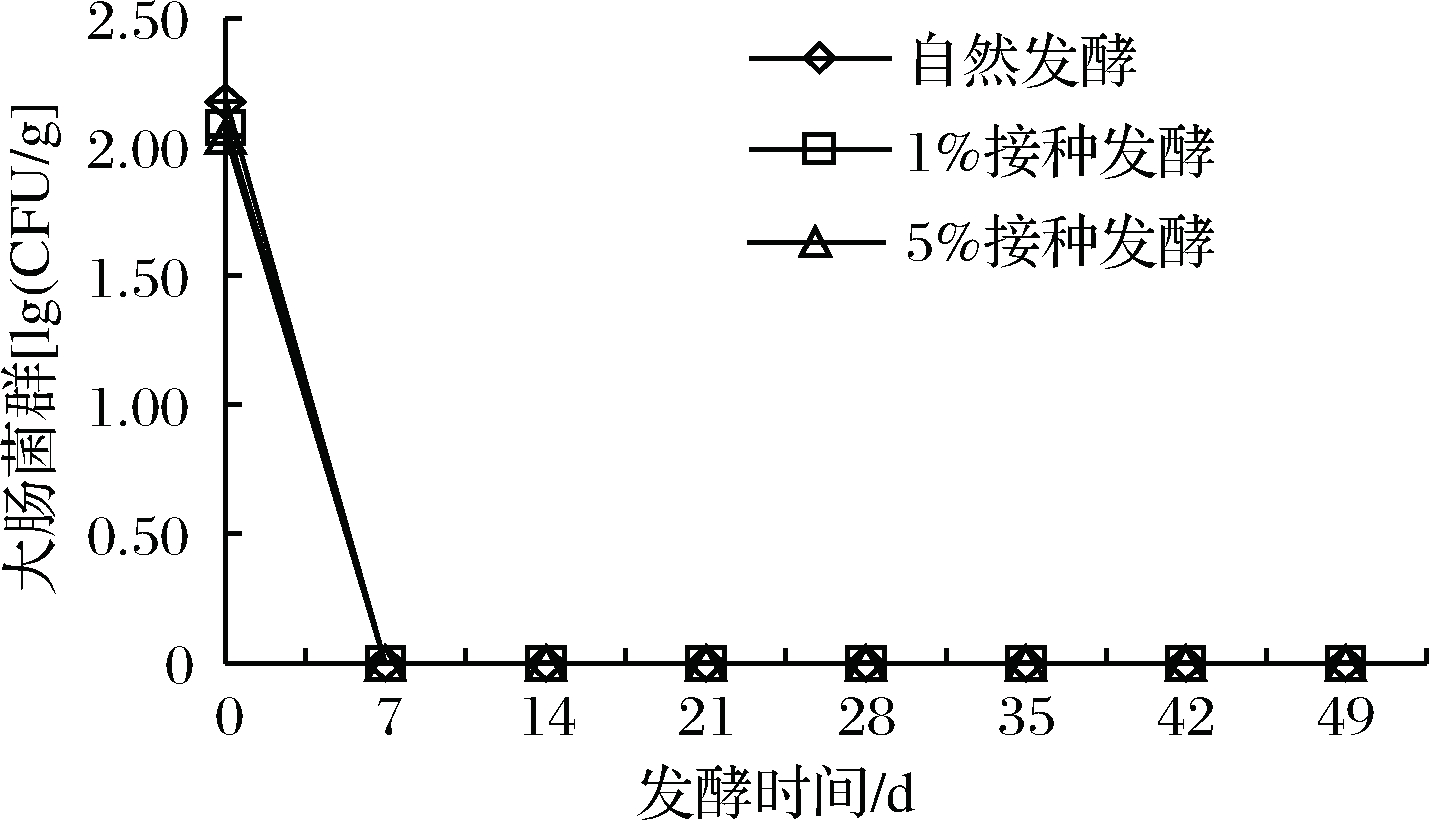
图6 樱菜发酵过程中大肠菌群变化
Fig.6 Change of coliform bacteria during the fermentation
of L. sativum
2.8 樱菜发酵过程中乳酸菌数的变化
乳酸菌是加速发酵樱菜成熟、形成风味的决定性因素,从图7可知,发酵起始阶段,由于肠膜明串珠菌的加入,人工接种发酵樱菜中乳酸菌数多于自然发酵组。3组发酵樱菜中乳酸菌均经历了增长期(0~14 d)、相对停滞期(14~21 d、42~49 d)和下降期(28~42 d)。体积分数1%接种组在发酵第14天时乳酸菌数达到峰值9.78 lg(CFU/g),同一发酵时期,自然发酵组中乳酸菌数小于人工接种组。
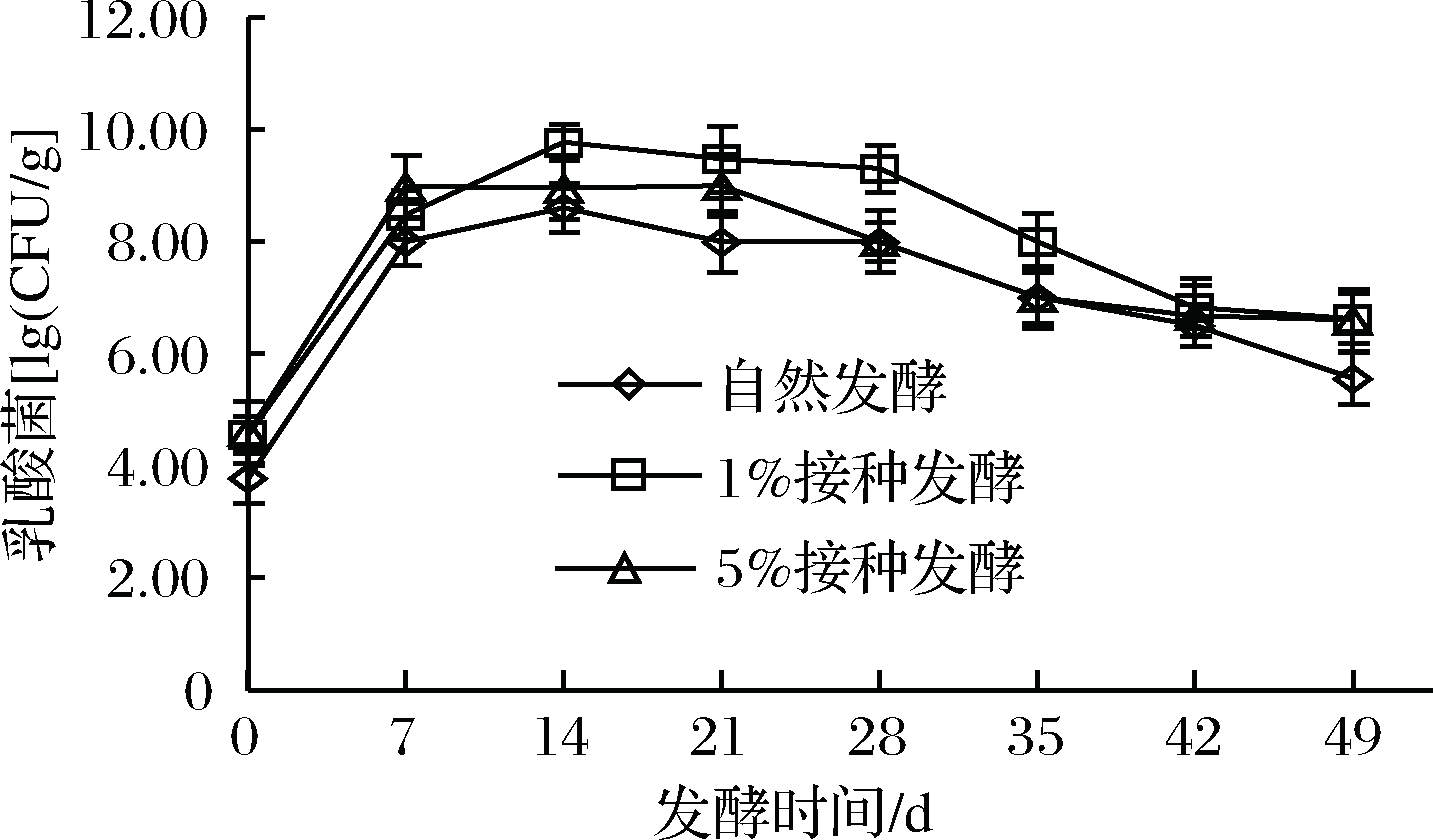
图7 樱菜发酵过程中乳酸菌总数变化
Fig.7 Change of lactic acid bacteria during the fermentation
of L. sativum
增长期是由于发酵过程中乳酸菌逐渐成为优势菌;进入停滞期和下降期,一是由于乳酸富集抑制不耐酸乳酸菌的生长[33],二是随着发酵时间的延长,微生物生长所需要的营养物质不足,使得乳酸菌数量减少。
2.9 樱菜发酵过程中酵母菌数的变化
由图8可知,酵母菌数量呈先增加后降低再趋于稳定,0~7 d酵母菌呈增加趋势,由于乳酸菌还未成为优势菌;从7~35 d逐渐下降,乳酸菌开始成为优势菌,产酸造成的酸性和低氧环境抑制了酵母菌的生长。整个发酵期间,自然发酵组中的酵母菌数多于人工接种组,说明人工接种对酵母菌的抑制优于自然发酵。
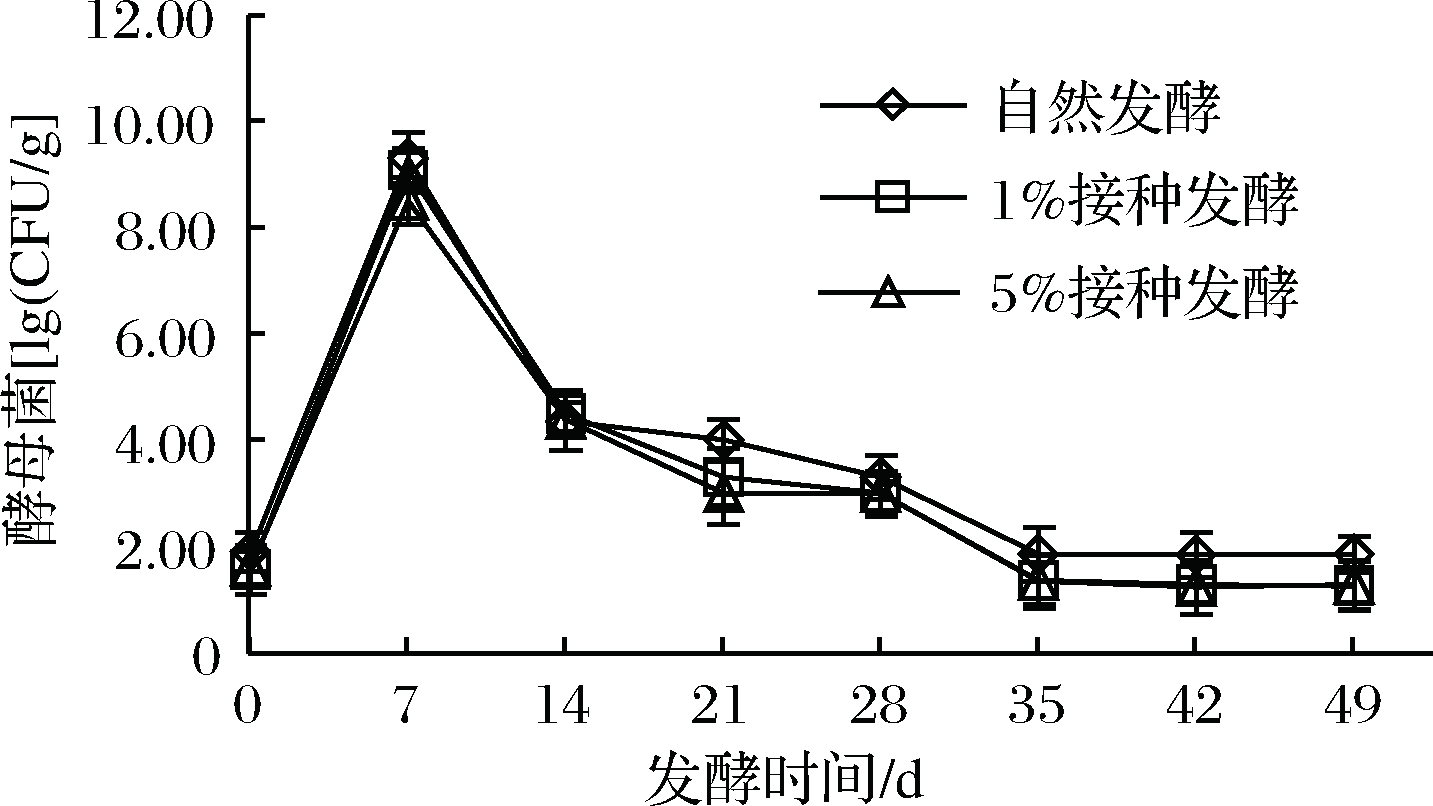
图8 樱菜发酵过程中酵母菌变化
Fig.8 Change of yeasts during the fermentation of
L. sativum
3 结论
通过分析降解亚硝酸盐肠膜明串珠菌发酵对樱菜化学成分和微生物变化,研究人工接种发酵和自然发酵对樱菜品质的影响,发现人工接种发酵樱菜亚硝酸盐含量低且降解速度快、总酸含量高、pH下降快、乳酸菌数量多,发酵周期比自然发酵缩短7 d左右;菌落总数和氨基酸态氮含量少,接种发酵比自然发酵食用安全性更高。
通过统计学分析,人工接种发酵和自然发酵相比,亚硝酸盐含量、总酸含量、氨基酸态氮含量、乳酸菌数量差异显著(P<0.05),人工接种发酵组对菌落总数、大肠菌群和酵母菌等有害菌的抑制效果优于自然发酵组。
综合分析,人工接种发酵樱菜优于传统自然发酵,且以体积分数1%接种量较好。
[1] LEE B H,HYUN J Y,MYEONG S P,et al.Tiansformation of the glycosides form food materials by piobiotics and food microorganisms[J].Microbiol Biotechn,2006,16(4):497-504.
[2] EOM H J,SEO D M,HAN N S. Selection of psychrotrophic Leuconostoc spp. producing highly active extransucrase from lactate fermented vegetables[J]. International Journal of Food Mcrobiology,2007,117(1):61-67.
[3] 李冬梅,白月娥,李玲,等.SDS-PAGE电泳法分析朝鲜族辣白菜中乳酸菌分布[J].食品科技,2012,37(11):10-13.
[4] 韩新锋,刘书亮,张艾青,等.产细菌素植物乳杆菌纯种半固态发酵对泡菜品质的影响[J].中国酿造,2012,31(7):72-76.
[5] 邹礼根,吴元锋,赵芸.蔬菜乳酸菌腌渍发酵过程亚硝酸盐变化研究[J].食品科技,2006(10):86-88.
[6] 成文玉,金红星,胡炎华,等.明串珠菌筛选与分类的研究进展[J].中国酿造,2010(3):7-9.
[7] 任大勇,李昌,秦艳青,等.乳酸菌益生功能及作用机制研究进展[J].中国兽药杂志,2011,45(2):47-50.
[8] 邵亚东.传统发酵乳制品中乳酸菌产双乙酰特性的研究[D].呼和浩特:内蒙古农业大学,2007.
[9] 宋春璐,胡文忠,陈晨,等.酸菜发酵工艺与贮藏特性的研究进展[J].食品工业科技,2016,37(9):376-379.
[10] 韩宏娇,丛敏,李欣蔚,等.自然发酵酸菜化学成分含量和微生物数量的动态变化及其相关性分析[J].食品工业科技,2019,40(2):148-153.
[11] GB 5009.33—2016《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》[S].北京:中国标准出版社,2016.
[12] GB 5009.7—2016《食品安全国家标准 食品中还原糖的测定》[S].北京:中国标准出版社,2016.
[13] GB 5009.235—2016《食品安全国家标准 食品中氨基酸态氮的测定》[S].北京:中国标准出版社,2016.
[14] GB/T 12456—2008《食品中总酸的测定》[S].北京:中国标准出版社,2016.
[15] GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[S].北京:中国标准出版社,2016.
[16] GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》[S].北京:中国标准出版社,2016.
[17] GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》[S].北京:中国标准出版社,2016.
[18] GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》[S].北京:中国标准出版社,2016.
[19] WOLF G,HAMMES W P.Effect of hematin on the activities of nitritereductase and catalase in lactobacilli[J].Archive Microbiology,1988,149:220-224.
[20] 周光燕,张小平,钟凯,等.乳酸菌对泡菜发酵过程中亚硝酸盐含量变化及泡菜品质的影响研究[J].西南农业学报,2006,19(2):290-293.
[21] 何淑玲.泡菜发酵过程中亚硝酸盐生成何降解机理的研究[D].北京:中国农业大学,2006.
[22] XIONG T,LI J,LIANG F,et al.Effects of salt concentration on Chinese sauerkraut fermentation[J].LWT-Food Science and Technology,2016,69(3):169-174.
[23] WU R N,WU Z X,ZHAO C Y,et al.Identification of lactic acid bacteria in Suancai,a traditional northeastern Chinese fermented food,and salt response of Lactobacillus paracasei,LN-1[J].Annals of Microbiology,2013,64(3):1 325-1 332.
[24] 杜书.酸菜自然发酵过程中风味及质地变化规律研究[D].沈阳:沈阳农业大学,2013.
[25] 马欢欢,吕欣然,林洋,等. 传统东北酸菜自然发酵过程中乳酸菌与营养物质同步分析[J].食品与发酵工业,2017,43(2): 79-84.
[26] 马艳弘,魏建明,侯红萍,等.发酵方式对山药泡菜理化特性及微生物变化的影响[J].食品科学,2016,37(17):179-184.
[27] XIONG T,PENG F.Changes and metabolic characteristics of main microorgaisms during Chinese sauerkraut fermentation[J].Food Science,2005,36:158-161.
[28] 丛敏,李欣蔚,武俊瑞,等.PCR-DGGE分析东北传统发酵酸菜中乳酸菌多样性[J].食品科学,2016,37(7):78-82.
[29] 刘洪.自然发酵与人工接种泡菜发酵过程中品质变化规律的动态研究[D].成都:西华大学,2012:9-36.
[30] 黄存辉,朴泓洁,金清,等.肠膜明串珠菌发酵对四川泡菜中有机酸生成的影响[J].食品科技,2018,43(6):23-28.
[31] 杨瑞,张伟,徐小会,等.泡菜发酵过程中主要化学成分变化规律的研究[J].食品工业科技,2005,26(2):95-98.
[32] JIANG X,QING S,WU T,et al.Effect of mixed fermentation of lactic acid bacteria on the quality of pickled cabbage[J]. Food and Ferment Industry,2016,42(5):126-131.
[33] 李欣,武俊瑞,田甜,等.大庆自然发酵酸菜中乳酸菌的分离鉴定及耐酸菌株初步筛选[J].食品科学,2014,35(1):150-154.