阿拉伯木聚糖(arabinoxylan)是谷物中最主要的非淀粉多糖[1],基本结构是以β-1,4糖苷键连接的D-吡喃木糖线型主链,通过C(O)-2、C(O)-3或C(O)-2,3糖苷键连接α-L-阿拉伯呋喃糖基取代物,侧链C(O)-5位上存在以酯键相连的阿魏酸[2]。在大米和高粱中阿拉伯木聚糖结构相对简单,而在大麦、小麦、燕麦、黑小麦、玉米等谷物中相对复杂。阿拉伯呋喃糖苷酶(EC 3.2.1.55)可以特异性水解阿拉伯木聚糖侧链上的α-1,2、α-1,3和α-1,5糖苷键[3],从而协同木聚糖酶促进阿拉伯木聚糖水解为寡糖。阿拉伯呋喃糖苷酶被归类于糖基水解酶GH3、GH43、GH51、GH54和GH62家族[5],不同家族水解酶表现出不同的底物特异性,如GH43家族成员倾向于水解寡糖中的侧链,GH51和GH54家族成员可水解阿拉伯聚糖和木聚糖的侧链,仅GH62家族成员特异性水解阿拉伯木聚糖侧链[6]。其中来源于草酸青霉菌(Penicillium oxalicum sp.68)的阿拉伯呋喃糖苷酶PoAbf62A即属于GH62家族,且研究表明,PoAbf62A仅有α-1,3-阿拉伯呋喃糖苷酶活性[7],具有特殊的研究和应用价值。
目前,已有利用酵母、大肠杆菌、芽孢杆菌等表达宿主进行阿拉伯呋喃糖苷酶的重组表达的研究[8-10]。相较于其他系统,毕赤酵母具有能够将外源基因稳定地同源重组至基因组;胞外分泌蛋白种类少,易于分离纯化目的蛋白;便于高密度发酵等优势[11]。因此,本研究选取毕赤酵母GS115重组表达PoAbf62A,并对酶学性质进行研究,优化重组菌株的发酵条件,为糖苷水解酶家族的研究提供参考,并为开发以阿拉伯木聚糖为代表的半纤维素资源利用的新方法提供理论基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株和质粒
大肠杆菌(Escherichia coli) DH5α,毕赤酵母(Pichia pastoris) GS115和pPIC9K质粒,本实验室保存。
1.1.2 试剂
限制性内切酶SalⅠ、NotⅠ和EcoRⅠ、rTaq酶、质粒提取试剂盒和胶回收试剂盒,TaKaRa公司;对硝基苯-α-L-阿拉伯呋喃糖苷(p-nitrobenzene-L-arabinofuranoside,pNPAF)、抗生素G418,上海索莱宝生物科技有限公司;低分子质量标准蛋白Marker,BBI生命科学有限公司。
1.1.3 培养基
YPD培养基(g/L):酵母提取物10,蛋白胨20,葡萄糖20;
MD固体培养基(g/L):葡萄糖20,YNB (无氨基酵母氮源)13.4,生物素0.000 4,琼脂20;
BMGY培养基(g/L):酵母提取物10,蛋白胨20,YNB 13.4,甘油的体积分数为1.0%,1 mol/L磷酸盐缓冲液(pH 6.0),体积分数为10%;
BMMY培养基(g/L):酵母提取物10,蛋白胨20,YNB 13.4,甲醇的体积分数为1.0%,1 mol/L磷酸盐缓冲液(pH 6.0),体积分数为10%。
1.1.4 主要仪器
琼脂糖凝胶电泳仪,美国Bio-Rad公司;JD-801凝胶成像仪,江苏省捷达科技发展有限公司;Spectra Max Plus 384酶标仪,美国MDC公司;HisTrapTM excel (1 mL)色谱柱,GE Healthcare公司;Mastercycler pro PCR仪,德国Eppendorf公司。
1.2 实验方法
1.2.1 poabf62a基因的克隆和重组表达
参照GenBank中poabf62a基因序列(GenBank ID:MG874674),设计重组蛋白序列:根据毕赤酵母密码子偏好性优化poabf62a序列,在其3’端添加His-tag序列,并在其5’和3’端分别添加NotⅠ和EcoR I酶切位点和保护碱基,由金唯智生物科技(苏州)有限公司合成,获得的基因片段经NotⅠ和EcoR I双酶切后,与表达载体pPIC9K连接,获得重组表达质粒pPIC9K-poabf62a,转化至大肠杆菌DH5α,测序正确后备用。
表达质粒pPIC9K-poabf62a经SalⅠ酶切线性化后电转入毕赤酵母GS115感受态细胞中,涂布于含有G418的MD平板筛选转化子,30 ℃培养48 h;待长出菌落后,随机挑取转化子于3 mL YPD培养基中,30 ℃培养36 h,提取基因组作为PCR模板鉴定阳性转化子,所用上下游引物序列为GAGGTCTCCTATCTCTAACTTGGACC/TGGTGGTGATGGTGGTG-CTT。
挑取阳性转化子单克隆至50 mL BMGY培养基,30 ℃培养24 h后8 000 r/min离心5 min收集菌体,加入50 mL BMMY培养基,每24 h加入500 μL甲醇,30 ℃培养5 d诱导目的基因表达,8 000 r/min离心5 min收集上清液,SDS-PAGE电泳检测重组酶,筛选表达量较高的转化子。
将筛选获得的重组酶表达量最高的转化子接种于50 mL BMGY培养基,30 ℃培养24 h后,8 000 r/min离心5 min,收集菌体重悬于50 mL BMMY培养基,进行甲醇诱导,甲醇初始体积分数为1.0%,每24 h补加500 μL甲醇进行持续诱导,5 d后于8 000 r/min离心5 min收集上清液,利用Ni-NTA镍亲和层析柱纯化重组阿拉伯呋喃糖苷酶,利用SDS-PAGE检测纯度。
1.2.2 重组PoAbf62A的酶活力测定
参照HU等[7]的方法,以pNPAF为底物检测酶活力,标准反应体系200 μL,其中含150 μL 20 mmol/L pH 4.5醋酸钠缓冲液,25 μL 0.5 mg/mL pNPAF,纯化的酶液25 μL;空白对照中含有等量沸水浴灭活的酶液。37 ℃反应30 min,加入50 μL 0.5 mol/L Na2CO3终止反应,静置30 min,用酶标仪测定OD405,根据对硝基苯酚标准曲线计算反应体系中对硝基苯酚的生成量。37 ℃下1 mg固体酶(或1 mL液体酶)每1 min释放1 μmol/L对硝基苯酚所需的酶量定义为1个酶活力单位(U/mg或U/mL)。
1.2.3 重组PoAbf62A的酶学性质研究
1.2.3.1 酶的最适温度及其热稳定性
将标准反应体系(见1.2.2)分别于30、35、40、45、50、55和60 ℃水浴反应30 min,测定PoAbf62A酶活力,以其中测得的最高酶活力设为100%。将适量纯化后的酶液分别置于40、45和50 ℃恒温水浴保温90 min,每间隔15 min取样1次,于最适反应条件下测定残余酶活力,以保温0 min时的酶活力设为100%。
1.2.3.2 酶的最适pH及其pH稳定性
配制20 mmol/L pH 2.5~7.0的醋酸-醋酸钠缓冲液,分别取150 μL不同pH的缓冲液与25 μL纯化的酶液和25 μL 0.5 mg/mL pNPAF混合,37 ℃反应30 min后,测定PoAbf62A酶活力,以其中测得的最高酶活力设为100%。将适量纯化后的酶液置于上述不同pH缓冲液中,4 ℃放置24 h后,于最适反应条件下测定其残余酶活力,其中酶活力最高的设为100%。
1.2.3.3 金属离子对重组PoAbf62A活性的影响
在标准反应体系(见1.2.2)中加入终浓度为1 mmol/L的金属离子(K+、Ca2+、Fe2+、Mn2+、Fe3+、Ni2+、Ba2+、Mg2+、Co2+、Zn2+、Cu2+、Al3+),以不加金属离子的反应体系作为对照(酶活力设为100%),测定各金属离子对PoAbf62A活性的影响。
1.2.3.4 重组PoAbf62A的动力学研究
在标准反应体系(见1.2.2)中加入不同浓度pNPAF (0.16~2.60 mmol/L),在最适条件下测定酶活力,利用米氏方程双倒数法(Lineweavere-Burk)作图并绘制曲线,计算Km、vmax和kcat值。
1.2.4 重组PoAbf62A表达条件优化
1.2.4.1 诱导表达时间
将BMGY培养基中酵母菌离心后,接种至BMMY培养基,使OD600 值为1.0,甲醇初始体积分数为1.0%,30 ℃ 250 r/min发酵7 d,每24 h补加甲醇使甲醇的体积分数为1.0%,并取1 mL发酵液离心取上清液,以pNPAF为底物测定发酵液酶活力。
1.2.4.2 诱导温度
将BMGY培养基中酵母菌离心后,分别接种至BMMY培养基,使OD600 值为1.0,甲醇初始体积分数为1.0%,分别置于26、28、30、32和34 ℃恒温培养箱中,调整转速为250 r/min,发酵5 d,每24 h补加甲醇使甲醇体积分数为1.0%,发酵结束后,发酵液离心取上清液,以pNPAF为底物测定发酵液酶活力。
1.2.4.3 甲醇诱导体积分数
将BMGY培养基中酵母菌离心后,接种至BMMY培养基,使OD600 值为1.0,分别添加甲醇使甲醇的体积分数为0.25%、0.5%、1.0%、1.5%、2.0%和2.5%,30 ℃ 250 r/min发酵5 d,每24 h补加1次相应体积分数的甲醇,发酵结束后,分别取发酵液离心,以pNPAF为底物测定发酵液酶活力。
1.2.4.4 BMMY培养基的接种量
将含有pPIC9K-poabf62a的转化子在BMGY培养基中扩大培养至对数生长期(30 ℃培养24 h),8 000 r/min离心收集菌体,接种至BMMY培养基,使菌体浓度(OD600)分别为1.0、3.0、5.0、7.0和9.0,甲醇初始体积分数为1.0%,30 ℃ 250 r/min发酵5 d,每24 h补加甲醇使甲醇的体积分数为1.0%并进行持续诱导,发酵结束后,发酵液离心取上清液,以pNPAF为底物测定发酵液酶活力。
1.2.4.5 响应面试验
根据以上单因素试验结果,选出3个显著性较明显的因素:甲醇体积分数(A)、温度(B)、接种量OD600(C)3个因素为自变量,发酵液酶活力为因变量,利用Design Expert 8.0.6软件设计Box-Behnken实验,确定最佳发酵工艺参数组合并进行验证。
2 结果与分析
2.1 PoAbf62A的克隆和表达纯化
GenBank数据库中poabf62a基因全长996 bp,编码332个氨基酸残基,预测蛋白分子质量为33 kDa。根据毕赤酵母密码子偏好性,优化poabf62a序列,通过化学合成方法合成优化的poabf62a基因,并在3’端添加His-tag序列,在其5’和3’端分别加入限制性酶切位点和保护碱基,以构建pPIC9K-poabf62a表达质粒。pPIC9K-poabf62a线性化后电转化至毕赤酵母GS115,经PCR验证(图1-a)及表达量筛选(图1-b),挑选表达量最高的阳性转化子表达重组酶,并利用Ni-NTA镍亲和层析柱分离纯化,SDS-PAGE电泳显示重组酶分子质量与预测结果基本一致(图1-c)。
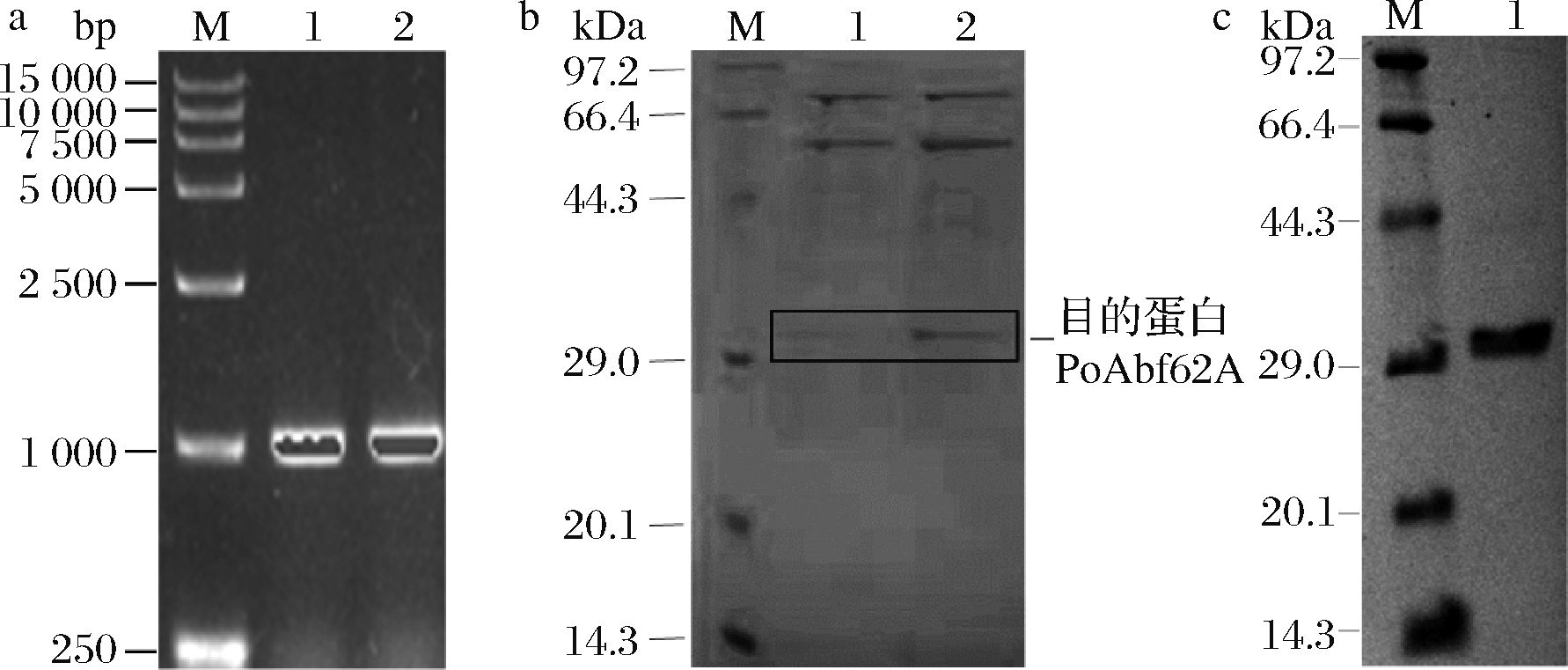
a-PCR鉴定;b-筛选;c-纯化蛋白
a:M-15 000 bp Marker;1-质粒为模板的PCR;2-重组菌株基因组
为模板的PCR;b:M-标准蛋白Marker,1、2-转化子发酵上清液;
c:M-标准蛋白Marker;1-纯化的酶液
图1 重组子的PCR鉴定和筛选及纯化蛋白的
SDS-PAGE鉴定
Fig.1 Identification and screening of recombinants
and the purified PoAbf62A in SDS-PAGE
2.2 重组PoAbf62A的酶学性质
2.2.1 重组PoAbf62A的最适反应温度和pH
不同反应温度下测定重组PoAbf62A的酶活力,结果表明,重组酶最适反应温度为40 ℃,当反应温度在30~45 ℃时,相对酶活力>80%;当反应温度为50 ℃,相对酶活力约为50%;当反应温度>55 ℃,相对酶活力<20% (图2-a)。在不同pH缓冲液(pH 2.5~7.0)下测定重组PoAbf62A的酶活力,结果表明,重组酶的最适pH值为4.5,在pH 4.0~5.0的范围内相对酶活力均在80%左右;在pH 5.5时相对酶活力约为40%;缓冲液pH<4.0或>6.0,相对酶活力<40% (图2-b)。

a-温度;b-pH
图2 温度和pH对重组PoAbf62A活力的影响
Fig.2 Effects of temperature and pH on the activity of
recombinant PoAbf62A
将适量酶液分别在40、45、50 ℃温度下恒温水浴90 min,每间隔15 min取酶液于最适反应条件下测定残余酶活力,将保温0 min时的酶活力设为100%。由图3-a可知,该酶在40、45、50 ℃条件下较稳定,其中40 ℃时最稳定,90 min后酶活力仍保留初始酶活力的50%左右,45 ℃和50 ℃为其次,90 min后分别能剩余20%左右的酶活力。
取适量酶液分别置于pH 2.5~7.0的缓冲液中,4 ℃放置24 h,于最适反应条件下测定残余酶活力,其中酶活力最高的设为100%。由图3-b可知,重组酶在pH 4.5比较稳定,处理24 h酶活力最高;在pH 5.0~7.0条件下处理24 h后,残余酶活力为20%左右;在pH 2.5~4.0条件下处理24 h后,基本丧失活性。
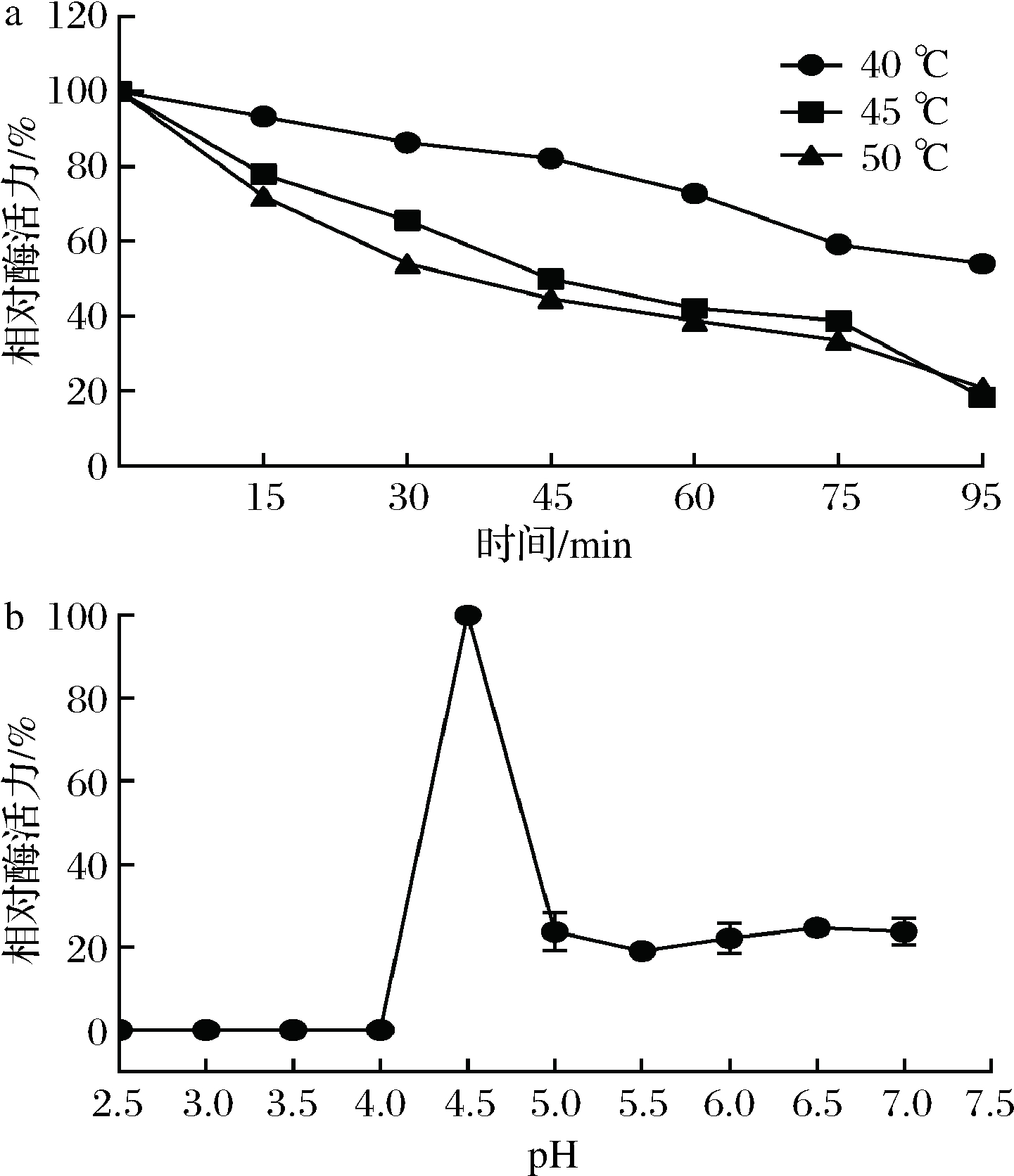
a-温度;b-pH
图3 温度和pH对重组PoAbf62A稳定性的影响
Fig.3 Effects of temperature and pH on the stability of
recombinant PoAbf62A
2.2.2 金属离子对重组PoAbf62A活性的影响
在以终浓度为1 mmol/L金属离子的标准体系(见1.2.2)中反应测量纯化后重组PoAbf62A酶活力, Fe3+、Mn2+、Cu2+和Fe2+对重组PoAbf62A的酶活力有强烈的抑制作用,使其几乎没有酶活力;Ni2+和Ba2+对重组PoAbf62A的酶活力有微弱的抑制作用,酶活力分别为对照的90.3%、79.8%;Zn2 +、Co2+、Mg2+和Al3+对重组PoAbf62A的酶活力有不同程度的促进作用;K+、Ca2+对其酶活力几乎没有影响(表1)。
表1 金属离子对重组PoAbf62A酶活力的影响
Table 1 Effects of metal ions on the activity of
recombinant PoAbf62A
金属离子酶活力/(U·mL-1)相对酶活力/%空白33.43100.0Mn2+00Zn2+39.30117.6K+33.43100.0Fe3+00Co2+37.05110.8Mg2+40.20120.2Fe2+00Ba2+26.6779.8Cu2+00Al3+39.30117.6Ca2+33.62100.6Ni2+30.1990.3
2.2.3 重组PoAbf62A的动力学
纯化后重组PoAbf62A的酶活力为0.67 U/mg,利用Lineweavere-Burk双倒数作图,分别求取以pNPAF为底物,重组PoAbf62A的Km、Vmax和kcat值。所得米氏方程为y=0.271 3x+0.110 5 (R2=0.997),重组PoAbf62A的动力学常数Km、Vmax和kcat值分别为2.46 mmol/L、9.05 μmol/(min·g)和0.22 s-1。
2.3 重组PoAbf62A的发酵优化
2.3.1 单因素实验
如图4-a所示,重组菌株在BMMY培养基中培养到120 h时,发酵液酶活力最高,为0.12 U/mL。因此,本研究将诱导表达重组酶的时间定为120 h。
在不同诱导温度下发酵,当发酵温度为30 ℃时发酵液酶活力最高,26和34 ℃时发酵液酶活力分别只有最优发酵温度时的20%和10%(图4-b)。当温度过低时,微生物的代谢缓慢,也不利于营养物质的运输,而温度过高时,蛋白质变性降解,因此温度过高或过低都不利于重组酶的表达。
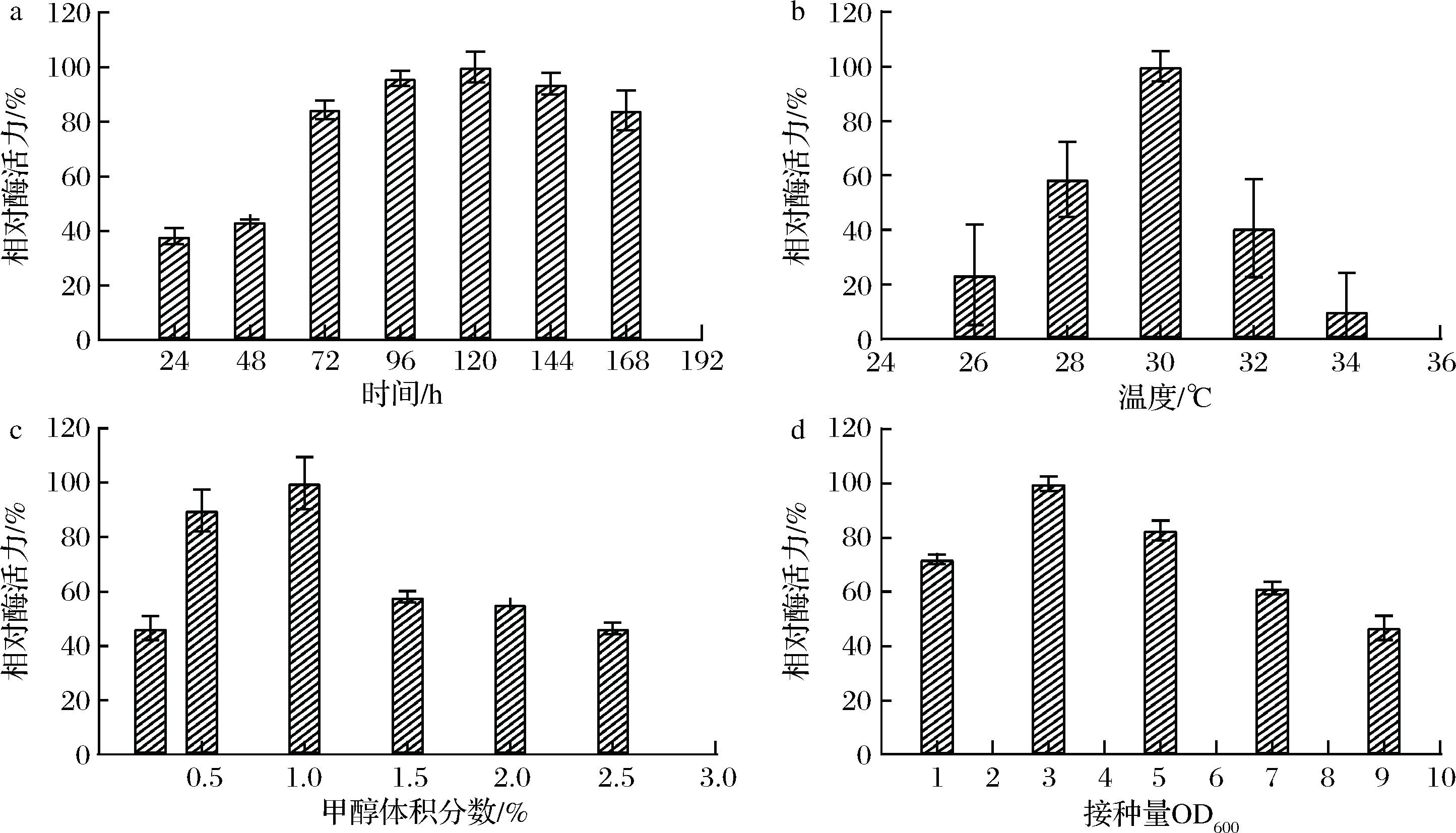
a-诱导时间;b-诱导温度;c-甲醇体积分数;d-接种量
图4 诱导时间、诱导温度、甲醇体积分数和接种量对重组菌株产酶的影响
Fig.4 The effects of induction period,temperature,methanol volume fraction and inoculation size on the
yield of recombinant PoAbf62A
在BMMY培养基中添加诱导剂甲醇使初始体积分数分别为0.25%、0.5%、1.0%、1.5%、2.0%和2.5%,且每隔24 h添加1次甲醇,如图4-c所示,当添加甲醇的体积分数为1.0%时,发酵5 d后发酵液酶活力最高。
比较BMMY培养基中初始菌体浓度(OD600)分别为1.0、3.0、5.0、7.0和9.0时,发酵完成后发酵液酶活力结果如图4-d所示,当初始OD600值为3.0时,发酵5 d后发酵液酶活力最高。
2.3.2 响应面分析
根据Box-Behnken试验设计原理,设计了17个实验的响应分析实验,以甲醇体积分数(A)、温度(B)、接种量OD600(C)3个因素为自变量,发酵液酶活力为因变量,实验设计与结果见表2。
表2 Box-Behnken实验设计与结果
Table 2 Box-Behnken test design and results
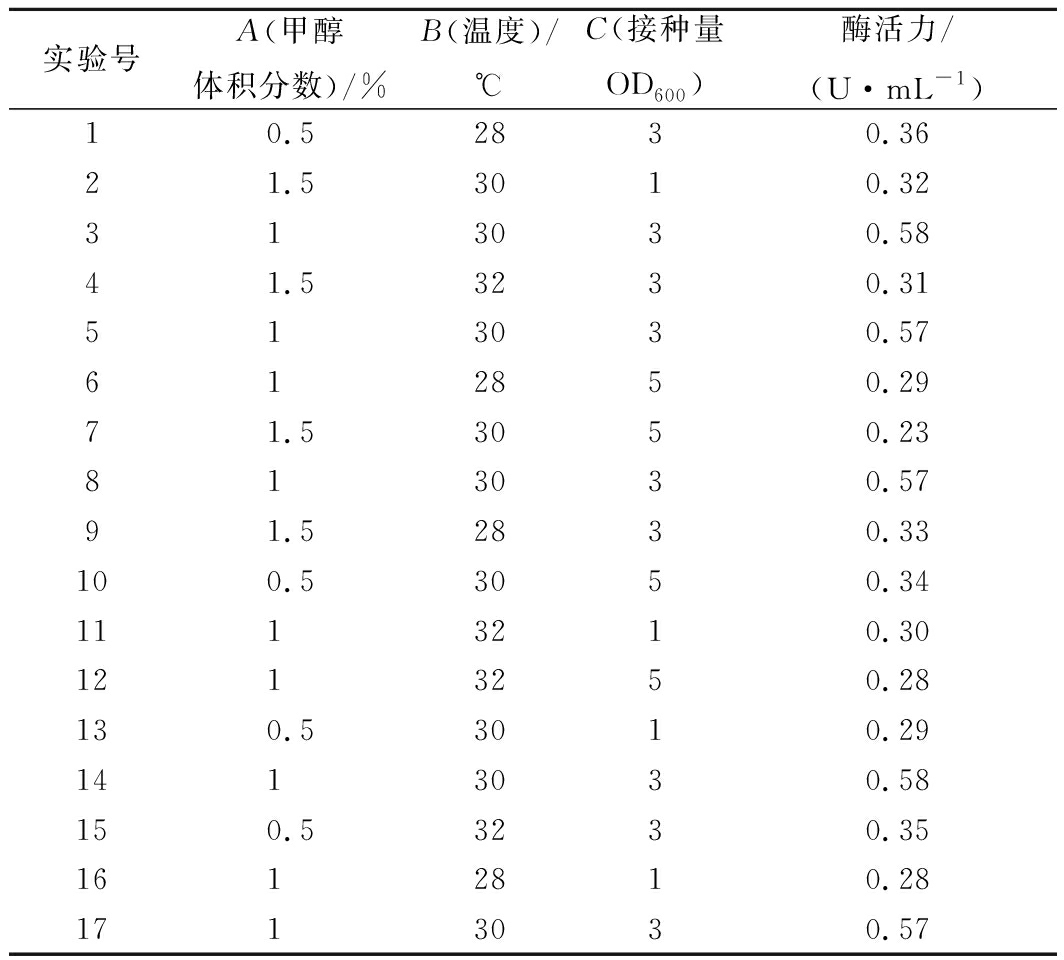
实验号A(甲醇体积分数)/%B(温度)/℃C(接种量OD600)酶活力/(U·mL-1)10.52830.3621.53010.32313030.5841.53230.31513030.57612850.2971.53050.23813030.5791.52830.33100.53050.341113210.301213250.28130.53010.291413030.58150.53230.351612810.281713030.57
运用软件Design-Expert 8.0.6进行回归分析,获得二次拟合回归方程:Y=0.57-0.018A-0.003B-0.006 7C-0.001 3AB-0.038AC-0.003 8BC-0.11A2-0.12B2-0.17C2(R2=0.998 1),对实验数据进行方差分析模型P>F<0.000 1,失拟项的P>F>0.05表明回归方程极显著,该方程为重组菌株发酵产酶提供了一个合适的模型,因此可用此模型代替实际实验对重组菌株发酵产酶进行分析和预测。根据软件计算回归模型存在的最大点为:A=1.05,B=30.49,C=2.36,根据实际情况将参数修改为:A=1.05,B=30.5,C=2.4。即得最佳发酵条件为:添加诱导剂甲醇的体积分数为1.05%,诱导表达温度为30.5 ℃,BMMY培养基中接种量OD600值为2.4,在此条件下预测发酵液酶活力为0.55 U/mL,实验实际值为0.51 U/mL,与预测结果基本接近,说明所建模型拟合度良好且可靠。
3 结论与讨论
本研究将来源于草酸青霉菌P. oxalicum sp.68的阿拉伯呋喃糖苷酶PoAbf62A在毕赤酵母GS115中重组表达,具有较好的温度稳定性,对pH较敏感,在40 ℃和pH 4.5的条件下具有最优水解活性。此前报道的来自稻平脐蠕孢、特异腐质霉和青春双歧杆菌的阿拉伯呋喃糖苷酶,其最适pH值分别为5.0、6.7和6.0,最适温度分别为50、53和40 ℃[12],PoAbf62A在酸性环境中表现出更好的活性和稳定性,使得该酶在果汁、酒类等食品加工领域具有更大的优势。
为了获得更多的重组酶,本研究结合单因素实验和响应面分析对发酵诱导条件进行了优化,即BMMY培养基中毕赤酵母工程菌接种量为OD600值为2.4,添加诱导剂甲醇的体积分数为1.05%,且每24 h补加1次,30.5 ℃ 250 r/min诱导120 h,获得的发酵液中酶活力为0.51 U/mL。以pNPAF为底物测得纯化后酶的Km值为2.46 mmol/L,最大反应速度Vmax值为9.05 μmol/(min·g),kcat值为0.22 s-1。
研究表明,草酸青霉菌P. oxalicum sp.68的阿拉伯呋喃糖苷酶PoAbf62A属于可特异性水解阿拉伯木聚糖侧链的GH62水解酶家族[12],但不同于其他GH62家族成员,该酶仅具有α-1,3-阿拉伯呋喃糖苷酶活性[11]。目前,对GH62家族的阿拉伯呋喃糖苷酶研究显示,大多数酶仅能降解单取代的阿拉伯糖侧链[13],能降解双取代阿拉伯糖侧链的阿拉伯呋喃糖苷酶大多来自于GH43家族,但对α-1,2和α-1,3糖苷键无选择性[14]。PoAbf62A对取代阿拉伯糖侧链和糖苷键的特异选择性,使其在生物技术和多糖结构研究中具有较大的应用潜力。
近年来,随着能源问题的日益突出,半纤维素资源利用价值逐渐受到人们的重视。半纤维素是由戊碳糖和(或)己碳糖及其衍生物通过糖苷键形成的不均一的带有支链的混合聚糖[15],其最主要的成分是由β-1,4糖苷键连接的D-吡喃木糖主链及连接了阿拉伯糖、阿魏酸酯基、葡萄糖醛酸、乙酰基等不同取代基的侧链构成的阿拉伯木聚糖[16]。阿拉伯木聚糖需要多种酶的参与才能完全水解,木聚糖酶、木糖苷酶水解主链[17-18],水解侧链的辅助酶如阿拉伯呋喃糖苷酶可协助阿拉伯木聚糖的水解,提高阿拉伯木聚糖的降解效率,使底物更彻底地水解,得到阿魏酸、低聚糖阿魏酸酯等产物[19]。研究表明,阿魏酸、低聚糖阿魏酸酯都具有抗氧化、抗辐射、抗菌、抗病毒、抗肿瘤等生理活性[4,20],因此,阿拉伯呋喃糖苷酶在水解以阿拉伯木聚糖为原料的生物活性物质制备中具有广阔的应用前景,对PoAbf62A的研究将为发展阿拉伯木聚糖水解酶复合物制备阿拉伯糖基寡糖提供新的工具,同时为将草酸青霉菌P. oxalicum sp.68应用于其他谷物原材料的再利用提供理论参考。
[1] KALE M S,YADAV M P,CHAU H K,et al.Molecular and functional properties of a xylanase hydrolysate of corn bran arabinoxylan [J].Carbohydrate Polymers,2018,181:119-123.
[2] 过嫣丹.麸质阿拉伯木聚糖的改性及应用[D].无锡:江南大学,2012.
[3] NUMAN M T,BHOSLE N B.Alpha-L-arabinofuranosidases: the potential applications in biotechnology[J].Journal of Industrial Microbiology and Biotechnology,2006,33(4):247-260.
[4] 张秋培.啤酒糟制备阿魏酰低聚糖的研究[D].无锡:江南大学,2015.
[5] HENRISSAT B,DAVIES G J. Glycoside hydrolases and glycosyltransferases. Families,modules,and implications for genomics [J].Plant Physiology,2000,124(4):1 515-1 519.
[6] TAYLOR E J,SMITH N L,TURKENBURG J P,et al.Structural insight into the ligand specificity of a thermostable family 51 arabinofuranosidase,Araf51,from Clostridium thermocellum [J].Biochemistry Journal,2006,395(1):31-37.
[7] HU Y,YAN X,ZHANG H,et al.Cloning and expression of a novel α-1,3-arabinofuranosidase from Penicillium oxalicum sp. 68[J].AMB Express,2018,8(1):51.
[8] 解西柱,张明,林材,等.α-L-阿拉伯呋喃糖苷酶在毕赤酵母中的表达及其对大麦麦芽过滤性能的影响[J].食品与发酵工业,2018,44(2):48-54.
[9] 邢亚欣,黄火清,苏小运.一个来源于稻平脐蠕孢的α-阿拉伯呋喃糖苷酶[J].生物技术通报,2020,36(4):84-92.
[10] 薛业敏,毛忠贵,邵蔚蓝.热稳定性α-阿拉伯糖苷酶/木糖苷酶的纯化[J].食品与发酵工业,2003,29(9):22-26.
[11] DAMASCENO L M,HUANG C J,BATT C A.Protein secretion in Pichia pastoris and advances in protein production[J].Applied Microbiology and Biotechnology,2012,93(1):31-39.
[12] GAO J,XU W,FANG Q,et al.Efficient biotransformation for preparation of pharmaceutically active ginsenoside compound K by Penicillium oxalicum sp. 68[J].Annals of Microbiology,2013,63(1):139-149.
[13] DE L M M,GUAIS O,BONNIN E,et al.Molecular and biochemical characterization of three GH62 alpha-L-arabinofuranosidases from the soil deuteromycete Penicillium funiculosum[J].Enzyme and Microbial Technology,2013,53(5):351-358.
[14] CARTMELL A,MCKEE L S,PENA M J,et al.The structure and function of an arabinan-specific α-1,2-arabinofuranosidase identified from screening the activities of bacterial GH43 glycoside hydrolases[J].Journal of Biological Chemistry,2011,286(17):15 483-15 495.
[15] REN J,SUN R.Applications of hemicelluloses and of their derivatives in papermaking-A review[J].Cellulose Chemistry and Technology,2006,40(5):281-289.
[16] 过嫣丹.麸质阿拉伯木聚糖的改性及应用[D].无锡:江南大学,2012.
[17] 闵兆升,郭会明,顾承真,等.木聚糖酶及其在食品工业中的应用[J].食品与发酵工业,2013,39(10):168-173.
[18] 王靖宇,刘玉春,韩伟,等.玉米皮纤维发酵裂褶菌的产酶分析及木聚糖酶基因克隆、表达和酶学性质测定[J].食品与发酵工业,2018,44(5):46-51.
[19] KANEZA P,杨林青,孙付保,等.甘蔗渣在添加剂和辅助酶作用下的浓醪酶解糖化[J].食品与发酵工业,2019,45(17):1-6.
[20] 袁小平.酶解麦麸制备阿魏酰低聚糖及其生物活性的研究[D].无锡:江南大学,2006.