植物甜蛋白是指自然界中存在有甜味或可以引起甜味产生的一种蛋白质,它们大多具有高倍甜度、低热量且安全无毒的特点,作为蔗糖替代品,不会引起高血压、高血脂、糖尿病等疾病,在食品和制药等行业有着潜在的应用价值[1-2]。迄今为止,学者从植物中已分离出7种甜蛋白,包括索马甜(Thaumatin)、马槟榔(Mabinlin)、巴西甜蛋白(Brazzein)、莫奈林(Monellin)、奇异果(Miraculin)、培它汀(Pentadin)及仙茅甜蛋白(Curculin)[3-4]。其中Brazzein由于具有良好的溶解性,较好的pH和热稳定性,是一种具有应用潜力的天然来源的高倍甜味剂[5]。
Brazzein由MING等[6]1994年在非洲西部野生植物Pentadiplandra brazzeana Baillon果实中首次分离发现。该蛋白分子由54个氨基酸残基组成,活性形式为单体,蛋白分子质量为6.5 kDa[7]。分子二级结构包含1个短α-螺旋(残基21~29)和3个反平行β-折叠(链I,残基5~7;链II,残基44~50;链III,残基34~39)[8-9]。其分子内部还包含4个二硫键(Cys4-Cys52、Cys16-Cys37、Cys22-Cys47和Cys26-Cys49),是其具有良好稳定性的结构基础。
除了在高倍甜味剂方面的应用外,有研究表明,巴西甜蛋白具有一定的消炎和抗氧化性,且其蛋白序列与抗细菌多肽防御素和胰蛋白酶抑制剂有42%~45%的相似性,与抗菌蛋白1(antimicrobial protein 1)、德罗霉素(drosomycin)、蝎子毒素(scorpion alpha-toxin OD1)、神经毒素(neurotoxin)和植物防御素(plant defensin)等都具有高度相似性[10]。有研究表明,其对于部分细菌和真菌具有一定的抑菌活性[11]。
由于巴西甜蛋白来源于植物,直接提取工艺复杂且产量低,不能满足市场需求[12],通过基因工程的手段高效表达外源巴西甜蛋白,并对其性能进行研究和应用开发均具有重要意义。目前已经有研究者将Brazzein基因构建到大肠杆菌表达系统[13],但是经诱导培养后,表达的巴西甜蛋白以包涵体的形式存在[14-15],纯化后的重组甜蛋白还需要进一步的复性才具有活性[16]。
本研究选用毕赤酵母表达系统对巴西甜蛋白与蛋白二硫键异构酶(protein disulfide isomerase,PDI)进行外源共表达;利用超滤-纳滤膜分离系统和冷冻干燥技术开发重组Brazzein的低成本制备工艺;对重组Brazzein进行口感评价,并研究其对常见致病菌和肠道益生菌的体外抑菌性能,为其在甜味剂方面的推广应用提供理论基础。
1 材料与试剂
1.1 菌株及质粒
大肠杆菌(Escherichia coli) DH5α、毕赤酵母(Pichia pastoris) GS115、枯草芽孢杆菌ATCC6633、金黄色葡萄球菌ATCC27217、大肠杆菌ATCC25922、白念珠菌ATCC36082、桧状靑霉ATCC10519、干酪乳杆菌ATCC334、嗜酸乳杆菌ATCC4356、粪肠球菌ATCC29212及质粒pPIC9K、pPICZA-PDI,均为天津工业生物技术研究所工业酶工程研究组实验室保存。
1.2 主要试剂与材料
限制性内切酶、T4 DNA连接酶,NEB公司;高保真DNA聚合酶、MIX酶,康为世纪公司;质粒小提试剂盒、酵母基因组DNA提取试剂盒等,TIANGEN公司;无氨基酵母氮源(YNB)培养基、葡萄糖,Solarbio公司;生物素,生物基础公司;无水甲醇,国药集团化学试剂有限公司;PCR所需引物,北京擎科有限公司合成;超纳滤膜芯,杭州瑞纳膜工程有限公司。
2 实验方法
2.1 Brazzein和PDI共表达质粒的构建
按照毕赤酵母密码子偏好性合成Brazzein 基因(KF013250.1),并克隆到穿梭质粒pPIC9K多克隆位点EcoR I和Not I之间,构建重组表达质粒pPIC9K-Brazzein。将重组表达质粒pPIC9K-Brazzein以及空白质粒pPIC9K分别用Sac I酶切线性化,电转(1 500 V)到毕赤酵母GS115感受态,用1 mol/L山梨醇缓冲液重悬细胞,然后将转化产物涂布MD平板。将重组质粒pPICZA-PDI用Sac I单酶切线性化,然后电转化到毕赤酵母GS115(pPIC9K-Brazzein)感受态中,用1 mol/L山梨醇缓冲液重悬保护,涂布Zeocin平板。
2.2 重组毕赤酵母工程菌GS115 pPIC9K-Brazzein的诱导表达
将毕赤酵母重组工程菌株GS115(pPIC9K-Brazzein)划线于YPD平板,挑取重组毕赤酵母工程菌单克隆接种到10 mL BMGY培养基中,30 ℃、220 r/min培养36 h左右,OD600达到3左右。然后收集菌体转接到20 mL BMMY诱导培养基中,并加400 μL无水甲醇进行诱导表达。每隔24 h添加体积分数为2%的无水甲醇,取2 mL诱导菌液离心并保留上清液,用于后续分析毕赤酵母表达重组Brazzein的水平。
2.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)
取毕赤酵母诱导表达发酵上清液1 mL,用三氯乙酸(trichloroacetic acid,TCA)溶液沉淀蛋白,得到的蛋白样品加入20 μL 6 mol/L的脲素溶解,并加入5 μL 5×蛋白电泳上样缓冲液混匀,100 ℃煮沸10 min。样品冷却后取10 μL蛋白样品、5 μL蛋白Marker开始上样,并采用90~120 V电泳。
2.4 重组Brazzein的发酵小试
挑取GS115(pPIC9K-Brazzein)单菌落接种于400 mL YPD液体培养基中,培养至OD600=10左右;将种子液接种至发酵培养基BSM(体积分数4%甘油、BSM基础盐类、PTM1盐类)中30 ℃培养,通气量400 L/h、初始转速为400 r/min,设定溶氧为20%,并设置溶氧与转速联动。当溶氧(dissolved oxygen,DO)<20%,转速逐步提高以控制DO值为20%,最大转速为800 r/min,用体积分数28%的NH3·H2O调节培养基的pH为5.0左右。发酵21 h左右,甘油消耗殆尽,当DO升高,转速降低时,每升加入含12 mL PTM1的甘油进行补料。补料至湿菌体质量达到180~220 g/L后停止;待甘油完全耗尽后饥饿1 h,DO上升后进行甲醇补料培养。
2.5 表达产物的初步膜法分离纯化
重组菌诱导到最佳时间后,离心收集菌体发酵上清液,利用瑞纳小型1812超滤-纳滤膜过滤系统进行纯化过滤。膜芯先选用星达Synder1812V0.1/1 000 kDa进行预过滤除菌体,然后采用星达Synder1812MK/30 kDa进行超滤除杂质,最后采用星达Synder1812XT/1 kDa、星达Synder1812NFG/600 Da或星达Synder1812VT/3 kDa分别在3种压力(0.2、0.4、0.6 MPa)下进行纳滤,回收可溶性重组甜蛋白,过滤温度为20 ℃。加入2倍体积纯水对纳滤体系进行清洗后,获得重组甜蛋白浓缩液。采用冻干的方式进行干燥浓缩,称量得到的粉末,密封保存在-20 ℃,用于后续Brazzein的活性检测。
2.6 重组Brazzein的甜味检测
双盲感官评定:将甜蛋白样品加蒸馏水稀释100倍,配制成质量浓度为10 g/L的母液,再梯度稀释为质量浓度1、0.5、0.25、0.125 g/L的溶液,用20 g/L的蔗糖作为对照,秘密编号(A:1 g/L蛋白、B:0.5 g/L蛋白、C:0.25 g/L蛋白、D:0.125 g/L蛋白、E:20 g/L蔗糖),选取9名志愿者组成口感评价小组,乱序品尝上清液,每人单独描述对品尝样品和蔗糖的甜度进行排序打分,并记录数据。确定与20 g/L的蔗糖甜度相当的样品浓度,从而计算出目的甜蛋白的甜度。
2.7 重组Brazzein的抑菌实验
利用制备出的重组Brazzein配制待测水溶液,质量浓度为30 mg/mL,进行抑菌试验。指示菌分别为:枯草芽孢杆菌ATCC6633、金黄色葡萄球菌ATCC27217、大肠杆菌ATCC25922、白念珠菌ATCC36082、桧状靑霉ATCC10519、干酪乳杆菌ATCC334、嗜酸乳杆菌ATCC4356、粪肠球菌ATCC29212。最小抑菌浓度(minimum inhibitory concentration,MIC)值测定采用试管二倍稀释法,向灭菌试管中加入各自培养基(pH 7.5)1 mL,依次编号,在第1管中加入浓缩样品1 mL,混匀后吸取1 mL至第2管,依次类推至第9管,弃去最后吸取的1 mL,然后于每管中加入0.1 mL浓度稀释至1×108 CFU/mL菌液,第10管加入菌液不含巴西甜蛋白作为阳性对照,第11管只加营养肉汤作为阴性对照,分别依次测定MIC值。
3 结果与分析
3.1 pPIC9K-Brazzein表达质粒的构建
如图1所示,优化后的基因连接到pPIC9K载体的EcoR I和Not I酶切位点,构建重组质粒pPIC9K-Brazzein。
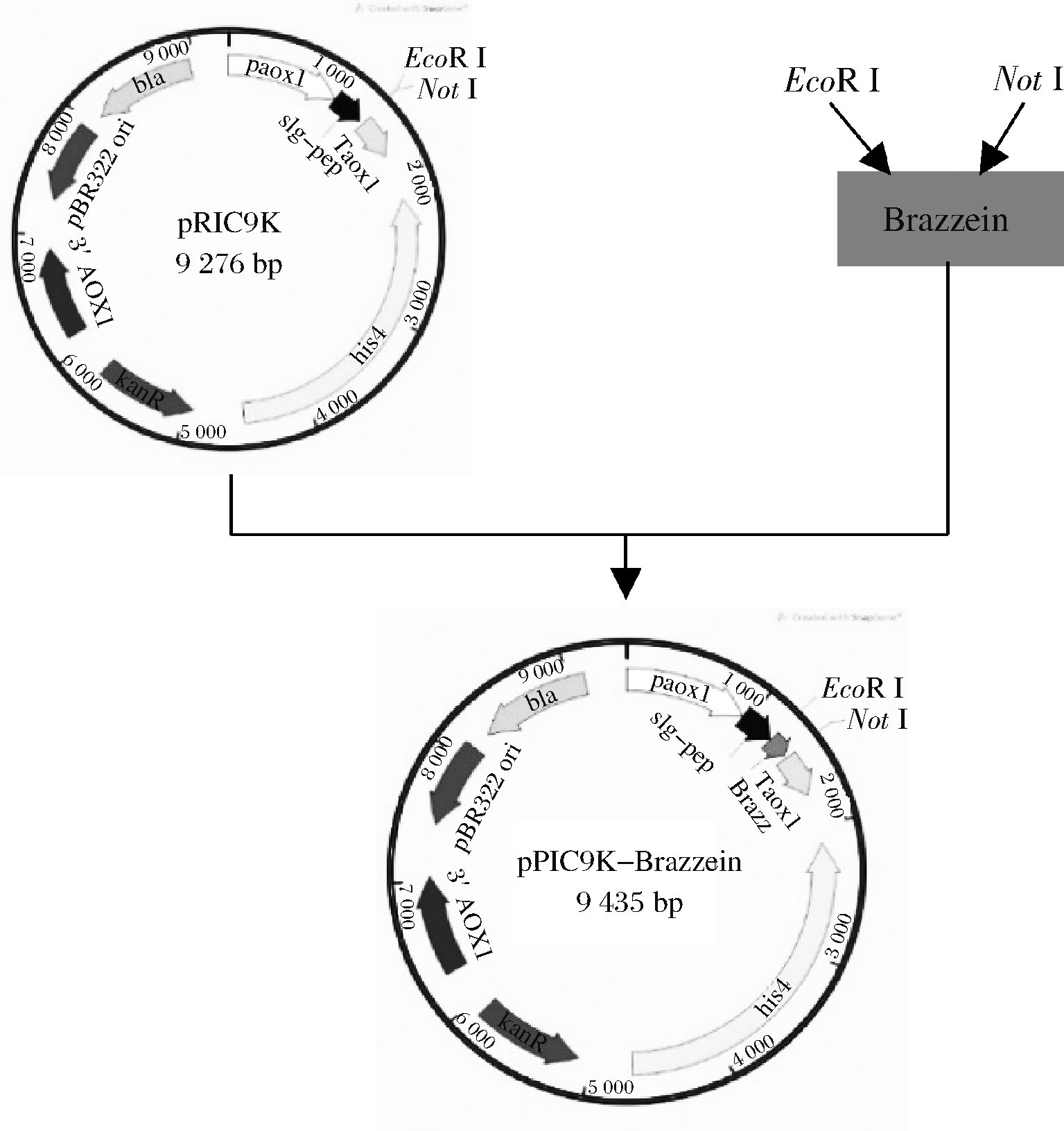
图1 重组质粒构建示意图
Fig.1 Schematic diagram of recombinant plasmid construction
3.2 重组毕赤酵母GS115基因组的PCR鉴定
利用AOX引物PCR验证pPIC9K-Brazzein整合毕赤酵母基因组情况,筛选Mut+整合,可见2条带,1条与目的基因相关,大小为Brazzein基因片段大小加492 bp,另1条为AOX1基因(大约为2.2 kb)。如图2所示,条带大小分别为2.2 kb和660 bp,测序结果显示正确转化,Brazzein基因被成功整合到毕赤酵母GS115基因组上。
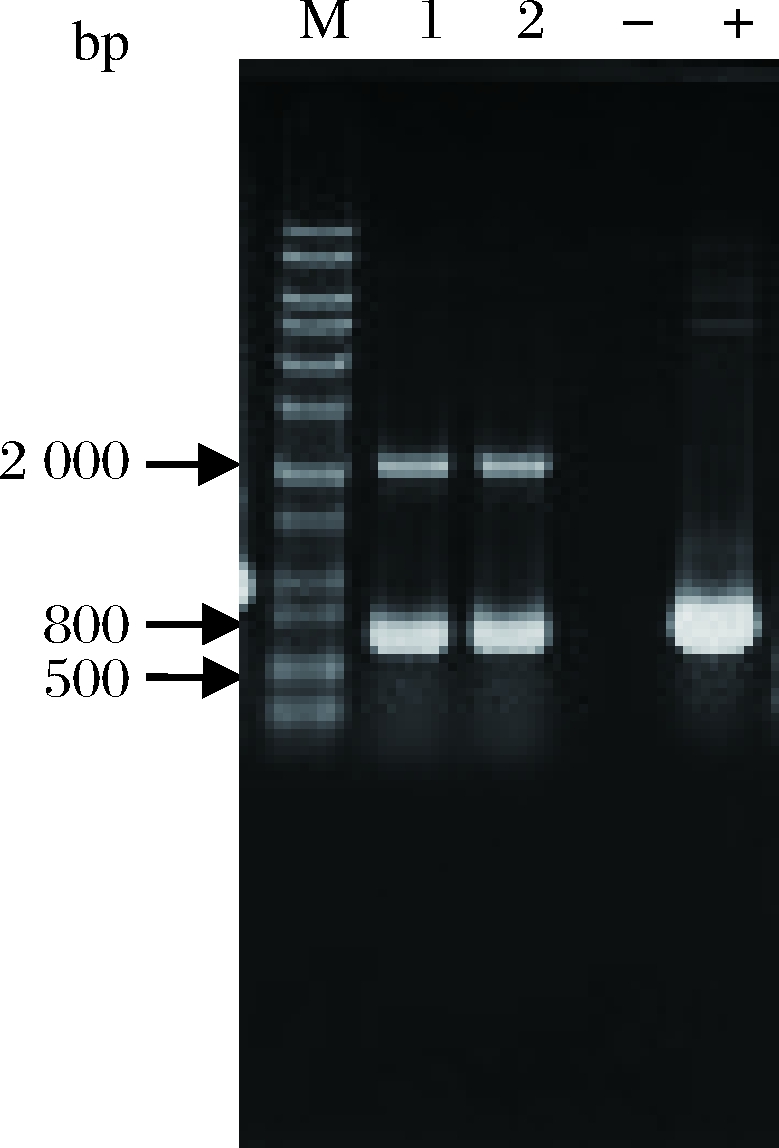
M-核酸分子标记物;1、2-GS115(pPIC9K-Brazzein)转化子;
--阴性对照;+-阳性对照
图2 酵母转化子的PCR验证
Fig.2 Yeast transformant PCR verification
利用Text引物PCR验证pPICZA-PDI整合毕赤酵母基因组情况,筛选正确的阳性转化子,如图3所示。阳性转化子在琼脂糖凝胶电泳中可见1条带,大小即为PDI的大小1 554 bp。测序结果显示正确转化,PDI基因被成功整合到毕赤酵母GS115基因组上。最终成功构建了重组菌株GS115(pPIC9K- Brazzein,pPICZA-PDI)。
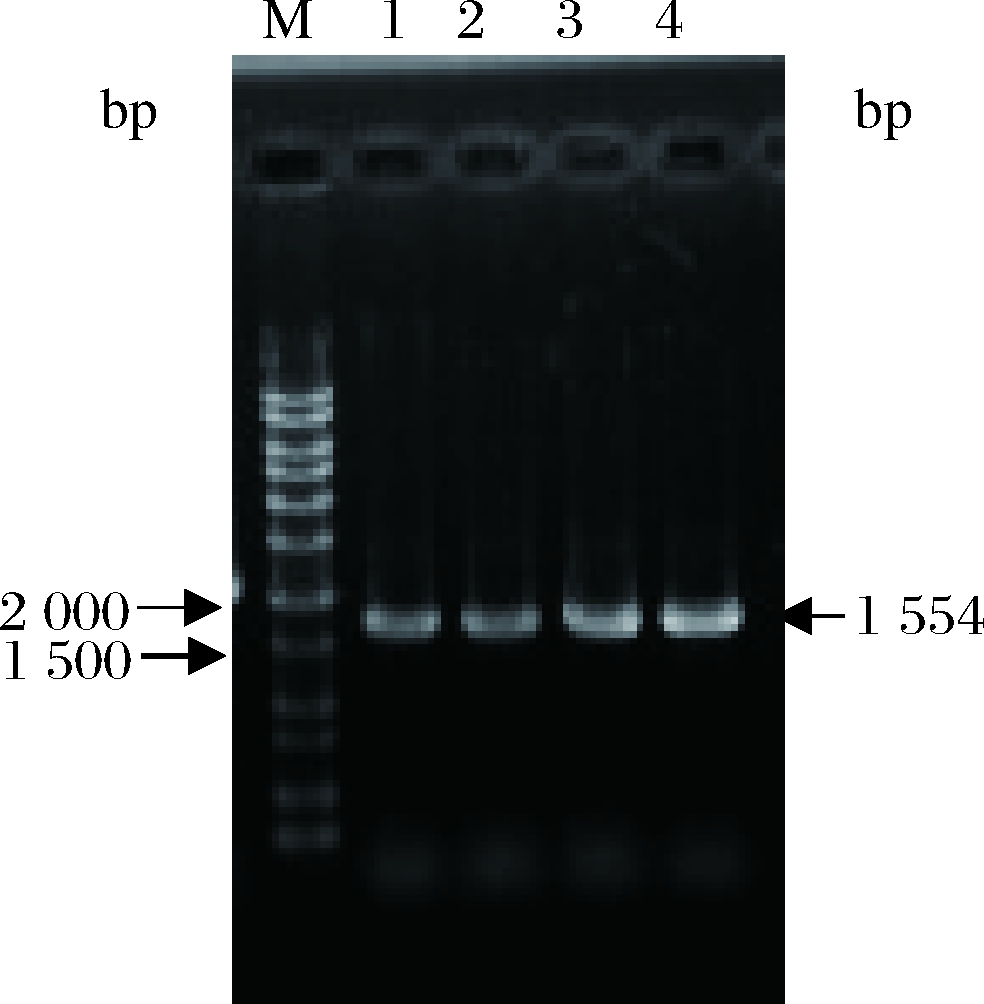
M-核酸分子标记物;1、2、3、4-GS115(pPIC9K-Brazzein,
pPICZA-PDI)转化子
图3 重组共表达菌株转化子PCR验证
Fig.3 PCR validation of recombinant co-expressing strains
transformants
3.3 重组Brazzein的表达
如图4所示,在6.5 kDa处重组子有1条明显的蛋白条带,和理论分子质量大小一致,而对照没有此条带。用BCA蛋白浓度测定试剂盒检测重组Brazzein质量浓度,表达量达到1 g/L。

M-蛋白分子标记物;1-GS115(pPIC9K-Brazzein,pPICZA-PDI);
2-GS115(pPIC9K,pPICZA-PDI)
图4 重组Brazzein表达电泳图
Fig.4 SDS-PAGE for the expression of recombinant Brazzein
3.4 5 L发酵罐高密度培养和超滤纳滤膜法分离
发酵过程分为3个阶段:甘油批式发酵、甘油补料培养和甲醇补料培养。甘油批式发酵至22.95 h时,甘油消耗殆尽,发酵罐中DO值迅速上升,达到41%,细胞湿质量达到107.2 g,此时开始进入第2阶段,甘油补料培养,增加细胞量。在培养至32.02 h时停止甘油补料培养,进入第3阶段,甲醇补料培养。在发酵至142.61 h时,菌体生长趋于稳定,每升发酵液中细胞湿质量达到301 g,毕赤酵母表达Brazzein发酵曲线如图5所示。利用超滤-纳滤膜过滤系统对发酵上清液进行纯化过滤,对比不同压力下SynderVT/3 kDa、SynderXT/1 kDa和SynderNFG/600 Da对于重组Brazzein的回收率,结果如图6所示。使用SynderNFG/600 Da在0.6 MPa工作压力下的回收效率最高,可达70.8%。

图5 毕赤酵母表达Brazzein诱导发酵曲线
Fig.5 Fermentation curve of Pichia pastoris expression
Brazzein
3.5 重组Brazzein的甜味检测
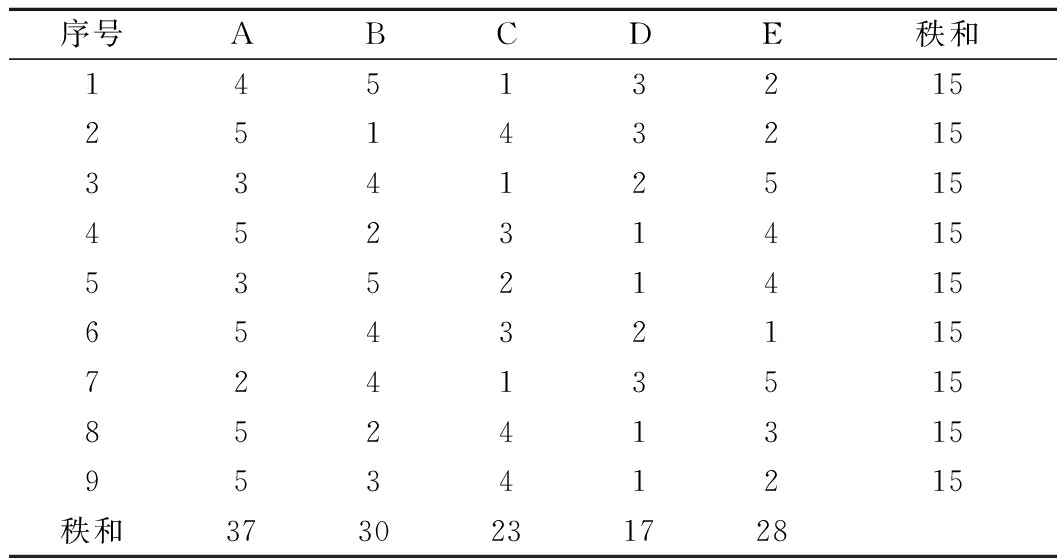
随机提供给评价员A、B、C、D、E五种样品,经过多次品尝,通过对重组Brazzein和蔗糖的双盲感官检验,采用排序法,并按甜度高低进行排序,给出每个样品的秩次,统计每个样品的秩和,采用弗里德曼(Friedman)检验分析,结果如表1所示。
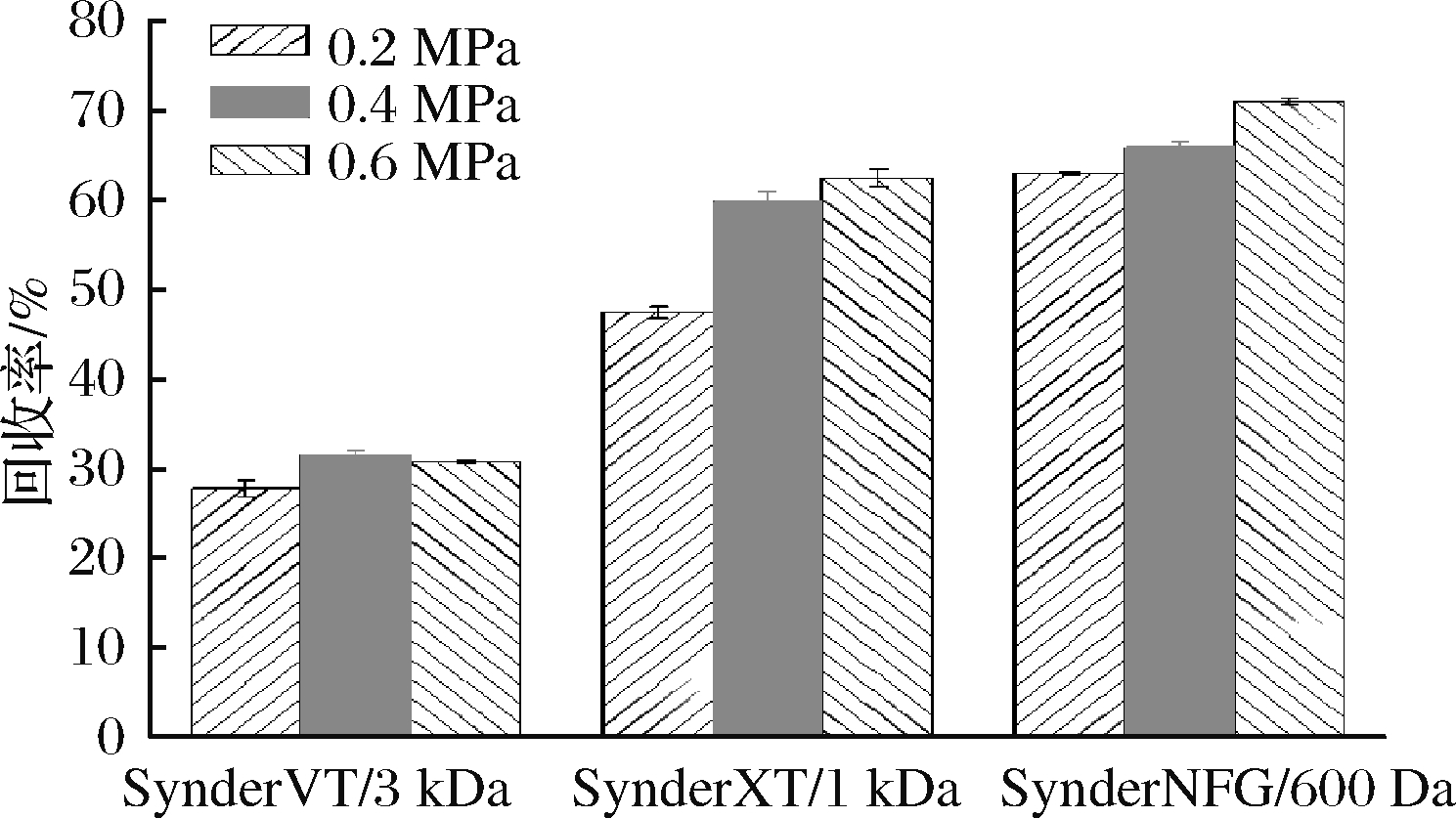
图6 三种纳滤膜在不同压力下对重组Brazzein的回收率
Fig.6 Recovery of recombinant Brazzein by three nanofiltration
membranes at different pressures
表1 重组Brazzein与蔗糖的甜度关系感官评定结果
Table 1 Sensory evaluation results of the sweetness
relationship between recombinant Brazzein and sucrose
序号ABCDE秩和145132152514321533412515452314155352141565432115724135158524131595341215秩和3730231728
注:5分甜度最强,1分甜度最弱
通过Friedman检验计算可知,F=10.044>F0.05=9.49,在0.05的置信水平下,5种溶液的甜度存在显著差异。根据排序结果,甜度排名为A>B>E>C>D。进一步分组比较分析(least significance difference,LSD),结果表明B和E之间没有显著差异。表明0.5 g/L的蛋白样品溶液甜度与20 g/L蔗糖无明显差异(P>0.05),通过计算,甜味蛋白的甜度约为蔗糖的40倍。而后进行重组Brazzein的甜味和杂味检测,结果表明,重组Brazzein具有明显的甜味,同时反馈有苦味,增加空白对照后发现,产生苦味主要原因为超滤纳滤纯化过程未能将发酵液中苦涩物质完全去除。另外,有2位评价员认为重组Brazzein的甜味持久性长于蔗糖。
3.6 重组Brazzein的抑菌作用
重组Brazzein对5种菌的抑制作用结果如表2所示。由表2可知,表达后的巴西甜蛋白对部分细菌和真菌抑菌性较弱,其中对白念珠菌的MIC值为15 mg/mL,对金黄色葡萄球菌的MIC值为7.5 mg/mL,对桧状青霉的MIC值为3.75 mg/mL,对枯草芽孢杆菌、大肠杆菌、干酪乳杆菌、嗜酸乳杆菌、粪肠球菌没有发现明显的抑菌效果。
表2 重组Brazzein抑菌作用结果
Table 2 Antibacterial effect of recombinant Brazzein

菌株MIC/(mg·mL-1)157.53.751.8750.90.470.230.120.058枯草芽孢杆菌+++++++++金黄色葡萄球菌--+++++++大肠杆菌+++++++++白念珠菌-++++++++桧状靑霉---++++++干酪乳杆菌+++++++++嗜酸乳杆菌+++++++++粪肠球菌+++++++++
注:“+”表示菌生长正常;“-”表示菌未生长
4 结论与讨论
本研究中重组毕赤酵母工程菌株分泌表达的巴西甜蛋白占总蛋白的80%以上。将巴西甜蛋白与PDI进行共表达在一定程度上减少了对宿主本身分子伴侣的占用,提高了重组蛋白的分泌效率,并最终实现了1 g/L的胞外分泌表达量,高于之前报道的385 mg/L蛋白产量[17],为其他甜蛋白的外源表达提供了参考。
对获得的重组巴西甜蛋白进行生物活性检测,甜味测试结果显示其甜度是蔗糖的40倍,与文献报道的2 000倍存在差距,推测甜味降低的原因主要有2方面:1)宿主对关键氨基酸的修饰作用。由于巴西甜蛋白甜味主要由位于分子弹性环周边包括Arg43的氨基酸残基参与产生[18],化学修饰其中部分位点会导致甜味的降低或消失[19]。而酵母对外源蛋白的糖基化修饰比较常见,也是许多外源蛋白活性降低的重要原因[20]。2)重组蛋白没有正确折叠。甜蛋白的甜味同样依赖于蛋白的正确折叠,经毕赤酵母与PDI共表达的重组巴西甜蛋白是否与天然构型完全一致还缺少研究。这也是下一步增强重组巴西甜蛋白甜味的主要研究方向。
对巴西甜蛋白的抑菌活性结果表明,巴西甜蛋白对部分细菌和真菌具有较弱的抑菌性,其中对白念珠菌的MIC值为15 mg/mL,对金黄色葡萄球菌的MIC值为7.5 mg/mL,对桧状青霉的MIC值为3.75 mg/mL,而对枯草芽孢杆菌、大肠杆菌、干酪乳杆菌、嗜酸乳杆菌、粪肠球菌没有发现明显的抑菌效果。根据以上实验结果和预期的口服量分析,食用重组巴西甜蛋白后对肠道菌群影响作用较弱。
[1] KANT R. Sweet proteins-potential replacement for artificial low calorie sweeteners[J].Nutrition Journal,2005,4(5):5-10.
[2] MOORADIAN A D,SMITH M,TOKUDA M. The role of artificial and natural sweeteners in reducing the consumption of table sugar: A narrative review[J].Clinical Nutrition ESPEN,2017,18(1):1-8.
[3] MASUDA T,KITABATAKE N. Developments in biotechnological production of sweet proteins[J].Journal of Bioscience and Bioengineering,2006,102(5):375-389.
[4] WINTJENS R,VIET T M,MBOSSO E,et al. Hypothesis/review: the structural basis of sweetness perception of sweet-tasting plant proteins can be deduced from sequence analysis[J].Plant Science,2011,181(4):347-354.
[5] ASSADI-PORTER F M,ACETI D J,CHENG H,et al. Efficient production of recombinant Brazzein,a small,heat-stable,sweet-tasting protein of plant origin[J].Archives of Biochemistry and Biophysics,2000,376(2):252-258.
[6] MING D,HELLEKANT G. Brazzein,a new high-potency thermostable sweet protein from Pentadiplandra brazzeana B[J].FEBS Letters,1994,355(1):106-108.
[7] FAUS I.Recent developments in the characterization and biotechnological production of sweet-tasting proteins[J].Applied Microbiology and Biotechnology,2000,53(2):145-151.
[8] CALDWELL J E,ABILDGAARD F,DZAKULA Z,et al. Solution structure of the thermostable sweet-tasting protein Brazzein[J].Nature Structural Biology,1998,5(6):427-431.
[9] NAGATA K,HONGO N,KAMEDA Y,et al. The structure of Brazzein,a sweet-tasting protein from the wild Africanplant Pentadiplandra brazzeana[J].Acta Crystallographica. Section D:Biological Crystallography,2013,69(4):642-647.
[10] CHUNG J H,KONG J N,CHOI H E,et al. Antioxidant,anti-inflammatory,and anti-allergic activities of the sweet-tasting protein Brazzein[J].Food Chemistry,2018,267(30):163-169.
[11] YOUNT N Y,YEAMAN M R. Multidimensional signatures in antimicrobial peptides[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(19):7 363-7 368.
[12] 王燕.农杆菌介导甜蛋白Brazzein基因转化‘章姬’草莓的研究[D].南京:南京农业大学,2012.
[13] 高逸群.甜味蛋白(Brazzein)大肠杆菌表达系统的建立[D].长春:吉林大学,2006.
[14] 刘松财,张永亮,任晓慧,等.甜味蛋白(Brazzein)基因的人工合成及其在大肠杆菌中的重组表达[J].中国兽医学报,2006,26(5):538-540.
[15] 王长远,张丽萍,刘松财,等.甜味蛋白Brazzein在毕赤氏酵母中表达的初步研究[J].中国食品学报,2009,9(5):43-48.
[16] 李春丽,何国庆,阮晖,等.des-pGlu1-Bra基因的人工合成及其在大肠杆菌中的重组表达[J].农业生物技术学报,2005,13(1):38-41.
[17] 赵红玲,陈劲春.利用毕赤酵母表达植物甜蛋白(Brazzein)的初步研究[J].北京化工大学学报(自然科学版),2005,32(2):14-16;20.
[18] ASSADI-PORTER F M,ACETI D J,MARKLEY J L.Sweetness determinant sites of Brazzein,a small,heat-stable,sweet-tasting protein[J].Archives of Biochemistry and Biophysics,2000,376(2):259-265.
[19] 丁鸣,胡忠.耐热甜味蛋白Brazzein的特性和化学修饰[J].云南植物研究,1996,18(2):123-133.
[20] 顾园,诸欣平,王少华.毕赤酵母表达蛋白质的糖基化[J].生命的化学,2004,24(4):353-355.