万寿菊(Tagetes erecta L.)为菊科万寿菊属一年生草本植物万寿菊的花,于每年夏秋季节采收,其花和叶干燥后均可入药,具有清热化痰、补血通经、去淤生新之功效[1-3]。万寿菊原产自墨西哥,因其生存能力和适应性极强,在我国南北方常被用作观赏植物进行栽培,资源极为丰富[4-5]。研究表明,万寿菊主要含有噻吩类[6]、精油类[2]、叶黄素类[7-9]、黄酮类及其苷类[10]、生物碱类和萜类等成分[3,11-12],尤其是噻吩类成分作为菊科植物的特征性次代谢生产物,具有广泛的杀虫活性[6];叶黄素类成分在老年性黄斑退化病和白内障疾病防治、缓解视疲劳等方面具有重要作用[13],亦有抗氧化、抗肿瘤和预防心血管疾病等功效,在食品领域有着广泛的应用[14-16]。当前,学界对万寿菊的研究主要集中在叶黄素分离提取和药理活性,而对万寿菊多糖的研究鲜有报道。基于此,本研究以万寿菊为原料,通过响应面法优化热水浸提乙醇沉淀法提取万寿菊多糖(Tagetes erecta L. polysaccharides,TEPs)工艺,继而采用DEAE-52纤维素和Sephadex G-100柱层析法进行分离纯化,在此基础上探究万寿菊多糖体外抗氧化和抑瘤规律,以期为万寿菊的深加工和综合利用提供依据。
1 材料与方法
1.1 材料与试剂
万寿菊于2018年8~9月采集自陕西省洛南县馒头山地区,经商洛学院制药工程教研室鉴定为菊科万寿菊属植物万寿菊的花,晾晒干后备用。
DEAE-52纤维素、Sephadex G-100、葡聚糖T系列、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT]、1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP),北京索莱宝科技有限公司;1,1-二苯基-2-苦味基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2′-azino bis 3-ethylbenzthiazoline-6-sulphonate acid,ABTS),美国Sigma-Aldrich公司;DMEM细胞培养基,赛默飞世尔科技(中国)有限公司;其他分析试剂均为国产分析纯。
1.2 主要设备
LC-10A高效液相色谱仪(含示差折光检测器),岛津公司;Form311 CO2培养箱,赛默飞世尔科技(中国)有限公司;RT6000酶标分析仪,深圳雷杜生命科学股份有限公司;TGL-16M超低温高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;BSC-1000IIA2生物安全柜,上海博讯医疗生物仪器股份有限公司。
1.3 TEPs分离制备方法
1.3.1 TEPs提取及工艺优化
1.3.1.1 TEPs提取
称取万寿菊粉末50 g,置于提取容器中,加入20倍体积的蒸馏水,在80 ℃水浴下恒温浸提2 h,过滤,将滤渣按照第1次提取方法重复提取2次[17]。将3次滤液合并,减压浓缩至100~200 mL。向浓缩液中加4倍体积无水乙醇,于4 ℃静置过夜后以4 000 r/min离心10 min,弃上清液(回收乙醇),沉淀溶解于少量蒸馏水中,透析3 d(每4 h换一次透析溶液),去除小分子杂质,冷冻干燥后即得万寿菊多糖粗提物,采用苯酚-硫酸法测定糖含量[17-18],多糖提取率按公式(1)计算:
多糖提取率![]()
(1)
1.3.1.2 TEPs提取工艺优化
单因素实验方法:分别称取万寿菊粉末10 g置于5个圆底烧瓶中,按1∶20体积比加蒸馏水,于80 ℃恒温水浴浸提3次,合并提取液,浓缩干燥,计算多糖提取率,以此考察提取时间为1、1.5、2、2.5和3 h对多糖提取率的影响;固定料液比为1∶20(g∶mL,下同),提取时间为2 h,提取次数3次,考察提取温度为60,70,80,90,100 ℃时对多糖提取率的影响;在80 ℃恒温水浴分别浸提3次,每次浸提2 h,考察料液比(1∶5、1∶10、1∶15、1∶20、1∶25)对多糖提取率的影响;最后,固定提取温度80 ℃、时间2 h、料液比为1∶20,考察提取次数对多糖提取率的影响[18]。
响应面优化实验:以万寿菊多糖提取率(Y)为响应值,基于单因素实验结果,优选主要影响因素,采用Box-Behnken进行响应面设计优化实验[19-20]。
1.3.2 DEAE-52纤维素和Sephadex G-100柱色谱法分离纯化TEPs
称取100 mg TEPs,溶于适量去离子水中,进行上样,而后打开DEAE-52纤维素层析柱(2.8 cm×60 cm)[17,21-23]下端的螺旋夹,使样品进入交换剂中,待样品快要进完时,加入少量缓冲液冲洗柱壁,待吸附12 h后分别用去离子水和0.1、0.2、0.3、0.4、0.5 mol/L的NaCl溶液进行洗脱,用自动部分收集器收集洗脱液,流速为1 mL/min,5 mL/管,用苯酚-硫酸法跟踪检测[17],以492 nm吸光值对洗脱管数作图,根据洗脱曲线分段合并,减压、浓缩、透析后分别上样于Sephadex G-100层析柱(1.6 cm×90 cm)[17,21-23],去离子水洗脱,流速0.35 mL/min,4 mL/管,苯酚-硫酸法跟踪检测[17],绘制TEPs纯化洗脱曲线。合并洗脱峰值处相应洗脱液,真空冷冻干燥后即得TEPs不同组分样品。
1.3.3 TEPs重均分子量测定及单糖组成分析
参照文献[17,24]中高效体积排阻色谱法(high performance size exclusion chromatography,HPSEC)测定多糖重均分子量和高效液相色谱法分析其单糖组成。
1.4 TEPs体外抗氧化活性规律分析
TEPs对DPPH自由基、羟自由基(·OH)、ABTS自由基和超氧阴离子自由基(O2-·)清除实验均参照本课题组已有方法进行[17,24-25]
1.5 TEPs体外抑瘤活性测定
以MTT法[25-27]检测TEPs对MCF-7细胞的生长抑制作用。取对数生长期(5×104~1×105 个/mL)细胞1 mL,接种于96孔细胞培养板,培养24 h待完全贴壁生长后弃上清液;每孔加新鲜培养液900 μL和100 μL质量浓度分别为50、100、150、200 μg/mL的待测TEPs溶液,以环磷酰胺(cyclophosphamide,CTX)作为阳性对照,阴性对照以生理盐水补足,继续培养44 h,加入5 mg/mL的MTT溶液100 μL,4 h后用十二烷基硫酸钠(sodium dodecyl sulfate,SDS)三联液终止反应。采用酶标分析仪于570 nm处检测OD值,每处理设置5个重复,按公式(3)计算抑制率:
抑制率/%=
(2)
以TEPs质量浓度为横坐标,其对MCF-7细胞的抑制率为纵坐标绘制曲线,计算半数抑制浓度(median inhibitory concentration,IC50)。
1.6 数据分析
单因素实验、抗氧化和抑瘤实验数据采用SPSS 18.0和Excel 2016软件进行统计分析,响应面实验设计和数据分析采用Design Expert 8.05b软件进行,所有实验至少平行测定3次。
2 结果与分析
2.1 TEPs提取单因素实验结果
从图1-a可知,万寿菊多糖提取率随着提取时间的延长而呈现先增后减的规律,在提取2 h时达到峰值,此后随着提取时间的延长提取率有所下降。因而,在本实验条件下,万寿菊多糖最佳提取时间为2 h。由图1-b可知,随着提取温度不断升高,TEPs提取率先快速增长而后缓慢下降,在80 ℃时达到极值。因此,选择80 ℃作为TEPs最佳提取温度。由图1-c可知,TEPs提取率随着提取溶剂倍数的不断增加而呈上升趋势,在提取溶剂(mL)用量为原材料(g)20倍以下(即料液比1∶20)的条件下,提取率增长幅度较快;提取溶剂用量大于20倍时,多糖提取率亦有所增加但增幅非常小,从经济高效的角度考虑选择料液比为1∶20为最佳。从图1-d可以看出,随着提取次数的增加,TEPs提取率先增后减,在提取3次的时候达到峰值。因此,从节省实验时间和成本等方面综合考虑选择提取3次为最佳条件,并结合张雪春等[28]的处理方法,后续响应面优化实验时不再考察提取次数。
2.2 响应面法优化TEPs提取工艺结果
2.2.1 响应面设计实验结果
基于单因素实验结果,从经济和节省时间的角度考量固定提取次数为3次,选取提取时间、提取温度和料液比作为实验因素,设计3因素3水平的响应面优化实验,因素水平表及响应面实验结果如表1和表2所示。
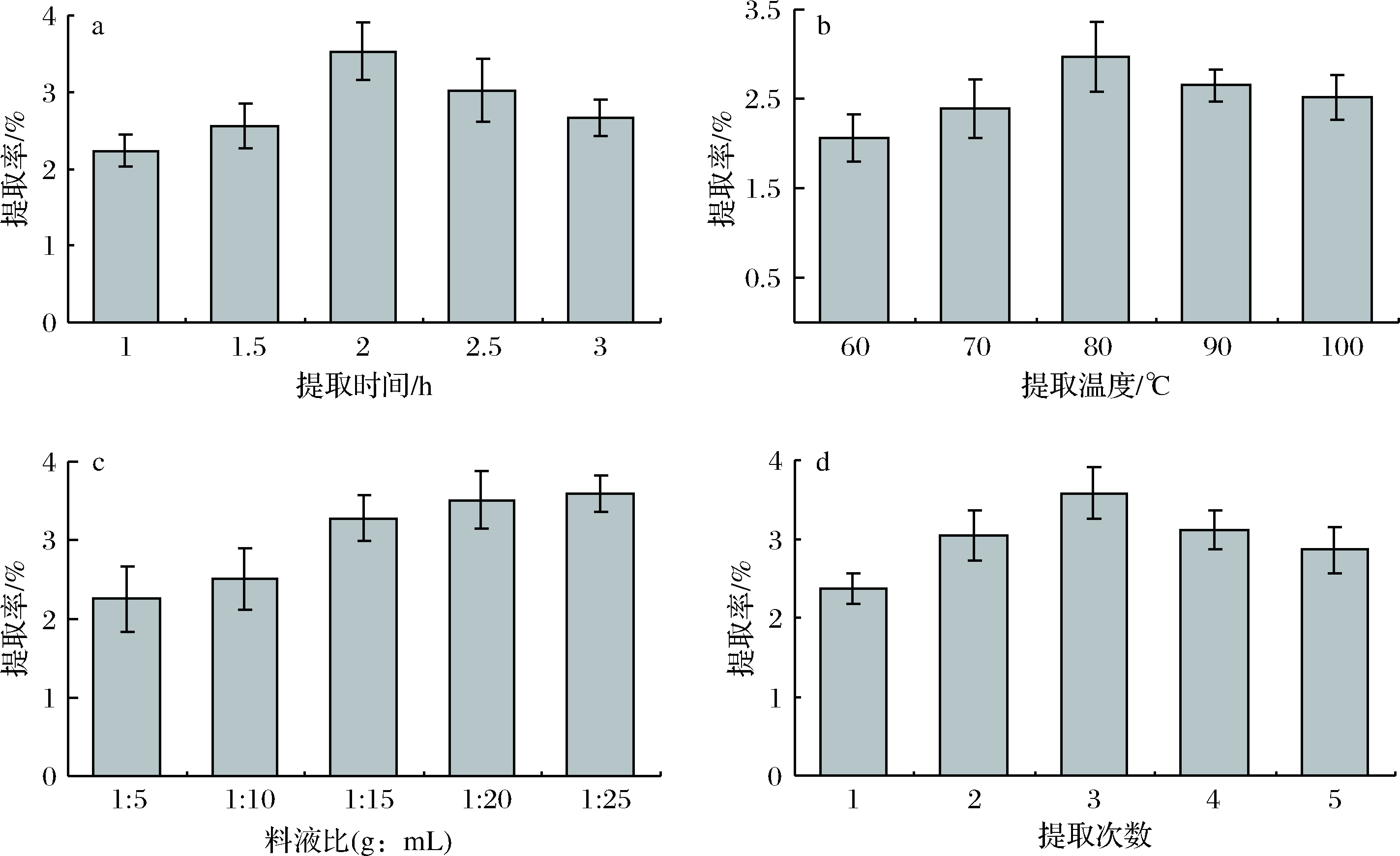
a-提取时间;b-提取温度;c-料液比;d-提取次数
图1 不同因素对万寿菊多糖提取率的影响
Fig.1 Effects of different factors on the extraction yield of TEPs
表1 响应面设计因素与水平
Table 1 Factors and level of Box-Behnken test

因素水平-10+1A提取温度/℃708090B提取时间/h1.522.5C料液比(g∶mL)1∶151∶201∶25
表2 响应面实验设计结果
Table 2 Box-Behnken design and results
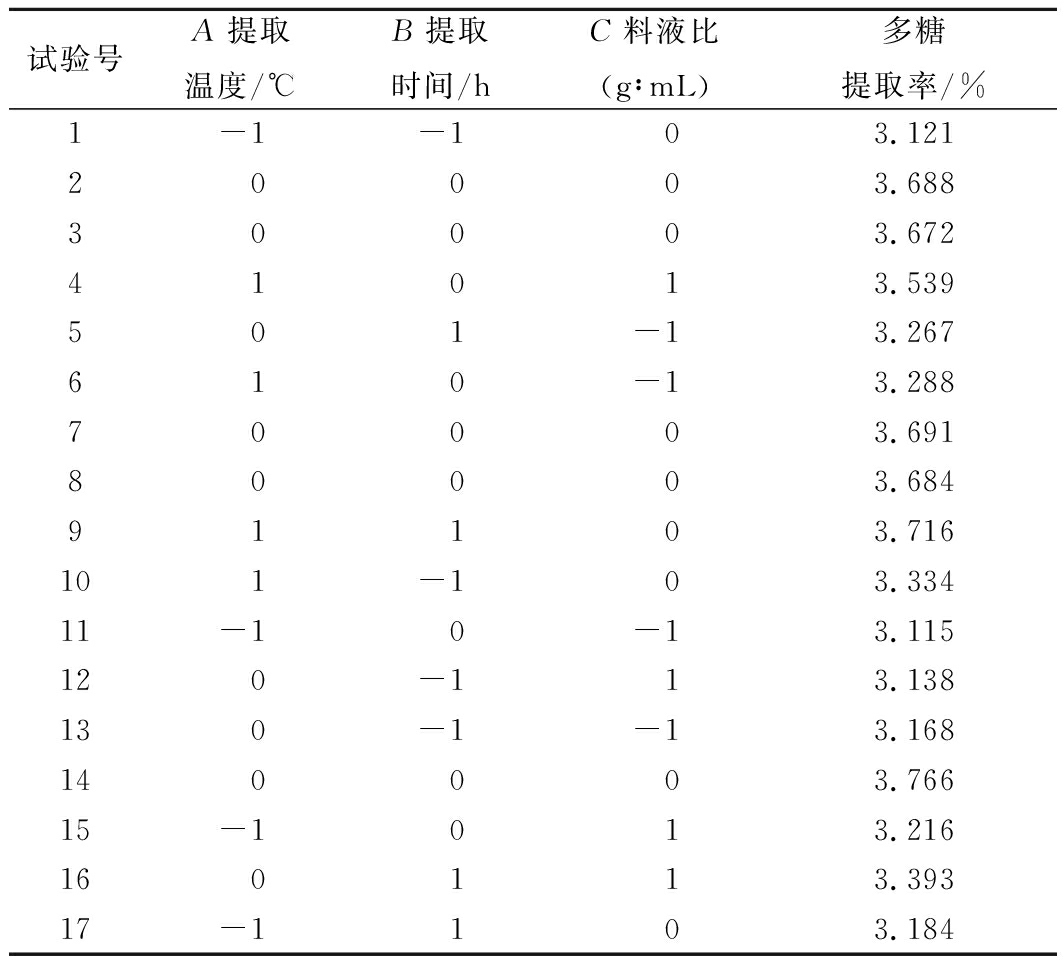
试验号A提取温度/℃B提取时间/hC料液比(g∶mL)多糖提取率/%1-1-103.12120003.68830003.67241013.539501-13.267610-13.28870003.69180003.68491103.716101-103.33411-10-13.115120-113.138130-1-13.168140003.76615-1013.216160113.39317-1103.184
2.2.2 多元回归方程的构建与分析
采用Design-Expert 8.0.5b软件对表2的实验结果进行方差分析(表3),进行多元回归拟合可得TEPs多糖提取率与提取温度(A)、提取时间(B)、料液比(C)的二次回归方程为:Y=3.70+0.16A+0.1B+0.056C+0.08AB+0.038AC+0.039BC-0.16A2-0.2B2-0.25C2
从表3中可以看出,该回归模型P<0.000 1,表明TEPs提取率响应面回归模型极显著。失拟项的P值为0.105 9,失拟项不显著,说明该模型构建合理。该模型相关系数R2为0.976 7,校正系数![]() 为0.946 8,变异系数为1.67,说明该模型拟合的非常好,可用于分析和预测提取温度、时间和料液比对TEPs提取率结果影响。由显著性检验结果可知,A和B因素对TEPs提取率影响极显著,C因素影响显著;在二阶因子中,A2、B2、C2都是极显著。
为0.946 8,变异系数为1.67,说明该模型拟合的非常好,可用于分析和预测提取温度、时间和料液比对TEPs提取率结果影响。由显著性检验结果可知,A和B因素对TEPs提取率影响极显著,C因素影响显著;在二阶因子中,A2、B2、C2都是极显著。
如图2所示,TEPs提取率随着3个因素的变化而呈现先增加后减小的趋势,等高线的形状可以反映出2个因素交互作用的强弱,其中近椭圆形状表示交互作用显著,近圆形则表示不显著[29]。由图中可以看出提取温度和提取时间、料液比交互作用显著,提取时间和料液比交互作用不显著,这与表3中显著性检验结果一致。
表3 回归模型方差分析
Table 3 Variance analysis of regression model
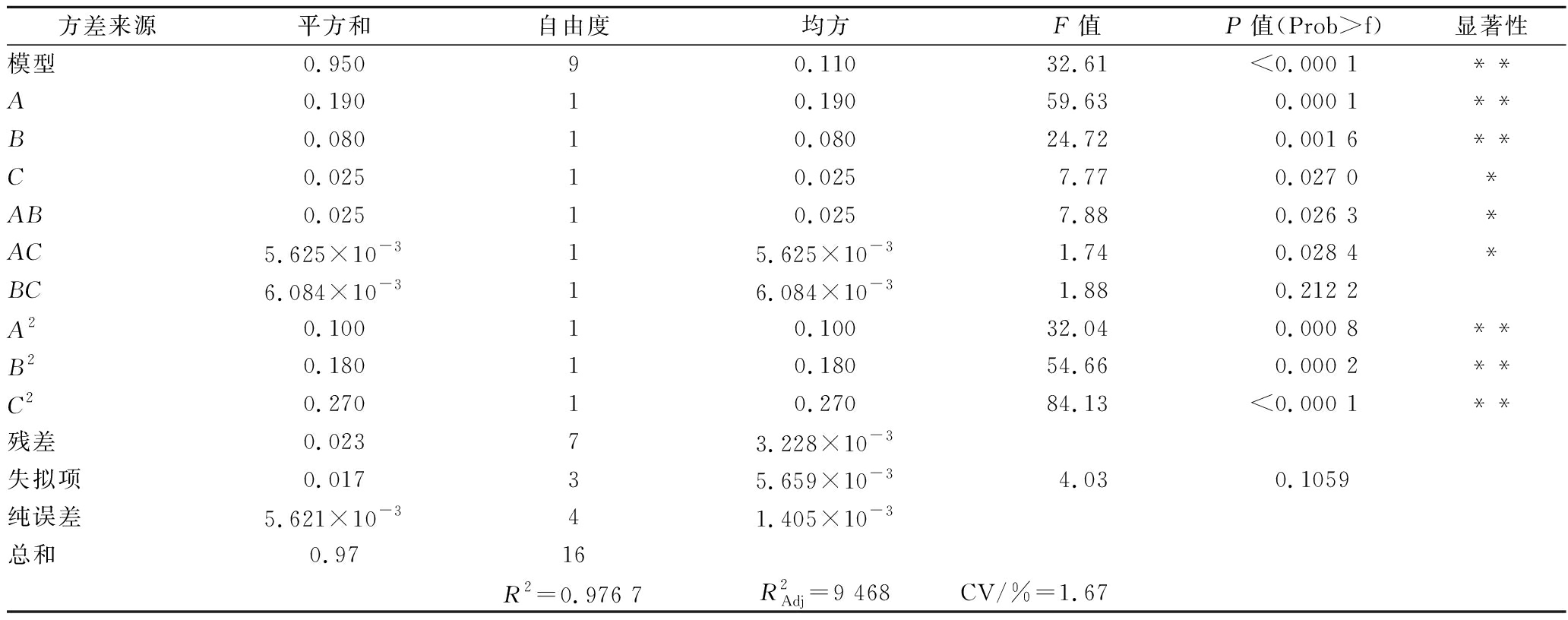
方差来源平方和自由度均方F值P值(Prob>f)显著性模型0.95090.11032.61<0.000 1**A0.19010.19059.630.000 1**B0.08010.08024.720.001 6**C0.02510.0257.770.027 0*AB0.02510.0257.880.026 3*AC5.625×10-315.625×10-31.740.028 4*BC6.084×10-316.084×10-31.880.212 2A20.10010.10032.040.000 8**B20.18010.18054.660.000 2**C20.27010.27084.13<0.000 1**残差0.02373.228×10-3失拟项0.01735.659×10-34.030.1059纯误差5.621×10-341.405×10-3总和0.9716R2=0.976 7R2Adj=9 468CV/%=1.67
注:P<0.01,差异极显著;P<0.05,差异显著

a-提取温度与提取时间;b-提取温度与料液比;c-提取时间与料液比
图2 提取温度、提取时间、料液比对TEPs提取率影响的响应面图
Fig.2 Response surface diagrams of the effect of extraction temperature, time, solid-to-solvent ratio on TEPs extraction yield
2.2.3 TEPs提取工艺优化与验证
通过对上述回归方程求偏导得最佳提取条件为:提取温度80.47 ℃、提取时间2.02 h、料液比1∶20.95(g∶mL),利用回归方程计算的预测值是3.732%,而实验过程中各因素0水平时,5次试验平均得率为(3.700±0.038)%,该模型优化工艺预测提取率提高了8.65%。综合考虑实际可操作性,将上述条件修正为:提取温度80 ℃、提取时间2 h、料液比1∶21(g∶mL)。在此条件下,进行3次验证实验,TEPs平均提取率为(3.707±0.072)%,低于模型预测值0.67%,符合客观实际。
2.3 TEPs分离纯化结果
TEPs经过DEAE-52纤维素柱层析后,洗脱曲线如图3所示。经去离子水和0.1~0.5 mol/L NaCl溶液梯度洗脱,得到大小不等5个洗脱峰,其中峰1和峰5几乎可忽略不计,峰3的多糖含量过低,没有进一步研究价值,只有峰2和峰4含量最高,进一步将其浓缩、透析后经Sephadex G-100柱层析纯化,得图4所示洗脱峰,由峰2和峰4各得到单一对称洗脱峰,将洗脱液收集、浓缩、冷冻干燥备用,分别命名为TEPs-1和TEPs-2,经测定二者总糖含量分别为79.27%和87.71%。
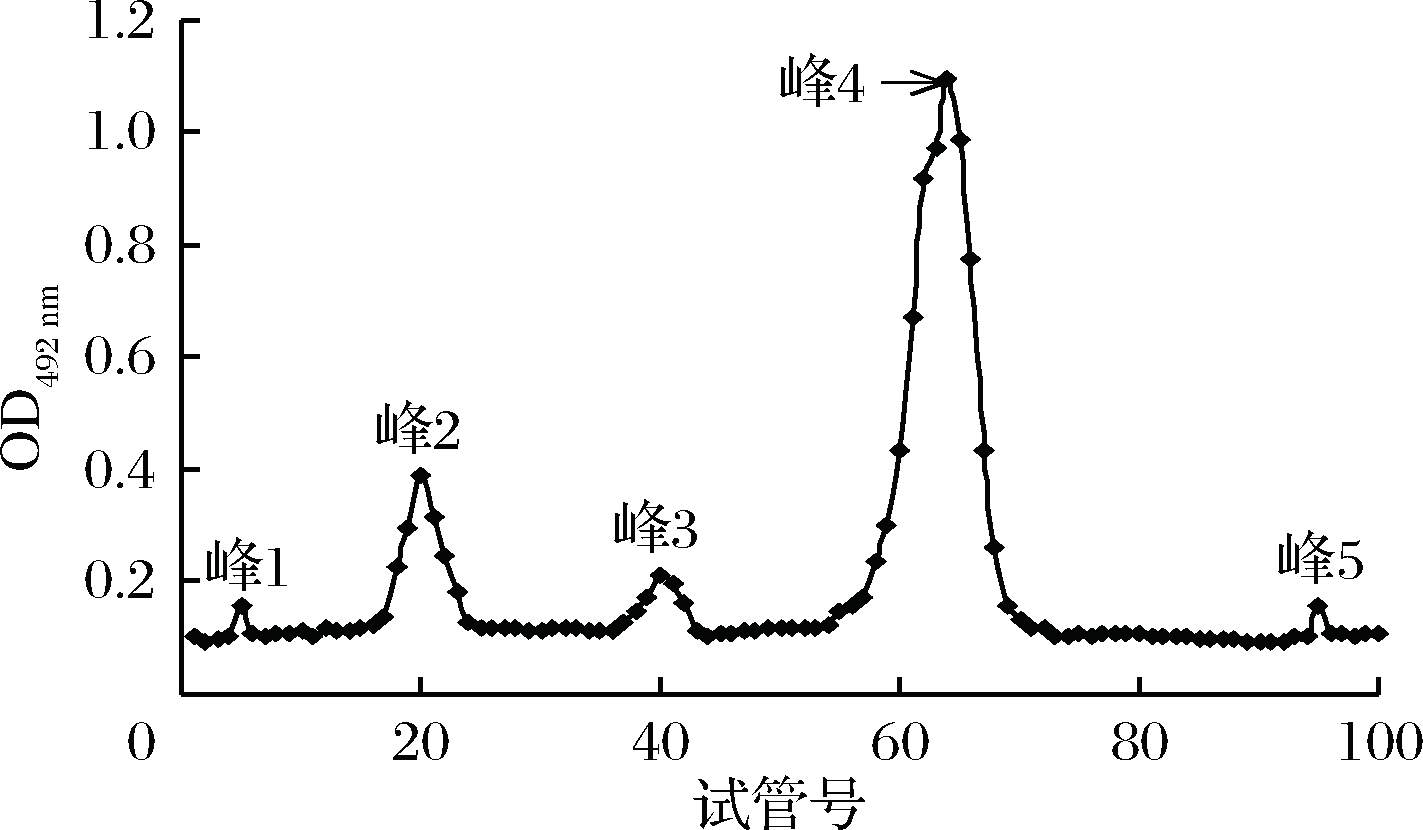
图3 TEPs的DEAE-52洗脱曲线
Fig.3 The elution curve of TEPs on DEAE-52
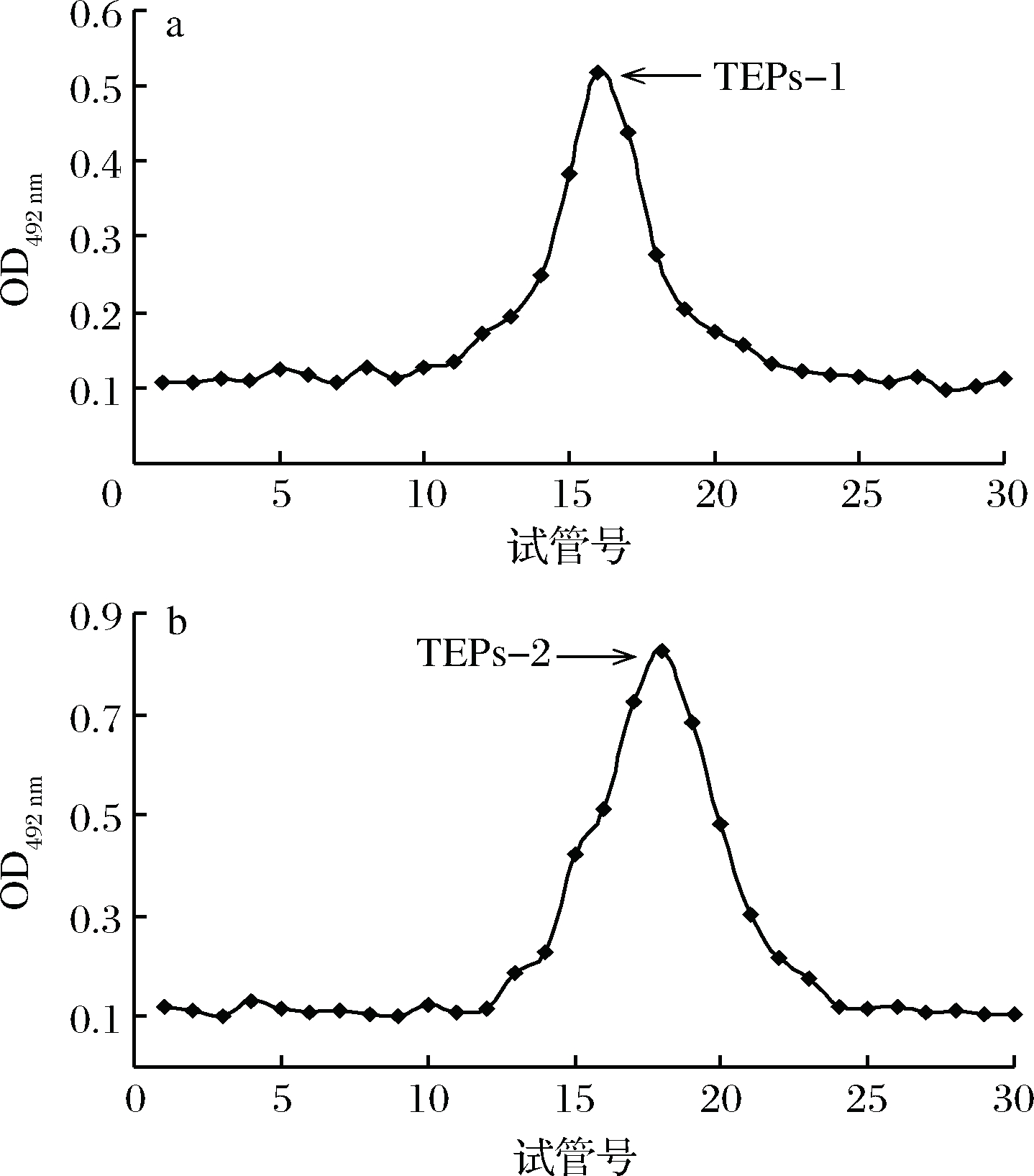
a-TEPs-1; b-TEPs-2
图4 TEPs的Sephadex G-100洗脱曲线
Fig.4 The elution curve of TEPs on Sephadex G-100
2.4 TEPs各组分重均分子量和单糖组成分析
2.4.1 TEPs-1和TEPs-2重均分子量
经HPSEC对TEPs 2个组分进行分析,结果如图5所示。
从图5可以看出,TEPs-1和TEPs-2的色谱峰均为单一对称峰,表明该组分为均一多糖。根据葡聚糖系列得回归方程为lg Mw=7.512 8-0.497 3Rt,R2=0.987 7。根据保留时间计算得TEPs-1和TEPs-2重均分子量分别为4.69和5.73 kDa。
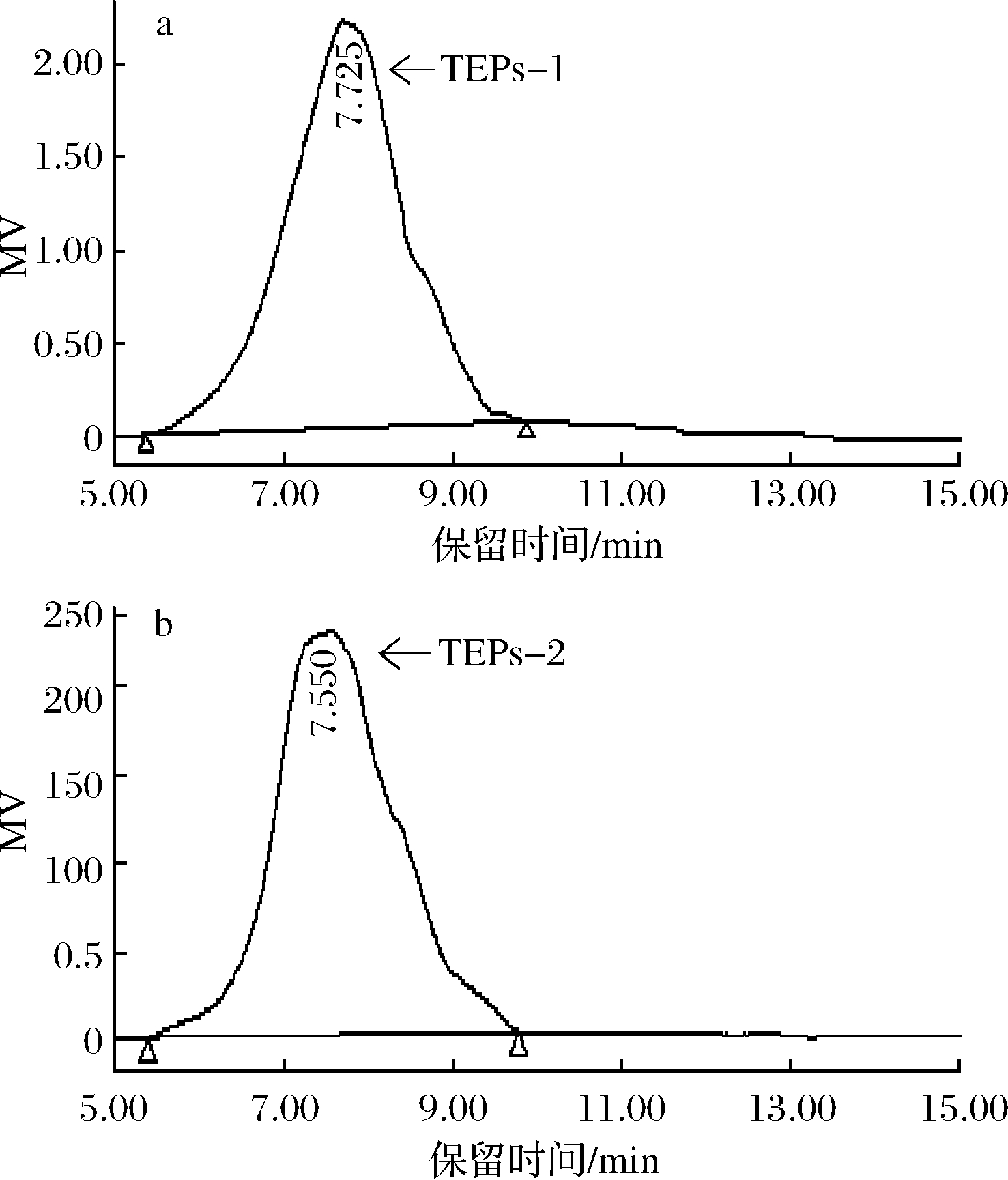
a-TEPs-1; b-TEPs-2
图5 TEPs-1和TEPs-2的HPSEC色谱图
Fig.5 HPSEC chromatograms of TEPs-1 and TEPs-2
2.4.2 TEPs-1和TEPs-2单糖组成分析
TEPs酸水解衍生物中单糖组成分析如图6和表4所示。由图6可以看出,TEPs-1和TEPs-2均由7种单糖组成,各组分单糖含量不尽相同且不含糖醛酸,说明TEPs是中性杂多糖[17,24]。而从表4中可以看出,TEPs 2个组分中甘露糖、半乳糖、葡萄糖和阿拉伯糖4种单糖含量较高,而鼠李糖、木糖和岩藻糖的含量非常少。
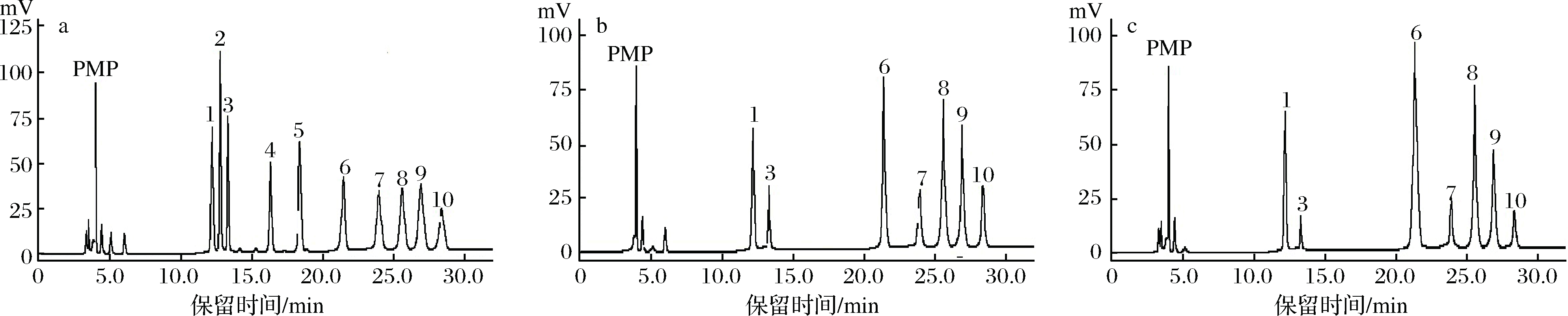
1-甘露糖;2-核糖;3-鼠李糖;4-葡萄糖醛酸;5-半乳糖醛酸;6-葡萄糖;7-木糖;
8-半乳糖;9-阿拉伯糖;10-岩藻糖;a-10种标准单糖;b-TEPs-1;c-TEPs-2
图6 TEPs-1、TEPs-2和混合标准单糖的HPLC色谱图
Fig.6 HPLC chromatograms of mixture of monosaccharide standards
表4 TEPs酸水解衍生物中单糖组成 单位:%
Table 4 Monosaccharide composition of TEPs acid hydrolytic derivatives

组分甘露糖鼠李糖葡萄糖木糖半乳糖阿拉伯糖岩藻糖TEPs-114.72±0.145.61±0.1224.85±0.156.23±0.0920.47±0.1819.04±0.198.08±0.15TEPs-216.28±0.211.34±0.1632.52±0.173.81±0.1124.52±0.1418.72±0.082.93±0.12
2.5 TEPs体外抗氧化活性分析
2.5.1 对DPPH自由基的清除作用
TEPs经纯化后得到均一多糖TEPs-1和TEPs-2具有良好的抗氧化活性。由图7-a可以看出,在TEPs质量浓度为1.0~3.5 mg/mL范围内,2种多糖对DPPH自由基的清除能力与其质量浓度呈现近似的线性递增关系,TEPs-2增加幅度明显高于TEPs-1,但都低于VC。
当质量浓度为3.5 mg/mL时,TEPs-1、TEPs-2和VC对DPPH自由基的清除率分别为45.01%、88.33%和100%。此外,从表5中可以看出TEPs-1和TEPs-2对DPPH的IC50值分别为4.27和2.24 mg/mL。
2.5.2 对·OH的清除作用
由图7-b可以看出,TEPs质量浓度从1.0 mg/mL增加至3.5 mg/mL时,TEPs两种组分对·OH的清除能力随着样品质量浓度的增加而增加。当质量浓度大于2.5 mg/mL时,TEPs-2对·OH的清除率增幅较快,VC对自由基的清除率几乎为100%,而TEPs-1则弱于TEPs-2。另外,从表5中可以看出TEPs-1和TEPs-2对·OH的IC50值分别为5.28和2.48 mg/mL。
2.5.3 对O2-·的清除作用
由图7-c可知,在一定的质量浓度范围内,浓度越大,对自由基清除能力越强,待测样品和VC清除O2-·的能力大小顺序依次为VC>TEPs-2>TEPs-1,TEPs-1和TEPs-2清除O2-·的IC50分别为4.38和2.62 mg/mL(表5)。
2.5.4 对ABTS自由基的清除作用
从图7-d和表5中可以看出,在1.0~3.5 mg/mL质量浓度范围内,样品具有明显的清除ABTS自由基的能力,TEPs 2种组分中TEPs-2清除能力更强,IC50为2.21 mg/mL,TEPs-1清除能力较弱,其IC50为3.94 mg/mL。由图7-d可知,2种组分对ABTS自由基的清除能力均小于同浓度的VC,当浓度达到3.5 mg/mL时,TEPs-2清除能力接近于VC。有研究表明,多糖的抗氧化活性可能与其分子质量和结构有关[30],TEPs经分离纯化得到了2种均一多糖,都有一定的抗氧化能力,但均未对其精细化结构进行研究,故而更深层次的抗氧化机制有待于下一步深入研究。
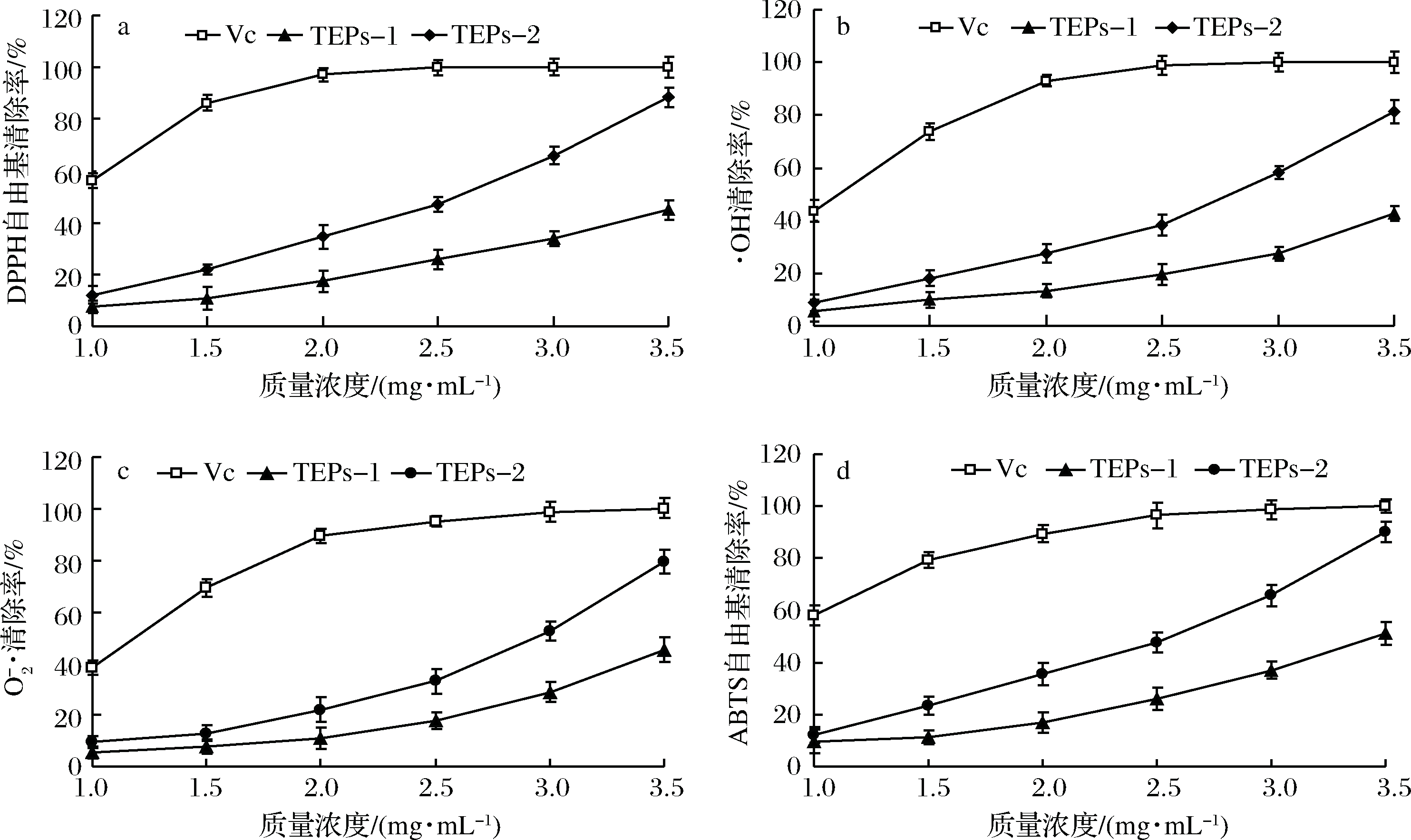
a-DPPH自由基;b-·OH;c-O2-·;d-ABTS自由基
图7 TEPs-1和TEPs-2体外抗氧化活性
Fig.7 In vitro antioxidant activities of TEPs-1 and TEPs-2
表5 TEPs对不同自由基体系清除能力的IC50值
Table 5 IC50 values of TEPs for scavenging capacity
of different free radical systems
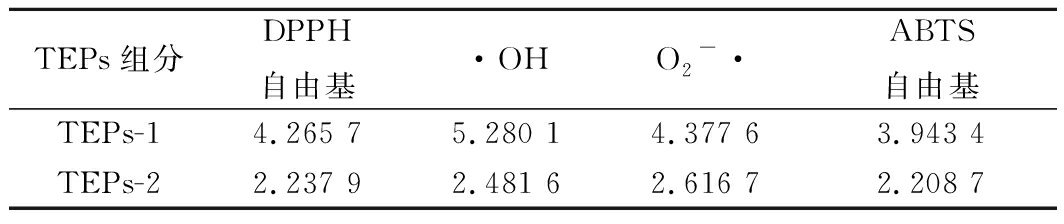
TEPs组分DPPH自由基·OHO2-·ABTS自由基TEPs-14.265 75.280 14.377 63.943 4TEPs-22.237 92.481 62.616 72.208 7
2.6 TEPs体外抑制肿瘤细胞生长情况分析
TEPs不同组分和CTX对MCF-7细胞的生长抑制作用如图8所示,TEPs两个组分对MCF-7细胞均有不同程度的生长抑制作用,且呈现明显的质量浓度依赖关系。当TEPs质量浓度为200 μg/mL时,TEPs-1对MCF-7的生长抑制率为40.82%,TEPs-2为73.45%,CTX为88.98%,说明TEPs-2对MCF-7细胞抑制率高于TEPs-1。经Excel软件计算可得,TEPs-1、TEPs-2和CTX的IC50值为319.76、134.04和67.77 μg/mL,三者之间存在显著差异(P<0.05)。
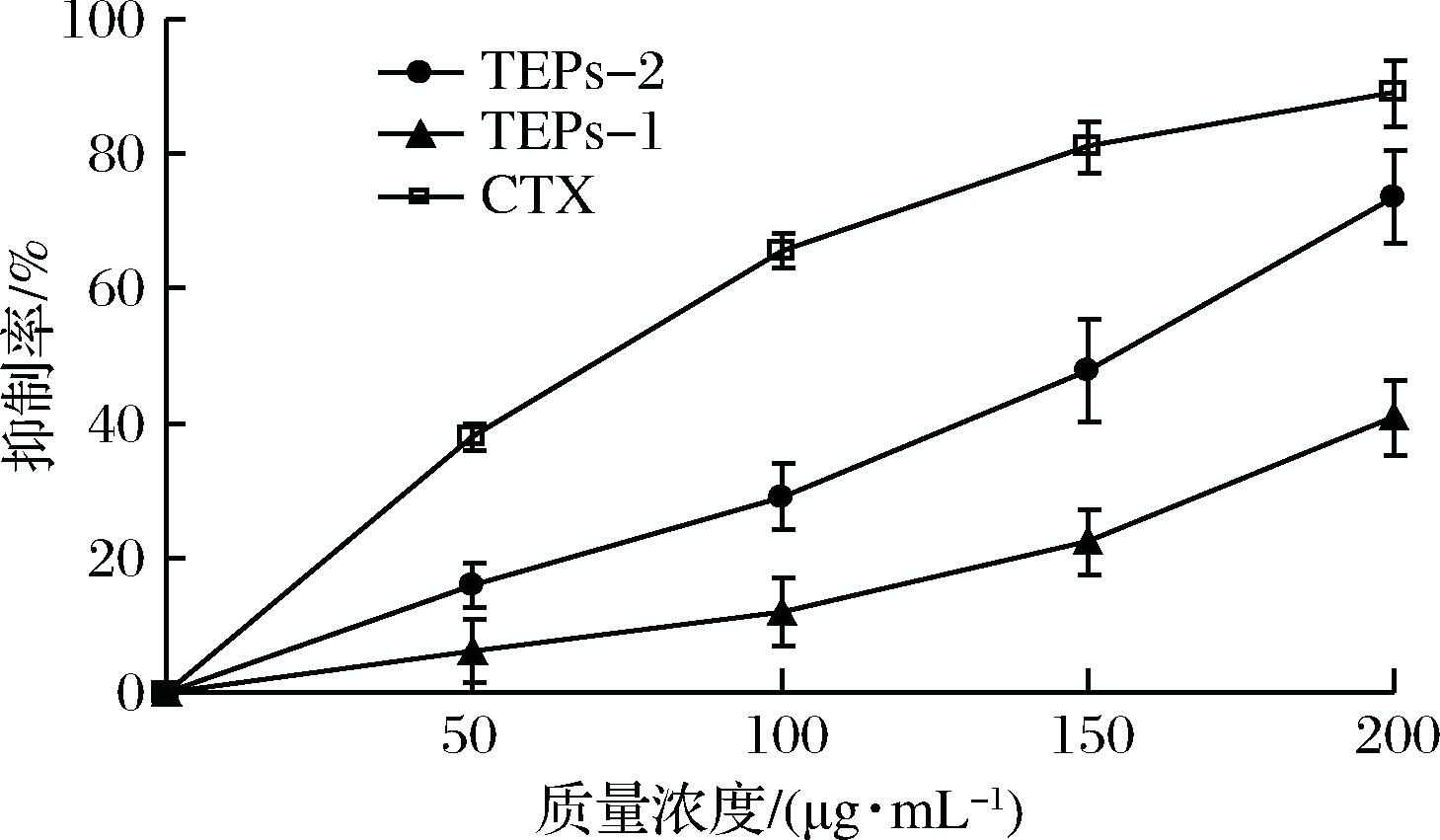
图8 TEPs对MCF-7细胞的抑制率
Fig.8 Inhibition rate of TEPs on MCF-7 cells
3 结论
在单因素实验的基础上,通过响应面优化万寿菊多糖水提醇沉工艺为:提取温度80 ℃、提取时间2 h、料液比1∶21(g∶mL),在此条件下多糖提取率为3.7%。继而采用DEAE-52和Sephadex G-100对TEPs进行纯化得到TEPs-1和TEPs-2两个均一组分,其总糖含量(质量分数)分别为79.27%和87.71%,重均分子质量分别为4.69 kDa和5.73 kDa。TEPs两种组分中甘露糖、半乳糖、葡萄糖和阿拉伯糖4种单糖含量较高,且均由7种单糖组成。
在实验质量浓度范围内,TEPs清除DPPH自由基、·OH、O2-·和ABTS自由基均呈现良好的浓度依赖关系,质量浓度越大清除率越高。TEPs-1清除DPPH自由基、·OH、O2-·和ABTS自由基的IC50依次为4.26、5.28、4.38、3.94 mg/mL;TEPs-2的IC50依次为2.24、2.48、2.62、2.21 mg/mL。
TEPs 两个组分对MCF-7细胞均有一定生长抑制作用,且呈明显的浓度依赖关系。当TEPs浓度为200 μg/mL时,TEPs-1和TEPs-2的生长抑制率分别为40.82%和73.45%。此外,TEPs-1和TEPs-2对MCF-7细胞的IC50分别为319.76和134.04 μg/mL。
[1] 张春华,黄前晶,孟桂兰,等.色素万寿菊及其深加工产品的国内、外研究、生产现状[J].内蒙古农业科技,2006(2):65-67.
[2] AJAY K,RAHULL D G,ASHOK K,et al. Floral biology of wild marigold (Tagetes minuta L.) and its relation to essential oil composition[J]. Industrial Crops and Products,2020,145: 111 996.
[3] 额尔敦巴雅尔,云雪艳,董同力嘎.基于UPLC-Q-TOF-MS法分析万寿菊提取物中化学成分研究[J].食品科技,2019,44(12): 266-271.
[4] 邵友元,杨忠林,陈莹,等.万寿菊中叶黄素的生产技术及应用[J].食品科技,2007,32(12):155-158.
[5] CONBOY J A,THOMAS M D,ORMEROD A,et al. Companion planting with French marigolds protects tomato plants from glasshouse whiteflies through the emission of airborne limonene[J]. PloS One,2019,14(3): e0213071.
[6] 王新国,徐汉虹,刘新清,等.四种菊科植物α-三连噻吩的含量测定及杀虫活性研究[J].华南农业大学学报,2001,22(3):26-28.
[7] 李大婧,刘春泉.万寿菊叶黄素的提取及分析方法研究进展[J].食品科学,2005,26(9):582-586.
[8] 杨忠林.万寿菊中叶黄素的提取及抗氧化研究[D].武汉:湖北工业大学,2009:5-7.
[9] 张志强,凡前峰,李佳佳,等.万寿菊中叶黄素的提取与皂化条件的研究[J].青海大学学报(自然科学版),2013,31(5):39-43.
[10] 郭耀东,任嘉瑜,胡莎莎.亚临界基质万寿菊残渣中多酚和黄酮超声波辅助提取研究[J].西北农业学报,2019,28(10):1 718-1 726.
[11] 谭美微,李国玉,吕鑫宇,等.万寿菊的化学成分和药理作用研究进展[J].中医药信息,2017,34(6):138-141.
[12] ANTON S,MANOL O,IVELINA V. Pectic polysaccharides extracted from pot marigold (Calendula officinalis) industrial waste[J]. Food Hydrocolloids,2020,101: 105 545.
[13] KRINSKY N I,LANDRUM J T,BONE R A. Biologic mechanisms of the protective role of lutein and zeaxanthin in the eye[J]. Annual Review of Nutrition,2003,23(1): 171-201.
[14] MARES-PERLMAN J A,MILLEN A E,FIECK T L,et al. The body of evidence to support a protective role for lutein and zeaxanthin in delaying chronicdiseases overview[J]. Journal of Nutrition,2002,132(3): 518-524.
[15] 余召辉,赵宗仁,李贺,等.叶黄素的药理作用[J].吉林医药学院学报,2017,38(1):58-60.
[16] 王丽,王新雨,胡明月.万寿菊花中叶黄素的提取方法及其药理作用研究进展[J].中国民族民间医药,2013,22(6):28;30.
[17] HE N,ZHAI X,ZHANG X,et al. Extraction,purification and characterization of water-soluble polysaccharides from green walnut husk with antioxidant and antiproliferative capacities[J]. Process Biochemistry,2020,88,170-179.
[18] 何念武,秦娇娇,王新军.超声辅助提取灰灰菜多糖工艺优化及其体外抗氧化活性[J].食品工业科技,2018,39(1):235-240;252.
[19] 喻俊,王涛,贾春红,等.响应面优化牛蒡子多糖的提取及其抗氧化活性研究[J].食品与发酵工业,2015,41(6):207-212.
[20] 邓学良,周文化,李岚,等.响应面法优化槟榔油提取工艺条件[J].食品与机械,2010,26(6):107-109.
[21] 谢东雪,陆娟,王月,等.长白山区核桃青皮多糖分离纯化、鉴定及抗氧化活性分析[J].食品科学,2019,40(18):281-286.
[22] 吴艳丽,邵珠领,张宇,等.南瓜均一多糖的分离纯化及其抗氧化活性的研究[J].食品研究与开发,2019,40(23):62-70.
[23] 杨嘉梁,陈小娥,方旭波,等.鱿鱼内脏多糖的分离纯化、理化性质及抗氧化活性研究[J].中国食品学报,2019,19(4):116-124.
[24] HE N,TIAN L,ZHAI X,et al. Composition characterization,antioxidant capacities and anti-proliferative effects of the polysaccharides isolated from Trametes lactinea (Berk.) Pat[J]. International Journal of Biological Macromolecules,2018,115: 114-123.
[25] HE N W,SHI X L,ZHAO Y,et al. Inhibitory effects and molecular mechanisms of selenium-containing tea polysaccharides on human breast cancer MCF-7 Cells[J]. Journal of Agricultural and Food Chemistry,2013,61(3): 579-588.
[26] 李莹,黄德春,陈贵堂,等.昆布多糖不同提取工艺优化及其理化性质和抗肿瘤活性比较[J].食品科学,2019,40(6):288-294.
[27] HE N, YANG X, JIAO Y, et al. Characterisation of antioxidant and antiproliferative acidic polysaccharides from Chinese wolfberry fruits[J]. Food Chemistry,2012,133(3): 978-989.
[28] 张雪春,田智宇,王振兴,等.核桃青皮多糖微波辅助提取工艺及抗氧化活性研究[J].食品与机械,2016,32(7):146-151.
[29] 李堆淑. 响应面法优化灰色链霉菌产纤维素酶的工艺研究[J].基因组学与应用生物学,2019,38(3): 1 123-1 130.
[30] WEI C Y,HE P F,HE L,et al. Structure characterization and biological activities of a pectic polysaccharide from cupule of Castanea henryi[J]. International Journal of Biological Macromolecules,2018,109: 65-75.