L-酪氨酸(L-tyrosine,Tyr)是人和动物体内的营养必需氨基酸[1],广泛用于食品、饲料添加剂及医药原料等[2-4]。L-酪氨酸可通过多种微生物发酵合成,其中大肠杆菌是目前研究较多的菌种,然而大肠杆菌系统不适于食品级酪氨酸的合成[5-12]。解淀粉芽胞杆菌因具有食用安全、易于培养、生长快速等优点,广泛应用于食品、农业等领域[13-15]。KEGG数据库显示,解淀粉芽胞杆菌中存在完整的L-酪氨酸合成途径,这为解淀粉芽胞杆菌构建L-酪氨酸高产菌株奠定了基础。然而,目前还未见通过解淀粉芽胞杆菌合成L-酪氨酸的报道。
磷酸转移酶葡萄糖转运系统是细菌吸收葡萄糖的主要途径,然而该过程会消耗大量的磷酸烯醇式丙酮酸,不利于L-酪氨酸的合成。非磷酸转移酶葡萄糖转运系统一方面可平衡糖酵解途径和三羧酸循环之间的代谢流,另一方面可增加磷酸烯醇式丙酮酸的积累[16-17],有利于L-酪氨酸的合成。本研究通过基因过表达技术构建了系列解淀粉芽胞杆菌工程菌株,考察强化非磷酸转移酶葡萄糖转运途径基因对解淀粉芽胞杆菌合成L-酪氨酸的影响,挖掘影响L-酪氨酸生物合成的关键基因,为解淀粉芽胞杆菌合成L-酪氨酸的代谢工程育种提供行之有效的策略。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
本研究所用到的菌株和质粒如表1和表2所示。其中大肠杆菌DH5α用于构建载体,HZΔptsH为本实验室保存缺失磷酸转移酶系统的解淀粉芽胞杆菌工程菌株。
表1 研究中使用的菌株
Table 1 Strains used in this study

菌株基因型或表型来源大肠杆菌(Escherichia coli)DH5αF-Φ80d/lacZΔM15,Δ(lacZYA-argF) U169, recA1, endA1, hsdR17 (rK-, mK+), phoA, supE44, λ-, thi-1, gyrA96, relA1本实验室保存大肠杆菌(E. coli)MG1655F-λ- ilvG- rfb-50 rph-1本实验室保存解淀粉芽胞杆菌(B.amyloliquefaciens ) HZ-12CCTCC M2015234, 野生菌本实验室保存HZΔptsHHZ-12缺失ptsH基因本实验室保存HZΔptsH/pHY300HZΔptsH携带pHY300PLK, Tetr本研究HZΔptsH/pHYgalP-EHZΔptsH含pHYgalP-E表达质粒(E.coli来源基因)本研究HZΔptsH/pHYglcPHZΔptsH含pHYglcP表达质粒本研究HZΔptsH/pHYidolT1-CHZΔptsH含pHYidolT1表达质粒(C.glu来源基因)本研究
表2 研究中使用的质粒
Table 2 Plasmids used in this study

质粒基因型或表现型来源pHY300PLKE.coli-B. amyloliquefaciens 穿梭质粒,Apr(E.coli),Tetr本实验室保存pHYglcPpHY300PLK含B.subtilis P43启动子、解淀粉芽胞杆菌glcP基因以及终止子TamyL,Apr(E.coli),Tetr本研究pHYgalP-EpHY300PLK含B.subtilis P43启动子、大肠杆菌galP基因以及终止子TamyL,Apr(E.coli),Tetr本研究pHYidolT1-CpHY300PLK含B.subtilis P43启动子、谷氨酸棒状杆菌idolT1基因以及终止子TamyL,Apr(E.coli),Tetr本研究
注:Tetr:四环素抗性;Kanr:卡那霉素抗性;orits:温敏型复制子
1.1.2 PCR引物
本研究所用的主要引物见表3。
表3 研究所使用的PCR引物
Table 3 Primers used for PCR in this study

引物名称引物序列(5'→3')pHY300-FGTTTATTATCCATACCCTTACpHY300-RCAGATTTCGTGATGCTTGTCglcP-P43-FCGGGATCCTGATAGGTGGTATGTTTTCGglcP-P43-RCAGCAGACGAGATTTCATCATTTCATGTGTACATTCCTCTCglcP-FGAGAGGAATGTACACATGAAATGAT-GAAATCTCGTCTGCTGglcP-RAATCCGTCCTCTCTGCTCTTTTACATTGATTTTGCTTTGCTGglcP-TamyL-FCAGCAAAGCAAAATCAATGTAAAAGAGCA-GAGAGGACGGATTglcP-TamyL-RGCTCTAGACGCAATAATGCCGTCGCACTgalP-P43-FTCCCCCGGGTGATAGGTGGTATGTTTTCG
续表3

引物名称引物序列(5'→3')galP-P43-RTGTTTTTTAGCGTCAGGCATTTCATGTGTACATTCCTCTCgalP-FGAGAGGAATGTACACATGAAATGCCTGACGCTAAAAAACAgalP-RAATCCGTCCTCTCTGCTCTTTTAATCGTGAGCGCCTATTTCgalP-TamyL-FGAAATAGGCGCTCACGATTAAAAGAG-CAGAGAGGACGGATTgalP-TamyL-RGCTCTAGACGCAATAATGCCGTCGCACTidolT1-P43-FCGGAATTCTGATAGGTGGTATGTTTTCGidolT1-P43-RCCTGAATGAAGGTACTAGCCATTTCATGT-GTACATTCCTCTCidolT1-FGAGAGGAATGTACACATGAAATGGCTAG-TACCTTCATTCAGGidolT1-RAATCCGTCCTCTCTGCTCTTTTAGTGCACCTTTCCTTTTCGidolT1-TamyL-FCGAAAAGGAAAGGTGCACTAAAAGAG-CAGAGAGGACGGATTidolT1-TamyL-RGCTCTAGACGCAATAATGCCGTCGCACT
注:方框内为限制性内切酶酶切位点;下划线为重叠延伸拼接SOE-PCR的重叠区域
1.1.3 主要试剂
TransStartR FastPfu DNA聚合酶、TransStartR easyTaq DNA聚合酶:北京全式金公司;dNTPS、DNA限制性内切酶、T4 DNA连接酶、DL5000 Marker:TaKaRa公司;DNA抽提试剂盒:武汉楚诚正茂科技工程有限公司;DNA回收试剂盒和质粒抽提试剂盒:美国 OmegaBio-Tek公司;基因引物合成、测序:武汉擎科创新生物科技有限公司;甲醇为色谱级,其他主要生化试剂均为国产分析级纯。
1.1.4 主要培养基
Luria-Bertani(LB)培养基(g/L):蛋白胨10.0,酵母浸出粉5.0,氯化钠10.0,固体培养基加1.5%~2%的琼脂粉。抗生素培养基添加相应抗生素,至终质量浓度为20 μg/L。
L-酪氨酸初始发酵培养基(g/L):葡萄糖22,(NH4)2SO4 3,K2HPO4 6.75,KH2PO4 1.25,MgSO4·7H2O 1.5,柠檬酸钠5,蛋白胨3,酵母提取物6。
微量元素(g/L):柠檬酸钠10,FeSO4·7H2O 4,CaC12 4,MnSO4·5H2O 1,CoCl2·6H2O 0.4,ZnSO4·7H2O 0.2,AlCl3·6H2O 0.1,CuCl2·H2O 0.1,H3BO4 0.05。
1.1.5 仪器与设备
Thermal Cycler (My Cycler) PCR仪,美国 Bio-Rad 公司;DYY-8C型电泳仪,北京六一仪器厂;HQL300B恒温大幅振荡摇床,武汉中科科仪技术发展有限责任公司;CR21G高速冷冻离心机,日本Hitachi公司;Legend Micro17R高速冷冻离心机,美国Thermo Fisher Scientific 公司;SKP-02.420电热恒温培养箱,黄石市恒丰医疗器械有限公司;Agilent Technologies1260高效液相色谱,美国Agilent公司。
1.2 实验方法
1.2.1 游离表达载体的构建(以glcP基因为例)
分别以B.subtillis 168基因组、B.amyloliquefaciens HZ-12基因组和B.licheniformis WX-02基因组,根据表3相对应的引物,扩增出P43启动子、glcP基因、终止子TamyL。纯化回收PCR产物,以P43-F、TamyL-R为引物通过SOE-PCR连接起来,与pHY300PLK质粒分别用BamH I和Xba I进行双酶切,用T4 DNA连接酶连接PCR产物和质粒,并转化至E.coli DH5α感受态细胞。用pHY300-F和pHY300-R对单菌落进行PCR验证,初步确定为阳性转化子后,抽取质粒进行双酶切和DNA测序验证,成功构建的游离表达载体命名为pHYglcP。
1.2.2 单基因游离表达工程菌株的构建
将游离表达载体的pHYglcP、pHYgalP-E、pHYidolT1-C和空载体pHY300PLK电转化至HZΔptsH感受态中,涂布于Tet抗性平板,37 ℃静置培养。挑选转化子单菌落于Tet平板上划线,用pHY300-F、pHY300-R进行PCR菌落验证。
1.2.3 发酵培养条件
从活化的平板上挑取单菌落接种于50 mL液体LB培养基中,37 ℃,180 r/min下培养9 h,携带质粒的菌株培养基需加入相应的抗生素,培养12 h左右。以3%(v/v)的接种量接种于50 mL的发酵培养基中,37 ℃,180 r/min,培养40 h。
1.2.4 L-酪氨酸液相检测
1 mL发酵液加入0.6 mL 1 mol/L HCl 涡旋振荡1 h,12 000 r/min离心3 min后,取上清液,用0.22 μm的微孔滤膜过滤。色谱柱:ZORBAX Eclipse XDB-C18(4.6 mm×250 mm,5 μm);流动相:V(甲醇)∶V(pH 4.0,100 mmol/L醋酸钠)=10∶90;流速:0.6 mL/min;进样量:10 μL;柱温:30 ℃;紫外检测波长:280 nm。
1.2.5 数据统计分析
每组实验设计3个重复,采用SPSS 20.0进行数据统计分析,评估数据差异的显著性,计算出平均值和标准偏差,采用Origin 8.5进行图表绘制。
2 结果与分析
2.1 游离表达载体的构建
据文献报道,大肠杆菌和谷氨酸棒状杆菌内均存在非磷酸转移酶系统介导的葡萄糖转运途径[18-20]。赖联贺等[21]通过敲除谷氨酸棒状杆菌ptsH基因激活非磷酸转移酶葡萄糖转运途径,过表达自身来源肌醇透性酶1编码基因iolT1,使得L-丝氨酸产量提高了5.1倍。借鉴上述思路,在HZΔptsH中过表达3种非磷酸转移酶系统介导的葡萄糖转运蛋白基因,包括大肠杆菌来源半乳糖透性酶基因galP、谷氨酸棒状杆菌来源肌醇透性酶基因idolT1以及解淀粉芽胞杆菌自身来源的glcP基因,以期强化非磷酸转移酶葡萄糖转运途径,提高L-酪氨酸的产量。
按照1.2.1中所述的方法构建游离表达载体,根据表3引物扩增出P43启动子、终止子TamyL、glcP基因、galP-E基因、idolT1-C基因,片段大小与理论值大小一致(分别是305、501、1 215、1 395和1 476 bp),凝胶电泳验证图如图1所示。SOE-PCR产物大小分别为2 021、2 201和2 282 bp,纯化后与pHY300PLK载体分别用BamH I和Xba I、Sma I和Xba I、EcoR I和Xba I进行双酶切,用T4 DNA连接酶连接后并转化至E.coli DH5α感受态细胞。选取验证正确的阳性转化子,抽提质粒并送至武汉擎科公司测序。测序结果比对显示序列正确,表明pHYglcP、pHYgalP-E、pHYidolT1-C质粒构建成功。
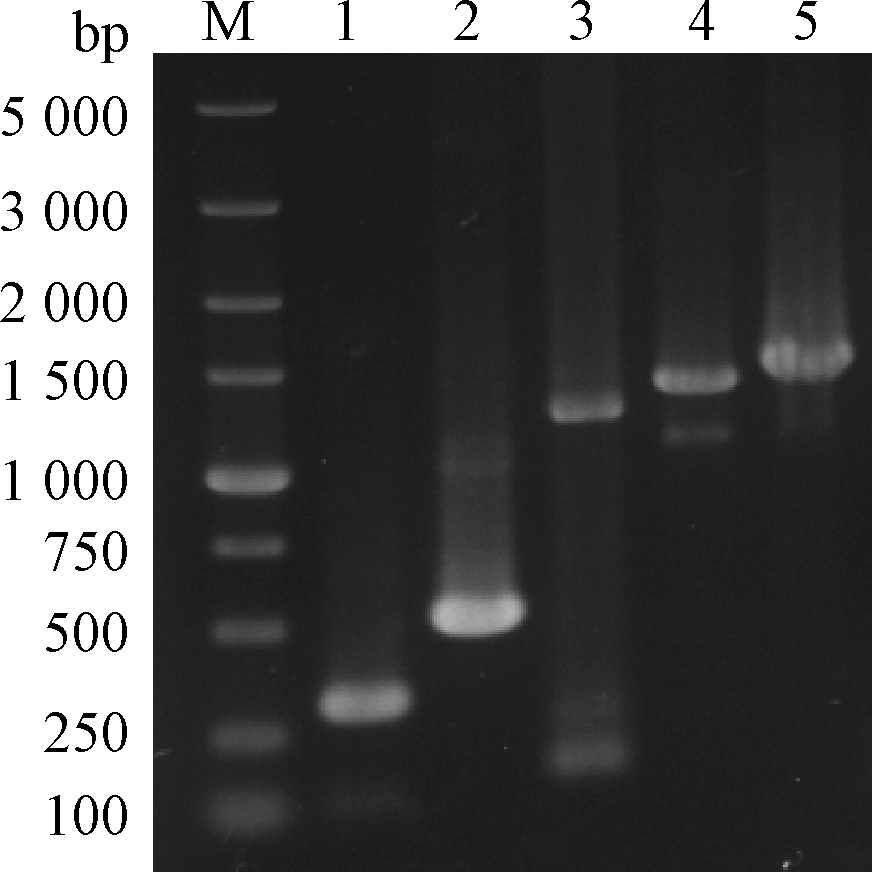
泳道1~5-P43启动子、TamyL终止子、glcP基因、galP-E基因、
idolT1-C基因PCR产物验证
图1 基因片段PCR扩增凝胶电泳图
Fig.1 Gel electrophoresis of gene fragment PCR amplification
2.2 游离表达菌株的构建
利用1.2.2中所述的方法构建游离表达工程菌株HZΔptsH/pHYglcP、HZΔptsH/pHYgalP-E、HZΔptsH/pHYidolT1-C,并利用表3中相应的引物进行菌落PCR验证,条带大小分别为2 321、2 501和2 582 bp,PCR验证电泳图如图2所示,条带大小与理论值一致,并送往测序公司进一步验证碱基序列,比对结果无误,表明工程菌株构建成功。
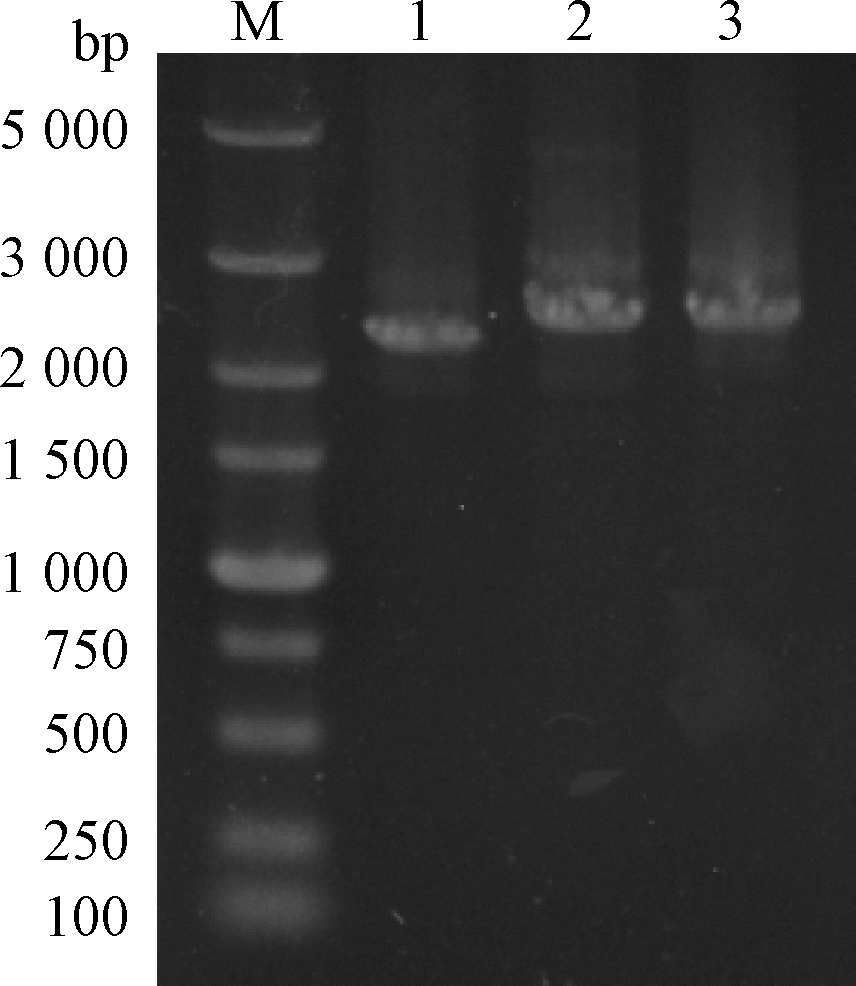
泳道1-引物pHY300-F和pHY300-R验证HZΔptsH/pHYglcP(2 321 bp);泳道2-引物pHY300-F和pHY300-R验证HZΔptsH/pHYgalP-E(2 501 bp);泳道3-引物pHY300-F和pHY300-R验证
HZΔptsH/pHYidolT1-C(2 582 bp)
图2 菌落PCR验证凝胶电泳图
Fig.2 Gel electrophoresis of colony PCR verification
2.3 强化非磷酸转移酶葡萄糖转运途径对L-酪氨酸合成的影响
按照1.1.4和1.2.3小节的发酵培养基和培养条件对工程菌株HZΔptsH/pHY300、HZΔptsH/pHY-P43glcP、HZΔptsH/pHY-P43galP-E、HZΔptsH/pHY-P43idolT1-C进行发酵验证,发酵周期40 h。发酵终点检测生物量OD600值和L-酪氨酸产量。结果如图3所示。
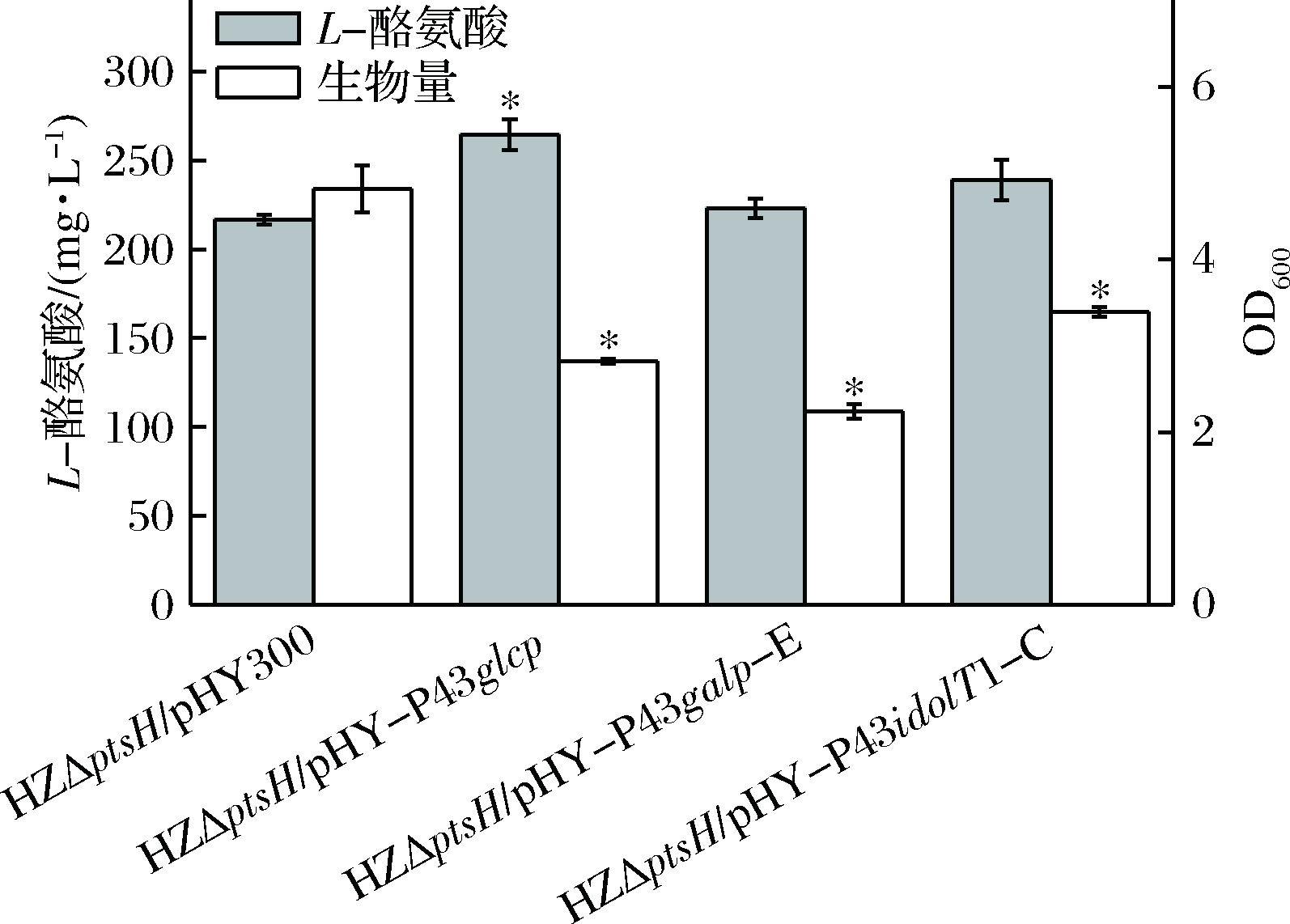
图3 表达非磷酸转移酶葡萄糖转运途径基因对
L-酪氨酸产量的影响
Fig.3 Effect of expressing the non-phosphotransferase glucose
transport pathway genes on L-tyrosine production
注:星号指示与对照菌株HZΔptsH/pHY300的数据相比,
具有显著性差异(P<0.05)
由图3可知,3株工程菌株生物量较对照菌株明显降低,工程菌株HZΔptsH/pHY-P43glcP的L-酪氨酸产量较对照菌株HZΔptsH/pHY300提高22%,达到了264.61 mg/L,推测其原因,解淀粉芽胞杆菌的葡萄糖转运系统包括两种:磷酸转移酶葡萄糖转运系统和非磷酸转移酶葡萄糖转运系统,前者可消耗大量的磷酸烯醇式丙酮酸,后者不消耗磷酸烯醇式丙酮酸。相比之下,通过增强表达glcP基因强化非磷酸转移酶葡萄糖转运系统,可分担一部分磷酸转移酶系统所转运的葡萄糖,从而降低磷酸烯醇式丙酮酸的消耗,促进更多的磷酸烯醇式丙酮酸用于L-酪氨酸合成[16-17],从而提高其产量。而过表达大肠杆菌galP基因和谷氨酸棒状杆菌idolT1基因对L-酪氨酸产量无显著性的影响,推测其原因,可能是由于转运蛋白的功能依赖特定宿主菌的细胞膜结构,来自大肠杆菌和谷氨酸棒状杆菌的异源转运蛋白在芽胞杆菌中难以正常组装到细胞模上,故不能发挥其功能。改造非磷酸转移酶葡萄糖转运系统在氨基酸的代谢工程中显示了良好的效果,然而针对解淀粉芽胞杆菌的改造尚未见报道,本文借鉴谷氨酸棒杆菌强化丝氨酸合成的思路[21],通过对比分析不同来源的转运蛋白基因对L-酪氨酸合成的影响,证明过表达解淀粉芽胞杆菌自身glcP基因可促进L-酪氨酸的合成,挖掘到了可增强酪氨酸合成的转运蛋白基因,为解淀粉芽胞杆菌非磷酸转移酶葡萄糖转运系统的改造和L-酪氨酸代谢工程育种提供了有效的基因原件,具有重要的理论意义和潜在的应用机制。
3 结论
本研究成功构建了系列单基因游离表达工程菌株HZΔptsH/pHY-P43glcP、HZΔptsH/pHY-P43galP-E、HZΔptsH/pHY-P43idolT1-C,首次探究了改造非磷酸转移酶葡萄糖转运途径对解淀粉芽胞杆菌合成L-酪氨酸的影响,发现系列工程菌株生物量相较于对照菌株均有不同程度下降,但是菌体生物量的下降对L-酪氨酸产量并无明显影响。强化表达解淀粉芽胞杆菌自身来源葡萄糖转运蛋白编码基因glcP后,L-酪氨酸产量提高了22%。本研究证实了改造解淀粉芽胞杆菌自身非磷酸转移酶葡萄糖转运途径对L-酪氨酸合成影响显著,为解淀粉芽胞杆菌合成L-酪氨酸的代谢工程育种提供了重要的思路。
[1] 姚元锋. L-酪氨酸代谢平台构建及其在丹参素合成中的应用[D].天津:天津大学,2013.
[2] DENG W,WANG Y,ZHANG S,et al. Catalytic amino acid production from biomass-derived intermediates[J]. Proceedings of the National Academy of Sciences,2018,115(20): 5 093-5 098.
[3] JANG S,GANG H,KIM B G,et al. FCS and ECH dependent production of phenolic aldehyde and melanin pigment from L-tyrosine in Escherichia coli[J]. Enzyme and Microbial Technology,2018,112: 59-64.
[4] WANG J,GULERIA S,KOFFAS M A G,et al. Microbial production of value-added nutraceuticals[J]. Current Opinion in Biotechnology,2016,37: 97-104.
[5] D′ESTE M,ALVARADO-MORALES M,ANGELIDAKI I. Amino acids production focusing on fermentation technologies-A review[J]. Biotechnology Advances,2018,36(1): 14-25.
[6] XU Y,LI Y,ZHANG L,et al. Unraveling the specific regulation of the shikimate pathway for tyrosine accumulation in Bacillus licheniformis[J]. Journal of industrial Microbiology & Biotechnology,2019,46(8): 1 047-1 059.
[7] RODRIGUEZ A,MARTNEZ J A,FLORES N,et al. Engineering Escherichia coli to overproduce aromatic amino acids and derived compounds[J]. Microbial Cell Factories,2014,13(1): 126.
[8] NODA S,KONDO A. Recent advances in microbial production of aromatic chemicals and derivatives[J]. Trends in Biotechnology,2017,35(8): 785-796.
[9] BREY L F,W ODARCZYK A J,THØFNER J F B,et al. Metabolic engineering of Synechocystis sp. PCC 6803 for the production of aromatic amino acids and derived phenylpropanoids[J]. Metabolic Engineering,2020,57: 129-139.
ODARCZYK A J,THØFNER J F B,et al. Metabolic engineering of Synechocystis sp. PCC 6803 for the production of aromatic amino acids and derived phenylpropanoids[J]. Metabolic Engineering,2020,57: 129-139.
[10] IKEDA M,OKAMOTO K,KATSUMATA R. Cloning of the transketolase gene and the effect of its dosage on aromatic amino acid production in Corynebacterium glutamicum[J]. Applied Microbiology and Biotechnology,1999,51(2): 201-206.
[11] SANTOS C N S,STEPHANOPOULOS G. Melanin-based high-throughput screen for L-tyrosine production in Escherichia coli[J]. Applied and Environmontal Microbiology,2008,74(4): 1 190-1 197.
[12] MU OZ A J,HERN
OZ A J,HERN NDEZ-CH
NDEZ-CH VEZ G,DE ANDA R,et al. Metabolic engineering of Escherichia coli for improving L-3,4-dihydroxyphenylalanine (L-DOPA) synthesis from glucose[J]. Journal of Industrial Microbiology & Biotechnology,2011,38(11): 1 845.
VEZ G,DE ANDA R,et al. Metabolic engineering of Escherichia coli for improving L-3,4-dihydroxyphenylalanine (L-DOPA) synthesis from glucose[J]. Journal of Industrial Microbiology & Biotechnology,2011,38(11): 1 845.
[13] FREITAS M A,MEDEIROS F H V,MELO I S,et al. Stem inoculation with bacterial strains Bacillus amyloliquefaciens (GB03) and Microbacterium imperiale (MAIIF2a) mitigates Fusarium root rot in cassava[J]. Phytoparasitica,2019,47(1): 135-142.
[14] TORRES M J,BRANDAN C P,SABATÉ D C,et al.Biological activity of the lipopeptide-producing Bacillus amyloliquefaciens PGPBacCA1 on common bean Phaseolus vulgaris L. pathogens[J]. Biological Control,2017,105:93-99.
[15] LEE J Y,SHIM J M,YAO Z,et al. Antimicrobial activity of Bacillus amyloliquefaciens EMD17 isolated from Cheonggukjang and potential use as a starter for fermented soy foods[J]. Food Science and Biotechnology,2016,25(2): 525-532.
[16] B EZ J L,BOL
EZ J L,BOL VAR F,GOSSET G. Determination of 3-deoxy-D-arabino-heptulosonate 7-phosphate productivity and yield from glucose in Escherichia coli devoid of the glucose phosphotransferase transport system[J]. Biotechnology and Bioengineering,2001,73(6): 530-535.
VAR F,GOSSET G. Determination of 3-deoxy-D-arabino-heptulosonate 7-phosphate productivity and yield from glucose in Escherichia coli devoid of the glucose phosphotransferase transport system[J]. Biotechnology and Bioengineering,2001,73(6): 530-535.
[17] ESCALANTE A,CALDER N R,VALDIVIA A,et al. Metabolic engineering for the production of shikimic acid in an evolved Escherichia coli strain lacking the phosphoenolpyruvate: Carbohydrate phosphotransferase system[J]. Microbial Cell Factories,2010,9(1): 21.
N R,VALDIVIA A,et al. Metabolic engineering for the production of shikimic acid in an evolved Escherichia coli strain lacking the phosphoenolpyruvate: Carbohydrate phosphotransferase system[J]. Microbial Cell Factories,2010,9(1): 21.
[18] LINDNER S N,SEIBOLD G M,HENRICH A,et al. Phosphotransferase system-independent glucose utilization in Corynebacterium glutamicum by inositol permeases and glucokinases[J]. Applied and Environmental Microbiology,2011,77(11): 3 571-3 581.
[19] IKEDA M,MIZUNO Y,AWANE S,et al. Identification and application of a different glucose uptake system that functions as an alternative to the phosphotransferase system in Corynebacterium glutamicum[J]. Applied Microbiology and Biotechnology,2011,90(4): 1 443.
[20] CHANDRAN S S,YI J,DRATHS K M,et al. Phosphoenolpyruvate availability and the biosynthesis of shikimic acid[J]. Biotechnology Progress,2003,19(3): 808-814.
[21] 赖联贺.改造谷氨酸棒杆菌非磷酸转移酶葡萄糖转运途径高产L-丝氨酸[D].无锡:江南大学,2017.