酱卤肉制品是指将鲜(冻)畜禽肉放入含有食盐、酱油以及香辛料的水中,经调味、煮制等工艺加工而成的一类熟肉类制品[1],代表性产品主要有烧鸡[2]、酱牛肉[3-4]、盐水鸭[5]、酱猪蹄、酱猪肘[6]以及红烧肉[7]等,因其鲜香馥郁、鲜美可口的特点而深受消费者喜欢。酱卤肉制品老汤对产品滋味影响重大,是决定酱卤肉制品品质的重要因素[8]。
老汤在连续煮制过程中会不断累积可溶性滋味物质,其中咸味和鲜味是老汤对产品最主要的滋味贡献,因此实现咸味和鲜味物质含量的实时监测对产品的标准化与稳定性至关重要。咸味大多使用硝酸盐滴定法进行实时监测[9];鲜味主要来源于老汤煮制过程的肉类降解产物,包括多肽类、核苷酸类、氨基酸类、有机酸等[10],其中鲜味氨基酸和鲜味核苷酸是老汤中最具代表性的两类鲜味成分,包括谷氨酸、天冬氨酸、5′-肌苷酸和5′-鸟苷酸[11-13]等,鲜味氨基酸大多通过氨基酸分析仪[14]、液相色谱法[15]、毛细管电泳法[16]和气相色谱法[17]等常规方法检测,存在设备成本高、样品前处理复杂、定性能力差等问题。目前电化学传感器检测逐渐成为新的研究趋势,利用物质在溶液中的反应引起一系列电化学反应的性质,通过反应所产生的电势差实现物质的检测,具有安全、灵敏度高、稳定性和可选择性强等优点[18-19]。本课题组前期研究发现,N,N′-二苯基硫脲(N,N′-diphenyl thiourea,DPTU)可作为鲜味敏感物质应用于电化学传感器特异性检测鲜味氨基酸[20],但尚未就其在实际样品的标准化检测应用方面开展系统研究。实现老汤鲜味氨基酸电化学快速、准确检测,必须满足样品检测参数标准化的要求,一套合适且固定的样品检测参数不仅有利于提高检测结果的准确性和稳定性,而且可以提高其检测效率。老汤成分复杂,过多的干扰物质会影响结果的准确性,离心是去除测定干扰的有效方法,且老汤中鲜味氨基酸含量较高,实际检测样品中鲜味氨基酸含量超过传感器的检测最高限,因此需要通过稀释以达到DPTU膜修饰传感器的检测限度。基于此,本文以扒鸡煮制老汤为研究对象,并以液相色谱检测结果为标准,研究适于N,N′-二苯基硫脲膜修饰传感器快速、准确检测鲜味氨基酸含量的样品前处理方式。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
材料:扒鸡老汤,由山东德州扒鸡股份有限公司提供。
试剂:异硫氰酸苯酯(phenyl isothiocyanate,PITC)、三乙胺、无水乙酸钠、正己烷、冰乙酸、浓H2SO4、H2O2、正己烷、四氢呋喃、邻苯二甲酸二辛酯、聚氯乙烯、DPTU为国产分析纯,阿拉丁试剂(上海)有限公司;谷氨酸、天冬氨酸为标准品(纯度>99%),北京索莱宝科技有限公司;乙腈、甲醇为色谱纯,美国Sigma公司。
1.1.2 主要仪器设备
CHI660E电化学工作站,北京壮仕科技有限公司;LC-20AT高效液相色谱仪,日本岛津仪器公司;Allegra 64R冷冻离心机,美国Beckman公司;AL104电子天平,瑞士Mettler Toledo公司;铂盘电极、铂丝电极、232型饱和甘汞电极,上海楚兮实业有限公司。
1.2 实验方法
1.2.1 液相色谱检测
标准工作溶液的配置:准确称取谷氨酸、天冬氨酸各10.00 mg,用去离子水定容至10 mL的容量瓶中,超声至完全溶解,得(1+1)mg/mL的谷氨酸-天冬氨酸混合标准溶液,4 ℃保存。用去离子水稀释成质量浓度为12.5、25、50、100、150、200、250 μg/mL的混合标准系列梯度溶液。
老汤样品前处理方法:扒鸡老汤(除去浮于表层的油脂)→过滤(除去香辛料碎渣、肉末等大块固形物)→离心→取2 mL上清液→定容至10 mL。
衍生:参照芮鸿飞等[21]的方法并稍作修改。取500 μL上述稀释后的老汤样品,置于4 mL的塑料试管中,再分别加入异硫氰酸苯酯-乙腈溶液、三乙胺-乙腈溶液各250 μL,将其充分混匀后在室温下放置30 min,加入50 μL的乙酸溶液充分混匀,随后向衍生完毕的溶液中加入1 mL的正己烷溶液,用漩涡振荡仪振荡60 s,萃取掉剩余的衍生试剂后,静置10 min分层,弃去上层正己烷溶液,用5 mL的注射器吸取出下层清液,经0.45 μm的有机滤膜过滤打入2 mL的液相色谱顶空瓶内,用于液相色谱仪的检测。
色谱条件:色谱柱Agilent ZORBAX SB-C18(250 mm×4.6 mm,5 μm); 柱温40 ℃; 检测波长254 nm;流速1 mL/min; 流动相A为乙酸钠溶液,流动相B为80%乙腈溶液;流动相洗脱程序:0 min,A 92%;B 8%;2 min,A 92%;B 8%;10 min,A 90%;B 10%。
1.2.2 电极预处理
电极预处理参考朱灵涛[20]的方法。铂盘电极预处理时,首先用5 000目砂纸打磨电极,直至表面光滑,用去离子水清洗干净表面,自然晾干,随后在抛光绒布上依次用300、50和10 nm的Al2O3抛光粉对铂盘表面进行抛光,抛光结束后,将铂盘电极浸泡于Piranha溶液中[V(浓H2SO4)∶V(30% H2O2)=3∶1],超声清洗5 min,随后放入去离子水中再超声清洗5 min,电极清洗完毕后,自然晾干,避光无尘保存备用。饱和甘汞电极无需过多的预处理,但新购买的饱和甘汞电极在试验前需要先确定电极内是否充满饱和KCl溶液,并有少许饱和KCl晶体存在,否则需要重新选择饱和甘汞电极。铂丝电极在试验前的预处理流程与铂盘电极类似,需要事先将铂丝电极分别浸泡于Piranha溶液及去离子水中超声清洗5 min后备用,目的是除去铂丝表面的杂质。由铂盘电极、铂丝电极和饱和甘汞电极构建三电极体系,并进行后续的电化学试验。
1.2.3 膜修饰传感器的制备
参照朱灵涛[20]的方法并稍作修改,含有鲜味氨基酸敏感物质的膜溶液组成为:四氢呋喃5 mL,邻苯二甲酸二辛酯0.50 mL,聚氯乙烯0.08 g,DPTU 0.095 g。采用直接滴涂法,用移液枪准确吸取10 μL膜溶液滴涂于铂盘电极表面,自然晾干后备用。
1.2.4 标准溶液的配制
准确称取谷氨酸、天冬氨酸各14.70、13.30 mg,用去离子水分别定容至100 mL,超声至完全溶解,得到1 mmol/L的谷氨酸和天冬氨酸标准溶液,4 ℃保存。
1.2.5 电化学传感器检测流程
扒鸡老汤(除去浮于表层的油脂)→过滤(除去香辛料碎渣、肉末等大块固形物)→取20 mL,离心→取5 mL上清液→定容至100 mL→搅拌(磁力搅拌,1 h)→电化学检测
本试验采用开路电位法进行电化学检测,参数设置为稳定时间:60 s;检测时间:60 s;检测间隔:0.1 s;高电位:+1.0 V,低电位:-1.0 V。
1.2.6 离心力对传感器检测结果的影响
离心力分别定为8 000、10 000、11 000、12 000、13 000、14 000、16 000×g,每组老汤样品设置3个平行。其他试验参数分别为离心时间20 min;稀释倍数为20;搅拌时间1 h;分析样本20 mL。
1.2.7 离心时间对传感器检测结果的影响
本试验中离心时间分别为10、15、20、25、30 min,每组老汤样品设置3个平行试验。其他试验参数分别为离心力13 000×g;稀释倍数为20;搅拌时间1 h;分析样本20 mL。
1.2.8 样品稀释倍数对传感器检测结果的影响
用去离子水对老汤分别进行10、15、20、25、30倍稀释后检测,其他试验参数分别为离心时间20 min;离心力13 000×g;搅拌时间1 h;分析样本20 mL,试验中结果的对比数据为检测相对应的同一条件下处理的样品。
1.3 数据处理
本试验采用SPSS 19.0 软件中的单因素方差分析(One-Way ANOVA)法对试验结果进行处理,显著性水平为 0.05,每个试验指标至少重复测定3次,传感器检测试验结果采用测定数据与液相色谱检测结果之间比较其偏差程度(%)。作图采用Origin 2017软件。
2 结果与分析
2.1 采用液相色谱仪检测鲜味氨基酸时标准溶液的线性关系
将7个不同质量浓度梯度 (12.5、25、50、100、150、200、250 μg/mL) 的混合氨基酸标准溶液分别进行检测,用各个氨基酸液相分析对应的峰面积对其相应的质量浓度 (单位μg/L) 进行回归分析(图1)。

a-谷氨酸;b-天冬氨酸
图1 液相色谱检测谷氨酸、天冬氨酸的浓度-峰面积
线性回归图
Fig.1 Linear regression plot of concentration-peak area for
glutamic acid and aspartic acid detected by liquid
chromatography
结果表明,天冬氨酸和谷氨酸均在12.5~250 μg/mL的浓度范围内具有较好的线性关系,其浓度与峰面积的线性关系分别为Y1=37 914X1-371 973、Y2=11 126X2-138 346,相关系数R2分别为0.994 0、0.993 7。
2.2 液相色谱仪对扒鸡老汤鲜味氨基酸的检测结果
2种鲜味氨基酸(谷氨酸和天冬氨酸)的高效液相色谱检测结果显示:老汤中鲜味氨基酸总含量为699.48 μg/mL(5.12 mmol/L),含量的RSD在5.0%以内,表明该方法重复性良好,所建立的分析方法稳定,可用于后续的试验。王南[22]采用氨基酸分析仪对老汤中的鲜味氨基酸进行检测,含量为70.30 mg/100 g(约为4.72 mmol/L),检测结果波动变化,但差异较小,差异的原因一方面取决于其原料肉中氨基酸形成和降解的比率,另一方面也取决于浓度差的作用,导致肉汤间的相互渗透存在差异[23]。
2.3 传感器响应信号分析
采用开路电位法对传感器的响应信号进行分析,传感器在氨基酸标准品溶液(以10-3 mol/L的谷氨酸标准品为例)和老汤稀释液(以老汤稀释1∶10倍为例)中的响应信号图如图2所示。

a-氨基酸标准品溶液;b-老汤稀释液
图2 DPTU膜修饰传感器的响应信号图
Fig.2 Response signal of DPTU film modified sensors
0~10 s内DPTU膜修饰传感器的响应信号急剧变化,电化学信号不稳定,易受外界条件影响而产生波动;10.1~60 s内电化学信号强度已趋于稳定,60.1~120 s电化学信号基本无变化。因此,为了避免仪器、环境以及人为操作等的干扰,以及提高试验效率,本试验缩短检测时间为60 s,并提取10.1~60 s的平均值作为一次电化学传感器检测信号值,单位为V进行数据分析。
2.4 传感器检测标准曲线线性范围的确定及线性拟合
如图3所示,谷氨酸和天冬氨酸均可配置成浓度较低的溶液,通过对-7.5~-3 lg(mol/L)的10个浓度梯度的鲜味氨基酸标准品进行传感器检测,确定鲜味氨基酸在-6~-3 lg(mol/L)的范围内线性良好。在10-6~10-3 mol/L浓度范围内对鲜味氨基酸的浓度梯度与电化学检测电信号的关系进行曲线拟合,拟合后的函数关系如公式(1)所示:
Ocp混合=0.049 81 lg c+0.271 6
(1)
式中:Ocp,开路电位法电位值,V;lgc,鲜味氨基酸浓度对数,mol/L。
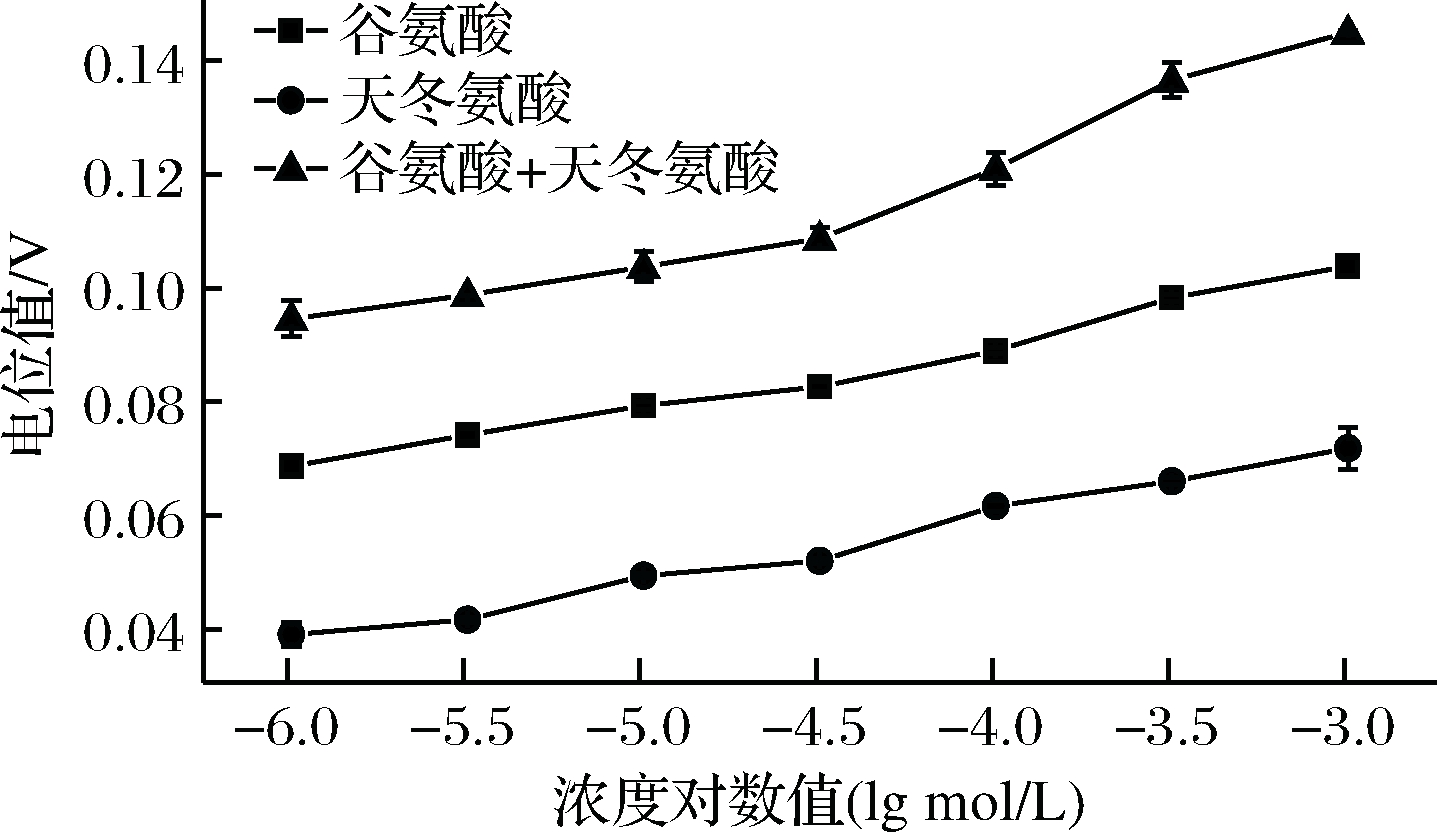
图3 膜修饰传感器在不同浓度鲜味氨基酸溶液的
电位值变化关系图
Fig.3 Variation of potential value of film modified sensors at
different concentrations of umami amino acid solution
2.5 离心力对传感器检测扒鸡老汤中鲜味氨基酸浓度的影响
图4显示,离心力在8 000~12 000×g,鲜味氨基酸的传感器检测值呈缓慢增加的趋势,继续增加离心力,传感器检测结果基本保持不变,原因可能是膜修饰铂盘电极的电催化氧化过程存在干扰物的毒化特性[24-25]。当离心力过小时,老汤样品中残留的干扰物质无法去除,造成电极的毒化,从而对试验结果产生干扰;随着离心力的增加,脂肪以及小分子蛋白质等干扰物质逐渐被离心沉淀,毒化作用减弱,从而使鲜味氨基酸的检测值与实际值接近。与液相色谱仪检测结果相比,当离心力为8 000、10 000、11 000、12 000、13 000、14 000、16 000×g时,传感器检测结果的偏离程度分别为11.79%、8.01%、7.42%、5.27%、3.13%、7.2%和6.25%。当离心力为13 000×g时,传感器检测结果的偏离程度最低,与液相色谱仪检测结果最接近,因此选择13 000×g为最佳离心力条件。

图4 不同离心力条件下DPTU膜修饰传感器检
测鲜味氨基酸浓度
Fig.4 DPTU film modified sensors for detecting umami amino
acid content under different centrifugation force
注:不同小写字母表示差异显著(下同)
2.6 离心时间对传感器检测扒鸡老汤中鲜味氨基酸浓度的影响
从图5可知,离心时间在10~15 min,鲜味氨基酸的传感器检测值呈缓慢增加的趋势,继续增加离心时间,传感器检测结果基本保持不变。原因可能是当离心时间过短时,老汤样品中的小分子蛋白质等可能与鲜味氨基酸紧密结合,从而对DPTU吸附鲜味氨基酸的反应形成竞争,导致鲜味氨基酸无法完全与DPTU结合,随着离心时间的增加,干扰成分已基本去除,从而使鲜味氨基酸的检测值与实际值相近;另一个原因可能是溶液中的鲜味氨基酸未完全解离,未解离形式的氨基酸由于不能将与DPTU结合的作用位点暴露[26],从而导致传感器信号的偏移。离心时间在10~30 min时,传感器测定数据与液相色谱检测结果之间的偏差程度分别为14.65%、6.64%、2.75%、5.86%和8.98%,在20 min时,传感器检测结果的偏离程度最低,与液相色谱仪检测结果最接近,因此选择20 min为离心时间。
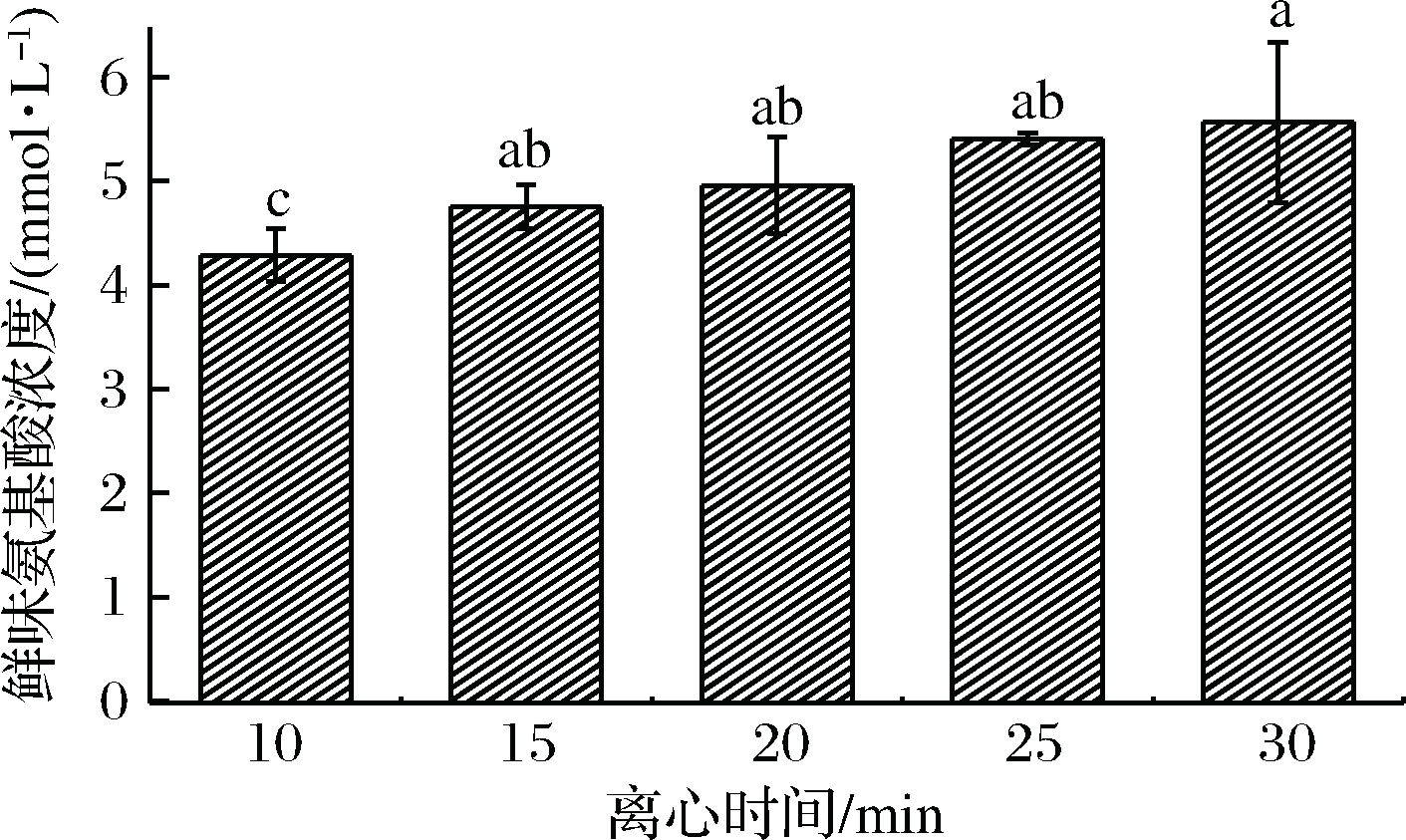
图5 不同离心时间条件下DPTU膜修饰传感器
检测鲜味氨基酸浓度
Fig.5 DPTU film modified sensors for detecting umami amino
acid content under different centrifugation time
2.7 老汤稀释倍数对传感器检测扒鸡老汤中鲜味氨基酸浓度的影响
溶于老汤体系中的鲜味氨基酸在溶液中发生解离,暴露出与鲜味敏感物质DPTU结合的作用位点[20]。在一定的检测范围内,浸出液中呈味物质浓度[27]和离子活度的差异[28-29]会直接影响传感器的响应信号。由图6可知,稀释倍数为10~20倍时,检测结果的差异不显著(P>0.05),随着稀释倍数的增加差异显著增加(P<0.05),不同稀释倍数条件下检测结果的偏离程度分别为7.29%、3.78%、3.03%、12.19%和19.96%。原因可能是不同稀释倍数条件下鲜味氨基酸的离子活度存在差异,稀释倍数越高,检测结果的偏离程度越高,稀释倍数越低,检测结果越接近液相色谱检测结果。随着老汤逐渐稀释,老汤中浓度较高的更多的干扰物质逐渐被稀释,达到传感器检测的浓度范围,引起电化学信号的偏移,从而使鲜味氨基酸含量的检测结果发生偏移。杨昌伟等[30]选用Roche E601电化学发光法研究了2、4、8、16、32不同稀释倍数对β-HCG检测结果的影响,结果发现,稀释倍数越高,检测的准确率越低,而一次性检出率越高,说明随着稀释倍数的增加,产生的误差增大,准确率越低。当稀释倍数为20倍时,传感器检测结果的偏离程度最低,结果最准确,因此试验确定最佳稀释倍数为20倍。

图6 不同老汤稀释倍数条件下DPTU膜修饰传感器
检测鲜味氨基酸浓度
Fig.6 DPTU film modified sensors for detecting umami amino
acid content under different dilution ratio of brine
3 结论
本研究探讨了N,N′-二苯基硫脲膜修饰传感器检测扒鸡煮制老汤的最佳样品前处理方式,当离心力为13 000×g、离心时间为20 min及老汤稀释倍数为20倍时,N,N′-二苯基硫脲膜修饰的传感器检测鲜味氨基酸含量的结果最为准确。利用N,N′-二苯基硫脲膜修饰的传感器检测酱卤老汤中鲜味氨基酸含量的方法是可行的,且比常规检测方法更为简便易行、快速、节约成本,可以用于生产实际。
[1] 马菲,郇延军,刁欣悦. 酱制时间对传统酱卤猪肉制品风味及质构变化规律的影响[J]. 食品与机械,2019,35(9): 55-63.
[2] 熊国远,夏陆阳,贾敬敏,等. 符离集烧鸡加工过程中的营养和理化品质变化[J]. 食品工业科技,2020,41(6): 47-52.
[3] 史华利,聂文,朱星海,等. 传统酱卤牛肉老汤成分分析研究[J]. 肉类工业,2018(1): 19-24.
[4] 李素,周慧敏,张顺亮,等. 不同加水量腌制酱牛肉中挥发性风味物质变化[J]. 食品科学,2019,40(10): 199-205.
[5] 李柯呈,徐宝才,姚忠,等. 干腌盐量对南京盐水鸭特征风味成分的影响[J]. 食品与发酵工业,2019,45(17): 98-104.
[6] 钱烨,张雅玮,王震,等. 气相色谱-质谱法测定酱猪蹄和酱猪肘中5种胆固醇氧化物[J]. 色谱,2019,37(5): 539-546.
[7] 刘登勇,董丽,刘欢,等. 红烧肉感官描述属性与各分指标测定值之间的相关性分析[J]. 食品与发酵工业,2017,43(3): 199-204.
[8] 刘登勇,王南,张庆永,等. 德州扒鸡加工过程中基本营养指标变化规律研究[J]. 食品工业科技,2016,37(12): 122-126.
[9] 盖圣美,顾明月,崔晓莹,等. 循环补盐对德州扒鸡盐分变化规律的影响[J]. 肉类研究,2019,33(6): 19-24.
[10] 李学鹏,谢晓霞,朱文慧,等. 食品中鲜味物质及鲜味肽的研究进展[J]. 食品工业科技,2018,39(22): 319-327.
[11] 冯珍泉,郝武斌,袁军,等. 鲜味物质对鸡汤鲜味及风味的影响[J]. 中国食品添加剂,2016,17(10): 97-101.
[12] YUASA M,KOE M,MAEDA A,et al. Characterization of flavor component in Japanese instant soup stocks ‘dashi’[J]. International Journal of Gastronomy and Food Science,2017,9: 55-61.
[13] KONG Yan,YANG Xiao,DING Qi,et al. Comparison of non-volatile umami components in chicken soup and chicken enzymatic hydrolysate[J]. Food Research International,2017,102: 559-566.
[14] KIM Y,KIM E Y,SON H J,et al. Identification of a key,umami-active fraction in modernized Korean soy sauce and the impact thereof on bitter-masking[J]. Food Chemistry,2017,233: 256-262.
[15] RANA M K,HASSAN A S,ZAKARIA M,et al. Determination of amino acids content in tea species using liquid chromatography via pre-column fluorescence derivatization[J]. Microchemical Journal,2019,150: 81-91.
[16] HONG A D,MINH T V,THANH D N,et al. Determination of 10-hydroxy-2-decenoic acid and free amino acids in royal jelly supplements with purpose-made capillary electrophoresis coupled with contactless conductivity detection[J]. Journal of Food Composition and Analysis,2020,87: 605-612.
[17] MOHANA K R M,RATNASEKHAR C,RAJEEV J,et al. Rapid and simultaneous determination of twenty amino acids in complex biological and food samples by solid-phase microextraction and gas chromatography-mass spectrometry with the aid of experimental design after ethyl chloroformate derivatization[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences,2013: 907: 56-64.
[18] FEI Qiqi,ZHANG Nana,SUN Chong,et al. A novel non-enzymatic sensing platform for determination of 5′-guanosine monophosphate in meat[J]. Food Chemistry,2019,286(15): 515-521.
[19] NASHMIL K,PEGAH H,ABBAS A,et al. The principles of bipolar electrochemistry and its electroanalysis applications[J].Current Opinion in Electrochemistry,2019,17: 30-37.
[20] 朱灵涛. 基于膜修饰传感器的牛肉滋味品质评价及呈鲜味氨基酸检测方法[D]. 长春:吉林大学,2019.
[21] 芮鸿飞,张晓瑜,刘兴泉,等. PITC柱前衍生-反相高效液相色谱法测定黄酒中游离氨基酸和生物胺[J]. 食品科学,2016,37(8): 159-163.
[22] 王南. 扒鸡加工过程中品质指标变化规律[D]. 锦州:渤海大学,2016.
[23] 麦润萍. 盐焗鸡卤制过程中卤汤成分的变化与控制研究[D]. 广州:华南理工大学,2018.
[24] 连小兵,陈怡婷,许妙琼,等. Pt电极表面有机小分子毒化中间体CO覆盖度的有效调控[J]. 中国科学:化学,2017,47(5): 647-654.
[25] VENKAT R R P,GARY J,MA W,et al. Fischer-Tropsch synthesis:Effect of carbonyl sulfide poison over a Pt promoted Co/alumina catalyst[J]. Catalysis Today,2018,299(1): 14-19.
[26] 李伍林,姚刚. 氨基酸在溶液中电离及存在形式探讨[J]. 咸宁学院学报,2004(3): 109-111.
[27] 田晓静,王俊,崔绍庆. 羊肉纯度电子舌快速检测方法[J]. 农业工程学报,2013,29(20): 255-262.
[28] QIN Ouyang,YANG Yongcun,WU Jizhong,et al. Measurement of total free amino acids content in black tea using electronic tongue technology coupled with chemometrics[J]. LWT,2020,118: 5 008-5 014.
[29] YOUSSEF E,PEDRO M C I,BADIAA L,et al. Insight into the sensing mechanism of an impedance based electronic tongue for honey botanic origin discrimination[J]. Sensors & Actuators: B. Chemical,2019,285: 24-33.
[30] 杨昌伟,郑家深,李雪,等. 不同稀释液及稀释倍数对β-HCG测定结果准确性的影响[J]. 实验与检验医学,2016,34(3): 347-348;357.