柑橘是芸香科(Rutaceae)柑橘亚科(Auramtioideae)柑橘族(Citreae)柑橘亚族(Citrinae)类植物的统称,主要包括甜橙类、宽皮柑橘类、葡萄柚和柚类、柠檬类、杂柑类和金柑类等。我国是柑橘的主要产地之一,2016年柑橘年产量达到3 839万t[1]。但我国柑橘主要以鲜食为主,柑橘皮渣大部分直接丢弃,不仅浪费资源,而且污染环境。大量研究表明,柑橘果皮中的酚酸含量远远高于柑橘果肉,在半成熟期的果皮中酚酸含量最高[2],而且酚酸类化合物不能由人和动物自身合成,必须通过食物获得[3]。研究发现酚酸类化合物具有抗氧化、抗炎、抑菌、抗糖尿病、抗癌等多种生物活性,因此酚酸类化合物可以应用于传统药物或作为膳食补充剂应用于现代营养制品中。
本文就柑橘中酚酸类化合物的组成、结构、合成途径、生物活性及作用机理,及其在体内的吸收代谢情况进行综述,以期为柑橘在营养、医药和保健方面的研究开发提供一定的理论基础,为柑橘综合利用提供科学参考。
1 柑橘中酚酸类化合物的组成
酚酸类化合物泛指同一苯环上有若干个羟基的一类化合物,相应碳骨架类型主要有 2 种:(1)C6-C1型即苯甲酸型,如对羟基苯甲酸、没食子酸、原儿茶酸;(2)C6-C3型即肉桂酸型,如咖啡酸、阿魏酸、对香豆酸、芥子酸等[4-5],详见图1。也有极少数不属于这2大类衍生物,如绿原酸是咖啡酸和奎宁酸的酯化物(图2)。研究发现柑橘中的酚酸类化合物主要为肉桂酸型,少数为苯甲酸型,其以酰胺、酯或糖苷的结合形式存在,很少以游离形式存在[6],详见表1。
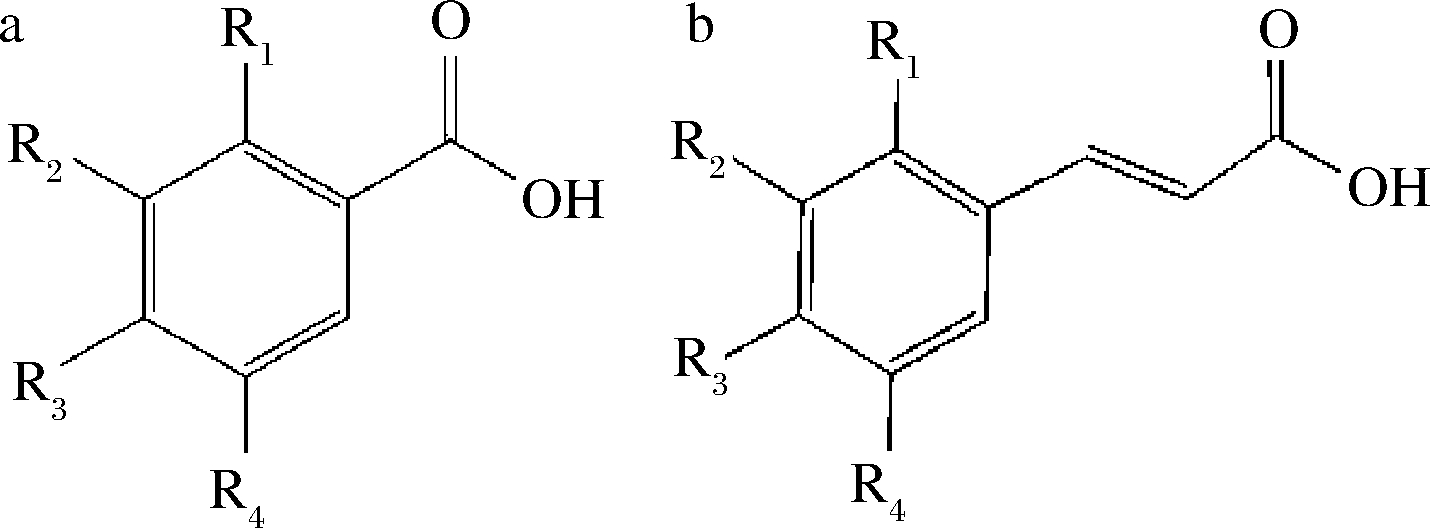
a-苯甲酸型;b-肉桂酸型
图1 酚酸类化合物骨架图
Fig.1 Skeleton diagram of phenolic compounds
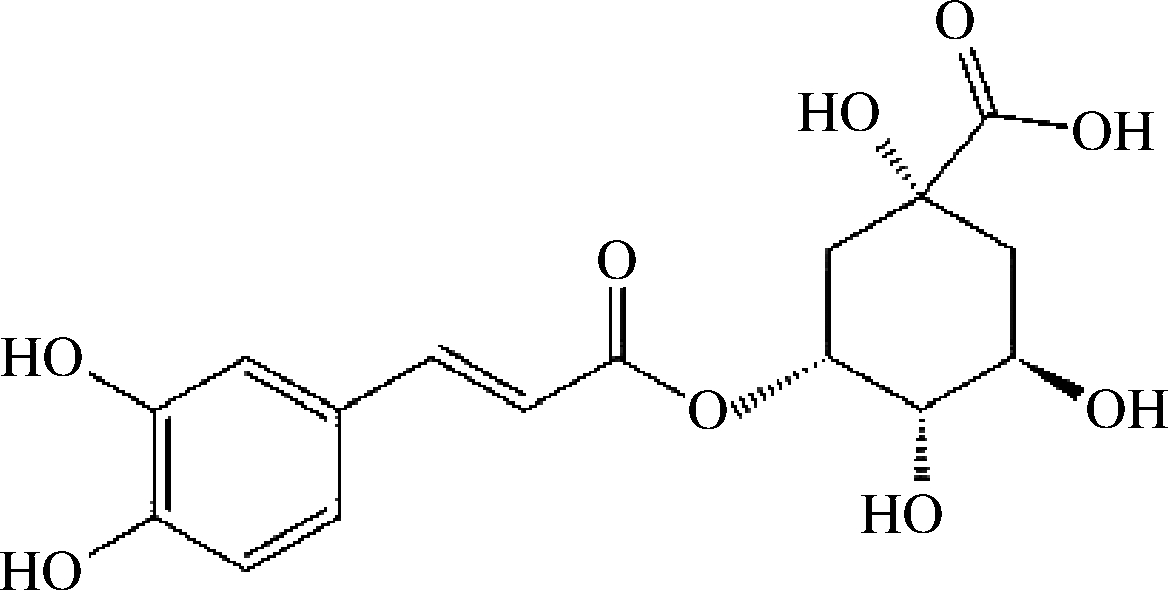
图2 绿原酸的化学结构
Fig.2 Chemical structure of chlorogenic acid
表1 柑橘中常见的酚酸类化合物
Table 1 Common phenolic compounds in citrus
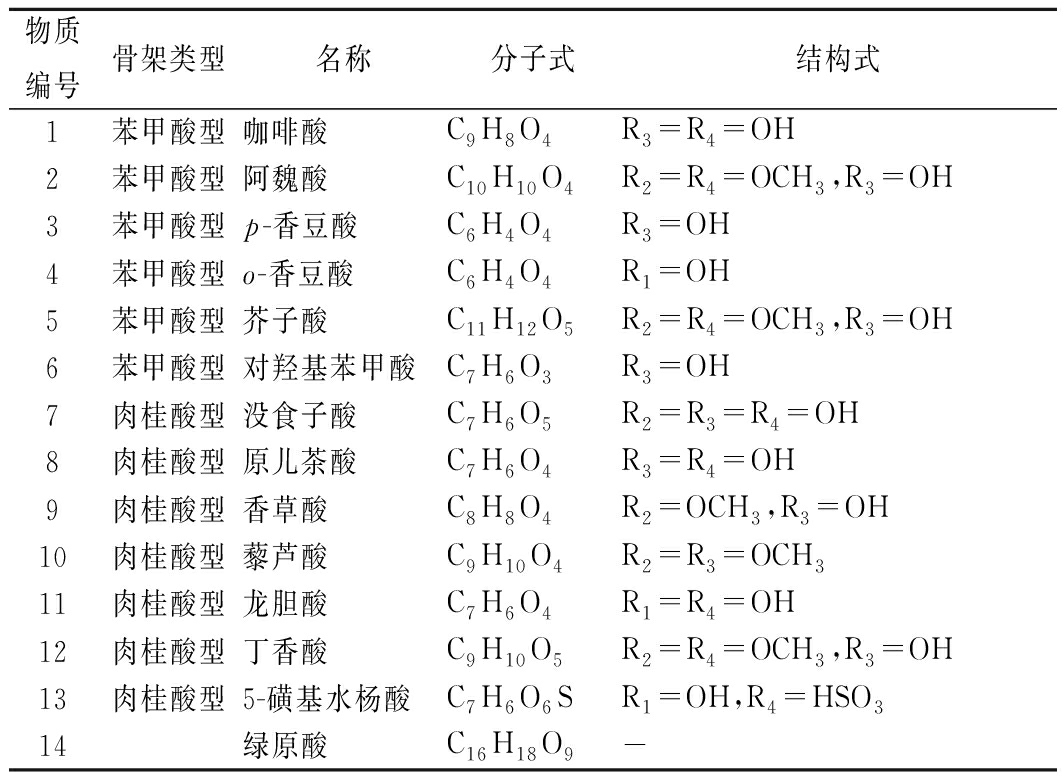
物质编号骨架类型名称分子式结构式1 苯甲酸型咖啡酸C9H8O4R3=R4=OH2苯甲酸型阿魏酸C10H10O4R2=R4=OCH3,R3=OH3苯甲酸型p-香豆酸C6H4O4R3=OH4苯甲酸型o-香豆酸C6H4O4R1=OH5苯甲酸型芥子酸C11H12O5R2=R4=OCH3,R3=OH6苯甲酸型对羟基苯甲酸C7H6O3R3=OH7肉桂酸型没食子酸C7H6O5R2=R3=R4=OH8肉桂酸型原儿茶酸C7H6O4R3=R4=OH9肉桂酸型香草酸C8H8O4R2=OCH3,R3=OH10肉桂酸型藜芦酸C9H10O4R2=R3=OCH311肉桂酸型龙胆酸C7H6O4R1=R4=OH12肉桂酸型丁香酸C9H10O5R2=R4=OCH3,R3=OH13肉桂酸型5-磺基水杨酸C7H6O6SR1=OH,R4=HSO314绿原酸C16H18O9-
2 柑橘酚酸类化合物的合成途径
酚酸类化合物的合成途径如图3所示,主要包括莽草酸途径和苯丙烷代谢途径。莽草酸途径是指由糖酵解(embden meyerhof parnas,EMP)途径生成的磷酸烯醇式丙酮酸和由磷酸戊糖途径(pentose phosphate pathway,PPP)生成的赤藓糖-4-磷酸降解为葡萄糖,在多步代谢中转化为脱氢莽草酸和莽草酸,脱氢莽草酸转变为没食子酸。而莽草酸通过分支酸、预苯酸经转氨作用形成苯丙氨酸,从而进入苯丙烷代谢途径[7]。

图3 酚酸的生物合成途径
Fig.3 Biosynthetic pathway of phenolic acid
苯丙烷代谢途径是酚酸生物合成的主要途径,主要是苯丙氨酸通过苯丙氨酸解氨酶(phenylalanineam-monia-lyase,PAL)的作用,脱去氨基,转化为反式肉桂酸。然后在肉桂酸-4-羟化酶(cinnamate 4-hydroxylase,C4H)的作用下,形成反式肉桂酸、对香豆酸、芥子酸和阿魏酸等酚酸。这些酚酸在4-香豆酸辅酶A连接酶(4-coumarate CoA-ligase,4CL)、甲基转移酶(O-methyltransferase,OMT)等酶的催化作用下,可进一步转化为咖啡酸和绿原酸等[8]。苯丙烷代谢中受到多种酶的调节,其中PAL、C4H和4CL是苯丙烷代谢中的3个关键酶。除苯丙烷代谢途径外,柑橘中还存在少量对羟基苯甲酸类酚酸合成的其他途径,如水杨酸可以通过莽草酸途径产生的分支酸在异分支酸合成酶、丙酮酸裂解酶催化下合成;对羟基肉桂酸类酚酸等可直接降解生成对羟基苯甲酸类酚酸,类似于脂肪酸的β-氧化[9]。
3 柑橘酚酸的生物活性
3.1 抗炎作用
炎症反应是指机体组织对损伤因子的防御性反应。在炎症过程中机体会释放白细胞介素-1b(IL-1b)、白细胞介素-6(IL-6)、肿瘤坏死因子(TNF-α)、一氧化氮合酶(iNOS)和环氧合酶-2(COX-2)等促炎细胞因子[10]。这些促炎因子会攻击正常细胞,导致基因突变、细胞增殖和DNA损伤,造成大面积组织炎症。因此控制促炎症因子的释放,是发挥抗炎作用的关键。相关研究发现,柑橘中酚酸类化合物通过调节激酶(蛋白激酶C和丝裂原活化蛋白激酶),使蛋白激酶作用于细胞核中的转录因子NF-κB,NF-κB可以调节炎症反应过程中的TNF-α、IL-1β、IL-2、IL-6、IL-8、IL-12、iNOS、COX-2和细胞黏附分子,从而控制炎症反应[11]。有研究表明,阿魏酸具有抗炎作用,能够明显抑制由二甲苯所导致的小鼠耳壳肿胀、醋酸引起的小鼠腹腔毛细血管通透性增高、组胺引起的大鼠皮肤毛细血管通透性升高,以及角叉菜胶、蛋清和甲酸所致的大鼠足跖肿胀[12]。同时发现在大鼠腹腔巨噬细胞中利用脂多糖诱导炎症反应,经绿原酸处理能够降低TNF-α和IL-6的蛋白质表达量,且随着绿原酸浓度的升高,抑制效果增强[13]。在HUVEC和U937单核细胞的体外实验中证实咖啡酸能诱导TNF-α抑制单核细胞化学引诱物蛋白1的表达,引发单核细胞的NF-κB易位,这也证明了咖啡酸治疗心血管疾病炎症的潜在作用[14]。
3.2 抗氧化作用
柑橘酚酸类化合物具有较强的抗氧化能力,主要是通过直接清除活性氧自由基(reactive oxygen species,ROS),直接或间接地抑制脂质过氧化,以及与变价金属离子(Cu2+、Fe2+)螯合等途径发挥抗氧化作用[15-16]。酚酸类化合物抗氧化能力的强弱与其特殊的化学空间结构及其结构状态相关。芳环上羟基中氢原子活性以及酚基自由基位阻会影响结构的稳定性,影响自由基淬火能力,从而影响酚酸的抗氧化活性,通常酚羟基氢原子活性和酚基自由基位阻越大,则抗氧化能力越强[17]。
研究发现在极性溶剂中,12 种酚酸的抗氧化活性由强到弱依次为: 没食子酸>咖啡酸>绿原酸>阿魏酸>芥子酸>原儿茶酸>p-香豆酸>2,4-二氢基苯甲酸>龙胆酸>香草酸>丁香酸>水杨酸[18]。张华[19]研究发现15种柑橘果实中的酚类物质抗氧化活性具有显著性差异,其中酚酸类物质体外抗氧化活性普遍高于黄酮类化合物,没食子酸、绿原酸、咖啡酸、阿魏酸能有效清除DPPH自由基,并加速铁离子还原反应。酚羟基数目越多,抗氧化活性越强,但酚羟基的糖基化或甲基化都会降低柑橘酚类物质的自由基清除能力。研究发现绿原酸能改善体外血管功能,保护细胞免受氧化损伤,提高NO的产生和HO-1的诱导[20],这些结果表明绿原酸可以作为细胞内抗氧化剂。KIKUZAK等[21]检测了咖啡酸、阿魏酸和没食子酸等酚类物质的体外抗氧化活性,研究表明咖啡酸体外抗氧化能力在3个酚酸中最强。
糖尿病是一种氧化应激障碍疾病,其发病机制主要为氧化应激反应。酚酸类化合物具有抗氧化能力,可以有效抑制氧化应激反应带来的代谢紊乱,达到抗糖尿病的作用。酚酸类化合物抗糖尿病机制是通过影响在糖尿病中起关键作用的葡萄糖和胰岛素受体的功能,增加胰岛β细胞中影响胰岛素产生的葡萄糖转运蛋白GLUT2的表达,并通过PI3K/Akt和AMP激活的蛋白激酶途径以促进GLUT4的转运来实现的[22-23]。研究表明阿魏酸能降低大鼠的血浆葡萄糖来抑制α-葡萄糖苷酶活性,刺激胰岛素分泌,且阿魏酸可能与降糖药发生协同作用[24]。例如,阿魏酸(40 mg/kg)与二甲双胍(12.5 mg/kg)或噻唑烷二酮(2.5 mg/kg)共同作用于STZ诱导的糖尿病大鼠3周后,血脂得到缓解[24]。更重要的是,阿魏酸与噻唑烷二酮联合用药后,副作用明显减轻。JIANG等[20]证明了绿原酸可以通过激活AMPK介导的GLUT4移位,降低空腹血糖,刺激骨骼肌中的葡萄糖转运,从而达到控制糖尿病的作用。另有研究表明给予咖啡酸或肉桂酸可缓解糖尿病小鼠症状,降低血浆中的糖化血红蛋白[25]。这是因为咖啡酸和肉桂酸通过AMPK途径影响小鼠肝细胞和骨骼肌细胞中葡萄糖的摄取,通过调节GK和HNF-4的表达,抑制肝脏中PEPCK和GSK-3的活性,降低肝脏中GLUT2和GLUT4的表达,从而改善葡萄糖代谢和糖原合成[26]。
3.3 抑菌作用
研究表明酚酸的抑菌作用受多方面的影响,如酚酸的化学结构、官能团的数量等。酚酸核心苯环中的饱和链长、位置和取代数,烷基链长对其抑菌效果影响较大,例如酚酸低聚物与其单体相比具有更高的活性。酚酸中羟基和甲氧基官能团的数量不同影响其抗菌活性,羟基肉桂酸的抗菌能力优于羟基苯甲酸,且羟基数目越多,苯甲酸型酚酸抗菌效力越弱,但对肉桂酸型酚酸影响不大。甲氧基取代氢原子后,苯甲酸型酚酸抗菌作用增强,而肉桂酸型酚酸的抑菌能力无显著性变化。此外羟基肉桂酸双键的减少显著降低了其抗菌活性。
与酚酸类化合物相比,黄烷醇需要更高的含量才能达到同样的抗菌效果。原儿茶酸(MIC: 4.09 mg GAE/mL)、对香豆酸(MIC: 1.30 mg GAE/mL)、没食子酸(MIC:2.05 mg GAE/mL)、香草酸(MIC:2.05 mg GAE/mL)、咖啡酸(MIC:2.05 mg GAE/mL)对耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)有抑制作用,但黄酮类化合物如槲皮素等并不能有效抑制MRSA[27]。绿原酸对主要致病菌有抑菌活性,尤其对金黄色葡萄球菌、产气荚膜梭菌,其最小抑菌浓度(minimal inhibit concentration,MIC)均为1.58 g/L[28]。
目前对于酚酸类化合物的抑菌机理尚未完全明确,可大致分为4个方面:(1)通过破坏细胞壁及细胞膜的屏障功能,增加膜的通透性,致使微生物胞内成分泄漏而影响细胞结构稳定性;(2)通过能量代谢系统使新陈代谢受阻,导致菌体死亡;(3)酚酸类化合物能与微生物的遗传物质结合并改变微生物生理使细胞失去生长繁殖的基础,从而抑制其生长;(4)酚酸类化合物通过细胞质的酸化作用,引起蛋白质变性,产生抗微生物活性从而达到抑菌效果[29-30]。
3.4 抗癌作用
癌症是在各种不同致癌因子的作用下使机体控制细胞生长的机制失常,机体内正常细胞发生癌变,严重危害人体健康。癌症是全球主要的健康问题之一,据世界卫生组织报告,每年死于癌症的人数大约是艾滋病、疟疾和肺结核的2倍。流行病学证据表明,若饮食中配有大量富含黄酮类化合物和酚酸类化合物的水果和蔬菜,则可以显著降低许多癌症的产生风险,这表明酚酸类化合物可以有效预防癌症的发生。迄今为止,常见的酚酸类化合物已被证实对乳腺癌、胃癌、血癌、肝癌、结肠癌等具有抗癌活性,详见表3所示。
表3 常见酚酸类化合物发挥抗癌作用的细胞类型和癌症类型
Table 3 Common cancer types and cells with anti-cancer effects of phenolic compounds

物质编号化学名称细胞类型癌症类型参考文献1绿原酸MCF-7,Hep-G2乳腺癌,肝癌[35-36]2没食子酸AGS,HL-60,MCF-7胃癌,血癌,乳腺癌[37-38]3咖啡酸MCF-7,Hep-G2,A-549,H1299,HL-60,HT-1080乳腺癌,肝癌,肺癌,血癌[36, 39]4对香豆酸KB,HT-29,HC-116,CAL-27,LNCaP,DU145结肠癌,宫颈癌,口腔癌,前列腺癌[40]5阿魏酸MCF-7,Hep-G2,HeLa,ME-180乳腺癌,肝癌,宫颈癌[41-42]63,4-二羟基肉桂酸HL-60血癌[37]73,4,5-三羟苯基丙烯酸KB,HT-29,HCT-116,CAL-27,LBCaP,DU145血癌,结肠癌,口腔癌,前列腺癌[40]
柑橘果实中酚酸类化合物的抗癌机制,主要包括以下4个途径:(1)酚酸类物质通过抑制 VCAM-1因子、MMP-2/9因子来抵抗肿瘤转移,从而达到抗癌的作用[31];(2)调控细胞中的凋亡和抗凋亡蛋白、ROS的生成及抑制致癌基因等而起抗癌作用[32-33];(3)调节含血红素的I期酶,致癌物解毒II期酶,并阻止DNA加合物的形成来达到抗癌作用[32];(4)防止遗传毒性分子的形成并阻止诱变剂转化酶的活性[32-34]。
4 柑橘酚酸类物质的吸收代谢途径
临床药代动力学研究结果表明酚酸类化合物在人和动物体内的生物利用度较差,因此研究酚酸类化合物的代谢过程对阐明其生物活性发挥着重要作用。有研究表明,小肠是酚酸类化合物的主要吸收部位,但是有部分酚酸可经胃直接吸收[43]。酚酸在人体内的吸收机制主要包括被动扩散和主动转运两大类,单体酚酸多以被动扩散,而多酚酸则以主动转运为主[44]。NARDINI等[45]研究了白葡萄酒中酚酸类化合物的吸收,结果表明羟基肉桂酸被胃肠道吸收,并在血液中循环,主要代谢为葡萄糖醛酸和硫酸化偶联物。OLTHOF等[46]研究在结肠炎患者小肠中绿原酸和咖啡酸的吸收率,结果表明绿原酸的吸收率为(33±17)%,咖啡酸的吸收率为(95±4)%。另有研究报道,给大鼠口服绿原酸6 h后,在大鼠血浆中未检出绿原酸,但在相同条件下口服咖啡酸后获得的咖啡酸代谢物的浓度要大于绿原酸,这就证明单体酚酸比多酚酸在人体内有更高的生物利用度。
在代谢过程中,酚酸在胃肠道吸收后在特定酶控制下发生甲基化、硫酸化和葡萄糖醛酸化等反应偶联 (图4)[47]。这表明酚酸在机体内主要是以Ⅱ相代谢为主,但也存在部分酚酸先发生Ⅰ相代谢,再进行Ⅱ相结合[48]。酚酸能在肝脏和肠道中代谢转化,并产生不同的代谢产物。研究表明,阿魏酸可在体内代谢为多种代谢物,包括阿魏酸葡糖醛酸、阿魏酸硫酸盐、阿魏酸二葡糖醛酸、阿魏酸磺基葡糖醛酸、间羟基苯丙酸酸、阿魏酰甘氨酸、二氢阿魏酸、异阿魏酸、香草酸和香草酰甘氨酸。在服用阿魏酸16 h后测得大鼠血浆阿魏酸葡萄糖醛酸的含量为(0.87±0.48) μmol/L,尿液中阿魏酸硫酸盐的含量为0.1~1 μmol/kg,阿魏酸磺基葡萄糖醛酸的含量为11.5~43.4 μmol/kg[49]。这些结果表明,与葡萄糖醛酸和硫酸根基团的缀合反应是体内阿魏酸代谢的主要途径。这种化合物的结合主要发生在肝脏,但肠粘膜和肾脏也参与了部分过程。除此之外,阿魏酸还可以被结肠菌群代谢,产生氢阿魏酸、异阿魏酸、香草酸、3-羟苯基乙酸和原儿茶酸[50]。
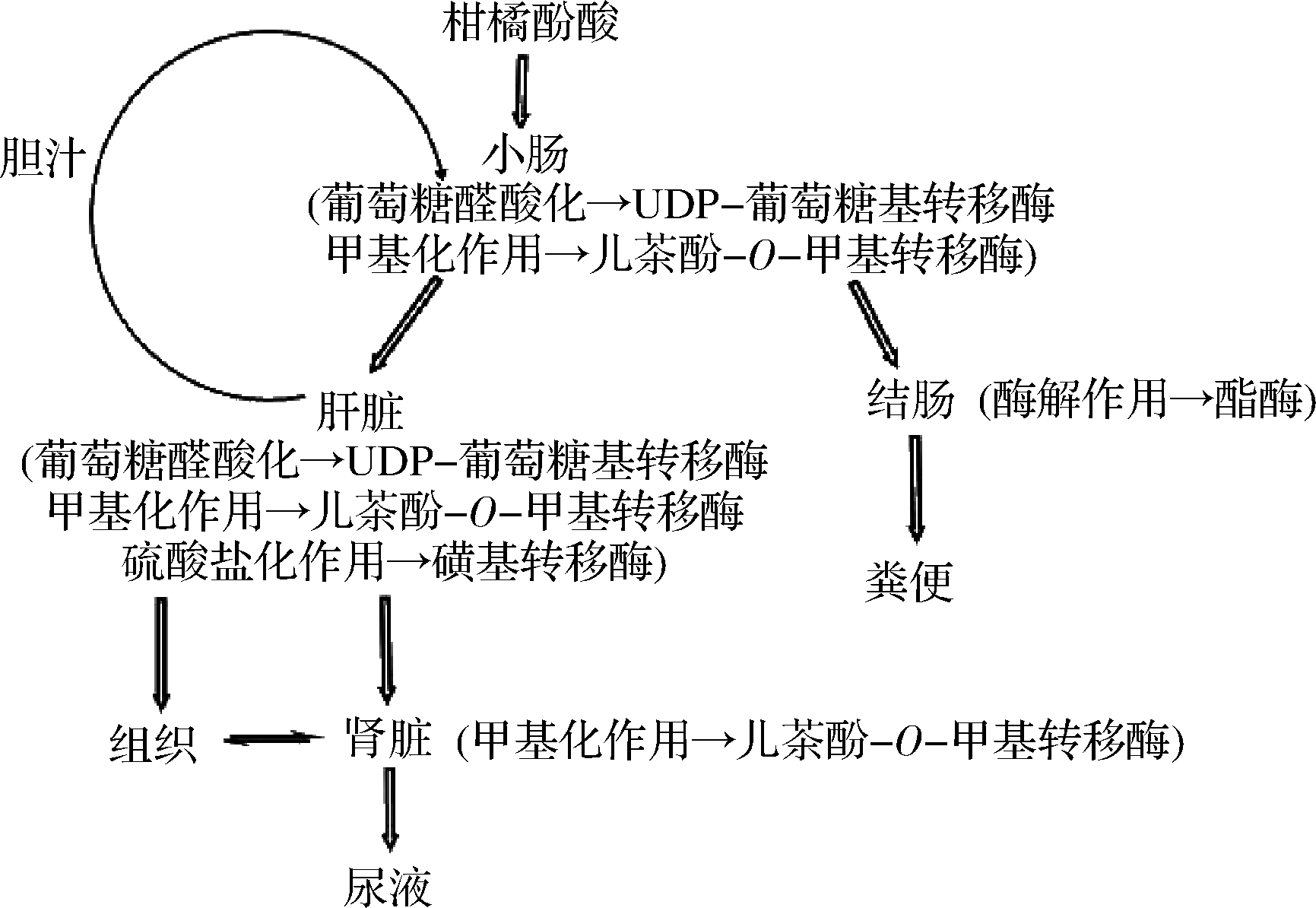
图4 酚酸的代谢途径
Fig.4 Metabolic pathway of phenolic acid
5 结语
近年来国内外研究人员对酚酸类化合物及其生物活性进行了较多研究,但对不同类酚酸类化合物的分子结构、功能基团与生物活性之间的联系方面的研究仍处于初步探索阶段,且对多种具有同种活性的酚酸类化合物之间是否存在协同作用或拮抗效应的研究较少。酚酸类化合物在人体内的吸收代谢过程尚未完全明确,柑橘酚酸类化合物生物利用度极大地限制了其在体内发挥应有的生物活性,但目前国内对提高其生物利用率的技术方法研究非常少,并且目前的技术方法都存在包埋或装载率较低的问题。因此,对于柑橘酚酸类化合物的研究,建议从提高生物可及性、吸收率和生物转化率来着手,并不断优化制备工艺以提高装载率进而实现产业化应用。
[1] 沈兆敏. 我国柑橘生产现状及未来前景展望[J]. 科学种养,2019(9): 5-10.
[2] 沈妍. 宽皮柑橘采后酚类物质与抗氧化活性变化规律的研究[D]. 杭州:浙江大学,2013.
[3] BABBAR N,OBEROI H S,SANDHU S K. Therapeutic and nutraceutical potential of bioactive compounds extracted from fruit residues[J]. Critical Reviews in Food Science and Nutrition,2015,55(3): 319-337.
[4] 林媚,平新亮,徐程楠,等. 温州蜜柑和红美人果实中类黄酮及酚酸特征研究[J]. 农产品质量与安全,2018(6): 43-48.
[5] KUMAR N,GOEL N. Phenolic acids: Natural versatile molecules with promising therapeutic applications[J]. Biotechnology Reports,2019,24: e370.
[6] 张元梅. 中国野生宽皮柑橘酚类物质的检测及其抗氧化活性研究[D]. 重庆:西南大学,2013.
[7] 李菊,李玉梅,苟亚妮,等. 酚酸类物质代谢及其化感效应研究进展[J]. 黑龙江农业科学,2019(8): 175-182.
[8] 马燕,魏媛,王冕,等. 谷物酚酸合成途径及代谢调控研究进展[J]. 食品科学,2019,40(15): 269-276.
[9] 高媛,马帅,代敏,等. 果蔬酚酸生物合成及代谢调控研究进展[J]. 食品科学,2018,39(9): 286-293.
[10] TASNEEM S,LIU B,LI B,et al. Molecular pharmacology of inflammation: Medicinal plants as anti-inflammatory agents[J]. Pharmacological Research,2019,139: 126-140.
[11] LV X,ZHAO S,NING Z,et al. Citrus fruits as a treasure trove of active natural metabolites that potentially provide benefits for human health[J]. Chemistry Central Journal,2015,9(1):e68.
[12] 胡慧娟,杭秉茜,王朋书. 阿魏酸的抗炎作用[J]. 中国药科大学学报,1990(5): 279-282.
[13] 丘岳. 广西山银花提取物绿原酸抗炎作用及其分子机制研究[D]. 南宁:广西医科大学,2009.
[14] MOON M K,LEE Y J,KIM J S,et al. Effect of caffeic acid on tumor necrosis factor-alpha-induced vascular inflammation in human umbilical vein endothelial cells[J]. Blological & Pharmaceutical Bulletin,2009,32(8): 1 371-1 377.
[15] 左龙亚. 柑橘亚属植物果皮多酚类物质提取及其抗氧化、抑菌活性检测[D]. 重庆:西南大学,2018.
[16] 吕泽芳. 重庆主栽锦橙品种果实酚类物质含量及抗氧化与抑菌作用研究[D]. 重庆:西南大学,2017.
[17] ZOU Z,XI W,HU Y,et al. Antioxidant activity of Citrus fruits[J]. Food Chemistry,2016,196: 885-896.
[18] 陈莹. 桑葚酒的发酵工艺及酚酸抗氧化研究[D]. 西安:西北大学,2011.
[19] 张华. 柑橘果实快速高效在线抗氧化活性评价方法的建立及其应用研究[D]. 重庆:西南大学,2014.
[20] JIANG R,HODGSON J M,MAS E,et al. Chlorogenic acid improves ex vivo vessel function and protects endothelial cells against HOCl-induced oxidative damage,via increased production of nitric oxide and induction of Hmox-1[J]. Journal of Nutritional Biochemistry,2016,27: 53-60.
[21] KIKUZAKI H,HISAMOTO M,HIROSE K,et al. Antioxidant properties of ferulic acid and its related compounds[J]. Journal of Agricultural and Food Chemistry,2002,50(7): 2 161-2 168.
[22] CHUKWUMA C I,MATSABISA M G,IBRAHIM M A,et al. Medicinal plants with concomitant anti-diabetic and anti-hypertensive effects as potential sources of dual acting therapies against diabetes and hypertension: A review[J]. Journal of Ethnopharmacology,2019,235: 329-360.
[23] SALEEM F,SARKAR D,ANKOLEKAR C,et al. Phenolic bioactives and associated antioxidant and anti-hyperglycemic functions of select species of Apiaceae family targeting for type 2 diabetes relevant nutraceuticals[J]. Industrial Crops and Products,2017,107: 518-525.
[24] PRABHAKAR P K,PRASAD R,ALI S,et al. Synergistic interaction of ferulic acid with commercial hypoglycemic drugs in streptozotocin induced diabetic rats[J]. Phytomedicine,2013,20(6): 488-494.
[25] CHAO P,HSU C,YIN M. Anti-inflammatory and anti-coagulatory activities of caffeic acid and ellagic acid in cardiac tissue of diabetic mice[J]. Nutrition & Metabolism,2009,6(33):33.
[26] HUANG D,SHEN S,WU J S. Effects of caffeic acid and cinnamic acid on glucose uptake in insulin-resistant mouse hepatocytes[J]. Journal of Agricultural and Food Chemistry,2009,57(17): 7 687-7 692.
[27] SALAHEEN S,PENG M,JOO J,et al. Eradication and sensitization of methicillin resistant Staphylococcus aureus to methicillin with bioactive extracts of berry pomace[J]. Frontiers in Microbiology,2017,8(253).DOI:10.3389/fmicb.2017.00253
[28] 王宏军,吴国娟,李焕荣,等. 金银花中绿原酸提取方法的筛选及其抑菌作用[J]. 北京农学院学报,2003,18(4): 262-265.
[29] LIMA M C,PAIVA DE SOUSA C,FERNANDEZ-PRADA C,et al. A review of the current evidence of fruit phenolic compounds as potential antimicrobials against pathogenic bacteria[J]. Microbial Pathogenesis,2019,130: 259-270.
[30] 周志娥,罗秋水,熊建华,等. 绿原酸、异绿原酸A对大肠杆菌的抑菌机制[J]. 食品科技,2014,35(3): 228-232.
[31] ROLEIRA F M F,TAVARES-DA-SILVA E J,VARELA C L,et al. Plant derived and dietary phenolic antioxidants: Anticancer properties[J]. Food Chemistry,2015,183: 235-258.
[32] SALEHI B,VLAISAVLJEVIC S,ADETUNJI C O,et al. Plants of the genus vitis: Phenolic compounds,anticancer properties and clinical relevance[J]. Trends in Food Science & Technology,2019,91: 362-379.
[33] SAMANTA S K,KANDIMALLA R,GOGOI B,et al. Phytochemical portfolio and anticancer activity of Murraya koenigii and its primary active component,mahanine[J]. Pharmacological Research,2018,129: 227-236.
[34] KUMAR SINGH S,PATRA A. Evaluation of phenolic composition,antioxidant,anti-inflammatory and anticancer activities of Polygonatum verticillatum (L.)[J]. Journal of Integrative Medicine,2018,16(4): 273-282.
[35] LIU X,ZHAO M,WU K,et al. Immunomodulatory and anticancer activities of phenolics from emblica fruit (Phyllantlius emblica L.)[J]. Food Chemistry,2012,131(2): 685-690.
[36] PRASAD N R,KARTHIKEYAN A,KARTHIKEYAN S,et al. Inhibitory effect of caffeic acid on cancer cell proliferation by oxidative mechanism in human HT-1080 fibrosarcoma cell line[J]. Molecular and Cellular Biochemistry,2011,349(1-2): 11-19.
[37] FABIANI R,ROSIGNOLI P,De BARTOLOMEO A,et al. The production of hydrogen peroxide is not a common mechanism by which olive oil phenols induce apoptosis on HL60 cells[J]. Food Chemistry,2011,125(4): 1 249-1 255.
[38] LUO W,ZHAO M,YANG B,et al. Antioxidant and antiproliferative capacities of phenolics purified from Phyllanthus emblica L. fruit[J]. Food Chemistry,2011,126(1): 277-282.
[39] LIN C L,CHEN R F,CHEN Y F,et al. Protective effect of caffeic acid on paclitaxel induced anti-proliferation and apoptosis of lung cancer cells involves NF-κB pathway[J]. International Journal of Molecular Sciences,2012,13(5): 6 236-6 245.
[40] ZHANG Y,SEERAM N P,LEE R,et al. Isolation and identification of strawberry phenolics with antioxidant and human cancer cell anti proliferative properties[J]. Journal of Agricultural and Food Chemistry,2008,56(3): 670-675.
[41] HE X,LIU R H. Phytochemicals of apple peels: isolation,structure elucidation,and their antiproliferative and antioxidant activities[J]. Journal of Agricultural and Food Chemistry,2008,56(21): 9 905-9 910.
[42] KARTHIKEYAN S,KANIMOZHI G,PRASAD N R,et al. Radiosensitizing effect of ferulic acid on human cervical carcinoma cells in vitro[J]. Toxicology in Vitro,2011,25(7): 1 366-1 375.
[43] 包伊凡,沈新春,汪芳. 咖啡酸及其主要衍生物的研究进展及开发前景[J]. 天然产物研究与开发,2018,30(10): 1 825-1 833.
[44] KISHIDA K,MATSUMOTO H. Urinary excretion rate and bioavailability of chlorogenic acid,caffeic acid,p-coumaric acid,and ferulic acid in non-fasted rats maintained under physiological conditions[J]. Heliyon,2019,5(10): e2708.
[45] NARDINI M,FORTE M,VRHOVSEK U,et al. White wine phenolics are absorbed and extensively metabolized in humans[J]. Journal of Agricultural and Food Chemistry,2009,57(7): 2 711-2 718.
[46] OLTHOF M R,HOLLMAN P,KATAN M B. Chlorogenic acid and caffeic acid are absorbed in humans[J]. Journal of Nutrition,2001,131(1): 66-71.
[47] SERRELI G,DEIANA M. In vivo formed metabolites of polyphenols and their biological efficacy[J]. Food Funct,2019,10(11): 6 999-7 021.
[48] BENTO-SILVA A,KOISTINEN V M,MENA P,et al. Factors affecting intake,metabolism and health benefits of phenolic acids: do we understand individual variability?[J]. European Journal of Nutrition,2019,59(4):1 275-1 293.
[49] ZHANG J,ZHANG G,ZHOU T. Metabolism of ferulic acid in rats[J]. Journal of Asian Natural Products Research,2005,7(1): 49-58.
[50] GAMEL T H,WRIGHT A J,TUCKER A J,et al. Absorption and metabolites of anthocyanins and phenolic acids after consumption of purple wheat crackers and bars by healthy adults[J]. Journal of Cereal Science,2019,86: 60-68.