叶黄素是一种含氧类胡萝卜素,存在于高等植物和其他光自养生物(如藻类)中[1]。由于具有抗氧化、抗炎和着色等特性,叶黄素被广泛用作食品添加剂、饲料添加剂或功能性营养品等,其市场价值约为3亿美元[2]。市售的叶黄素主要来源于万寿菊,但是以万寿菊生产叶黄素存在生长速度慢、劳动力成本高和占用大量耕地资源等问题[3]。利用微藻生产叶黄素具有生长速度快、叶黄素含量高、不占用耕地、可以全年收获等优点[3]。但其生产成本相对较高,如生产1 kg 栅藻(Scenedesmus almeriensis)藻粉的成本约为69欧元[4],导致商业化应用受限。室外开放式培养系统(如开放池和跑道池)由于生产成本较低而被广泛用于微藻基产品的商业化生产,但是这种培养系统需要使用大量的水资源,据报道,生产1 kg藻粉和1 kg叶黄素分别需要消耗0.19~0.77 t和38~154 t水[3]。由于淡水资源相对匮乏,如能采用海水培养微藻,可在一定程度上改善微藻大规模生产的经济可行性[5]。
进化育种技术常被用于选育有价值的微藻品系。在进化育种中,通过设定选择性条件进行生物的长期适应培养,以通过自然突变来改善细胞表型[6]。KATO等[7]研究发现,经过长期的高盐度适应性驯化,衣藻的耐盐株可在70 g/L盐度条件正常生长。目前,已报道生产叶黄素的藻种主要有Chlorella protothecoides、S. almeriensis、Muriellopsis sp.、Chlorococcum citriforme、Neospongiococcus gelatinosum等,这些藻株的叶黄素质量分数一般为3~7 mg/g,叶黄素产率可达1~10 mg/(L·d)[8]。本课题组前期筛选获得了1株小球藻(Chlorella sorokiniana) FZU60,其叶黄素质量分数及产率可分别高达9.57 mg/g和11.57 mg/(L·d)[9]。为提高该藻株的耐盐性,本研究对其进行了高盐度适应性驯化培养,分析了驯化过程其细胞生长及细胞组成的变化,并进一步对比了耐盐株和原始株的叶黄素生产情况,旨在为利用海水进行微藻叶黄素生产及降低生产成本提供合适的藻种来源。
1 材料与方法
1.1 材料与试剂
小球藻(Chlorella sorokiniana) FZU60,由福建省海产品废弃物综合利用工程技术研究中心保存。
三氟化硼/甲醇溶液为分析纯,CNW公司;正己烷、甲醇均为色谱纯,国药集团化学试剂有限公司;乙酸铵、37种脂肪酸甲酯混标、二十碳酸甲酯标准品均为色谱纯,Sigma-Aldrich公司;丁基羟基甲苯、甲基叔丁基醚均为色谱纯,Acros Organics公司;三乙胺为色谱纯,Fisher Chemical公司;叶黄素、紫黄素、α-胡萝卜素、β-胡萝卜素的标准品均为色谱纯,Chromadex公司;丙酮、无水乙醚、无水Na2SO4、乙醇、苯酚、H2SO4、HCl、葡萄糖、木糖以及BG11培养基[10]成分均为分析纯,国药集团化学试剂有限公司;海盐为分析纯,Sigma-Aldrich公司;PierceTM BCA蛋白定量分析试剂盒,Thermo公司。
1.2 仪器与设备
TGL-20bR高速冷冻离心机、LXJ-2B低速大容量离心机,上海安亭科学仪器厂;ST3100F pH计,OHAUS奥豪斯仪器常州有限公司;AB104N电子天平,Sartorius公司;RCT-B-S025加热磁力搅拌器,德国IKA公司;DW-HL340超低温冰箱,中科美菱低温科技有限公司;SP-756P紫外可见分光光度计,上海光谱仪器有限公司;PGX-450D智能光照培养箱,宁波海曙赛福实验仪器厂;移液枪,德国Eppendorf公司;FD-2真空冷冻干燥机,北京博医康实验仪器有限公司;Ci-S显微镜,尼康仪器(上海)有限公司;GC-2014C气相色谱仪、LC-16高效液相色谱仪,岛津仪器(苏州)有限公司。
1.3 实验方法
1.3.1 小球藻高盐度适应性驯化
从生长良好的小球藻平板中挑取藻泥,按质量浓度35~50 mg/L的初始接种量转接于40 g/L盐度的BG11培养基中,调节pH值为7.5。控制培养条件为:温度30 ℃,光照强度150 μmol/(m2·s),搅拌速率500 r/min,并以0.15 vvm的通气速率连续供应2.5%(体积分数)CO2。每隔5 d重新转接1次,待藻细胞在40 g/L盐度生长稳定后转接于50 g/L盐度的BG11培养基中,直至藻细胞在50 g/L盐度生长稳定。每隔一定时间测定藻液的生物量、pH和NaNO3质量浓度,并在显微镜下观察藻细胞形态。在每次转接前离心收集藻体,于-20 ℃保存,用于测定色素、蛋白、碳水化合物和油脂的质量分数。
1.3.2 耐盐株和原始株在30 g/L盐度下的培养表征
将原始藻株接种于不含海盐的BG11培养基中,耐盐藻株接种于50 g/L盐度的BG11培养基中,二者均培养至对数生长期后按质量浓度60~70 mg/L的初始接种量分别转接至30 g/L盐度的BG11培养基中培养,同时控制培养条件为:温度33 ℃,光照强度600 μmol/(m2·s),搅拌速度500 r/min,并以0.15 vvm的通气速率连续供应2.5%CO2。每隔一定时间测定藻液的生物量、pH和硝酸盐质量浓度。待硝酸盐消耗90%时,离心收集藻体,用于测定叶黄素质量分数。
1.3.3 藻体生物量的测定
采用分光光度计测定藻液在682 nm波长下的吸光值,根据标准曲线计算生物量质量浓度。藻株FZU60在40 g/L盐度下驯化培养1、3、6、9、12批次时其生物量质量浓度标准曲线分别为y=0.332 8x-0.001 3(R2=0.999 8)、y=0.312 8x-0.000 8(R2=0.999 9)、y=0.333 7x-0.000 6(R2=0.999 9)、y=0.330 1x-0.001 8(R2=0.999 8)、y=0.321 x-0.000 9(R2=0.999 9);在50 g/L盐度下驯化培养1、2、6、9、13批次时其生物量质量浓度标准曲线分别为y=0.359 6x-0.000 3(R2=1)、y=0.376 5x+0.000 7(R2=0.999 8)、y=0.390 6x-0.000 8(R2=0.999 9)、y=0.360 8x-0.002 6(R2=0.999 7)、y=0.370 6x-0.002 5(R2=0.999 7)。其中,y为生物量质量浓度(g/L),x为OD682 nm值。根据XIE等[11]的方法计算生物量产率和比生长速率。
1.3.4 NaNO3质量浓度的测定
由于NO3-在220 nm波长下具有最大的吸光值,根据XIE等[12]报道的紫外分光光度计法测定藻液的NaNO3质量浓度。NaNO3质量浓度(y,mg/L)与OD220 nm值(x)之间的对应关系为:y=22.63x-0.035 9(R2=0.999 8)。
1.3.5 藻体色素含量的测定
采用丙酮提取法[13-14]测定小球藻的叶绿素含量。采用CHEN等[15]报道的方法萃取小球藻的类胡萝卜素,然后采用TAYLOR等[16]报道的高效液相色谱法测定各类胡萝卜素组分。
1.3.6 蛋白质含量的测定
采用 PiercTE BCA蛋白定量分析试剂盒测定蛋白质含量。
1.3.7 氨基酸组成测定和必需氨基酸指数(essential amino acid index,EAAI)的计算
氨基酸组成的测定参照GB/T 5009.124—2016《食品中氨基酸的测定》。按公式(1)计算EAAI[17]:
(1)
式中:aan,样品中必需氨基酸质量占总蛋白质量的比例;AAn,FAO/WHO参考标准中必需氨基酸质量占总蛋白质量的比例[18]。
1.3.8 藻体碳水化合物含量的测定
采用H2SO4-苯酚法[13,19]测定小球藻FZU60细胞中的碳水化合物含量。碳水化合物含量(y,mg/L)与OD490 nm值(x)之间的对应关系为:y=83.365x-0.340 1(R2=0.999)。
1.3.9 藻体油脂含量及其组成的测定
采用直接转酯化方法[13]测定小球藻FZU60中的油脂含量及组成。
2 结果与分析
2.1 盐度适应性驯化过程中小球藻的生长情况变化
如图1所示,在40 g/L盐度下经过连续12批次的转接驯化培养,小球藻的生物量质量浓度可从1.00 g/L提高至2.31 g/L。且继续在50 g/L盐度下经过13批次的驯化培养,藻细胞的质量浓度可稳定在2.11 g/L(图2)。该结果说明在驯化过程中,藻细胞逐渐适应了高盐度环境。盐度主要以渗透胁迫、离子(盐)胁迫或改变细胞离子比率3种方式影响浮游植物[20-21]。藻细胞可通过渗透作用将Na+隔离在液泡中,以保持在高盐度下的膨胀压力,从而适应一定程度的盐度胁迫[22]。

图1 40 g/L盐度下藻株FZU60适应性驯化过程的
生物量变化曲线
Fig.1 Biomass concentration curve of strain FZU60 during
adaptive domestication under 40 g/L salinity
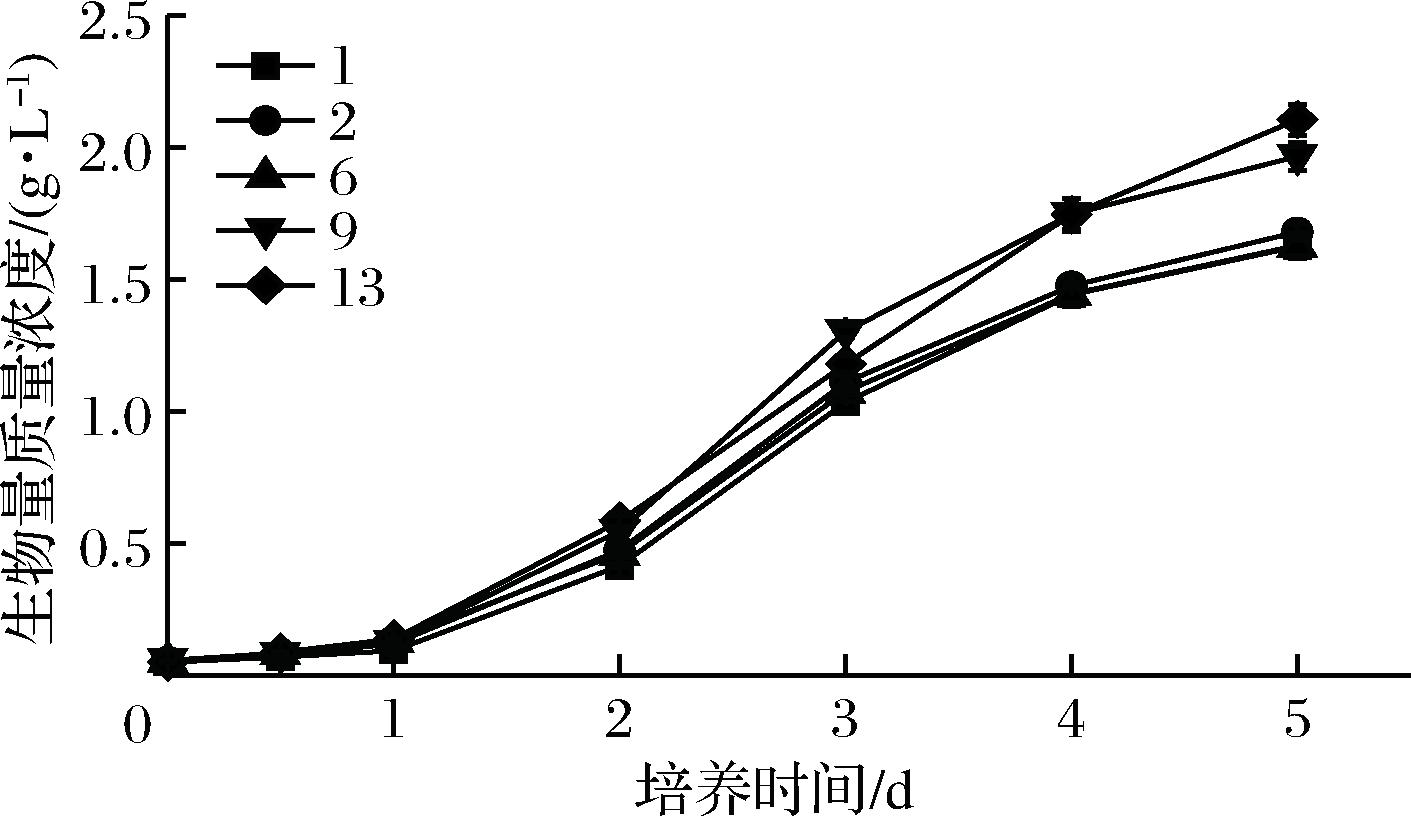
图2 50 g/L盐度下藻株FZU60适应性驯化过程的
生物量变化曲线
Fig.2 Biomass concentration curve of strain FZU60
during adaptive domestication under 50 g/L salinity
由图3可知,与原始藻株相比,耐盐株的细胞体积变大,藻体颜色加深。有研究发现,一些绿藻(如莱茵衣藻和雨生红球藻)可通过形成聚集的肥大细胞以应对外界的胁迫条件[23-24]。因此,小球藻FZU60可能通过增大细胞体积来应对外界的高盐环境。

a-原始株;b-耐盐株
图3 FZU60原始藻株与耐盐藻株的细胞形态
Fig.3 Cellular morphology of wild and salt-tolerant
strains of FZU60
2.2 盐度适应性驯化过程中小球藻FZU60的类胡萝卜素组成变化
如图4所示,经过40 g/L盐度的驯化培养,藻细胞的总类胡萝卜素质量分数从8.39 mg/g提高至12.08 mg/g;转移至50 g/L盐度条件驯化时,总类胡萝卜素质量分数则呈现先降低后升高趋势。在盐度适应性驯化前期藻细胞的总类胡萝卜素质量分数较低,这可能是由于在高盐条件下光合系统I的捕光复合物被活性氧破坏[25]。而随着驯化次数的增加,藻细胞逐渐适应高盐环境,使得总类胡萝卜素质量分数逐渐提高。小球藻FZU60的类胡萝卜素组成主要包括叶黄素、α-胡萝卜素、β-胡萝卜素、紫黄素、新黄素。在整个盐度适应性驯化过程中,叶黄素可维持在总类胡萝卜素的61%~67%(质量分数)。
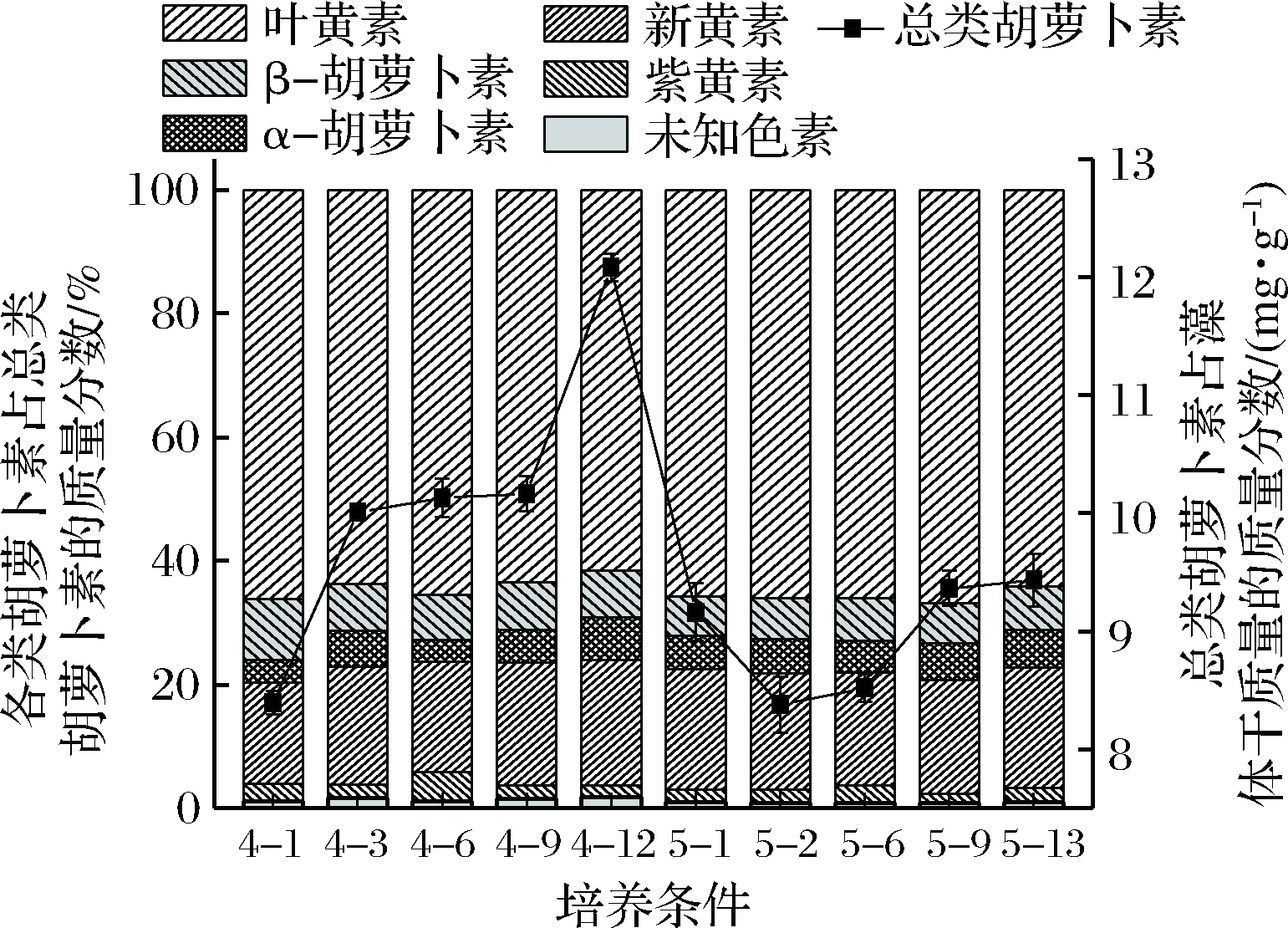
4-1、4-3、4-6、4-9、4-12表示40 g/L盐度条件下驯化1、3、
6、9、12次;5-1、5-2、5-6、5-9、5-13表示50 g/L盐度条件下
驯化1、2、6、9、13次(下同)
图4 盐度适应性驯化过程中藻株FZU60的类胡萝卜素
含量及组成变化
Fig.4 Ccarotenoid content and composition of strain FZU60
during salinity adaptive domestication
2.3 盐度适应性驯化过程中小球藻FZU60的氨基酸组成变化
如图5所示,经过40 g/L盐度的适应性驯化培养,藻细胞的必需氨基酸占总氨基酸的含量略微增加,从32.79%提高至36.54%;而转移至50 g/L盐度条件下时,其必需氨基酸占总氨基酸的含量在33.33%~34.71%波动。
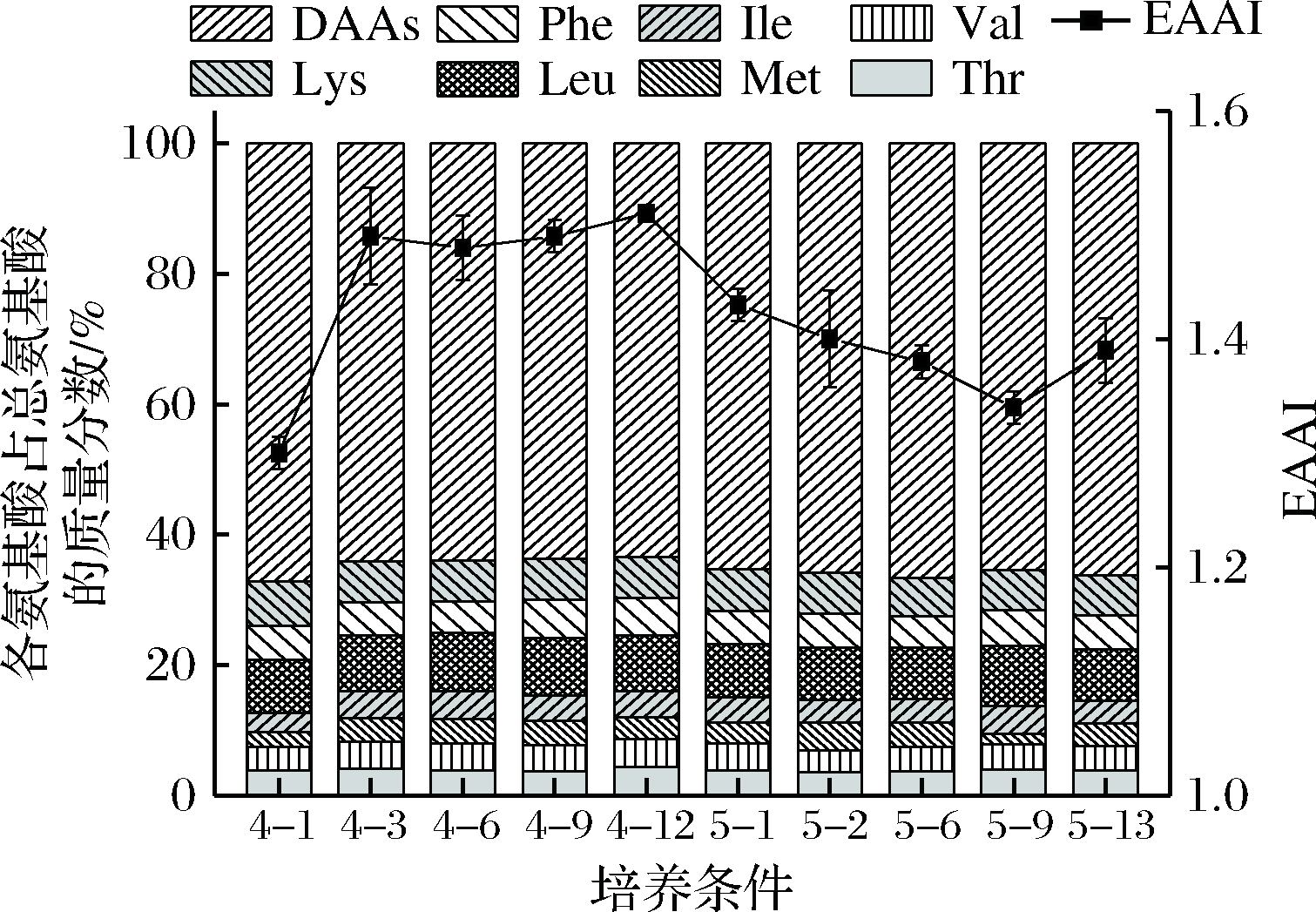
图5 盐度适应性驯化过程中藻株FZU60的氨基酸
组成和EAAI变化
Fig.5 Amino acid composition and EAAI of strain FZU60
during salinity adaptive domestication
此外,在40 g/L盐度驯化条件下,EAAI值呈现上升趋势,从1.30提高至1.51,但转移至50 g/L盐度驯化后,EAAI则呈现下降趋势,最终下降至1.34左右。这可能与驯化过程中藻细胞所需的蛋白质种类密切相关。EAAI>1表示蛋白品质优良,可用于人类食品[17,26]。因此,在盐度适应性驯化过程中小球藻FZU60的氨基酸组成可保持优良品质。
2.4 盐度适应性驯化过程中小球藻FZU60的脂肪酸组成变化
如图6所示,藻细胞中肉豆蔻酸(C14∶0)的含量较低,仅占总脂肪酸的1%~2%,而棕榈酸(C16∶0)和亚油酸(C18∶2)的含量最高,二者质量分数可占总脂肪酸的53%~58%。在盐度胁迫条件下脂肪酸含量及组成的变化可能是为了维持膜的流动性以防止细胞被破坏[27]。在盐度适应性驯化过程中,饱和脂肪酸(saturated fatty acid,SFA)比例总体呈现先下降后上升趋势,最终由39.69%提高至40.6%;单不饱和脂肪酸(monounsaturated fatty acid,MUFA)比例呈现上升趋势,从20.69%提高至22.35%;多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)比例呈现下降的趋势,从39.62%下降至37.05%。这与XU等[28]在盐藻Dunalliela sp.中的研究结果相一致。

图6 盐度适应性驯化过程中藻株FZU60的
脂肪酸组分变化
Fig.6 Fatty acid composition of strain FZU60 during
salinity adaptive domestication
2.5 盐度适应性驯化过程中小球藻FZU60的细胞组分变化
如图7所示,小球藻FZU60的细胞组成主要包含蛋白质、脂肪酸、碳水化合物和色素(叶绿素和类胡萝卜素),其中前3者占细胞组成的81%~92%。在盐度驯化过程中,蛋白质质量分数从37.60%提高至46.48%;油脂质量分数从9.80%提高至12.59%;碳水化合物质量分数从34.05%降低至26.23%;色素质量分数变化不大。以上结果表明,高盐度可促进藻细胞内蛋白质和脂质的积累,但不利于碳水化合物积累。类似地,有研究表明高盐条件下藻细胞的碳水化合物合成会受到抑制[29],而油脂合成的效率则会提高[22]。这可能是由于盐度胁迫可激活相关酶的活性,以分解碳水化合物用于合成能量更高的油脂,从而使得细胞能够承受渗透压力的变化。例如,在盐胁迫下嗜盐微藻(Dunaliella salina)胞内淀粉(碳水化合物)会被代谢转移至三酰甘油酯(油脂)的生物合成中[30]。
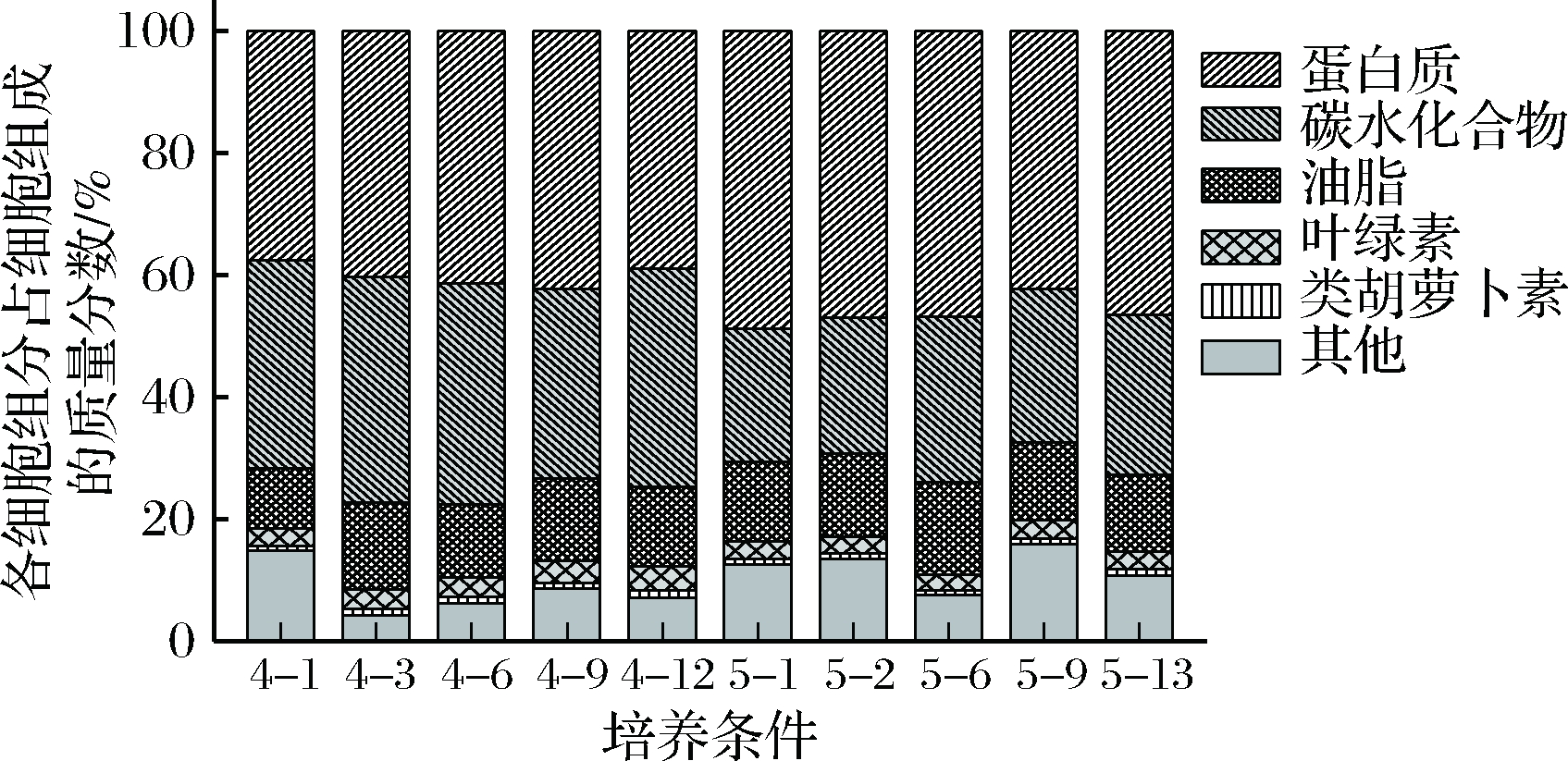
图7 盐度适应性驯化过程中藻株FZU60的
细胞组分变化
Fig.7 Cell composition of strain FZU60 during salinity
adaptive domestication
2.6 30 g/L盐度下耐盐株和原始株的细胞生长及叶黄素积累情况
海水盐度一般在30~35 g/L,若微藻能在30 g/L盐度下生长,则可以使用海水进行培养,从而达到节约淡水资源并降低微藻培养成本的目的[31]。如图8-a所示,在30 g/L盐度条件下培养4 d的过程中,耐盐株的生物量质量浓度始终高于原始株,且耐盐株的氮源消耗速度也更快(如图8-b)。
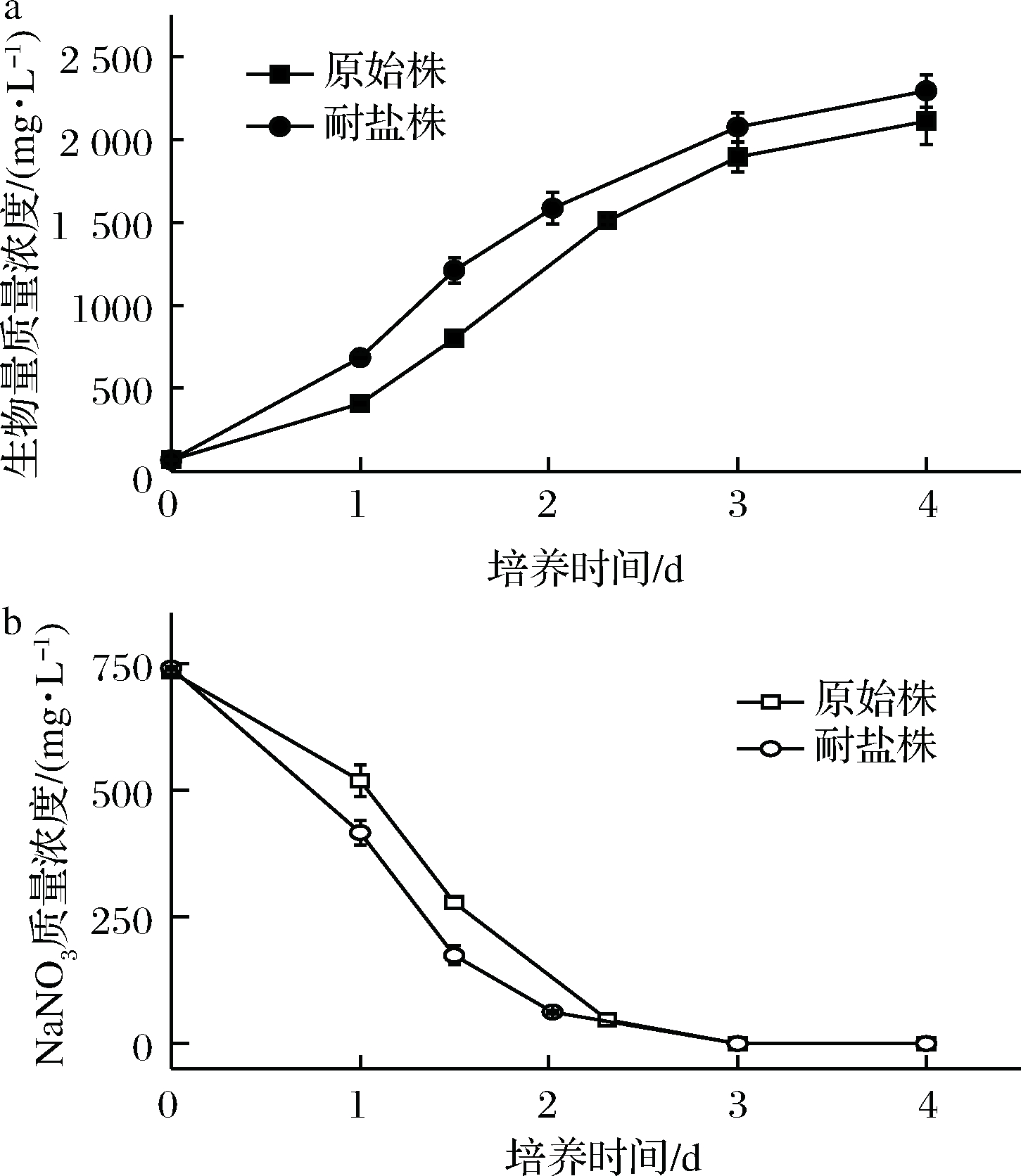
a-细胞生长;b-氮源消耗
图8 30 g/L盐度下FZU60原始株和耐盐株的细胞生长
及氮源消耗情况
Fig.8 Cell growth and nitrogen source consumption
of wild and salt-tolerant strains of FZU60 at 30 g/L salinity
有研究报道,当培养基中氮源即将耗尽时(耗完90%氮源),藻细胞的叶黄素质量分数可达最高,因此一般在此时间点收集藻细胞用于叶黄素提取[32]。如图8-b所示,原始株和耐盐株分别在培养2.31和2.02 d时耗完90%氮源,此时两者的叶黄素质量分数无显著性差异,分别为(7.26±0.13)和(7.31±0.23) mg/g(表1)。但由于耐盐株的生物量产率明显高于原始株,使得其叶黄素产率及产量均显著高于原始株(表1)。因此综上可知,在30 g/L盐度下耐盐株具有更高的叶黄素生产能力。
表1 30 g/L盐度下FZU60原始株和耐盐株的细胞生长
及叶黄素生产情况对比
Table 1 Comparison of cell growth and lutein production
of wild and salt-tolerant strains of FZU60 at 30 g/L salinity

藻株生物量产率/[mg·(L·d)-1]叶黄素质量分数/(mg·g-1)叶黄素产率/[mg·(L·d)-1]叶黄素产量/(mg·g-1)原始株624.05±24.357.26±0.134.53±0.2610.96±0.21耐盐株767.89±36.667.31±0.235.62±0.4611.58±0.35
3 结论
本研究采用长期的高盐度适应性驯化方法,获得了可在50 g/L盐度下正常生长的耐盐小球藻藻株。与原始藻株相比,耐盐株的细胞体积增大,藻体颜色加深。经过高盐度适应性驯化培养,耐盐株的油脂和蛋白质质量分数均有所提高,色素质量分数无显著变化,但碳水化合物质量分数有所降低。在30 g/L盐度下,耐盐藻株具有更高的生物量产率和叶黄素产率,因此可用于海水培养生产叶黄素的实际应用中。但值得注意的是,本研究采用海盐来配制海水,若直接采用天然海水进行培养,可能会由于不同海域的海水其盐离子组成及配比存在差异,从而会对藻体生长和叶黄素合成产生一定影响,因此在实际应用中需注意海水的离子组成及配比。
[1] RUDALL P J. An introduction to plant structure and development: Plant anatomy for the twenty-first century[J]. Annals of Botany,2011,36(2): 520.
[2] SUN Z,LI T,ZHOU Z G,et al. Microalgae as a source of lutein: Chemistry,biosynthesis,and carotenogenesis[J]. Microalgae Biotechnology,2016,153: 37-58.
[3] LIN J H,LEE D J,CHANG J S. Lutein production from biomass: marigold flowers versus microalgae[J]. Bioresource Technology,2015,184: 421-428.
[4] ACIÉN F G,FERN NDEZ J M,MAG
NDEZ J M,MAG N J J,et al. Production cost of a real microalgae production plant and strategies to reduce it[J]. Biotechnology Advances,2012,30(6): 1 344-1 353.
N J J,et al. Production cost of a real microalgae production plant and strategies to reduce it[J]. Biotechnology Advances,2012,30(6): 1 344-1 353.
[5] BOROWITZKA M A,MOHEIMANI N R. Sustainable biofuels from algae[J]. Mitigation and Adaptation Strategies for Global Change,2013,18(1): 13-25.
[6] DRAGOSITS M,MATTANOVICH D. Adaptive laboratory evolution-principles and applications for biotechnology[J]. Microbial Cell Factories,2013,12(1): 64.
[7] KATO Y,HO S H,VAVRICKA C J,et al. Evolutionary engineering of salt-resistant Chlamydomonas sp. strains reveals salinity stress-activated starch-to-lipid biosynthesis switching[J]. Bioresource Technology,2017,245: 1 484-1 490.
[8] FERN NDEZ-SEVILLA J M,FERN
NDEZ-SEVILLA J M,FERN NDEZ F G A,GRIMA E M. Biotechnological production of lutein and its applications[J]. Applied Microbiology and Biotechnology,2010,86(1): 27-40.
NDEZ F G A,GRIMA E M. Biotechnological production of lutein and its applications[J]. Applied Microbiology and Biotechnology,2010,86(1): 27-40.
[9] XIE Y P,LI J,MA R,et al. Bioprocess operation strategies with mixotrophy/photoinduction to enhance lutein production of microalga Chlorella sorokiniana FZU60[J]. Bioresource Technology,2019,290: 121 798.
[10] XIE Y P,HO S H,CHEN C N,et al. Phototrophic cultivation of a thermo-tolerant Desmodesmus sp. for lutein production: effects of nitrate concentration,light intensity and fed-batch operation[J]. Bioresource Technology,2013,144: 435-444.
[11] XIE Y P,ZHAO X R,CHEN J F,et al. Enhancing cell growth and lutein productivity of Desmodesmus sp. F51 by optimal utilization of inorganic carbon sources and ammonium salt[J]. Bioresource Technology,2017,244: 664-671.
[12] XIE Y P,LU K Y,ZHAO X R,et al. Manipulating nutritional conditions and salinity-gradient stress for enhanced lutein production in marine microalga Chlamydomonas sp.[J]. Biotechnology Journal,2019,14(4): 1 800 380.
[13] 谢友坪,赵旭蕊,阳需求,等. 脉冲式添加氮源对耐温微藻Desmodesmus sp. F51细胞生长和细胞组成的影响[J]. 食品科学,2017,38(14): 64-70.
[14] 李君兰,杨澜,吴潇霞,等. 葡萄糖酸钙采前处理对鲜枣果实低温贮藏品质及活性氧代谢的影响[J]. 食品与发酵工业,2019,45(7): 144-150.
[15] CHEN C Y,JESISCA,HSIEH C,et al. Production,extraction and stabilization of lutein from microalga Chlorella sorokiniana MB-1[J]. Bioresource Technology,2016,200: 500-505.
[16] TAYLOR K L,BRACKENRIDGE A E,VIVIER M A,et al. High-performance liquid chromatography profiling of the major carotenoids in Arabidopsis thaliana leaf tissue[J]. Journal of Chromatography A,2006,1121(1): 83-91.
[17] SUI Y X,MUYS M,VAN DE WAAL D B,et al. Enhancement of co-production of nutritional protein and carotenoids in Dunaliella salina using a two-phase cultivation assisted by nitrogen level and light intensity[J]. Bioresource Technology,2019,287: 121 398.
[18] WHO/FAO/UNU Expert Consultation. Protein and amino acid requirements in human nutrition introduction[C].World Health Organization Technical Report,2007.
[19] 王宝贝,李丽婷,刘磊,等. 烘焙处理对小球藻营养成分及其抗氧化活性的影响[J]. 食品与发酵工业,2019,45(4): 147-151.
[20] ALYABYEV A J,LOSEVA N L,GORDON L K,et al. The effect of changes in salinity on the energy yielding processes of Chlorella vulgaris and Dunaliella maritima cells[J]. Thermochimica Acta,2007,458(1-2): 65-70.
[21] EL-SHEEKH M,ABOMOHRA A E F,HANELT D. Optimization of biomass and fatty acid productivity of Scenedesmus obliquusas a promising microalga for biodiesel production[J]. World Journal of Microbiology and Biotechnology,2013,29(5): 915-922.
[22] ZHANG L,PEI H,CHEN S,et al. Salinity-induced cellular cross-talk in carbon partitioning reveals starch-to-lipid biosynthesis switching in low-starch freshwater algae[J]. Bioresource Technology,2018,250: 449-456.
[23] KHONA D K,SHIROLIKAR S M,GAWDE K K,et al. Characterization of salt stress-induced palmelloids in the green alga Chlamydomonas reinhardtii[J]. Algal Research,2016,16: 434-448.
[24] SHAH M M,LIANG Y,CHENG J J,et al. Astaxanthin-producing green microalga Haematococcus pluvialis: from single cell to high value commercial products[J]. Frontiers in Plant Science,2016,7: 531.
[25] SUBRAMANYAM R,JOLLEY C,THANGARAJ B,et al. Structural and functional changes of PSI-LHCI supercomplexes of Chlamydomonas reinhardtii cells grown under high salt conditions[J]. Planta,2010,231(4): 913-922.
[26] KENT M,WELLADSEN H M,MANGOTT A,et al. Nutritional evaluation of Australian microalgae as potential human health supplements[J]. PloS One,2015,10(2): e0118985.
[27] ZHILA N O,KALACHEVA G S,VOLOVA T G. Effect of salinity on the biochemical composition of the alga Botryococcus braunii Kütz IPPAS H-252[J]. Journal of Applied Phycology,2011,23(1): 47-52.
[28] XU X Q,BEARDALL J. Effect of salinity on fatty acid composition of a green microalga from an antarctic hypersaline lake[J]. Phytochemistry,1997,45(4): 655-658.
[29] VAZQUEZ-DUHALT R,ARREDONDO-VEGA B O. Haloadaptation of the green alga Botryococcus braunii [J]. Phytochemistry,1991,30(9): 2 919-2 925.
[30] ISHIKA T,BAHRI P A,LAIRD D W,et al. The effect of gradual increase in salinity on the biomass productivity and biochemical composition of several marine,halotolerant,and halophilic microalgae[J]. Journal of Applied Phycology,2018,30(3): 1 453-1 464.
[31] ISHIKA T,MOHEIMANI N R,BAHRI P A,et al. Halo-adapted microalgae for fucoxanthin production: Effect of incremental increase in salinity[J]. Algal Research,2017,28: 66-73.
[32] HO S H,CHAN M C,LIU C C,et al. Enhancing lutein productivity of an indigenous microalga Scenedesmus obliquus FSP-3 using light-related strategies[J]. Bioresource Technology,2014,152: 275-282.