大豆种皮是大豆产品加工过程中主要的副产物,约占大豆质量的6%~8%[1],具有廉价、果胶和纤维素含量高等特点,常被作为提取多糖及过氧化酶等物质的原料[1-2]。研究发现,大豆种皮多糖(soy hull polysaccharide,SHP)具有良好的功能特性和生物活性[3],其功能特性及生物活性依赖于化学结构,利用改性修饰的方法可以提高其功能特性,拓宽应用领域[3-4]。果胶类多糖的修饰主要包括物理法、化学法、酶解法等。BIZMAEK等[5-6]研究发现,乙基化的纤维素纳米颗粒能够在几秒内吸附至油水界面并显著降低表面张力,能有效稳定水包油型皮克林乳液。王胜男等[7]发现,微波辅助草酸铵法提取的SHP比热水提取法具有较好的乳化性能。酶解法具有特异性高、反应条件温和等优点,被广泛应用于多糖修饰。KIM等[8]用α-淀粉酶和淀粉葡糖苷酶酶解红参粗多糖,发现酶解后多糖对肠道免疫系统和巨噬细胞活性有明显增强作用。SHP主要由半乳糖醛酸、半乳糖、鼠李糖、阿拉伯糖和部分蛋白质构成[9],利用酶解法对多糖链段进行断裂或修饰蛋白部分可改变多糖结构及功能特性。因此,本文利用β-半乳糖苷酶、β-葡聚糖酶和木瓜蛋白酶对SHP进行酶解处理,通过基本成分、傅里叶红外光谱(Fourier transform infrared,FT-IR)分析,原子力显微镜(atomic force microscopy,AFM)对酶解后多糖进行表征,通过粒径、Zeta电位、乳化活性、乳化稳定性及多重光散射分析不同酶酶解前后多糖结构及对乳化性能,为酶解法改性多糖提供理论参考。
1 材料与方法
1.1 材料与试剂
大豆皮,辽宁锦州大豆皮经销公司;β-半乳糖苷酶(10 000 U/g),上海普育科贸有限公司;β-葡聚糖酶(10 000 U/g),山东安克生物工程有限公司;木瓜蛋白酶(10 000 U/g),上海麦克林生化科技有限公司;草酸铵、无水乙醇、十二烷基硫酸钠(sodium dodecyl sulfate,SDS),均为分析纯。
1.2 仪器与设备
FW-100型高速万能粉碎机,北京市永光明医疗仪器厂;马弗炉,上海特成机械设备有限公司;8L-320S型电子天平、UV-2550型紫外分光光度仪,日本岛津公司;RE-3000型旋转蒸发器,上海亚莱生化仪器厂;BT-9300ST型激光粒度分布仪,丹东市百特仪器有限公司;Nano-ZS90型激光粒度仪,英国马尔文公司;XE-70原子力显微镜,韩国Park Systems公司;L535R型台式低速冷冻离心机,长沙湘仪离心机仪器有限公司;90 Plus型Zeta电位仪,美国布鲁克海文仪器公司;DHR-1型流变仪,美国TA公司;Scitar 2000型傅里叶红外仪,美国安捷伦科技有限公司;JB-2A恒温磁力搅拌器,上海雷磁仪器有限公司。
1.3 实验方法
1.3.1 SHP的提取
大豆种皮过筛,将其中豆瓣碎渣除去后,粉碎过60目筛。取大豆种皮200 g于烧杯中,按料液比1∶10(g∶mL)加入1%(体积分数)的乙醇溶液,室温下搅拌30 min,静置后用200目双层纱布过滤,将滤渣放置于65 ℃的鼓风干燥箱中烘干。准确称取烘干后的大豆种皮残渣100 g,按料液比1∶20(g∶mL)加入质量浓度6 g/L的草酸铵,再加入95~100 ℃的蒸馏水,在微波85 ℃条件下处理20 min,冷却静置后,200目双层纱布过滤后在3 500 r/min的条件下离心15 min[10]。取上清液蒸发浓缩至原体积的1/3,用0.01 mol/L HCl调节pH至4.0,缓慢加入双倍体积的无水乙醇,用玻璃棒进行搅拌,直至多糖完全析出,放置40 min后过滤,将滤渣于65 ℃恒温干燥箱中烘干,即可得到SHP。
1.3.2 酶解SHP的制备
称取15.00 g SHP,加入0.10 g β-半乳糖苷酶,调节pH至6.7,在水浴锅中恒温39 ℃,酶解2 h。酶解后95 ℃加热10 min灭酶活力,再将其倒入干净托盘中,放置于65 ℃烘箱中烘干,得到β-半乳糖苷酶酶解的多糖(SHP modified by β-galactosidase,GAL)[11]。
称取15.00 g SHP,加入0.10 g β-葡聚糖酶,调节pH至7.5,在水浴锅中恒温45 ℃,酶解1.5 h。酶解后95 ℃加热10 min灭酶活力,再将其倒入干净托盘中,放置于65 ℃烘箱中烘干,得到β-葡聚糖酶酶解的多糖(SHP modified by β-glucanase,GLU)。
称取10.00 g SHP,根据木瓜蛋白酶的酶活力,加入0.115 g木瓜蛋白酶,调节pH至6.0,在水浴锅中恒温50 ℃,酶解1 h。酶解后95 ℃加热10 min灭酶活力,再将其倒入干净托盘中,放置于65 ℃烘箱中烘干,得到木瓜蛋白酶酶解的多糖(SHP modified by papain,PAP)[12]。
1.3.3 基本成分测定
总糖含量:采用苯酚-H2SO4法测定[13];
蛋白质含量:采用酶标仪法利用BCA试剂盒测定;
水分含量:参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》进行测定;
灰分含量:参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》利用分析天平进行测定;
糖醛酸含量:采用H2SO4-咔唑比色法进行测定[14]。
1.3.4 FT-IR测定
采用压片法,将样品与KBr按质量比为1∶100混合充分研磨,利用模具与压片机将粉末制成压片。在样品测定之前先进行背景扫描去除干扰因素,在400~4 000 cm-1进行红外光谱扫描。
1.3.5 AFM测定
将SHP、GAL、GLU、PAP分别配制成质量浓度5 mg/mL,取5 μL样品溶液置于新剥离云母片表面,自然干燥后利用AFM测量。
1.3.6 乳液的制备
将大豆分离蛋白(soy protein isolate,SPI)配制成4%(质量分数)水溶液,取80 mL与20 mL大豆油混合,在8 000 r/min的高速分散均质机下剪切2 min,得到初级乳状液。再将SHP、GAL、GLU、PAP分别配制成0.8%(质量分数)水溶液100 mL,并进行磁力搅拌使其充分溶解后,与初级乳状液混合,利用高速分散均质机在8 000 r/min下剪切2 min进行粗均质,再使用高压均质机在50 MPa下均质3 min,最终使乳状液包含2%(质量分数)SPI、10%(体积分数)油和0.4%(质量分数)酶解大豆种皮多糖。再加入0.2%(质量分数)叠氮化钠抑制微生物的生长,并将制得的乳状液在4 ℃下避光保存。以未添加多糖,添加2%(质量分数)大豆分离蛋白乳状液(SPI emulsion,SPIE)为对照组,其余4组添加不同多糖配制的乳状液简写为β-半乳糖苷酶酶解多糖乳液(GAL emulsion,GALE)、β-葡聚糖酶酶解多糖乳液(GLU emulsion,GLUE)、木瓜蛋白酶(PAP emulsion,PAPE)和大豆种皮多糖乳液(SHP emulsion,SHPE)。
1.3.7 乳化活性和乳化稳定性的测定
乳化性的测定参考MOLINA等[15]的方法,将大豆多糖-大豆分离蛋白复合乳液用质量浓度1 g/L SDS溶液稀释1 000倍。在波长500 nm条件下,用紫外分光光度计测定吸光值A0,计算乳化活性指数(emulsifying activity index,EAI)。静置30 min后测定吸光值A30,计算乳化稳定性(emulsiflying stability index,ESI)。
1.3.8 乳液粒径分布与Zeta电位的测定
利用BT-9300ST激光粒度分布仪测定乳状液的粒度分布情况,测定前需搅拌溶液,使其溶液内分子分布均匀,并记录中位径(D50)、表面积分数平均粒径(D3,2)及体积分数平均粒径(D4,3)[16]。利用NANO ZS90激光粒度分布仪在室温下测定乳状液Zeta电位。
1.3.9 流变性质的测定
采用DHR-1流变仪测定,取1.5 mL乳状液加在测试台上,狭缝距离设置为0.5 mm,剪切速率0~100 s-1,检测样品流变特性。
1.3.10 多重光散射的测定
将20 mL样品装进样品瓶,确保没有气泡,多重光散射仪扫描,1 min扫描1次,扫描30 min。
1.3.11 数据统计及分析
数据统计分析采用SPSS 19.0软件进行差异显著性分析,检验标准,P<0.05。采用Origin 8.5软件绘图。
2 结果与分析
2.1 酶解大豆种皮多糖组成成分及结构
酶解后大豆种皮多糖组成成分见表1。β-半乳糖苷酶水解β-半乳糖苷键,β-葡聚糖酶水解β-1,3和β-1,4糖苷键,而木瓜蛋白酶可以水解蛋白质。4种多糖的总糖含量差异不显著(P>0.05),GAL总糖含量最高为(46.96±8.36)%。3种酶解多糖的糖醛酸含量差异显著(P<0.05),GAL与GLU糖醛酸含量显著增加(P<0.05),原因可能为2种酶将SHP分解为小分子低聚糖;而PAP糖醛酸含量显著降低(P<0.05),可能是木瓜蛋白酶将多糖中蛋白质分解为小分子多肽,引起多肽和糖醛酸间相互作用。酶解后的多糖水分含量较SHP高,可能是多糖经酶解后吸湿性发生改变。
表1 基本组成成分 单位:%
Table 1 Basic composition

多糖样品总糖蛋白质水分灰分糖醛酸GAL46.96±8.36a6.56±0.21b10.65±0.12b6.00±0.12c34.27±0.21aGLU47.82±7.20a7.64±0.47a10.93±0.10a6.00±0.15c30.53±0.88bPAP38.43±2.18a5.67±0.13c9.45±0.12c7.33±0.09a17.51±0.40dSHP42.70±3.9a4.96±0.13d8.15±0.15d6.36±0.15b28.10±0.94c
注:同一列上标小写字母不同代表组成成分含量差异显著(P<0.05)(下同)
SHP、GAL、GLU和PAP的红外图谱见图1。从图1可知,在3 200 cm-1处4种多糖均出现较宽吸收峰,此处为C—H伸缩振动,且GLU在此处峰强较弱,说明β-葡聚糖酶处理的SHP不饱和度降低。3种酶处理多糖在1 599、1 442 cm-1附近出现较强吸收峰,分别由C![]() O非对称伸缩振动和C—O伸缩振动引起[17],PAP峰强最大,原因可能是木瓜蛋白酶酶解了大豆多糖中的蛋白质,使其由大分子分解成小分子基团,而造成峰值偏高,而GLU在1 599 cm-1处峰强较弱,推测不饱和度降低可能由C
O非对称伸缩振动和C—O伸缩振动引起[17],PAP峰强最大,原因可能是木瓜蛋白酶酶解了大豆多糖中的蛋白质,使其由大分子分解成小分子基团,而造成峰值偏高,而GLU在1 599 cm-1处峰强较弱,推测不饱和度降低可能由C![]() O的破坏引起。此外,酶修饰多糖在1 200~1 000 cm-1处吸收峰与SHP差别不大,表明都有C—O—C存在[18]。767 cm-1处吸收峰是由α-D-(1-4)和α-D-(1-6)的拉伸振动与形变振动引起的[19],除GLU外,其他3种多糖在该处均有较强吸收峰。以上结果说明经木瓜蛋白酶处理的多糖结构变化较明显。
O的破坏引起。此外,酶修饰多糖在1 200~1 000 cm-1处吸收峰与SHP差别不大,表明都有C—O—C存在[18]。767 cm-1处吸收峰是由α-D-(1-4)和α-D-(1-6)的拉伸振动与形变振动引起的[19],除GLU外,其他3种多糖在该处均有较强吸收峰。以上结果说明经木瓜蛋白酶处理的多糖结构变化较明显。
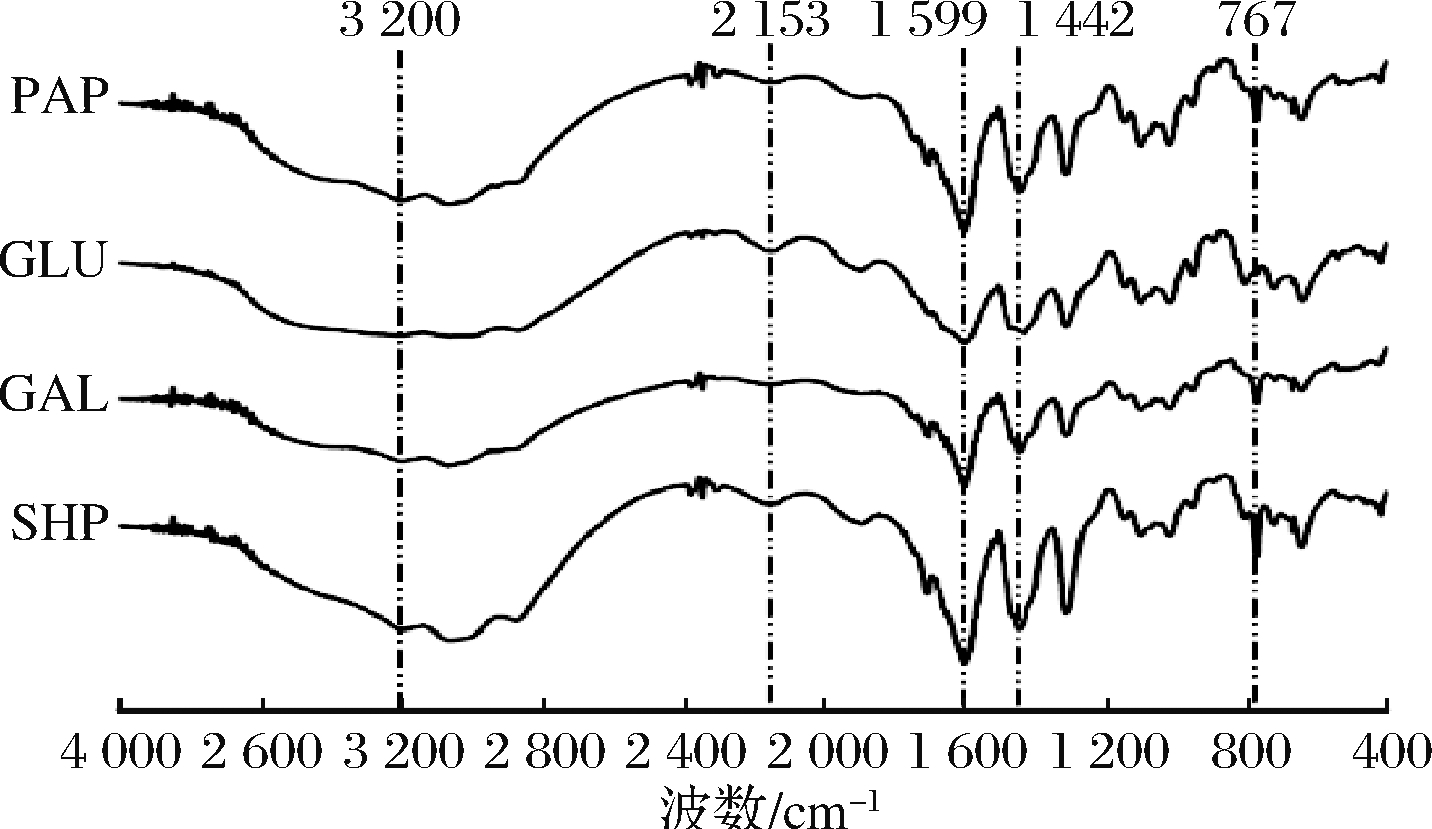
图1 四种大豆种皮多糖的傅里叶红外光谱图
Fig.1 FT-IR of four soy hull polysaccharides
2.2 AFM分析
SHP、GAL、GLU和PAP的AFM图见图2。由图2可知,4种多糖在云母片上形成不均匀的薄膜,由块状多糖聚集体与颗粒组成。GAL(图2-a)与GLU(图2-b)的聚集体尺寸比SHP小,小颗粒明显增多,原因可能是GAL与GLU含有较多的糖醛酸,糖醛酸中羧基或羧基阴离子上强电负性氧原子与糖链中氢原子形成氢键所致[20]。由图2-a可知,GAL拥有较多的糖链分支结构而导致多糖聚集体较其他多糖多,可能造成多糖支链灵活性降低进而影响多糖乳化性能。PAP(图2-c)聚集体较大,原因可能是较大的电负性与带负电荷云母之间产生较大排斥力所致。
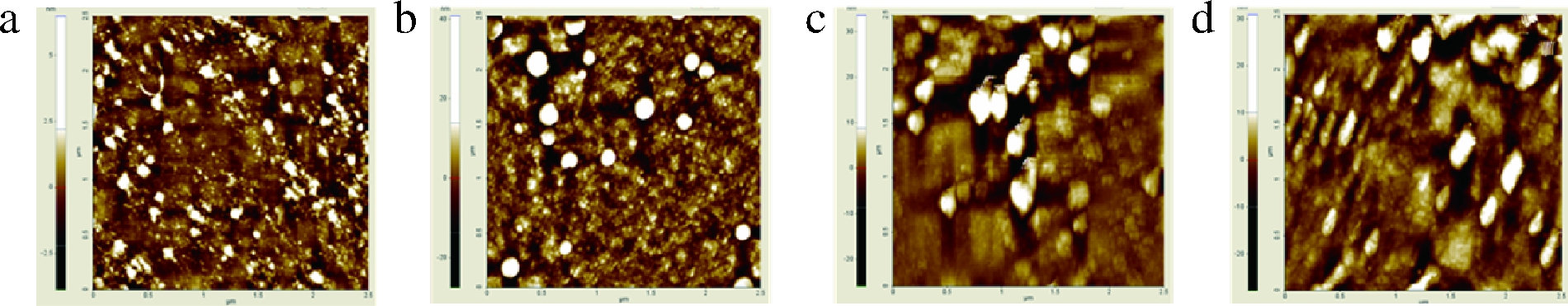
a-GAL;b-GLU;c-PAP;d-SHP
图2 四种大豆种皮多糖的原子力显微镜图
Fig.2 Atomic force microscope of four soy hull polysaccharides
2.3 乳液粒径分布与Zeta电位
5种乳液的平均粒径及粒径分布如表2和图3所示。由表2可知,与SHPE、SPIE相比,GALE与GLUE平均粒径均显著减小(P<0.05),PAPE则无显著差别(P>0.05),说明GAL和GLU所形成的蛋白乳状液较稳定。结合图3可知,GALE、PAPE、SHPE和SPIE均呈现单峰,为单分散体系,而GLUE呈现双峰分布,为多分散体系。GALE和GLUE液滴均朝粒径变小方向移动,峰值高且分布集中,乳化液稳定性较好,而PAPE、SHPE、SPIE粒径分布基本一致,峰值低且粒径分布范围较宽,粒径较大液滴占主要部分,可见GALE和GLUE乳化能力较强。
由表2可知,5种乳液均带负电荷,GALE与GLUE电位绝对值较小,分别为(-2.40±0.44)和(-2.88±0.60)mV,液滴之间的斥力较小,乳状液的稳定性较差,PAPE电位变化明显[(-29.1±2.59)mV]且电位绝对值最大(P<0.05),液滴之间的斥力较大不易聚集,乳状液稳定性好。这种现象可能由于木瓜蛋白酶对SHP中蛋白质酶解作用,多糖中带负电荷基团的暴露和带正电荷蛋白质的酶解从而引起PAPE电位显著变化。SHP在油水界面与SPI发生微弱相互作用导致GALE、GLUE、SHPE电位绝对值较SPIE有所降低。
表2 乳状液粒径、Zeta电位、乳化活性及乳化稳定性
Table 2 Particle size,Zeta potential,emulsifying active and emulsifying stability value of emulsion
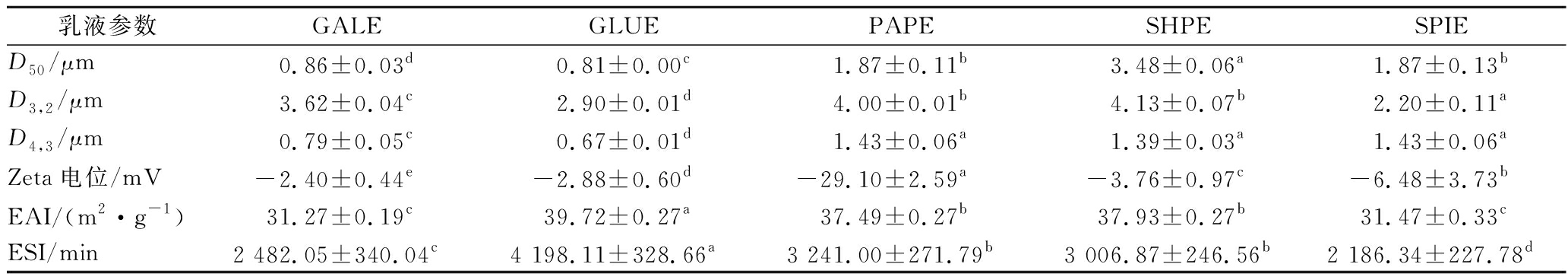
乳液参数GALEGLUEPAPESHPESPIED50/μm0.86±0.03d0.81±0.00c1.87±0.11b3.48±0.06a1.87±0.13bD3,2/μm3.62±0.04c2.90±0.01d4.00±0.01b4.13±0.07b 2.20±0.11aD4,3/μm0.79±0.05c0.67±0.01d1.43±0.06a1.39±0.03a1.43±0.06aZeta电位/mV -2.40±0.44e-2.88±0.60d-29.10±2.59a-3.76±0.97c-6.48±3.73bEAI/(m2·g-1)31.27±0.19c39.72±0.27a37.49±0.27b37.93±0.27b31.47±0.33cESI/min2 482.05±340.04c4 198.11±328.66a3 241.00±271.79b3 006.87±246.56b2 186.34±227.78d

图3 乳状液粒径分布图
Fig.3 Normal distribution of emulsion particle size
2.4 乳液乳化活性及乳化稳定性
乳化活性和乳化稳定性是直接反映乳状液特性的重要指标。5种乳液的EAI和ESI如表2所示。SPIE乳化稳定性最差,其ESI值为2 186.34 min,添加4种多糖后GALE的EAI及ESI值变化最小,分别为31.27 m2/g 和2 482.05 min,而GLUE乳化活性及乳化稳定性最好,分别为39.72 m2/g和4 198.11 min。原因可能是GAL的总糖和蛋白质含量最高,液滴表面蛋白质多糖复合保护层较其他3种乳状液厚,随时间延长不易破损,所以提高了乳化活性与乳化稳定性。SHP中半乳糖含量占27.26%并含有聚半乳糖,经β-半乳糖苷酶酶解后断裂了β-半乳糖苷键形成了较多的低聚糖,导致GALE乳化活性及乳化稳定性均较低。
2.5 乳液流变性性质
图4-a和图4-b分别表示剪切速率对剪切应力和黏度的影响。由图4-a可知,随剪切速率的增加乳状液剪切应力依次增大,其中PAPE的剪切应力最大,其次是SHPE、GALE、GLUE和SPIE。5种乳液剪切速率0.1~100 s-1间均呈现剪切变稀现象,PAPE变化显著说明多糖促进乳液抗絮凝作用较好。由图4-b可知,GALE,GLUE和SPIE黏度变化较小,结合2.3与2.4分析可知,GALE粒径小、分布窄造成黏度变化缓慢,而GLUE与SPIE由于乳化稳定性较好,单个液滴不易分散成小液滴导致黏度下降迟缓。
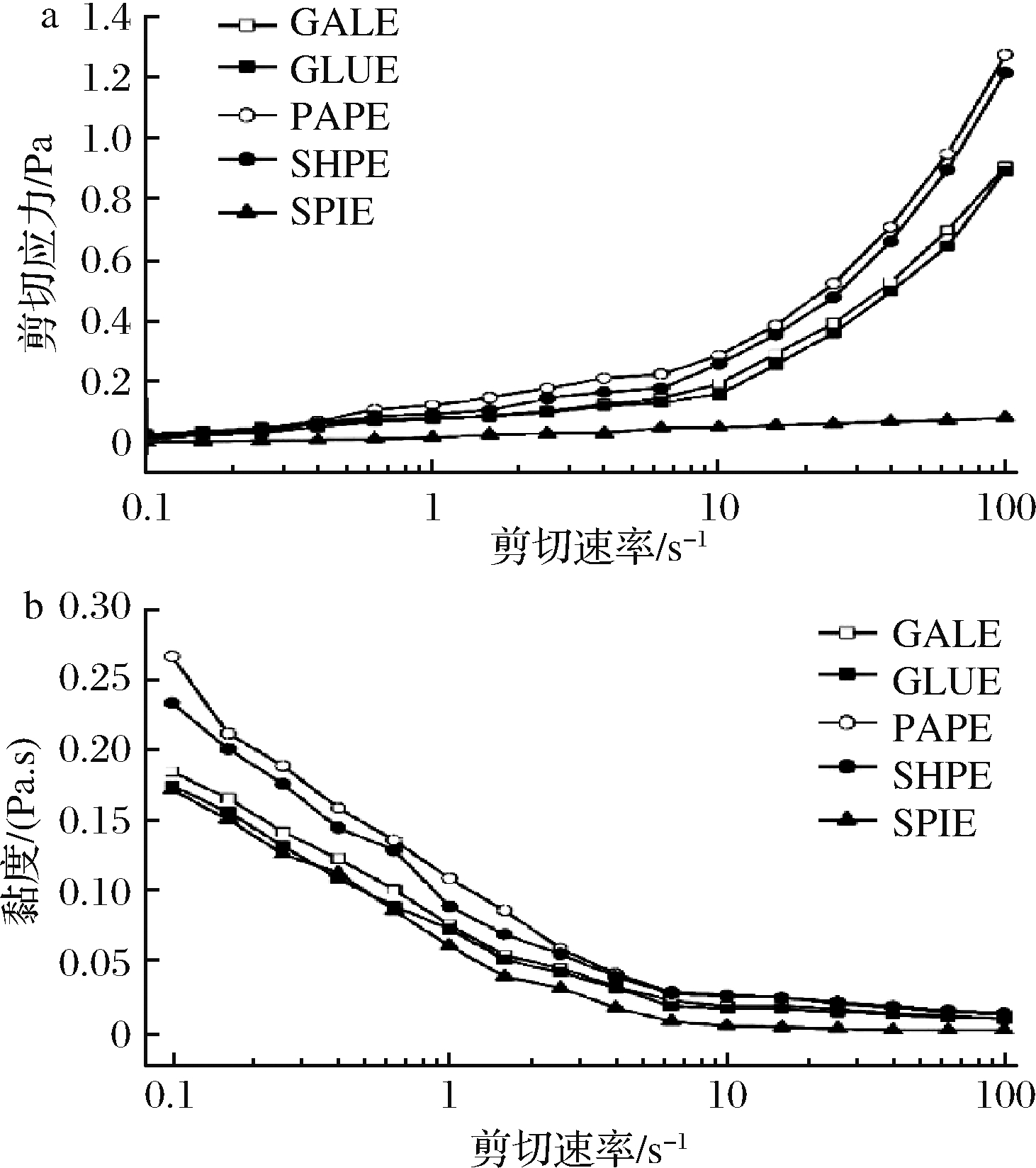
a-剪切应力;b-黏度
图4 乳液的流变学性质
Fig.4 Rheology property of emulsions
2.6 多重光散射
乳状液在放置过程中,液滴在重力和布朗运动作用下相互碰撞,导致出现分层、絮凝、聚集等失稳现象。多重光散射技术可以对流体稳定性做出快速、有效的评价[21]。图5为5种乳液在14 d Turbiscan稳定性指数(turbiscan stability index,TSI)的变化趋势图,TSI 稳定系数越小、斜率越小,表明乳液越稳定。如图5所示,初始乳液在扫描时间30 min内TSI值均在0.5左右,说明初始乳状液稳定性能较好。随贮藏时间的延长,储存7 d后 SPIE的TSI值增大,而多糖乳状液的TSI值变化不大,但SHPE乳液稳定性较GLUE与GALE差。储存14 d后SPIE出现分层现象,未测定TSI值。添加酶改性多糖乳状液中PAPE的TSI值在30 min内增至0.72,GALE、GLUE和SHPE的TSI值略有升高但最终保持在0.5左右,SHPE在0~10 min上升趋势较GLUE和GALE快,稳定性略差。

a-初始样品;b-7 d样品;c-14 d样品
图5 贮藏时间对TSI的影响
Fig.5 The influence of storage time on TSI
3 结论
本研究采用β-半乳糖苷酶、β-葡聚糖酶、木瓜蛋白酶处理SHP,发现酶改性后多糖的组成、结构、分子链形貌差异显著,其中PAP的结构变化较大。研究发现,酶改性多糖的乳化能力均提高。同时,添加不同酶改性可以提高乳液的稳定性,其中GALE与GLUE粒径较小且分布均匀,同时黏度与剪切应力随剪切速率增大变化较小,TSI值随贮藏时间的延长变化不大,证明经β-半乳糖苷酶、β-葡聚糖酶处理的SHP可有效增强乳液稳定性。因此,可利用β-半乳糖苷酶、β-葡聚糖酶改性提高SHP的乳化能力。
[1] MAR A C P,JORGE R W. Extraction and characterization of soy hull polysaccharide-protein fractions. Analysis of aggregation and surface rheology[J]. Food Hydrocolloids,2018,79:40-47.
A C P,JORGE R W. Extraction and characterization of soy hull polysaccharide-protein fractions. Analysis of aggregation and surface rheology[J]. Food Hydrocolloids,2018,79:40-47.
[2] GENG Z H,RAO K J,BASSI A S,et al. Investigation of biocatalytic properties of soybean seed hull peroxidase[J]. Catalysis Today,2001,64(3):233-238.
[3] XU Y,WU Y J,SUN P L,et al. Chemically modified polysaccharides: Synthesis,characterization,structure activity relationships of action[J]. International Journal of Biological Macromolecules,2019,132:970-977.
[4] XIE L M,SHEN M Y,HONG Y Z,et al. Chemical modifications of polysaccharides and their anti-tumor activities[J]. Carbohydrate Polymers,2020,229:115-436.
[5] BIZMARK N,IOANNIDIS M A. Effects of ionic strength on the colloidal stability and interfacial assembly of hydrophobic ethyl cellulose nanoparticles[J]. Langmuir 2015,31(34):9 282-9 289.
[6] BIZMARK N,IOANNIDIS M A. Ethyl cellulose nanoparticles at the alkane-water interface and the making of Pickering emulsions[J]. Langmuir 2017,33(40):10 568-10 576.
[7] 王胜男,赵玲玲,张红运,等. 提取方法对大豆种皮多糖乳化能力的影响 [J]. 中国食品学报,2018,18(1):154-161.
[8] KIM H,KIM H W,YU W K,et al. Polysaccharides fractionated from enzyme digests of Korean red ginseng water extracts enhance the immunostimulatory activity[J]. International Journal of Biological Macromolecules,2019,121:913-920.
[9] YANG L N,ZHANG H Y,ZHAO Y F,et al. Chemical structure,chain conformation and rheological properties of pectic polysaccharides from soy hulls[J]. International Journal of Biological Macromolecules,2020,148:41-48.
[10] 刘贺,郭晓飞,高虹妮,等. 微波辅助提取大豆皮果胶工艺参数优化[J]. 食品与发酵科技,2010,46(5): 37-40.
[11] 卜建斌. β-半乳糖苷酶及其固定化在低乳糖牛奶生产中的应用研究[D]. 呼和浩特: 内蒙古农业大学,2006.
[12] CHEN R,LI H,LI S,et al. Extraction optimization,preliminary characterization and immunological activity of polysaccharides from figs[J]. International Journal of Biological Macromolecules,2015,72:185-194.
[13] DUBOIS M,GILLES K A,HAMILTON J K,et al. Colorimetric method for determination of sugars and related substances-analytical chemistry (ACS publications)[J]. Springerplus,1980,89(5):449-454.
[14] YANG X,HUANG M,QIN C,et al. Structural characterization and evaluation of the antioxidant activities of polysaccharides extracted from Qingzhuan brick tea[J]. International Journal of Biological Macromolecules,2017,101:768-775.
[15] MOLINA E,PAPADOPOULOU A,LEDWARD D A. Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins[J]. Food Hydrocolloids,2001,15(3):263-269.
[16] PETER C,SHOICHI G,HIDEFUMI Y,et al. Physical properties of oil-in-water emulsions as a function of oil and soy soluble polysaccharide types[J]. Food Hydrocolloids,2014(39): 34-40.
[17] WANG Z,ZHANG H,SHEN Y,et al. Characterization of a novel polysaccharide from Ganoderma lucidum and its absorption mechanism in Caco-2 cells and mice model[J]. International Journal of Biological Macromolecules,2018,118:320-326.
[18] YANG L Q,ZHANG L M,Chemical structural and chain conformational characterization of some bioactive polysaccharides isolated from natural sources[J]. Carbohydrate Polymers,2009,76(3):349-361.
[19] WANG J,SOMASUNDARAN P. Adsorption and conformation of carboxymethyl cellulose at solid-liquid interfaces using spectroscopic,AFM and allied techniques[J]. Journal of Colloid and Interface Science,2005,291(1):75-83.
[20] 章轶锋. 超支化多糖的结构和链构象及其功能化. [D]. 武汉: 武汉大学,2011.
[21] JUKKOLA A,PARTANEN R,XIANG W,et al. Food emulsifiers based on milk fat globule membranes and their interactions with calcium and casein phosphoproteins[J]. Food Hydrocolloids,2019,94:30-37.