高血压现已成为全球性的主要健康风险,它能引起心脑血管疾病、心力衰竭和终末期肾脏病等。据统计,因高血压引发的心脑血管疾病至少占到了整个心脑血管疾病的50%[1]。血压受不同生化途径调控,肾素-血管紧张素-醛固酮系统和舒血管素-激肽系统是其中的主要调节系统。血管紧张素转化酶(angiotensin-converting enzyme,ACE)是这些血压调节系统中的关键酶,它能促进血管紧张素Ⅰ转化为血管紧张素Ⅱ,降解缓激肽为无活性片段,从而导致血压升高。因此,通过抑制ACE活性,有助于降低机体血压。然而,化学合成的ACE抑制剂对人体具有副作用。一些源自牛乳[2]、小麦[3]、肉[4]等的食源性多肽,因安全,易与ACE结合、反应等特性,备受研究者关注。
干酪是重要的发酵乳制品,富含蛋白质和复杂多样的蛋白酶。成熟干酪中酪蛋白经凝乳酶、微生物蛋白酶、肽酶等作用,逐级降解为多肽,这些多肽不仅参与干酪风味、滋味和质地等形成,而且部分多肽还具有生物活性。Cheddar[5]、Gouda[6]、Emmental等[7]干酪的水溶性提取物已发现具有ACE抑制作用。G MEZ-RUIZ等[8]从成熟8个月的绵羊乳Manchego干酪的水溶性提取物中分离、鉴定出ACE抑制肽。Cheddar干酪中鉴定的VPP和IPP,对小鼠和人类具有降血压作用[9]。
MEZ-RUIZ等[8]从成熟8个月的绵羊乳Manchego干酪的水溶性提取物中分离、鉴定出ACE抑制肽。Cheddar干酪中鉴定的VPP和IPP,对小鼠和人类具有降血压作用[9]。
牦牛乳硬质干酪富含蛋白质,前期发现其水溶性提取物中含有生物活性多肽[10]。生物活性多肽经胃肠液消化、吸收,达到心血管系统后,才能发挥作用。生物活性多肽的化学结构信息与其生物活性密切相关,多肽的氨基酸组成和序列信息对其生物活性具有重要影响。因此,本试验使用胃蛋白酶和胰蛋白酶,模拟体外胃肠液消化,运用液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)技术,基于已报道的ACE抑制肽结构和活性关系,进一步比较牦牛乳硬质干酪经消化酶降解前后ACE抑制肽差异,为开发出具有功能特性的牦牛乳硬质干酪提供理论依据。
1 材料与方法
1.1 材料与主要试剂
牦牛乳,甘肃省天祝藏族自治县抓喜秀龙乡;CHOOZIT型乳酸菌发酵剂(保加利亚乳杆菌和嗜热链球菌),丹麦丹尼斯克公司;小牛凝乳酶(酶活力10万U/g),兰州生物技术有限公司;马尿酰-组氨酰-亮氨酸(N-hippuryl-His-Leu hydrate,HHL)、血管紧张素转换酶、甲酸(质谱级),美国Sigma-Aldrich公司;胃蛋白酶(USP级,1∶30 000)、胰蛋白酶(生物试剂纯,1∶250,250 U/mg,USP级), 上海源叶生物科技有限公司;乙腈(质谱级),美国Fisher Chemical公司。
1.2 仪器与设备
自制干酪槽;真空包装机,广东中山市名康包装机械厂;TGL-20 高速台式冷冻离心机,长沙湘仪离心机仪器有限公司;Scientz-10ND真空冷冻干燥机,宁波新芝生物科技股份有限公司;723紫外可见分光光度计,上海光谱仪器有限公司;Ultimate 3000毛细管高效液相色谱仪、Quadrupole-Orbitrap质谱仪,美国Thermo Fishier Scientific公司。
1.3 试验方法
1.3.1 干酪制作
参考刘兴龙等[11]的方法,适当微调,具体工艺流程如下:
原料乳→检验→巴氏杀菌(60 ℃、30 min)→冷却至32 ℃→添加发酵剂(10 g/L原料乳)→添加CaCl2(0.3 g/L原料乳)→添加凝乳酶→凝乳(40 min)→切割→排乳清→二次加热(温度缓慢从35 ℃升到45 ℃)→排乳清→搅拌、加盐(20 g/kg凝乳块)→堆酿→压榨成型→真空包装→15 ℃下成熟6个月该成熟牦牛乳硬质干酪水分质量分数为40.8%,蛋白质质量分数为27.22%,脂肪质量分数为45.9%。最后,将贮藏于-18 ℃备用。
1.3.2 干酪水溶性多肽的提取
参考RIZZELLO等[12]的方法提取。以1∶3(g∶mL)加入磷酸盐缓冲液(50 mmol/L,pH 7.0),150 r/min,40 ℃恒温振荡1 h后,4 ℃、4 200 r/min离心30 min,除去上层脂肪后,用Whatman No.2滤纸真空过滤,将滤液pH值调至4.6,4 ℃、7 500 r/min离心10 min,即获得上清液。真空冷冻干燥,于-18 ℃储藏备用。
1.3.3 干酪水溶性多肽的体外消化
参考LO等[13]的方法进行体外试验。配制30 g/L的干酪水溶性多肽溶液10 mL,用1 mol/L盐酸将pH调节为2.0,加入适量胃蛋白酶,使其质量分数为4%,摇动、恒温(37 ℃)反应2 h,沸水浴5 min。使用0.9 mol/L NaHCO3将溶液pH调节为5.0,再用1 mol/L NaOH将溶液pH调节为7.5,加入适量胰蛋白酶, 使其质量分数为4%,摇动、恒温(37 ℃) 反应2 h,沸水浴灭酶5 min,最后,取上清液进行后续试验。
1.3.4 ACE抑制活性测定
参考CUSHMAN等[14]的方法,采用分光光度法进行测定。5 mmol/L的HHL溶液与40 μL ACE 抑制肽混合(缓冲溶液作为空白样品),37 ℃水浴预热53 min后,加入0.1 U/mL ACE溶液20 μL,继续37 ℃水浴反应30 min。随后加入1 mol/L HCl溶液100 μL终止反应。将各试剂依次加入5 mL离心管中并混匀,待反应结束后,加入1.7 mL乙酸乙酯萃取马尿酸,经15 s振荡、混匀后离心(4 000 r/min,15 min,4 ℃),吸取1.0 mL乙酸乙酯层于小试管中,放在100 ℃水浴锅中15 min,之后加入3 mL去离子水于试管中,228 nm处测定吸光度,按公式(1)计算:
ACE抑制率![]()
(1)
式中:A,反应中ACE抑制肽与ACE同时存在的吸光度值;B,反应中没有ACE抑制肽的吸光度值;C,反应中ACE和HHL空白反应的吸光度值。
1.3.5 采用LC-MS/MS进行多肽分析
色谱条件:Acclaim PepMap Rplc C18(1.9 μm×150 μm×150 mm)色谱柱;流动相A 0.1%(体积分数,下同)甲酸,2%乙腈;流动相B 0.1%甲酸,80%乙腈。梯度洗脱程序:0~8 min(6%~9%流动相B);8~24 min(9%~14%流动相B);24~60 min(14%~30%流动相B);60~75 min(30%~40%流动相B);75~78 min(40%~95%流动相B);流速600 nL/min。
质谱条件:一级质谱参数分辨率70 000;AGC目标3e6;一级最大注射时间40 ms;扫描范围m/z 300~1 600;二级质谱参数分辨率75 000;AGC目标1e5;一级最大注射时间60 ms。
1.4 数据分析
采用Microsoft Excel和SPSS 19.0进行作图和试验数据处理。如果方差分析差异显著,用Duncan法进行多重比较。质谱原始数据采用Maxquant(1.6.2.10)检索目标蛋白数据库。检索参数为可变修饰为N段乙酰化(N-acetyl)、甲硫氨酸氧化[Oxidation(M)];半胱氨酸固定化修饰为氨基甲酰化[Carbamidomethyl (C)];一级质谱误差为6 ppm;二级质谱误差为20 ppm;遗漏酶切位点为2;显著性阈值为0.01。
2 结果与分析
2.1 牦牛乳硬质干酪水性多肽体外消化前后ACE抑制活性比较
牦牛乳硬质干酪水溶性多肽经胃蛋白酶、胰蛋白酶降解前后的ACE抑制活性比较见图1。从图1可知,干酪经消化酶降解后,其ACE抑制率降低了13.06%,这说明消化酶对干酪水溶性多肽的ACE抑制活性具有一定影响。但是与消化前干酪水溶性多肽ACE抑制活性间无显著性差异(P>0.05),这表明干酪水溶性多肽经胃蛋白酶、胰蛋白酶作用后,其ACE抑制活性基本保持稳定。
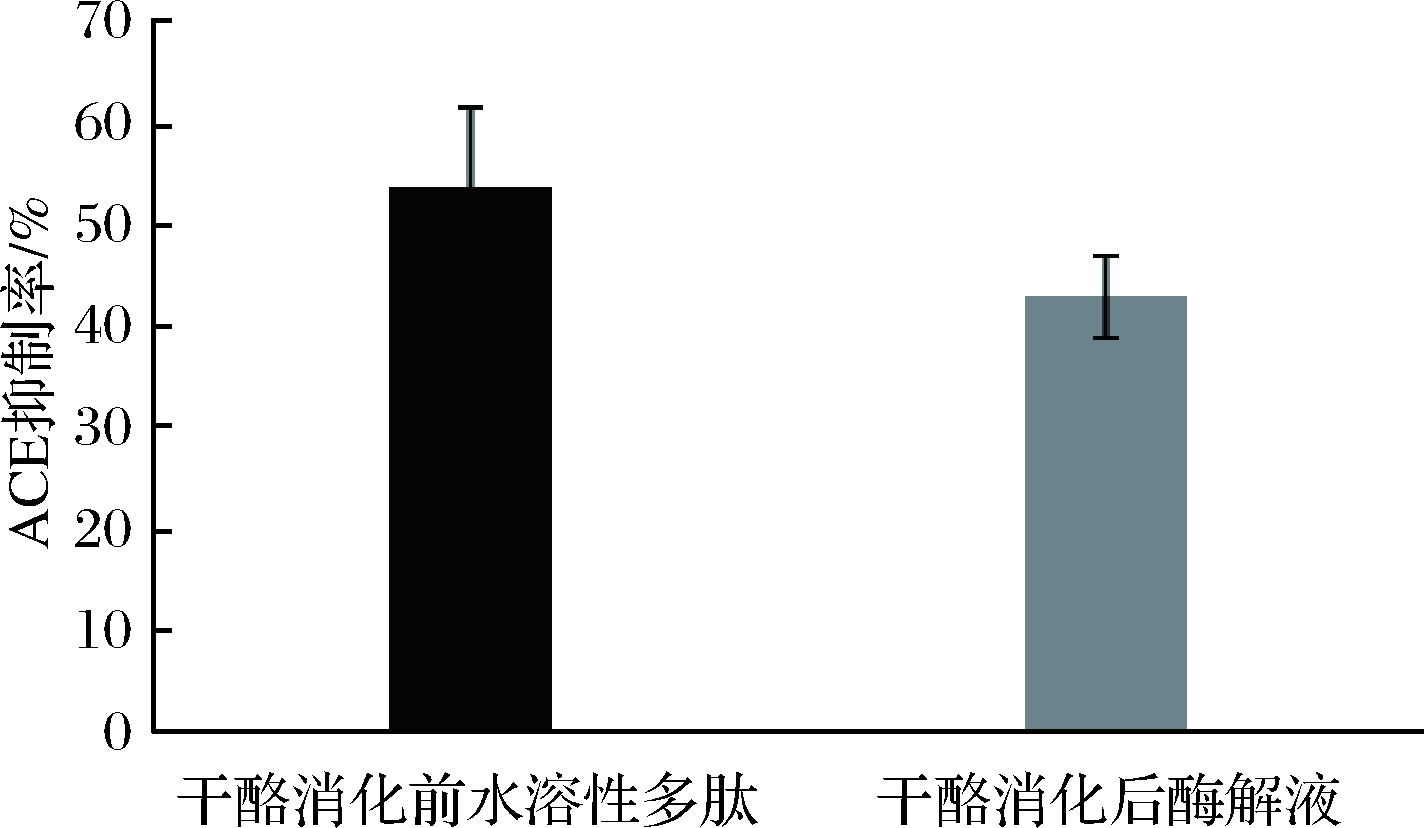
图1 牦牛乳硬质干酪水溶性多肽体外消化前后ACE
抑制活性比较
Fig.1 Comparison of the ACE-inhibitory activity of water-
soluble extract of hard cheese made from yak milk and
in vitro digest
2.2 牦牛乳硬质干酪水溶性多肽体外消化前后质谱分析
为了确定牦牛乳硬质干酪体外消化前后,对ACE起抑制作用的多肽,本试验采用毛细管液相色谱结合Quadrupole-Orbitrap质谱仪对干酪中水溶性多肽和消化酶降解物进行了分离、鉴定(总离子流色谱原图见增强出版)。
牦牛乳硬质干酪水溶性多肽和其消化酶降解物较为复杂。通过Maxiquant 软件对所得质谱图与蛋白质数据库中蛋白质序列进行比对,肽段分数越高,肽段丰度越强,所得肽段越可靠。因此,依据多肽分值和丰度,鉴定出消化前后牦牛乳硬质干酪水溶性多肽分别为36和23种,具体结果见表1和表2。
从表1可知,牦牛乳硬质干酪中源自аs1-酪蛋白、аs2-酪蛋白、β-酪蛋白和κ-酪蛋白的多肽分别为8、2、25和1种,源自аs1-酪蛋白和β-酪蛋白的多肽占总肽数量的91.67%。多肽氨基酸残基数为7~25个,其中氨基酸残基数为7~13个的多肽占总肽数量的41.67%。另外,发现一些多肽如KEDVPSERYL、KEDVPSERYLG、KEDVPSERYLGY等[23]之间存在相互关系,这主要与干酪中作用于蛋白质的多样和复杂的蛋白质降解酶有关。
从表2可知,牦牛乳硬质干酪中源自аs1-酪蛋白、β-酪蛋白和κ-酪蛋白的多肽分别为4、18和1种,其中,源自аs1-酪蛋白和β-酪蛋白的多肽占总肽数量的95.65%。多肽氨基酸残基数为7~14个,氨基酸残基数为7~13个的多肽占总肽数量的95.83%。牦牛乳硬质干酪经消化酶作用后,其水溶性多肽中长链肽减少,短链肽增多。
表1 牦牛乳硬质干酪中水溶性多肽
Table 1 Water-soluble peptides of hard cheese made from yak milk

前体蛋白质分子质量/Da氨基酸个数肽序列肽片段具有ACE抑制活性的肽参考文献аs1-酪蛋白1 002.628KKYKVPQL117~124KKYNVPQL[9]2 143.0320SDIPNPIGSENSGKTTMPLW195~214KTTMPLW[15]2 055.9919DIPNPIGSENSGKTTMPLW196~214KTTMPLW[15]1 234.6210KEDVPSERYL98~107VPSERYL[9]1 291.6411KEDVPSERYLG98~108RYLG[16]1 454.7012KEDVPSERYLGY98~109RYLGY/VPSERYL[9,16]1 843.8618SDIPNPIGSENSGKTTMP195~2121 583.8014AQQKEPMIGVNQEL144~157аs2-酪蛋白1 278.6210TEEEKNRLNF169~1782 831.5725LYQGPIVLN-PWDQVKRNAVPITPTL114~138β-酪蛋白1 649.9515SKVLPVPQKAVPYPQ183~197SKVLPVPQ[17]1 081.6110SQSKVLPVPQ181~190SKVLPVPQ[17]2 461.3522SKVLPVPQKAVPYPQRDMPIQA183~204SKVLPVPQ[17]1 716.9916QEPVLGPVRGPFPIIV209~224RGPFPIIV/GPVRGPF[15,18]1 588.9315EPVLGPVRGPFPIIV210~224RGPFPIIV/GPVRGPF[15,18]866.528SKVLPVPQ183~190SKVLPVPQ[17]1 472.8213TDVENLHLPLPLL143~155LPLPLL[19]801.447KAVPYPQ191~1971 780.9916YQEPVLGPVRGPFPII208~223GPVRGPF[15]1 459.8914PVLGPVRGPFPIIV211~224RGPFPIIV/GPVRGPF[15,18]1 667.9015YQEPVLGPVRGPFPI208~222GPVRGPF[15]1 554.8214YQEPVLGPVRGPFP208~221GPVRGPF[15]1 617.9215QEPVLGPVRGPFPII209~223GPVRGPF/RGPFPIIV[15,18]1 562.9214KVLPVPQKAVPYPQ184~197VLPVPQ[20]1 612.8414KAVPYPQRDMPIQA191~2041 359.7412TDVENLHLPLPL143~154HLPLP[21]1 362.8413VLGPVRGPFPIIV212~224RGPFPIIV/GPVRGPF[15,18]2 676.4424SQSKV-LPVPQKAVPYPQRDMPIQA181~204SKVLPVPQ[17]1 865.0417SQSKVLPVPQKAVPYPQ181~197SKVLPVPQ[17]2 390.3121SKVLPVPQKAVPYPQRDMPIQ183~203SKVLPVPQ[17]2 605.4123SQSKVLPVPQKAVPYPQRDMPIQ181~203SKVLPVPQ[17]1 134.6611PVLGPVRGPFP211~221GPVRGPF[15]1 541.8013KAVPYPQRDMPIQ191~2031 391.7613QEPVLGPVRGPFP209~221GPVRGPF/VRGPFP[9,15]1 016.609HLPLPLLQS149~157HLPLP[21]κ-酪蛋白1 797.9115INNQFLPYPYYAKPA72~86LPYPYY/FLPYPYY[22]
注:空白处表示无相关结果或信息(下同)
表2 牦牛乳硬质干酪体外消化后水溶性多肽
Table 2 Water-soluble peptides of hard cheese made from yak milk after in vitro digestion
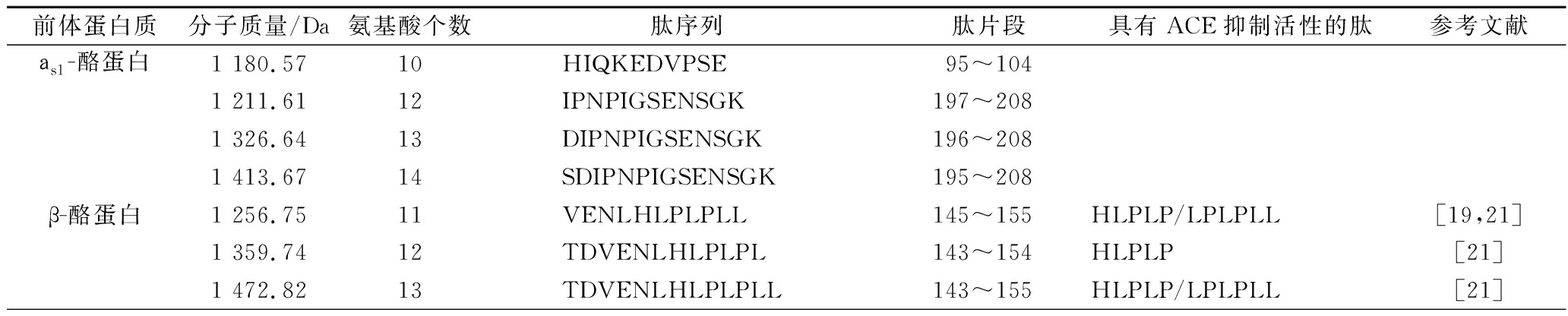
前体蛋白质分子质量/Da氨基酸个数肽序列肽片段具有ACE抑制活性的肽参考文献аs1-酪蛋白1 180.5710HIQKEDVPSE95~1041 211.6112IPNPIGSENSGK197~2081 326.6413DIPNPIGSENSGK196~2081 413.6714SDIPNPIGSENSGK195~208β-酪蛋白1 256.7511VENLHLPLPLL145~155HLPLP/LPLPLL[19,21]1 359.7412TDVENLHLPLPL143~154HLPLP[21]1 472.8213TDVENLHLPLPLL143~155HLPLP/LPLPLL[21]
续表2
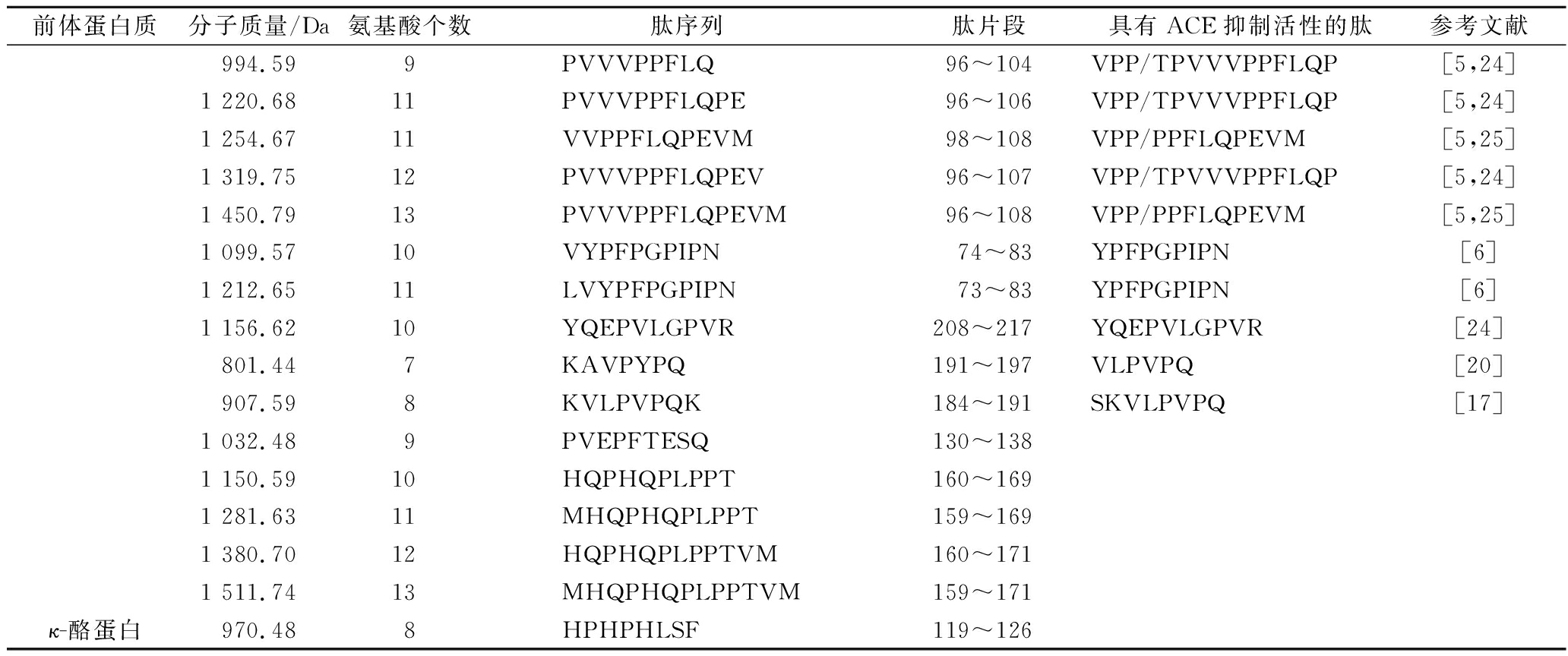
前体蛋白质分子质量/Da氨基酸个数肽序列肽片段具有ACE抑制活性的肽参考文献994.599PVVVPPFLQ96~104VPP/TPVVVPPFLQP[5,24]1 220.6811PVVVPPFLQPE96~106VPP/TPVVVPPFLQP[5,24]1 254.6711VVPPFLQPEVM98~108VPP/PPFLQPEVM[5,25]1 319.7512PVVVPPFLQPEV96~107VPP/TPVVVPPFLQP[5,24]1 450.7913PVVVPPFLQPEVM96~108VPP/PPFLQPEVM[5,25]1 099.5710VYPFPGPIPN74~83YPFPGPIPN[6]1 212.6511LVYPFPGPIPN73~83YPFPGPIPN[6]1 156.6210YQEPVLGPVR208~217YQEPVLGPVR[24]801.447KAVPYPQ191~197VLPVPQ[20]907.598KVLPVPQK184~191SKVLPVPQ[17]1 032.489PVEPFTESQ130~1381 150.5910HQPHQPLPPT160~1691 281.6311MHQPHQPLPPT159~1691 380.7012HQPHQPLPPTVM160~1711 511.7413MHQPHQPLPPTVM159~171κ-酪蛋白970.488HPHPHLSF119~126
ACE抑制肽是ACE的竞争性底物,其多肽结构和ACE活性相互关系显示,其C-末端含有疏水性氨基酸残基时,更倾向与ACE的催化位点结合。结合表1和表2,干酪中25种多肽C-末端含有疏水性氨基酸如脯氨酸(Pro)、缬氨酸(Val)、亮氨酸(Leu)、异亮氨酸(Ile)和芳香族氨基酸如色氨酸(Trp)等。干酪消化后14种多肽C-末端含有疏水性氨基酸如Leu、甲硫氨酸(Met)、苯丙氨酸(Phe)和碱性氨基酸如赖氨酸(Lys)和精氨酸(Arg)等。更为重要的是,干酪消化前后与已报道的ACE抑制肽具有一定同源性的多肽分别为29和13种,分别占总肽数量的80.56%和56.52%,这说明牦牛乳硬质干酪的水溶性多肽和消化酶降解物中存在较多ACE抑制肽。ACE抑制肽C-末端三肽的氨基酸组成对抑制ACE活性影响最大[16],进一步分析发现,消化前后牦牛乳硬质干酪水溶性多肽C-末端三肽的序列与已确定ACE抑制肽相同的分别占总肽数量的36.11%和30.43%,这些多肽有助于消化前后干酪对ACE的抑制作用。
2.3 牦牛乳硬质干酪体外消化前后ACE抑制肽质谱分析
依据ACE抑制肽C-末端特征、肽链长度以及文献所报道的ACE抑制肽,牦牛乳硬质干酪体外消化前后共鉴定出ACE抑制肽分别为15、12种,详细ACE抑制肽序列和特征见表3。
从表3可知,牦牛乳硬质干酪体外消化前后ACE抑制肽主要源自β-酪蛋白,相同ACE抑制肽3种,大多数ACE抑制肽由8~12个氨基酸组成,分子质量在800~1 500 Da。ACE抑制肽一般含有2~12个氨基酸残基[26],因此,大多数ACE抑制肽链长度在此范围内。多肽C-末端三肽氨基酸分别为疏水性氨基酸如酪氨酸(Tyr)、Phe、Trp、丙氨酸(Ala)、Ile、Leu、Val和 Met或者带正电的氨基酸如Arg、Lys以及Pro时,该肽能很好地与ACE结合[27],如干酪消化前后的PVLGPVRGPFP、TDVENLHLPLPL、TDVENLHLPLPLL、VENLHLPLPLL、KEDVPSERYL、QEPVLGPVRGPFP、VLGPVRGPFPIIV、PVLGPVRGPFPIIV、YQEPVLGPVRGPFPI、YQEPVLGPVR等的C-末端三肽氨基酸具有以上特征。源自牦牛乳酪蛋白降解物LPLPLL具有ACE抑制活性,其半抑制浓度(half inhibitory concentration,IC50)为10.46 μmol/L[19],而TDVENLHLPLPLL、VENLHLPLPLL的C-端共享了此部分序列。
ACE抑制肽的C-端氨基酸组成对其发挥ACE抑制作用具有重要影响。消化前牦牛乳硬质干酪中源自β-酪蛋白的PVLGPVRGPFP、YQEPVLGPVRGPFP、QEPVLGPVRGPFP和KEDVPSERYLGY的C-末端为Pro或Tyr,该结构易于和ACE结合。干酪中KEDVPSERYL、KEDVPSERYLG、KKYKVPQL与已报道ACE抑制肽VPSERYL、KKYNVPQL(IC50为77.1 μmol/L)[9]存在相同片段。牦牛乳硬质干酪中VLGPVRGPFPIIV、PVLGPVRGPFPIIV与Cheddar干酪中ACE抑制肽YQEPVLGPVRGPFPIIV[5]以及干酪中SQSKVLPVPQ与SKVLPVPQ在多肽C-末端具有高度相似性,而SKVLPVPQ(IC50为39 μmol/L)已证实具有较强ACE抑制活性[17]。干酪中YQEPVLGPVRGPFPI和QEPVLGPVRGPFP已报道具有ACE抑制活性[6,9,28]。
表3 牦牛乳硬质干酪中体外消化前后ACE抑制肽
Table 3 ACE-inhibitory peptides from hard cheese made from yak milk before and after simulated
gastro-intestinal digestion.
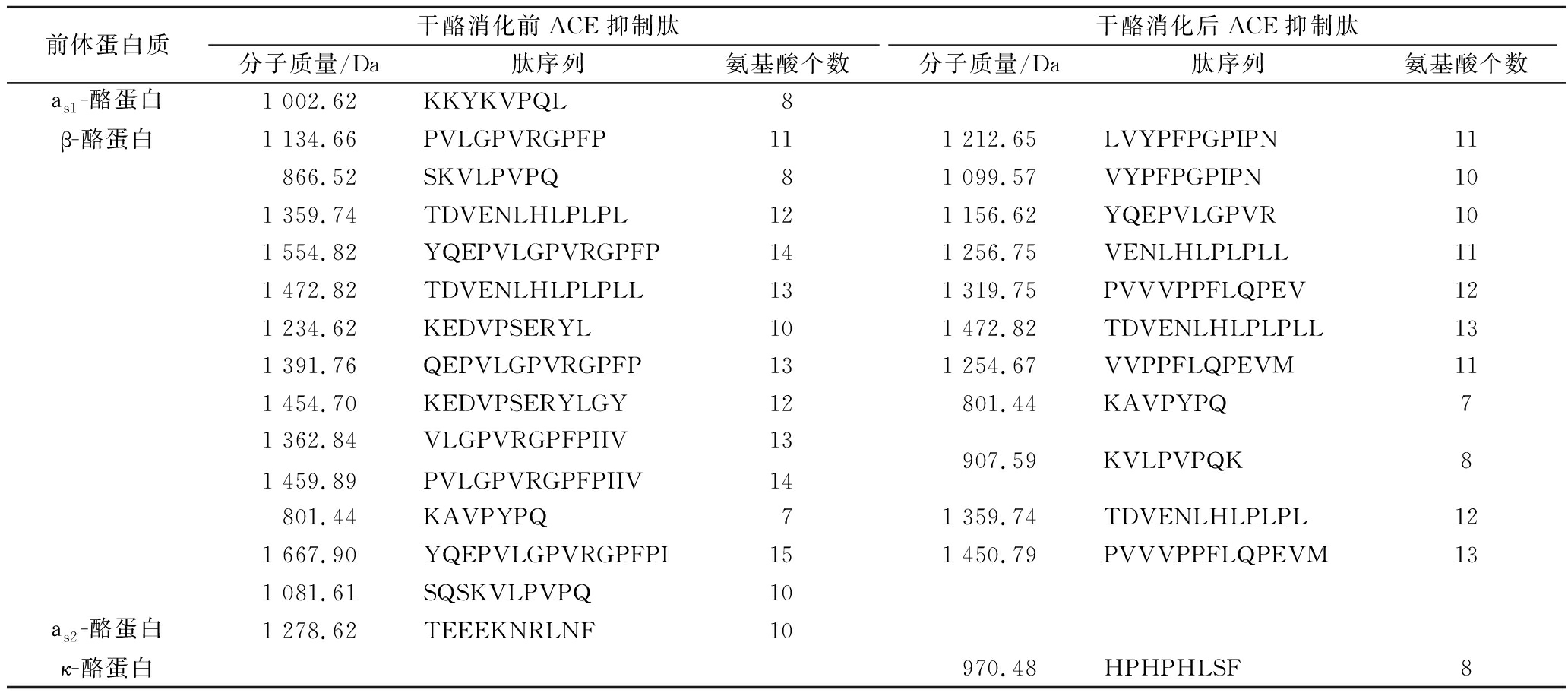
前体蛋白质干酪消化前ACE抑制肽干酪消化后ACE抑制肽分子质量/Da肽序列氨基酸个数分子质量/Da肽序列氨基酸个数аs1-酪蛋白1 002.62KKYKVPQL8β-酪蛋白1 134.66PVLGPVRGPFP111 212.65LVYPFPGPIPN11866.52SKVLPVPQ81 099.57VYPFPGPIPN101 359.74TDVENLHLPLPL121 156.62YQEPVLGPVR101 554.82YQEPVLGPVRGPFP141 256.75VENLHLPLPLL111 472.82TDVENLHLPLPLL131 319.75PVVVPPFLQPEV121 234.62KEDVPSERYL101 472.82TDVENLHLPLPLL131 391.76QEPVLGPVRGPFP131 254.67VVPPFLQPEVM111 454.70KEDVPSERYLGY12801.44KAVPYPQ71 362.841 459.89VLGPVRGPFPIIVPVLGPVRGPFPIIV1314907.59KVLPVPQK8801.44KAVPYPQ71 359.74TDVENLHLPLPL121 667.90YQEPVLGPVRGPFPI151 450.79PVVVPPFLQPEVM131 081.61SQSKVLPVPQ10аs2-酪蛋白1 278.62TEEEKNRLNF10κ-酪蛋白970.48HPHPHLSF8
牦牛乳硬质干酪消化后的LVYPFPGPIPN、VYPFPGPIPN是非常具有潜力的 ACE抑制肽,它们的抑制活性已分别在山羊乳Kefir[29]及源自β-酪蛋白消化酶产物中被证实[30]。Gouda干酪中发现的YPFPGPIPN[6]和源自牦牛乳酪蛋白的PFPGPIPN对ACE的IC50分别14.8和12.79 μmol/L[19],且YPFPGPIPN对随机高血压鼠具有降压作用[6],因此,消化后牦牛乳硬质干酪中的LVYPFPGPIPN、VYPFPGPIPN具有较强ACE抑制作用。多肽C-末端含有赖氨酸(K)时[31],该肽也具有抑制作用,如干酪消化后的源自β-酪蛋白的KVLPVPQK。干酪消化后的VVPPFLQPEVM、PVVVPPFLQPEVM与源自酸奶的PPFLQPEVM(IC50为34.63 μmol/L)[25] 共享了C-端氨基酸序列。另外,多肽N-端为脂肪族氨基酸如Ala、Val、Leu和Ile时,能有效与ACE结合[32]。因此,这些肽具有潜在ACE抑制活性。消化后牦牛乳硬质干酪中KVLPVPQK与发酵乳中ACE抑制肽KVLPVPQ、VLPVPQK高度共享了部分序列[20]。消化后干酪中YQEPVLGPVR已证实具有ACE抑制活性[24]。
综上所述,牦牛乳硬质干酪消化前后鉴定的大多数ACE抑制肽具备了抑制ACE活性的结构特征,干酪消化前后分别有10和8种ACE抑制肽与已报道ACE抑制肽共享了C-末端三肽氨基酸特征,干酪中SKVLPVPQ、QEPVLGPVRGPFP、YQEPVLGPVRGPFPI和干酪消化后LVYPFPGPIPN、VYPFPGPIPN、YQEPVLGPVR已确定具有ACE抑制活性。
3 讨论
成熟短期到中长期干酪中水溶性提取物具有较强ACE抑制作用[33],但是干酪水溶性提取物中ACE-I抑制肽经胃肠蛋白质酶降解后[7],其潜在作用将发生变化。为此,结合前期试验,本试验以15 ℃成熟6个月的牦牛乳硬质干酪中水溶性多肽为研究对象,发现牦牛乳硬质干酪中1种ACE抑制肽源自аs1-酪蛋白,13种源自β-酪蛋白,1种源自аs2-酪蛋白,经胃蛋白酶、胰蛋白酶消化后,11种ACE抑制肽源自β-酪蛋白,1种源自κ-酪蛋白。GOMEZ-RUIZ等[34]利用高效液相色谱-质谱串联技术在不同西班牙干酪中鉴定出ACE抑制肽41种,且大部分来自β-酪蛋白和аs1-酪蛋白。酪蛋白含有丰富的脯氨酸,乳酸菌拥有特异性脯氨酸肽酶,因此,干酪中ACE抑制肽主要来源于β-酪蛋白和аs1-酪蛋白[33]。
牦牛乳硬质干酪中ACE抑制肽为其具有ACE抑制活性提供了可能。但是,不同ACE抑制肽在胃肠液中的存在能力不同[9]。胃蛋白酶特异性较低,主要水解多肽氨基端或羧基端为芳香族氨基酸或者疏水性氨基酸,而胰蛋白酶特异性酶切位点主要倾向于碱性氨基酸如Arg或者Lys。干酪中YQEPVLGPVRGPFP、YQEPVLGPVRGPFPI、YQEPVLGPVRGPFPII经消化酶作用后,转化为YQEPVLGPVR。干酪中KVLPVPQKAVPYPQ、SKVLPVPQKAVPYPQ、SKVLPVPQKAVPYPQRDMPIQ、SQSKVLPVPQKAVPYPQ、SQSKVLPVPQKAVPYPQRDMPIQ等转化为KVLPVPQK,这说明牦牛乳硬质干酪中ACE抑制肽,甚至活性较弱或者没有活性的多肽经胃胰蛋白酶消化后能够转化为其他ACE抑制肽。B. bifidum MF 20/5发酵乳中LVYPFP经胃蛋白酶水解后,也产生了具有更强ACE抑制活性的多肽[35]。
牦牛硬质干酪中ACE抑制肽15种,经消化酶降解后,干酪中ACE抑制肽变为12种,且大多数ACE抑制肽种类不同。这说明,消化酶对干酪中ACE抑制肽种类有影响。STUKNYTE等对比了不同干酪中的8种ACE抑制肽,研究发现,经体外胃肠消化后,Cheddar、Gorgonzola、Maasdam、Grana Padano等干酪中只存在VPP、IPP、HLPLP、LHLPLP等4种ACE抑制肽[36]。Emmental 干酪中具有ACE-I活性的多肽经胃蛋白酶和胰蛋白水解后,ACE抑制活性分别降低了(33±13)%和(32±13)%[7]。本试验发现牦牛乳硬质干酪经体外消化后其ACE抑制活性与消化前无显著性差异。一方面,可能与牦牛乳硬质干酪消化后活性较强ACE抑制肽的生成量有关;另一方面,也可能存在干酪消化后ACE抑制肽的协同效应,因此,还需要进一步对牦牛乳硬质干酪消化前后ACE抑制活性强的多肽进行深入研究。
4 结论
牦牛乳硬质干酪鉴定出ACE抑制肽15种,经胃蛋白酶、胰蛋白酶降解后,ACE抑制肽为12种。大多数ACE抑制肽源自β-酪蛋白,分子质量为 800~1 500 Da。相同ACE抑制肽3种,大多数ACE抑制肽不同。通过详细对ACE抑制肽氨基酸组成分析,发现干酪体外消化前后的大多数ACE抑制肽具备抑制ACE活性的结构特征,干酪消化前后分别有10和8种ACE抑制肽与已报道ACE抑制肽共享了其C-末端的三肽氨基酸,它们是潜在ACE抑制肽。其中,干酪中SKVLPVPQ、QEPVLGPVRGPFP、YQEPVLGPVRGPFPI和干酪消化后LVYPFPGPIPN、VYPFPGPIPN、YQEPVLGPVR确定具有ACE抑制活性。干酪水溶性多肽与其经胃蛋白酶和胰蛋白酶降解的酶解物的ACE抑制活性间无显著性差异(P>0.05),这为开发具有保健功能特性的牦牛乳硬质干酪提供了理论依据。
[1] KUMAR N,YIN C.The anti-inflammatory peptide Ac-SDKP: Synthesis,role in ACE inhibition,and its therapeutic potential in hypertension and cardiovascular diseases[J].Pharmacological Research,2018,134:268-279.
[2] SEPPO L,JAUHIAINEN T,POUSSA T,et al. A fermented milk high in bioactive peptides has a blood pressure-lowering effect in hypertensive subjects[J]. The American Journal of Clinical Nutrition,2003,77(2):326-330.
[3] JIA J,MA H,ZHAO W,et al. The use of ultrasound for enzymatic preparation of ACE-inhibitory peptides from wheat germ protein[J].Food Chemistry,2009,119(1):336-342.
[4] JANG A,LEE M. Purification and identification of angiotensin converting enzyme inhibitory peptides from beef hydrolysates[J]. Meat Science,2004,69(4):653-661.
[5] ONG L,HENRIKSSON A,SHAH NP. Angiotensin converting enzyme-inhibitory activity in Cheddar cheeses made with the addition of probiotic Lactobacillus casei sp.[J]. Le Lait, 2007,87(2): 149-165.
[6] SAITOT,NAKAMURA T,KITAZAWA H,et al.Isolation and structural analysis of antihypertensive peptides that exist naturally in Gouda cheese[J]. J Dairy Sci,2000,83(7):1 434-1 440.
[7] PARROT S,DEGRAEVE P,CURIA C,et al. In vitro study on digestion of peptides in Emmental cheese: analytical evaluation and influence on angiotensin I converting enzyme inhibitory peptides[J]. Die Nahrung,2003,47(2):87-94.
[8] G MEZ-RUIZ J A,RAMOS M,RECIO I.Identification and formation of angiotensin-converting enzyme-inhibitory peptides in Manchego cheese by high-performance liquid chromatography-tandem mass spectrometry[J].Journal of chromatography: A,2004,1 054(1-2):269-277.
MEZ-RUIZ J A,RAMOS M,RECIO I.Identification and formation of angiotensin-converting enzyme-inhibitory peptides in Manchego cheese by high-performance liquid chromatography-tandem mass spectrometry[J].Journal of chromatography: A,2004,1 054(1-2):269-277.
[9] NAKAMURA Y,YAMAMOTO N,SAKAI K,et al. Antihypertensive effect of sour milk and peptides isolated from it that are inhibitors to angiotensin I-converting enzyme [J]. Journal of Dairy Science,1995,78(6):1 253-1 257.
[10] 宋雪梅,梁琪,张炎,等. 成熟温度和时间对牦牛乳硬质干酪中生物活性肽的影响[J].中国酿造,2019,38(7):60-64.
[11] 刘兴龙,甘伯中,李帆,等. 白牦牛乳硬质干酪加工工艺技术研究[J].食品科学,2009,30(14):94-98.
[12] RIZZELLO C G,LOSITO I,GOBBETTI M,et al. Antibacterial activities of peptides from the water-soluble extracts of Italian cheese varieties[J]. Journal of Dairy Science,2005,88(7): 2 348-2 360.
[13] LO W M Y,LI-CHAN E C Y. Angiotensin I converting enzyme inhibitory peptides from in vitro pepsin-pancreatin digestion of soy protein[J]. Journal of Agriculture and Food Chemistry,2005,53(9):3 369-3 376.
[14] CUSHMAN D W,CHEUNG H S. Spectrophotometric assayand properties of the angiotensin-converting enzyme of rabbit lung[J].Biochemical Pharmacology,1971,20(7):1 637-1 648.
[15] HERN NDEZ-LEDESMAB,AMIGO L,RAMOS M,et al. Application of high-performance liquid chromatography-tandem mass spectrometry to the identification of biologically active peptides produced by milk fermentation and simulated gastrointestinal digestion[J]. Journal of Chromatography: A,2004,1 049(1-2):107-114.
NDEZ-LEDESMAB,AMIGO L,RAMOS M,et al. Application of high-performance liquid chromatography-tandem mass spectrometry to the identification of biologically active peptides produced by milk fermentation and simulated gastrointestinal digestion[J]. Journal of Chromatography: A,2004,1 049(1-2):107-114.
[16] CONTRERASM R,SANCHEZ D,SEVILLA M,et al. Resistance of casein-derived bioactive peptides to simulated gastrointestinal digestion[J]. International Dairy Journal,2013,32(2): 71-78.
[17] YAMAMOTO N,AKINO A,TAKANO T. Antihypertensive effect of the peptides derived from casein by an extracellular proteinase form Lactobacillus helveticus CP790[J]. Journal of Dairy Science,1994,77(4):917-922.
[18] COSTE M,ROCHET V,LEONILJ,et al. Identification of C-terminal peptides of bovine β-casein that enhance proliferation of rat lymphocytes[J]. Immunology Letters,1992,33(1): 41-46.
[19] LIN K,ZHANG L W,HAN X,et al. Novel angiotensin I-converting enzyme inhibitory peptides from protease hydrolysates of qula casein: Quantitative structure-activity relationship modeling and molecular docking study [J]. Journal of Functional Foods,2017,32: 266-277.
[20] HERN NDEZ-LEDESMA B,AMIGO L,RAMOS M,et al. Angiotensin converting enzyme inhibitory activity in commercial fermented products. Formation of peptides under simulated gastrointestinal digestion[J].Journal of Agricultural and Food Chemistry,2004,52(6): 1 504-1 510.
NDEZ-LEDESMA B,AMIGO L,RAMOS M,et al. Angiotensin converting enzyme inhibitory activity in commercial fermented products. Formation of peptides under simulated gastrointestinal digestion[J].Journal of Agricultural and Food Chemistry,2004,52(6): 1 504-1 510.
[21] HERN NDEZ-LEDESMA B,QUIR
NDEZ-LEDESMA B,QUIR S A,AMIGO L,et al. Identification of bioactive peptides after digestion of human milk and infant formula with pepsin and pancreatin[J].International Dairy Journal,2005,17(1): 42-49.
S A,AMIGO L,et al. Identification of bioactive peptides after digestion of human milk and infant formula with pepsin and pancreatin[J].International Dairy Journal,2005,17(1): 42-49.
[22] JIANG J,CHEN S,REN F,et al. Yak milk casein as a functional ingredient: preparation and identification of angiotensin-I-converting enzyme inhibitory peptides[J]. Journal of Dairy Research,2007,74(1):18-25.
[23] GUPTAA,MANNB,KUMAR R,et al. Antioxidant activity of cheddar cheeses at different stages of ripening[J]. International Journal of Dairy Technology,2009,62(3): 339-347.
[24] NONGONIERMAA B,FITZGERALD R J.Strategies for the discovery,identification and validation of milk protein-derived bioactive peptides[J]. Trends in Food Science & Technology,2016,50:26-43.
[25] JIN Y,YU Y,QI Y,et al. Peptide profiling and the bioactivity character of yogurt in the simulated gastrointestinal digestion [J]. Journal of Proteomics,2016,141:24-46.
[26] DASKAYA-DIKMEN C,YUCETEPE A,KARBANCIOGLU-GULER F,et al.Angiotensin-I-converting enzyme (ACE)-inhibitory peptides from plants(Review) [J]. Nutrients,2017,9(4):1-19.
[27] LOPEZ-FANDI O R,OTTE J,VAN CAMP J. Physiological,chemical and technological aspects of milk-protein-derived peptides with antihypertensive and ACE-inhibitory activity[J]. International Dairy Journal,2006,16(11):1 277-1 293.
O R,OTTE J,VAN CAMP J. Physiological,chemical and technological aspects of milk-protein-derived peptides with antihypertensive and ACE-inhibitory activity[J]. International Dairy Journal,2006,16(11):1 277-1 293.
[28] HAYES M,STANTON C,FITZGERALD G F,et al. Putting microbes to work: Dairy fermentation,cell factories and bioactive peptides. Part II: bioactive peptide functions[J]. Biotechnology Journal,2007,2(4):435-449.
[29] QUIR S A,HERN
S A,HERN NDEZ-LEDESMA B,RAMOS M,et al.Angiotensin-converting enzyme inhibitory activityof peptides derived from caprine kefir[J]. Journal of Dairy Science,2005,88(10):3 480-3 487.
NDEZ-LEDESMA B,RAMOS M,et al.Angiotensin-converting enzyme inhibitory activityof peptides derived from caprine kefir[J]. Journal of Dairy Science,2005,88(10):3 480-3 487.
[30] JINSMAA Y,YOSHIKAWA M. Enzymatic release of neocasomorphin and beta-casomorphin from bovine beta-casein[J]. Peptides,1999,20 (8):957-962.
[31] LI G,LE G,SHI Y. Angiotensin I-converting enzyme inhibitorypeptides derived from food proteins and their physiological and pharmacological effects[J]. Nutrition Research,2004,24(7):469-486.
[32] PAN S,WANG S,JING L,et al. Purification and Characterization of a novel angiotensin-I converting enzyme (ACE)-inhibitory peptide derived from enzymatic hydrolysate of enteromorpha clathrate protein[J]. Food Chemistry,2016,211:423-430.
[33] SIEBER R,BÜTIKOFER U,EGGER C,et al. ACE-inhibitory activity and ACE-inhibiting peptides in different cheese varieties[J]. Dairy Science & Technology,2010,90(1): 47-73.
[34] G MEZ-RUIZ J
MEZ-RUIZ J ,TABORDA G,AMIGO L,et al.Identification of ACE-inhibitory peptides in different Spanish cheeses by tandem mass spectrometry[J]. European Food Research and Technology,2006,223(5): 595-601.
,TABORDA G,AMIGO L,et al.Identification of ACE-inhibitory peptides in different Spanish cheeses by tandem mass spectrometry[J]. European Food Research and Technology,2006,223(5): 595-601.
[35] GONZALEZ-GONZALEZ C,GIBSON T,JAUREGI P. Novel probiotic-fermented milk with angiotensin I-converting enzyme inhibitory peptides produced by Bifidobacterium bifidum MF20/5[J].International Journal of Food Microbiology,2013,167(2):131-137.
[36] STUKNYTE M,CATTANEO S,MASOTTI F,et al. Occurrence and fate of ACE-inhibitor peptides in cheeses and in their digestates following in vitro static gastrointestinal digestion[J].Food Chemistry,2015,168:27-33.