黄曲霉毒素(aflatoxin,AFT)是一类毒性很强的真菌毒素,它主要是黄曲霉(Aspergillus flavus)和寄生曲霉(Aspergillus parasiticus)次级代谢产生的二氢呋喃氧杂萘邻酮衍生物,其致癌性来源是香豆素结构,毒性来源是二氢呋喃环结构[1]。黄曲霉毒素B1(aflatoxin B1,AFB1)是已发现的AFT中毒性及致癌性最强的,1993年国际癌症研究机构(International Agency for Research on Cancer,IARC)将AFB1划分为I类致癌物。AFB1对人畜有很强的致癌、致突变、致畸性,对肝脏及免疫系统有强抑制性[2-3]。目前对AFB1有效的脱毒方式有物理、化学、生物和基因干预4种方式。物理、化学、基因干预等方法会产生有毒副产物或改变物质原有性状,破坏食品品质[4-6]。生物脱毒法可以有效地去除AFB1,其有很强的特异性。
生物AFB1脱毒法主要有抑制、吸附、降解3种模式[7-9]。目前,3种生物脱毒模式各有利弊,生物抑制法能从根本上抑制AFB1产生,但是存在菌株筛选困难、难保持菌株活性和菌株食品安全、工业化大规模应用技术瓶颈等问题。生物降解法存在可降解AFB1的大分子活性物质难分离纯化、降解后产物难与食品分离等问题,但优点是可以永久去除![]() 生物吸附法多采用乳酸菌、酵母菌吸附AFB1毒素,这2种菌对人及动物消化系统更安全,并且菌株-毒素复合物易通过离心、过滤去除。菌株吸附能力取决于吸附毒素功能性结构,吸附通过非共价键结合且过程可逆,吸附条件改变,存在解吸现象。吸附稳定性由菌株特异性决定,具有个体差异[11]。本研究为工业化大规模应用菌株直投式菌剂吸附去除AFB1筛选吸附率高、稳定性好的优势菌株。
生物吸附法多采用乳酸菌、酵母菌吸附AFB1毒素,这2种菌对人及动物消化系统更安全,并且菌株-毒素复合物易通过离心、过滤去除。菌株吸附能力取决于吸附毒素功能性结构,吸附通过非共价键结合且过程可逆,吸附条件改变,存在解吸现象。吸附稳定性由菌株特异性决定,具有个体差异[11]。本研究为工业化大规模应用菌株直投式菌剂吸附去除AFB1筛选吸附率高、稳定性好的优势菌株。
TAHEUR等[12]从开菲尔培养物中分离出对AFB1吸附和生物转化能力强的乳酸杆菌,当pH值为4.8时,其在牛奶中能吸附82%的AFB1,在解吸实验后仍能吸附65%的AFB1。黄丽[13]从中国传统乳制品中分离出1株植物乳杆菌,吸附率为59.44%,解吸后保留20.66%的吸附率。本实验从西北酸菜中分离出AFB1脱毒菌株,丰富AFB1脱毒菌株种类,研究菌株吸附稳定性,体外模拟胃液消化,探究菌株-AFB1复合体代谢过程稳定性。
1 材料与方法
1.1 实验材料
1.1.1 菌株来源
2019年7月~8月采集甘肃兰州、天水、白银、定西等地市售西北酸菜样品,实验室前期研究西北酸菜发酵主导菌株为乳酸菌、酵母菌。CARLOS等[14]研究发现,乳酸菌对AFB1具有吸附能力,可以使AFB1脱毒;刘畅等[15]首次筛选出吸附率达81.16%的酿酒酵母Y1。试验从样品中分离纯化具有典型菌落特征的菌株,初步筛选西北酸菜中具有AFB1脱毒性能的菌株[16-17]。
1.1.2 主要试剂
(1)基础培养基
MRS培养基(CM188)、莫匹罗星锂盐(P-109)、半胱氨酸盐酸盐(P-03)、MC培养基(CM156)、磷酸盐缓冲液(CM1022)、乳酸杆菌生化鉴定套装(S021)、嗜热链球菌生化鉴定套装(S022)、营养琼脂培养基(CM107)、马铃薯葡萄糖琼脂培养基(CM123)、马铃薯-葡萄糖琼脂培养基(CM123A)、缓冲蛋白胨水(CM201),北京陆桥技术股份有限公司。
(2)基因提取、扩增试剂
DNA提取试剂盒、核酸多重PCR检测试剂盒,大连宝生物工程有限公司;核酸染料GS101-01,GELStain;AFB1标准品,TMstandard;二氯甲烷、甲醇、乙晴、苯、盐酸均为色谱纯、Sigma;NaCl(分析纯),科密欧。
(3)酶类
胃蛋白酶,Sigma,USA。
1.2 仪器设备
1300 SERLES A2-1379型生物安全柜,赛默白世尔(苏州)仪器有限公司;QTRAP 4500超高效液相色谱仪串联三重四级杆质谱联用仪,SCIEX;KH30R-II高速冷冻离心机,湖南凯达科学仪器有限公司;DJS-2016R全温度恒温摇床,上海世平实验设备有限公司;PTY-623电子天平,梅特勒-托利多仪器上海有限公司;PYC-16恒温培养箱,美国精骐有限公司;T100 PCR仪、PowerPac Basic电泳仪、GEL DOC XR+凝胶成像系统,BIO-RAD。
1.3 实验方法
1.3.1 AFB1脱毒菌株的初筛
AFB1-MRS溶液:将AFB1标准品用V(苯)∶V(乙晴)=96∶4的溶液稀释到目标浓度,加入MRS(pH 7.4)溶液中,75 ℃水浴加热20 min,蒸发溶液中苯-乙晴,制备质量浓度为10 ng/mL的AFB1-MRS溶液。
将具备典型菌落特征的菌株分离纯化,悬浮于磷酸盐缓冲液(phosphate buffer saline,PBS) (pH 7.4)中,制备成活菌浓度为109 CFU/mL的菌悬液,接种于质量浓度为10 ng/mL的AFB1-MRS溶液中,孵育72 h后,离心(12 000 r/min,15 min,4 ℃),收集上清液,对上清液中残留的AFB1含量用超高效液相色谱-三重四级杆串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)方法进行分析,测量菌株脱去毒素的效率。选择脱毒率最高的菌株进行下一步鉴定和脱毒机制研究。按公式(1)计算AFB1脱毒率:
(1)
式中:S,AFB1脱毒率,%;C,接种菌株孵育后样品中残留AFB1的峰面积;F,对照样品AFB1的峰面积。
1.3.2 样品前处理方法及UPLC-MS/MS测定方法条件
样品前处理方法:12 000 r/min离心15 min分离发酵液,上清液经0.22 μm滤膜过滤后过免疫亲和柱,用超纯水洗滤2遍,然后用甲醇洗脱,收集洗脱液。
UPLC-MS/MS方法条件:
液相色谱:C18柱(100 mm×2.1 mm,1.7 μm);柱箱温度:40 ℃;流动相(乙酸铵/甲醇)液相色谱梯度洗脱条件见表1[18]。
表1 液相色谱梯度洗脱条件
Table 1 Gradient elution conditions for liquid
chromatography
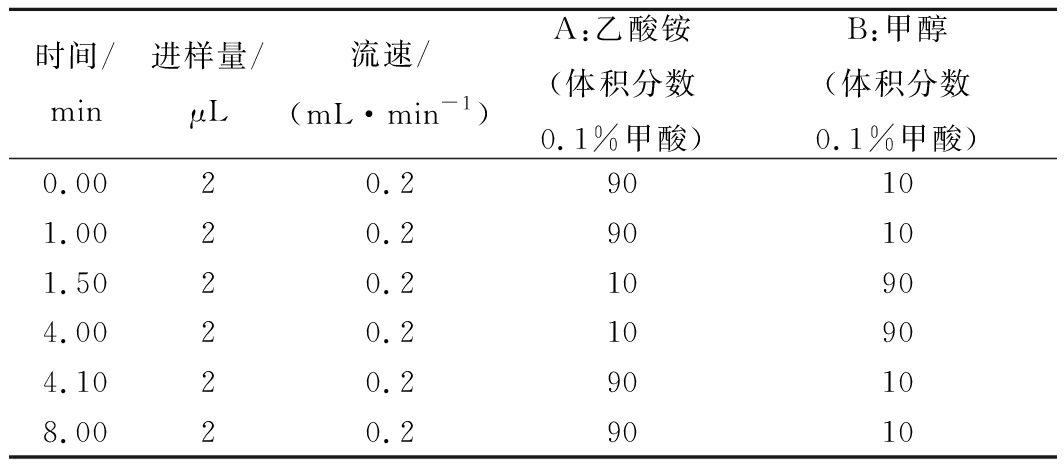
时间/min进样量/μL流速/(mL·min-1)A:乙酸铵(体积分数0.1%甲酸)B:甲醇(体积分数0.1%甲酸)0.0020.290101.0020.290101.5020.210904.0020.210904.1020.290108.0020.29010
质谱条件:电离方式:电喷雾电离(electrospray ionization,ESI+);检测方式:多反应监测模式(multiple reaction monitoring,MRM);气帘气(CUR):35 psi;碰撞气(CAD):medium;离子化电压(IS):5 500 V;离子源温度:550 ℃;喷雾气(GSI):55 psi;辅助加热器(GS2):60 psi。MRM参数见表2。
表2 AFB1的质谱检测条件
Table 2 Mass spectrum parameter of AFB1

目标物保留时间/min母离子(m/z)子离子(m/z)去簇电压碰撞能量AFB14.71313.0285.1*240.91401403149
注:*为定量离子对
1.3.3 制备热灭活菌
将活菌悬液样品在121 ℃高压湿热灭活20 min,灭菌物同时涂布MRS平板,36 ℃培养48 h作对照,验证灭菌效果。
1.3.4 菌株生长曲线
筛选菌株接种于MRS液体培养基中,36 ℃恒温振荡培养,每隔2 h测定菌株发酵液OD600值,以培养时间为横坐标,发酵液OD600值为纵坐标,绘制菌株生长曲线[19]。
1.4 高效脱毒菌株的鉴定
1.4.1 形态学鉴定
将1.3.1中筛选到的AFB1脱毒能力最强的菌株,活化2代后接种到营养琼脂培养基、MRS琼脂培养基,36 ℃培养48~72 h后,形成菌株单菌落,革兰氏染色后,油镜观察菌株形态。
1.4.2 菌株生理生化鉴定
依据《伯杰氏细菌鉴定手册》[20]、《常见细菌系统鉴定手册》[21],采用细菌生化鉴定试剂盒,对筛选出的菌株进行生理生化鉴定试验。
1.4.3 16S rRNA基因序列分析及构建系统发育树
依据细菌DNA提取试剂盒说明书提取目标菌株DNA,采用试剂盒提供通用引物27F(5′-AGACTATGATCGTCGCACTG-3′),1541R(5′-AAGGAGGTGTACCTGCC-3′)由大连宝生物工程有限公司PCR扩增试剂盒提供。PCR反应体系见表3。
表3 PCR反应体系条件
Table 3 PCR reaction system condition
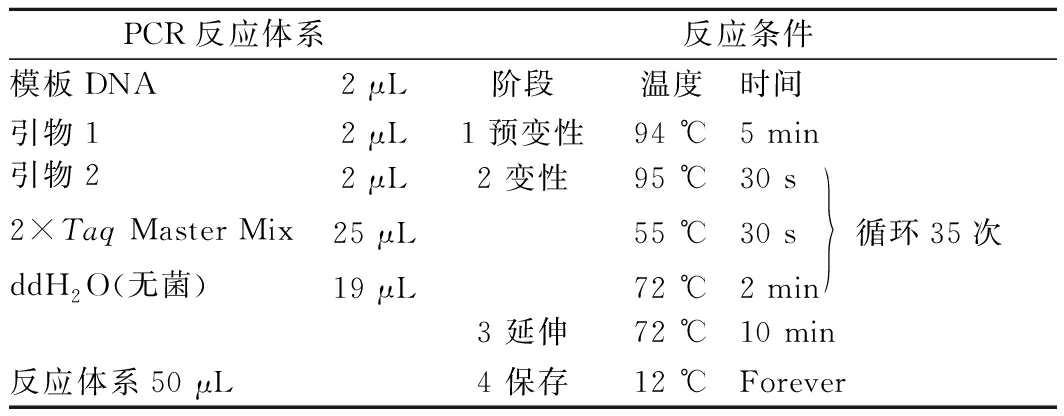
PCR反应体系反应条件模板DNA2 μL阶段温度时间引物12 μL1 预变性94 ℃5 min引物22×Taq Master MixddH2O(无菌)2 μL25 μL19 μL2 变性95 ℃55 ℃72 ℃30 s30 s2 min 循环35次3 延伸72 ℃10 min反应体系50 μL4 保存12 ℃Forever
将PCR产物送到上海生工生物有限公司测序,测序结果提交到NCBI进行BLAST分析,将目标序列与搜索到的同源序列在GenBank下载其模式菌株,用MEGA软件中的N-J法构建系统发育树。
1.5 菌株-AFB1复合体稳定性研究
根据HERNANDEZ-MENDOZA等[22]研究,多数乳酸菌、酵母菌对AFB1脱毒机制是利用细胞壁的某些成分吸附AFB1,形成菌体-AFB1复合体,起到脱毒的效果[23]。菌株吸附通过非共价键连接AFB1毒素,吸附稳定性由菌株特异性决定,试验通过PBS洗脱,体外模拟胃部消化环境,研究已筛选到的优势菌株吸附稳定性。
1.5.1 PBS洗脱对菌株吸附稳定性影响
将筛选到的菌株经脱毒试验,离心得到沉淀,重悬于等体积的PBS溶液(pH 7.4)中,30 ℃振荡20 min,5 000 r/min离心15 min,收集上清液,重复上述步骤6次,累积收集上清液,用UPLC-MS/MS法测定其中AFB1质量浓度。利用公式(2)计算菌株脱毒稳定性:
(2)
式中:M,菌株保留吸附率,%;ρ1,累积上清液中AFB1质量浓度,ng/mL;ρ2,初始菌株复合AFB1质量浓度,ng/mL。
1.5.2 模拟体外胃液消化对菌株吸附稳定性影响
将吸附率高的菌株脱毒试验后离心得到的沉淀,重悬于胃液模拟物(体积分数90%生理盐水、体积分数5% 3 mg/mL胃蛋白酶盐酸溶液、体积分数5% 0.1 mol/L HCl溶液)[24],36 ℃,200 r/min恒温振荡培养3 h,每隔0.5 h,累计收集上清液,用UPLC-MS/MS法测定其中AFB1含量。利用1.5.1公式(2)计算菌株脱毒稳定性。
1.6 数据统计分析
实验重复3次,实验结果表示为![]() 采用EXCEL软件中数据分析进行统计学分析,数据间的显著性差异分析采用单因素方差分析,显著性水平设定为P<0.05[25]。
采用EXCEL软件中数据分析进行统计学分析,数据间的显著性差异分析采用单因素方差分析,显著性水平设定为P<0.05[25]。
2 结果与分析
2.1 菌种的筛选
从35份西北酸菜样品中分离出37株具有菌落特征的菌株,初步筛选出20株具有AFB1脱毒能力的菌株。菌株脱毒效率在18.37%~65.06%,不同菌株对AFB1脱毒能力有差异。由表4可知,菌株C2、C6、L12、P25活菌脱毒能力略高于热灭活菌株;其余菌株热灭活菌株脱毒能力高于活菌株,菌株编号为L25-2、P6、P16、C26-1活菌株与热灭活菌株在脱毒率存在统计学显著差异(P<0.05)。编号为L34-2的菌株脱毒能力最强,活菌脱毒率为66.41%,热灭活菌株脱毒率为65.06%,选择L34-2菌株进行菌种鉴定和脱毒机制的进一步研究。
表4 菌株AFB1脱毒效率 单位:%
Table 4 Percentage of AFB1 detoxification to strains
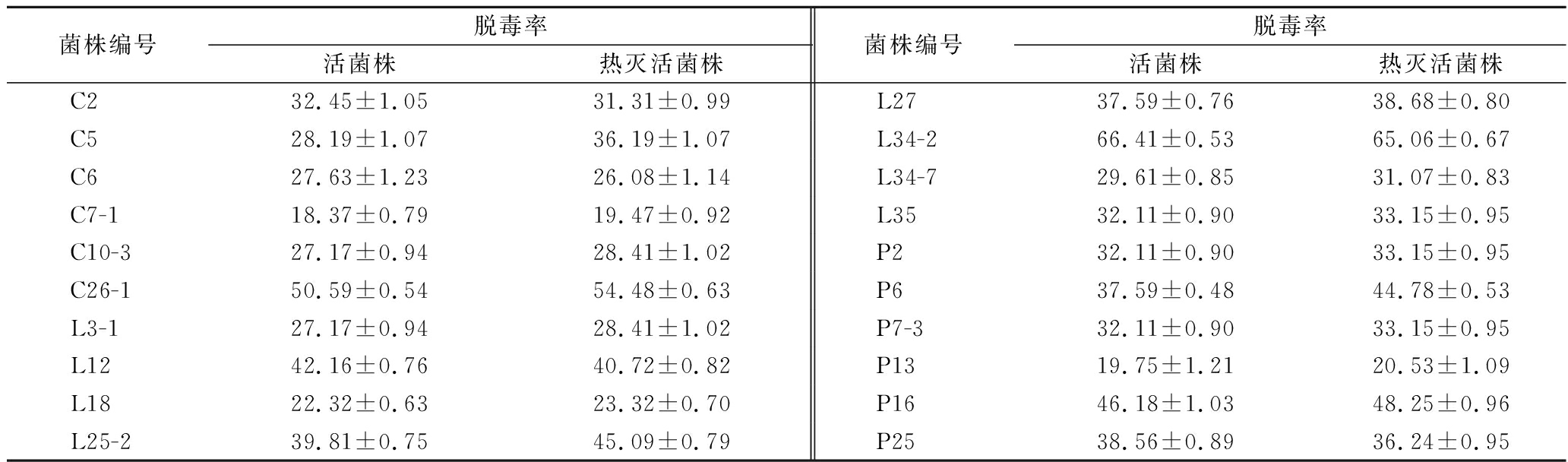
菌株编号脱毒率活菌株热灭活菌株菌株编号脱毒率活菌株热灭活菌株C232.45±1.0531.31±0.99L2737.59±0.7638.68±0.80C528.19±1.0736.19±1.07L34-266.41±0.5365.06±0.67C627.63±1.2326.08±1.14L34-729.61±0.8531.07±0.83C7-118.37±0.7919.47±0.92L3532.11±0.9033.15±0.95C10-327.17±0.9428.41±1.02P232.11±0.9033.15±0.95C26-150.59±0.5454.48±0.63P637.59±0.4844.78±0.53L3-127.17±0.9428.41±1.02P7-332.11±0.9033.15±0.95L1242.16±0.7640.72±0.82P1319.75±1.2120.53±1.09L1822.32±0.6323.32±0.70P1646.18±1.0348.25±0.96L25-239.81±0.7545.09±0.79P2538.56±0.8936.24±0.95
2.2 菌株形态学及生理生化鉴定
从35份西北酸菜样品中分离到1株活菌AFB1脱毒率为66.41%的菌株L34-2,菌落呈乳白色,表面光滑湿润,半透明,中央凸起,MRS平板培养有溶钙圈,菌落大小为0.2~0.6 mm、G+,细胞短杆状或短杆状,呈链状排列,无芽孢。菌株L34-2依据《乳酸细菌分类鉴定及实验方法》[26]、《伯杰细菌鉴定手册》[20]及《常见细菌系统鉴定手册》[21]进行生理生化鉴定,将L34-2菌株初步鉴定为乳酸杆菌。菌株形态学见图1,生理生化反应见表5。
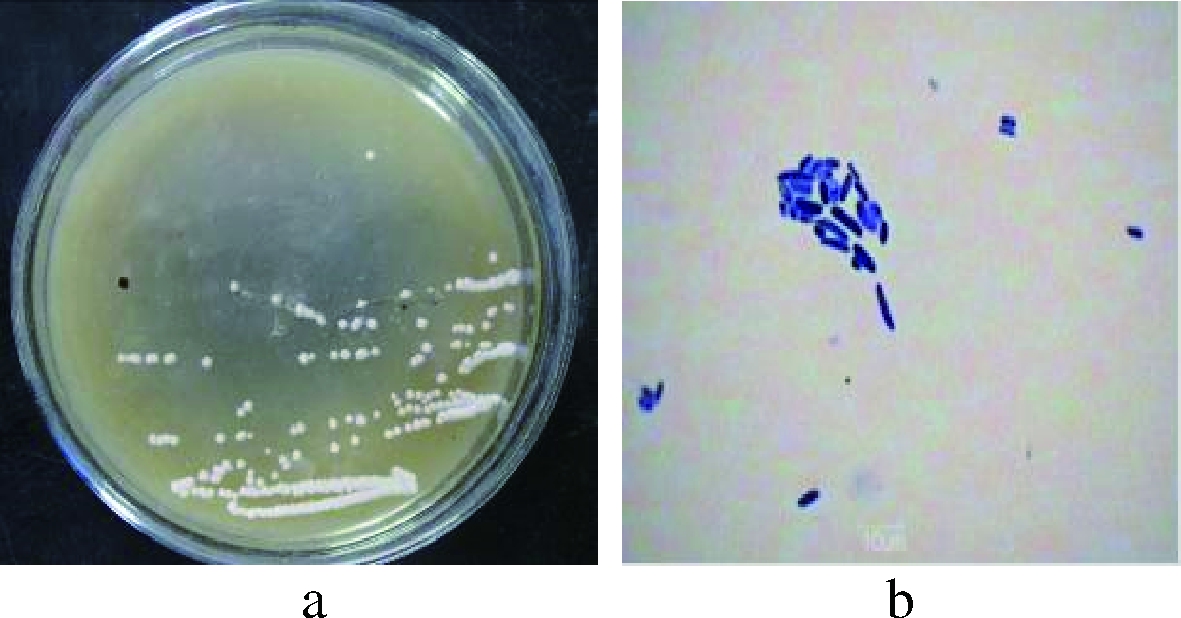
a-菌落形态;b-革兰氏染色菌株形态
图1 菌株L34-2形态学特征
Fig.1 Morphological properties of L34-2
表5 菌株L34-2生理生化特征
Table 5 Physiological and biochemical characteristics of
stain L34-2
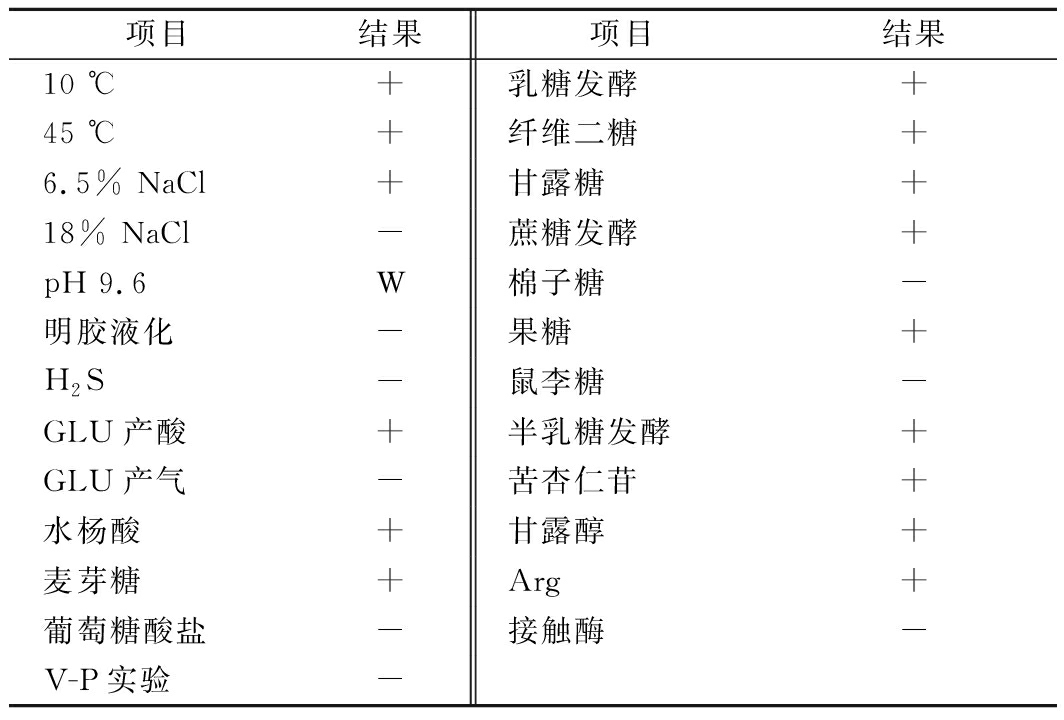
项目结果项目结果10 ℃+乳糖发酵+45 ℃+纤维二糖+6.5% NaCl+甘露糖+18% NaCl-蔗糖发酵+pH 9.6W棉子糖-明胶液化-果糖+H2S-鼠李糖-GLU产酸+半乳糖发酵+GLU产气-苦杏仁苷+水杨酸+甘露醇+麦芽糖+Arg+葡萄糖酸盐-接触酶-V-P实验-
注:“+”,阴性;“-”,阳性;“W”,不生长
2.3 菌株L34-2生长曲线
菌株36 ℃培养,0~2 h时,菌株处于生长延滞期,2~6 h处于生长对数期,8~20 h,菌株生长处于平衡期,20 h后菌株OD600值缓慢下降,见图2。
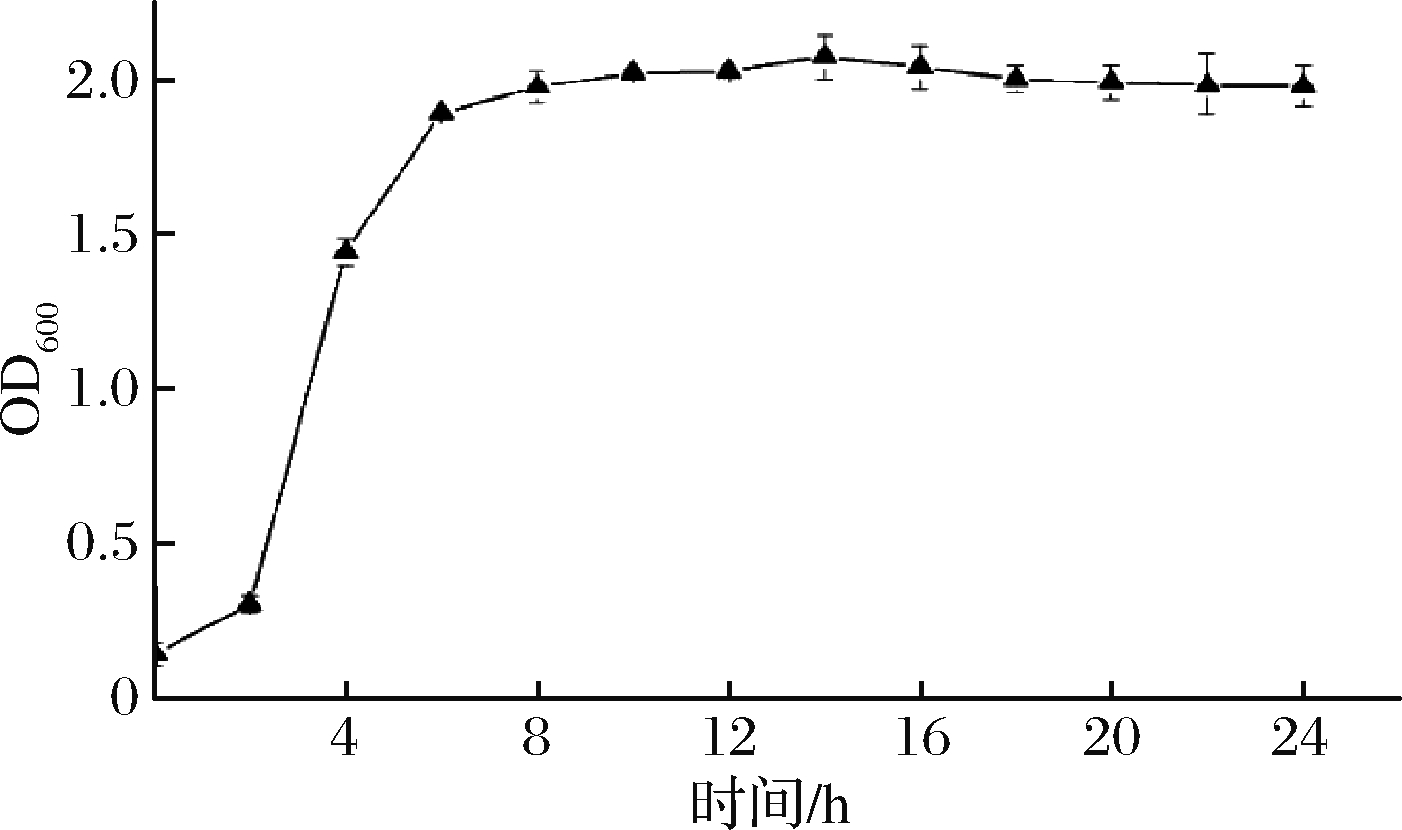
图2 菌株L34-2生长曲线(36 ℃)
Fig.2 Growth curve of L34-2
2.4 菌株16S rRNA基因序列分析及系统发育树构建
菌株16S rRNA基因序列经PCR扩增后,有1条长度大约1 500 bp左右的核苷酸片段被扩增出,如图3所示。
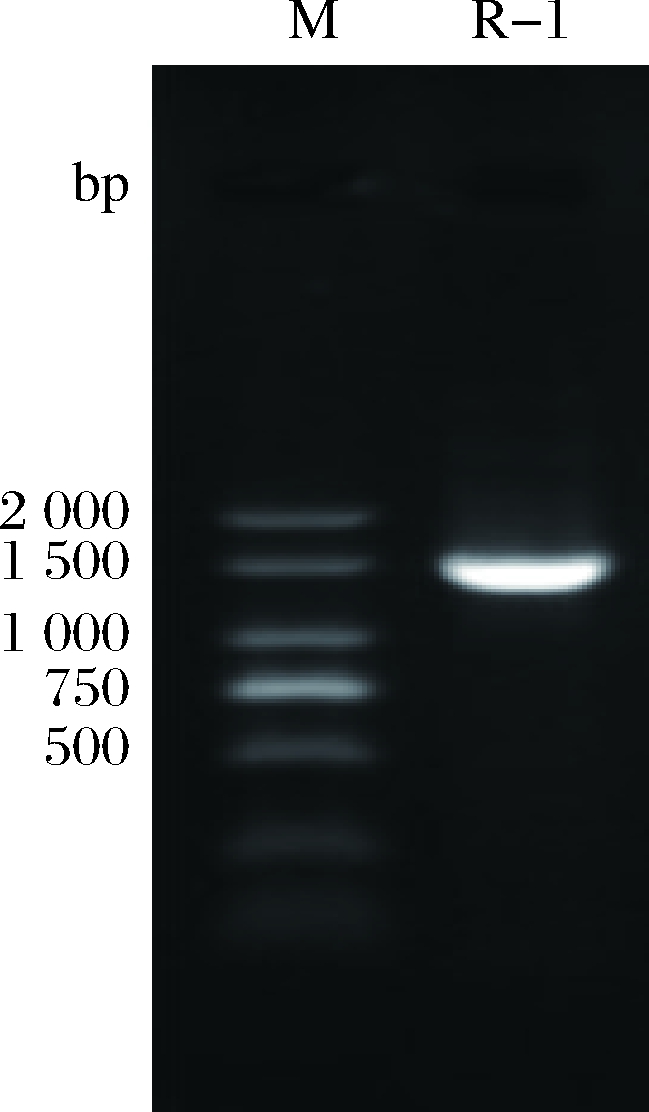
图3 L34-2菌株PCR 16S rRNA扩增产物
Fig.3 PCR amplification of 16S rRNA sequences
of strain L34-2
将PCR基因扩增片段分离纯化后测序。测序基因序列运用BLAST程序比对,在GenBank中下载与L34-2同源性较高的模式菌株。通过MEGA 7软件构建系统发育树,选用2%核苷酸置换率,用N-J法构建发育树,并用bootstrap进行1 000次重复支持率。系统发育树结果如图4所示,菌株L34-2与布氏乳杆菌(Lactobacillus buchneri)(登录号:FJ867641.1)相似度达到99%,结合L34-2菌株形态学特征、生理生化特点,鉴定L34-2菌株为布氏乳杆菌(Lactobacillus buchneri)。将L34-2基因序列提交GenBank数据库,注册号为:HM151332。
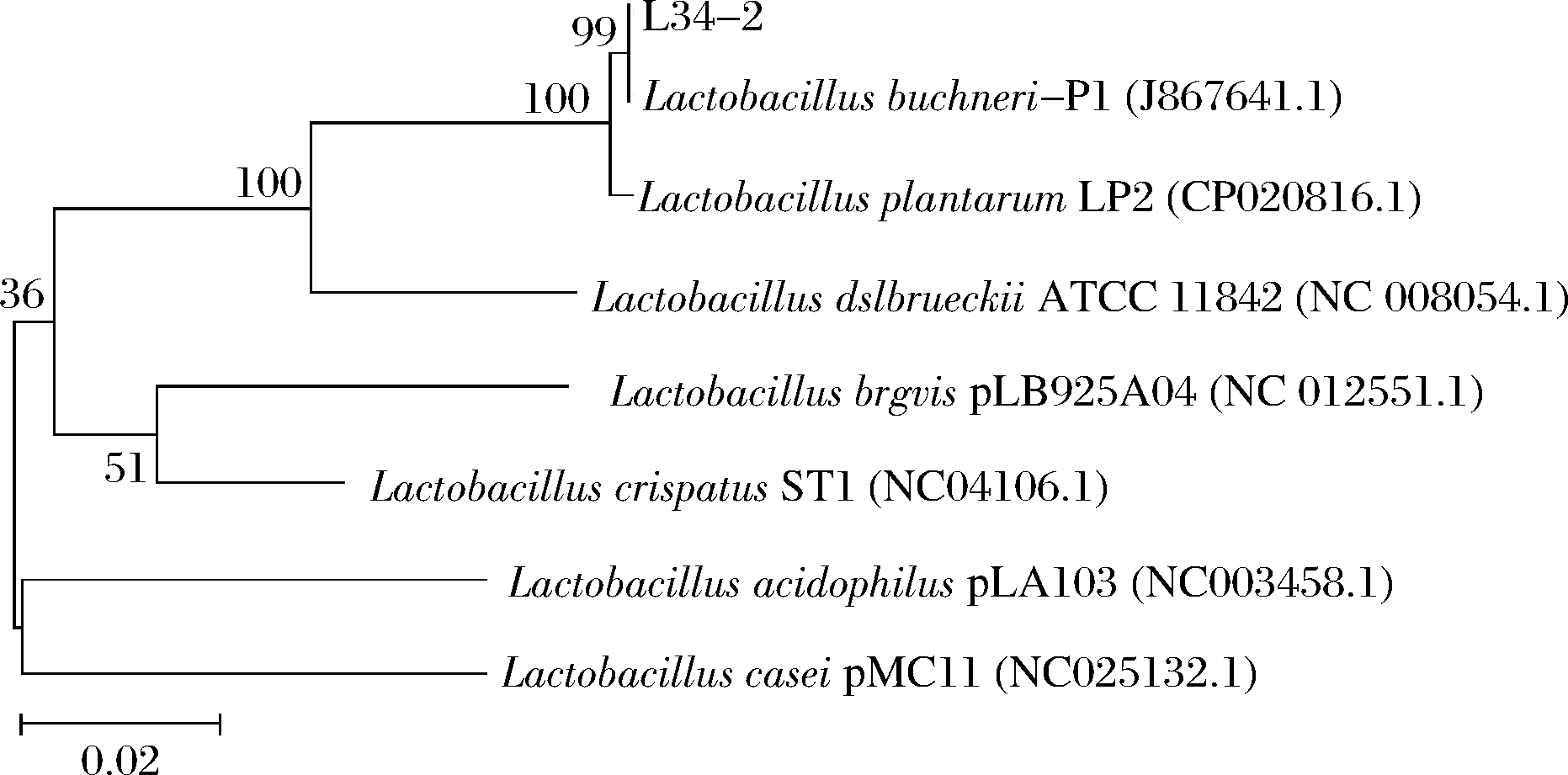
图4 菌株L34-2系统发育树
Fig.4 Phylogenetic tree of stain L34-2
2.5 菌株脱毒稳定性研究
2.5.1 PBS洗脱对菌株L34-2 AFB1脱毒稳定性研究
用PBS反复洗涤菌体-AFB1复合物,检测AFB1释放量,菌体洗脱后残留吸附AFB1含量评价菌种L34-2对AFB1吸附能力稳定性。由图5可知,第1次洗脱过程中,AFB1释放量最大,从初始吸附率66.4%降至60.1%;洗脱3次后,菌体-AFB1复合物吸附率保留54.5%,PBS洗脱6次后,吸附率保留53.7%。洗脱3和6次,菌体-AFB1复合物吸附率相似,单因素方差分析第3次及第6次洗脱后吸附率,两者没有统计学上的显著差异(P=0.06>0.05),如表6所示。洗脱3次后,复合物AFB1释放量趋于平衡,再洗脱只有微量的AFB1释放出来。布氏乳杆菌L34-2菌体吸附AFB1是一个可逆的过程,该菌株在洗脱6次后,仍保留较高的吸附率,吸附率为53.7%,菌体-AFB1复合物的稳定性取决于菌株自身的结合能力,具有菌株特异性,菌体L34-2吸附AFB1具有较好的稳定性。

图5 洗脱对AFB1吸附稳定性影响
Fig.5 Effect of elution on AFB1-strain complex
表6 洗脱次数单因素方差分析
Table 6 One factor analysis of variance for elution test
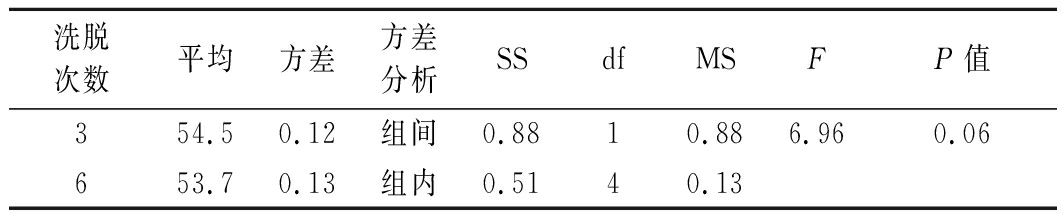
洗脱次数平均方差 方差分析SSdfMSFP值354.50.12组间0.8810.886.960.06653.70.13组内0.5140.13
2.5.2 体外模拟胃液消化对菌株吸附稳定性的影响
体外模拟胃液消化过程,研究动物消化过程对菌株-AFB1复合体稳定性的影响,评估复合体在食用后的食品安全性能。由图6可知,菌株L34-2-AFB1复合体模拟体外胃液消化0.5~1 h时,解吸出8%吸附的AFB1毒素,消化1.5 h时,菌株-AFB1复合体释放率最大,解吸出19.3%吸附的AFB1霉素。消化2~3 h,菌株-AFB1复合物释放量趋于稳定。根据单因素方差分析消化2与3 h后保留吸附率,两者没有统计学上的显著差异(P=0.07>0.05),如表7所示,说明复合体经胃液消化后,会有一定量AFB1被释放出来,但是仍有大部分菌株-AFB1复合体保持吸附,胃液消化2 h后,释放量趋于平衡,胃液消化3 h后,保留吸附率为45.9%,占初始吸附的69.1%。体外模拟胃液消化实验表明,菌株-AFB1复合体具有较好的稳定性。
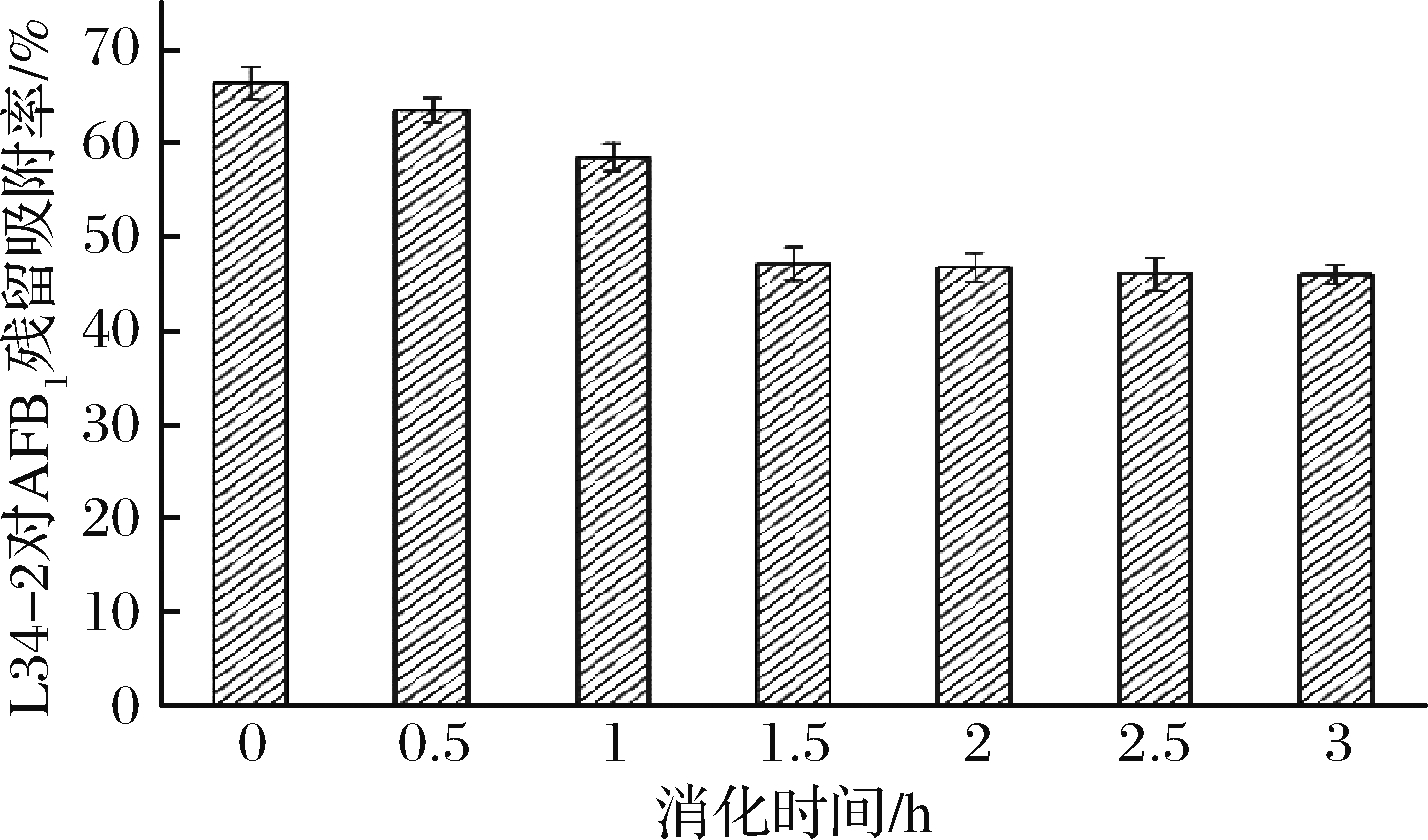
图6 胃液消化对AFB1吸附稳定性影响
Fig.6 Effect of gastric juice digestion on AFB1-strain complex
表7 消化时间单因素方差分析
Table 7 One factor analysis of variance for variance
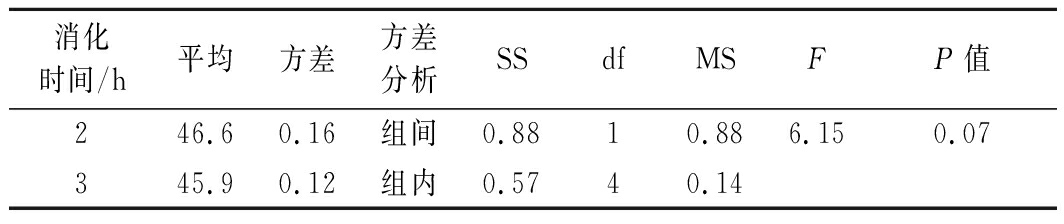
消化时间/h平均方差 方差分析SSdfMSFP值246.60.16组间0.8810.886.150.07345.90.12组内0.5740.14
3 结论与讨论
本研究从35份西北酸菜样品中筛选到1株活菌AFB1吸附率达66.41%的菌株L34-2,经形态学、生理生化及基因测序,鉴定为布氏乳杆菌(Lactobacillus buchneri)。菌株L34-2吸附稳定性研究结果表明,菌株吸附AFB1有较好的稳定性,菌株-AFB1复合体在消化过程中仍有较强的吸附性,能保障食品安全。本研究从日常食用的西北酸菜中筛选AFB1吸附率高的布式乳杆菌,与多数生物降解AFB1筛选枯草芽孢杆菌、假单胞菌属等菌株比较,菌株更适合在食品及饲料中吸附AFB1,更适应机体消化系统。与TAHEUR等[12]筛选高吸附率的乳酸杆菌比较,菌株L34-2未优化吸附率为66.41%,后续研究将通过优化菌株发酵条件,提高菌株吸附能力及稳定性。
[1] 罗自生,秦雨,徐艳群,等.黄曲霉毒素的生物合成、代谢和毒性研究进展[J].食品科学,2015,36(3):250-257.
[2] 赵萌,高婧,褚华硕,等.黄曲霉毒素B1的分子致毒机理及其微生物脱毒研究进展[J].食品科学,2019,40(11):235-245.
[3] 乔宏兴,姜亚乐,王永芬,等.黄曲霉毒素的危害及其脱毒方法研究进展[J].动物医学进展,2017,38(1):89-93.
[4] LIU Ruijie,WANG Ruiqi,LU Jian,et al.Degradation of AFB1 in aqueous medium by electron beam irradiation:Kinetics,pathway and toxicology[J].Food Control,2016,66:151-157.
[5] MOON Y S,KIM H M,CHUN H S,et al.Organic acids suppress aflatoxin production via lowering expression of aflatoxin biosynthesis-related genes in Aspergillus flavus[J].Food Control,2018,88:207-216.
[6] RASTEGAR H,SHOEIBI S,YAZDANPANAH H,et al.Removal of aflatoxin B1 by roasting with lemon juice and/or citric acid in contaminated pistachio nuts[J].Food Control,2017,71:279-284.
[7] 蔡俊,田尔诺,邵帅,等.黄曲霉毒素B1生物脱毒的研究进展[J].微生物学通报,2017,44(3):726-731.
[8] VERHEECKE C,LIBOZ T,MATHIEU F.Microbial degradation of aflatoxin B1: Current status and future advances[J].International Journal of Food Microbiology,2016,237:1-9.
[9] ADEBO O A,NJOBEH P B,GBASHI S,et al.Review on microbial degradation of aflatoxins[J].Critical Reviews in Food Science and Nutrition,2017,57(15):3 208-3 217.
[10] XU L,AHMED M F E,SANGARE L,et al. Novel aflatoxin-degrading enzyme from Bacillus shackletonii L7[J].Toxins,2017,9(1):36.
[11] SHUKLA S,PARK J H,CHUNG S H,et al.Ochratoxin a reduction ability of biocontrol agent Bacillus subtilis isolated from korean traditional fermented food kimchi.[J].Scientific reports,2018,8(1):8 039.
[12] TAHEUR F B,FEDHILA K,CHAIEB K,et al.Adsorption of aflatoxin B1,zearalenone and ochratoxin A by microorganisms isolated from Kefir grains[J]. International Journal of Food Microbiology,2017,251:1-7.
[13] 黄丽.植物乳杆菌C88干预黄曲霉毒素B1毒性的分子机制[D].长春:东北师范大学,2019.
[14] CARLOS A F O,FERNANDA B,CARLOS H C,et al.Recent trends in microbiological decontamination of aflatoxins in foodstuffs[J].Recent Advances and Future Prospects,2013,2013:59-92.
[15] 刘畅,刘阳,邢福国,等.黄曲霉毒素B1吸附菌株的筛选及吸附机理研究[J].核农学报,2010,24(4):766-771.
[16] XIA Xiaoshuang,ZHANG Ye,LI Mingyan,et al.Isolation and characterization of a Bacillus subtilis strain with aflatoxin B1 biodegradation capability[J].Food Control,2017,75:92-98.
[17] 李超波,李文明,杨文华,等.黄曲霉毒素B1降解菌的分离鉴定及其降解特性[J].微生物学报,2012,52(9):1 129-1 136.
[18] 孟繁磊,宋志峰,牛红红,等.基于UPLC-MS-MS技术快速测定花生中4种黄曲霉毒素[J].中国油脂,2018,43(1):136-139.
[19] 邵帅,戴军,杜馨,等.降解黄曲霉毒素B1菌株的发酵条件优化及降解机制[J].食品科学,2016,37(5):138-143.
[20] GARRITY G M,BELL J A,LILBURN T G. Bergey’s Manual of Systematic Bacteriology [M]. Ninth Edition. New York: Springer New York Berlin Herdelberg,2004.
[21] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:318-419.
[22] HERNANDEZ-MENDOZA A,GUZMAN-DE-PENA D,GARCIAH S.Key role of teichoic acids on aflatoxin B1 binding by probiotic bacteria[J].Journal of Applied Microbiology,2009,107(2):395-403.
[23] Kim S,Lee H,Lee S,et al.Invited review:Microbe-mediated aflatoxin decontamination of dairy products and feeds[J]. Journal of Dairy Science,2017,100(2):871-880.
[24] 田申,李贻杰,曹文红,等.利用虾头内源酶模拟胃肠道消化制备短肽的研究[J].食品工业科技,2016,37(9):92-96.
[25] 王宁.基于菌藻联合策略防控刺参圈水绵的研究[D].大连:大连理工大学,2019.
[26] 凌代文.乳酸细菌分类鉴定及实验方法[J].微生物学通报,1999(1):23.