近几年,新疆的葡萄酒产业发展迅猛,逐渐形成了伊犁河谷、天山北麓、吐哈盆地及焉耆盆地四大优势产区[1]。赤霞珠(Cabernet Sauvignon)酿酒葡萄起源于法国,是波尔多酿造红葡萄酒的传统品种,也是世界上种植面积最广的酿酒葡萄品种[2]。作为生产优质干红葡萄酒的主要原料,赤霞珠葡萄在新疆的许多酿酒葡萄地区种植。高品质葡萄酒的发酵一般需要经历酒精发酵和苹果酸-乳酸发酵(malolactic fermentation,MLF)过程。MLF是继酒精发酵后,葡萄酒中L-苹果酸在乳酸菌的苹果酸-乳酸酶催化下转变成L-乳酸和CO2的过程[3]。
在葡萄酒中启动并进行MLF过程的乳酸菌称为葡萄酒乳酸菌,主要包括4个属的多个种,如酒酒球菌、植物乳杆菌、瑞士乳杆菌、短乳杆菌、干酪乳杆菌和副干酪乳杆菌等[4]。MLF过程中,乳酸菌能够代谢多种物质,一方面为自身的生长繁殖提供了营养和能量来源;另一方面其代谢产物赋予葡萄酒丰富的香气,提升了葡萄酒的品质[5]。葡萄酒在MLF过程中产生了乙酸、乙酸酯、高级醇、羰基化合物和脂肪酸等多种挥发性化合物[6-7],赋予葡萄酒果味[8]和黄油气味[9]等。此外,红葡萄酒、部分白葡萄酒以及起泡葡萄酒都依赖于MLF来提升葡萄酒的品质[10]。然而,商业乳酸菌发酵剂在葡萄酒发酵过程中的应用,使得葡萄酒同质化现象较为严重,难以体现不同葡萄酒产区的区域特色。
新疆的酿酒葡萄因独特的地理气候而独具特色(例如“高糖低酸”)[11],本研究以新疆天山北麓产区赤霞珠葡萄酒自然MLF过程中分离的乳酸菌为发酵剂启动MLF过程,监测其发酵过程中理化指标和挥发性香气物质的变化,考察乳酸菌在MLF过程中对葡萄酒品质的影响,为地方区域优质乳酸菌在MLF中的应用奠定理论基础,为葡萄酒品质控制和发展提供参考。
1 材料与方法
1.1 材料与试剂
葡萄酒发酵液:2018年10月取自张裕巴堡男爵酒庄(中国新疆)结束酒精发酵的赤霞珠葡萄酒。其中,残糖3.82 g/L,总酸6.56 g/L,pH 3.59,酒精度11.7%vol。
商业菌株S1(Lactoenos 450PreAc),法国LAFFORT公司;MRS培养基,青岛高科技工业园海博生物技术有限公司;内标物2-甲基戊酸,上海源叶生物科技有限公司;苹果酸标品、乳酸标品,北京万佳首化生物科技有限公司;细菌DNA提取试剂盒,北京天根生化科技有限公司。
1.2 仪器与设备
DYY-8C 电泳仪,北京六一生物科技有限公司;T100 梯度PCR仪,美国Bio-rad公司;LC-2900 高效液相色谱仪,上海天普分析仪器有限公司;SAX强阴离子固相萃取柱(1 000 mg,6 mL),冠森生物科技(上海)有限公司;7890B系列气相色谱仪和配备MSD选择性检测器的安捷伦5977A质谱仪(配备HP-InnOAVx毛细管柱),美国Aligent公司。
1.3 乳酸菌的分离鉴定
从张裕巴堡男爵酒庄收集结束酒精发酵的赤霞珠葡萄酒发酵液于密闭玻璃容器中,于25 ℃培养箱中恒温放置,进行自然MLF过程。每隔4 d定期取样,共取5次。取出的样品经102倍稀释摇匀后,均匀涂布于MRS培养基上,分离纯化得到纯培养物,经显微镜形态观察和革兰氏染色观察进行初步鉴定。以通用引物扩增菌株的16S rDNA序列,并在NCBI数据库中进行比对。将同源性较大的已知菌株与未知菌株的16S rDNA序列用MEGA软件以邻近法构建系统发育树,明确未知菌株的种属关系。
1.4 MLF
取张裕巴堡男爵酒庄经酒精发酵后的赤霞珠葡萄酒发酵液,用0.45 μm水系膜对葡萄酒发酵液进行过滤除菌,过滤之后的发酵液在4 ℃下短期贮藏,用作MLF原料。将分离得到的3株乳酸菌和1株商业菌株S1接种到MRS液体培养基中活化,待培养至对数生长期,以107 CFU/mL的接种量接到装有100 mL过滤除菌的葡萄发酵液三角瓶中,在25 ℃培养箱中进行MLF过程。测定苹果酸含量变化(参照GB 5009.157—2016),以苹果酸质量浓度为标准,当苹果酸质量浓度<0.5 g/L时,结束发酵。之后取样收集,8 000 r/min离心10 min,取上清液,用于分析葡萄发酵液中理化指标和挥发性香气物质。以不添加任何菌株作为空白对照,与实验组一起放置于相同条件下并取样。
1.5 理化指标检测
采用斐林试剂滴定法(参照GB/T 15038—2006)测定残糖含量;通过酸碱滴定法(参照GB/T 15038—2006)测定MLF前后的总酸含量变化;采用pH计测定MLF前后的pH变化;利用酒精计法(参照GB 5009. 225—2016)测定样品中的酒精度;根据碘滴定法(参照GB/T 15038—2006)测定SO2的含量;通过高效液相色谱法测定苹果酸和乳酸含量变化(参照GB 5009.157—2016)。
1.6 挥发性香气物质
采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)法提取葡萄酒中的挥发性香气成分,并用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)法进行分析[14]。在HS-SPME提取之前,葡萄酒样品在密闭条件下8 000 r/min离心10 min,使细菌和杂质沉淀。将5 mL离心后的葡萄酒样品、1 g NaCl和2 μL体积分数0.98% 2-甲基戊酸加到15 mL样品瓶中,混合均匀后放入1颗磁力搅拌转子。然后用聚四氟乙烯表层的隔膜盖密封小瓶。样品放置在磁力搅拌器上,转速300 r/min,40 ℃平衡10 min后,用50/30 μm(DVB/CAR/PDMS) 固相微萃取(solid-phase microextraction,SPME)的萃取头对平衡后的样品在40 ℃下连续加热搅拌萃取60 min,萃取和富集发酵液中挥发性香气物质。
使用配备HP-InnOAVx毛细管柱(60 m×0.25 mm,0.25 μm)的安捷伦7890B系列气相色谱仪和配备选择性检测器(MSD)的安捷伦5977A质谱仪对前面用HS-SPME萃取的挥发性芳香化合物进行解吸和分析。具体方法:通过将SPME萃取头插入气相色谱仪注射器中进行热解吸,保持在250 ℃,然后在HP-InnOAVx毛细管柱上进行分离。升温程序:50 ℃持续5 min,以3 ℃/min升至86 ℃,接着以1 ℃/min升至90 ℃,再以3 ℃/min升至180 ℃,保持3 min,最后以15 ℃/min升至230 ℃(5 min)。载气(He)流速为1 mL/min。分离出的挥发性芳香化合物通过电子电离质谱法进行,在总离子电流(TiC)模式下操作,电离能为70 eV。采集范围为m/z 35~450。
定性定量分析:通过比较用质谱库搜索(National Institute of Standards and Technology,NIST)获得的光谱及资料分析鉴定提取的挥发性组分,并与文献报道的保留指数(retention index,RI)相比较,或与同条件下该物质标准品的RI和MS图像比较,以确定某物质。利用2-甲基戊酸内标法进行半定量分析。计算公式如下公式(1)所示:
(1)
式中:ρn,各香气物质质量浓度,μg/L;ρ1,内标物质质量浓度,μg/L;Si,各组分峰面积;S0,内标物质峰面积。
1.7 感官评定
建立感官评定小组,由12位经过培训的人员(6男6女,年龄范围为22~30岁)组成,培训标准根据ISO 13300-2-2006[13]制定,评定方法参考JACKSON[14]的感官环境和操作步骤进行,感官分析方法参考RUTAN等[15]的研究,根据实际情况建立对葡萄酒的呈香感官描述(表1)。评定方法为9分嗜好法[16],0~9分表示风味逐渐增强,其中0分代表没有被察觉,9分代表风味强度最大。每种发酵酒感官评定3次,取平均值。
表1 葡萄酒风味描述
Table 1 Flavor descriptions of wine

风味描述风味定义柑橘类葡萄、柚子、柠檬、橙子莓果类草莓、黑莓果园水果梨、苹果、杏、桃乳酸奶酪、奶油香料甘草、茴香、黑胡椒花香丁香花、玫瑰、茉莉果树类凤梨、荔枝、香蕉果酱果酱、果糖不良风味烧焦味、烟味
1.8 数据分析
对于葡萄酒样品,一式三份进行化学指标和香气分析,结果表示为![]() SPSS统计软件版本22用于执行所有统计测试。使用Origin ver 8.0和Microsoft Office Excel 2010处理GC-MS和化学指示剂数据,使用SIMCA软件绘制主成分分析图。
SPSS统计软件版本22用于执行所有统计测试。使用Origin ver 8.0和Microsoft Office Excel 2010处理GC-MS和化学指示剂数据,使用SIMCA软件绘制主成分分析图。
2 结果和分析
2.1 乳酸菌的分离鉴定
通过多次分离纯化后,筛选到疑似乳酸菌18株,其中JN1、ZN3和GN9具有较强的苹果酸降解能力。分离的乳酸菌在MRS培养基中生长状况良好,单菌落较小,表面光滑、湿润,呈乳白色,边缘整齐;革兰氏染色试验呈阳性,显微形态呈球状和杆状,均符合乳酸菌的基本生长特征及显微特征。通过16S rDNA分析鉴定,在NCBI中经BLAST比对分析,构建系统发育树,如图1所示。

图1 JN1、ZN3、GN9菌株系统发育树
Fig.1 JN1,ZN3,GN9 strain phylogenetic tree
菌株JN1和酒酒球菌(Oenococcus oeni)具有较高的同源性;菌株ZN3和植物乳杆菌(Lactobacillus plantarum)具有较高的同源性;菌株GN9和干酪乳杆菌(Lactobacillus casei)具有较高的同源性。综上所述,分离得到的3株乳酸菌分别为酒酒球菌JN1、植物乳杆菌ZN3和干酪乳杆菌GN9。
2.2 乳酸菌对葡萄酒理化指标的影响
为了考察MLF过程中乳酸菌对葡萄酒理化指标的影响,本研究分别以JN1、ZN3、GN9和S1作为发酵剂开启赤霞珠葡萄酒MLF过程,以不添加发酵剂为空白对照,监测处理样和空白样中残糖量、总酸、pH、酒精度等各项理化指标变化(表2)。
由表2可知,各组理化指标存在一定差异。4个发酵酒样的残糖量对比空白对照组均有降低,可能是因为乳酸菌在增殖过程中消耗了部分残糖。先前有研究表明,乳酸菌能利用残糖和有机酸为碳源,产生双乙酰等对葡萄酒风味影响较大的物质[17-18]。总酸含量均有所降低,降低量为2.52~2.71 g/L,其中ZN3酒样降低幅度最大,说明ZN3降酸能力突出。pH均升高,在3.78~3.90之间。酒精度和SO2含量未发生明显变化。上述4个酒样各项指标符合GB 15037—2006《葡萄酒》。此外,苹果酸和乳酸含量的变化,可以直接体现出乳酸菌的MLF能力。4株乳酸菌均可以将苹果酸转换为乳酸,MLF能力最优的是ZN3,对比未进行发酵的空白对照组,苹果酸质量浓度降低了2.28 g/L,乳酸质量浓度升高了1.72 g/L。MLF能力由大到小排序为:ZN3>S1>JN1>GN9。
表2 理化指标变化
Table 2 Changes of physicochemical indexes

样品残糖量/(g·L-1)总酸/(g·L-1)pH酒精度/%volSO2/(mg·L-1)苹果酸/(g·L-1)乳酸/(g·L-1)空白对照组3.79±0.06b6.63±0.19b3.59±0.09ab11.70±0.30a21.78±0.57a2.59±0.10d0.98±0.03aJN1处理组3.41±0.06a4.02±0.10a3.83±0.04a11.52±0.26a21.32±0.42a0.42±0.01b2.54±0.08bcZN3处理组3.31±0.08a3.92±0.08a3.90±0.11b11.69±0.21a20.69±0.54a0.31±0.01a2.70±0.08dGN9处理组3.43±0.07a4.11±0.11a3.78±0.14ab11.55±0.30a21.51±0.47a0.61±0.02c2.42±0.08bS1处理组3.44±0.08a4.00±0.07a3.85±0.11b11.63±0.22a20.72±0.36a0.39±0.01ab2.61±0.05cd
注:同列不同小写字母表示差异显著(P<0.05);总酸以酒石酸计(下同)
2.3 乳酸菌对挥发性香气物质组成的影响
MLF过程会引起葡萄酒中挥发性香气物质的改变,不同菌株会产生不同的香气[19],表3展示了各组中鉴定出的主要挥发性香气物质。4个发酵酒样和空白对照组中共鉴定出67种主要挥发性香气物质。包括25种醇类、2种酚类、6种醛类、3种酮类、7种酸类、15种酯类、5种芳香族类、其他类别4种。醇类是主要的挥发性成分,占总香气物质的84.49%~93.29%,在酒精发酵结束后,酵母菌在葡萄酒中积累了大量醇类,构成了葡萄酒的主要香气成分[20]。异戊醇是主要醇类物质,同时在总体香气物质中含量最高,占总香气物质含量的61.81%~76.78%。先前有研究表明,异戊醇是发酵过程中由亮氨酸进行脱羧反应和脱氨作用的产物,会给葡萄酒带来草本植物的味道,是葡萄酒重要的风味化合物[21]。其余成分中,酚类占比0.48%~2.16%、醛类占比1.35%~4.19%、酮类占比0~1.67%、酸类占比2.62%~6.73%、酯类占比1.34%~2.98%、芳香族类占比0~1.91%、其他类占比0~0.14%。乙酸和辛酸是主要酸类,乙酸是由乳酸菌对柠檬酸的分解代谢形成的,提供了刺激气味[22],辛酸提供了汗液和奶酪气味[19]。乙酸乙酯为主要酯类,由乙酰辅酶A与氨基酸或糖类降解后产生的高级醇反应生成,赋予了葡萄酒水果和指甲油气味[23]。2,4-二叔丁基苯酚和2,4-二甲基苯甲醛是主要酚类和醛类。酮类、芳香族类和其他类的含量较低,对葡萄酒MLF过程前后香气物质的贡献作用较小,这也与先前的研究结果保持一致[24-25]。
表3 挥发性香气物质和含量
Table 3 Analysis of volatile aroma compounds and content
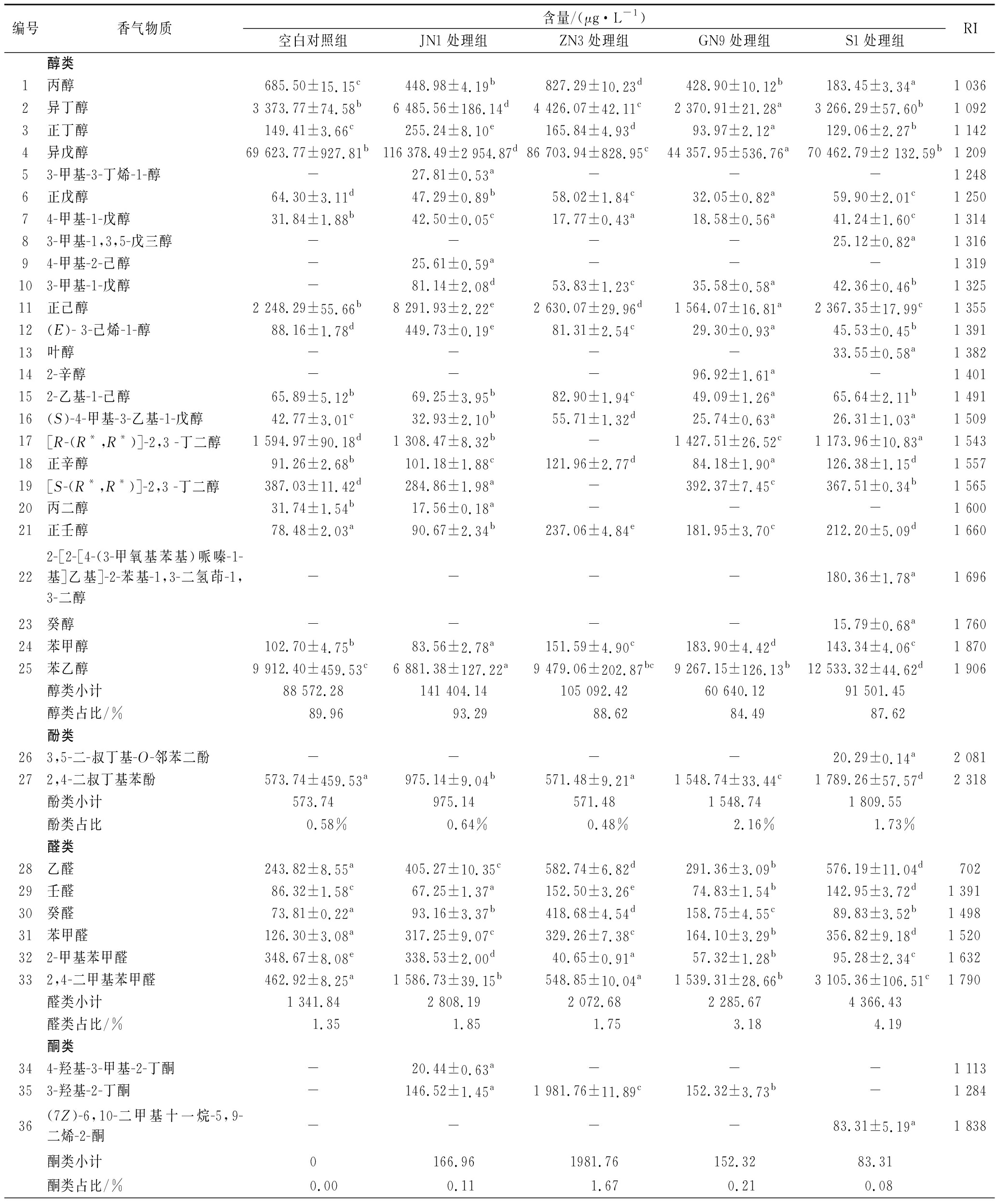
编号香气物质含量/(μg·L-1)空白对照组JN1处理组ZN3处理组GN9处理组S1处理组RI醇类1丙醇685.50±15.15c448.98±4.19b827.29±10.23d428.90±10.12b183.45±3.34a1 0362异丁醇3 373.77±74.58b6 485.56±186.14d4 426.07±42.11c2 370.91±21.28a3 266.29±57.60b1 0923正丁醇149.41±3.66c255.24±8.10e165.84±4.93d93.97±2.12a129.06±2.27b1 1424异戊醇69 623.77±927.81b116 378.49±2 954.87d86 703.94±828.95c44 357.95±536.76a70 462.79±2 132.59b1 20953-甲基-3-丁烯-1-醇-27.81±0.53a---1 2486正戊醇64.30±3.11d47.29±0.89b58.02±1.84c32.05±0.82a59.90±2.01c1 25074-甲基-1-戊醇31.84±1.88b42.50±0.05c17.77±0.43a18.58±0.56a41.24±1.60c1 31483-甲基-1,3,5-戊三醇----25.12±0.82a1 31694-甲基-2-己醇-25.61±0.59a---1 319103-甲基-1-戊醇-81.14±2.08d53.83±1.23c35.58±0.58a42.36±0.46b1 32511正己醇2 248.29±55.66b8 291.93±2.22e2 630.07±29.96d1 564.07±16.81a2 367.35±17.99c1 35512(E)- 3-己烯-1-醇88.16±1.78d449.73±0.19e81.31±2.54c29.30±0.93a45.53±0.45b1 39113叶醇----33.55±0.58a1 382142-辛醇---96.92±1.61a-1 401152-乙基-1-己醇65.89±5.12b69.25±3.95b82.90±1.94c49.09±1.26a65.64±2.11b1 49116(S)-4-甲基-3-乙基-1-戊醇42.77±3.01c32.93±2.10b55.71±1.32d25.74±0.63a26.31±1.03a1 50917[R-(R*,R*)]-2,3 -丁二醇1 594.97±90.18d1 308.47±8.32b-1 427.51±26.52c1 173.96±10.83a1 54318正辛醇91.26±2.68b101.18±1.88c121.96±2.77d84.18±1.90a126.38±1.15d1 55719[S-(R*,R*)]-2,3 -丁二醇387.03±11.42d284.86±1.98a-392.37±7.45c367.51±0.34b1 56520丙二醇31.74±1.54b17.56±0.18a---1 60021正壬醇78.48±2.03a90.67±2.34b237.06±4.84e181.95±3.70c212.20±5.09d1 660222-[2-[4-(3-甲氧基苯基)哌嗪-1-基]乙基]-2-苯基-1,3-二氢茚-1,3-二醇----180.36±1.78a1 69623癸醇----15.79±0.68a1 76024苯甲醇102.70±4.75b83.56±2.78a151.59±4.90c183.90±4.42d143.34±4.06c1 87025苯乙醇9 912.40±459.53c6 881.38±127.22a9 479.06±202.87bc9 267.15±126.13b12 533.32±44.62d1 906醇类小计88 572.28141 404.14105 092.4260 640.1291 501.45醇类占比/%89.9693.2988.6284.4987.62酚类263,5-二-叔丁基-O-邻苯二酚----20.29±0.14a2 081272,4-二叔丁基苯酚573.74±459.53a975.14±9.04b571.48±9.21a1 548.74±33.44c1 789.26±57.57d2 318酚类小计573.74975.14571.481 548.741 809.55酚类占比0.58%0.64%0.48%2.16%1.73%醛类28乙醛243.82±8.55a405.27±10.35c582.74±6.82d291.36±3.09b576.19±11.04d70229壬醛86.32±1.58c67.25±1.37a152.50±3.26e74.83±1.54b142.95±3.72d1 39130癸醛73.81±0.22a93.16±3.37b418.68±4.54d158.75±4.55c89.83±3.52b1 49831苯甲醛126.30±3.08a317.25±9.07c329.26±7.38c164.10±3.29b356.82±9.18d1 520322-甲基苯甲醛348.67±8.08e338.53±2.00d40.65±0.91a57.32±1.28b95.28±2.34c1 632332,4-二甲基苯甲醛462.92±8.25a1 586.73±39.15b548.85±10.04a1 539.31±28.66b3 105.36±106.51c1 790醛类小计1 341.842 808.192 072.682 285.674 366.43醛类占比/%1.351.851.753.184.19酮类344-羟基-3-甲基-2-丁酮-20.44±0.63a---1 113353-羟基-2-丁酮-146.52±1.45a1 981.76±11.89c152.32±3.73b-1 28436(7Z)-6,10-二甲基十一烷-5,9-二烯-2-酮----83.31±5.19a1 838酮类小计0166.961981.76152.3283.31酮类占比/%0.000.111.670.210.08
续表3

编号香气物质含量/(μg·L-1)空白对照组ZN3处理组GN9处理组S1处理组JN1处理组RI酸类37乙酸1 596.60±95.29a2 589.50±62.44c1 985.74±17.16b2 723.51±32.11d1 536.90±9.66a1 44938异丁酸34.15±1.46ab35.08±0.39b301.69±7.43c-27.10±0.78a1 570393-甲基丁酸161.04±3.93c 174.04±2.73d138.42±3.81b132.94±3.37b123.36±3.45a1 75740己酸801.76±31.60c529.04±17.96a698.09±7.28b671.51±12.27b842.36±49.96c1 84641辛酸1 177.10±22.91c642.02±10.73a1 129.72±25.01b1 271.92±18.46d2 086.13±1.49e2 06042壬酸----26.54±0.86a2 17143癸酸--29.29±0.69a30.84±0.78a43.10±1.89b2 276酸类小计3 770.653 969.684 282.954 830.724 685.49酸类占比/%3.832.623.616.734.49酯类44乙酸乙酯741.46±29.22b713.52±23.51b1 105.74±11.98c579.07±5.58a-88845己酸乙酯-53.86±1.50a107.59±1.98d84.91±2.18c-1 233463-甲基戊酸乙酯----86.47±1.00a1 182472-甲基戊酸戊酯124.27±4.36a158.87±4.17b281.08±5.67c274.37±5.08c166.20±5.73b1 30448乳酸乙酯468.01±15.37c560.39±1.55d380.38±9.25a407.26±9.42b401.11±8.36ab1 34949辛酸乙酯222.58±10.25b95.66±1.12a367.78±8.56e249.76±4.19c308.68±2.87d1 43550乳酸异戊酯27.47±0.98b22.29±0.95a--34.05±0.80c1 58051γ-丁内酯36.00±0.04c8.60±0.65a47.25±0.98d30.48±0.94b-1 63252癸酸乙酯-9.15±0.04a40.79±0.94c101.93±1.68d27.87±0.47b1 63853苯甲酸乙酯27.36±0.51a25.93±1.41a--112.07±0.88b1 65854琥珀酸二乙酯275.77±4.62c199.14±2.10a268.47±5.80c240.97±7.43b315.83±5.14d1 68055水杨酸甲酯--37.23±1.16c19.87±0.58b15.74±1.18a1 765563-甲基丁酸乙酯104.17±3.93b76.63±2.29a98.90±2.55b-102.31±4.30b1 80557乙酸-2-苯乙酯155.47±11.87b106.24±3.43a218.66±4.34c152.19±3.38b285.55±5.39d1 81358乙酸异戊酯--45.15±1.12a--1 098酯类小计2 182.562 030.282 999.022 140.811 855.88酯类占比/%2.221.342.532.981.78芳香族类594-乙基邻二甲苯28.46±3.36a----1 399601,2,4,5-四甲苯441.27±1.44c18.23±0.11a315.02±7.27b--1 416611,2,3,4-四甲苯326.51±0.51d21.37±1.34a227.03±5.74c28.19±0.73b-1 43362萘1082.71±5.86d187.95±5.39b958.20±23.29c59.78±1.73a-1 74663甲基萘--37.88±1.14a82.00±1.47b-1 825芳香族类小计1 878.95227.551 538.13169.970芳香族类占比/%1.910.151.300.240.00其他类644-甲基-2,3-二氢-1H-茚135.64±11.39b-54.34±0.72a--1 46865长叶烯----51.86±1.24a1 57766正十六烷----64.67±2.40a1 600677-乙基-1,3,5-环庚三烯----12.23±0.14a1 633其他类小计135.64054.340128.76其他类占比/%0.140.000.050.000.12总计98 455.65151 581.94118 592.7871 768.35104 430.84
注:同行不同小写字母表示差异显著(P<0.05)
5个酒样中所含香气物质种类数目由大到小排序为:S1>JN1>ZN3>GN9=空白对照,5个酒样中所含香气物质总含量由大到小排序为:JN1>ZN3>S1>空白对照>GN9。JN1酒样共检测出49种香气物质,与空白对照相比,含量增加的香气物质有25种,其中新产生的香气物质有6种(3-甲基-3-丁烯-1-醇、4-甲基-2-己醇、3-甲基-1-戊醇、4-羟基-3-甲基-2-丁酮、3-羟基-2-丁酮和癸酸乙酯)。ZN3酒样共检测出46种香气物质,与空白对照相比,含量增加的香气物质有31种,其中新产生的香气物质有8种(3-甲基-1-戊醇、3-羟基-2-丁酮、正癸酸、己酸乙酯、癸酸乙酯、水杨酸甲酯、乙酸异戊酯和甲基萘)。GN9酒样共检测出45种香气物质,与空白对照相比,含量增加的香气物质有20种,其中新产生的香气物质有8种(3-甲基-1-戊醇、2-辛醇、3-羟基-2-丁酮、正癸酸、己酸乙酯、癸酸乙酯、水杨酸甲酯和甲基萘)。S1酒样共检测出51种香气物质,与空白对照相比,含量增加的香气物质有36种,其中新产生的香气物质有15种(3-甲基-1,3,5-戊三醇、3-甲基-1-戊醇、叶醇、2-[2-[4-(3-甲氧基苯基)哌嗪-1-基]乙基]-2-苯基-1,3-二氢茚-1,3-二醇、癸醇、3,5-二-叔丁基-O-邻苯二酚、(7Z)-6,10-二甲基十一烷-5,9-二烯-2-酮、壬酸、正癸酸、3-甲基戊酸乙酯、癸酸乙酯、水杨酸甲酯、长叶烯、正十六烷、7-乙基-1,3,5-环庚三烯)。
综上所述,4株乳酸菌进行MLF过程后,对葡萄酒中香气物质的种类及含量具有重要调节作用,形成各自独特的香气组成结构。除GN9外,其他菌株参与发酵后均使香气物质的种类和含量有所增加。不同乳酸菌发酵后的香气物质通过数量、种类以及相互之间的协调作用使葡萄酒展现出特有的香气。
2.4 关键性香气物质的主成分分析
仅通过分析香气物质的种类和含量,无法确定各种香气物质对葡萄酒香气的贡献大小,因此引入香气活力值(odor activity value,OAV)来确定关键性香气物质,从而进一步研究不同乳酸菌赋予葡萄酒的风味。OAV是由该物质的含量除以其阈值得到的,OAV>1的香气物质对葡萄酒的风味贡献较显著,且OAV越大对香气特征作用越明显,而OAV<1的物质对葡萄酒的风味贡献较小,只起到协香作用[26]。因此,我们将OAV>1的香气物质归为关键性香气物质。计算OAV,结果如表4所示。
表4 挥发性香气物质的OAV(OAV>1)
Table 4 OAV of volatile aroma compounds
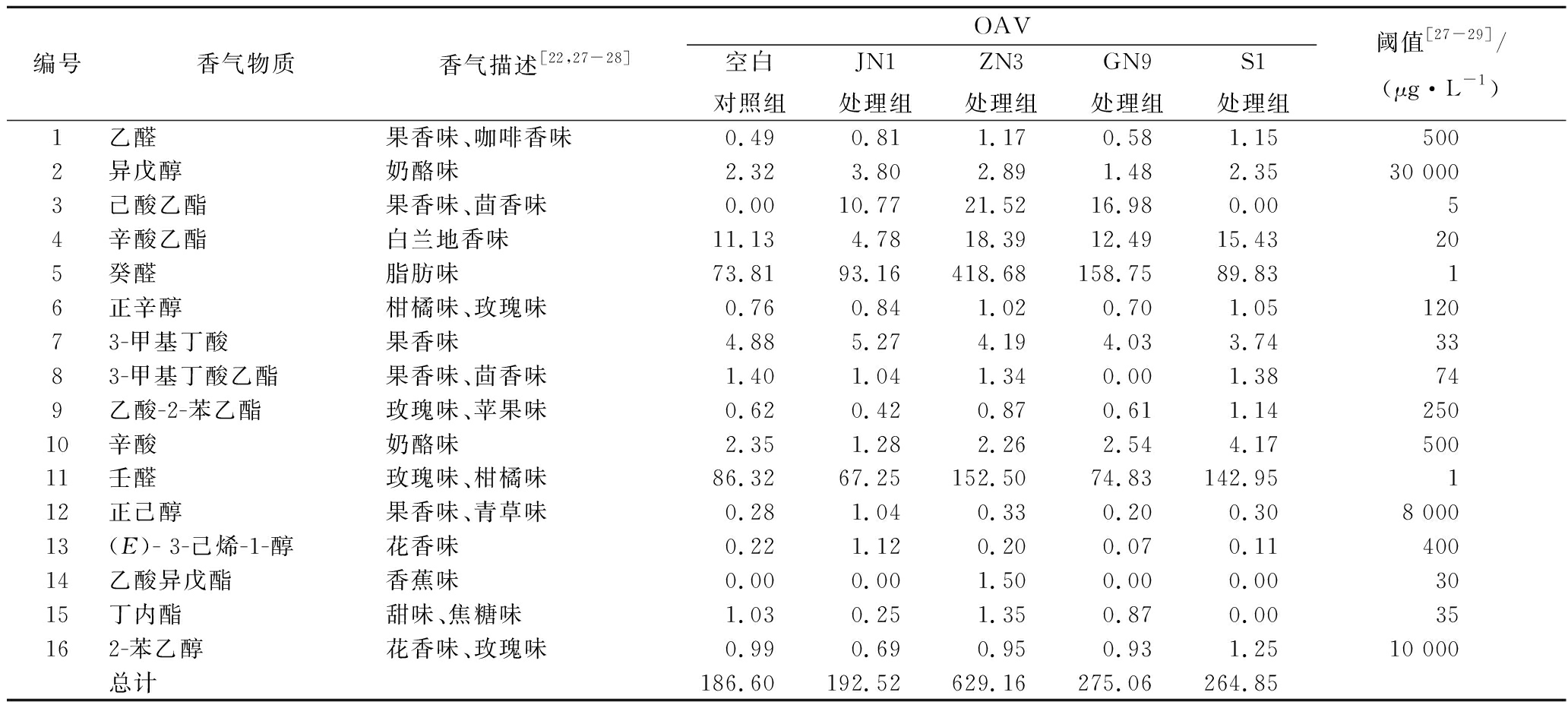
编号香气物质香气描述[22,27-28]OAV空白对照组JN1处理组 ZN3处理组GN9处理组S1处理组阈值[27-29]/(μg·L-1)1乙醛果香味、咖啡香味0.490.81 1.17 0.58 1.15 5002异戊醇奶酪味2.323.80 2.89 1.48 2.35 30 0003己酸乙酯果香味、茴香味0.0010.77 21.52 16.98 0.00 54辛酸乙酯白兰地香味11.134.78 18.39 12.49 15.43 205癸醛脂肪味73.8193.16 418.68 158.75 89.83 16正辛醇柑橘味、玫瑰味0.760.84 1.02 0.70 1.05 12073-甲基丁酸 果香味4.885.27 4.19 4.03 3.74 3383-甲基丁酸乙酯果香味、茴香味1.401.04 1.34 0.00 1.38 749乙酸-2-苯乙酯玫瑰味、苹果味0.620.42 0.87 0.61 1.14 25010辛酸奶酪味2.351.28 2.26 2.54 4.17 50011壬醛玫瑰味、柑橘味86.3267.25 152.50 74.83 142.95 112正己醇果香味、青草味0.281.04 0.33 0.20 0.30 8 00013(E)- 3-己烯-1-醇花香味0.221.12 0.20 0.07 0.11 40014乙酸异戊酯香蕉味0.000.00 1.50 0.00 0.00 3015丁内酯甜味、焦糖味1.030.25 1.35 0.87 0.00 35162-苯乙醇花香味、玫瑰味0.990.69 0.95 0.93 1.25 10 000总计186.60192.52629.16275.06264.85
由表4可知,共有16种香气物质的OAV>1,包括醇类、醛类、酸类和酯类。其中,OAV>10的物质有4种(异戊醇、辛酸乙酯、癸醛和壬醛),OAV>100的物质有2种(癸醛和壬醛),这些即为酒样中的关键性香气物质。各组中关键性香气物质数目的排序为:ZN3(12种)>S1(11种)>JN1(10种)>空白对照(8种)>GN9(7种),OAV总和的排序为:ZN3(629.16)>GN9(275.06)>S1(264.85)>JN1(192.52)>空白对照(186.6)。由排序可知,ZN3酒样具有最高的香气评价。但是,由于关键性香气物质在不同样本中的浓度差异较大,而且香气功能相近的化合物之间存在协同作用,单纯地分析数目和含量并不能够直接反映酒样的香气特征。因此,为了进一步分析关键性香气物质对不同酒样的贡献,明确各个酒样的香气成分差异。将16种关键性香气物质的OAV和5个酒样进行主成分分析,如图2所示。
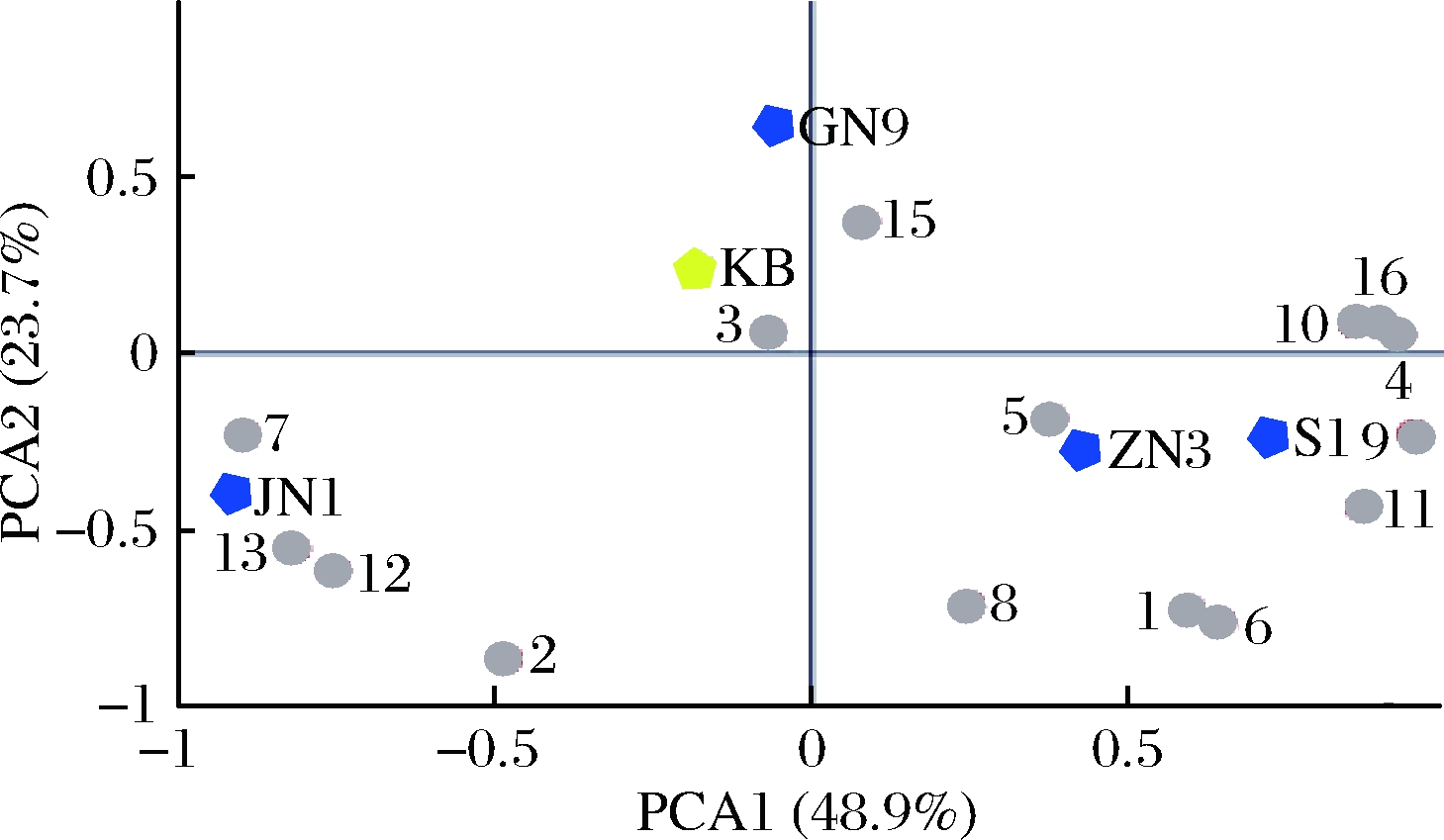
图2 OAV>1的香气物质对前2个主成分分析图
Fig.2 PCA of aroma compounds with OAV greater
than 1 to the first two principal components
注:JN1、ZN3、GN9和S1为各个酒样编号,KB为空白对照组;
数字1~16为各香气物质的编号,见表4
PC1和PC2的解释率分别为48.9%和23.7%,5个酒样可清楚地分为3组,第1组是GN9酒样和空白对照组,位于第Ⅱ象限,第2组是JN1酒样,位于第Ⅲ象限,第3组是ZN3酒样和S1酒样,位于第Ⅳ象限。丁内酯(甜味、焦糖味)对GN9酒样的风味贡献较大,3-甲基丁酸(果香味)、(E)- 3-己烯-1-醇(花香味)、异戊醇(奶酪味)和正己醇(果香味、青草味)对JN1酒样的风味贡献较大,癸醛(脂肪味)、乙醛(果香味、咖啡香味)、正辛醇(柑橘味、玫瑰味)和3-甲基丁酸乙酯(果香味、茴香味)对ZN3酒样的风味贡献较大,乙酸-2-苯乙酯(玫瑰味和苹果味)、壬醛(玫瑰味和柑橘味)、辛酸乙酯(白兰地香味)、辛酸(奶酪味)和2-苯乙醇(花香味、玫瑰味)对S1酒样的风味贡献较大。上述结果与各香气物质在不同酒样中的OAV有一定对应关系,即对某酒样贡献作用较大的香气物质,在该酒样中同样也具有较高的OAV。
2.5 感官评价
如图3所示,其中ZN3酒样的柑橘类(葡萄味等)、莓果类(草莓味等)、果园水果(苹果味等)、乳酸(奶酪味等)、香料(茴香味等)、果酱(果糖味等)感官分数均为最高值,与ZN3酒样的关键性香气物质结果分析中乙醛(果香味和咖啡香味)、己酸乙酯(果香味和茴香味)、辛酸乙酯(白兰地香味)、癸醛(脂肪味)、壬醛(玫瑰味、柑橘味)、乙酸异戊酯(香蕉味)和丁内酯(甜味和焦糖味)的高含量相对应,同时与ESCUDERO等[30]研究发现酯类化合物可增强发酵葡萄酒中的水果香气和花香的结论相符。JN1酒样的果树类感官分数为最高值。S1酒样的花香(玫瑰味等)感官分数为最高值,与S1酒样的关键性香气物质结果分析中正辛醇(柑橘类和玫瑰味)、乙酸-2-苯乙酯(玫瑰味和苹果味)和2-苯乙醇(花香味和玫瑰味)的高含量相对应。综上所述,乳酸菌参与MLF过程后,香气评价优于未发生MLF过程的空白对照组,整体香气可接受性总得分由大到小依次为:ZN3酒样>JN1酒样>GN9酒样=S1酒样>空白对照。
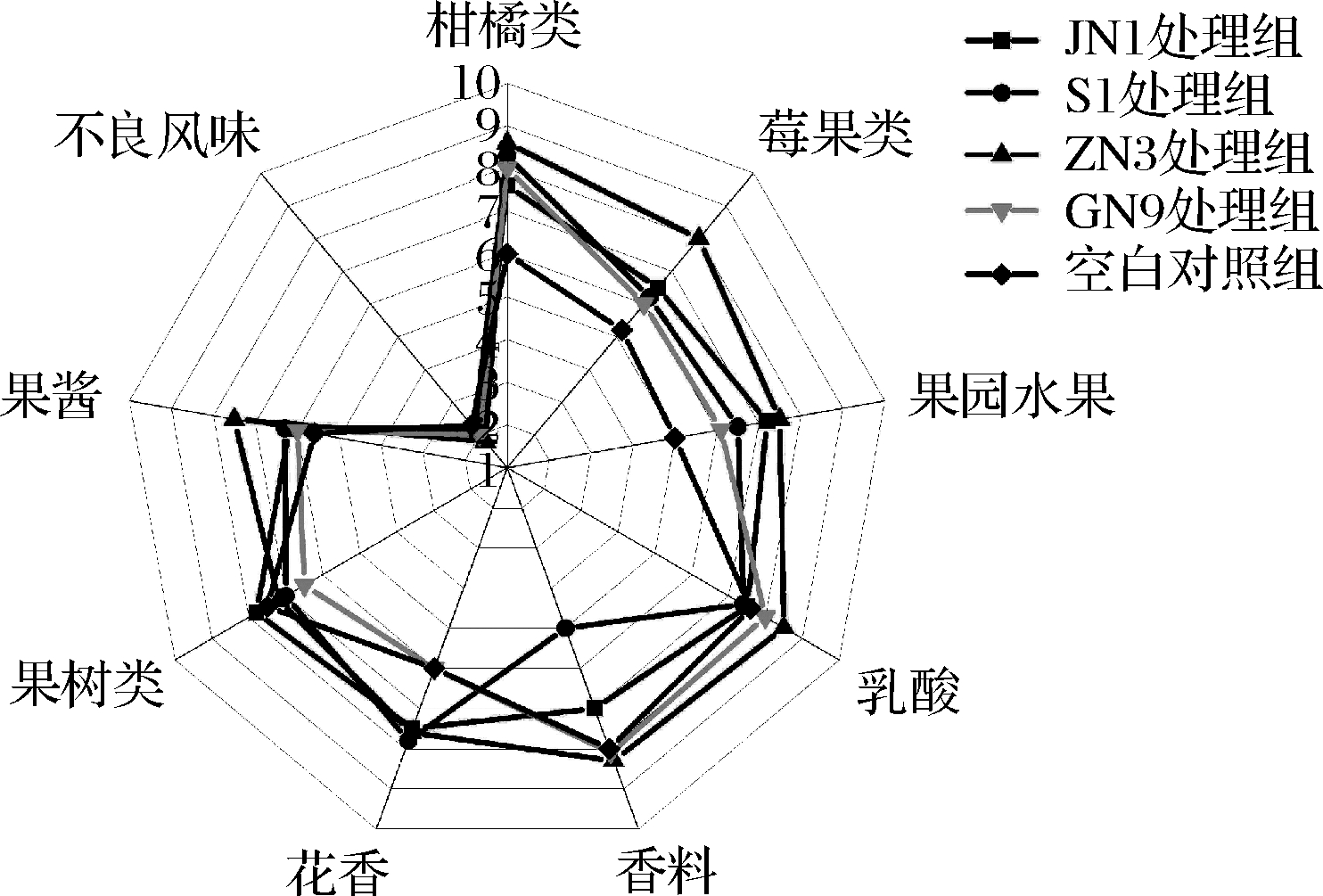
图3 香气评价图
Fig.3 Radar map of aroma evaluation
3 结论与讨论
本研究分别以酒酒球菌JN1、植物乳杆菌ZN3、干酪乳杆菌GN9和商业菌株S1为发酵剂对赤霞珠葡萄酒进行MLF过程,并以未进行MLF过程的酒样作为空白对照。4株菌均具有MLF能力,MLF能力由大到小排序为:ZN3>S1>JN1>GN9。4株菌参与MLF后,酒样的总酸和残糖含量降低,pH升高,酒精度和SO2含量未发生明显变化。酒样中共检测到了67种香气物质,包括25种醇类、2种酚类、6种醛类、3种酮类、7种酸类、15种酯类、5种芳香族类、其他类别4种,其中,异戊醇是葡萄酒中主要香气物质。除GN9外,其他菌株经MLF过程后均使香气物质的种类和含量有所增加。5个酒样中的关键性香气物质(OAV>1的香气物质)共有16种(乙醛、异戊醇、己酸乙酯、辛酸乙酯、癸醛、正辛醇、3-甲基丁酸、3-甲基丁酸乙酯、乙酸-2-苯乙酯、辛酸、壬醛、正己醇、(E)- 3-己烯-1-醇、乙酸异戊酯、丁内酯和2-苯乙醇),其中ZN3酒样具有最高的香气评价。丁内酯(甜味、焦糖味)为GN9酒样的特征性香气物质,3-甲基丁酸(果香味)、(E)- 3-己烯-1-醇(花香味)、异戊醇(奶酪味)和正己醇(果香味、青草味)为JN1酒样的特征性香气物质,癸醛(脂肪味)、乙醛(果香味、咖啡香味)、正辛醇(柑橘味、玫瑰味)和3-甲基丁酸乙酯(果香味、茴香味)为ZN3酒样的特征性香气物质,乙酸-2-苯乙酯(玫瑰味和苹果味)、壬醛(玫瑰味和柑橘味)、辛酸乙酯(白兰地香味)、辛酸(奶酪味)和2-苯乙醇(花香味、玫瑰味)为S1酒样的特征性香气物质。
结果表明,分离筛选出的乳酸菌具有良好的MLF能力,相比于商业菌株S1,它们参与发酵后的酒样具有风格迥异的风味结构。植物乳杆菌ZN3具有最强的MLF能力,能显著增加香气物质的种类和含量,在关键性香气分析和感官分析中均具有最优评价。对比商业菌株S1,发现其具有一定商业运用潜力,在后续工作中可进一步开展商业菌株开发应用相关实验,如混菌发酵的发酵特性,相关组学分析揭示特性机理等。本研究为确定葡萄酒中乳酸菌参与MLF过程产生的香气物质成分以及含量提供了可靠的参考数据,为乳酸菌在葡萄酒MLF过程中的应用及其品质控制奠定理论基础,为葡萄酒生产技术和质量评价提供了重要的实用价值。
[1] 王平,孙钦明. 对新疆葡萄酒产业发展的几点思考[J]. 新疆农垦科技,2016,39(5): 67-69.
[2] JANCIS R. Oxford companion to wine[J]. 1994.
[3] BELAND F A,BENSON R W,MELLICK P W,et al. Effect of ethanol on the tumorigenicity of urethane (ethyl carbamate) in B6C3F1 mice[J]. Food and Chemical Toxicology,2005,43(1): 1-19.
[4] 张春晖,李华. 葡萄酒微生物学[M]. 西安: 陕西人民出版社,2003.
[5] MICHLMAYR H,NAUER S,BRANDES W,et al. Release of wine monoterpenes from natural precursors by glycosidases from Oenococcus oeni[J]. Food Chemistry,2012,135(1):80-87.
[6] BARTOWSKY E,RESEARCH W. Oenococcus oeni and malolactic fermentation-moving into the molecular arena[J]. Australian Journal of Grape and Wine Research,2010,11(2): 174-187.
[7] SIEBERT T E,SMYTH H E,CAPONE D L,et al. Stable isotope dilution analysis of wine fermentation products by HS-SPME-GC-MS[J]. Analytical and Bioanalytical Chemistry,2005,381(4): 937-947.
[8] LAURENT M H,HENICK-KLING T,ACREE T-E. Changes in the aroma and odor of Chardonnay wine due to malolactic fermentation[J]. Wein-Wissenschaft,1994,49(1): 3-10.
[9] BARTOWSKY E J,HENSCHKE P A. The ‘buttery’ attribute of wine diacetyl desirability,spoilage and beyond[J]. International Journal of Food Microbiology,2004,96(3): 235-252.
[10] TOIT M D, ENGELBRECHT L, LERM E, et al. Lactobacillus: The next generation of malolactic fermentation starter cultures—an overview[J]. Food and Bioprocess Technology,2011,4(6): 876-906.
[11] 钟海霞,周晓明,齐莹莹,等.新疆8个葡萄品种糖组分及含量比较分析[J]. 新疆农业科学,2019,56(7): 1 250-1 257.
[12] ANTALICK G,PERELLO M C,REVEL G D. Development,validation and application of a specific method for the quantitative determination of wine esters by headspace-solid-phase microextraction-gas chromatography-mass spectrometry[J]. Food Chemistry,2010,121(4): 1 236-1 245.
[13] Sensory analysis: General guidance for the staff of a sensory evaluation laboratory. Part 2: Recruitment and training of panel leaders: NEN ISO 13300-2-2006[S]. Switzerland: Geneva,2006.
[14] JACKSON R S. Wine tasting: A professional handbook[M]. 2th ed. Pittsburgh: Academic Press,2009.
[15] RUTAN T,HERBST-JOHNSTONE M,PINEAU B,et al. Characterization of the aroma of central Otago pinot noir wines using sensory reconstitution studies[J]. American Journal of Enology and Viticulture,2014,65(4): 424-434.
[16] 冯涛,王旭增,王一非,等. 葡萄园土壤中酿酒酵母的分离鉴定及其发酵葡萄酒香气成分分析[J]. 食品科学,2018,39(14): 213-220.
[17] MICHLMAYR H,EDER R,KULBE K D,et al. β-Glycosidase activities of Oenococcus oeni: Current state of research and future challenges[J]. Mitteilungen Klosterneuburg,2012,62(3): 87-96.
[18] GAGNÉ S,LUCAS P M,PERELLO M C,et al. Variety and variability of glycosidase activities in an Oenococcus oeni strain collection tested with synthetic and natural substrates[J]. Journal of Applied Microbiology,2011,110(1): 218-228.
[19] MALHERBE S,TREDOUX A G J,HÉL NE H,et al. Comparative metabolic profiling to investigate the contribution of O.oeni MLF starter cultures to red wine composition[J]. Journal of Industrial Microbiology & Biotechnology,2012,39(3): 477-494.
NE H,et al. Comparative metabolic profiling to investigate the contribution of O.oeni MLF starter cultures to red wine composition[J]. Journal of Industrial Microbiology & Biotechnology,2012,39(3): 477-494.
[20] HÉCTOR R,BLANCA D L R,CARMEN G C,et al. Characterization of tannase activity in cell-free extracts of Lactobacillus plantarum CECT 748T[J]. International Journal of Food Microbiology,2008,121(1): 92-98.
[21] MOLINA A M,GUADALUPE V,VARELA C,et al. Differential synthesis of fermentative aroma compounds of two related commercial wine yeast strains[J]. Food Chemistry,2009,117(2): 189-195.
[22] ANA E,EVA C,LAURA F A,et al. Analytical characterization of the aroma of five premium red wines. Insights into the role of odor families and the concept of fruitiness of wines[J]. Journal of Agricultural Food Chemistry,2007,55(11): 4 501-4 510.
[23] FRANCIS I L,NEWTON J,RESEARCH W. Determining wine aroma from compositional data[J]. Australian Journal of Grape and Wine Research,2008,11(2): 114-126.
[24] MAICAS S,GIL J V,PARDO I,et al. Improvement of volatile composition of wines by controlled addition of malolactic bacteria[J]. Food Research International,1999,32(7): 491-496.
[25] DELAQUIS P,CLIFF M,KING M,et al. Effect of two commercial malolactic cultures on the chemical and sensory properties of Chancellor wines vinified with different yeasts and fermentation temperatures[J]. American Journal of Enology and Viticulture,2000,51(1): 42-48.
[26] ALLEN M S,LACEY M J,BOYD S,et al. Determination of methoxypyrazines in red wines by stable isotope dilution gas chromatography-mass spectrometry[J]. Journal of Agricultural and Food Chemistry,1994,42(8): 1 734-1 738.
[27] ZHANG Z W,JIANG B. Volatile compounds of young wines from cabernet sauvignon,cabernet gernischet and chardonnay varieties grown in the loess plateau region of China[J]. Molecules,2010,15(12): 9 184-9 196.
[28] GARC A-CARPINTERO E G,S
A-CARPINTERO E G,S NCHEZ-PALOMO E,G
NCHEZ-PALOMO E,G MEZ GALLEGO M A,et al. Effect of cofermentation of grape varieties on aroma profiles of La Mancha red wines[J]. Journal of Food Science,2011,76(8): 1 169-1 180.
MEZ GALLEGO M A,et al. Effect of cofermentation of grape varieties on aroma profiles of La Mancha red wines[J]. Journal of Food Science,2011,76(8): 1 169-1 180.
[29] WANG J,GAMBETTA J M,JEFFERY D W. Comprehensive study of volatile compounds in two Australian rosé wines: Aroma extract dilution analysis (AEDA) of extracts prepared using solvent-assisted flavor evaporation (SAFE) or headspace solid-phase extraction (HS-SPE)[J]. Journal of Agricultural and Food Chemistry,2016,64(19): 3 838-3 848.
[30] ESCUDERO A,CAMPO E,FARI A L,et al. Analytical characterization of the aroma of five premium red wines. Insights into the role of odor families and the concept of fruitiness of wines[J]. Journal of Agricultural and Food Chemistry,2007,55(11): 4 501-4 510.
A L,et al. Analytical characterization of the aroma of five premium red wines. Insights into the role of odor families and the concept of fruitiness of wines[J]. Journal of Agricultural and Food Chemistry,2007,55(11): 4 501-4 510.