ε-聚赖氨酸是一种L-赖氨酸均聚物,主要由链霉菌属和一些丝状真菌分泌产生[1-2]。由于ε-聚赖氨酸具备易被生物降解、可食用、对人体和环境无毒无害等特点而广泛应用于食品和医药行业[3-5]。近几年,人们对ε-聚赖氨酸的研究也越来越多,但大多都是针对ε-聚赖氨酸生产菌株进行发酵条件优化(包括培养基优化[6]、营养物质流加[7]、pH调控[8]等)和菌株育种改造(物理和化学诱变[9-10]、核糖体工程[11]、等离子诱变和基因组改组[12])等策略来改善ε-聚赖氨酸的产量。利用白色链霉菌直接进行发酵来实现ε-聚赖氨酸的生产是最为常用的方法,如REN等利用发酵培养基优化和两阶段pH控制策略,对Streptomyces sp.M-Z18进行5 L发酵罐补料分批发酵192 h,其ε-聚赖氨酸产量高达54.7 g/L[8]。虽然其ε-聚赖氨酸产量很高,但发酵周期长,且发酵液成分复杂,不利于ε-聚赖氨酸的分离纯化。
利用全细胞作为催化剂进行目标产物的生产已成为一种趋势,这种方法成本低、易操作,而且副产物少、有利于分离纯化。目前,ε-聚赖氨酸的生产菌株大多是白色链霉菌,白色链霉菌是非食品安全性菌株,而ε-聚赖氨酸主要用于食品和医药行业,故其产品安全性问题令人堪忧[13-14]。枯草芽孢杆菌(Bacillus subtilis)是一种经美国食品药品监督管理局批准的GRAS菌株,常用作细胞工厂进行重组蛋白、氨基酸和化学品等的生产[15-16],且目前仅有一项研究是利用Bacillus subtilis进行ε-聚赖氨酸的生产,其产量仅达76.3 mg/L[17]。
考虑到ε-聚赖氨酸产品的安全性问题,本研究克隆了经密码子优化的白色链霉菌Streptomyces albulus来源的ε-聚赖氨酸合酶编码基因pls,成功实现了ε-聚赖氨酸合酶在食品安全性菌株Bacillus subtilis 168中的异源表达,获得了B. subtilis 168/pMA5-pls重组菌株。针对B. subtilis 168/pMA5-pls重组菌株全细胞催化生产ε-聚赖氨酸的催化体系进行了优化,结果表明,在L-赖氨酸产量为0.5 g/L, 初始pH和温度分别为3.0和30 ℃条件下,转化4 h,ε-聚赖氨酸的产量达到195.1 mg/L,远高于已报道的B.subtilis直接发酵生产的ε-聚赖氨酸产量。本研究构建的全细胞催化体系为食品级ε-聚赖氨酸的生产提供了一种新的策略。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
本研究中所用到的菌株Escherichia coli JM109、Bacillus subtilis 168、Mycobacterium neoaurum VKM Ac-1815D以及质粒pMA5,均为本实验室保藏;pET28a-pls质粒,苏州金唯智生物科技有限公司合成。
1.1.2 实验试剂
Nde I、BamH I限制性内切酶和10 000 bp核酸marker等,大连宝生物公司;高保真酶、同源重组酶克隆试剂盒,南京诺维赞生物科技有限公司;小量质粒提取试剂盒、琼脂糖凝胶DNA回收试剂盒,上海捷瑞生物工程有限公司;L-赖氨酸和ε-聚赖氨酸,Sigma公司;二硫苏糖醇(dithiothreitol,DTT)、洗涤剂NP-40和BHI培养基,上海阿拉丁有限公司。
1.1.3 培养基与缓冲液
LB培养基(g/L):蛋白胨10、酵母提取物5、NaCl 10,固体培养基则加入1.5%~2.0%(质量分数)的琼脂粉,根据需要加入相应浓度的抗生素。
M3G发酵培养基(g/L):葡萄糖60、酵母提取物10.5、(NH4)2SO4 15、K2HPO2 3.5、MgSO4·7H2O 1.25、ZnSO4·7H2O 0.1和FeSO4·7H2O 0.02。
BHI培养基:根据配方说明,按照36.5 g/L进行配置。
缓冲液A:100 mmol/L Tris-HCl,20%甘油(体积分数),2 mmol/L 乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),0.2 mol/L NaCl和5 mmol/L DTT,pH 8.0。
缓冲液B:50 mmol/L Tris-HCl,20% 甘油(体积分数), 1 mol/L NaCl和 5 mmol/L DTT,pH 8.0。
缓冲液C:10 mmol/L 三羟甲基甲胺基丙磺酸(N-[Tris(hydroxymethyl)metyl]-3-aminopropanesulfonic acid,TAPS)-NaOH, 5 mmol/L MgCl2,0.5 mmol/L 腺嘌呤核苷三磷酸(adenosine triphosphate,ATP), 0.1 mmol/L DTT,2 g/L NP-40, 10%甘油(体积分数),pH 8.5。
1.2 实验方法
1.2.1 ε-聚赖氨酸合酶编码基因pls的克隆
将NCBI数据库查询到的S.albulus来源的ε-聚赖氨酸合酶编码基因pls序列提交至苏州金唯智生物科技有限公司进行合成,并进行密码子优化,以利于其在B. subtilis 168的异源表达。
以公司提供的pET28a-pls重组质粒为模板,以pls-F:aaaaggagcgatttacatatgatgagtagtccgctgctggaga和pls-R:gagctcgactctagaggatccttatgctgctgcgccaccctcg为引物进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,获得含同源臂的pls基因片段。
1.2.2 重组菌株的构建
将胶回收纯化的pls基因片段与经Nde I、BamH I限制性快切酶酶切且胶回收获得的pMA5线性化质粒在37 ℃下同源重组连接30 min,获得的连接产物转化E. coli JM109感受态细胞,涂布至含质量浓度50 μg/mL氨苄青霉素的LB平板上,于37 ℃培养箱倒置培养8~12 h。挑取转化子进行培养,提取重组质粒进行双酶切验证,验证正确的质粒送苏州金唯智有限公司进行测序分析,SnapGene 2.3.2软件分析测序结果,测序正确的重组质粒命名为pMA5-pls。
将重组质粒pMA5-pls转化B. subtilis 168感受态细胞,涂布至含质量浓度50 μg/mL卡那霉素的LB平板上,于37 ℃培养箱倒置培养8~12 h。挑取转化子进行菌落PCR验证,验证正确的重组菌株命名为B. subtilis 168/pMA5-pls。
1.2.3 ε-聚赖氨酸合酶的表达
首先,将冻干管保存的B. subtilis 168/pMA5-pls重组菌株在含质量浓度50 μg/mL卡那霉素的LB平板上划线活化,挑取单菌落转接10 mL的LB液体培养基(含50 μg/mL卡那霉素),37 ℃、200 r/min下培养8~12 h后,按10%接种量转接50 mL的M3G发酵培养基(含质量浓度50 μg/mL卡那霉素),30 ℃、180 r/min下培养72 h,以诱导ε-聚赖氨酸合酶的表达。之后,在4 ℃、10 000 r/min下离心10 min收集细胞,弃去培养基,细胞菌体用10 mL缓冲液A清洗悬浮后,4 ℃、10 000 r/min下离心20 min,弃去上清液。再换用等量缓冲液B清洗悬浮,4 ℃、8 000 r/min下离心5 min,弃去上清液。最后,将细胞菌体悬浮于5 mL缓冲液C中并用超声破碎仪进行破碎,破碎液在4 ℃下离心20 min,收集上清,用于后续的酶活测定,蛋白浓度测定采用Bradford法[18-19]。对照菌株B. subtilis 168按照同样的方法进行诱导表达。
1.2.4 酶活测定
ε-聚赖氨酸合酶的酶活测定体系[20-22]:100 nmol/L、pH 8.5的TAPS-NaOH,990 mmol/L L-赖氨酸,5 mmol/L MgCl2,5 mmol/L ATP,1 mmol/L DTT,20%甘油(体积分数),2 g/L NP-40和占总体积10%的酶溶液。
首先,将不含粗酶液的反应混合物在30 ℃下孵育10 min,然后加入反应总体系10%的粗酶液启动酶反应,反应10 min后,在酶反应体系中加入质量浓度150 g/L三氯乙酸溶液以终止反应。
配置不同质量浓度的ε-聚赖氨酸标准溶液(25~200 mg/L),各取1 mL不同浓度的ε-聚赖氨酸标准溶液加入到2.8 mL磷酸盐缓冲液(0.1 mmol/L、pH 7.0)中,再添加120 μL台盼蓝溶液(1 mg/mL),充分混合并在37 ℃下孵育60 min,测定A580[23],绘制标准曲线。按照同样的操作方法,将1 mL转化液加入到2.8 mL 磷酸盐缓冲液(0.1 mmol/L、pH 7.0)中,并添加120 μL台盼蓝溶液(1 mg/mL),充分混合并在37 ℃下孵育60 min,测定A580。酶活定义为1 min生成1 μmol的ε-聚赖氨酸所需的酶量为1 U。ε-聚赖氨酸含量的计算则通过将测得的A580代入标准曲线方程来确定。
1.2.5 ε-聚赖氨酸的MALDI-TOF-MS质谱分析
将转化液进行基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time of flight mass spectrometry,MALDI-TOF-MS)分析,以确定转化液中是否生成ε-聚赖氨酸,并将所得数据利用MassLynx 4.1 SCN 562/SCN 568软件计算ε-聚赖氨酸的分子质量[24-26],并判断产物ε-聚赖氨酸的聚合状态。
1.2.6 全细胞催化生产ε-聚赖氨酸
将冻干管保存的B. subtilis 168/pMA5-pls重组菌株首先在含质量浓度50 μg/mL卡那霉素的LB平板上划线活化,挑取单菌落转接10 mL的LB液体培养基(含50 μg/mL卡那霉素),37 ℃、200 r/min下培养8~12 h后,转接250 mL的M3G发酵培养基(含质量浓度50 μg/mL卡那霉素),30 ℃、180 r/min下培养72 h,4 ℃、10 000 r/min下离心10 min以收集菌体细胞。取25 mg的L-赖氨酸投加至50 mL缓冲液C中使转化体系中L-赖氨酸终质量浓度为0.5 g/L,然后再在转化体系中投加5 g细胞菌体并充分混合,最后,于30 ℃、200 r/min下连续转化4 h,测定转化液中ε-聚赖氨酸的含量。
1.2.7 抗菌活性检测
将大肠杆菌(E. coli JM109)和新生分枝杆菌(Mycobacterium neoaurum VKM Ac-1815D)分别接种到LB和BHI培养基中,分别置于37 ℃和30 ℃下培养12 h。将取适量获得的菌液分别涂布于LB和BHI固体平板,并在平板中间加入含有200 μL的重组菌株B. subtilis 168/pMA5-pls转化液,最后,分别置于37 ℃培养24 h和30 ℃培养48 h,观察有无明显抑菌圈。
2 结果与分析
2.1 B. subtilis 168/pMA5-pls重组菌株的构建
根据文献报道,白色链霉菌来源的基因GC偏高,这可能不利于其在其他宿主细胞中进行异源表达[27]。于是,我们对NCBI数据库查询到的白色链霉菌S.albulus来源的ε-聚赖氨酸合酶编码基因pls(GenBank: AB385841.1)的GC含量进行分析,结果表明其GC含量高达75%。因此,在pls基因合成过程中,对其密码子进行了优化,使其GC含量降低为58.21%,以期能够成功实现在B. subtilis 168中的异源表达。
如图1所示,以pls-F和pls-R为引物,以pET28a-pls质粒为模板PCR扩增获得的pls基因片段,回收后的pls基因片段与pMA5线性化质粒进行同源重组连接,连接产物转化E. coli JM109。重组质粒进行双酶切验证,验证成功的送苏州金唯智有限公司进行测序分析,SnapGene 2.3.2软件分析测序结果,测序正确的菌株命名为E.coli JM109/pMA5-pls。重组质粒pMA5-pls转化B. subtilis 168感受态细胞,转化子菌落PCR验证正确的重组菌株命名为B. subtilis 168/pMA5-pls。
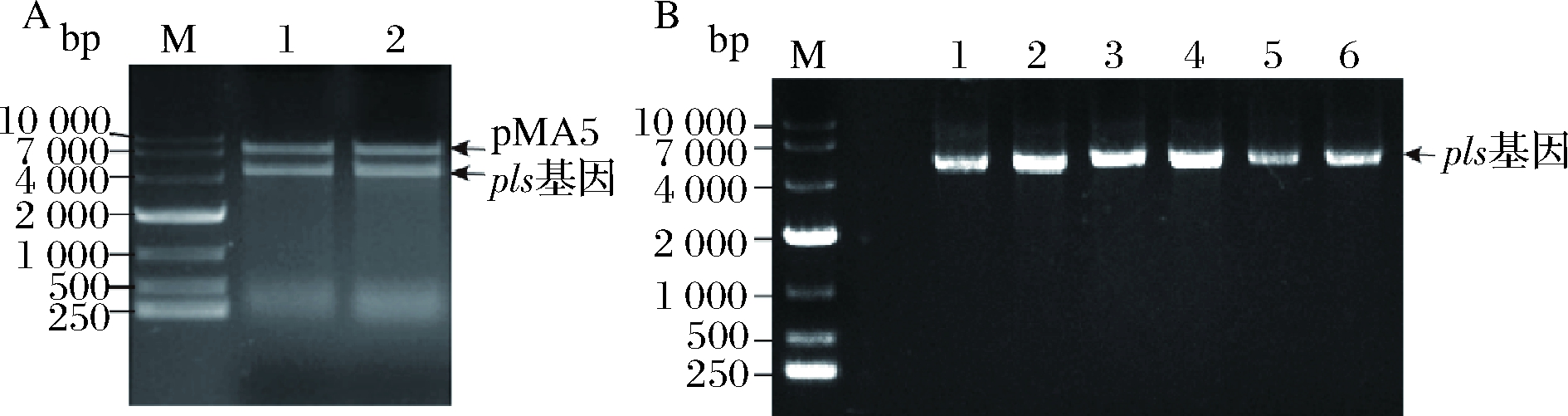
M,10 000 bp核酸Marker;A中泳道1~2,pMA5-pls重组质粒双酶切验证结果;B中泳道1~6,重组菌株B. subtilis168/pMA5-pls转化子菌落PCR验证结果A-双酶切验证;B-菌落PCR验证
图1 pMA5-pls重组质粒酶切验证与菌落PCR验证
Fig.1 Verification of pMA5-pls recombinant plasmid by enzyme digestion and colony PCR
2.2 ε-聚赖氨酸合酶的表达与酶活测定
将B. subtilis 168对照菌株与B. subtilis 168/pMA5-pls重组菌株按照1.2.3所述的方法进行ε-聚赖氨酸合酶的诱导表达,细胞破碎离心收集的粗酶液进行酶活测定,酶活测定结果显示,B. subtilis 168对照菌株中未检测到ε-聚赖氨酸合酶酶活,而B. subtilis 168/pMA5-pls重组菌株中检测到ε-聚赖氨酸合酶酶活,通过计算得出,ε-聚赖氨酸合酶的比酶活为71 U/mg,即ε-聚赖氨酸合酶在B. subtilis 168中成功实现了功能性表达。
2.3 ε-聚赖氨酸的MALDI-TOF-MS分析
ε-聚赖氨酸的抑菌谱很广,对革兰氏阴性菌、革兰氏阳性菌以及一些病毒都有较好的抑菌效果,而ε-聚赖氨酸的抑菌活性与L-赖氨酸的聚合度有关。当L-赖氨酸的聚合度低于9时,ε-聚赖氨酸几乎没有抑菌活性,只有当L-赖氨酸的聚合度高于9时,特别是聚合度为25~35,ε-聚赖氨酸具有较强的抑菌活性[2, 28]。
为了鉴定酶反应产物是否为目的产物ε-聚赖氨酸,并确定ε-聚赖氨酸的聚合状态和相对分子质量。采用MALDI-TOF-MS对酶反应产物进行了分析。结果如图2所示,B. subtilis 168/pMA5-pls重组菌株转化L-赖氨酸生成的ε-聚赖氨酸的相对分子质量分布在3 605~4 502 Da,且主要集中于4 118 Da。根据赖氨酸的分子质量,可知其对应聚合度为25~30,主要为28,进一步验证了ε-聚赖氨酸合酶在B. subtilis 168中成功实现了功能性表达。
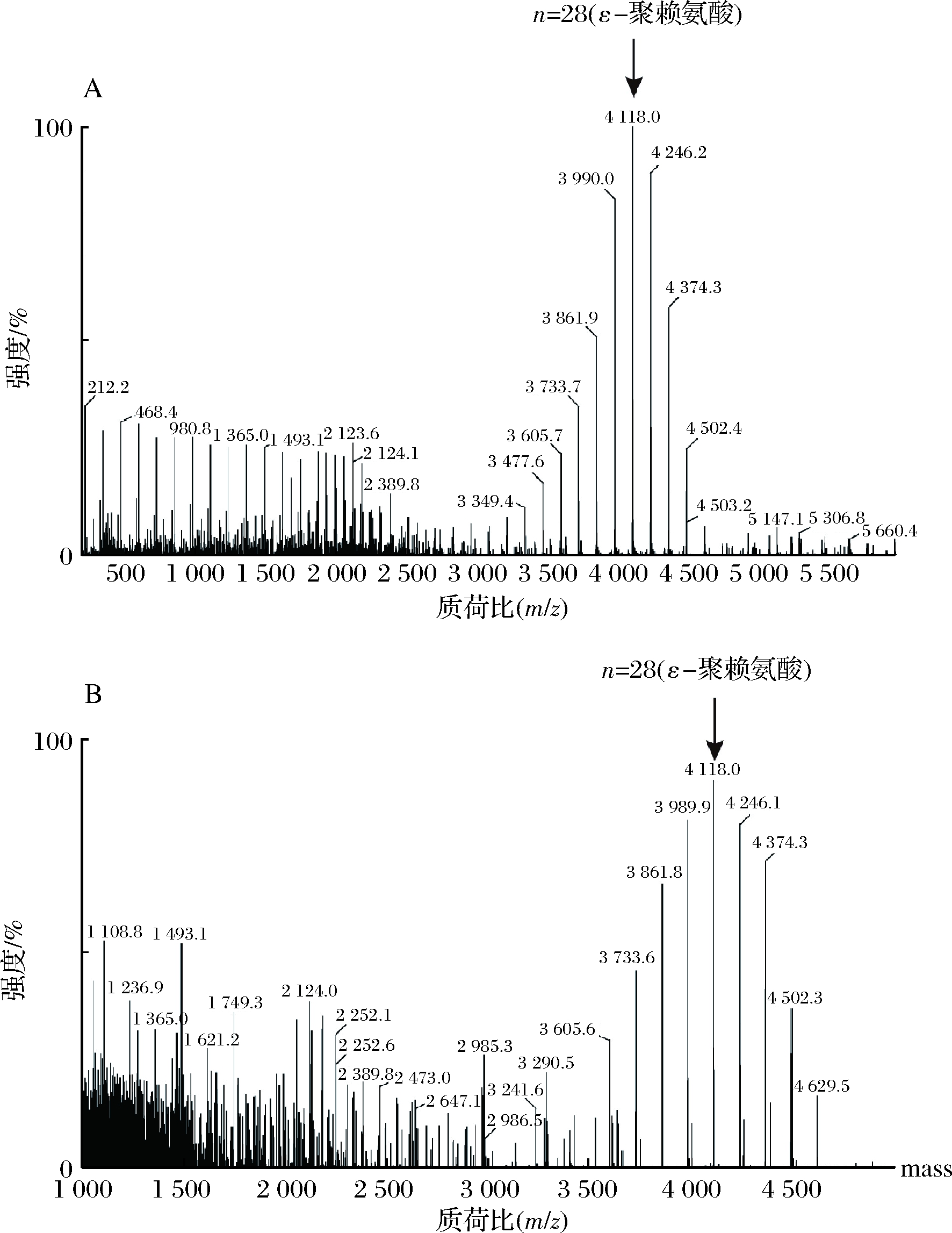
A-ε-聚赖氨酸标准样品;B-转化液样品
图2 MALDI-TOF-MS分析结果
Fig.2 Analysis results of MALDI-TOF-MS
2.4 B. subtilis 168/pMA5-pls重组菌株全细胞催化生产ε-聚赖氨酸的条件优化
2.4.1 温度对ε-聚赖氨酸生产的影响
温度主要通过影响酶活性进而影响产物的生成。通过将5 g的 B. subtilis 168/pMA5-pls重组菌株的菌体投入到添加质量浓度0.5 g/L底物 L-赖氨酸的50 mL缓冲液C中,分别置于20、25、30、35、40、45和50 ℃,200 r/min下转化4 h,检测ε-聚赖氨酸含量,以确定最优转化温度。如图3所示,在20~30 ℃,ε-聚赖氨酸含量随着温度的升高而升高,最优温度为30 ℃,ε-聚赖氨酸质量浓度达到181.6 mg/L;但当温度超过30 ℃时,温度越高,ε-聚赖氨酸含量不断下降,特别是温度为45 ℃时,ε-聚赖氨酸含量较35 ℃时的ε-聚赖氨酸下降了56.9%。由此可知,B. subtilis 168/pMA5-pls重组菌株全细胞催化生产ε-聚赖氨酸的最优温度为30 ℃。
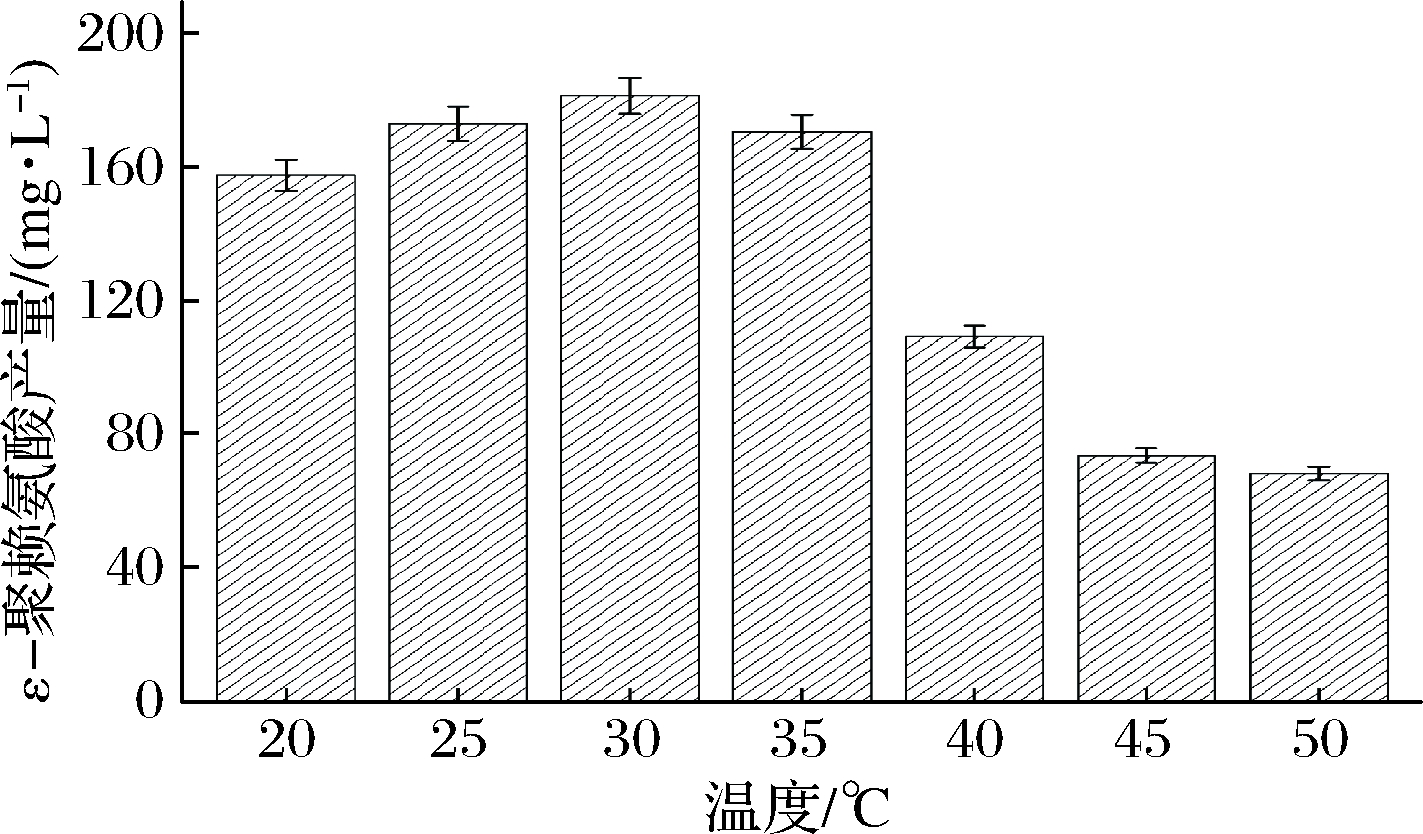
图3 温度对ε-聚赖氨酸生产的影响
Fig.3 Effect of temperature on ε-poly-L-lysine production
2.4.2 初始pH对ε-聚赖氨酸生产的影响
将5 g的 B. subtilis 168/pMA5-pls重组菌株的菌体投入到添加质量浓度0.5 g/L底物L-赖氨酸的不同pH的50 mL缓冲液C中,pH分别设为2.0、3.0、4.0、5.0、6.0和7.0,于30 ℃、200 r/min下反应4 h,检测不同pH条件下ε-聚赖氨酸的含量。由图4结果分析可知,pH为3.0时,ε-聚赖氨酸的含量最高,为185.9 mg/L。当pH高于3.0时,ε-聚赖氨酸的含量不断下降,pH为7.0时,ε-聚赖氨酸的含量仅为109.4 mg/L。由此可知,B. subtilis 168/pMA5-pls重组菌株全细胞催化生产ε-聚赖氨酸的最优pH为3.0。
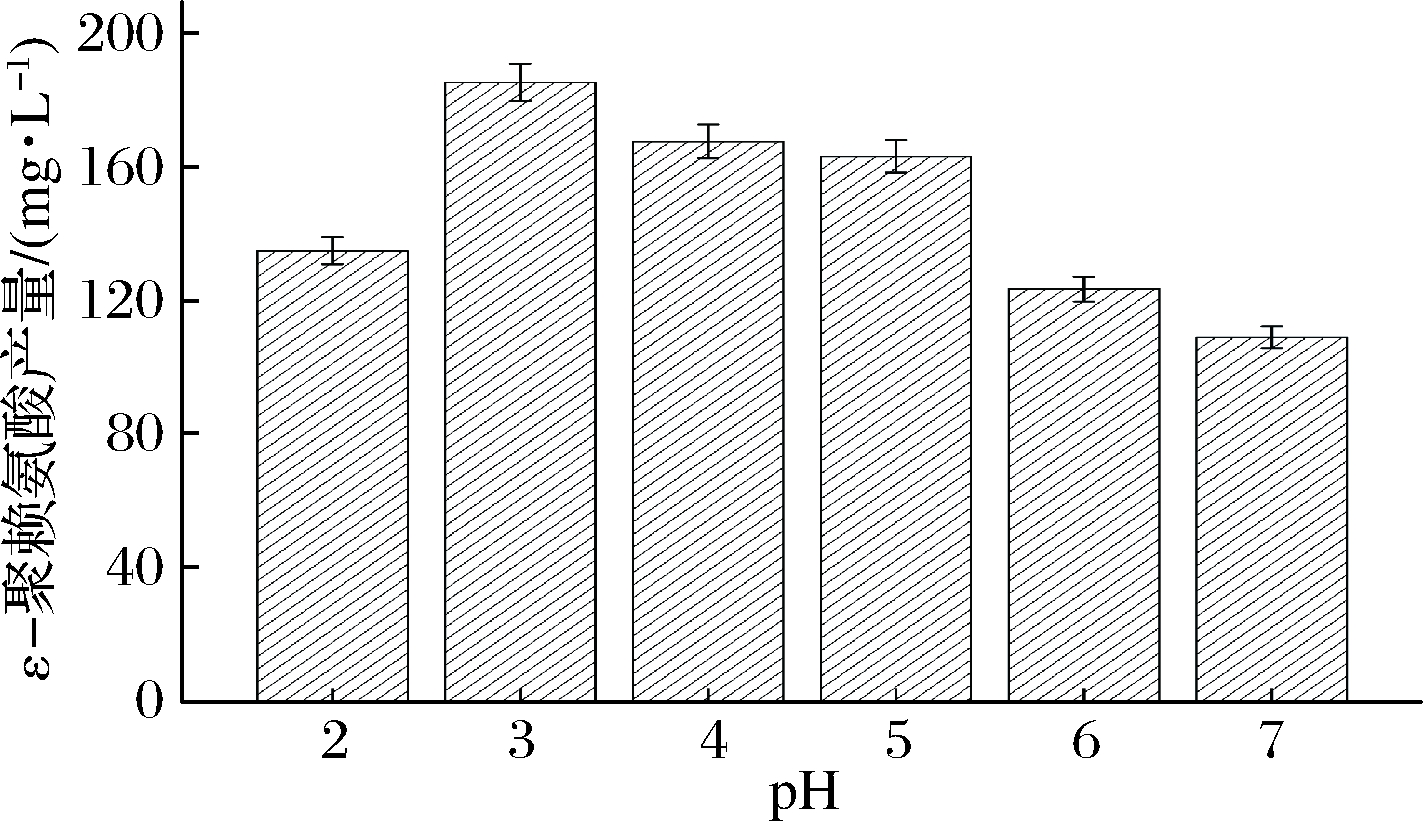
图4 初始pH对ε-聚赖氨酸生产的影响
Fig.4 Effect of initial pH on ε-poly-L-lysine production
2.4.3 底物浓度对ε-聚赖氨酸生产的影响
首先在pH 3.0的缓冲液C中投加不同质量浓度的L-赖氨酸(0.1~1.0 g/L,质量浓度间隔为0.1 g/L),之后分别投加5 g的 B. subtilis 168/pMA5-pls重组菌株的菌体,于30 ℃、200 r/min下反应4 h,检测不同L-赖氨酸质量浓度下ε-聚赖氨酸的含量。由图5可知,L-赖氨酸质量浓度在0.1~0.5 g/L时,随着质量浓度的升高,ε-聚赖氨酸的含量上升缓慢,但当L-赖氨酸质量浓度上升至0.5 g/L时,ε-聚赖氨酸的含量上升迅速,达到195.1 mg/L。而L-赖氨酸质量浓度继续提高时,ε-聚赖氨酸的含量却不断降低。由此可知,B. subtilis 168/pMA5-pls重组菌株全细胞催化生产ε-聚赖氨酸的最优底物质量浓度为0.5 g/L。

图5 不同L-赖氨酸质量浓度对ε-聚赖氨酸生产的影响
Fig.5 Effect of different L-lysine concentrations on ε-poly-L-lysine production
2.5 ε-聚赖氨酸的抗菌活性检测
为了验证B. subtilis 168/pMA5-pls重组菌株全细胞催化L-赖氨酸产生的ε-聚赖氨酸是否具有抗菌活性。本研究以大肠杆菌E. coli和分枝杆菌M.neoaurum VKM Ac-1815D为研究对象,测试了反应产物对大肠杆菌E. coli和分枝杆菌M.neoaurum VKM Ac-1815D的生长是否有影响。测试结果如图6所示, E.coli形成的抑菌圈直径约为13 mm,M.neoaurum VKM Ac-1815D形成的抑菌圈直径约为12 mm。结果表明,全细胞催化生成的ε-聚赖氨酸能够抑制E. coli JM109和M.neoaurum VKM Ac-1815D的生长,进一步证实了ε-聚赖氨酸合酶成功实现了在B. subtilis 168中的功能性表达,利用B. subtilis 168/pMA5-pls重组菌株全细胞催化L-赖氨酸产生的ε-聚赖氨酸具有良好的抑菌效果。
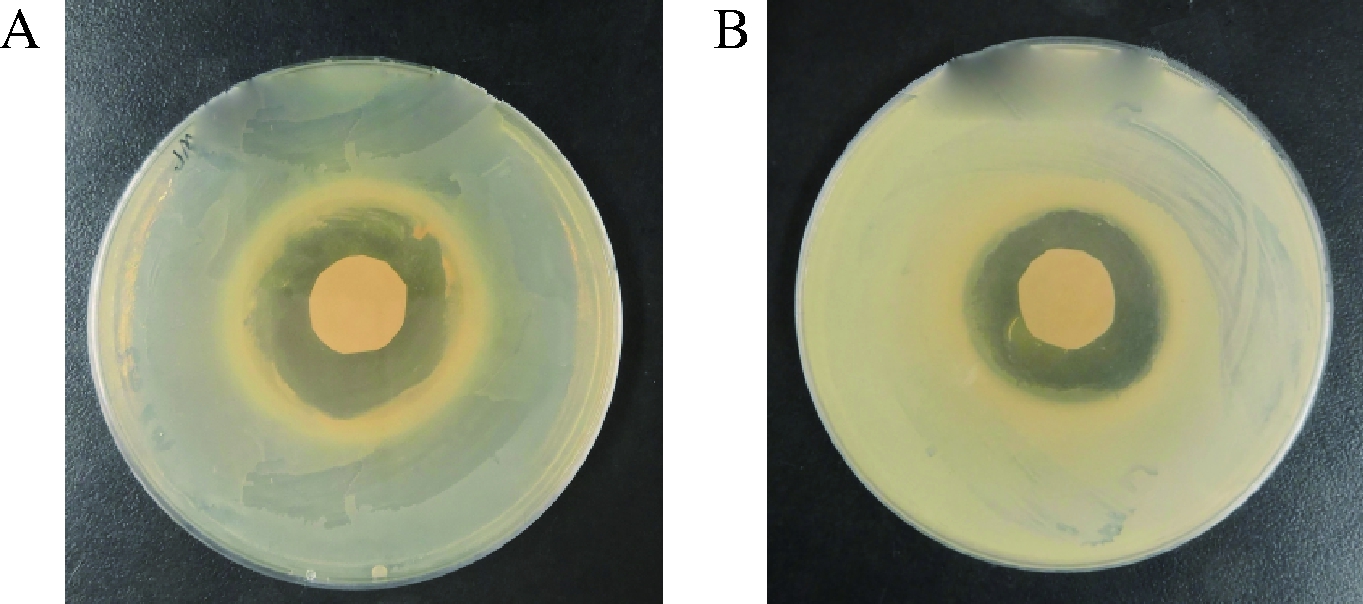
A-ε-聚赖氨酸对E. coli JM109的抑菌效果;B-ε-聚赖氨酸对M.neoaurum VKM Ac-1815D的抑菌效果
图6 ε-聚赖氨酸的抗菌活性检测
Fig.6 Antibacterial activity test of ε-poly-L-lysine
3 讨论
ε-聚赖氨酸是一种由25~35个L-赖氨酸通过异形肽键连接而成的较为特殊的阳离子氨基酸聚合物,由于其具备易降解、可食用、对人体和环境无毒无害等特性而广泛应用于食品和医药行业[3-5]。尽管目前通过对白色链霉菌菌种选育结合发酵条件优化策略,ε-聚赖氨酸产量已达到较高水平,但是,非GRAS菌株产生的ε-聚赖氨酸的安全性问题却令人堪忧,这可能会限制其在食品和医药行业的应用[13-14]。SHIMA等曾通过14C放射性同位素标记技术对L-赖氨酸进行标记,证实了L-赖氨酸是ε-聚赖氨酸生产的前体物质[29]。然而,目前未有将ε-聚赖氨酸合酶异源表达,利用全细胞催化实现ε-聚赖氨酸生产的相关研究、本文首次实现了ε-聚赖氨酸合酶在GRAS菌株B. subtilis 168中的异源表达,并将其作为细胞工厂,全细胞催化实现了ε-聚赖氨酸的生物合成。
虽然本研究获得的ε-聚赖氨酸的含量未达到较高水平,但是却为食品级ε-聚赖氨酸的生产提供了一种新策略。下一步,将会针对ε-聚赖氨酸合酶进行理性改造,提高其催化活性,以进一步改善ε-聚赖氨酸产量。
[1] YOSHIDA T,NAGASAWA T.ε-poly-L-lysine: Microbial production, biodegradation and application potential[J].Applied Microbiology and Biotechnology,2003,62(1):21-26.
[2] 石慧,李婵娟,张俊红. ε-聚赖氨酸产生菌及其应用研究概述[J].食品与发酵工业,2016,42(9):263-269.
[3] 张伟娜,李迎秋.ε-聚赖氨酸在食品中应用的进展[J].中国调味品,2012,37(12):5-9.
[4] HYLDGAARD M,MYGIND T,VAD B S,et al.The antimicrobial mechanism of action of ε-poly-L-lysine[J].Applied & Environental Microbiology,2014,80(24):7 758-7 770.
[5] YE Ruosong,XU Hengyi,WAN Cuixiang,et al.Antibacterial activity and mechanism of action of ε-poly-L-lysine[J].Biochemical Biophysical Research Communications,2013,439(1):148-153.
[6] CHEN Xusheng,TANG Lei,LI Shu, et al.Optimization of medium for enhancement of ε-Poly-L-Lysine production by Streptomyces sp. M-Z18 with glycerol as carbon source[J]. Bioresource Technology,2011,102(2):1 727-1 732.
[7] 董难,陈旭升,任喜东,等.发酵过程流加L-谷氨酸提高ε-聚赖氨酸的产量[J].食品与发酵工业,2013,39(7):79-82.
[8] REN Xidong,CHEN Xusheng,ZENG Xin,et al.Acidic pH shock induced overproduction of ε-poly-L-lysine in fed-batch fermentation by Streptomyces sp. M-Z18 from agro-industrial by-products[J].Bioprocess and Biosystems Engineering,2015,38(6):1 113-1 125.
[9] 余明洁,田丰伟,范大明,等.高产ε-聚赖氨酸白色链霉菌的复合诱变选育研究[J].食品工业科技,2008,29(7):99-101;104.
[10] 张超,王正刚,段作营,等.大剂量紫外诱变选育ε-聚赖氨酸高产菌[J].生物加工过程,2007,5(3):64-68.
[11] 吴光耀,陈旭升,王靓,等.核糖体工程技术选育ε-聚赖氨酸高产菌株[J].微生物学通报,2016,43(12):2 744-2 751.
[12] ZHOU Yongpeng,REN Xidong,WANG Liang,et al.Enhancement of ε-poly-lysine production in ε-poly-lysine-tolerant Streptomyces sp. by genome shuffling[J].Bioprocess & Biosystems Engineering,2015,38(9):1 705-1 713.
[13] SHIH I,SHEN M,VAN Y.Microbial synthesis of poly(ε-lysine) and its various applications[J].Bioresource Technology,2006,97(9):1 148-1 159.
[14] SHI Ci,ZHAO Xingchen,LIU Zonghui,et al.Antimicrobial, antioxidant, and antitumor activity of epsilon ε-poly-L-lysine and citral, alone or in combination[J].Food & Nutrition Research,2016,60(1):31 891.
[15] SINGH M,PATEL S K,KALIA V C.Bacillus subtilis as potential producer for polyhydroxyalkanoates[J].Microbial Cell Factories,2009,8(1): 38.
[16] WESTERS L,WESTERS H,QUAX W J.Bacillus subtilis as cell factory for pharmaceutical proteins: A biotechnological approach to optimize the host organism[J].Biochim et Biophys Acta,2004,1 694(1-3):299-310.
[17] EL-SERSY N A,ABDELWAHAB A E,ABOUELKHIIR S S,et al.Antibacterial and anticancer activity of ε-poly-L-lysine (ε-PL) produced by a marine Bacillus subtilis sp.[J].Journal of Basic Microbiology,2012,52(5):513-522.
[18] WALKER J M.The Protein Protocols Handbook[M].3rd edition T,New Jersey: Humama Press,2009.
[19] KRUGER N J.The bradford method for protein quantitation[J].Methods Mol Biol,1994,32:9-15.
[20] ZENG X,CHEN X S,REN X D,et al.Insights into the role of glucose and glycerol as a mixed carbon source in the improvement of ε-poly-L-lysine productivity[J].Applied Biochemistry Biotechnology,2014,173(8):2 211-2 224.
[21] WANG L,LI S,ZHAO J,et al.Efficiently activated ε-poly-L-lysine production by multiple antibiotic-resistance mutations and acidic pH shock optimization in Streptomyces albulus[J].Microbiologyopen,2019,8(5):e00 728.
[22] YAMANAKA K,MARUYAMA C,TAKAGI H,et al.ε-poly-L-lysine dispersity is controlled by a highly unusual nonribosomal peptide synthetase[J].Nature Chemical Biology,2008,4(12):766-772.
[23] SHEN W C,YANG D,RYSER J P.Colorimetric determination of microgram quantities of polylysine by trypan blue precipitation[J].Analytical Biochemistry,1984,142(2):521-524.
[24] MAEDA S,KUNIMOTO K K,SASAKI C,et al.Characterization of microbial poly (ε-L-lysine) by FT-IR, Raman and solid state 13C NMR spectroscopies[J].Journal of Molecular Structure,2003,655(1):149-155.
[25] 黄静敏,吴清平,刘盛荣,等.ε-聚赖氨酸产生菌新菌株的筛选和产物结构鉴定[J].微生物学通报,2011,38(6):871-877.
[26] NISHIKAWA M.Molecular mass control using polyanionic cyclodextrin derivatives for the ε-poly-L-lysine biosynthesis by Streptomyces[J].Enzyme and Microbial Technology,2009,45(4):295-298.
[27] GUSTAFSSON C,GOVINDARAJAN S,MINSHULL J.Codon bias and heterologous protein expression[J].Trends in Biotechnology,2004,22(7):346-353.
[28] SHIMA S,MATSUOKA H,IWAMOTO T,et al.Antimicrobial action of ε-poly-L-lysine[J]. Journal of Antibiotics,1984,37(11):1 449-1 455.
[29] SHIMA S,OSHIMA S,SAKAI H.Biosynthesis of ε-poly-L-lysine by washed mycelium of Streptomyces albulus no. 346[J].Journal of the Agricultural Chemical Society of Japan,1983,57(3):221-226.