凝结芽孢杆菌(Bacillus coagulans),革兰氏阳性杆菌,属芽孢杆菌属,端生芽孢无鞭毛[1],最早于1915年由HAMMER分离自酸败牛奶中,并且发现其能像传统乳酸菌一样高产L-乳酸,将其命名为芽孢乳酸菌,20世纪30年代,奥地利细菌学家将其归入乳酸菌大家族[2-3]。
乳酸菌是一类发酵糖类产乳酸的革兰氏阳性菌的总称,因其具有改善风味、调节肠道菌群平衡、提高免疫力等功能受到广大研究者的关注和重视[4]。目前国内外应用于乳制品和保健品的乳酸菌主要有双歧杆菌、乳球菌、保加利亚乳杆菌、嗜热链球菌、粪肠球菌和屎肠球菌等。然而,随着工业发展中加工方式和产品多样化的形式,乳酸菌不易保存、热耐性差等短板日渐明显。因此,开发一种抗逆性强且有益生特性的菌种成为当今研究的重大方向。研究表明,凝结芽孢杆菌可像传统乳酸菌—样进入动物肠道将乳糖发酵为乳酸,降低肠道pH,促进肠道蠕动,抑制沙门氏菌等有害菌的生长[5]。另一方面,凝结芽孢杆菌还具有芽孢杆菌属高抗逆性、易于培养、储存稳定等优点[6],其芽孢体具有耐酸、耐热和耐胆盐等特点,是进入胃肠道的重要保障[7]。
几十年研究以来,学者们对凝结芽孢杆菌杆的益生特性和安全性已进行权威认证[8],现已被中国农业部列为可直接饲用于畜禽生产的新型饲料添加剂[7],同时凝结芽孢杆菌被作为新资源食品公示[9]。目前已广泛应用于饲料加工、畜牧养殖、水产养殖、食品和药品等行业[10]。研究表明凝结芽孢杆菌替代抗生素添加于饲料中可有效提高幼仔动物的机体免疫力和生产性能[11];凝结芽孢杆菌对新生儿黄疸[12]、风湿性关节炎[13]、口疮性口炎、龋齿[14]、婴儿湿疹[15]等疾病的预防具有临床应用价值。但是凝结芽孢杆菌应用于饮料行业的研究报道较少。
本研究拟以奶粉来源凝结芽孢为研究对象,研究其耐酸、耐热和耐胆盐能力,并对耐受能力良好的分离株进行生产模拟挑战试验,旨在为凝结芽孢杆菌饮料发酵剂的研制提供优势菌种,为凝结芽孢杆菌发酵饮料的开发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试剂与耗材
MRS肉汤、平板计数琼脂、无菌均质袋,均购自海博生物技术有限公司。
1.1.2 仪器与设备
HH-S4电热数显恒温水浴锅,济南鑫贝西生物技术有限公司;ADX-SHP-160恒温培养箱,常州金坛金达仪器制造有限公司;STIK高压灭菌器,美国施都凯;SW-CJ-2FD净化工作台,上海博讯; Mixer B-400均质仪,瑞士BUCHI;VITEK2 COMPACT全自动微生物分析系统,法国梅里埃。
1.2 试验方法
1.2.1 细菌的分离与纯化
称取不同来源奶粉各25 g于无菌均质袋中,加入225 mL 80 ℃生理盐水后充分均质,水浴加热(80 ℃,20 min),加热结束后迅速冷却至室温,制成奶粉稀释液。分别取稀释液1 mL到MRS琼脂培养基中,涂布均匀后置于40 ℃生化培养箱中培养,48 h后挑取单菌落菌株,将菌落进行3次连续划线纯化后保藏待用。
1.2.2 细菌形态观察
挑取单菌落涂抹于洁净载玻片上,滴加草酸铵结晶紫初染1 min,纯净水洗去干燥后滴加碘液媒染1 min,95%乙醇脱色20 s后滴加番红复染2 min,清洗干燥后显微镜观察[16]。
1.2.3 凝结芽孢杆菌的鉴定
挑取镜检结果阳性的单菌落于质量浓度4.5 g/L盐水中,制成麦氏浊度为1.8的悬浊液,选取BCL VITEK鉴定板上机鉴定。
1.2.4 芽孢耐酸性试验
取待测菌株菌液0.1 mL,涂布于锰盐平板计数琼脂上,置于40 ℃恒温培养箱中培养5 d,菌体用无菌水洗脱后80 ℃处理10 min以灭杀凝结芽孢杆菌营养体,反复用无菌水清洗,离心后得到芽孢体,镜检观察芽孢形态。各取1 mL加热前后芽孢收集液梯度稀释后进行菌落计数,计算芽孢形成率。芽孢形成率计算如公式(1)所示。将80 ℃处理前后菌落总数无显著性差异的芽孢收集液冷藏待用。
形成率![]()
(1)
将待检测芽孢以106 CFU/mL的浓度接种于MRS肉汤培养基中,用盐酸调节pH,分别为2.0、 3.0、 4.0,以磷酸盐缓冲液为对照。保温5 h后取菌液1 mL进行菌落计数,计算芽孢存活率,每个pH值作3次重复,取平均数。芽孢杆菌存活率计算如公式(2)所示。若存活率超过100%则表示该处理条件下未对分离株产生抑制效果。
存活率![]()
(2)
1.2.5 高温杀菌试验
将待检测芽孢以106 CFU/mL的浓度分别接种于MRS肉汤培养基中,设置90、95、100 ℃的梯度杀菌温度,将待测菌液水浴加热10 min后取样1 mL进行菌落计数并计算芽孢存活率,以4 ℃保存的培养液为对照,每个温度作3次重复,取平均数。
1.2.6 芽孢耐胆盐试验
将待检测芽孢以106 CFU/mL的浓度分别接种于胆盐质量分数为0.5%和1.0%的MRS肉汤培养基中,以未添加胆盐的PBS为对照。置于42 ℃恒温培养箱中保温24 h,取待测菌液1 mL进行菌落计数并计算芽孢存活率,每个胆盐浓度作3次重复,取平均数。
1.2.7 酸性条件下的高温杀菌挑战试验
筛选出耐酸抗热的凝结芽孢杆菌菌株,将待检测芽孢以106 CFU/mL的浓度分别接种于MRS肉汤培养基中,用盐酸调节pH,分别为2.0、3.0、4.0,并设置90、95、100 ℃的梯度杀菌温度,将待测菌液水浴加热10 min后取样1 mL进行菌落计数并计算芽孢存活率。
1.2.8 数据分析
运用SPSS 19.0进行数据统计分析,运用Origin 9.0软件进行图表绘制。
2 结果与分析
2.1 分离菌株形态
分离得到的单菌落在PCA平板上呈白色不透明圆形状,边缘不整齐且表面突起。经染色鉴定为革兰氏阳性,菌体杆菌,菌体大小为1.0 μm×3.0 μm,单个生长,偶会形成短链。有卵圆形芽胞,端生,芽胞囊膨大。
2.2 分离菌株生化反应特征
将镜检结果为革兰氏阳性杆菌且带有芽孢的分离菌株上机鉴定,生理生化试验结果如表1所示,鉴定结果为凝结芽孢杆菌。
表1 凝结芽孢杆菌生化鉴定结果
Table 1 Biochemical identification of B. coagulans

注:+,90%~100%阳性;(+),76%~89%阳性;(-),11%~25%阳性;-,0%~10%阳性;置信度,99%概率为极好的鉴定
试验种类试验结果试验种类试验结果试验种类试验结果β-木糖苷酶-D-甘露醇+糖元-L-赖氨酸芳胺酶-D-甘露糖+肌醇-L-天冬氨酸芳胺酶-D-松三糖-甲基葡萄糖甙酸化+亮氨酸芳胺酶(-)N-乙酰-D-葡萄糖氨+二硫代硝基苯甲酸+苯丙氨酸芳胺酶+古老糖+甲基-D-木糖苷-脯氨酸芳胺酶+L-鼠李糖-α-甘露糖苷酶-β-半乳糖苷酶(+)β-葡萄糖苷酶-麦芽三糖+吡咯烷基芳胺酶+β-甘露糖苷酶-氨基酸芳胺酶-α-半乳糖苷酶+三氯氧化磷-D-核糖+丙氨酸芳胺酶-丙酮酸盐-腐胺同化-酪氨酸芳胺酶+α-葡萄糖苷酶-6.5%(质量分数)NaCl生长-N-乙酰-β-D-葡萄糖氨酶_D-塔格糖-卡那霉素耐受-丙氨酸-苯丙氨酸-脯氨酸芳胺酶+D-海藻糖+竹桃霉素耐受-环糊精+菊粉-七叶灵水解+D-半乳糖+D-葡萄糖+红四氮唑-多黏菌素B耐受-
2.3 芽孢耐酸性试验结果
凝结芽孢杆菌分离株耐酸性试验结果如图1所示,12株分离株对不同pH的生长环境表现出不同程度的耐受性。W3分离株随着pH的降低存活率呈上升趋势,W25分离株随着pH的降低存活率呈先降后升趋势,W80分离株随着pH的降低存活率呈先升后降趋势,剩余分离株随着pH的降低存活率呈下降趋势。其中,W3、W25、W80和W55分离株在pH=2.0时存活率分别为364.3%、100.6%、100.2%和78.4%,显著高于其余分离株(P < 0.05),表明这些分离株在酸性条件下可以较好的生长,对酸性环境有较强的耐受性。
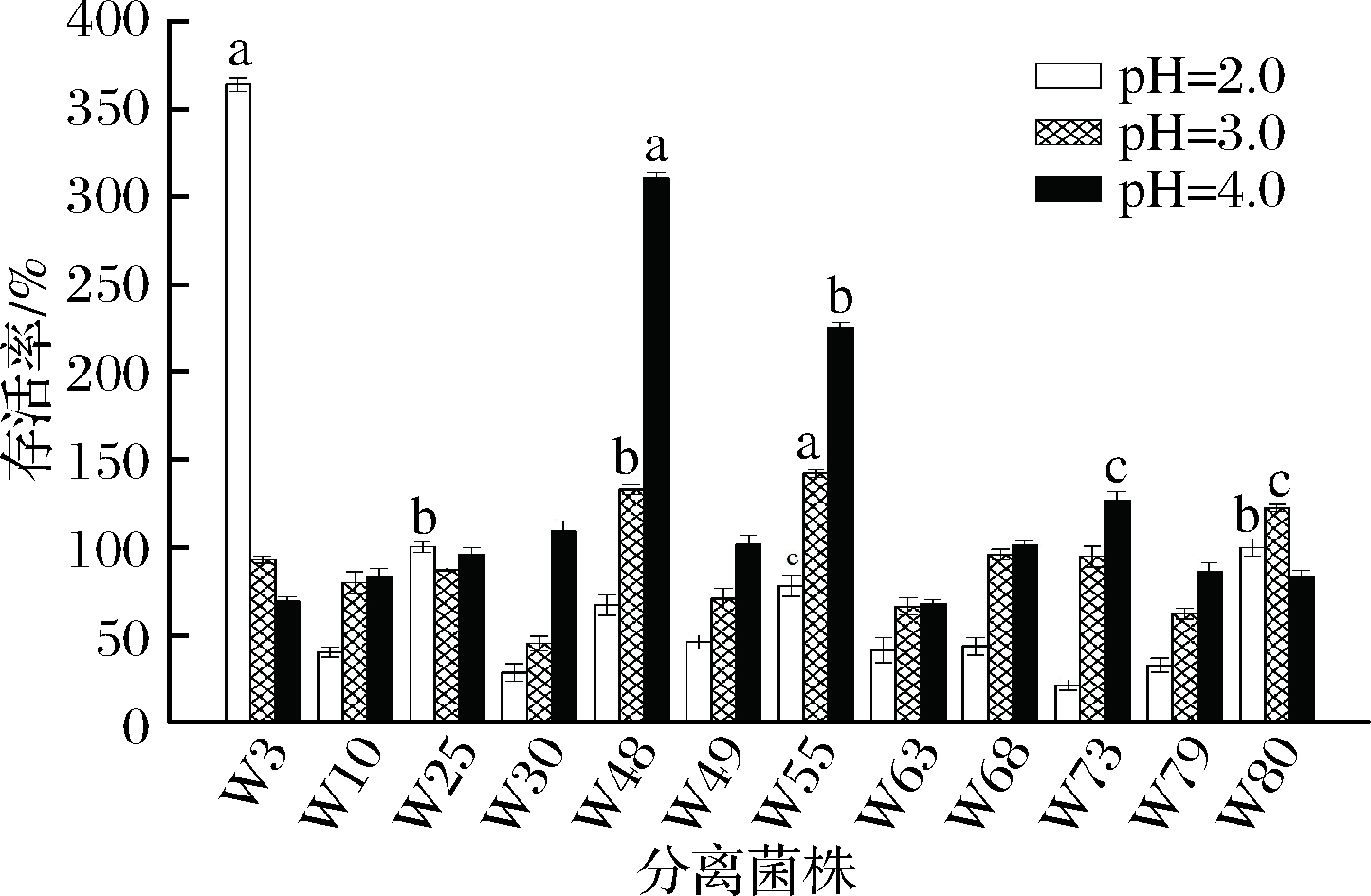
图1 耐酸性试验结果
Fig.1 Results of acid resistance test
注:数据以平均值±标准差的形式呈现,字母a~c则代表在该条件下分离菌株存活率存在显著性差异(下同)
2.4 芽孢耐热性试验结果
如图2所示,分离株在3个温度下的存活率分别为3.7%~211.4%、1.2%~49.1%和0.003%~0.9%。随着温度的提高,12株凝结芽孢杆菌分离株存活率下降明显(P<0.05)。在90 ℃下,W55、W80和W73存活率显著高于其余分离株(P<0.05);在95 ℃下,W25、W55和W68存活率显著高于其余分离株(P<0.05);在100 ℃温度下,W55、W10、W25和W80存活率显著高于其余分离株(P<0.05),综合分析表明,W55分离株对高温的耐受性高于其余分离株。
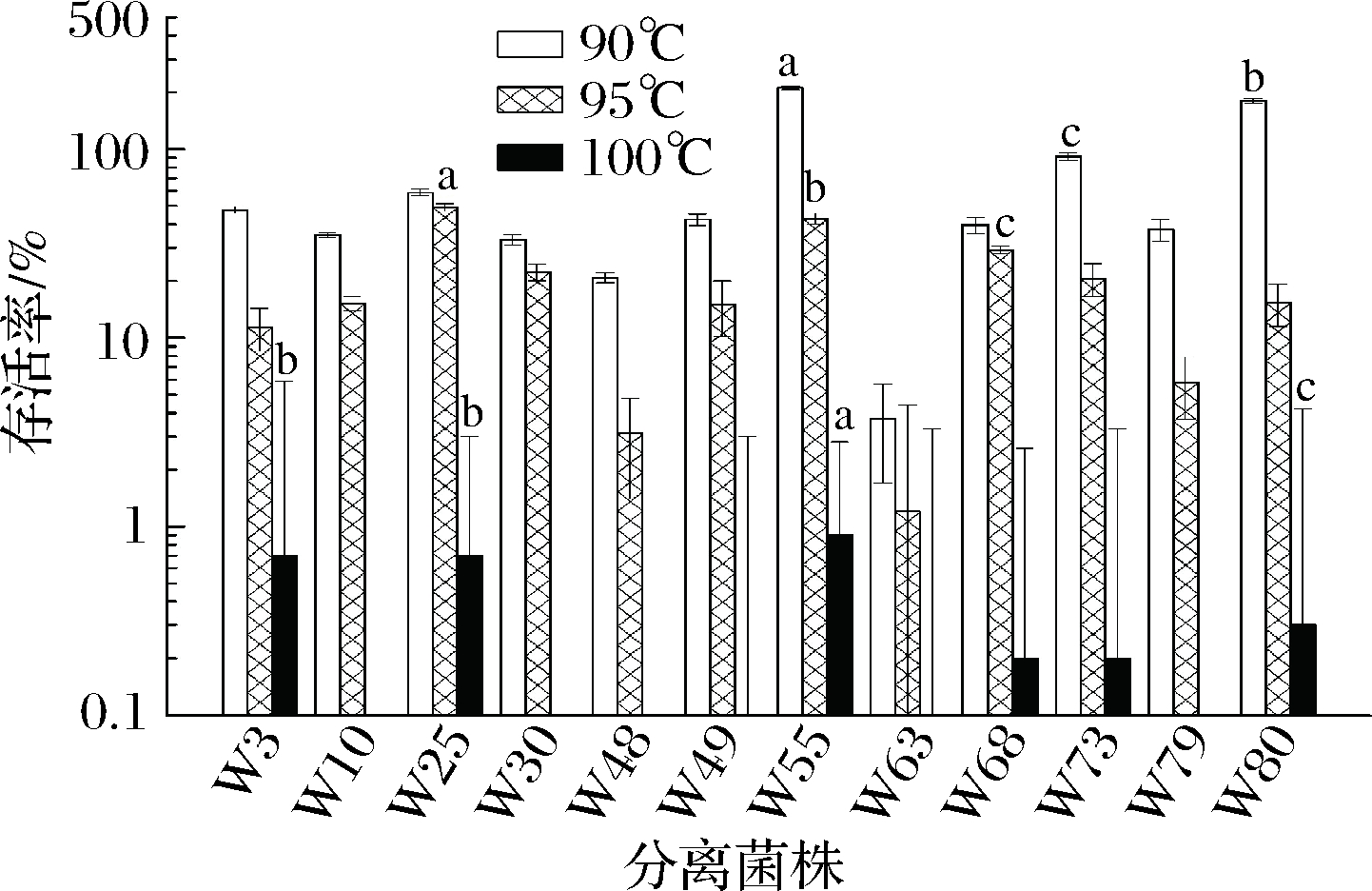
图2 耐热性试验结果
Fig.2 Results of heat resistance
2.5 芽孢耐胆盐试验结果
由图3可知,12株凝结芽孢杆菌分离株对胆盐的耐受性不尽相同,W3、W25、W30、W55、W73和W79分离株随胆盐质量分数提高其存活率呈下降趋势,W10、W49和W80分离株随胆盐质量分数提高其存活率呈上升趋势。W48、W63和W68分离株随着胆盐质量分数的提高其存活率基本保持不变,其中W48和W68保持了较高存活率水平的稳定,表现了良好的抗胆盐耐受性。此外,W55、W48和W68分离株在不同胆盐质量分数下存活率均明显高于其他分离株(P < 0.05)。

图3 耐胆盐试验结果
Fig.3 Results of bile salt resistance
2.6 酸性条件下的高温杀菌试验结果
发酵饮料的生产通常需要高温加热,根据杀菌方式不同,可从89~137 ℃;且饮料本身pH较低,最低可达4.1,这就要求所用菌株对酸和高温环境有较好的耐受性。通过对凝结芽孢杆菌分离株的耐酸和耐高温试验结果的分析,本研究筛选出W55分离株作为生产用候选菌株。如图4所示,在90 ℃时,随着pH的降低,菌株存活率呈先升后降的趋势;在95 ℃时,菌株存活率随着pH的降低而降低;100 ℃时菌株存活率保持在较低的水平。由此表明,酸性环境会影响菌株对高温环境的耐受性,在pH=4.0,加热温度为90 ℃时存活率最高。
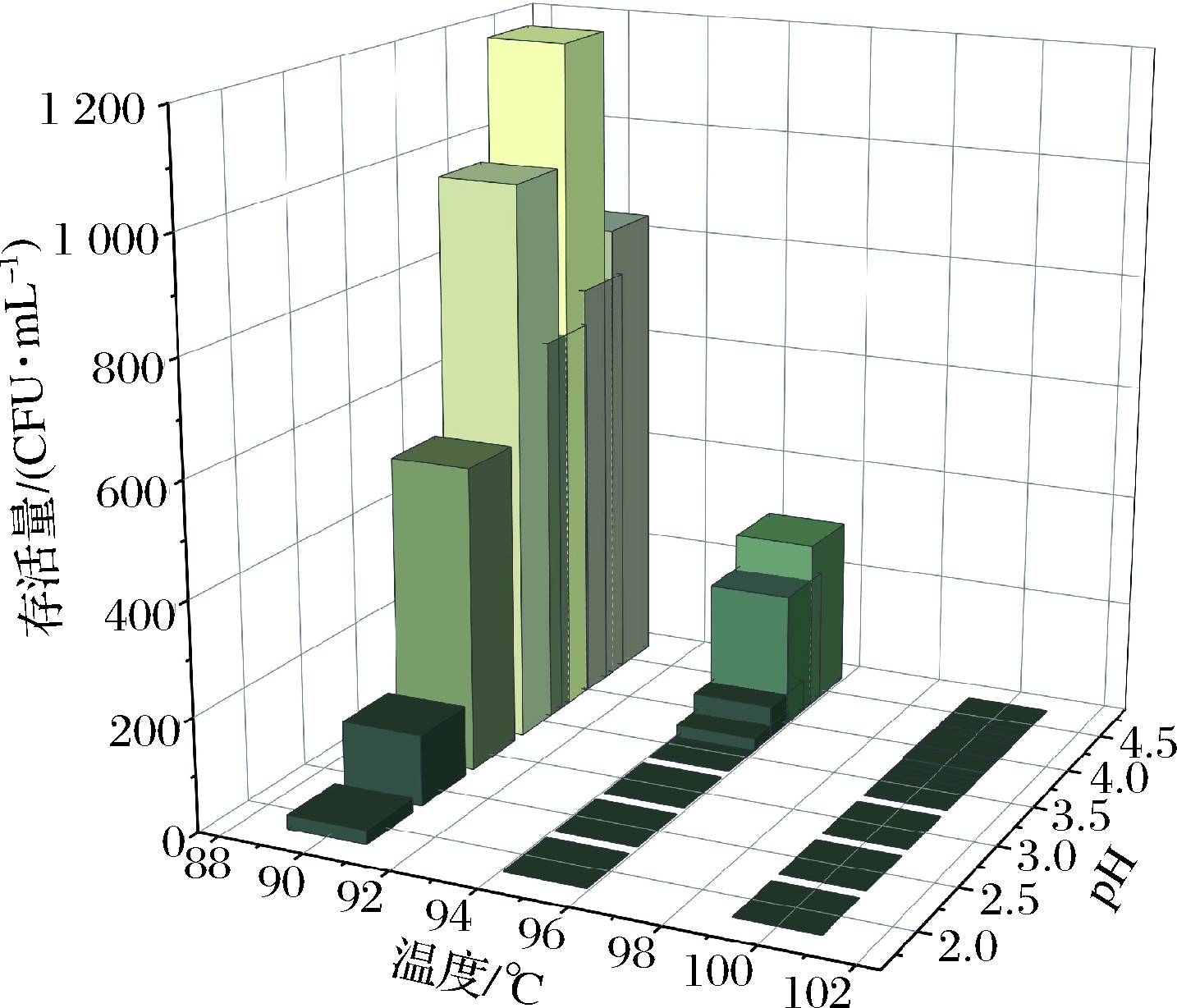
图4 酸性条件下的高温杀菌试验结果
Fig.4 Sterilization results of high temperature under acidic conditions
3 讨论
本研究对奶粉中分离出的12株凝结芽孢杆菌进行了耐酸、耐热和耐胆盐试验,部分凝结芽孢杆菌分离株对酸、热和胆盐环境耐受性较高,赵文龙等[17]发现凝结芽孢杆菌具有优秀的抗逆性能,能够抵抗pH 3.0 处理3 h,0.3%(质量分数)胆盐处理8 h,能够耐受100 ℃、30 min处理;王金果等[18]分离得到的凝结芽孢杆菌在100 ℃处理10 min后的存活率仍可达96.4%,高于本研究分离株,但耐酸和胆盐性能低于本研究分离株;戴青等[19]研究发现凝结芽孢杆菌胃液处理30 min后存活率为91%,最高可耐受3.0%(质量分数)胆盐,与本研究中凝结芽孢杆菌分离株性能基本保持一致。
近年来的研究发现,凝结芽孢杆菌在食品发酵中具有重要作用。研究表明,凝结芽孢杆菌在发酵食品具有增强营养价值、改善风味、延长货架期、增强保健功效等作用[9]。目前有部分凝结芽孢杆菌应用于发酵饮料的研制,黄翠华[9]利用凝结芽孢杆菌进行陈皮发酵饮料的开发,马欣等[20]通过凝结芽孢杆菌复合干酪乳杆菌进行发酵南瓜饮料的研制。
本研究中,对抗逆性良好的W55分离株进行了酸性条件下的高温杀菌试验,模拟凝结芽孢杆菌在饮料生产中的环境,结果显示酸性环境会影响菌株对高温环境的耐受性,在pH=4.0,加热90 ℃时存活率最高。
4 结论
本研究以奶粉为样品来源,通过80 ℃加热、分离纯化鉴定获得了12株凝结芽孢杆菌,编号为W3、W10、W25、W30、W48、W49、W55、W63、W68、W73、W79和W80。经显微镜染色观察为革兰氏阳性杆菌,且携带有芽孢。
通过耐酸、耐高温和耐胆盐试验,结果显示不同分离株对酸性、高温和胆盐环境的耐受性各不相同。其中,W3、W25、W80和W55分离株在酸性环境中存活率较高;W55、W10、W25和W80分离株在高温环境中存活率较高;W55、W48和W68分离株在胆盐中的存活率较高。
将抗逆性较好的W55分离株进行了酸性条件下的高温挑战试验,结果显示,分离株在pH=4.0,加热90 ℃时存活率最高,但低于单因素下(酸性或高温环境)的存活率(P < 0.05)。挑战试验结果表明,酸性条件和高温会相互影响凝结芽孢杆菌的耐受性。本结果也为后续凝结芽孢杆菌发酵饮料的研制提供了理论依据和基础。
[1] 王春维.高抗逆性芽孢杆菌的开发及断奶仔猪应用效果研究 [C].中国粮油学会饲料分会饲料科技论坛暨学术年会、第二届天目湖论坛、中国饲料工业生产管理与工艺创新论坛, 2013.
[2] 刘转,邱成书,敬小兵,等.凝结芽孢杆菌001RC的分离鉴定及其抗逆性研究[J]. 四川大学学报:自然科学版, 2013,50(2): 385-390.
[3] 杨立华,赵述淼,冷一非,等.一株凝结芽孢杆菌产芽孢条件的研究[J]. 中国酿造, 2010(5): 96-98.
[4] 谢丽曲,林丽花,陈婉如.凝结芽孢杆菌的研究进展[J]. 福建畜牧兽医, 2013(2):39-42.
[5] MIDHUN S J, NEETHU S, VYSAKH A, et al. Antagonism against fish pathogens by cellular components/preparations of Bacillus coagulans (MTCC-9872) and it’s in vitro probiotic characterisation [J]. Current Microbiology, 2018, 75 (9):1 174-1 181.
[6] HYRONIMUS B, MARREC C L, SASSI A H, et al. Acid and bile tolerance of spore-forming lactic acid bacteria [J]. 2000,61(2):193-197,
[7] 安济山,胡睿智,杨玲,等.凝结芽孢杆菌的生物学功能及其在畜禽生产中的应用[J].动物营养学报,2020,32(3):1 076-1 083.
[8] 郭庆丰,陈林,马经纬.凝结芽孢杆菌益生机制及应用研究进展[J]. 食品研究与开发,2018,39(18): 208-213.
[9] 黄翠华.一种陈皮发酵饮料的制备工艺研究及品质分析[D].广州:华南农业大学,2016.
[10] 赵钰.凝结芽孢杆菌抑菌物质分离鉴定及其对大黄鱼保鲜效果的研究[D].杭州:浙江工商大学, 2015.
[11] 牛自康,武洪志,富超,等.凝结芽孢杆菌的应用现状[J].中国饲料, 2019(17):22-24.
[12] 秦爱华.凝结芽孢杆菌活菌片预防新生儿黄疸的疗效观察[J].河北医药, 2015,37(13): 1 997-1 999.
[13] MANDEL D R, EICHAS K, HOLMES J. Bacillus coagulans: A viable adjunct therapy for relieving symptoms of rheumatoid arthritis according to a randomized, controlled trial[J]. Bmc Complementary & Alternative Medicine, 2010, 10(1):1-7.
[14] JINDAL G, PANDEY R K, AGARWAL J. A comparative evaluation of probiotics on salivary mutans streptococci counts in Indian children [J]. 2011,12(4): 211-215.
[15] 叶翠青.凝结芽孢杆菌活菌片治疗婴儿湿疹48例疗效观察[J]. 中国实用医药,2017,12(18):120-121.
[16] 吴红萍,王陈仪,宋晶霞,等.微生物学实验教学——细菌的革兰氏染色经典法和三步法的比较与分析[J]. 高校实验室工作研究, 2017(3):56-59.
[17] 赵文龙,王龙,张永红,等. 一株抗逆性凝结芽孢杆菌的分离与鉴定[J]. 北京农学院学报, 2014, 29(2):36-39.
[18] 王金果,莫云,赵雁青,等. 产乳酸凝结芽孢杆菌N001的抗逆性研究[C].中国畜牧兽医协会动物微生态分会,第四届第几次全国学术研讨会暨饲料和动物食品安全战略论坛论文集,中国畜牧兽医学会动物微生物学分会:中国畜牧兽医学会,2008:267-271.
[19] 戴青,赵述淼,谢树贵,等.一株凝结芽孢杆菌的分离筛选及生物学特性研究[J].饲料工业,2008(12): 36-38.
[20] 马欣,古绍彬,吴影.凝结芽孢杆菌复合干酪乳杆菌发酵南瓜饮料的研制[J].食品与发酵工业,2018, 44(7): 161-167.