D-阿拉伯醇在自然界中主要存在于蘑菇类和地衣类中[1],具有较低的卡路里含量,可抑制龋菌的生长和产酸[2],可减少体内脂肪组织,其功效类似于可溶性膳食纤维[3],也可作为药物中间体合成药物[4]。因此D-阿拉伯醇在口腔保健,糖尿病患者产品和制药工业中具有广泛应用前景[5-6]。
D-阿拉伯醇的生产可采用自然提取法、化学催化加氢法和微生物发酵法。由于发酵法具有条件温和、成本低、环境友好等特点,已成为当前研究热点[7]。目前已报道的能生产D-阿拉伯醇的微生物多为耐高渗酵母[8]。SAHA等[9]利用分离的鲁氏接合酵母以葡萄糖为底物发酵生产D-阿拉伯醇,产量达到83.4 g/L;ZHU等[6]从蜜蜂蜂巢中筛选到1株奥默柯达酵母菌,经72 h发酵后D-阿拉伯醇产量为81.2 g/L;蔡莉等[10]从环境中分离得到1株柯达属酵母菌,D-阿拉伯醇产量为82.2 g/L;宋卫斌等[11]从花粉中筛选得到1株假丝酵母菌,D-阿拉伯醇产量为86.55 g/L;张丽丽[12]通过富集培养从环境中筛选出1株D-阿拉伯醇产量为105.41 g/L的巴利汉逊酵母菌,可见目前发酵法生产D-阿拉伯醇的产量并不理想。为提高D-阿拉伯醇产量,利用基因工程方法通过改变一个或几个关键酶基因的表达来提高产物产量仍存在一定困难,传统的诱变选育仍是获得高产菌株的有效方法[3,13],而多数情况下化学诱变效果好于物理诱变[14]。
本研究使用硫酸二乙酯诱变处理,经过摇瓶发酵筛选、遗传稳定性验证获得D-阿拉伯醇高产菌株,并使用单因素与正交试验对发酵培养基成分进行优化,以进一步提高产量,为D-阿拉伯醇的工业化生产奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株
近平滑假丝酵母菌(Candida parapsilosis)SK26.002,本实验室保藏,用作本实验原始菌株。
1.1.2 培养基
平板培养基(g/L):葡萄糖20,酵母提取物20,琼脂20,pH 5.0。
种子培养基(g/L):葡萄糖20,酵母提取物20,pH 5.0。
初始发酵培养基(g/L):葡萄糖200,酵母提取物30,CaCl2 0.1,FeCl3·6H2O 0.03,pH 4.0。
1.1.3 主要试剂
硫酸二乙酯、硫代硫酸钠、乙腈及其他常规试剂(分析纯),国药集团;D-阿拉伯醇标准品,美国Sigma公司。
1.1.4 仪器与设备
HYL-B型恒温培养摇床,太仓市强乐有限公司;CT88A标准型灭菌器,厦门和谱仪器有限公司;Waters e2695高效液相色谱仪,上海沃特世科技有限公司;发酵罐,Eppendorf公司。
1.2 实验方法
1.2.1 培养方法
平板培养:取甘油管保存的原始菌株或菌悬液接种于平板上,将平板倒置于恒温培养箱中30 ℃培养24 h,于4 ℃冰箱保藏待用。
种子液培养:挑取单菌落1环接种于装有50 mL生长培养基的250 mL摇瓶中,30 ℃、200 r/min培养21 h。
摇瓶发酵培养:以4%接种量将种子液接种于装有50 mL发酵培养基的250 mL摇瓶中,30 ℃、200 r/min培养96 h。
1.2.2 硫酸二乙酯诱变及突变株筛选
(1)种子生长曲线测定。每隔3 h取种子液,测量菌体OD600。
(2)菌悬液的制备。取对数期种子液,12 000 r/min离心10 min,菌体用无菌的9 g/L生理盐水洗涤并适当稀释,使用血球计数板将细胞浓度调整为107个/mL[15]。
(3)致死率曲线测定。取4 mL菌悬液加入16 μL硫酸二乙酯,在28 ℃、200 r/min下分别振荡处理10、20、30、40、50、60 min后立即取100 μL菌悬液加入100 μL 250 g/L的硫代硫酸钠溶液混合均匀以终止反应。对照组为用生理盐水代替硫酸二乙酯,其他条件相同。将诱变处理后的菌悬液与对照组菌悬液适当稀释,取100 μL涂布于平板上培养,然后进行菌落计数,并计算致死率,如公式(1)所示:
致死率![]()
(1)
(4)突变株筛选。根据致死率曲线确定诱变时间,在该条件下按1.2.2(3)方法进行诱变处理和平板培养,挑选生长较好的单菌落进行发酵培养。发酵结束后取发酵液于12 000 r/min下离心10 min,收集上清液,测定D-阿拉伯醇含量。
(5)遗传稳定性试验。将筛选出的D-阿拉伯醇产量提高的突变株在平板上连续传代8代,分别测定第2、4、6、8代突变株的D-阿拉伯醇产量,筛选出生产性能稳定的突变株。
1.2.3 发酵培养基优化
(1)葡萄糖质量浓度。改变初始发酵培养基中的葡萄糖质量浓度,选取的葡萄糖质量浓度为150、200、250、300、350、400 g/L。
(2)氮源种类及质量浓度。将酵母提取物分别与胰蛋白胨、尿素、(NH4)2SO4和NaNO3搭配,酵母提取物添加量为20 g/L,其他氮源添加量均为10 g/L。并优化最适复合氮源的比例及质量浓度。
(3)金属离子种类及质量浓度。将不同质量浓度梯度的金属离子(CuSO4·5H2O、MgCl2·6H2O、MnCl2·4H2O、FeCl3·6H2O、NaCl、CaCl2、ZnCl2、CoCl2·6H2O、K2HPO4·3H2O)添加到培养基中。
(4)正交试验设计。根据单因素优化结果,以葡萄糖、酵母提取物+尿素、FeCl3·6H2O、CaCl2质量浓度为4因素,选择3水平,设计L9(34)正交试验。
1.2.4 发酵罐扩大培养
在优化培养条件下,将近平滑假丝酵母在3 L发酵罐中进行培养,装液量1.2 L,接种量4%,通气量2 vvm,转速400 r/min,30 ℃培养120 h,定期取样测定发酵过程中菌体量、pH、葡萄糖以及D-阿拉伯醇含量的变化。
1.2.5 检测方法
生物量测定方法为将培养液用去离子水适当稀释,以水作为对照,于600 nm下测量菌体OD值。
葡萄糖及D-阿拉伯醇含量测定:发酵液于12 000 r/min 离心5 min,取上清液经树脂除盐和0.22 μm膜过滤处理,然后采用高效液相色谱法检测发酵液中葡萄糖和D-阿拉伯醇含量。色谱条件:示差折光检测器;色谱柱为Shodex Asahipak NHP-50 4E(4.6 mm×250 mm),柱温为30 ℃;流动相为70%乙腈,流速为1 mL/min;进样量为10 μL。
2 结果与分析
2.1 诱变及突变株筛选
2.1.1 种子生长曲线
如图1所示,原始菌株在12 h开始进入对数期,27 h进入稳定期。对数期的细胞代谢活力高,生长旺盛,酶系活跃,易受外界刺激影响,此时进行诱变育种菌株突变的概率较大,因此选择对种龄21 h的菌种进行诱变。
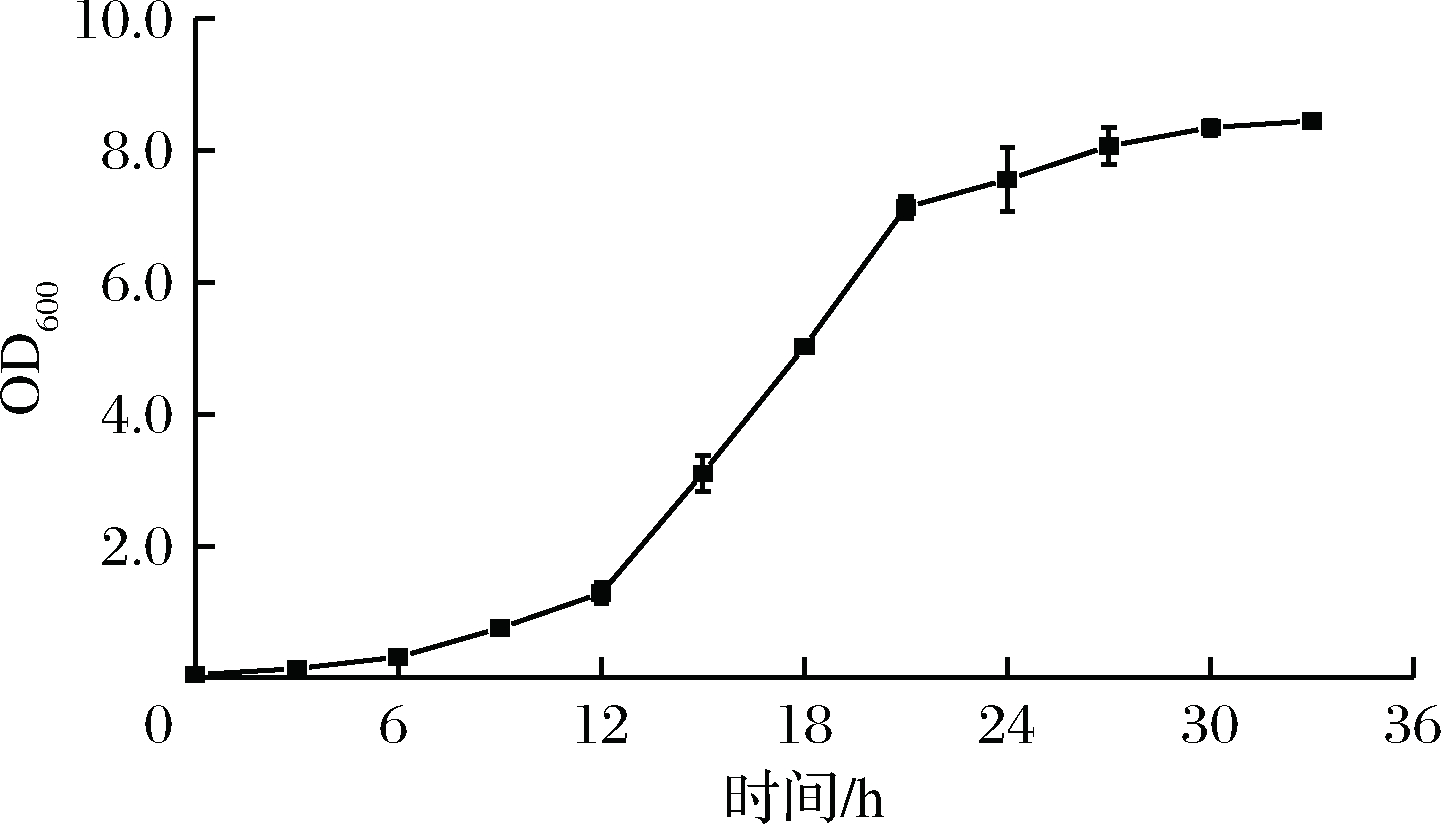
图1 种子生长曲线
Fig.1 Seed growth curve of C. parapsilosis SK26.002
2.1.2 诱变时间选择
如图2所示,当诱变时间为13~18 min时致死率为60%~80%,30 min时菌体基本全部死亡。诱变程度是关键因素,诱变时间太短会降低细胞突变的概率,且低致死剂量下易发生负突变,诱变时间太长会使大量细胞死亡[16]。因此选用70%的致死率条件,即处理时间为15 min。
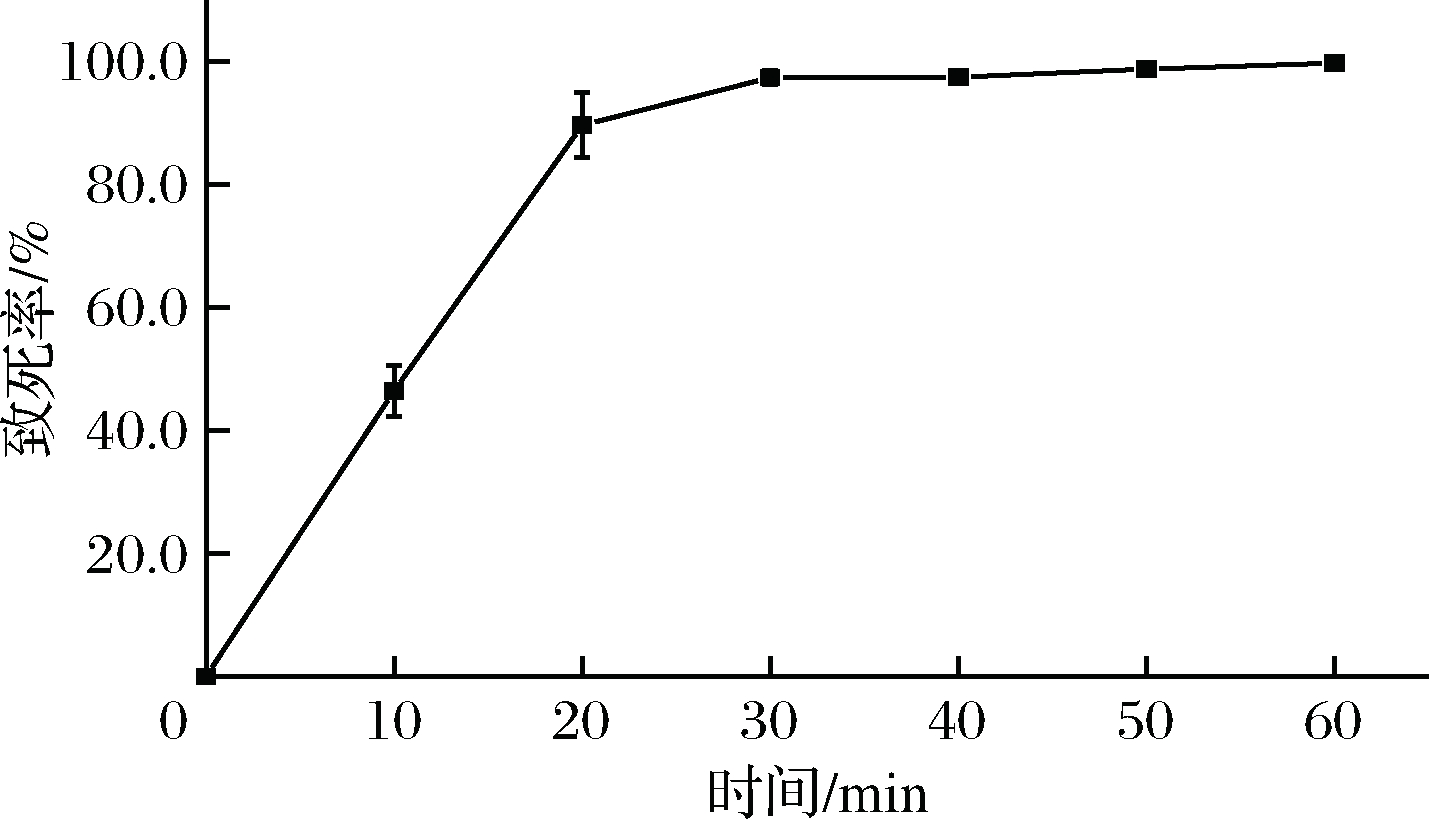
图2 诱变致死率曲线
Fig.2 The mortality rate at different exposure times
2.1.3 突变株筛选
如图3所示,83株突变株产量高于原始菌株,正突变率为59.71%,其中突变株D8、D15、D68、D89、D129、D130、D137产量较原始菌株提高15%以上,突变株D137产量最高为27.29 g/L,较原始菌株提高26.11%(原始菌株产量为21.64 g/L)。硫酸二乙酯是一种烷化剂,能够烷化DNA分子上的碱基,当DNA受到损伤时机体会启动SOS修复机制,修复结果是维持基因组的完整性,提高细胞生存率,但产生的错误较多,从而使细胞发生突变[17],这些变化可能是遗传特性、生物体性状或生活周期等[18]。结果表明,使用硫酸二乙酯诱变来提高产量是一种可行且有效的方法。
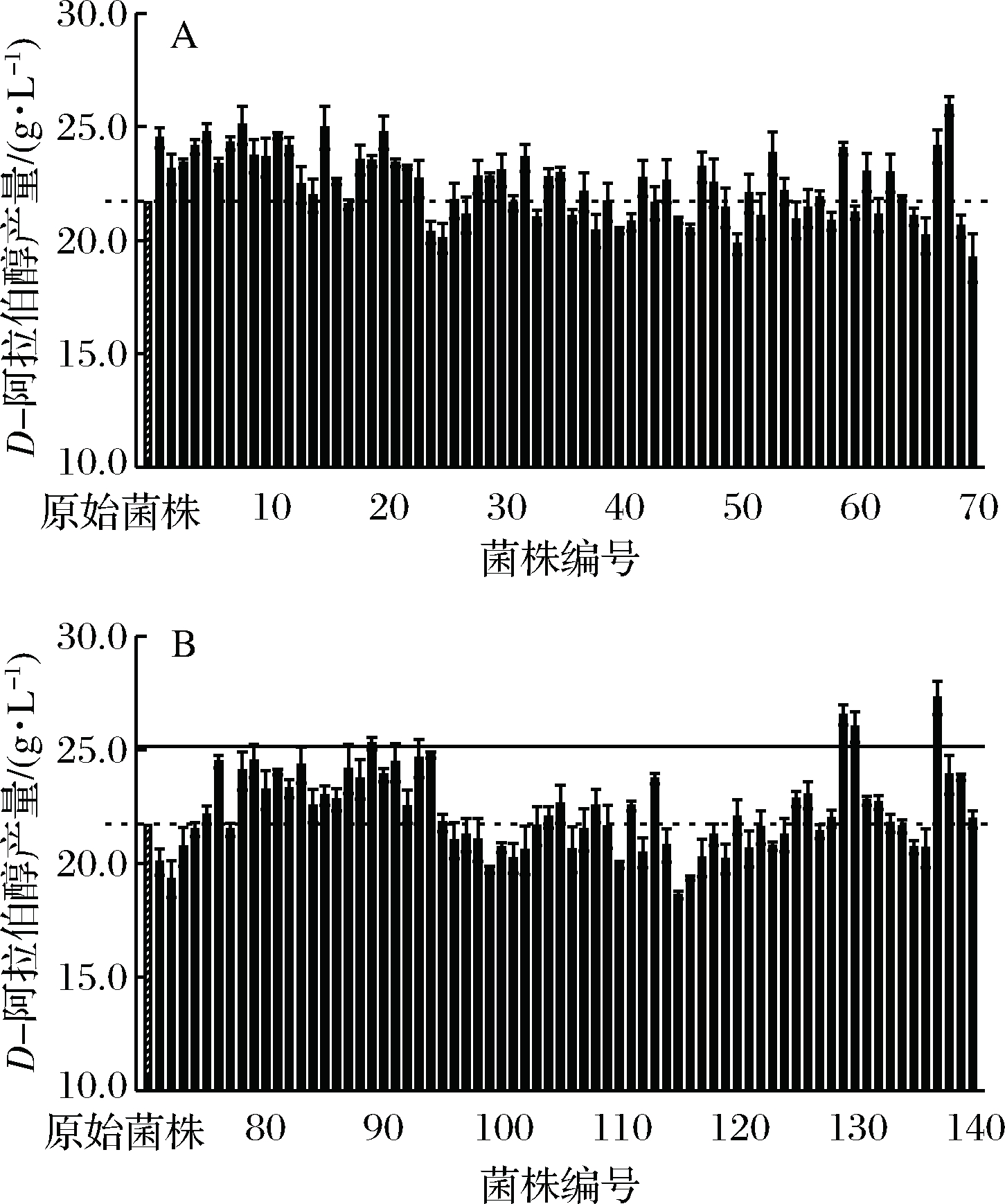
A-筛选结果Ⅰ;B-筛选结果Ⅱ图3 突变株筛选结果
Fig.3 The selection of mutants
2.1.4 遗传稳定性试验
菌株诱变后生物活性高,但产量不一定稳定,若突变株的遗传性状不稳定,对于工业生产就没有实际意义,因此经过诱变处理后,需要对突变株进行遗传稳定性检验。结果如表1所示,突变株D8、D15、D129、D130、D137的D-阿拉伯醇产量较稳定,其中突变株D137产量最高且生产能力较稳定,平均产量为28.75 g/L,因此选择D137作为目标菌株用于进一步研究。
表1 突变株传代稳定性
Table 1 The genetic stability validation of mutants
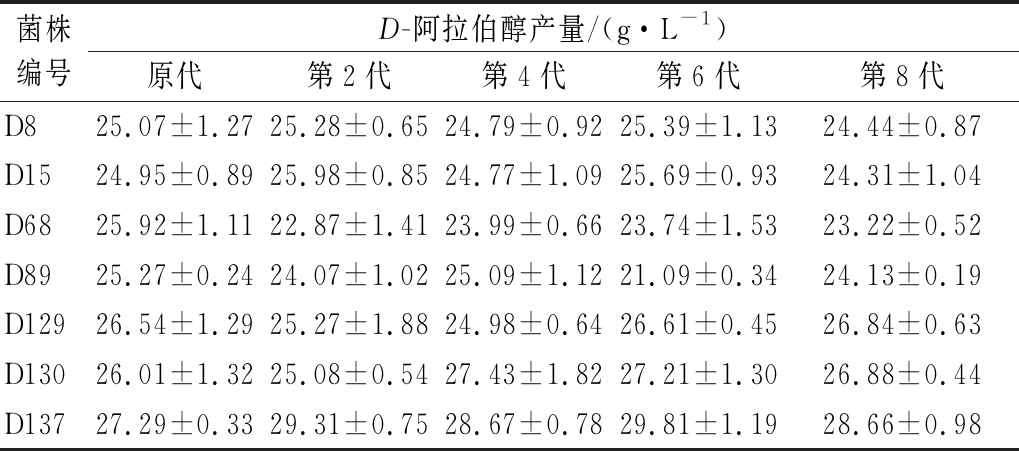
菌株编号D-阿拉伯醇产量/(g·L-1)原代第2代第4代第6代第8代D825.07±1.2725.28±0.6524.79±0.9225.39±1.1324.44±0.87D1524.95±0.8925.98±0.8524.77±1.0925.69±0.9324.31±1.04D6825.92±1.1122.87±1.4123.99±0.6623.74±1.5323.22±0.52D8925.27±0.2424.07±1.0225.09±1.1221.09±0.3424.13±0.19D12926.54±1.2925.27±1.8824.98±0.6426.61±0.4526.84±0.63D13026.01±1.3225.08±0.5427.43±1.8227.21±1.3026.88±0.44D13727.29±0.3329.31±0.7528.67±0.7829.81±1.1928.66±0.98
2.2 培养基成分对D-阿拉伯醇生产的影响
2.2.1 葡萄糖质量浓度
酵母菌发酵产D-阿拉伯醇能以多种碳源为底物,例如葡萄糖、果糖、蔗糖、麦芽糖、半乳糖、甘露糖、淀粉和甘油等[19-21],目前研究发现葡萄糖是多种碳源中较适宜且经济的底物,既能较好地用于细胞生长又具有相对较高的底物转化率[22]。因此本实验研究了葡萄糖质量浓度对D-阿拉伯醇生产的影响。
由图4可知,当葡萄糖质量浓度增加到300 g/L时,菌体生物量随之增加,D-阿拉伯醇产量由21.05 g/L增加至46.09 g/L,底物转化率基本不变。当葡萄糖质量浓度增加到400 g/L时,产量降低到34.87 g/L,葡萄糖残余量明显增加,菌体生物量呈下降趋势。当葡萄糖质量浓度较低时,菌体缺乏合成产物的底物,所以随着葡萄糖质量浓度增加,产量随之增加。当葡萄糖质量浓度过高时,高浓度的葡萄糖使得培养基偏黏稠,不利于溶氧,同时渗透压增加,致使菌体生长受到抑制,产量减少。因此优选葡萄糖质量浓度为300 g/L。
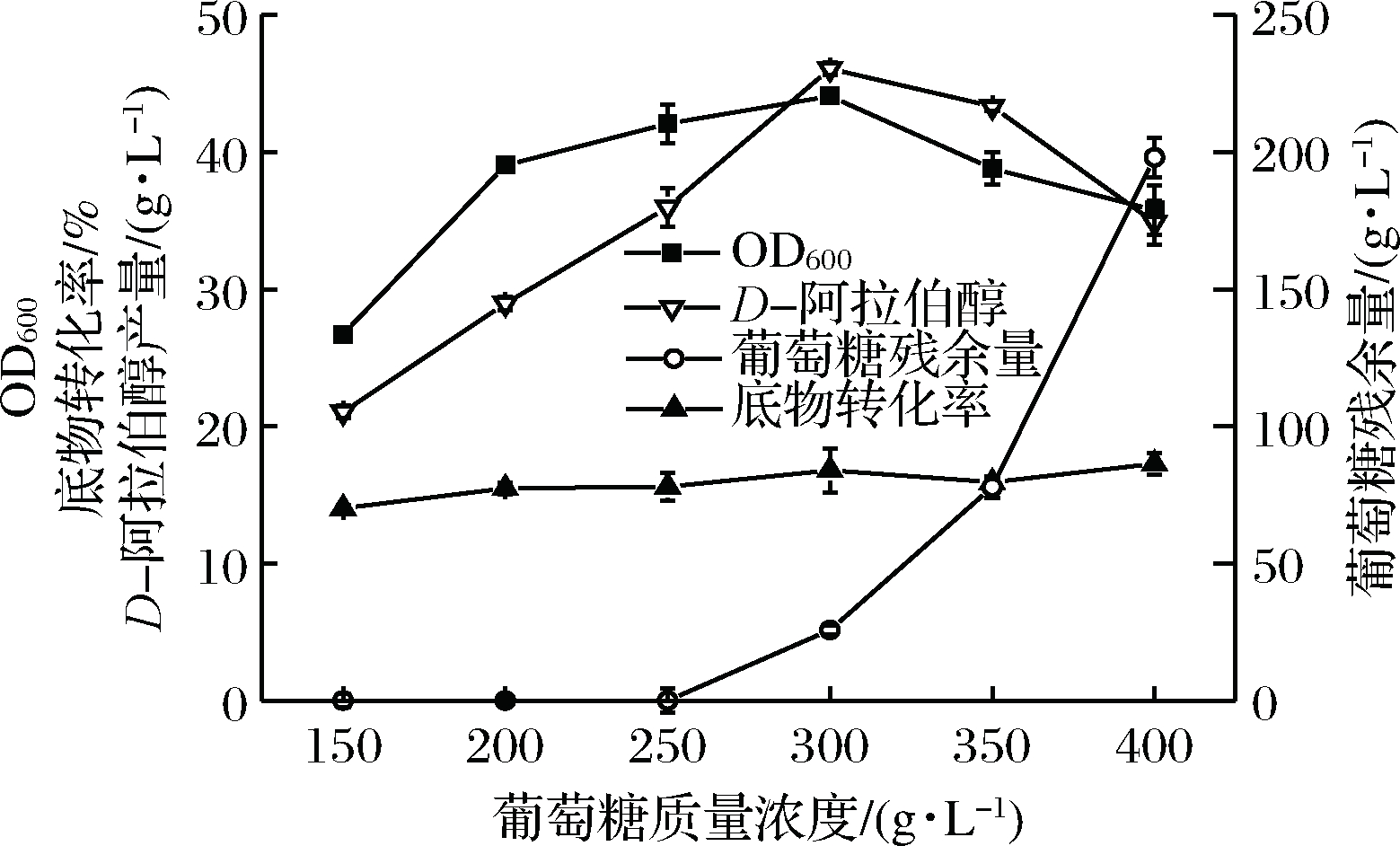
图4 葡萄糖浓度对D-阿拉伯醇生产的影响
Fig.4 Effects of glucose concentration on D-arabitol production
2.2.2 氮源种类及质量浓度
如图5-A所示,当培养基中氮源为酵母提取物时,D-阿拉伯醇产量为43.61 g/L,添加尿素后产量提高了15.99%,但对菌体生长的影响并不明显,说明尿素有利于底物的转化,对D-阿拉伯醇的合成有促进作用。相反,胰蛋白胨、(NH4)2SO4和NaNO3抑制了产物的合成。因此,选择酵母提取物和尿素作为优选复合氮源。
如图5-B所示,当尿素与酵母提取物的质量比为5∶1 时,D-阿拉伯醇产量最高为66.80 g/L,底物转化率为30.04%,因此确定尿素与酵母提取物质量比为5∶1。在此基础上,本实验又考察了复合氮源质量浓度对产物合成的影响,如图5-C所示,高质量浓度的氮源有利于菌体生长和底物利用,但对产物合成没有明显促进效果,从底物转化率和经济效益方面考虑,优选氮源质量浓度为30 g/L。
2.2.3 金属离子种类及质量浓度
由图6-A可知,Cu2+、Co2+对产物合成有严重抑制作用,而Mg2+、Mn2+也会影响产物形成。Cu2+是一些生物过程中的辅酶,当Cu2+质量浓度过大时会促使活性氧化物的产生,对生物大分子的生理功能有破坏作用;Co2+也会使某些蛋白质受影响而变性[23]。Mg2+在糖酵解、三羧酸循环等过程中起重要作用,是柠檬酸裂合酶和各种激酶的辅因子,而Mn2+是丙酮酸羧化酶的辅因子[24],因而Mg2+、Mn2+会影响微生物代谢过程中的酶反应。合适的金属离子质量浓度是必要的,过量的离子会抑制酶反应速度。D-阿拉伯醇的合成受到抑制可能就是因为这些金属离子影响了微生物代谢过程中的酶反应。
由图6-B可知,Ca2+、Fe3+、Na+、K+、Zn2+均能促进D-阿拉伯醇的产生,最高产量分别提高了15.49%、16.78%、11.95%、12.28%和8.43%。据研究发现,Ca2+会影响细胞膜通透性,促进胞内产物的释放[25];Fe3+是氧化还原反应中必不可少的电子载体,在电子传递体系中起重要作用;Zn2+是一些醇脱氢酶的辅因子;K+对ATP的水解、磷的传递、渗透压调节等起重要作用[24]。微生物对金属离子的需求很小,微量金属离子对菌体代谢是有益的,但过量的金属离子可能会引起微生物中毒,所以随着金属离子质量浓度的增加,D-阿拉伯醇产量呈下降趋势。
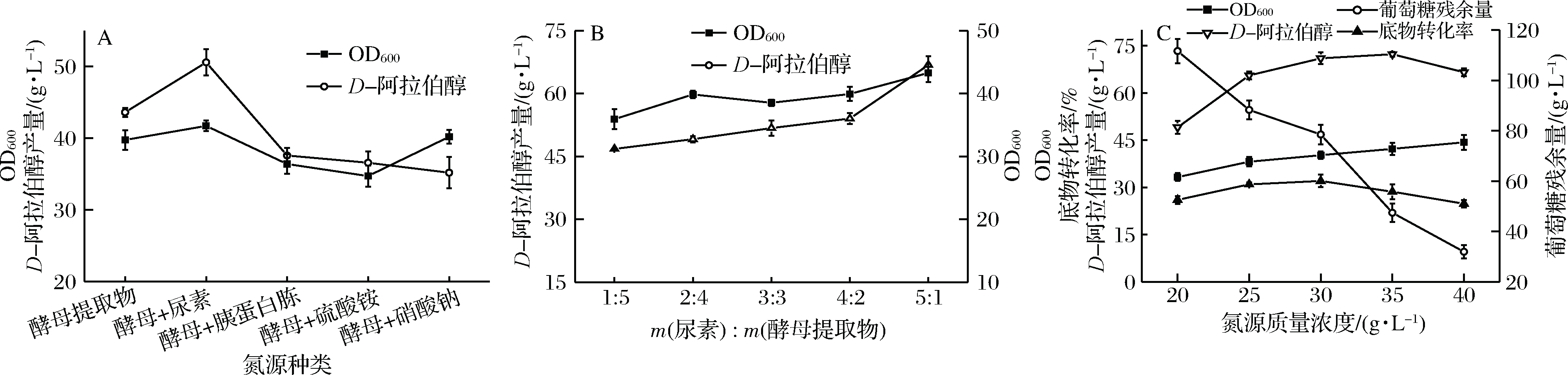
A-氮源种类对D-阿拉伯醇产量的影响;B-氮源比例对D-阿拉伯醇产量的影响;C-氮源质量浓度对D-阿拉伯醇产量的影响图5 氮源对D-阿拉伯醇生产的影响
Fig.5 Effects of nitrogen sources on D-arabitol production
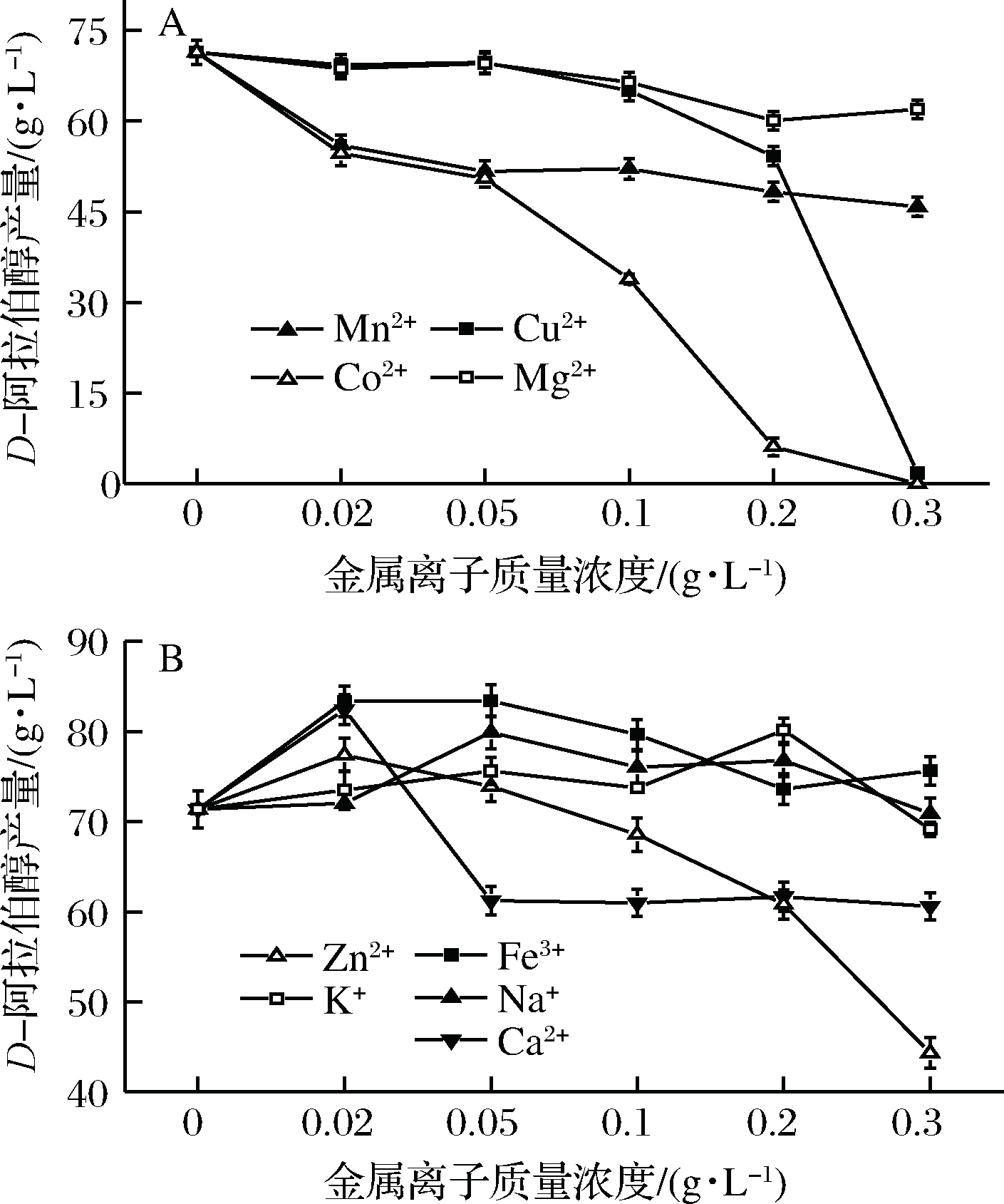
A-金属离子 Ⅰ 对D-阿拉伯醇产量的影响;B-金属离子 Ⅱ 对D-阿拉伯醇产量的影响图6 金属离子对D-阿拉伯醇生产的影响
Fig.6 Effects of metal ions on D-arabitol production
2.2.4 正交试验结果
考虑到各单因素间的相互作用对D-阿拉伯醇生产的影响,在单因素实验基础上设计正交试验,试验因素及水平如表2所示,试验结果如表3所示。
表2 正交试验因素水平表
Table 2 Factors and levers of orthogonal experiment

水平因素葡萄糖(A)/(g·L-1)氮源(B)/(g·L-1)FeCl3·6H2O(C)/(g·L-1)CaCl2(D)/(g·L-1)1250250.020.012300300.050.023350350.10.03
由表3可知,各因素对D-阿拉伯醇生产的影响顺序为:A>D>C>B,即葡萄糖>CaCl2>FeCl3·6H2O>氮源,优选组合为A2B2C3D2,即葡萄糖300 g/L,氮源质量浓度30 g/L(5 g/L酵母提取物+25 g/L尿素),FeCl3·6H2O 0.1 g/L,CaCl2 0.02 g/L。此条件下进行摇瓶发酵,D-阿拉伯醇产量为87.58 g/L,较优化前提高了2.2倍。
表3 正交试验结果与极差分析
Table 3 The results of orthogonal experiment and range analysis

实验号因素ABCDD-阿拉伯醇产量/(g·L-1)1111179.91±0.99 2122286.42±0.67 3133378.98±1.34 4212386.31 ±0.895223188.97±0.58 6231283.50±1.46 7313282.71 ±1.238321374.79±0.93 9332176.23±1.51 K1245.31248.93238.20245.10K2258.78250.18248.96252.63K3233.74238.71250.66240.09R8.353.824.154.18
2.3 发酵罐扩大培养
如图7所示,发酵培养基初始pH为4.0,灭菌后pH为8.5,这可能是因为高温灭菌时尿素分解产生氨气所致。前36 h葡萄糖消耗迅速,菌体生物量快速增长,D-阿拉伯醇没有产生,说明此时底物主要用来满足菌体生长,且菌体生长过程中产生了乳酸等酸性物质致使pH急剧下降。36~72 h D-阿拉伯醇呈线性增长,说明此时底物既用于菌体生长又用于产物合成。72 h后细胞逐渐进入平稳期,产物合成缓慢。120 h时葡萄糖基本消耗殆尽,此时D-阿拉伯醇产量为96.68 g/L。发酵过程中pH变化明显,前期菌体生长时pH急剧下降,中后期产物合成时pH变化较小,因此考虑菌体生长和产物合成所需pH可能不同,可尝试通过阶段pH调节来提高D-阿拉伯醇产量。
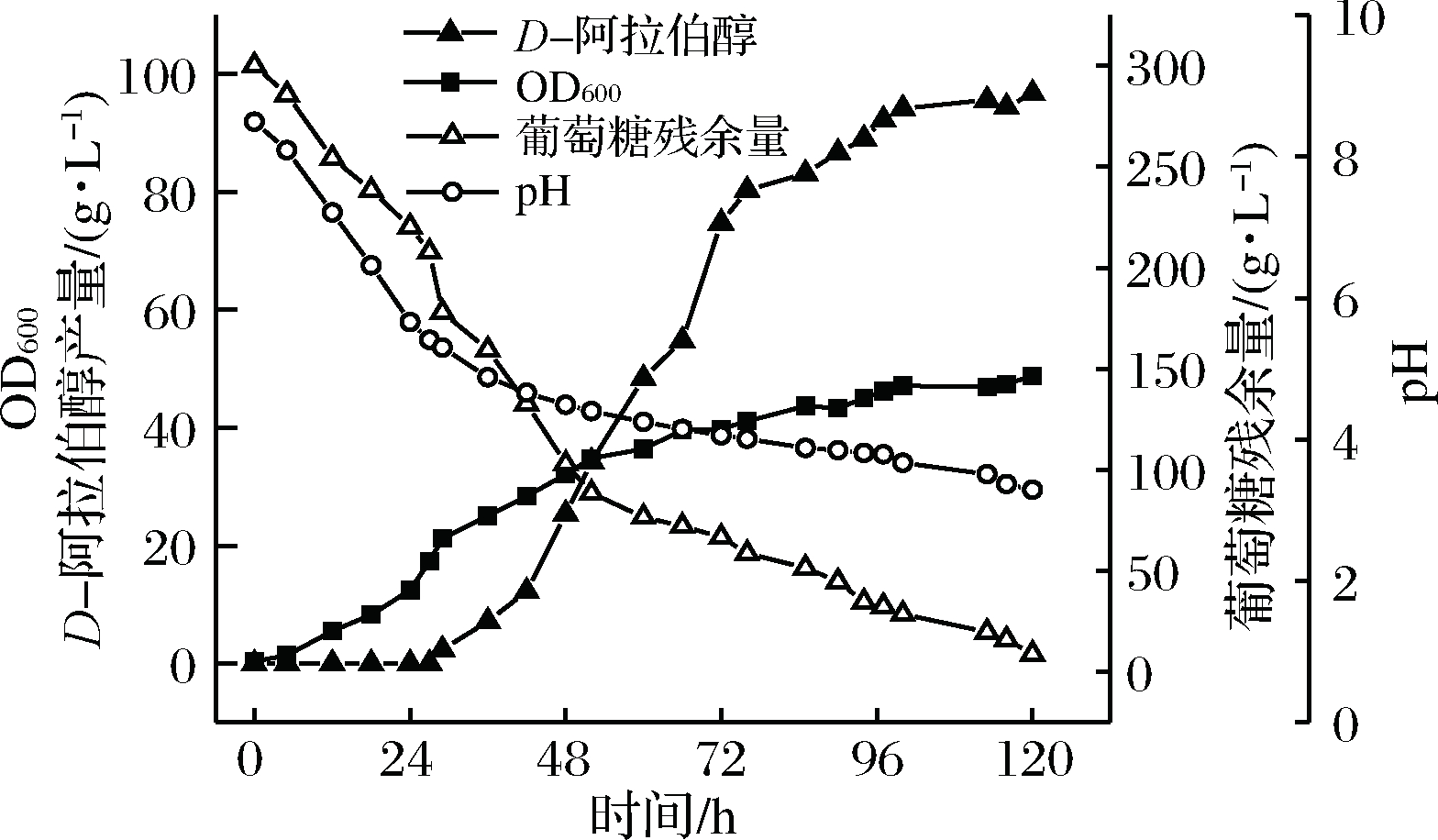
图7 突变株D137的发酵曲线
Fig.7 The fermentation curve of mutant D137
3 结论
利用化学诱变方法对近平滑假丝酵母进行诱变选育,得到1株能使D-阿拉伯醇产量提高且生产性能稳定的突变株D137,产量由21.64 g/L提高至27.29 g/L。通过发酵培养基的优化,产量进一步提高至87.58 g/L。在3 L发酵罐中进行扩大培养时,产量为96.68 g/L。结果表明,菌株诱变和发酵优化对提高D-阿拉伯醇产量是一种行之有效的方法。通过传统诱变获得的菌株具有应用于实际生产的潜能,其结果可为D-阿拉伯醇的扩大生产提供参考。在D-阿拉伯醇生产过程中,环境也会影响其合成,因此发酵过程中的pH调节、溶氧控制等是今后研究工作的方向。
[1] 孙文涛. 耐高渗酵母产D-阿拉伯醇的研究[D]. 泰安:山东农业大学, 2013.
[2] LOMAN A A, ISLAM S M M, JU L. Production of arabitol from enzymatic hydrolysate of soybean flour by Debaryomyces hansenii fermentation[J]. Applied Microbiology and Biotechnology, 2017, 102(2):641-653.
[3] KORDOWSKA WIATER M, LISIECKA U, KOSTRO K. Improvement of Candida parapsilosis by genome shuffling for the efficient production of arabitol from L-arabinose[J]. Food Science and Biotechnology, 2018, 27(5):1 395-1 403.
[4] YOSHIKAWA J, HABE H, MORITA T, et al. Production of D-arabitol from raw glycerol by Candida quercitrusa[J]. Applied Microbiology & Biotechnology, 2014, 98(7):2 947-2 953.
[5] GUO Q, ZABED H, ZHANG H, et al. Optimization of fermentation medium for a newly isolated yeast strain (Zygosaccharomyces rouxii JM-C46) and evaluation of factors affecting biosynthesis of D-arabitol[J]. Lebensmittel-Wissenschaft und-Technologie, 2019, 99:319-327.
[6] ZHU H Y, XU R, DAI R Y, et al. Production of D-arabitol by a newly isolated Kodamaea ohmeri[J]. Bioprocess & Biosystems Engineering, 2010, 33(5):565-571.
[7] KORDOWSKA-WIATER M. Production of arabitol by yeasts: Current status and future prospects[J]. Journal of Applied Microbiology, 2015, 119(2):303-314.
[8] ZHANG G, LIN Y, HE P, et al. Characterization of the sugar alcohol-producing yeast Pichia anomala[J]. Journal of Industrial Microbiology & Biotechnology, 2013, 41(1):41-48.
[9] SAHA B C, SAKAKIBARA Y, COTTA M A. Production of D-arabitol by a newly isolated Zygosaccharomyces rouxii[J]. Journal of Industrial Microbiology & Biotechnology, 2007, 34(7):519-523.
[10] 蔡莉, 张扬, 朱宏阳, 等. 1株产D-阿拉伯糖醇的菌株的分离筛选及鉴定[J]. 食品与发酵工业, 2009, 35(1):23-26.
[11] 宋卫斌, 林燕青, 胡海燕, 等. 产D-阿拉伯醇菌株的筛选、鉴定及其产D-阿拉伯醇条件的优化[J]. 微生物学报, 2011, 51(3):332-339.
[12] 张丽丽. 高产D-阿拉伯糖醇酵母菌株的筛选及其发酵条件的研究[D]. 无锡:江南大学, 2009.
[13] LI X, LIU R, LI J, et al. Enhanced arachidonic acid production from Mortierella alpina combining atmospheric and room temperature plasma (ARTP) and diethyl sulfate treatments[J]. Bioresource Technology, 2015, 177:134-140.
[14] 石慧, 李婵娟, 张俊红. ε-聚赖氨酸产生菌及其应用研究概述[J]. 食品与发酵工业, 2016, 42(9):263-269.
[15] SAVERGAVE L S, GADRE R V, VAIDYA B K, et al. Two-stage fermentation process for enhanced mannitol production using Candida magnoliaemutant R9[J]. Bioprocess and Biosystems Engineering, 2013, 36(2):193-203.
[16] WINSTON F. EMS and UV mutagenesis in yeast[J]. Current Protocols in Molecular Biology, 2008, 82(1):13.
[17] ZHANG X, ZHANG C, ZHOU Q Q, et al. Quantitative evaluation of DNA damage and mutation rate by atmospheric and room-temperature plasma (ARTP) and conventional mutagenesis[J]. Applied Microbiology & Biotechnology, 2015, 99(13):5 639-5 646.
[18] HOFFMANN G R. Genetic effects of dimethyl sulfate, diethyl sulfate, and related compounds[J]. Mutation Research, 1980, 75(1):63-129.
[19] JAGTAP S S, RAO C V. Production of D-arabitol from D-xylose by the oleaginous yeast Rhodosporidium toruloides IFO0880[J]. Applied Microbiology & Biotechnology, 2017, 102:143-151.
[20] KOGANTI S, KUO T M, KURTZMAN C P, et al. Production of arabitol from glycerol: Strain screening and study of factors affecting production yield[J]. Applied Microbiology & Biotechnology, 2011, 90(1):257-267.
[21] KUMDAN H, MURTHY S N, GUMMADI S N. Production of ethanol and arabitol by Debaryomyces nepalensis: Influence of process parameters[J]. AMB Express, 2013, 3(1):23.
[22] 宁肖肖. D-阿拉伯糖醇高产多形汉逊酵母重组菌株选育及其发酵工艺研究[D]. 西安:陕西科技大学, 2016.
[23] 魏文婷, 张涛, 江波, 等. 近平滑假丝酵母发酵产甘露醇[J]. 食品与发酵工业, 2013,39(10):119-124.
[24] 寇明旭, 刘全阳. 金属离子对活性污泥微生物影响研究进展[J]. 山西建筑, 2007, 33(5):176-177.
[25] LEE J K, OH D K, SONG H Y, et al. Ca2+ and Cu2+ supplementation increases mannitol production by Candida magnoliae[J]. Biotechnology Letters, 2007, 29(2):291-294.
DOI:10.13995/j.cnki.11-1802/ts.023786
引用格式:于卓然,陈程鹏,张耀,等.基于两阶段L-谷氨酸添加的功能性红曲产酸式Monacolin K的发酵工艺优化[J].食品与发酵工业,2020,46(16):127-134.YU Zhuoran, CHEN Chengpeng, ZHANG Yao, et al. Optimization of fermentation process for Monacolin K acid production using functional Monascus with two-stage L-glutamic acid addition[J].Food and Fermentation Industries,2020,46(16):127-134.