蛋白酶根据其最适pH可分为酸性、中性和碱性3种,因此,中性蛋白酶是一类能够在pH=6.5~7.5的环境中催化蛋白质发生水解,产生游离氨基酸和多肽片段的酶的总称[1-3]。中性蛋白酶是很早就在工业生产中使用的蛋白酶类,广泛应用于食品、饲料、医药、洗涤、化妆品、纺织等行业[4-7]。中性蛋白酶的广泛使用是由于其作为天然生物酶制剂,具有催化条件温和,催化速率高,无工业污染等特点,与一般的化学添加剂相比,对人和动物更加安全可靠[8]。目前,生产中性蛋白酶的微生物主要包括细菌、霉菌、酵母和放线菌等[9]。
枯草芽孢杆菌(Bacillus subtilis)是一类需氧型的革兰氏阳性菌,在土壤、海洋、动物、植物中广泛存在[10]。同时,枯草芽孢杆菌具有易于存活、生长繁殖快,无致病性的特点,能够分泌蛋白酶、淀粉酶、纤维素酶、葡聚糖酶、植酸酶、果胶酶等十几种酶[11-15]。因此,枯草芽孢杆菌在改善肠道菌群、调节免疫力、促进植物生长、改善脂类代谢等方面都有广泛应用[16-18]。本实验室前期分离出1株具有高产中性蛋白酶潜力的枯草芽孢杆菌L07,本实验主要对枯草芽孢杆菌L07产中性蛋白酶的能力进行考察,以碳源、氮源、吐温-80、初始pH、MgSO4、种子液添加量、发酵温度、发酵时间为条件进行单因素实验分析,再通过Plackett-Burman实验、最陡爬坡实验和Box-Behnken实验响应面分析,最终确定枯草芽孢杆菌L07产中性蛋白酶的最优发酵条件。
1 材料与方法
1.1 实验材料
枯草芽孢杆菌(Bacillus subtilis)L07由本实验室前期筛选并保藏,实验所用试剂为市售分析纯。
种子培养基(g/100mL):NaCl 1、牛肉膏1、蛋白胨1,pH 7.0,高温高压灭菌后在30 ℃条件下振荡培养到A600=1.0为制备种子液;
基础发酵培养基(g/100mL):蔗糖5、蛋白胨5、MgSO40.1、吐温-80 0.1 mL/100mL、pH 6.8,高温高压灭菌后加入种子液3 mL/100mL,在30 ℃环境下振荡培养36 h。
1.2 实验方法
1.2.1 中性蛋白酶酶活力的测定
各组发酵结束后,4 ℃离心取上清,即得待测发酵粗酶液。参考GB/T 23527—2009,采用Folin-酚法进行蛋白酶酶活力的测定[19-21]。在pH 7.2、40 ℃的条件下1 mL粗酶液1 min水解酪蛋白产生1 μg酪氨酸定义为1个活力单位(U),以U/mL表示,如公式(1)所示:
中性蛋白酶活力(U/mL)=A×N×4/10
(1)
式中:A为由吸光度对应的酪氨酸微克数;4为反应总体积;10为反应时长;N为稀释倍数。
1.2.2 单因素实验分析
1.2.2.1 蔗糖、蛋白胨添加量对菌种产中性蛋白酶的影响
分别在编号1~7的7个新配置基础培养基中加入终质量浓度为8、10、12、14、16、18、20 g/100mL的蔗糖溶液,其余按上述基本培养基的成分和条件进行培养,发酵结束后进行酶活力测定。
分别在编号1~7的7个新配置基础培养基中加入终质量浓度为6、9、12、15、18、21、24 g/100mL的蛋白胨,其余按上述基本培养基的成分和条件进行培养,发酵结束后进行酶活力测定。
1.2.2.2 吐温-80、初始pH对菌种产中性蛋白酶的影响
分别在编号1~7的7个新配置基础培养基中加入终浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL/100mL的吐温-80,其余按上述基本培养基的成分和条件进行培养,发酵结束后进行酶活力测定。
分别将编号1~7的7个新配置基础培养基调整初始pH至6.6、6.8、7.0、7.2、7.4、7.6、7.8,其余按上述基本培养基的成分和条件进行培养,发酵结束后进行酶活力测定。
1.2.2.3 MgSO4、种子液添加量对菌种产中性蛋白酶的影响
分别在编号1~7的7个新配置基础培养基中加入终质量浓度为0.2、0.4、0.6、0.8、1.0、1.2、1.4 g/100mL的MgSO4,其余按上述基本培养基的成分和条件进行培养,发酵结束后进行酶活力测定。
分别在编号1~7的7个新配置基础培养基中加入终浓度为3、5、7、9、11、13、15 mL/100mL的种子培养液,其余按上述基本培养基的成分和条件进行培养,发酵结束后进行酶活力测定。
1.2.2.4 发酵温度、发酵时间对菌种产中性蛋白酶的影响
配制编号1~7的7个新配置基础培养基,分别置于30、32、34、36、38、40、42 ℃条件下进行培养,其余按上述基本培养基的成分和条件进行培养,发酵结束后取培养液进行酶活力测定。
配制编号1~7的7个新配置基础培养基,分别培养40、44、48、52、56、60、64 h,其余按上述基本培养基的成分和条件进行培养,发酵结束后取培养液进行酶活力测定。
1.2.3 Packett-Burman实验分析
根据单因素试验结果,采用Packett-Burman设计法,对蔗糖(A)、蛋白胨(B)、吐温-80(C)、初始pH(D)、MgSO4(E)、接种量(F)、发酵温度(G)、发酵时间(H)这8个影响菌种产中性蛋白酶的实验因素进行探究,从中确定出3个相对较显著的影响因子,以便进行下一步实验。这8个影响因子分别取高低2个水平,以发酵液的中性蛋白酶活力为单一响应值,Packett-Burman实验设计的因子和水平如表1所示。
1.2.4 最陡爬坡实验分析
根据上一步Packett-Burman实验结果筛选得出的3个显著因子,参考各个显著因子的正负效应值,确定最陡爬坡实验的适当步长。以最陡爬坡实验结果的最大响应值作为下一步Box-Behnken实验分析的中心点。
1.2.5 Box-Behnken实验分析
根据Packett-Burman实验筛选得出的3个显著因子,最陡爬坡实验得出3个显著因子的质量浓度范围,利用Design-Expert 8.0.5软件进行Box-Behnken实验设计和数据分析。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 蔗糖、蛋白胨添加量对菌种产中性蛋白酶的影响
碳源在微生物的生长过程中普遍发挥着重要的作用,而氮源添加量则对微生物合成蛋白质和产酶有重要影响。本实验选择蔗糖作为碳源、蛋白胨作为氮源,两者添加量对菌种产中性蛋白酶的影响如图1所示。由图1可知,当蔗糖的添加量从8 g/100mL上升到16 g/100mL时,枯草芽孢杆菌L07产酶活力呈现缓慢上升的趋势,而在培养基中蔗糖含量在16~20 g/100mL阶段时,出现了相对明显的下降。当蛋白胨的添加量从6 g/100mL上升到15 g/100mL时,枯草芽孢杆菌L07产酶活力呈现明显上升的趋势,而在培养基中蔗糖含量在15~24 g/100mL阶段时,出现了明显的下降。
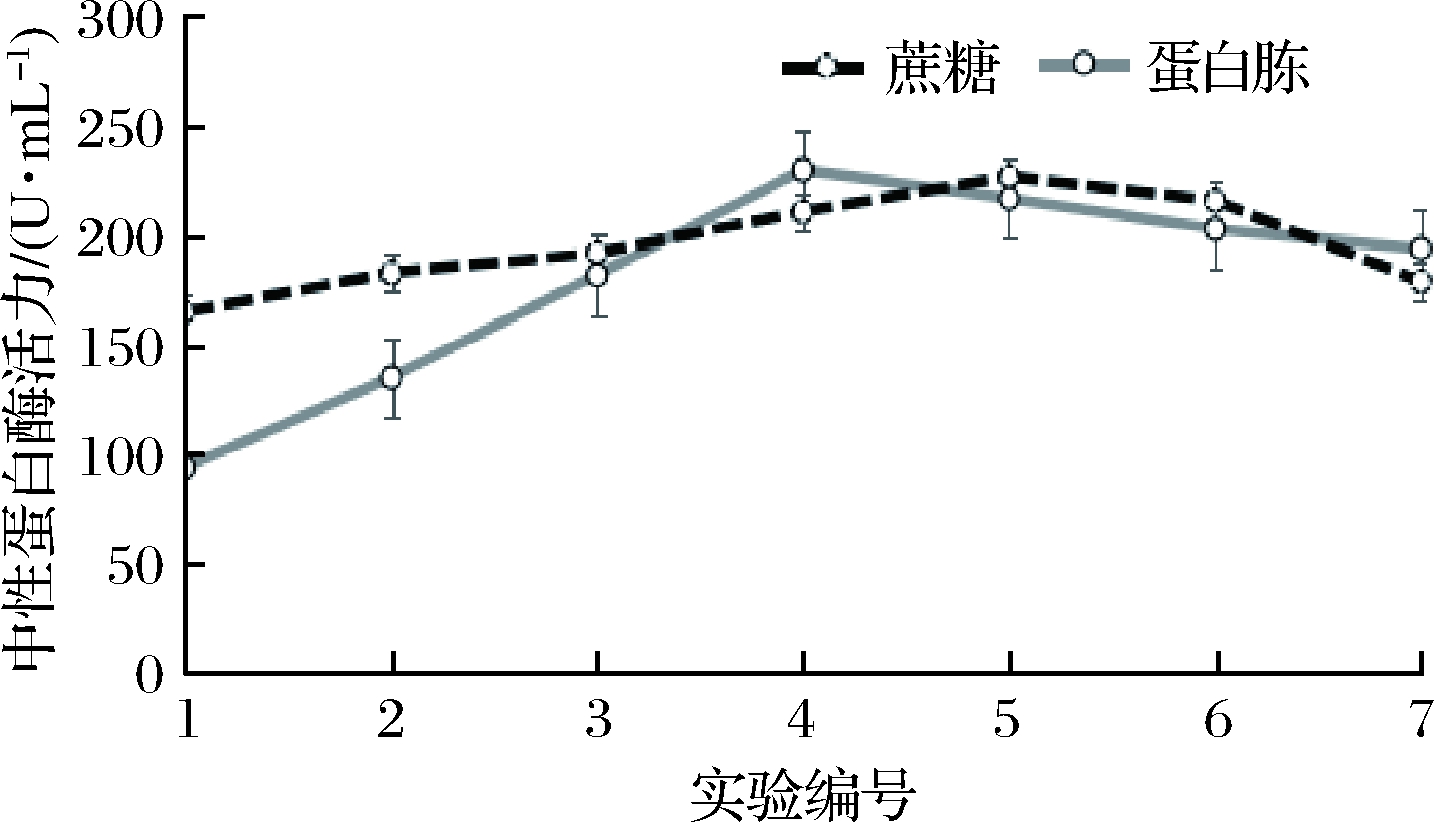
图1 蔗糖和蛋白胨添加量对产酶的影响
Fig.1 Effects of sucrose and peptone on protease production
2.1.2 吐温-80、初始pH对菌种产中性蛋白酶的影响
吐温-80作为微生物发酵常见的表面活性剂,可能在调节细胞膜的通透性上有积极的作用。吐温-80、初始pH对菌种产中性蛋白酶的影响如图2所示。当吐温-80的添加量从0.1 mL/100mL上升到0.4 mL/100mL时,枯草芽孢杆菌L07产酶活力呈现缓慢上升的趋势,而随着吐温-80在培养基中含量增高,培养基中酶活力出现了相对明显的下降。而当培养基中的初始pH从6.6调整到7.8的过程中,枯草芽孢杆菌L07产酶活力呈现一个起伏的趋势。
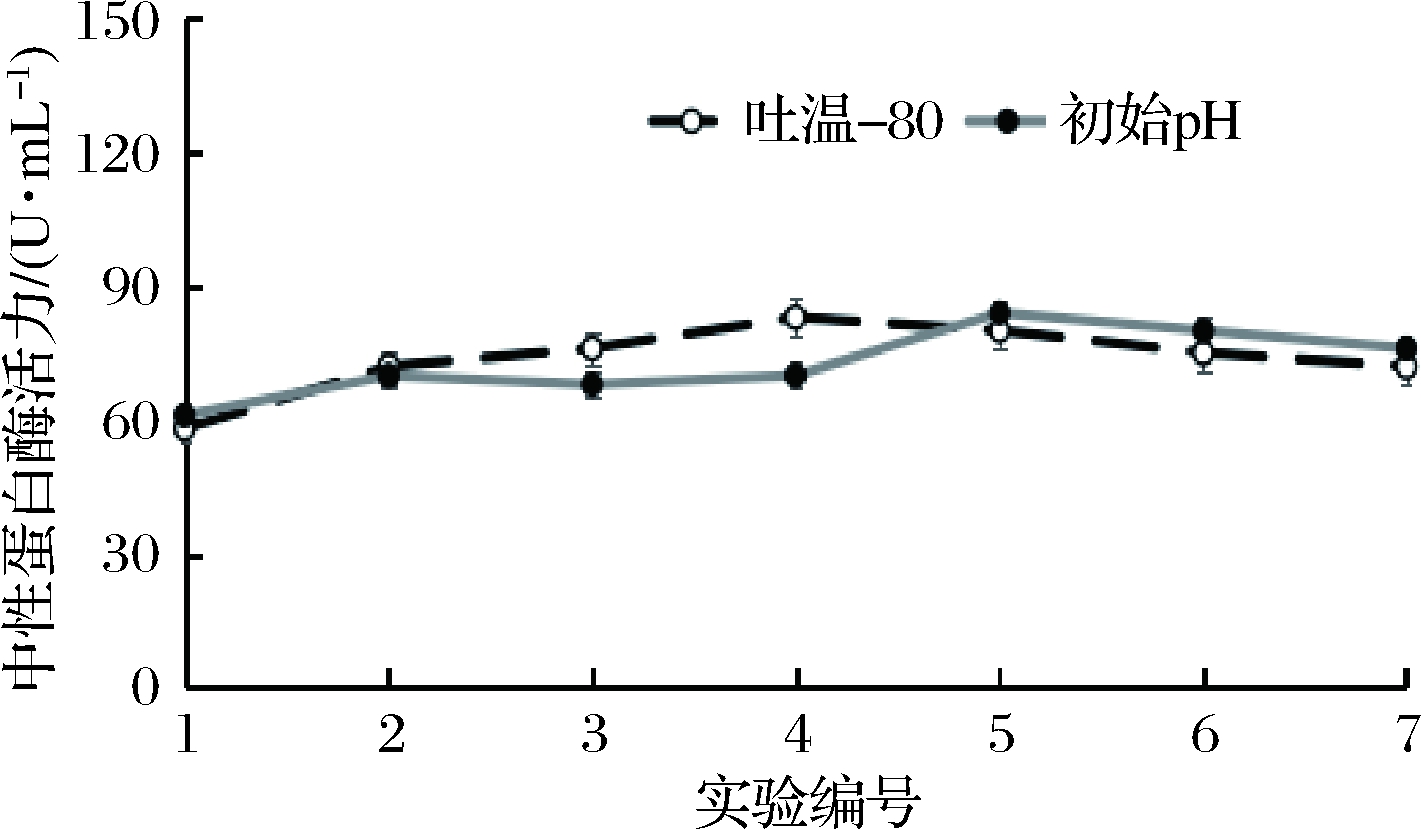
图2 吐温-80和初始pH对产酶的影响
Fig.2 Effects of Tween-80 and initial pH on protease production
2.1.3 MgSO4、种子液添加量对菌种产中性蛋白酶的影响
无机盐可以调节微生物的生长过程中细胞膜的渗透压,而Mg2+作为许多蛋白酶的辅助因子,对维持酶的催化性有重要作用。由图3可知,当MgSO4的添加量从0.2 g/100mL上升到0.4 g/100mL时,枯草芽孢杆菌L07产酶活力呈现上升的趋势,而在培养基中MgSO4含量继续增加到1.4 g/100mL时,培养基中酶活力出现了相对明显的下降。当培养基中的种子液含量从3 mL/100mL上升到13 mL/100mL时,枯草芽孢杆菌L07产酶活力呈现持续上升的趋势,而在培养基中种子培养液继续增加到15 mL/100mL,酶活力下降。
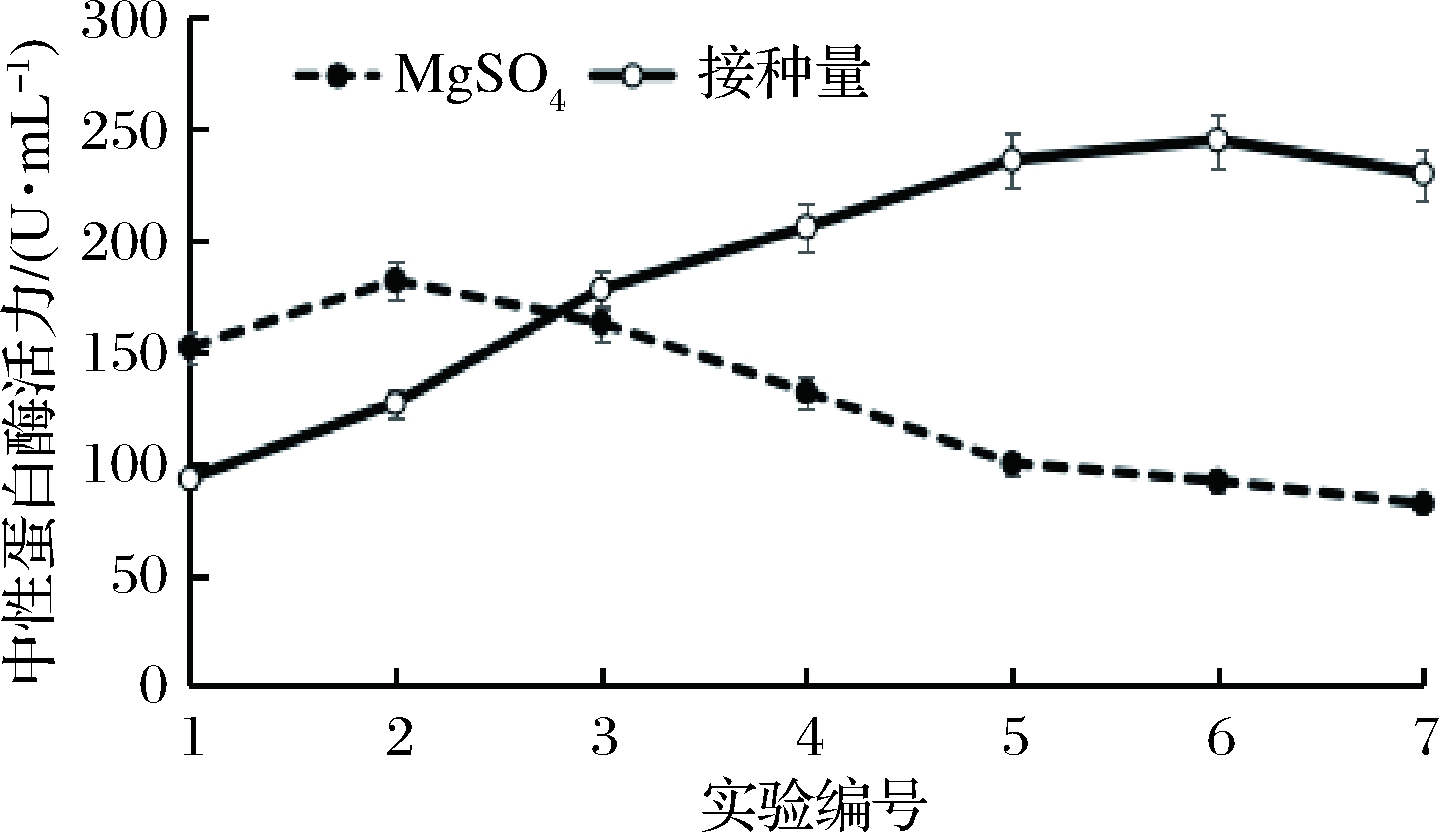
图3 MgSO4和接种量对产酶的影响
Fig.3 Effects of MgSO4 and inoculation volume on protease production
2.1.4 发酵温度、发酵时间对菌种产中性蛋白酶的影响
发酵温度和发酵时间能够影响微生物的动态生长过程和代谢过程。由图4可知,当发酵温度从30 ℃上升到38 ℃的时候,枯草芽孢杆菌L07产酶活力呈现缓慢上升的趋势,发酵温度继续升到42 ℃的时候,酶活力出现了相对较快下降。当发酵时间从40 h持续增加到60 h期间,枯草芽孢杆菌L07产酶活力呈现持续上升的趋势,继续发酵到64 h时,发酵
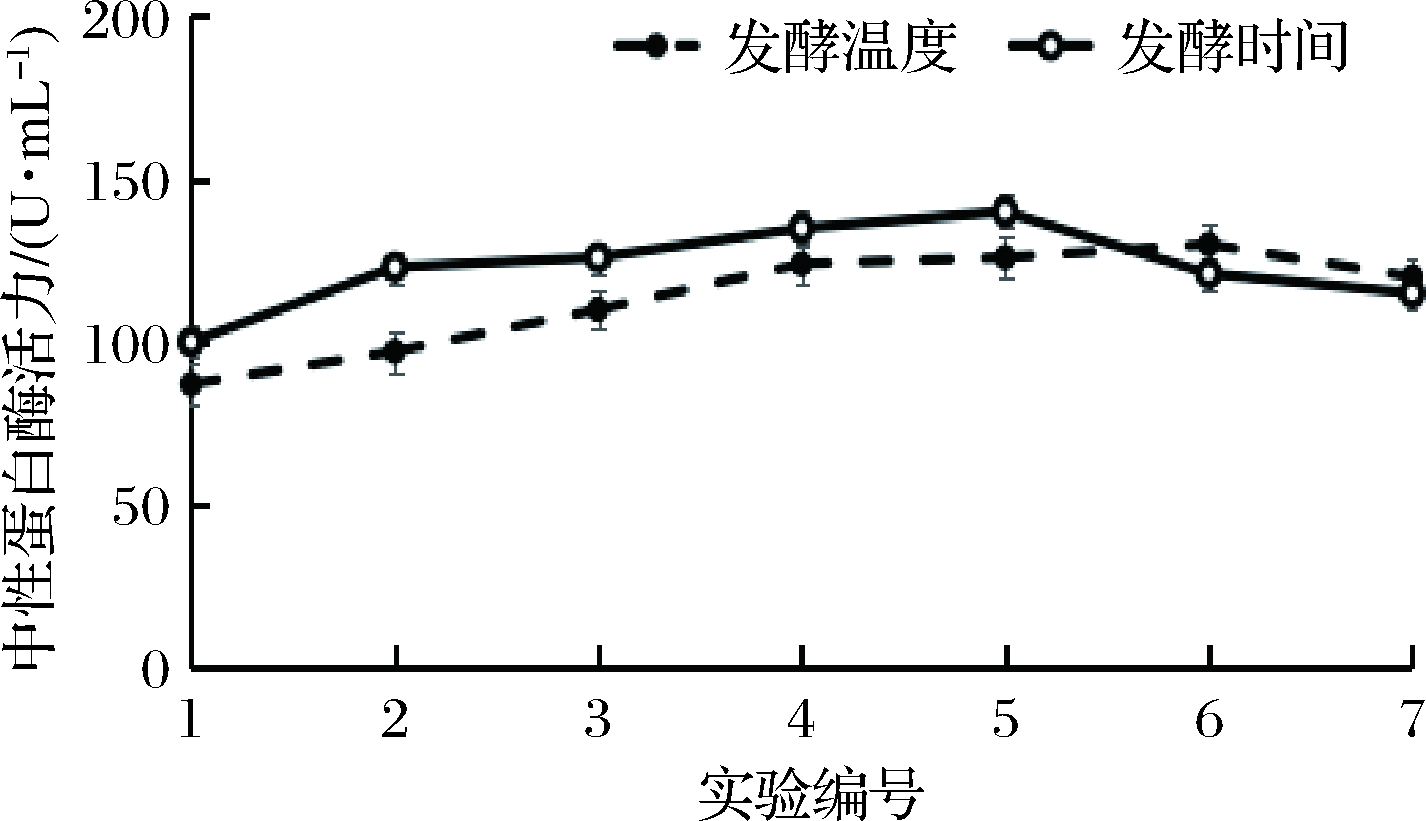
图4 发酵温度和发酵时间对产酶的影响
Fig.4 Effects of fermentation time and temperature on protease production
液中酶活力下降。
2.2 Packett-Burman实验结果
根据单因素试验结果,利用Minitab 17软件进行Packett-Burman实验设计。Packett-Burman实验设计和实验结果如表1所示,Packett-Burman实验结果分析如表2所示。
表1 Plackett-Burman实验设计和结果
Table 1 Design and results of Plackett-Burman test
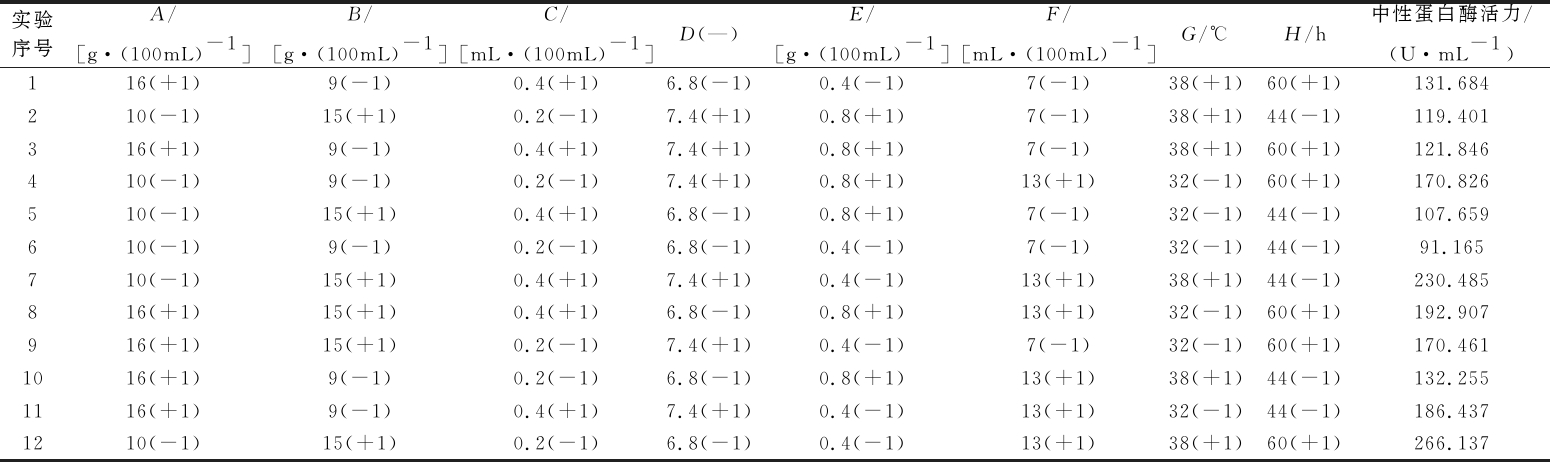
实验序号A/[g·(100mL)-1]B/[g·(100mL)-1]C/[mL·(100mL)-1]D(—)E/[g·(100mL)-1]F/[mL·(100mL)-1]G/℃H/h中性蛋白酶活力/(U·mL-1)116(+1)9(-1)0.4(+1)6.8(-1)0.4(-1)7(-1)38(+1)60(+1)131.684210(-1)15(+1)0.2(-1)7.4(+1)0.8(+1)7(-1)38(+1)44(-1)119.401316(+1)9(-1)0.4(+1)7.4(+1)0.8(+1)7(-1)38(+1)60(+1)121.846410(-1)9(-1)0.2(-1)7.4(+1)0.8(+1)13(+1)32(-1)60(+1)170.826510(-1)15(+1)0.4(+1)6.8(-1)0.8(+1)7(-1)32(-1)44(-1)107.659610(-1)9(-1)0.2(-1)6.8(-1)0.4(-1)7(-1)32(-1)44(-1)91.165710(-1)15(+1)0.4(+1)7.4(+1)0.4(-1)13(+1)38(+1)44(-1)230.485816(+1)15(+1)0.4(+1)6.8(-1)0.8(+1)13(+1)32(-1)60(+1)192.907916(+1)15(+1)0.2(-1)7.4(+1)0.4(-1)7(-1)32(-1)60(+1)170.4611016(+1)9(-1)0.2(-1)6.8(-1)0.8(+1)13(+1)38(+1)44(-1)132.2551116(+1)9(-1)0.4(+1)7.4(+1)0.4(-1)13(+1)32(-1)44(-1)186.4371210(-1)15(+1)0.2(-1)6.8(-1)0.4(-1)13(+1)38(+1)60(+1)266.137
对表1所列的Packett-Burman实验结果进行方差分析得到回归模型方程:Y=160.11-4.58 A+21.07 B+1.73 C+6.47 D-19.29 E+36.40 F+6.86 G+15.54 H。该模型R2=0.985 3,说明模型显著,拟合良好。根据表2所列的方差分析结果可知,8个影响因子的显著性排序为F(接种量)>B(蛋白胨)>E(MgSO4)>H(发酵时间)>G(发酵温度)>D(初始pH)>A(蔗糖)>C(吐温-80),且F(接种量)、B(蛋白胨)、E(MgSO4)3个因子的添加量在8个因子中最显著。因此确定接种量、蛋白胨、MgSO4这3个因子进行下一步的最陡爬坡实验。
表2 Plackett-Burman实验结果显著性分析
Table 2 Significance test of factors for Plackett-Burman test
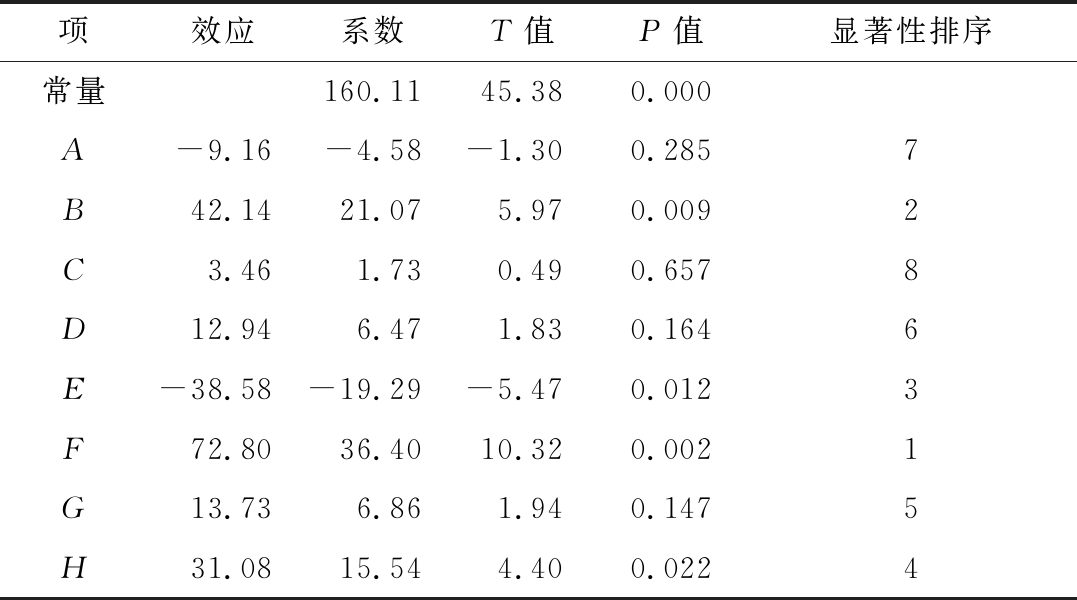
项效应系数T值P值显著性排序常量160.1145.380.000A-9.16-4.58-1.300.2857B42.1421.075.970.0092C3.461.730.490.6578D12.946.471.830.1646E-38.58-19.29-5.470.0123F72.8036.4010.320.0021G13.736.861.940.1475H31.0815.544.400.0224
2.3 最陡爬坡实验分析
根据表1的Packett-Burman实验结果,在最陡爬坡实验中将4个不显著因子维持相对较低水平。对于Packett-Burman实验筛选得出的接种量、蛋白胨和MgSO43个最显著因子,参考这3个因子的效应值可知,接种量和蛋白胨含量对产酶的影响为正效应,MgSO4含量对产酶的影响为负效应。因此在最陡爬坡实验中需要逐步升高接种量和蛋白胨含量,降低MgSO4的含量。
最陡爬坡实验结果如表3所示,随着接种量、蛋白胨和MgSO4三个因子在发酵液中含量的变化,枯草芽孢杆菌L07产酶呈现先上升后下降的趋势。最陡爬坡实验中最优实验结果为第4组,即接种量为13 mL/100mL、蛋白胨质量浓度为15 g/100mL,MgSO4质量浓度为0.4 g/100mL,以此质量浓度为中心点进行下一步Box-Behnken实验分析。
表3 最陡爬坡实验设计和结果
Table 3 Design and results of steepest ascent experiment
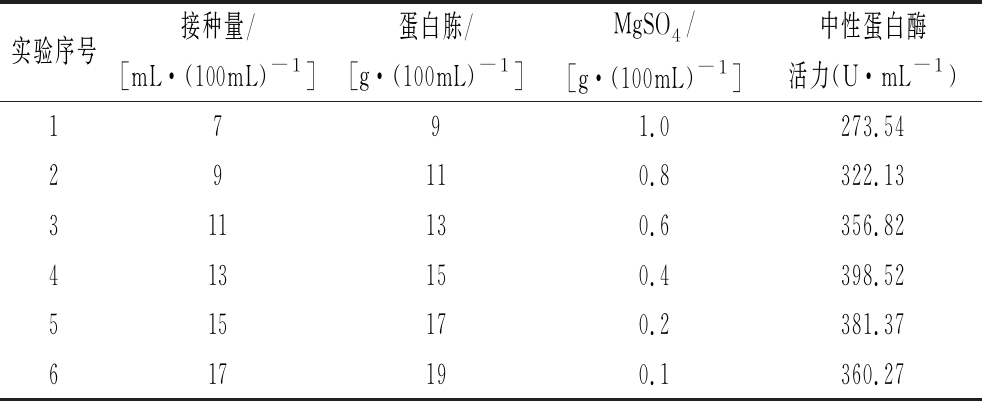
实验序号接种量/[mL·(100mL)-1]蛋白胨/[g·(100mL)-1]MgSO4/[g·(100mL)-1]中性蛋白酶活力(U·mL-1)1791.0273.5429110.8322.13311130.6356.82413150.4398.52515170.2381.37617190.1360.27
2.4 Box-Behnken实验分析
根据前面Packett-Burman实验筛选得出的3个显著因子,最陡爬坡实验得出3个显著因子的浓度范围,利用Design-Expert 8.0.5软件进行Box-Behnken实验设计和数据分析,结果如表4、5所示。
表4 Box-Behnken实验设计和结果
Table 4 Design and results of Box-Behnken experiment
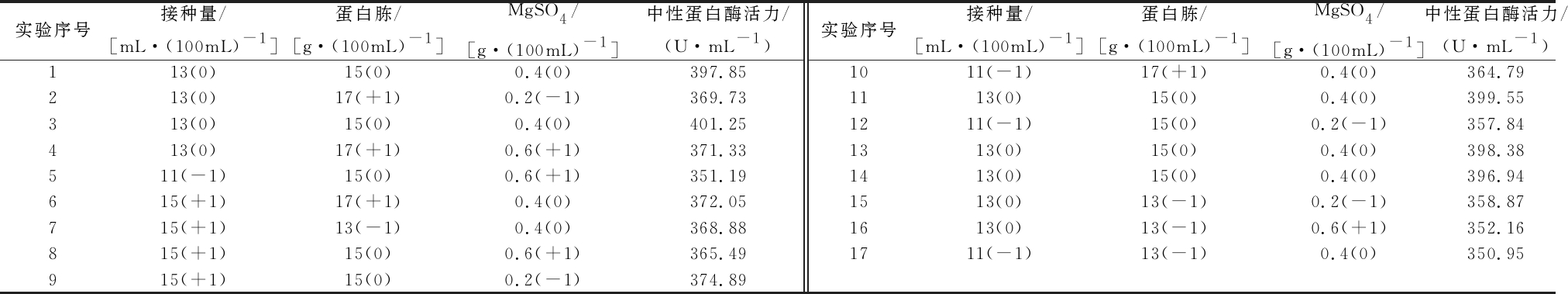
实验序号接种量/[mL·(100mL)-1]蛋白胨/[g·(100mL)-1]MgSO4/[g·(100mL)-1]中性蛋白酶活力/(U·mL-1)实验序号接种量/[mL·(100mL)-1]蛋白胨/[g·(100mL)-1]MgSO4/[g·(100mL)-1]中性蛋白酶活力/(U·mL-1)113(0)15(0)0.4(0)397.851011(-1)17(+1)0.4(0)364.79213(0)17(+1)0.2(-1)369.731113(0)15(0)0.4(0)399.55313(0)15(0)0.4(0)401.251211(-1)15(0)0.2(-1)357.84413(0)17(+1)0.6(+1)371.331313(0)15(0)0.4(0)398.38511(-1)15(0)0.6(+1)351.191413(0)15(0)0.4(0)396.94615(+1)17(+1)0.4(0)372.051513(0)13(-1)0.2(-1)358.87715(+1)13(-1)0.4(0)368.881613(0)13(-1)0.6(+1)352.16815(+1)15(0)0.6(+1)365.491711(-1)13(-1)0.4(0)350.95915(+1)15(0)0.2(-1)374.89
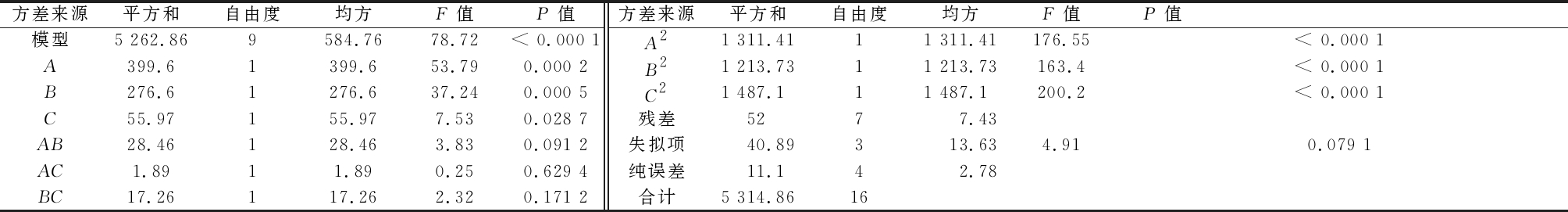
对表4的Box-Behnken实验结果进行分析可得回归模型方程:Y=398.79+7.07 A+5.88 B-2.64 C-2.67 AB-0.69 AC+2.08 BC-17.65 A2-16.98 B2-18.79 C2。模型和表5中A代表接种量,B代表蛋白胨,C代表MgSO4,Y代表预测的中性蛋白酶活力。由表5的方差分析结果可知,该模型显著,失拟项不显著。模型的R2=0.990 2,校正后![]() 信噪比=24.035>4,以上数据表明该模型拟合程度较好,误差较小,在设计区间内能准确预测响应值(中性蛋白酶活力)的变化。
信噪比=24.035>4,以上数据表明该模型拟合程度较好,误差较小,在设计区间内能准确预测响应值(中性蛋白酶活力)的变化。
表5 回归模型的方差分析结果
Table 5 Analysis results of the regression model
方差来源平方和自由度均方F 值P 值方差来源平方和自由度均方F 值P 值模型5 262.869584.7678.72< 0.000 1A21 311.4111 311.41176.55< 0.000 1A399.61399.653.790.000 2B21 213.7311 213.73163.4< 0.000 1B276.61276.637.240.000 5C21 487.111 487.1200.2< 0.000 1C55.97155.977.530.028 7残差5277.43AB28.46128.463.830.091 2失拟项40.89313.634.910.079 1AC1.8911.890.250.629 4纯误差11.142.78BC17.26117.262.320.171 2合计5 314.8616
通过Design-Expert 8.0.5软件得到接种量、蛋白胨和MgSO4含量3个因子之间的模型响应曲面图如图5所示。由图5可知,当蛋白胨含量一定时,随着种子液含量升高,发酵液中性蛋白酶活力呈现先增高后降低的趋势,这可能是由于随着菌体的生长繁殖,培养基中的营养成分消耗在加速,同时溶氧供应不足从而影响了中性蛋白酶的合成。此外,大量菌体分泌代谢产物的迅速增多可能会导致反馈抑制。当接种量一定时,适当的Mg2+能够增加菌体细胞膜的通透性和渗透压,有利于中性蛋白酶的合成和释放,而当无机盐离子质量浓度过高时,可能会影响菌体的正常生长代谢。同时,蛋白胨为枯草芽孢杆菌L07的产酶提供了重要的氮源,而当蛋白胨在发酵液中超过一定质量浓度的时候,可能会影响发酵液的通透性和溶氧量,从而影响菌种的产酶。综上所述,根据建立的数学模型分析,3个影响因子在A=0.19、B=0.15、C=-0.065时,有最佳产酶响应值。换算为接种量在13.4 mL/100mL、蛋白胨含量在15.3 g/100mL、MgSO4含量在0.39 g/100mL条件下,此时枯草芽孢杆菌L07产中性蛋白酶活力值预测将达到401.005 U/mL。

a-接种量和蛋白胨对中性蛋白酶活力的影响;b-接种量和MgSO4对中性蛋白酶活力的影响;c-蛋白胨和MgSO4对中性蛋白酶活力的影响图5 各因素对产酶影响的响应曲面图
Fig.5 Response surface for the factors on protease production
为了验证该模型的准确性和实用性,按照上述的预测发酵条件进行3次平行实验验证,结果测得枯草芽孢杆菌L07产中性蛋白酶活力分别为402.13、401.25、401.83 U/mL。3次平行实验验证的平均值为401.74 U/mL,与理论预测值401.005 U/mL非常贴近,说明该模型有良好的准确性和实用性。
3 结论
本文通过单因素实验、Plackett-Burman实验、最陡爬坡实验和响应面Box-Behnken实验设计对枯草芽孢杆菌L07产中性蛋白酶的发酵条件进行优化。得到最佳发酵条件为蔗糖10 g/100mL、蛋白胨15.3 g/100mL、吐温-80为0.2 mL/100mL、初始pH 6.8、MgSO4 0.39 g/100mL、接种量13.4 mL/100mL、发酵温度32 ℃、发酵时间44 h,在此发酵条件下理论预测枯草芽孢杆菌L07产中性蛋白酶酶活力为401.005 U/mL,实测值达到401.83 U/mL,比最初优化前133.42 U/mL提高了2.01倍。
[1] 宁跃龙,魏玉娟,赵尚,等.中性蛋白酶1398在羊毛洗毛工艺中的应用[J].毛纺科技,2019,47(4):26-29.
[2] 桂丽,孙谧,刘均忠,等.中性蛋白酶发酵液脱色工艺优化[J].食品与发酵工业,2016,42(8):92-96.
[3] 凌德娣,周亚楠,黄昕畑,等.中性蛋白酶提取植脂末油脂工艺的研究[J].中国油脂,2018,43(8):119-121.
[4] FONTENOT K R, EDWARDS J V, HALDANE D, et al. Designing cellulosic and nanocellulosic sensors for interface with a protease sequestrant wound-dressing prototype: Implications of material selection for dressing and protease sensor design[J]. Journal of Biomaterials Applications,2017,32(5):622-637.
[5] 朱瀛,赵改名,柳艳霞,等.中性蛋白酶水解鸡骨泥制备短肽工艺优化[J].农业工程学报,2016,32(12):309-314.
[6] 刘进杰,岳思涵,邹宁,等.中性蛋白酶水解螺旋藻制备抗氧化肽的工艺研究[J].食品工业,2018,39(11):27-31.
[7] BACON C W, HINTON D M, MITCHELL T R, et al. Characterization of endophytic strains of Bacillus mojavensis and their production of surfactin isomers[J]. Biological Control, 2012, 62(1):1-9.
[8] 余茜.米曲霉中性蛋白酶的分离纯化及Cu2+对其酶学性质的影响[D].雅安:四川农业大学,2018.
[9] 张晓燕,国立东,刘晓艳.枯草芽孢杆菌中性蛋白酶的研究进展[J].中国酿造,2018,37(4):12-15.
[10] KAZUNOBU O, MASAHITO H, XIA Z, et al. A newly derived protein from Bacillus subtilis natto with both antithrombotic and fibrinolytic effects[J]. Journal of Pharmacological Sciences,2005,99(3):247-251.
[11] 李洪康,李由然,李赢,等.枯草芽孢杆菌产中性蛋白酶发酵条件优化[J].食品与发酵工业,2016,42(5):102-107.
[12] 王晓阁.枯草芽孢杆菌研究进展与展望[J].中山大学研究生学刊(自然科学·医学版),2012,33(3):14-23.
[13] WANG H,YANG L,PING Y H, et al. Engineering of a Bacillus amyloliquefaciens strain with high neutral protease producing capacity and optimization of its fermentation conditions[J]. PLoS One,2016,11(1):e0146 373.
[14] 张若兰,刘庆国,王敏,等.枯草芽孢杆菌碱性蛋白酶基因在酿酒酵母中的表达和应用[J].食品与发酵工业,2018,44(7):76-81.
[15] 于平,吴赟婷,杨柳贞,等.蜡样芽孢杆菌高产新型中性蛋白酶发酵条件的优化[J].中国食品学报,2020,20(1):109-117.
[16] 刘文龙,刘胜利,王兴吉,等.枯草芽孢杆菌产中性蛋白酶发酵条件的优化[J].化学与生物工程,2019,36(1):47-52.
[17] 张咪,钱静亚.脉冲磁场诱变结合发酵条件优化提高中性蛋白酶产量的研究[J].包装与食品机械,2019,37(3):5-7;18.
[18] 蒋宝莹,裘娟萍,孙东昌.芽胞杆菌基因敲除技术及其在工农业应用中的研究进展[J].食品与发酵工业,2016,42(5):264-271.
[19] GB 23527 —2009蛋白酶制剂[S].北京:中国国家标准化管理委员会,2009.
[20] DAI L, LI J, YANG J, et al. Promiscuous glycosyltransferase from Bacillus subtilis 168 for the enzymatic synthesis of novel protopanaxatriol-type ginsenosides[J]. Journal of Agricultural & Food Chemistry, 2018, 66(4):943-949.
[21] 吴俊.分光光度法测定中性蛋白酶活力的不确定度分析[J].现代食品科技,2011,27(8):1 049-1 051.