虫生真菌因具有特异的杀虫作用,并且与昆虫长期协同进化[1],已成为生物防治的重要材料[2-3],也是宝贵的药用资源,如冬虫夏草、蝉花等[4-6]。古尼虫草[Cordyceps gunnii (Berk.)Berk. ]是寄生于蝙蝠蛾幼虫的一种虫草[7],其药用作用与冬虫夏草生药相当,古尼拟青霉(Paecilomyces gunnii Liang)为古尼虫草的无性型[8]。近年来,对古尼拟青霉液体发酵活性成分[9]和药理作用[10-13]的研究较多,但对其固体培养物研究较少。笔者前期研究发现古尼拟青霉固体发酵培养物有较强的抗氧化活性。本研究在前期研究的基础上对古尼拟青霉产抗氧化活性成分进行分离纯化与鉴定,为规模化生产提供基础。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌种
古尼拟青霉,采自安徽省金寨县,分离于蝙蝠蛾科幼虫,菌株编号为RCEF4117,由安徽省微生物防治重点实验室提供(菌库国际微生物数据中心登记号为WDCM No.1031)。
1.1.2 培养基
基础培养基:葡萄糖40 g,蛋白胨10 g,酵母浸粉10 g,琼脂20 g,配制好后用蒸馏水定容至1 L。
1.1.3 仪器与设备
6210 TOF高分辨液质联用分析仪(liquid chromatography/mass spectrometry,LC/MS),美国安捷伦公司;SPD-M20A高效液相色谱仪,日本岛津公司;Atlantis dC18(5 μm,3.9 mm×150 mm)分析型色谱柱、Atlantis dC18(5 μm,10 mm×150 mm)半制备型色谱柱,美国沃特世公司;Spectra Max M2酶标仪,美国Molecular device公司;LRT-250G光照培养箱,广东省医疗器械厂;分析级甲醇,上海建信化工有限公司;色谱级甲醇,美国天地(Tedia)公司。
1.2 实验方法
1.2.1 样品制备
按照1.1.2配制好培养基,高压蒸汽灭菌20 min后待冷却至55 ℃左右倒培养皿。待培养基完全冷却凝固,将剪好的玻璃纸(已灭菌)平铺覆盖在培养基上方,用移液器接种1 mL种子液于玻璃纸表面,置恒温培养箱中培养,培养温度为25 ℃,时间为8 d,培养好后刮取玻璃纸上方的菌丝冷冻干燥备用。将冻干菌丝粉碎,称取古尼拟青霉固体培养菌丝冻干粉100 g,按照料液比1∶30(g∶mL)加入甲醇,超声波浸提30 min,提取功率为80 kHz,提取温度为40 ℃。提取液经真空浓缩冻干后备用。
1.2.2 抗氧化活性测定
本研究采用二苯代苦味肼基(1,1-dipheny1-2-picrylhyldrazyl,DPPH)自由基法测定自由基清除率来表示抗氧化活性,具体选择了测定抗氧化活性较方便快捷的酶标仪实验法(DPPH-Microplate)[14-16]和薄层色谱实验法(DPPH-thin layer chromatography,DPPH-TLC)[17]。DPPH自由基清除率计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:Ap,样品加入DPPH试液的吸光值;Ac,样品不加入DPPH试液的吸光值;Am,不加样品(以100%甲醇代替)DPPH试液的吸光值。
1.2.3 LC/MS条件
MS条件:ESI离子源,雾化气压为35 Psi,液相色谱到质谱的分流比为4∶1,氮气流速12 L/min;阳离子下离子化电压为4 000 V,碎片电压250 V,阴离子下离子化电压为3 500 V,碎片电压175 V。高效液相色谱(high performance liquid chromatography,HPLC)洗脱条件:流动相A为甲醇,B为水;洗脱速度为0.8 mL/min;检测波长为200~600 nm全波长扫描;梯度洗脱程序如表1所示。
1.2.4 高效液相制备色谱条件
制备用反相高效液相色谱条件:流动相A为甲醇,B为水;洗脱速度为3.5 mL/min;检测波长为254 nm;梯度洗脱程序如表1所示。
表1 HPLC梯度洗脱程序
Table 1 Program of HPLC gradient elution

时间/min流动相A/%流动相B/%001002010055050256040301000401000
2 结果与分析
2.1 古尼拟青霉固体培养菌丝抗氧化活性的测定
精确称取30 mg古尼拟青霉固体培养菌丝冻干粉放入1.5 mL离心管中,加 1 mL甲醇,超声波浸提30 min,静置24 h,离心后取上清液。按DPPH-TLC法进行清除自由基活性的定性试验,薄层色谱图(图1)中可见多条黄色色带(DPPH为稳定的自由基,能与自由基清除剂反应使吸收光发生蓝移显黄色)[18]。分别取100 μL上清液和100 μL质量浓度为0.2 mg/mL DPPH试液于96孔酶标板中,混匀振荡30 s,常温静置20 min后于517 nm波长下测定其吸光值(Ap)。同时测定上清液不加入DPPH试液的吸光值(Ac)和加0.2 mg/mL DPPH试液但不加上清液(以同体积100%甲醇代替)的吸光值(Am)。按1.2.2中公式(1)测得其自由基清除率高达95%。结果显示古尼拟青霉固体培养菌丝中存在着较强自由基清除能力的活性成分。
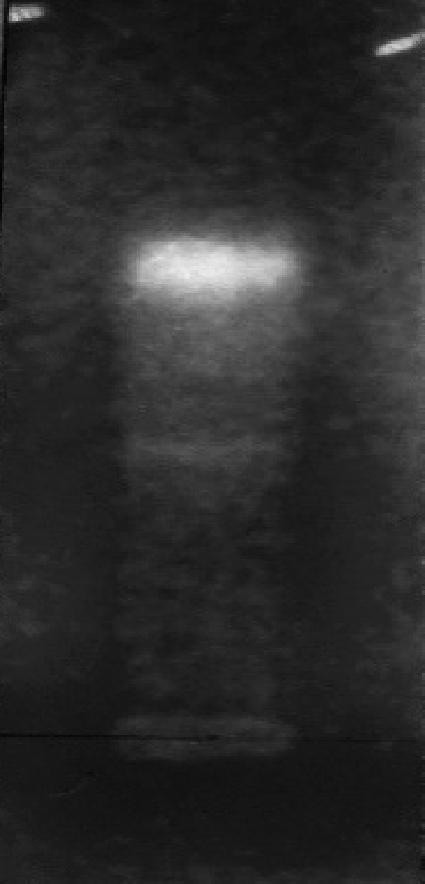
图1 古尼拟青霉甲醇提取物DPPH薄层色谱图
Fig.1 DPPH-TLC of methanol extract from P.gunnni
2.2 活性组分的分离纯化
2.2.1 提取物活性成分分析
将20 mg/mL的样品甲醇提取物进样20 μL进行液质联用分析,同时用1.5 mL离心管收集分流物,按1 min每管的速度收集,然后用氮气吹干,加70 μL甲醇溶解,按DPPH-Microplate法测定每管的自由基清除率,找出相应的活性组分。
由图2可知,样品中清除自由基活性组分主要集中在2个时间段,即10~13 min和15~17 min收集的流分,分别对应着HPLC色谱图(图3)中保留时间为10.8 min和15.8 min的2个峰,MS色谱图(图4)中保留时间为11.2 min和16.2 min的2个离子流峰。可以初步判断样品中含有2个活性组分。
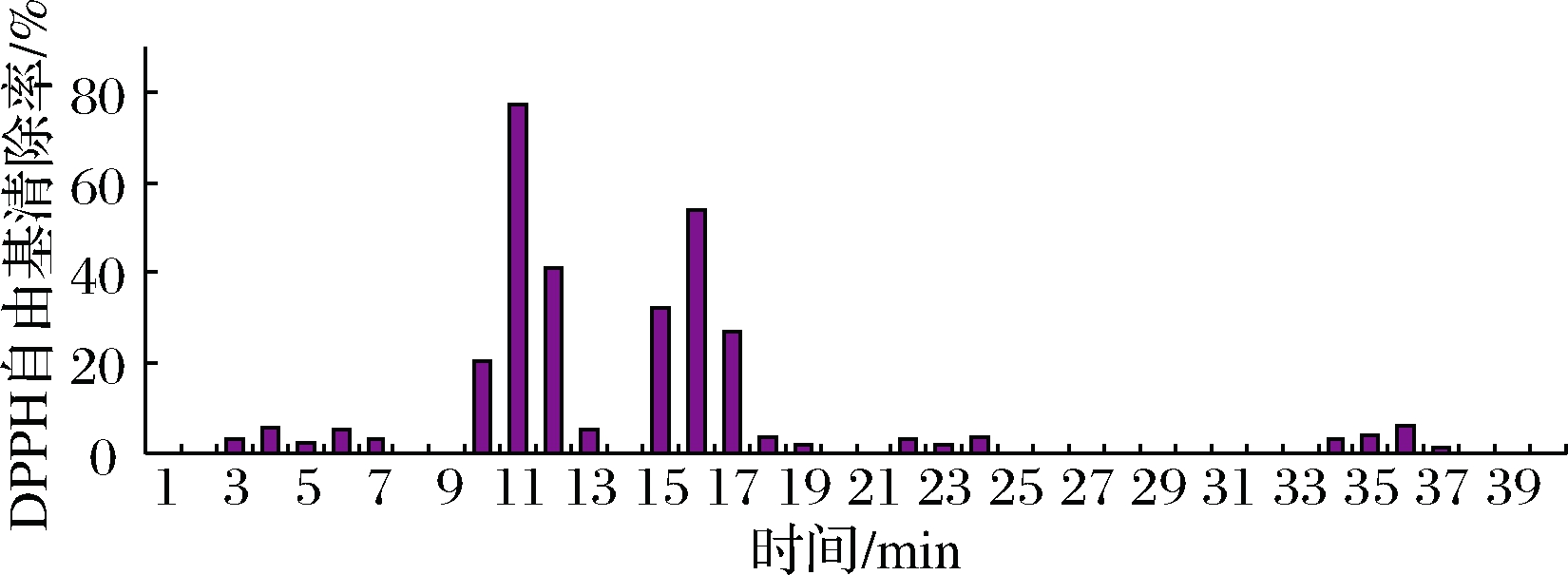
图2 古尼拟青霉甲醇提取物的HPLC流分活性
Fig.2 Activity of the HPLC eluates of methanol extract from P.gunnni
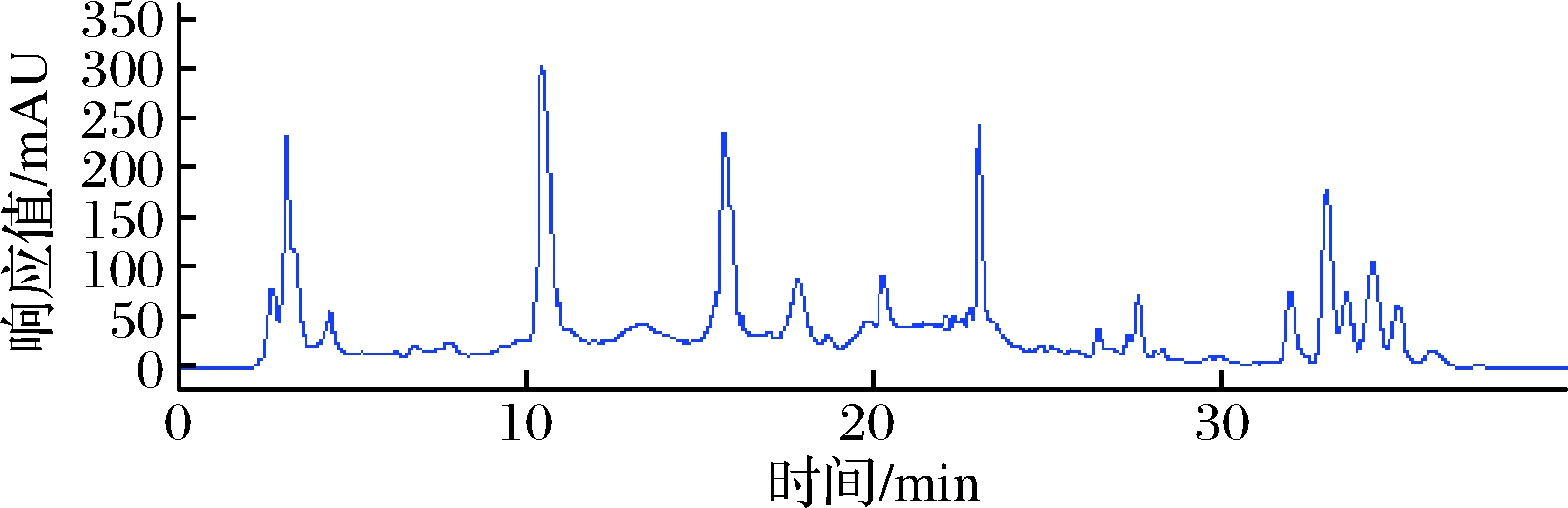
图3 古尼拟青霉甲醇提取物的HPLC图谱
Fig.3 HPLC chromatogram of methanol extract from P.gunnni
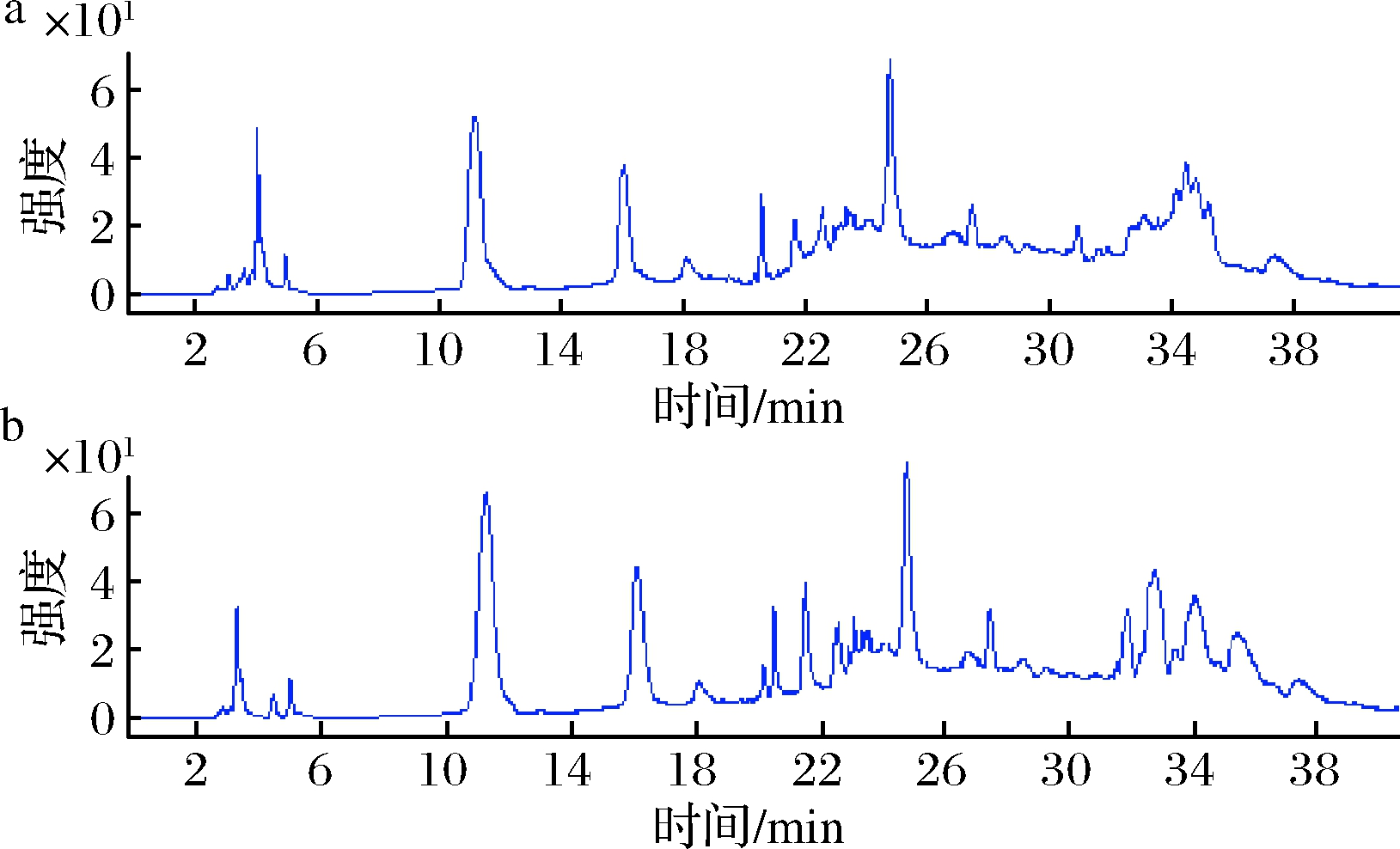
a-阴离子流图谱;b-阳离子流图谱图4 古尼拟青霉HPLC-MS的离子流图谱
Fig.4 Ion flow of HPLC-MS from P.gunnni
2.2.2 提取物中活性组分分离制备
将20 mg/mL的样品甲醇提取物进样500 μL,利用反相高效液相色谱分离制备上述2个活性组分。从提取物的HPLC制备图谱(图5)中可以看出,应重点收集峰A和峰B,同时也收集其他峰,以备做进一步研究。收集得到的峰A、峰B流分分别记为PG-1、PG-2。重复进样20次,合并对应的目标组分,将收集到的PG-1、PG-2于低温真空浓缩后冻干,分别得到目标化合物21 mg和12 mg。
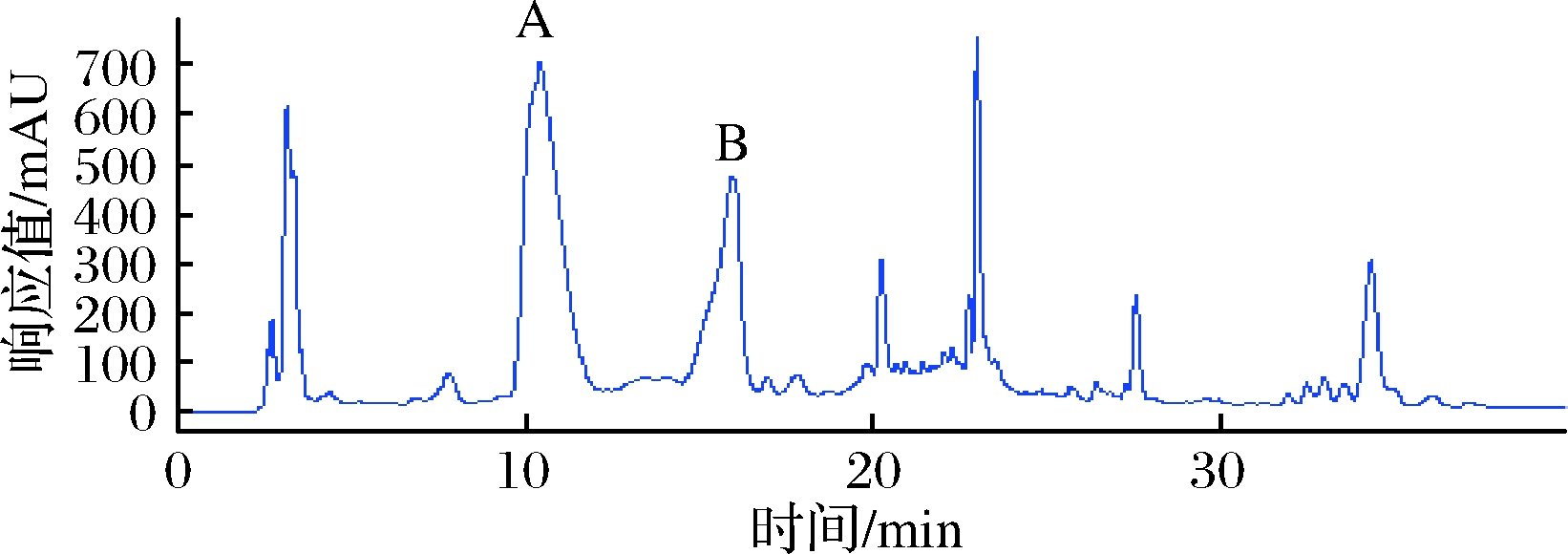
图5 古尼拟青霉甲醇提取物的HPLC制备图谱
Fig.5 Prep-HPLC of methanol extract form P.gunnni
2.3 活性分析和纯度鉴定
2.3.1 活性分析
精确称取10 mg PG-1溶解于1 mL甲醇中,取70 μL PG-1甲醇溶解液和70 μL质量浓度为0.2 mg/mL DPPH试液加入384孔酶标板中混匀,按照DPPH-Microplate法于517 nm下测定其吸光值,计算PG-1的清除自由基活性的平均值,对其进行活性定量分析确认。PG-2的活性定量分析确认方法同PG-1。结果显示目标化合物PG-1和PG-2清除自由基活性仍较强,自由基清除率分别达89.62%和75.45%。同时用DPPH-TLC法进行活性定性确认,显示制备的PG-1和PG-2在接触DPPH试剂后均显现出黄色斑点。定量和定性分析结果均表示制备过程中活性未丢失。
2.3.2 纯度鉴定
用HPLC对活性成分进行纯度鉴定,由图6可知,在254 nm条件下,活性组分PG-1和PG-2均仅有1个色谱峰,且其峰前、中、后3段的紫外-可见光吸收谱相同,并与制备前提取物HPLC-MS分析结果一致,说明制备的组分中无紫外可见光吸收的杂质,可初步判断活性组分PG-1和PG-2均为纯品。同时,采用HPLC峰面积归一化法,计算分离到的PG-1和PG-2纯度分别为97.31%和97.12%。
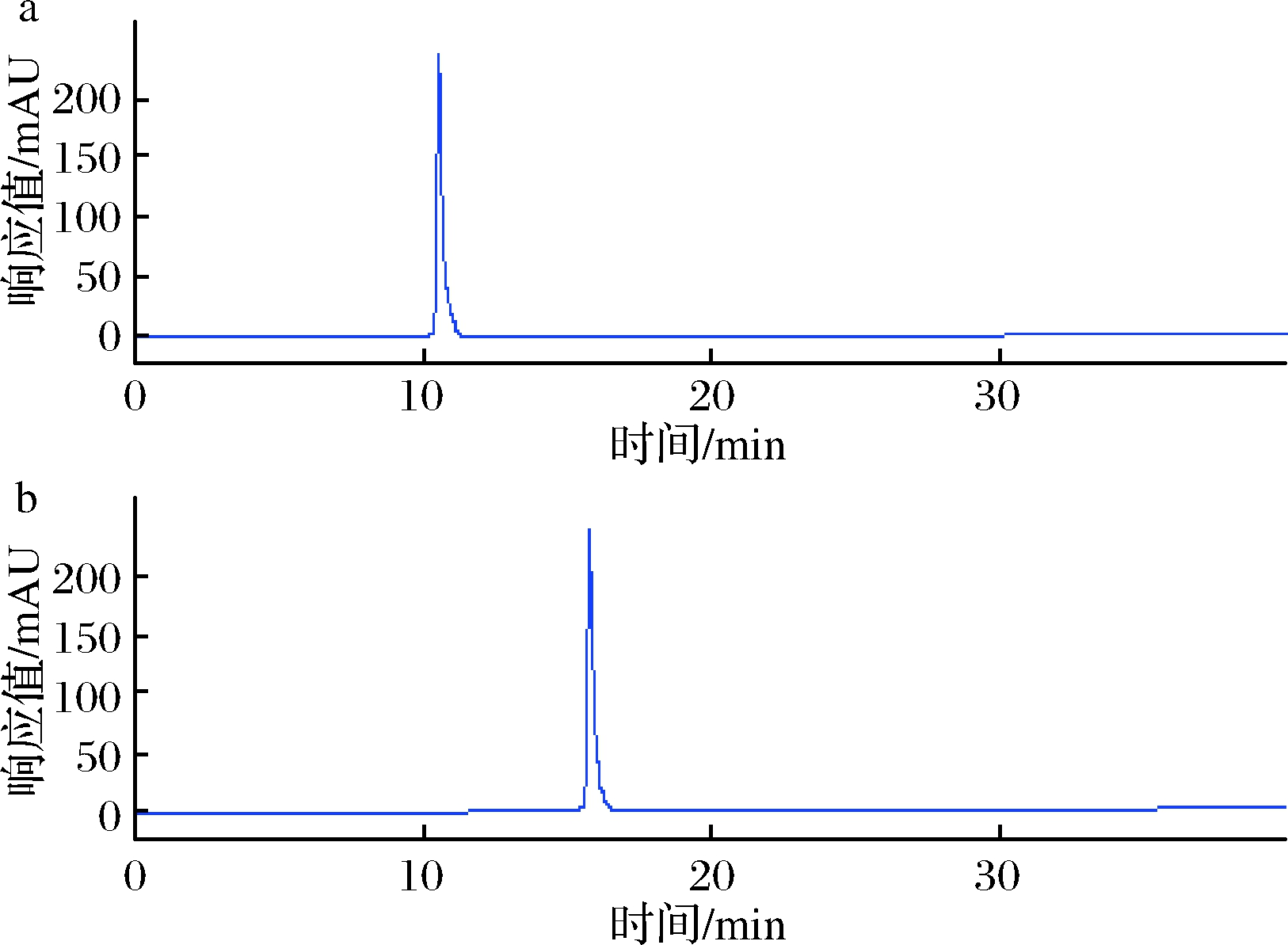
a-活性组分PG-1 HPLC色谱图;b-活性组分PG-2HPLC色谱图图6 活性组分HPLC色谱图
Fig.6 HPLC chromatogram of active components
2.4 质谱分析
组分PG-1高分辨质谱分析如图7所示,阳离子质谱图上有2个质荷比(m/z)为312.096 09和330.107 07的离子峰,精确计算得其离子式分别为![]() 和
和![]() 根据ESI离子源的离子化特征可知为[M-H2O+H]+离子峰和 [M+H]+ 离子峰;阴离子质谱图上仅有一个m/z为328.083 64离子峰,经精确计算得其离子式为
根据ESI离子源的离子化特征可知为[M-H2O+H]+离子峰和 [M+H]+ 离子峰;阴离子质谱图上仅有一个m/z为328.083 64离子峰,经精确计算得其离子式为![]() 为[M-H]-离子峰。综合高分辨质谱分析结果,可确定其分子式为C17H15NO6。
为[M-H]-离子峰。综合高分辨质谱分析结果,可确定其分子式为C17H15NO6。
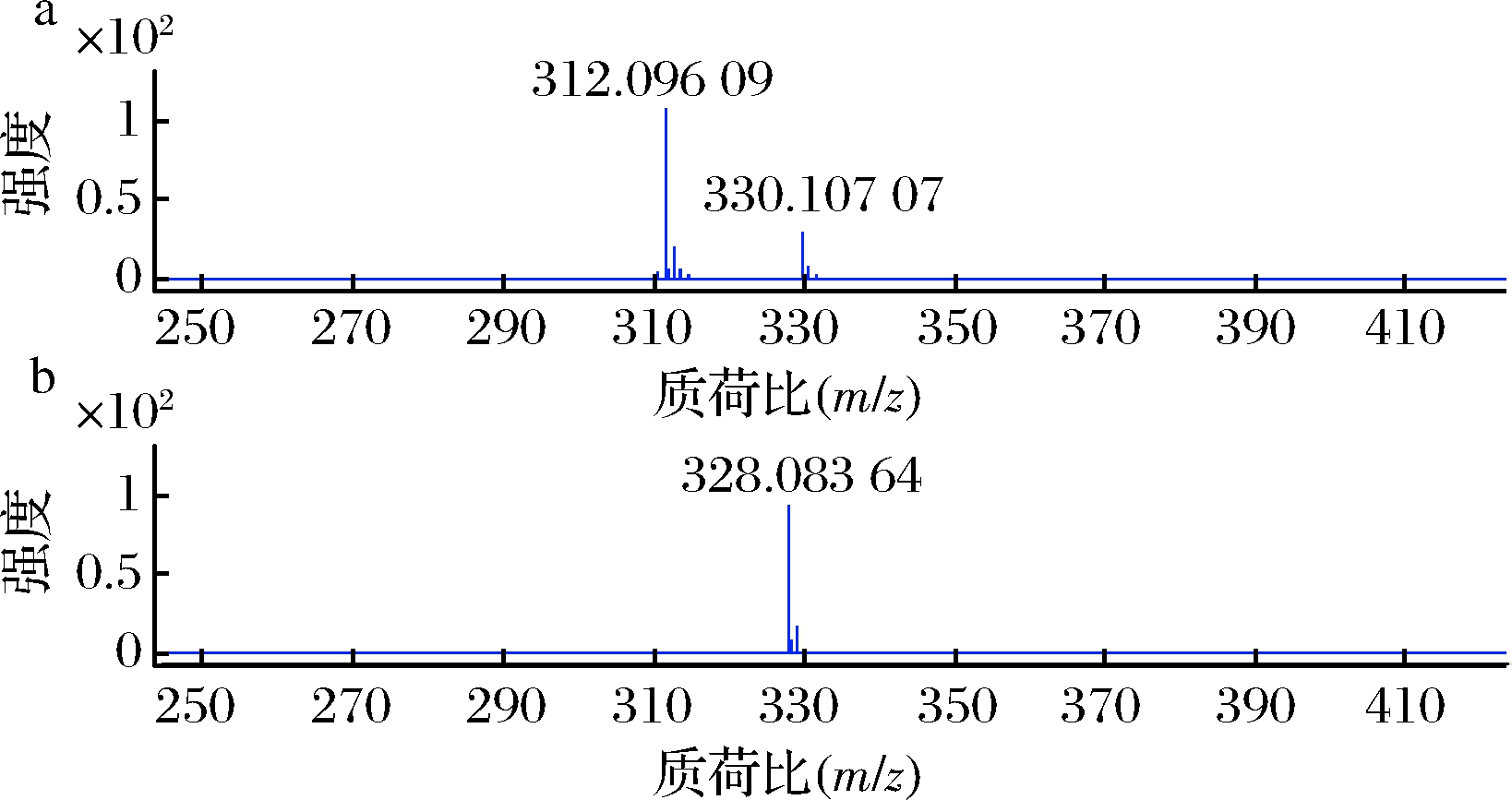
a-活性组分PG-1阳离子质谱图;b-活性组分PG-1阴离子质谱图图7 活性组分PG-1的高分辨质谱图
Fig.7 High resolution MS of active component PG-1
组分PG-2高分辨质谱分析如图8所示,阳离子质谱图上有2个质荷比(m/z)分别为303.091 11和325.074 08的离子峰,精确计算得其离子式分别为![]() 和
和![]() 根据ESI离子源的离子化特征可知为[M+H]+离子峰和[M+Na]+离子峰;阴离子质谱图仅有一个m/z为301.060 58的离子峰,精确计算得其离子式为
根据ESI离子源的离子化特征可知为[M+H]+离子峰和[M+Na]+离子峰;阴离子质谱图仅有一个m/z为301.060 58的离子峰,精确计算得其离子式为![]() 为[M-H]-离子峰。综合高分辨质谱分析结果,可以确定其分子式为C16H14O6。
为[M-H]-离子峰。综合高分辨质谱分析结果,可以确定其分子式为C16H14O6。
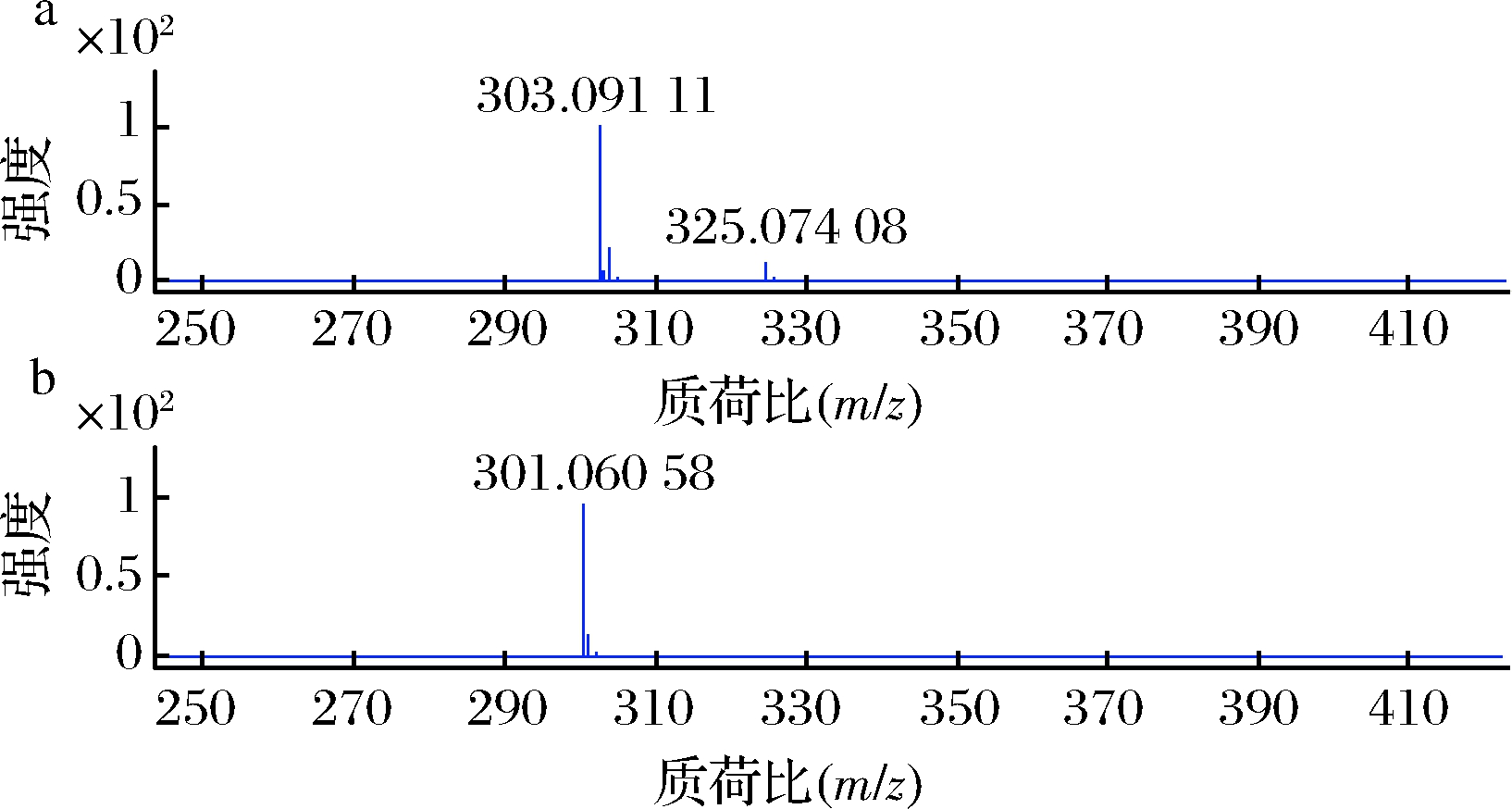
a-活性组分PG-2阳离子质谱图;b-活性组分PG-2阴离子质谱图图8 活性组分PG-2的高分辨质谱图
Fig.8 High resolution MS of active component PG-2
由于组分PG-1和组分PG-2纯品的质荷比与分离纯化前一致,确认制备出的2种化合物为古尼拟青霉固体培养物中存在的天然化合物。通过从天然产物数据库中查询,发现2种化合物为首次从古尼拟青霉中分离出。
3 讨论与结论
虫生真菌天然活性物质常用的分离纯化方法有:柱色谱法[19-20]、薄层色谱法[21]和高速逆流色谱法[22]等,本研究利用制备型HPLC对古尼拟青霉固体培养物抗氧化活性组分进行分离纯化,得到2种纯度较高的抗氧化活性物质,并验证了分离纯化过程中目标组分的抗氧化活性未丢失。本研究还利用高分辨HPLC-MS对古尼拟青霉固体培养物产抗氧化活性物质进行分析,为找出目标组分的分离制备条件,结合高分辨质谱能快速确定活性物的种类与性质。此方法适合用于活性强、含量高,有可能为未知化合物的研究[23-24]。若将各活性组分成功分离纯化,同时确定其结构相关信息,会为进一步研究和开发利用提供理论基础。
[1] 蒲蛰龙,李增智.昆虫真菌学[M].合肥:安徽科学技术出版社,1996.
[2] 黄红艳,刘九成.真菌杀虫剂在生物防治中的应用[J].北京农业,2015(6):73.
[3] 李增智.我国利用真菌防治害虫的历史、进展及现状[J].中国生物防治学报,2015,31(5):699-711.
[4] 董彩虹,李文佳,李增智,等.我国虫草产业发展现状、问题及展望——虫草产业发展金湖宣言[J].菌物学报,2016,35(1):1-15.
[5] 梁宗琦.中国真菌志(第三十二卷,虫草属)[M].北京:科学出版社,2007.
[6] LIANG Z Q, HAN Y F, CHU H L, et al. Studies on the genus Paecilomyces in China.I[J].Fungal Diversity,2005, 20: 83-101.
[7] 梁宗琦.古尼虫草分生孢子阶段的分离和鉴定[J].真菌学报,1985,4(3):32-36;67.
[8] 张泽文,傅岚,陈作红.古尼虫草无性型的分子鉴别[J].菌物学报,2005,24(3):344-348.
[9] 陈安徽,李春如,葛飞,等.古尼拟青霉小孢变种的主要有效成分分析[J].食品与发酵工业,2006,32(12):124-126.
[10] 甘卓亭,姚婷,丁璐.新古尼异虫草的化学成分、药理作用及开发应用研究进展[J].天然产物研究与开发,2019,31(6):1 109-1 115;1 108.
[11] 张倩. 古尼拟青霉主要成分的分析及药理作用初步研究[D].合肥:安徽农业大学,2011.
[12] ZHENG Y B, XU X P, ZOU X W. Biotransformation of caffeine in oolong tea by Paecilomyces gunnii[J]. International Biodeterioration & Biodegradation, 2016, 114: 141-144.
[13] LU R L, LIU X X, GAO S, et al. New tyrosinase inhibitors from Paecilomyces gunnii[J]. Journal of Agricultural and Food Chemistry, 2014, 62(49): 11 917-11 923.
[14] 章能胜. 一株古尼拟青霉提取物清除自由基活性研究[D].合肥:安徽农业大学,2010.
[15] ZHANG C, BERTIN R, FROLDI G. Ec 50 estimation of antioxidant activity in DPPH assay using several statistical programs[J]. Food Chemistry, 2013, 138(1): 414-420.
[16] DAWIDOWICZ A L, WIANOWSKA D, OLSZOWY M. On practical problems in estimation of antioxidant activity of compounds by DPPH method (Problems in estimation of antioxidant activity)[J]. Food Chemistry, 2012, 131(3): 1 037-1 043.
![]() J, STOCHMAL A,et al.Approach to develop a standardized TLC-DPPH test for assessing free radical scavenging properties of selected phenolic compounds[J].Journal of Pharmaceutical and Biomedical Analysis, 2012, 70: 126-135.
J, STOCHMAL A,et al.Approach to develop a standardized TLC-DPPH test for assessing free radical scavenging properties of selected phenolic compounds[J].Journal of Pharmaceutical and Biomedical Analysis, 2012, 70: 126-135.
[18] 胡丰林,陆瑞利,黄勃,等.一种被毛孢(Hirsutella sp.)培养液中自由基清除剂的分析、分离和制备[J].微生物学报,2008,48(8):1 035-1 041.
[19] LU R L, BAO G H, HU F L, et al. Comparison of cytotoxic extracts from fruiting bodies, infected insects and cultured mycelia of Cordyceps formosana[J]. Food Chemistry, 2014, 145(5): 1 066-1 071.
[20] ZHANG C, WANG W, LU R L,et al.Metabolic responses of Beauveria bassiana to hydrogen peroxide-induced oxidative stress using an LC-MS-based metabolomics approach[J]. Journal of Invertebrate Pathology, 2016, 137: 1-9.
[21] HU F L, HE Y Q, HUANG B, et al. Secondary metabolites in a soybean fermentation broth of Paecilomyces militaris[J].Food Chemistry, 2009, 116(1): 198-201.
[22] 章能胜,王金彬,胡丰林,等.玫烟色拟青霉中过氧麦角甾醇的高速逆流色谱法分离纯化及质谱分析[J].食品与发酵工业,2009,35(6):14-17.
[23] DABUR R,MITTAL A. Detection and qualitative analysis of fatty acid amides in the urine of alcoholics using HPLC-QTOF-MS[J]. Alcohol, 2016, 52: 71-78.
[24] YANG Z Z, LI Z H, LI Z. DPPH-HPLC-MS assisted rapid identification of endothelial protective substances from Xiao-Ke-An[J].Journal of Ethnopharmacology,2017,211(7): 188-196.