胶原蛋白是脊椎动物的主要结构蛋白,广泛分布于动物结缔组织、韧带、跟腱等,约占生物体自身总蛋白含量的30%,皮肤干重的3/4[1]。同时,参与细胞的增殖、分化与迁移,使骨、腱、软骨和皮肤具有一定机械强度[2]。因具有其他合成材料无法比拟的生物相容性、可生物降解性以及可大规模生产的可行性等优点,胶原蛋白广泛应用于健康食品、化妆品、生物材料和医药工业[3-5]。
目前,胶原蛋白的生产方法主要有:传统提取法、化学合成法、现代生物技术生产法[6-7]。传统提取法和化学合成法所获得的胶原蛋白活性较低,且带有安全隐患[8-9]。与动物来源的胶原蛋白相比,重组胶原蛋白具有更强的生物学活性、安全性、亲水性、可加工性和低免疫原性的特点[10-13]。已有多种通过基因工程技术生产重组人源性胶原蛋白的研究,涉及大肠杆菌、酵母、昆虫细胞、转基因作物、转基因小鼠等不同表达体系。因哺乳动物细胞、昆虫细胞、转基因小鼠等表达体系成本高、周期长,难以满足产业化需求,相比之下酵母和大肠杆菌表达系统具有成本低、速度快、技术相对简单、可进行高密度发酵等优点,是工业化生产的首选方式。
本研究利用酵母分泌表达获得重组人Ⅲ型胶原蛋白发酵液,以盐析沉淀和阳离子柱层析结合的方法,纯化出高纯度的重组人Ⅲ型胶原蛋白。该纯化工艺简便、稳定可靠,为其后续开发生产奠定了基础。
1 材料与方法
1.1 材料
重组人Ⅲ型胶原蛋白发酵液,由本实验室生产;XK 16/20层析柱、Capto SP impress(Capto SP)、SP Sepharose High Performance(强阳离子交换层析柱, SP HP)填料,GE healthcare公司;Cellufine MAX S-h(MAX S-h)、JNC corporation、SP Beads 6 FF,常州天地人和;重组人Ⅲ型胶原蛋白兔多抗,武汉博士德生物工程有限公司;驴抗兔HRP标记二抗,北京博奥森公司;其余化学试剂,成都市科龙化工试剂厂。
1.2 仪器与设备
AKTA pure System层析系统,GE healthcare公司;高速冷冻离心机,湖南湘仪仪器有限公司;电子天平,赛多利斯科学仪器有限公司;pH计,METTLER TOLEDO公司;电泳仪,BIO-RAD公司。
1.3 试验方法
1.3.1 重组人Ⅲ型胶原蛋白发酵液盐析
取离心过滤后发酵液,缓慢加入饱和硫酸铵,使其硫酸铵饱和度分别为15%、20%、30%。于室温下放置10 min,5 000 r/min离心3min,分别收集上清液及沉淀,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测。
1.3.2 重组人Ⅲ型胶原蛋白阳离子交换层析缓冲条件筛选
配制pH为5.5的20 mmol/L柠檬酸盐缓冲液,pH为6.0和6.5的20 mmol/L磷酸缓冲液(phosphate buffer,PB),pH为8.0的20 mmol/L Tris缓冲液,分别以SP Beads 6F填料进行层析纯化。收集各步骤样品,进行SDS-PAGE检测。
1.3.3 重组人Ⅲ型胶原蛋白阳离子交换层析填料筛选
以20 mmol/L PB(pH 6.0)缓冲液,分别用Capto SP impress、MAX S-h、SP Beads 6FF、SP HP填料进行柱层析。收集各步骤样品,进行SDS-PAGE检测。
1.3.4 重组人Ⅲ型胶原蛋白阳离子交换层析洗脱条件摸索及验证
以20 mmol/L PB(pH 6.0)平衡阳离子交换层析柱,上样再平衡后,以NaCl浓度梯度进行洗脱,分步收集洗脱样品,进行SDS-PAGE电泳检测。确定最佳洗脱条件后,以该条件进行至少2次验证实验。
2 结果与分析
2.1 重组人Ⅲ型胶原蛋白硫酸铵盐析结果
为降低层析上样时间,采用盐析法沉降重组人Ⅲ型胶原蛋白,再以超纯水复溶,从而起到浓缩的作用,并对样品进行初步纯化。如图1所示,当硫酸铵饱和度达到20%时,发酵液开始出现沉淀,但沉淀不完全;当饱和度达到30%时,上清中重组人Ⅲ型胶原蛋白几乎完全沉淀。因此,后续纯化对样品的初处理采用30%饱和度的硫酸铵以沉淀并浓缩重组人Ⅲ型胶原蛋白。

M-蛋白质分子质量标准;1-发酵液上清;2-15%饱和度硫酸铵盐析上清;3、 4-20%饱和度硫酸铵盐析上清;5、 6-30%饱和度硫酸铵盐析上清图1 重组人Ⅲ型胶原蛋白硫酸铵盐析电泳图
Fig.1 SDS-PAGE of ammonium sulfate salting out results of recombinant human type Ⅲ collagen
2.2 pH对重组人Ⅲ型胶原蛋白阳离子交换层析的影响
利用不同的缓冲体系,对重组人Ⅲ型胶原蛋白在pH为5.5、6.0、6.5、8.0时进行阳离子交换层析的捕获情况进行研究。层析填料:MAX SH;样品:发酵液以30%饱和度硫酸铵盐析,沉淀用超纯水复溶后,对相应pH缓冲液透析;洗脱条件:0~1 mol/L NaCl线性梯度洗脱,出峰后分步收集。层析结果如图2所示,在碱性条件下,重组人Ⅲ型胶原蛋白未被捕获,而在酸性条件时,可被阳离子交换柱捕获。其中,pH为6.0时,流穿中重组人Ⅲ型胶原蛋白量最少,重组人Ⅲ型胶原蛋白损失最小。因此,选用pH 6.0的缓冲条件进行重组人Ⅲ型胶原蛋白的纯化。
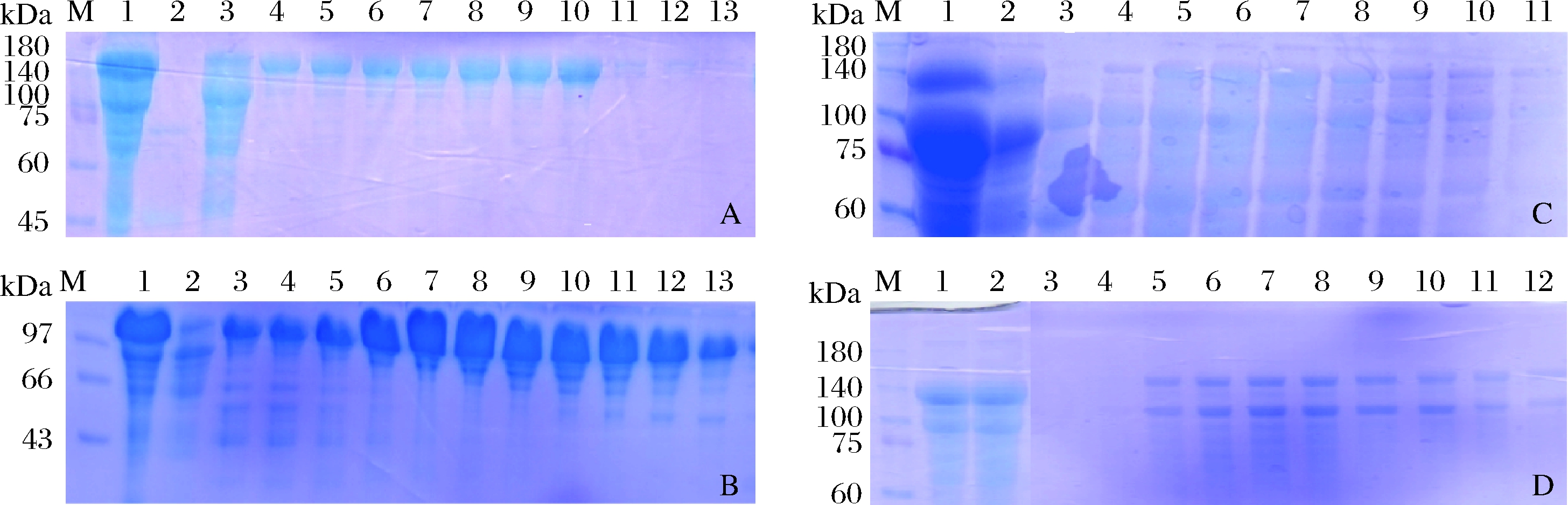
M-蛋白质分子质量标准;1-上样前样品;2-层析穿透;3~13-分步收集样品A-pH 5.5柠檬酸盐缓冲液阳离子柱层析结果;B-pH 6.0磷酸盐缓冲液阳离子柱层析结果;C-pH 6.5磷酸盐缓冲液阳离子柱层析结果;D-pH 8.0 Trise缓冲液阳离子柱层析结果;图2 pH对重组人Ⅲ型胶原蛋白阳离子交换层析的影响
Fig.2 Effect of pH on cation exchange chromatography of recombinant human type Ⅲ collagen
2.3 阳离子交换层析填料的筛选
在研究了重组人Ⅲ型胶原蛋白最适捕获缓冲体系后,在该体系下进行适宜的阳离子交换填料的筛选。结果如图3所示,在pH 6.0的缓冲体系中,重组人Ⅲ型胶原蛋白与4种阳离子交换填料都能结合。其中MAX S-h和SP HP填料的分辨率高,对重组人Ⅲ型胶原蛋白的分离效果好,但是MAX S-h载量低,因此采用SP HP填料进行后续研究。

M-蛋白质分子量标准;1-上样前样品;2-层析穿透;3~16-分步收集样品A-重组人Ⅲ型胶原蛋白MAX S-h柱纯化结果;B-重组人Ⅲ型胶原蛋白SP beads 6FF柱纯化结果;C-重组人Ⅲ型胶原蛋白Capto SP柱纯化结果;D-重组人Ⅲ型胶原蛋白SP HP柱纯化结果图3 不同阳离子交换层析填料对重组人Ⅲ型胶原蛋白的分离
Fig.3 Separation of recombinant human type Ⅲ collagen with different cation exchange chromatography
2.4 重组人Ⅲ型胶原蛋白阳离子交换层析洗脱条件优化
在pH为6.0缓冲条件下,以SP HP阳离子交换层析对重组人Ⅲ型胶原蛋白进行纯化,并对洗脱条件进行研究。上样后,以0~1 mol/L NaCl线性梯度洗脱。结果如图4所示,分析纯化图谱A和电泳图B、C,洗脱峰p1、p3、p4的NaCl浓度分别为52、150、250 mmol/L。250 mmol/L NaCl洗脱的p4,为高纯度重组人Ⅲ型胶原蛋白。
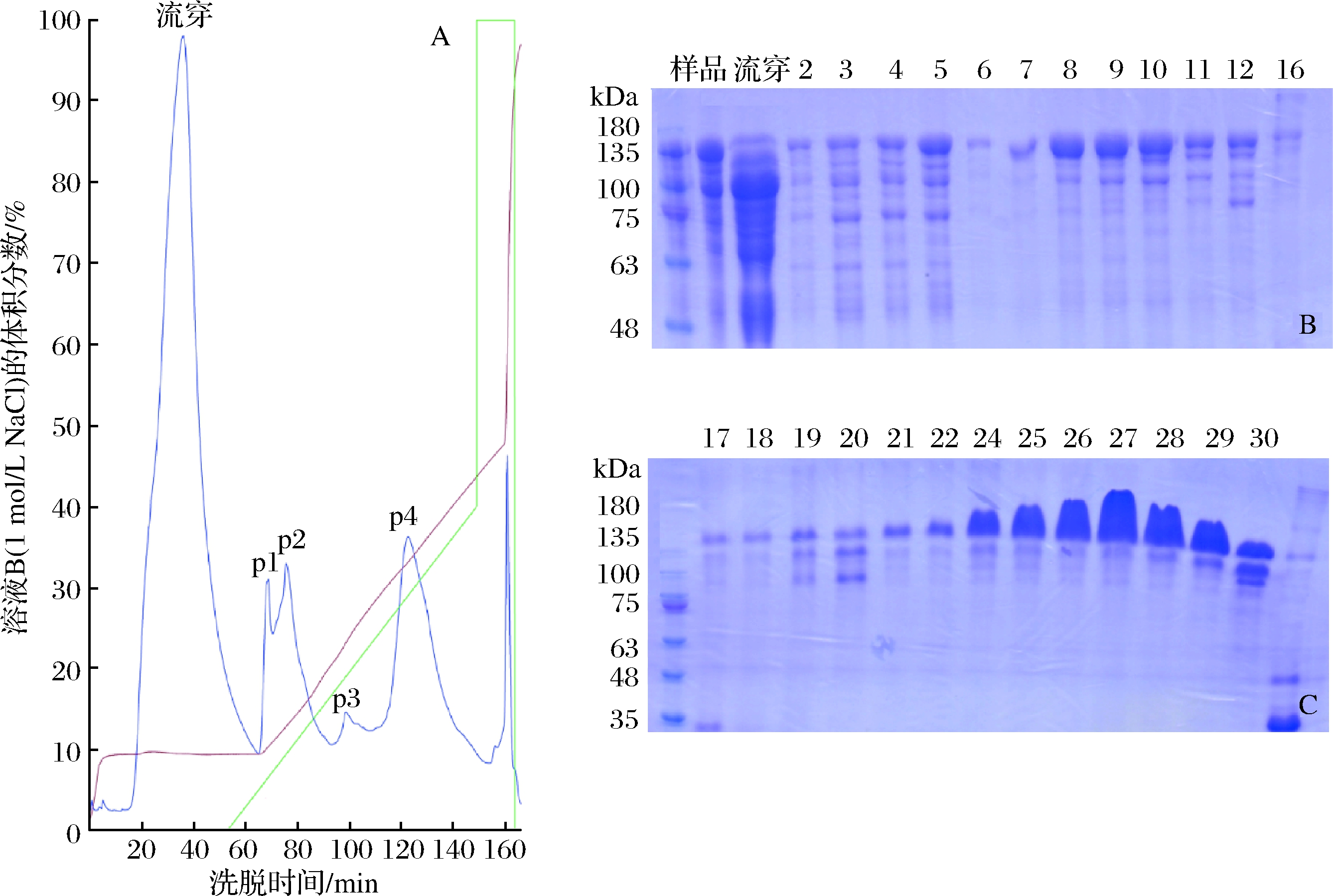
A-重组人Ⅲ型胶原蛋白SP HP纯化层析图;B、 C-重组人Ⅲ型胶原蛋白SP HP纯化电泳图图4 SP HP阳离子交换层析柱线性梯度洗脱结果
Fig.4 Results of linear gradient elution in SP HP cation exchange chromatography
注:泳道上的数字为分步收集样品编号
根据上述结果,采用52、150、250 mmol/L NaCl进行阶段梯度洗脱,结果如图5所示,重组人Ⅲ型胶原蛋白在250 mmol/L NaCl条件下被洗脱下来,而52、150 mmol/L NaCl洗脱品为重组人Ⅲ型胶原蛋白的降解物。
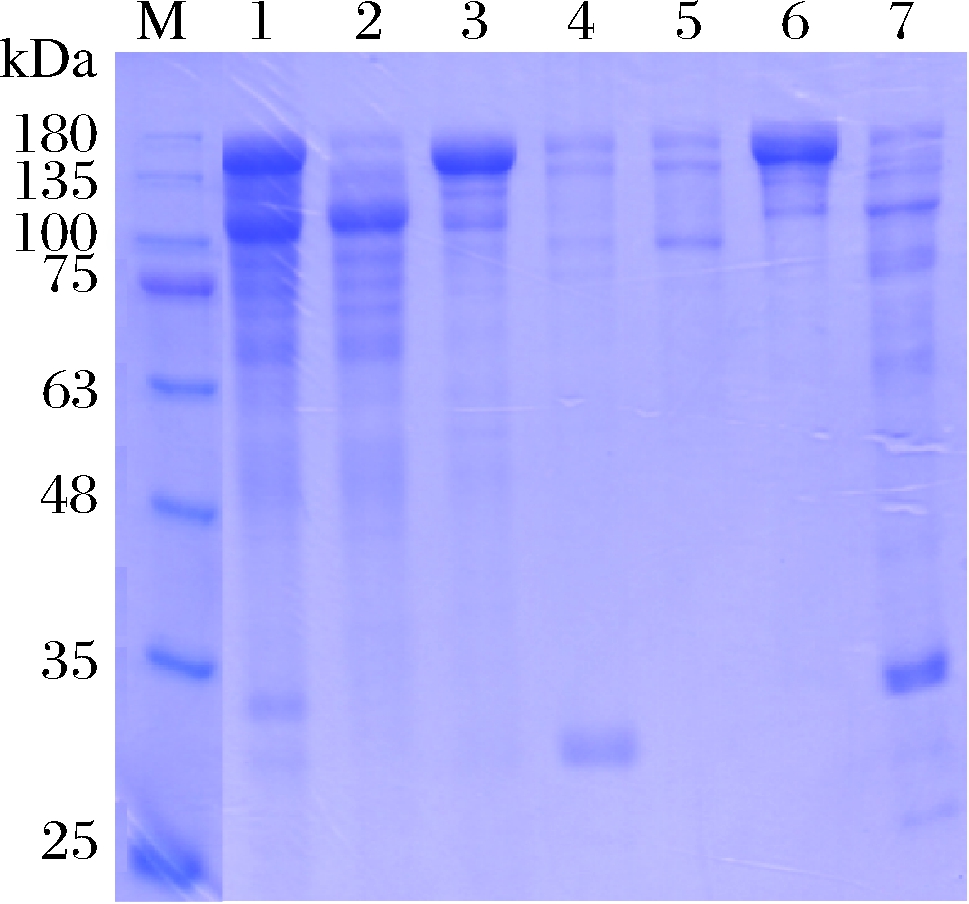
M-蛋白质分子量标准;1-上样前样品;2-层析穿透;3、 4-52 mmol/L NaCl洗脱样;5-150 mmol/L NaCl洗脱样;6-250 mmol/L NaCl 洗脱样;7-1 mol/L NaCl清洗层析柱图5 重组人Ⅲ型胶原蛋白阳离子交换层析阶段梯度洗脱结果
Fig.5 Results of step gradient elution of cation exchange chromatography of recombinant human type Ⅲ collagen
采用优化后的层析工艺对60 L发酵液进行重组人Ⅲ型胶原蛋白的纯化,产品纯度97.7%,总回收率68.8%,如表1所示。
表1 重组人Ⅲ型胶原蛋白纯化工艺各步骤回收率
Table 1 Recovery rate of each step of the purification process of recombinant human type Ⅲ collagen
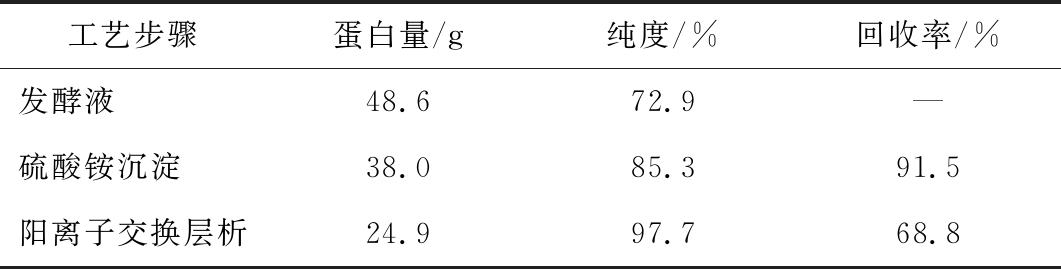
注:—表示无
工艺步骤蛋白量/g纯度/%回收率/%发酵液 48.672.9—硫酸铵沉淀 38.085.391.5阳离子交换层析24.997.768.8
2.5 重组人Ⅲ型胶原蛋白的鉴定
将纯化的蛋白采用免疫印迹进行鉴别实验,方法参见《中国药典》[14],证明其为重组人Ⅲ型胶原蛋白,结果如图6所示。
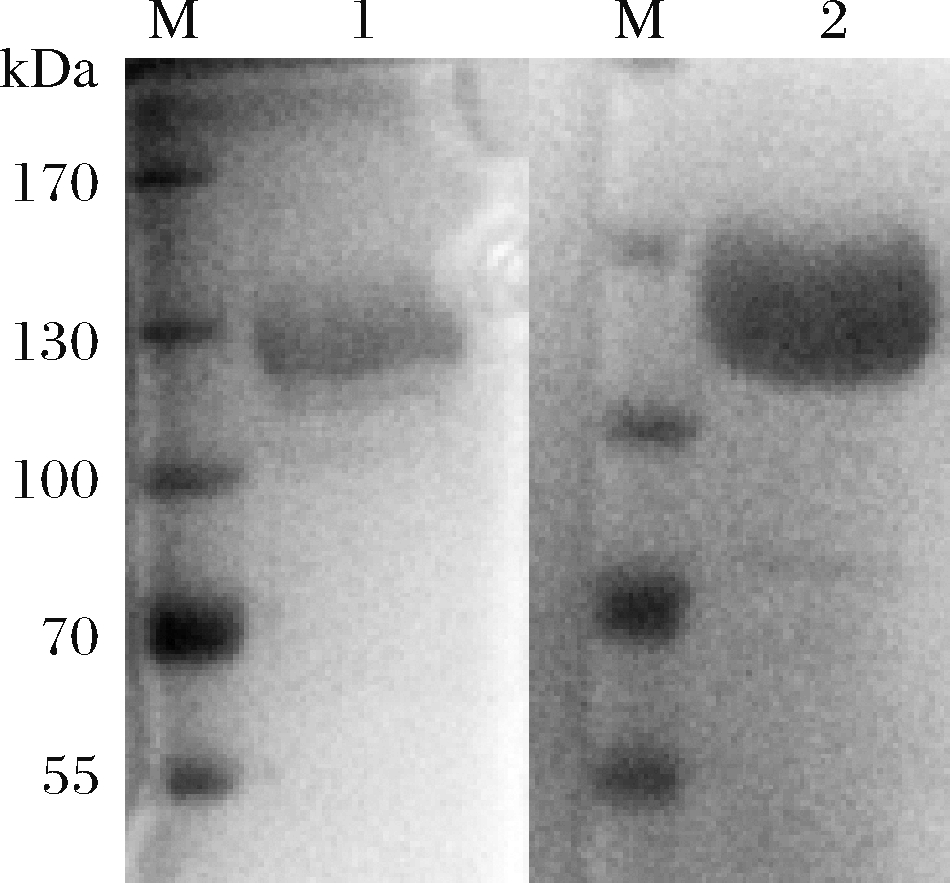
M-蛋白质分子量标准;1-重组人Ⅲ型胶原蛋白考马斯亮蓝染色;2-重组人Ⅲ型胶原蛋白免疫印迹图6 重组人Ⅲ型胶原蛋白免疫印迹检测及考马斯亮蓝染色对照
Fig.6 Immunoblotting and Coomassie brilliant blue staining of recombinant human type Ⅲ collagen
2.6 重组人Ⅲ型胶原蛋白的纯度分析
采用分子排阻高效液相色谱(size exclusion high performance liquid chromatography,SEC-HPLC)对纯化的重组人Ⅲ型胶原蛋白进行纯度分析,其纯度为97.7%,结果如图7所示。
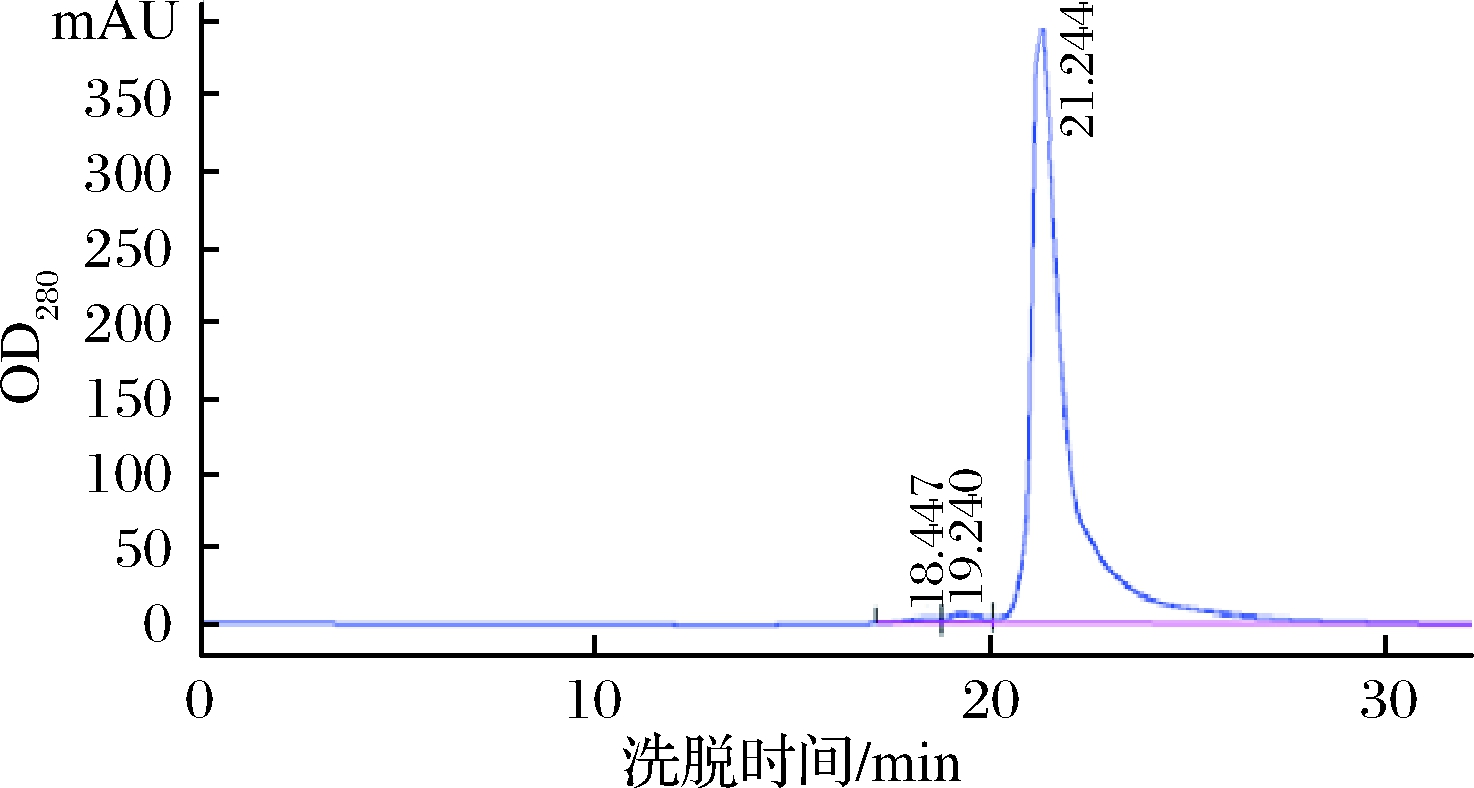
图7 重组人Ⅲ型胶原蛋白SEC-HPLC分析
Fig.7 SEC-HPLC Analysis of recombinant human type Ⅲ collagen
3 讨论与结论
重组人Ⅲ型胶原蛋白在医药、保健、营养等方面具有重要的应用价值,对其开发生产具有巨大的市场价值。早期的重组胶原蛋白,多采用大肠杆菌表达,分离纯化工艺复杂,热原难以控制。王晓军等[15]从大肠杆菌中经阴离子交换和分子筛(Sephadex G-100)柱层析分离重组胶原蛋白,最终产物纯度达98%,回收率为80.5%。毕赤酵母由于既有原核微生物的特点,又有真核生物的特性,可以对目的蛋白进行糖基化、二硫键形成等翻译后修饰,近年来在胶原蛋白的表达中越来越受到青睐。周爱梅等[10]采用巴氏毕赤酵母分泌表达重组人源胶原蛋白,采用40%饱和度硫酸铵沉淀和Sephadex G-100纯化得到电泳重组人源胶原蛋白。但上述工艺中,由于分子筛柱层析费时少、处理量小,不利于产业化应用。
本研究建立了一步层析法从毕赤酵母发酵液中纯化重组人Ⅲ型胶原蛋白:发酵液以30%饱和度硫酸铵盐析沉淀重组人Ⅲ型胶原蛋白,沉淀用超纯水复溶后,对20 mmol/L PB(pH 6.0)超滤、转换介质,上阳离子交换柱SP HP,以20 mmol/L PB(pH 6.0)-150 mmol/L NaCl洗脱杂蛋白及降解的重组人Ⅲ型胶原蛋白,以20 mmol/L PB(pH 6.0)-250 mmol/L NaCl洗脱重组人Ⅲ型胶原蛋白。该纯化工艺简便,离子交
换层析放大容易,因此更便于产业化。纯化的高纯度、全分子重组人Ⅲ型胶原蛋白,热原含量低,可用于医药领域,如医用海绵、薄膜、缝合线等。
[1] 蒋挺大.胶原与胶原蛋白[M].北京:化学工业出版社,2006:171-173.
[2] EXPOSITO J,VALCOURT U,CLUZEL C,et al.The fibrillar collagen family[J].International Journal of Molecular Sciences,2010,11(2):407-426.
[3] GELSE K,POSCHL E,AIGNER T.Collagens-structure,function, and biosynthesis[J].Advanced Drug Deliver Reviews,2003,55(12):1 531-1 546.
[4] YU X Y,TANG C E,XIONG S B,et al.Modification of collagen for biomedical applications: A review of physical and chemical methods[J].Current Organic Chemistry,2016,20(17):1 797-1 812.
[5] DESHMUKH S N,DIVE A M,MOHARIL R,et al.Enigmatic insight into collagen[J].Journal of Oral and Maxillofacial Pathology,2016,20(2):276-283.
[6] 李国英,张忠楷,雷苏,等.胶原、明胶和水解胶原蛋白的性能差异[J].四川大学学报,2005,37(4):54-58.
[7] PROCKOP D J,SIERON A L,LI S W.Procollagen N-proteinase and procollagen C-proteinase: Two unusual metalloproteinases that are essential for collagen processing probably have two important roles in development and cell signaling [J].Matrix Biology,1998,16(1):399-408.
[8] PINKAS D M,DING S,RAINES R T,et al.Tunable, post-translational hydroxylation of collagen domains in Escherichia coli[J]. ACS Chemical Biology,2011,6(4):320-324.
[9] 杨立霞,修建新,朱欣杰,等.重组生产胶原蛋白的研究进展.河北化工,2007,30(7):43-46.
[10] 周爱梅,张静,邓爱鹏,等.重组人源胶原蛋白的分离纯化及其结构表征[J].食品与发酵工业,2015,41(3):46-52.
[11] TOMITA M,MUNETSUNA H,SATO T,et al.Transgenic silkworms produce recombinant human type Ⅲ procollagen in cocoons [J].Natual Biotechnol,2003,21(1):52-56.
[12] WEGNER G H.Emerging applications of the methylotrophic yeasts [J].FEMS Microbiology Reviews,1990,7(3-4):279-283.
[13] KEIZERGUNNINK I,VUORELA A,MYLLYHARJU J,et al.Accumulation of properly folded human type Ⅲ procollagen molecules in specific intracellular membranous compartments in the yeast Pichia pastoris [J].Matrix Biology,2000,19(1):29-36.
[14] 国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2005.
[15] 王晓军,惠俊峰,米钰,等.重组类人胶原蛋白的分离纯化.中国生物制品学杂志,2003,16(4):212-214.