全氟辛烷磺酸(perfluorooctane sulfonate, PFOS)作为典型全氟化合物(per-and polyfluoroalkyl substances,PFASs),因对热稳定和化学稳定性等被用于民用和工业方面[1]。PFOS难被降解,故可随食物链在体内积累[2],造成肝脏损伤[3-4],神经毒性[5],生殖、生长发育毒性[6-7],还与血脂、血压及血糖[8-9],高尿酸血症等疾病相关[10],已成为新型的环境污染物和内分泌干扰物。
研究表明胆汁酸螯合剂消胆胺、槲皮素和葡萄籽提取物可缓解PFASs造成的肝脏损伤。PFASs可通过粪便、尿液排出,但也会在肝肠循环之后被重吸收,胆汁酸螯合剂消胆胺可阻碍胆汁酸的重吸收,缓解其毒害[11],但此药有副作用。抗氧化物质槲皮素和葡萄籽提取物均可缓解机体氧化应激反应,减弱PFASs暴露引起的毒性损伤[12-13]。但这类物质发挥作用的有效含量太高,且过量摄入微量元素及植物化合物对机体不利。而以乳酸菌为代表的益生菌在人体中具重要生理功能,研究表明乳酸菌具有优良的抗氧化能力,可缓解镉、铜等暴露导致的肝功能和肠道损伤[14-15]。但目前对PFOS造成的肠道损伤及乳酸菌缓解PFOS毒性的研究很少。因此,本研究探究了乳酸菌缓解PFOS暴露导致的肠道及肝脏损伤的能力。
分离自发酵食品的Lactobacillus bulgaricus D2A49和Lactobacillus bulgaricus DQHXNS3L9及分离自健康人肠道的Pediococcus pentosaceus FSCDJY63L2和Pediococcus pentosaceus JSNJPK1-1是4株不同来源的乳酸菌。本研究通过分析这4株乳酸菌缓解PFOS造成的肠道及肝脏损伤的能力,为乳酸菌防治PFOS毒性研究提供依据,同时为寻找安全有效缓解PFOS毒性的膳食方案奠定基础。
1 材料与方法
1.1 实验菌株
L. bulgaricus D2A49和L. bulgaricus DQHXNS3L9,P. pentosaceus FSCDJY63L2和P. pentosaceus JSNJPK1-1,均来源于江南大学生物技术中心菌种保藏库,具体信息如表1所示。
表1 实验菌株的具体信息
Table 1 The information about the experimental strain

注:-表示无
菌株编号样品性别年龄地区保加利亚乳杆菌L. bulgaricus D2A49牧户发酵的样品---保加利亚乳杆菌L. bulgaricus DQHXNS3L9小商户购买的酸奶--青海戊糖片球菌P. pentosaceus FSCDJY63L2人体粪便女8岁四川戊糖片球菌P. pentosaceus JSNJPK1-1人体粪便女出生2 d江苏
1.2 实验材料
PFOS(98%),百灵威科技有限公司;总蛋白试剂盒,碧云天生物技术有限公司;紧密连接蛋白ZO-1、Occludin和Claudin-1 ELISA试剂盒,上海酶联生物科技有限公司;肿瘤坏死因子α (TNF-α)、白介素1β(IL-1β)和白介素10(IL-10)检测试剂盒,R&D公司。
1.3 仪器与设备
PB300-N电子天平,梅特勒-托利多国际贸易(上海)有限公司;Free Zone真空冷冻干燥机,美国LABCONCO公司;Milli-Q水净化系统,密理博(中国)有限公司;Trace 1300气质联用仪、Multiskan GO全波长酶标仪,美国赛默飞世尔科技公司; BS-480全自动生化分析仪,深圳迈瑞生物医疗电子股份有限公司。
1.4 动物实验设计
实验选用36 只 6 周龄体重 20 g 左右的SPF级健康 C57BL/6J 雄鼠(上海斯莱克实验动物中心),饲养于江南大学动物实验中心。动物实验方案经江南大学实验伦理委员会批准(伦理审核编号:JN.No2019 0415c1200608[67]),根据江南大学动物管理与使用委员会的规定(SYXK 2012-0002)和欧盟指导手册(编号:2010/63/EU)开展实验,为减少小鼠的痛苦,用戊巴比妥钠将小鼠麻醉后进行所有手术。小鼠随机分成6组(4个菌株干预组、1个空白对照组和1个PFOS模型组),温度(22±2) ℃,湿度40%~60%,光照12 h昼夜循环,自由采食饲料和水。小鼠适应1周后进行实验。将活化、扩培的乳酸菌重悬于质量浓度30 g/L的蔗糖溶液中使菌的终浓度为109CFU/mL,每只小鼠每天灌胃0.2 mL,PFOS模型组和空白对照组灌胃等量的30 g/L蔗糖溶液;PFOS溶解在超纯水中,根据小鼠体重调整PFOS的每日灌胃量使小鼠每日PFOS暴露剂量达到3 μg/(g BW·d),灌胃体积为0.2 mL,用等量的超纯水灌胃空白对照组。动物实验流程如图1所示。
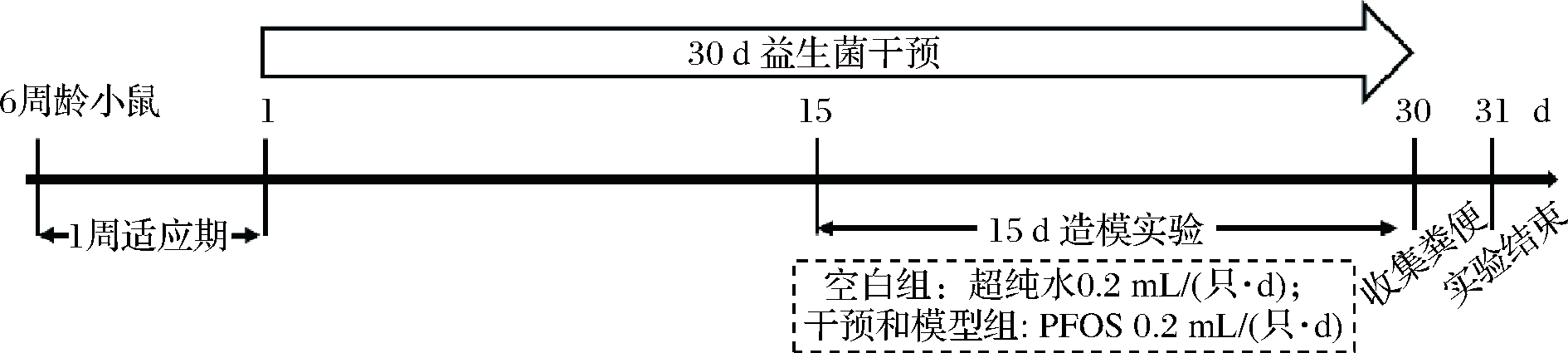
图1 动物实验流程图
Fig.1 The process of animal experiment
注:乳酸菌灌胃浓度为109 CFU/mL,每天灌胃0.2 mL;空白对照组灌胃30 g/L蔗糖溶液;PFOS灌胃浓度根据小鼠体重确定,终浓度为3 μg/(g BW·d)
1.5 检测指标及方法
1.5.1 血清及组织收集
实验结束后,取新鲜粪便于-80 ℃冰箱保存。眼眶取血,室温静置2 h后以3 000 r/min离心15 min收集血清并保存于-80 ℃冰箱。取肝脏称重,肝脏和结肠均分为两部分,一部分于质量浓度为40 g/L的多聚甲醛溶液中固定,另一部分于液氮中迅速冷冻后转移至-80 ℃冰箱。肝脏指数为小鼠肝脏质量(g)占小鼠体重(100 g)的比例,计算如公式(1)所示:
(1)
式中:R,肝脏指数;m1,肝脏质量,g; m2,小鼠体重,100 g。
1.5.2 肝脏、结肠病理学检测
将固定在多聚甲醛中的肝脏和结肠,用75%、85%、 95%和100%(体积分数)的酒精依次脱水后,用二甲苯透明,用石蜡包埋,切成5 μm切片,并用苏木精-伊红(H&E)染色后镜检。
1.5.3 血清肝酶与肝脏炎症水平测定
血清肝酶包括谷丙转氨酶(alanine aminotransferase,ALT), 谷草转氨酶(aspartate aminotransferase,AST), 碱性磷酸酶(alkaline phosphatase,ALP)和γ-谷氨酰转肽酶(γ-glutamyl transferase,γ-GT)用全自动生化分析仪测定。肝脏称重后加入9倍质量的生理盐水,用组织破碎仪充分破碎后以5 000 r/min 的转速离心10 min,得到质量浓度为100 g/L的肝脏上清液按照试剂盒说明书测定TNF-α和IL-1β含量。
1.5.4 结肠炎症因子及紧密连接蛋白含量测定
将结肠称重剪碎后,加入9倍质量的生理盐水,用组织破碎仪充分破碎,以5 000 r/min的转速离心10 min,得到质量浓度为100 g/L的结肠上清液。取结肠上清液按试剂盒说明书测定TNF-α、IL-10、紧密连接蛋白ZO-1、Occludin和Claudin-1的含量。
1.5.5 小鼠粪便中短链脂肪酸含量测定
取50 mg冷冻干燥的小鼠粪便加入500 μL饱和 NaCl 溶液破碎,加入40 μL 10%(体积分数)的H2SO4振荡酸化,加入1 mL乙醚,振荡均匀后以12 000 r/min,4 ℃的条件离心 15 min萃取短链脂肪酸。取上层液体加入0.25 g无水硫酸钠静置后以12 000 r/min、4 ℃的条件离心15 min,取上清液于进样瓶中,采用外标法全扫描模式于气质联用仪测定短链脂肪酸(乙酸、丙酸、丁酸、异丁酸和异戊酸)的含量(μmol/g)。
1.5.6 数据分析
数据以“均数±标准差”表示,用GraphPad Prism 5 (GraphPad Software Inc.,San Diego, CA, USA)进行处理,采用单因素方差分析(one-way ANOVA)和Dunnett’s post hoc事后检验分析各组与PFOS模型组之间的差异,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 四株乳酸菌对小鼠肝脏指数和血清中肝酶含量的影响
如图2所示,PFOS模型组肝脏指数与空白对照组相比显著增加(P<0.05)。而4株乳酸菌均可显著缓解由PFOS造成的肝脏肿大,其中P. pentosaceus JSNJPK1-1的效果最好,L. bulgaricus D2A49和P. pentosaceus FSCDJY63L2次之,L. bulgaricus DQHXNS3L9效果略差。

图2 乳酸菌对PFOS暴露小鼠肝脏指数的影响
Fig.2 Effect of LAB strains on the liver index in PFOS exposured mice
注:*表示P<0.05(与PFOS模型组比较),**表示P<0.01,***表示P<0.001(下同)
如表2所示,PFOS暴露后小鼠血清中ALT、AST、ALP、γ-GT的含量显著增加(P<0.05),L. bulgaricus D2A49干预使血清中ALT、AST、ALP的含量显著降低(P<0.05),L. bulgaricus DQHXNS3L9对AST、ALP的升高表现出缓解作用(P<0.05),而P. pentosaceus FSCDJY63L2只显著降低了血清ALP水平(P<0.05),P. pentosaceus JSNJPK1-1对血清中AST和γ-GT水平表现出显著降低作用(P<0.05)。因此,4株乳酸菌对血清肝酶含量的影响具有差异性,其中L. bulgaricus D2A49可恢复由PFOS暴露导致的血清ALT、AST和ALP升高,在缓解PFOS损伤方面效果较佳。
表2 乳酸菌对PFOS暴露小鼠血清肝酶的影响 单位:U/L
Table 2 Effect of LAB strains on the liver enzyme in PFOS exposured mice serum
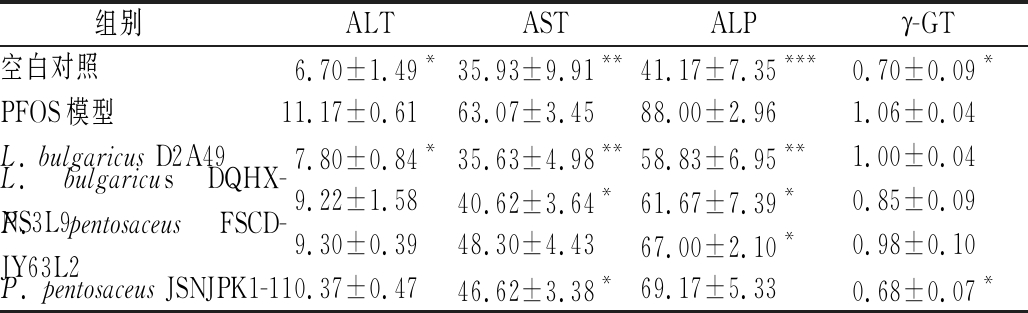
注:*表示P<0.05(与PFOS模型组比较),**表示P<0.01,***表示P<0.001(下同)
组别 ALTASTALPγ-GT空白对照6.70±1.49*35.93±9.91**41.17±7.35***0.70±0.09*PFOS模型11.17±0.6163.07±3.4588.00±2.961.06±0.04L. bulgaricus D2A497.80±0.84*35.63±4.98**58.83±6.95**1.00±0.04L. bulgaricus DQHX-NS3L99.22±1.5840.62±3.64*61.67±7.39*0.85±0.09P. pentosaceus FSCD-JY63L29.30±0.3948.30±4.4367.00±2.10*0.98±0.10P. pentosaceus JSNJPK1-110.37±0.4746.62±3.38*69.17±5.330.68±0.07*
2.2 四株乳酸菌对小鼠肝脏病理及炎症水平的影响
如图3所示,PFOS模型组小鼠出现轻微地肝细胞水肿变性,细胞排列紊乱,细胞核逐渐溶解消失,而菌株干预组肝细胞排列整齐,细胞水肿现象减轻,与血清中肝酶水平结果一致的是,L. bulgaricus D2A49干预后小鼠肝脏细胞排列最整齐,最接近空白对照组。

a-L. bulgaricus D2A49组;b-L. bulgaricus DQHXNS3L9组;c-PFOS模型组;d-P.pentosaceus FSCDJY63L2组;e-P. pentosaceus JSNSPK1-1组;f-空白对照组
图3 乳酸菌对PFOS暴露小鼠肝脏H&E染色结果的影响(×200)
Fig.3 Effect of LAB strains on the liver H&E staining of the PFOS exposure mice
TNF-α和IL-1β在调节免疫方面发挥重要作用[16-17]。如图4所示, PFOS暴露后肝脏IL-1β水平降低,但与空白对照组无显著差异,而4株乳酸菌干预组小鼠肝脏中IL-1β含量显著升高(P<0.05),这可能与小鼠机体免疫的反馈调节有关。PFOS暴露后肝脏TNF-α的水平与空白对照组没有显著变化,但出现降低趋势,此结果与邢家潥[18]的研究一致,且MOLLENHAUER等[19]的研究发现在PFOS含量较低时[0.1 mg/(kg·d)]小鼠血清中TNF-α含量降低,这表明PFOS暴露导致了免疫系统的紊乱。L.bulgaricus D2A49和L. bulgaricus DQHXNS3L9干预后,小鼠肝脏的TNF-α含量显著降低(P<0.05),而P. pentosaceus FSCDJY63L2和P. pentosaceus JSNJPK1-1干预组TNF-α水平无显著变化。2株保加利亚乳杆菌干预后小鼠的TNF-α降低,可能在一定程度上缓解了肝脏炎症(图5)。

图4 乳酸菌对PFOS暴露小鼠肝脏IL-1β含量的影响
Fig.4 Effect of LAB strains on the IL-1β concentration in PFOS exposured mice liver
注:ns表示不具有显著性差异(下同)
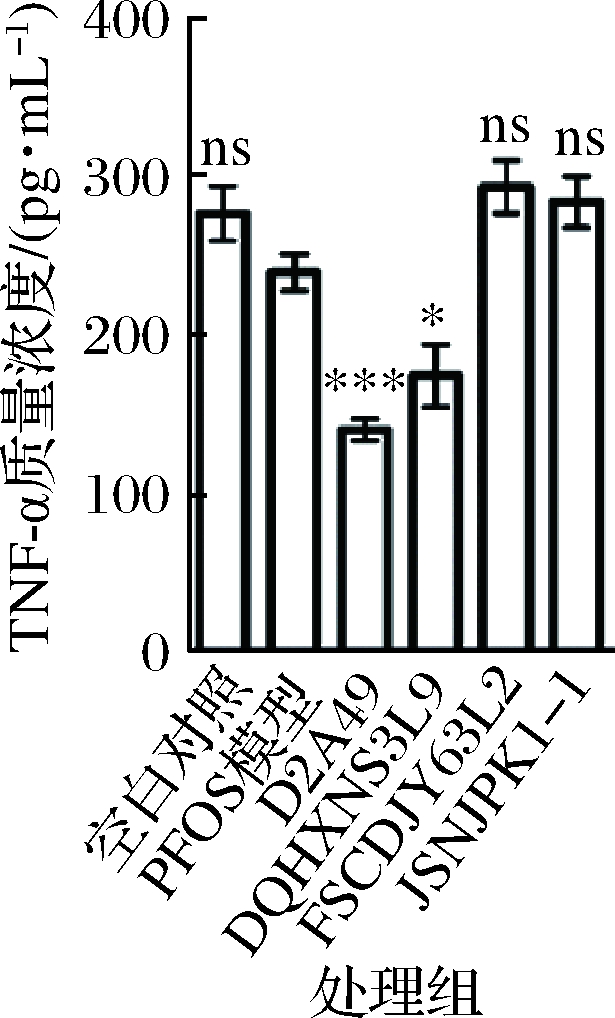
图5 乳酸菌对PFOS暴露小鼠肝脏TNF-α含量的影响
Fig.5 Effect of LAB strains on the TNF-α concentration in PFOS exposured mice liver
2.3 四株乳酸菌对小鼠肠道病理及炎症水平的影响
结肠病理结果如图6所示,PFOS暴露后小鼠结肠中炎症细胞增多,出现大块炎性细胞浸润,且杯状细胞变大,排列不整齐,表现出病理性损伤。而4株乳酸菌干预后结肠炎症细胞浸润明显减少,且杯状细胞的排列相对整齐。翟齐啸[14]的研究表明,镉暴露导致肠道中TNF-α的含量增多,造成肠道炎症和肠道通透性增大。本研究中,PFOS暴露肠道TNF-α表现出与镉暴露相似的结果,PFOS暴露后肠道中TNF-α的含量显著升高(P<0.05),如图7所示,L. bulgaricus D2A49和L. bulgaricus DQHXNS3L9干预后小鼠肠道中TNF-α水平显著降低(P<0.05),而P. pentosaceus FSCDJY63L2、P. pentosaceus JSNJPK1-1干预后TNF-α的含量未有显著变化。IL-10为抑炎因子,与多种疾病相关。有研究表明PFOS暴露后小鼠脾脏中IL-10含量有下降趋势[20],而在本研究中PFOS暴露后小鼠结肠中IL-10含量显著下降(P<0.05),表明结肠存在炎症反应。4株乳酸菌均可上调肠道中IL-10的含量,结合小鼠肝脏TNF-α和肠道中TNF-α、IL-10的变化来看,L. bulgaricus D2A49和L. bulgaricus DQHXNS3L9干预后小鼠的炎症减弱,可缓解PFOS暴露引起的损伤(图8)。

a-L. bulgaricus D2A49组;b-L. bulgaricus DQHXNS3L9组;c-PFOS模型组;d-P. pentosaceus FSCDJY63L2组;e-P. pentosaceus JSNSPK1-1组;f-空白对照组
图6 乳酸菌对PFOS暴露小鼠结肠H&E染色结果的影响(×200)
Fig.6 Effect of LAB strains on the colon H&E staining of the PFOS exposure mice
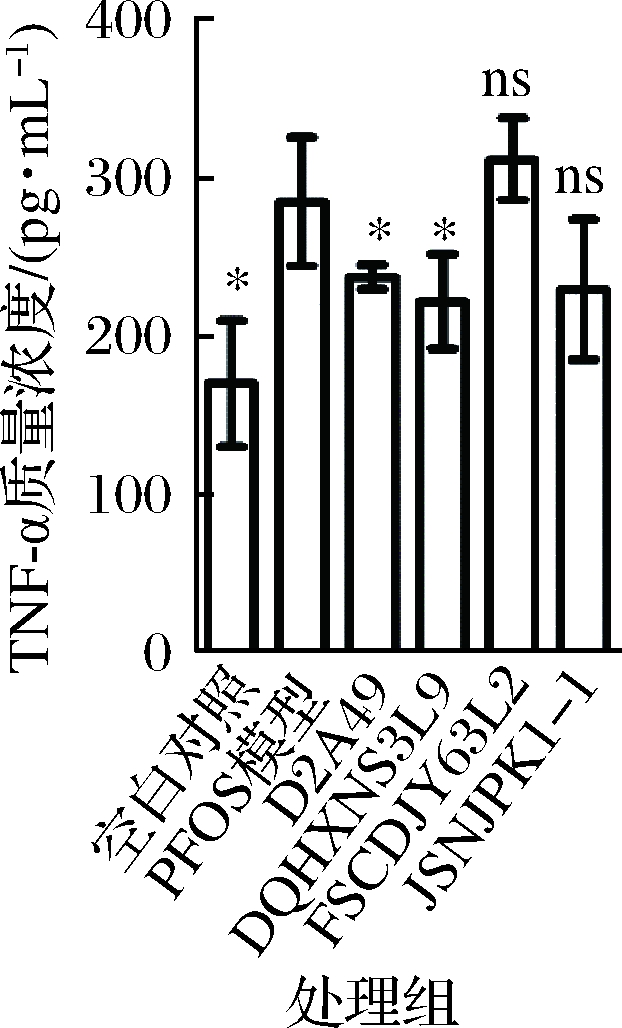
图7 乳酸菌对PFOS暴露小鼠结肠TNF-α含量的影响
Fig.7 Effect of LAB strains on the TNF-α concentration in PFOS exposured mice colon
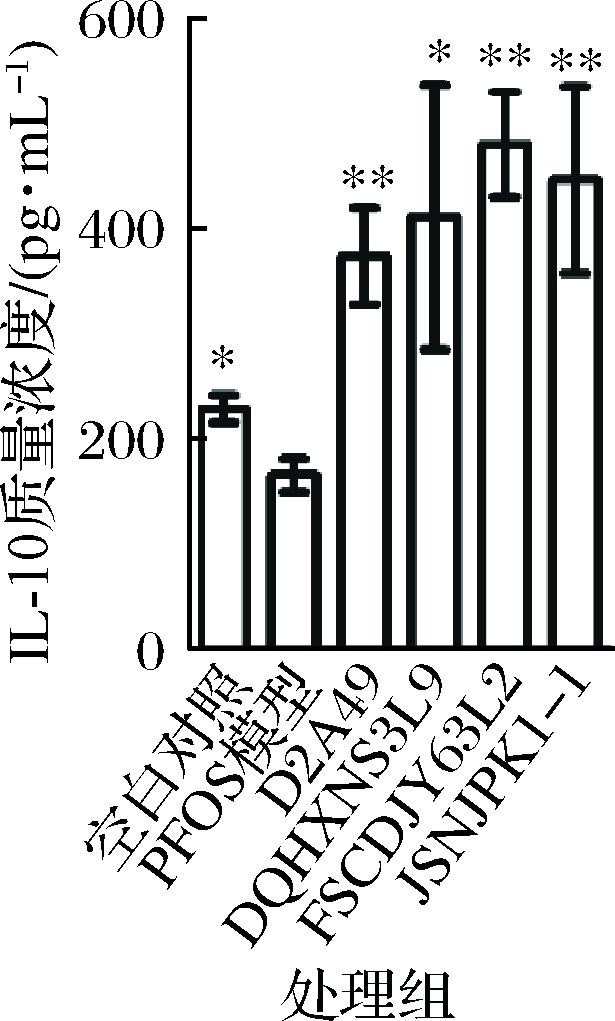
图8 乳酸菌对PFOS暴露小鼠结肠IL-10含量的影响
Fig.8 Effect of LAB strains on the IL-10 concentration in PFOS exposured mice colon
2.4 四株乳酸菌对小鼠结肠紧密连接蛋白水平的影响
MIR等[21]和 马姝丽等[22]研究发现,肠道中 Occludin和 ZO-1含量下降后肠黏膜通透性发生改变,肝损伤加重。因此,PFOS导致的肝损伤,除PFOS直接作用肝脏导致肝毒害外,可能还存在PFOS暴露后肠道屏障破坏所导致的间接肝损伤。如图9所示,PFOS暴露后肠道中紧密连接蛋白ZO-1、Occludin和Claudin-1的含量出现降低趋势。4株乳酸菌均能显著提高ZO-1的含量(P<0.05);而4株菌对Occludin含量虽有提高趋势但无显著差异;只有L. bulgaricus D2A49和P. pentosaceus FSCDJY63L2能显著提高Claudin-1的含量(P<0.05)。由此可知,L. bulgaricus D2A49和P. pentosaceus FSCDJY63L2可通过提高ZO-1和Claudin-1的水平保护肠道紧密连接,维持肠道屏障完整性,缓解PFOS毒性损伤。
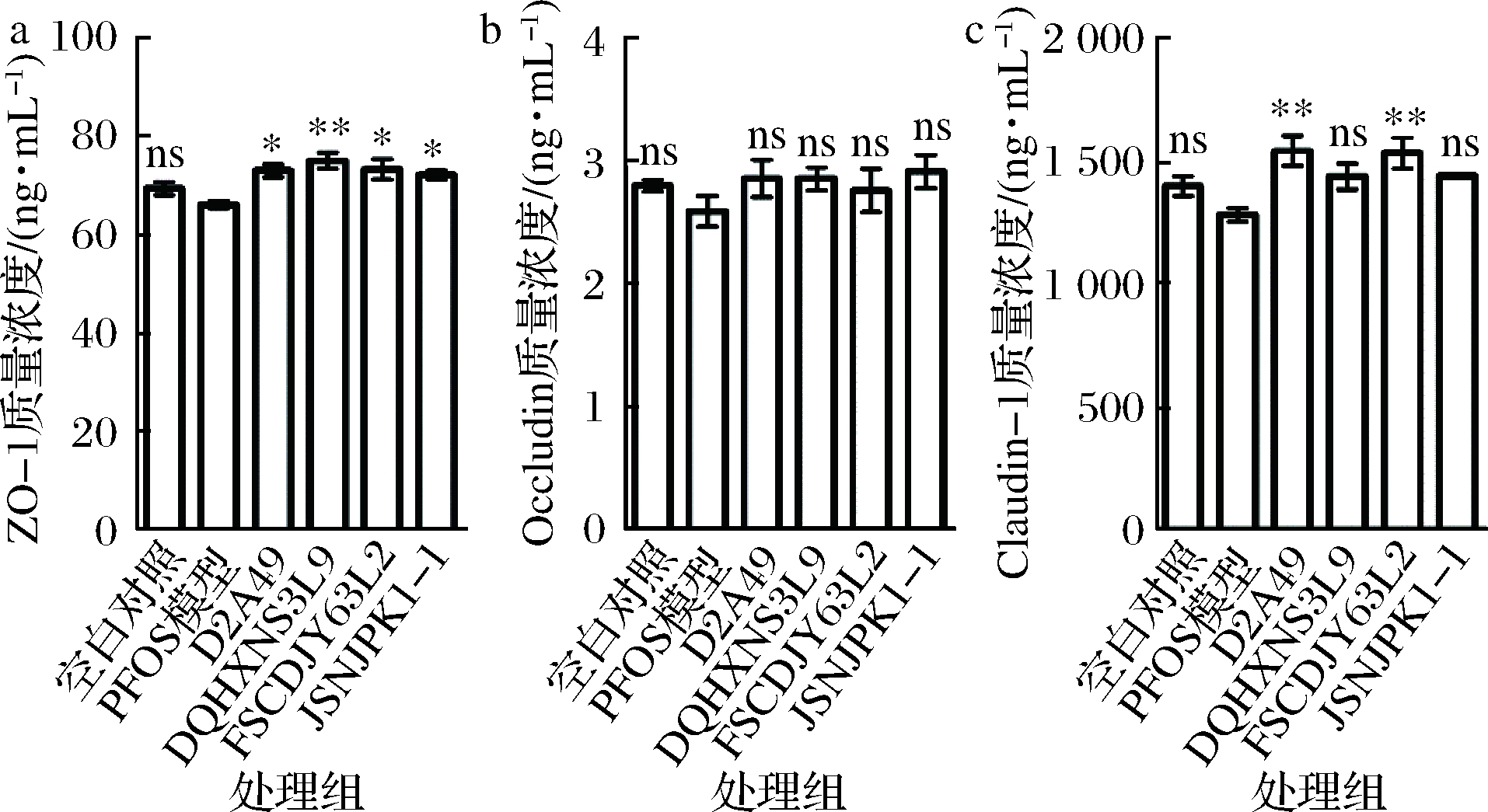
a-ZO-1含量;b-Occludin含量;c-Claudin-1含量
图9 乳酸菌对PFOS暴露小鼠肠道紧密连接蛋白含量的影响
Fig.9 Effect of LAB strains on the tight junction proteins in PFOS exposured mice colon
2.5 四株乳酸菌对小鼠粪便短链脂肪酸的影响
短链脂肪酸具有重要的生理功能[23-26]。如表3所示,PFOS模型组和空白对照组相比,粪便中乙酸、丙酸和丁酸含量存在显著差异(P<0.05),4组菌株干预组均显著提高了粪便中乙酸、丙酸和丁酸的含量(P<0.05)。其中,L. bulgaricus D2A49组丙酸和丁酸含量极显著提高(P<0.01),L. bulgaricus DQHXNS3L9组乙酸含量极显著升高(P<0.001),P. pentosaceus FSCDJY63L2组乙酸含量极显著升高(P<0.01),P. pentosaceus JSNJPK1-1组中乙酸和丙酸含量均极显著升高(P<0.01);只有L. bulgaricus D2A49组异丁酸含量显著提高(P<0.05);L. bulgaricus D2A49组和L. bulgaricus DQHXNS3L9组异戊酸含量显著升高(P<0.05),P. pentosaceus FSCDJY63L2组和P. pentosaceus JSNJPK1-1组异丁酸和异戊酸含量有上升趋势但与PFOS模型组无显著差异。综上,PFOS暴露可降低粪便中短链脂肪酸的含量,而乳酸菌干预可部分恢复短链脂肪酸含量,其中L. bulgaricus DQHXNS3L9和L. bulgaricus D2A49组能上调乙酸、丙酸、丁酸和异戊酸的含量,减轻PFOS暴露对肠道造成的损伤。
表3 乳酸菌对PFOS暴露小鼠粪便短链脂肪酸含量的影响 单位: μmol/g
Table 3 Eeffect of LAB strains on the SCFAs contents in PFOS exposured mice feces

组别乙酸丙酸丁酸异丁酸异戊酸空白对照174.12±29.13*35.33±0.79*16.88±2.19*4.495±0.2895.92±0.60PFOS模型124.04±10.4318.50±2.606.54±0.823.616±0.3373.66±0.30L. bulgaricus D2A49222.33±26.27*37.29±3.35**26.24±4.17**5.480±0.727*7.55±1.32**L. bulgaricus DQHX-NS3L9252.42±28.53***33.73±3.93*18.55±3.53*4.180±0.3876.24±0.43*P. pentosaceus FSCD-JY63L2246.31±35.94**35.18±6.57*21.73±6.05*4.540±0.585.86±1.01P. pentosaceus JSNJPK1-1242.30±12.94**38.05±2.76**16.77±1.55*3.850±0.084.69±0.38
通过4株乳酸菌与空白对照组在各指标间的主成分分析(principal components analysis,PCA),我们进一步综合评价了4株乳酸菌缓解PFOS毒害的能力大小。如图10所示,虽然从肝脏炎症因子的水平来看,2株戊糖片球菌组对炎症反应的缓解效果优于2株保加利亚乳杆菌,但综合肝脏指数及血清肝酶含量、结肠紧密连接蛋白含量、短链脂肪酸及肠道炎症因子相关指标来看,保加利亚乳杆菌L. bulgaricus DQHXNS3L9和L. bulgaricus D2A49对于缓解PFOS毒性损伤的效果较佳。

a-肝重、血清肝酶;b-肝脏炎症因子;c-肠道紧密连接蛋白;d-肠道短链脂肪酸;e-肠道炎症因子
图10 各组间在各指标间的PCA分析
Fig.10 PCA analysis for each index of each group
2.6 相关性分析
从各个指标之间的相关性分析结果可以发现,丙酸与血清肝酶AST呈显著负相关,乳酸菌干预后小鼠肠道中丙酸含量有所升高,影响血清肝酶AST含量与肝脏毒性的缓解有关。另外和大多研究相似的是,我们发现丙酸与结肠紧密连接蛋白Claudin-1、Occludin呈正相关,短链脂肪酸乙酸、丙酸及丁酸之间呈正相关,与肠道IL-10正相关,则乳酸菌干预后小鼠肠道紧密连接蛋白的变化会在一定程度上和丙酸含量的变化有关,另外血清中肝酶AST含量与ALT和ALP含量呈正相关,则乳酸菌干预后小鼠肠道内丙酸增加会降低血清肝酶含量的增加,一定程度上缓解肝脏损伤。因此,从相关性分析的结果推测,乳酸菌可能通过调节肠道中短链脂肪酸的含量,进一步影响肠道紧密连接蛋白含量和IL-10含量,从而缓解周身性炎症,缓解肝脏等脏器损伤并使血清中肝酶AST、ALT和ALP含量下降(表4)。
表4 小鼠各指标间的相关性
Table 4 Correlation among the indexes of mice
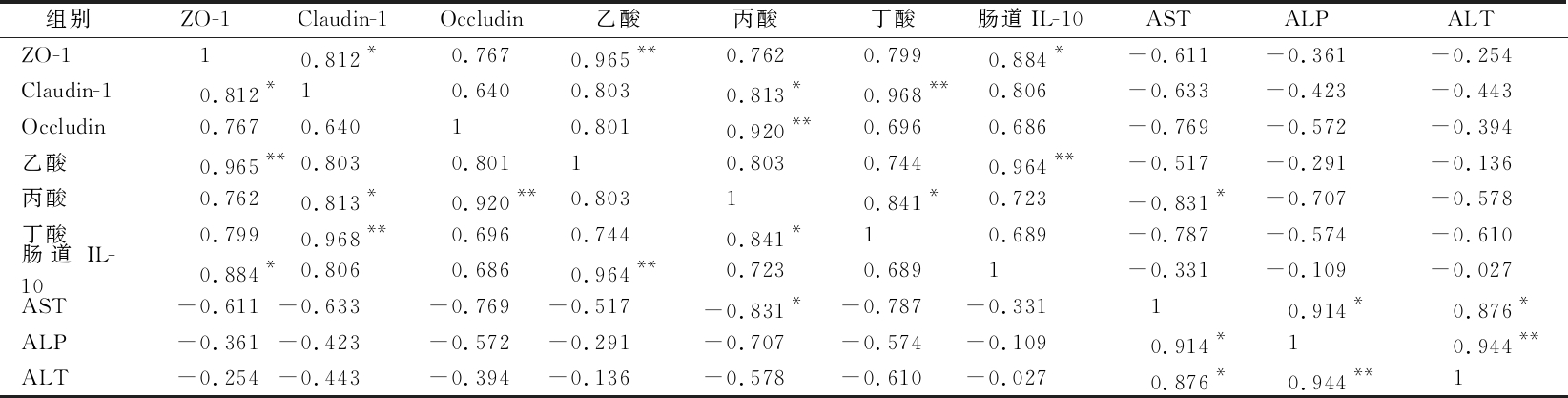
组别ZO-1Claudin-1Occludin乙酸丙酸丁酸肠道IL-10ASTALPALTZO-110.812*0.7670.965**0.7620.7990.884*-0.611-0.361-0.254Claudin-10.812*10.6400.8030.813*0.968**0.806-0.633-0.423-0.443Occludin0.7670.64010.8010.920**0.6960.686-0.769-0.572-0.394乙酸0.965**0.8030.80110.8030.7440.964**-0.517-0.291-0.136丙酸0.7620.813*0.920**0.80310.841*0.723-0.831*-0.707-0.578丁酸0.7990.968**0.6960.7440.841*10.689-0.787-0.574-0.610肠道IL-100.884*0.8060.6860.964**0.7230.6891-0.331-0.109-0.027AST-0.611-0.633-0.769-0.517-0.831*-0.787-0.33110.914*0.876*ALP-0.361-0.423-0.572-0.291-0.707-0.574-0.1090.914*10.944**ALT-0.254-0.443-0.394-0.136-0.578-0.610-0.0270.876*0.944**1
3 结论
4株乳酸菌在一定程度上均具有缓解PFOS暴露导致的毒性损伤的能力,其中,根据各组在各指标间的PCA分析,我们发现L. bulgricus DQHXNS3L9和L. bulgricus D2A49缓解PFOS毒性损伤的效果最明显,可以改善PFOS造成的肝脏指数升高、血清中肝酶含量升高、肠道炎症水平升高及紧密连接蛋白含量下降,另外,相关性分析初步发现乳酸菌缓解PFOS毒性损伤可能是通过调节肠道短链脂肪酸的含量实现的,此结论还有待进一步验证。而乳酸菌在缓解PFOS损伤的效果存在菌株差异,尤其是2株保加利亚乳杆菌和2株戊糖片球菌在肝脏和肠道TNF-α水平上表现出不同的结果,这种差异还有待于结合乳酸菌各自的遗传背景进行深入研究。乳酸菌对PFOS毒性损伤的缓解也为开发安全有效的缓解PFOS毒性的膳食方案提供了思路。
[1] 宋彦敏,周连宁,郝文龙,等.全氟化合物的污染现状及国内外研究进展[J]. 环境工程,2017,35(10):82-86.
[2] TOMY G T, BUDAKOWSKI W, HALLDORSON T, et al. Fluorinated organic compounds in an eastern Arctic marine food web[J]. Environmental science & technology, 2004, 38(24):6 475-6 481.
[3] XU C, JIANG Z Y, LIU Q, et al. Estrogen receptor beta mediates hepatotoxicity induced by perfluorooctane sulfonate in mouse[J]. Environmental Science and Pollution Research, 2017, 24(15): 13 414-13 423.
[4] MARTIN M T, BRENNAN R J, HU W Y, et al. Toxicogenomic study of triazole fungicides and perfluoroalkyl acids in rat livers predicts toxicity and categorizes chemicals based on mechanisms of toxicity[J]. Toxicological Sciences, 2007, 97(2):595-613.
[5] CHEN X, NIE X, MAO J, et al. Perfluorooctanesulfonate induces neuroinflammation through the secretion of TNF-α mediated by the JAK2/STAT3 pathway[J]. NeuroToxicology, 2018, 66(3): 32-42.
[6] LONG M,KJELDSEN L,GHISARI M,et al. Endocrine disrupting compounds and heavy metals in the amniotic fluid and neurodevelopment disorders: A case-control study[J]. Toxicology Letters, 2014, 229(S1): 121.
[7] WANG H X,DU H Y,YANG J Q,et al. PFOS, PFOA, estrogen homeostasis, and birth size in Chinese infants[J]. Chemosphere, 2019, 221(4): 349-355.
[8] HAUGHOM B, ØYSTEIN S.The mechanism underlying the hypolipemic effect of perfluorooctanoic acid (PFOA), perfluorooctane sulphonic acid (PFOSA) and clofibric acid[J]. Biochimica et Biophysica Acta(BBA)-Lipids and Lipid Metabolism, 1992, 1 128(1):65-72.
[9] CHRISTENSEN K Y, RAYMOND M, MEIMAN J. Perfluoroalkyl substances and metabolic syndrome[J]. International Journal of Hygiene and Environmental Health, 2019, 222(1):147-153.
[10] DEE G S,JIE X,ANOO P S. Positive association between perfluoroalkyl chemicals and hyperuricemia in children[J]. Am J Epidemiol, 2013, 177(11): 1 255-1 262.
[11] JOHNSON J D, GIBSON S J, OBER R E. Cholestyramine-enhanced fecal elimination of carbon-14 in rats after administration of ammonium[14C]Perfluorooctanoate or Potassium [14C]Perfluorooctanesulfonate [J]. Toxicological Sciences, 1984, 4(6): 972-976.
[12] ZOU W, LIU W, YANG B, et al. Quercetin protects against perfluorooctanoic acid-induced liver injury by attenuating oxidative stress and inflammatory response in mice [J]. International Immunopharmacology, 2015, 28(1): 129-135.
[13] LIU W, XU C, SUN X, et al. Grape seed proanthocyanidin extract protects against perfluorooctanoic acid-induced hepatotoxicity by attenuating inflammatory response, oxidative stress and apoptosis in mice [J]. Toxicology Research, 2016, 5(1): 224-234.
[14] 翟齐啸. 乳酸菌减除镉危害的作用及机制研究[D].无锡:江南大学,2015.
[15] 刘云才,张娟,焦聪聪,等. 乳酸菌对铜暴露大鼠肝功能及氧化应激的影响[J].青岛大学医学院学报, 2017, 53(2):198-202.
[16] 韩佳萦,苏伊玲,熊丽,等. 塑化剂DEHP暴露对小鼠巨噬细胞的免疫毒性作用[J].农业环境科学学报, 2018, 37(4):673-679.
[17] 李秋月,许海玉,杨洪军.促炎因TNF-α,IL-1β,IL-6在神经病理性疼痛中的研究进展[J].中国中药杂志, 2017,42(19):3 709-3 712.
[18] 邢家溧.植物乳杆菌缓解典型全氟及多氟烷基化合物毒性及机制研究[D]. 无锡:江南大学,2017.
[19] MOLLENHAUER M A M, BRADSHAW S G, FAIR P A, et al. Effects of perfluorooctane sulfonate (PFOS) exposure on markers of inflammation in female B6C3F1 mice[J]. Journal of environmental science and health. Part A, 2011, 46(2): 97-108.
[20] 郑丽,董光辉,潘艳艳,等.全氟辛烷磺酸对雄性小鼠免疫状态的影响[J]. 环境与健康杂志, 2011,28(3):189-191.
[21] MIR H, MEENA A S, CHAUDHRY K K, et al. Occludin deficiency promotes ethanol-induced disruption of colonic epithelial junctions, gut barrier dysfunction and liver damage in mice[J]. BBA - General Subjects, 2016, 1 860(4): 765-774.
[22] 马姝丽,李小芹,王菊平.酪酸梭菌对胆汁淤积大鼠的肠黏膜通透性和紧密连接蛋白的影响[J]. 实用医学杂志, 2018, 34(6):69-72.
[23] 徐万里,陆高,梁世杰,等.短链脂肪酸介导的菌群-宿主互动与肠易激综合征的研究进展[J]. 世界华人消化杂志,2015,23(36):5 815-5 822.
[24] REILLY R J, ROMBEAU J L. Metabolism and potential clinical application of short chain fatty acid[J]. Clinical Nutrition, 1993, 12(Suppl 1):97-105.
[25] BULTMAN S J. Molecular pathways: Gene-environment interactions regulating dietary fiber induction of proliferation and apoptosis via butyrate for cancer prevention[J]. Clinical Cancer Research, 2014, 20 (4):799-803.
[26] FUKUDA S, TOH H, HASE K, et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate[J]. Nature, 2012, 469 (7 331):543-547.