松露(Truffle)属子囊菌门西洋块菌科西洋块菌属,是非常珍贵和稀有的食用菌[1-2]。松露营养丰富,富含蛋白质、多种氨基酸、维生素和矿物质等[3-4]。多糖是松露中最重要的成分之一,松露多糖有较高的抗氧化活性,可作为天然的抗氧化剂用于功能食品,松露多糖还有免疫调节活性、抗肿瘤活性和抗癌作用[5-6]。目前,国内关于松露的研究大都集中在对真松露和假松露从外形、气味、孢子形态进行鉴别以及对松露的挥发性物质的探索方面,对松露多糖的研究不多。本实验以四川会东松露为原料,优化松露多糖的提取工艺,过DEAE-52纤维素柱对多糖进行分级分离,利用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)法对其抗氧化性进行测定,并通过红外光谱对松露多糖的结构进行初步鉴定,旨在为松露多糖资源的综合利用提供一定参考。
1 材料与方法
1.1 材料与试剂
松露:四川会东县嘎吉乡,收集时间为2019年12月10日,经鉴定为中华块菌;各种单糖标准品,DEAE-Sepharose 52,Solarbio;NaCl、H2SO4、DPPH、苯酚,国药集团化学试剂有限公司。
1.2 仪器与设备
101-2AB恒温干燥箱,北京中兴伟业仪器有限公司;多模式微孔板检测仪(酶标仪),美国Bio-Tek;GC-MS-QP2010 SE,日本岛津。
1.3 方法
1.3.1 松露多糖的提取及测定
1.3.1.1 多糖含量的测定
采用苯酚-硫酸法测定粗多糖含量,参考文献[7],葡萄糖标准曲线方程为y=6.828 6x-0.009,R2=0.999。
1.3.1.2 松露提取工艺优化
新鲜松露洗净,切片后,放置于60 ℃烘箱中烘干,打粉过40目筛,备用。称取松露干粉,按比例加入蒸馏水,在加热过程中不断搅拌,收集上清液;醇沉(乙醇体积分数为80%),4 ℃过夜沉淀;离心收集沉淀,冷冻干燥后得松露粗多糖。
单因素试验:选取提取时间(0.5、1.0、1.5、2.0和2.5 h)、提取温度(60、70、80、90、100 ℃)和料液比(1∶10、1∶20、1∶30、1∶40、1∶50, g∶mL),探究松露多糖在不同条件下的提取率。
正交优化试验:以多糖提取量为参考,综合上述单因素试验结果,设计3因素3水平正交试验,见表1。
表1 正交试验因素与水平
Table 1 Factors and levels of orthogonal tests

水平因素A(提取时间)/hB(提取温度)/℃C(料液比)(g∶mL)11.5801∶3022.0901∶4032.51001∶50
1.3.2 脱蛋白方法和蛋白质含量得测定
蛋白质含量采取考马斯亮蓝的方法,具体操作步骤见参考文献[8],标准曲线方程为y=0.166 8x+0.676 8,R2=0.998,x代表蛋白质量浓度(μg/mL);Sevag法脱除蛋白,其中正丁醇-氯仿混合液体积比1∶4,重复5次,测蛋白质含量[9]。
1.3.3 松露多糖的分级分离
准确称取400 mg 松露多糖溶于6 mL去离子水中,过膜后加入纤维素层析柱(2.6 cm×50 cm),用去离子水、0.1、0.2、0.3、0.4、0.5 mol/L NaCl溶液进行梯度洗脱。流速为 1 mL/min,5 min/管,各个浓度收集20管。在490 nm下测吸光度值,绘制曲线。由图2可以看出,松露多糖的洗脱峰有2个,出现在0.2 mol/L 和0.3 mol/L NaCl溶液洗脱液中,分别命名为TPS-A和 TPS-B,适当浓缩后装入3 000 kDa透析袋中透析,封好口后,置于4 ℃超纯水中透析48 h,除去氯化钠,6~8 h更换1次超纯水,冻干[12]。
1.3.4 松露粗多糖抗氧化性的测定
DPPH自由基(DPPH·)清除能力:对纯化后得到的TPS-A松露多糖参照参考文献[11]的方法进行测定,DPPH·清除率按公式(1)计算:
DPPH·清除率![]()
(1)
式中:A0为无TPS-A多糖的混合液的吸光度;A为有TPS-A多糖混合液的吸光度;Ab为无DPPH样品的吸光度。
1.3.5 单糖组成的测定
取2 mg多糖,1 mL的2 mol/L三氟乙酸在120 ℃条件下水解90 min,旋转蒸发仪蒸干。残基加入2 mL双蒸水,100 mg硼氢化钠还原,加入冰醋酸中和,旋蒸,110 ℃烘箱烘干,然后加入1 mL乙酸酐乙酰化100 ℃反应1 h,冷却,然后加入3 mL甲苯,减压浓缩蒸干,重复4~5次,以除去多余的醋酐。将乙酰化后的产物用3 mL氯仿溶解后转移至分液漏斗,加入少量蒸馏水充分震荡后,除去上层水溶液,如此重复5次。氯仿层以适量的无水硫酸钠干燥,定容10 mL,分析采用Shimadzu GCMS-QP 2010气相色谱-质谱联用仪测定乙酰化产物样品[13]。
GC-MS条件:RXI-5 SIL MS色谱柱30 mm×0.25 mm×0.25 mm;程序升温条件为:起始温度120 ℃,以3 ℃/min升温至250 ℃/min;保持5 min;进样口温度为250 ℃,检测器温度为250 ℃/min,载气为氦气,流速为1 mL/min。其中标准品顺序为:鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖。
1.3.6 傅里叶红外光谱分析(Fourier transform infrared spectroscopy,FTIR)
将多糖与KBr研磨均匀后,压片,在4 000~400 cm-1范围内进行扫描[14]。
1.3.7 TPS-A的扫描电镜(scanning electron microscope, SEM)分析
将TPS-A与样品载物台紧密贴合,使其均匀分布于表面,随后喷金,用扫描电镜进行观察,具体操作步骤参考文献[15]。
1.4 数据处理
本实验应用Origin 2018和Excel 2010进行图形绘制和数据分析。
2 结果与分析
2.1 松露多糖提取工艺优化结果
2.1.1 单因素实验结果
由图1-a可知,多糖提取率随提取时间的延长而逐渐增加,至2 h时达到最大,超过2 h,多糖提取率降低,原因是随着加热时间的增加,不溶物及黏性物质等溶出,杂质和黏度增加,且有助于其他水溶性物质如色素、蛋白等溶出,从而影响了松露多糖的提取率[16];由图1-b可知,在90 ℃时多糖提取率最大,多糖提取率为9.28%,超过90 ℃后,提取率降低,可能是温度高,水分蒸发,溶液变黏稠,多糖溶解难度增加;温度低,小分子之间的活动不剧烈,多糖得率下降[17];由图1-c可以看出,多糖提取率在料液比为130(g∶mL)时达到最大,超过1∶30(g∶mL)后,多糖提取率下降。所以,选择料液比1∶30~1∶50(g∶mL)、加热时间1.0~2.0 h、提取温度80~100 ℃进行正交实验。
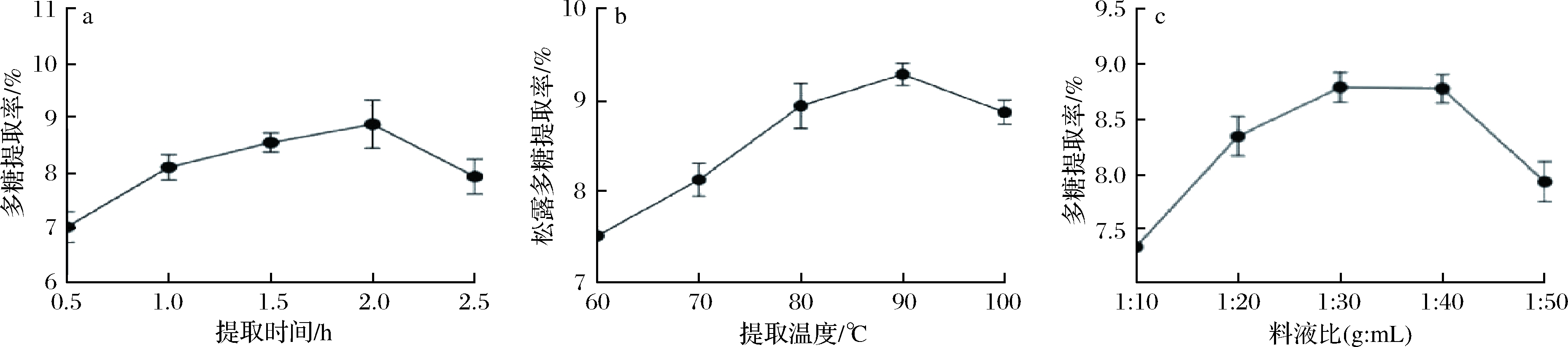
a-提取时间;b-提取温度;c-料液比图1 单因素试验结果
Fig.1 Results of one-factor-at-a-time experiments
2.1.2 正交实验结果
由表2可知,3个因素对松露粗多糖得率的影响大小排序为B>A>C,即提取温度对粗多糖得率的影响>提取时间>料液比。由k值得到最优水平为A3B1C2,最佳提取工艺组合为提取时间为2 h,提取温度为80℃,料液比为1∶40(g∶mL)。
表2 正交试验结果与分析
Table 2 Results and analysis of orthogonal tests
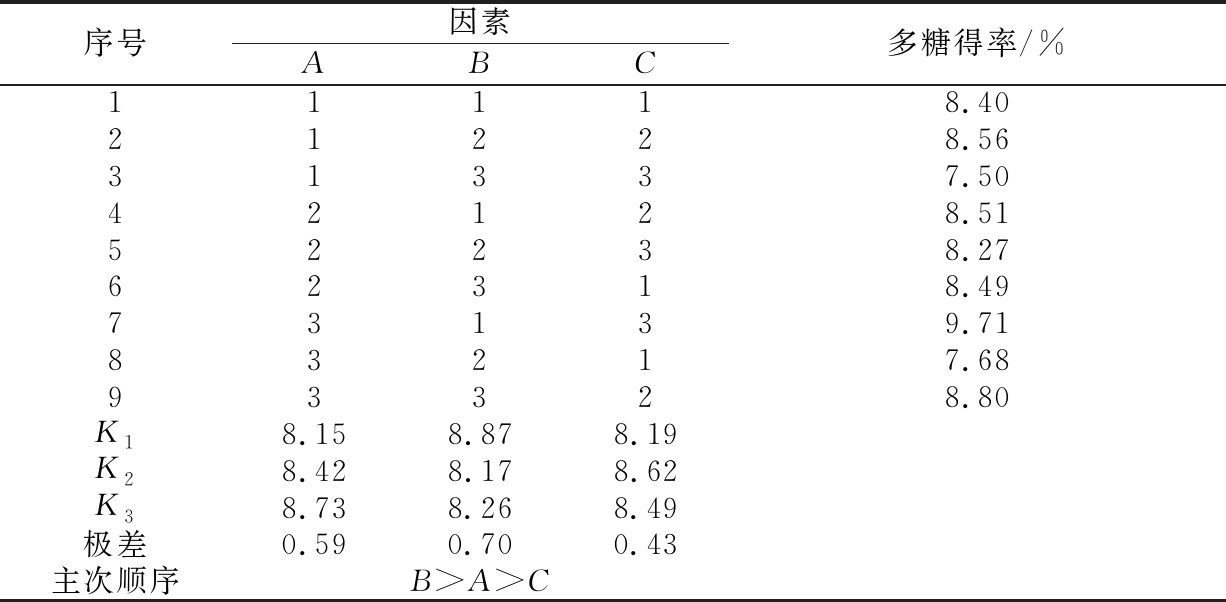
序号因素ABC多糖得率/%11118.4021228.5631337.5042128.5152238.2762318.4973139.7183217.6893328.80K18.158.878.19K28.428.178.62K38.738.268.49极差0.590.700.43主次顺序B>A>C
2.2 验证实验
最优提取条件A3B1C2并未在正交试验中出现,需要补充实验对比L9(33)中A3B1C3和A3B1C2的多糖提取率,实验结果为:A3B1C3为(9.83±0.04)%,A3B1C2为(9.74±0.06)%。根据提取率的高低,确定最优提取条件为A3B1C2,即提取时间为2 h,提取温度为80 ℃,料液比为1∶40(g∶mL),松露粗多糖的提取率为9.83%,高于李明华等[18]对江苏等地金针菇中多糖的提取率(6.85%)和张丽娟等[19]对武夷山产长根菇多糖的提取率(5.85%),低于丛媛媛等[20]对新疆阿魏菇中的多糖提取率(14.69%);从提取方法来看,与孔庆龙[21]的松露多糖的得率接近(10.75%),但孔庆龙[21]的提取时间长(3.7 h),料液比大(1∶59,g∶mL),延长了后续的浓缩、乙醇沉淀和冷冻干燥的实验周期,且增加了溶剂(乙醇、正丁醇和氯仿)的使用量;赖婷[10]研究发现提取次数的增加能提高松露多糖的得率,但同时延长了实验周期,赖婷将提取次数调整为3次,多糖提取率从5%增加到10%左右,但提取时间增加到6 h,是本文提取时间的3倍。综上所述,适当缩短提取时间将有助于缩短实验周期,减少能耗,降低生产成本,符合工业生产要求,同时料液比1∶40(g∶mL),减少后续脱蛋白的正丁醇和氯仿的使用量,既能减少溶剂的浪费也能使工艺更简单易操作,故此工艺可行且环保。
2.3 多糖的分级结果
前期实验对NaCl浓度梯度的分离效果进行了预实验,适当的调整了浓度梯度,由图2可以看出,0、0.1~0.5 mol/L的NaCl对多糖的分离效果明显,松露多糖经DEAE-52纤维素柱层析分离后出现2个峰,分别为TPS-A、TPS-B,收集第41~53管为TPS-A,第75~83管为TPS-B,过柱后TPS-B含量较少,故后续仅对TPS-A进行研究,经检测TPS-A的总糖含量为75.26%,蛋白质含量占总质量的1.32%。
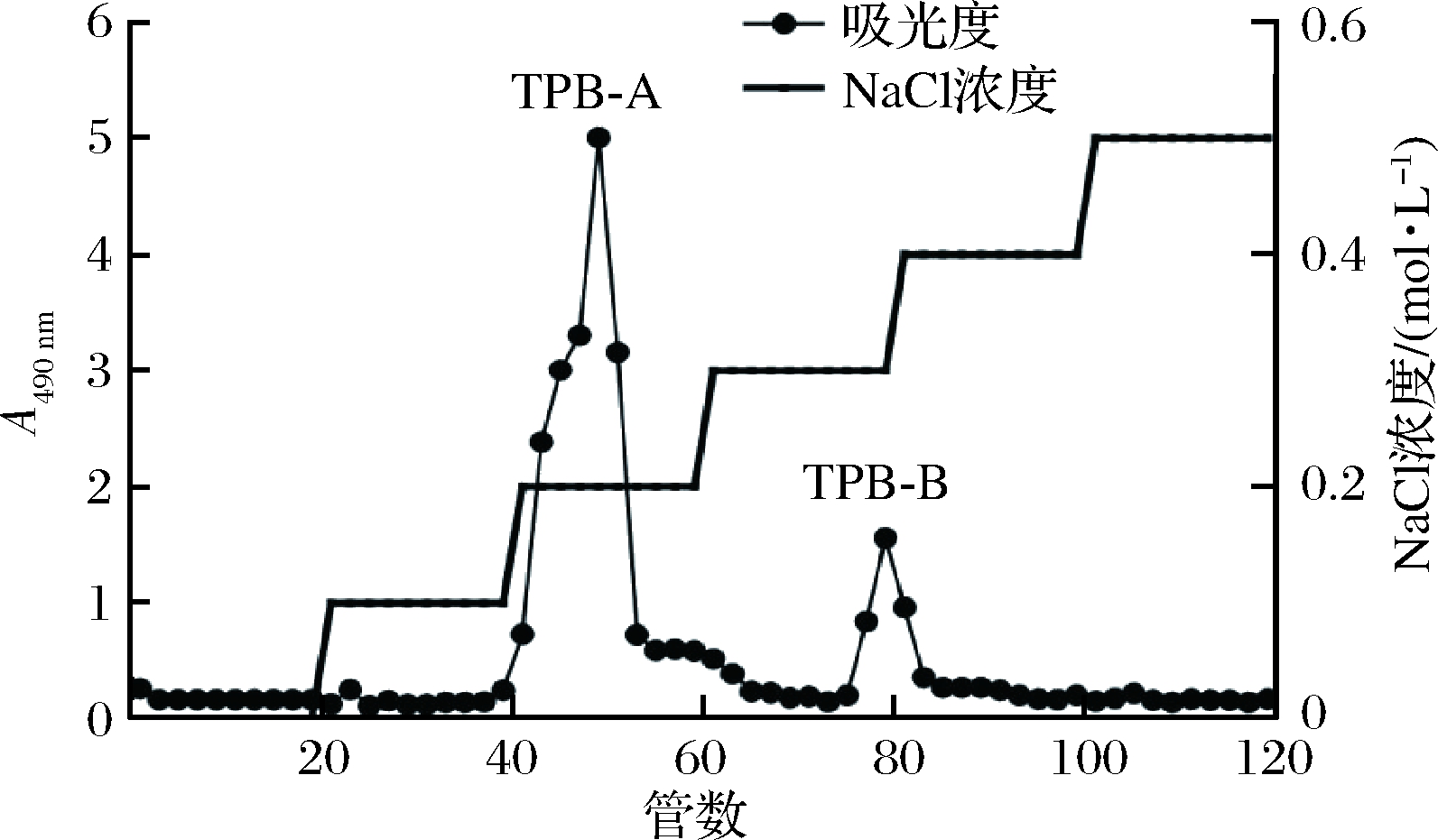
图2 多糖DEAE-52纤维素柱洗脱曲线
Fig.2 Elution profile of polysaccharides by DEAE-52cellulose column chromate graphy
2.4 松露多糖的抗氧化结果
由图3可知,TPS-A和VC对DPPH·清除率效果较好。低浓度(0.125 mg/mL)VC的DPPH·清除率也能保持在80%;松露多糖的DPPH·清除率随着多糖浓度的增加缓慢升高。TPS-A对DPPH·的IC50为0.98 mg/mL;和刘宇琪等[22]实验中灵芝多糖的清除率接近(IC50为1 mg/mL),邓加聪等[23]通过超声水溶液提取牛肝菌多糖的DPPH·的IC50为1.03 mg/mL;DPPH·的IC50的多糖浓度越低,清除效率越好,因此,松露多糖TPS-A具有较高的抗氧化活性。

图3 松露多糖对DPPH·的清除作用
Fig.3 DPPH radical scavenging activity of the polysaccharides from Truffles
2.5 单糖的组成
由图4可知,TPS-A的组成主要为鼠李糖、甘露糖和葡萄糖,按照出峰时间的先后顺序分别对应图4-b中的1、5和6,所占比例分别为2%、3%和95%。松露多糖 TPS-A 的单糖组成与王小花[26]研究的松露多糖的单糖组成结果类似,葡萄糖含量占90%以上,另有少量甘露糖和半乳糖;孔庆龙[21]发现纯化后的松露多糖主要是由葡萄糖组成的多糖,这也证实松露多糖 TPS-A 中葡萄糖的含量较高检测准确。
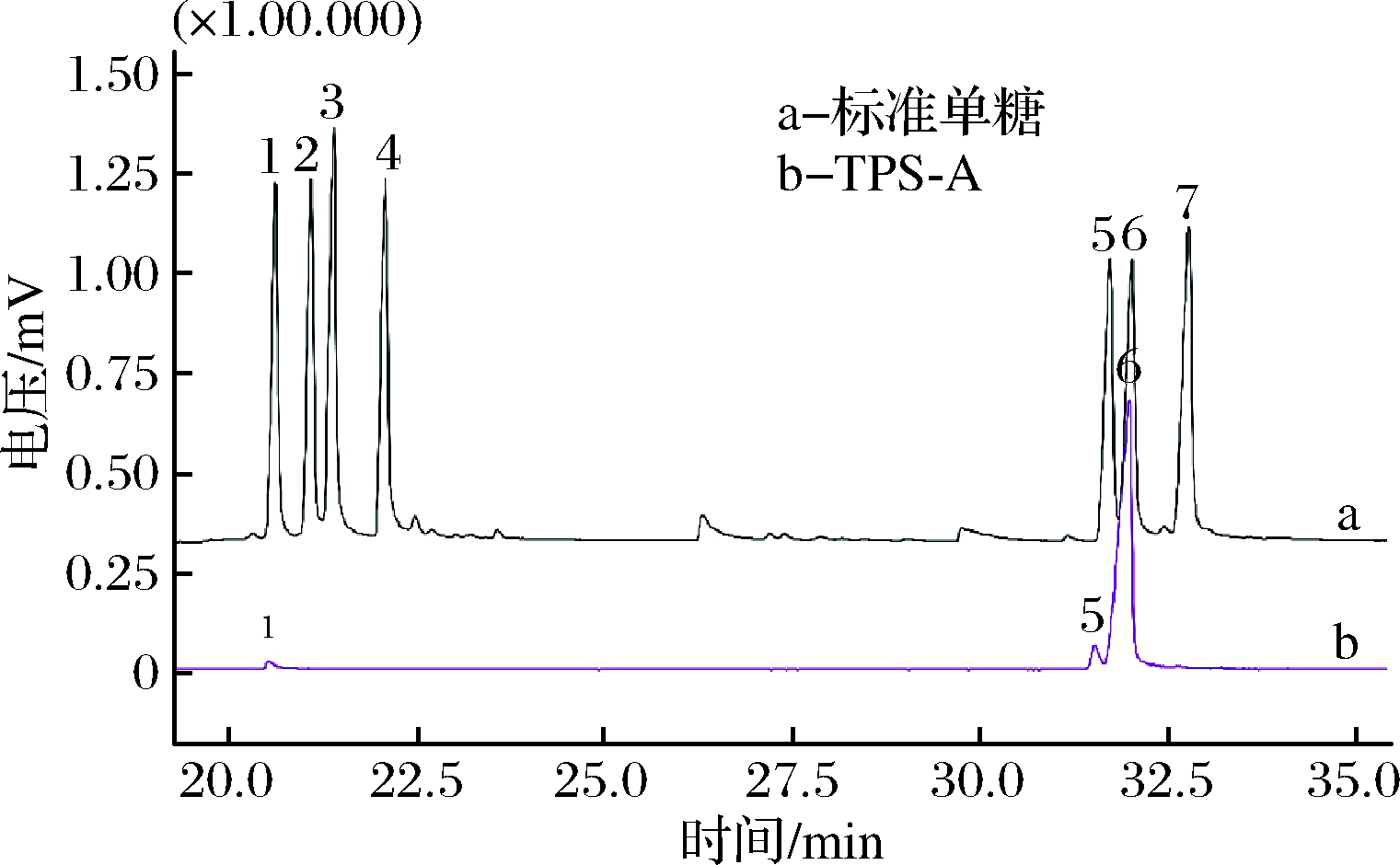
图4 标准单糖、TPS-A水解衍生化产物的GC图
Fig.4 GC of mixed standard monosaccharides, TPS-A
2.6 松露多糖TPS-A 的FTIR扫描结果
由图5可知,松露多糖TPS-A在3 413.462 cm-1有较强的吸收峰,表明多糖分子间或分子内有O—H;在2 930.495 cm-1 有吸收峰,说明分子内有C—H;在1 644.381 cm-1处有吸收峰,是C![]() O不对称伸缩引起的振动[24];在1 404 cm-1的吸收峰是糖类C—H变角振动引起的;在1 150~1 050 cm-1的峰是吡喃型糖苷环骨架C—O变角振动吸收峰,说明多糖中存在C—O—H和C—O—C结构;松露多糖中分别在800~600 cm-1处有吸收峰,可能含有β-D-葡萄吡喃糖吸收峰,其他结构需后续研究确证[25]。
O不对称伸缩引起的振动[24];在1 404 cm-1的吸收峰是糖类C—H变角振动引起的;在1 150~1 050 cm-1的峰是吡喃型糖苷环骨架C—O变角振动吸收峰,说明多糖中存在C—O—H和C—O—C结构;松露多糖中分别在800~600 cm-1处有吸收峰,可能含有β-D-葡萄吡喃糖吸收峰,其他结构需后续研究确证[25]。
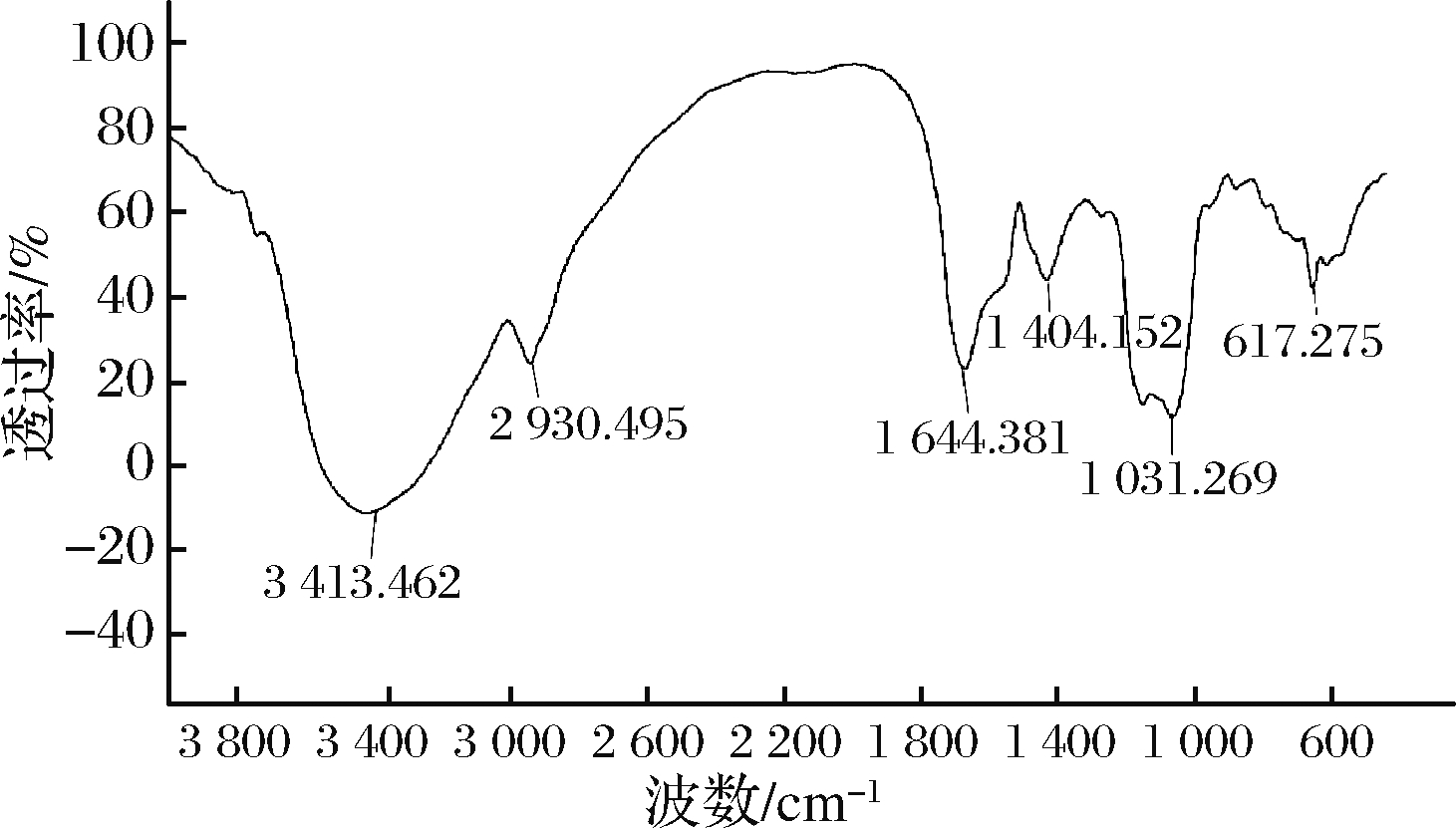
图5 TPS-A的傅里叶红外光谱图
Fig.5 FTIR spectrum of TPS-A
2.7 TPS-A扫描电镜结果
图6-a、图6-b、图6-c分别为TPS-A在100、30、5 μm放大倍数下的电镜扫描图像,可知冷冻干燥和提取工艺并未对多糖的结构造成破坏。由图6-a可知,TPS-A主要由长杆状、圆形颗粒和大块的片状组成,其中长杆状的数量多且呈网状排列,在长杆状的周围零星分布着圆形颗粒,颗粒大小接近于长杆的横截面,片状结构体积大,但数量少,表面光滑;由图6-b可更清晰的观察到长杆状相互缠绕,并和圆形颗粒相互重叠,内部空间结构疏松,故多糖的吸水效果好;由图6-c中可以看出,圆形颗粒表面光滑,颗粒外形完整,数量多。
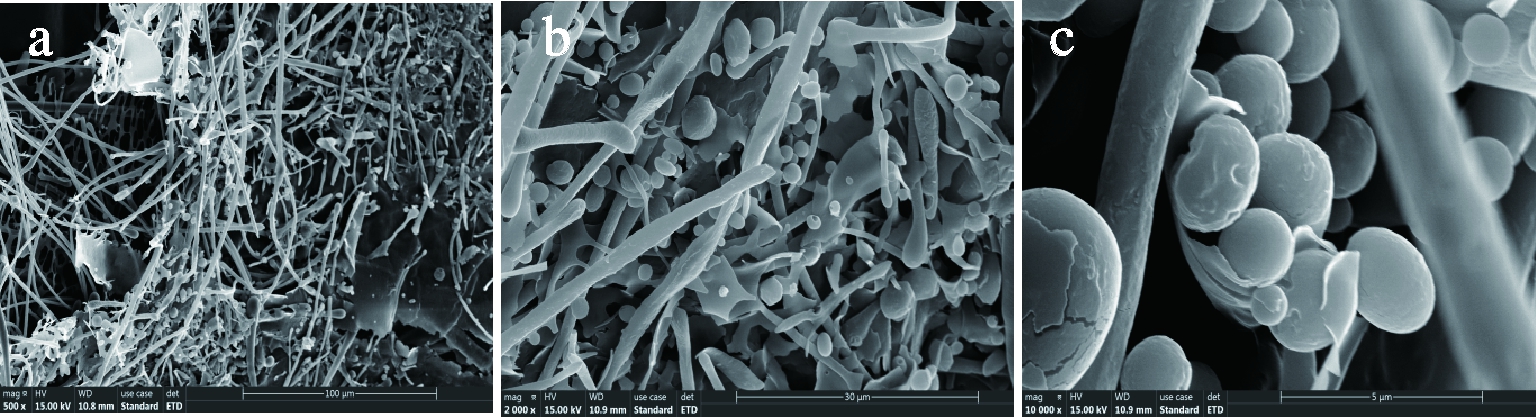
图6 TPS-A不同放大倍数扫描电镜图
Fig.6 SEM images of TPS-A
3 结论
本文对松露粗多糖的水提醇沉工艺进行了优化,通过正交实验优化松露多糖提取工艺为:提取时间2 h、料液比1∶40(g∶mL)和提取温度80 ℃,此条件下的多糖提取量为9.83%;后采用DEAE-52纤维素柱层析分离得到2个不同的组分,分别为TPS-A和TPS-B,其中TPS-B量少,后续仅对TPS-A进行结构鉴定和抗氧化实验。TPS-A对DPPH·的IC50值为0.98 mg/mL,同时测得松露多糖TPS-A是由甘露糖、葡萄糖和鼠李糖组成,且葡萄糖含量高达95%,经红外检测分析发现TPS-A是一种含有β糖苷键的吡喃型多糖。松露多糖在抗氧化活性方面表现优异,作为一种天然的食品成分,可用于医学美容、保健品和食品添加剂方面,这为四川会东松露多糖的综合开发提供思路。
[1] POMA A, T LIMONGI,PACIONI G. Current state and perspectives of truffle genetics and sustainable biotechnology[J]. Applied Microbiology & Biotechnology, 2006, 72(3): 437-441.
[2] ANGELINI P, TIRILLINI B, PROPERZI A, et al. Identification and bioactivity of the growth inhibitors in Tuber spp. methanolic extracts[J]. Plant Biosystems, 2014(2):21.
[3] 路娟,房碧晗,陈哲,等.不同产地块菌中营养成分研究[J].中医药信息,2015(2): 5-7.
[4] 卫强,任定美,李四聪,等.皖南山区红豆杉多糖提取、纯化方法及单糖组成分析[J].食品科学, 2017, 38(16): 190-197.
[5] BARROS L, FERREIRA M J, QUEIR S B, et al, Baptista P (2007) Total phenols, ascorbic acid, β-carotene and lycopene in Portuguese wild edible mushrooms and their antioxidant activities[J]. Food Chemistry,2007,103(2):413-419.
S B, et al, Baptista P (2007) Total phenols, ascorbic acid, β-carotene and lycopene in Portuguese wild edible mushrooms and their antioxidant activities[J]. Food Chemistry,2007,103(2):413-419.
[6] BEARA I N , LESJAK M M , CETOJEVIC-SIMIN D D , et al. Phenolic profile, antioxidant, anti-inflammatory and cytotoxic activities of black (Tuber aestivum Vittad.) and white (Tuber magnatum Pico) truffles [J]. Food Chemistry, 2014,165:460-466.
[7] 甄东.树舌子实体多糖分离纯化、结构表征及抗肿瘤活性研究[D].长春:吉林农业大学,2018:17.
[8] 杨静,白冰,王宁,等.考马斯亮蓝法对烟草薄片涂布液中蛋白质含量的测定[J].湖北农业科学, 2017, 56(5): 946-947;950.
[9] 王海亮.沙棘多糖对神经系统相关疾病的药效学研究[D]. 长春:吉林大学,2019:14.
[10] 赖婷.块菌多糖的提取纯化、结构鉴定及其羧甲基改性研究[D].广州:华南理工大学,2016:30-31.
[11] 杜凯,马养民,郭林新.杏仁皮单宁提取工艺优化及其DPPH自由基清除活性[J].食品工业科技, 2019(21):176-178.
[12] 郑大恒.玫瑰茄多糖的分离纯化、结构表征、免疫活性及其机制研究 [D]. 镇江:江苏大学, 2018:37-40.
[13] 郑伟.黄秋葵花多糖分离纯化、初步表征及生物活性研究[D].镇江:江苏大学,2014:16-17.
[14] 李顺峰,王安建,田广瑞,等.双孢菇菇柄多糖柱层析纯化及单糖组成[J].食品工业科技, 2018(12):16-20.
[15] 梁涛,张静,张力妮,等.碱提杏鲍菇多糖PEAP-1的结构初探及形貌观察[J].食品与生物技术学报, 2013, 32(9):951-956.
[16] 陈金娥,高瑞苑,张海容.响应面法优化胡麻籽壳多糖超声提取工艺[J].中国油脂, 2017, 42(9): 145-148;156.
[17] 陈树俊,李佳益,王翠连,等.黄梨渣多糖的提取、分离纯化和结构鉴定[J].食品科学, 2018, 39(20):289-297.
[18] 李明华,路正清,孟秀梅,等.金针菇多糖闪式提取工艺及其抗氧化活性研究[J].食品与发酵工业,2016,42(10):216-221.
[19] 张丽娟,阎静芳,乐田,等.长根菇多糖的分离提取[J].食品与发酵工业,2015,41(8):224-228.
[20] 丛媛媛,阿依江·哈拜克·米仁沙.牙库甫,等.响应面法优化阿魏菇多糖的超声辅助提取工艺及抗氧化活性研究[J].食品研究与开发,2019,40(22):32-34.
[21] 孔庆龙.印度块菌多糖的分离纯化、结构表征及抗氧化性研究[D].昆明:昆明理工大学, 2013:42-43.
[22] 刘宇琪,郝利民,鲁吉珂,等.灵芝子实体和孢子粉纯化多糖体外抗氧化活性研究[J].食品工业科技, 2019(16):27-30.
[23] 邓加聪,曾锈华,陈婕,等.牛肝菌多糖的提取及抗氧化性研究[J].食品工业科技, 2019,38(10):160.
[24] ZHANG Z, WANG F, WANG M, et al. A comparative study of the neutral and acidic polysaccharides from Allium macrostemon Bunge [J]. Carbohydrate Polymers,2015, 117: 980-987.
[25] 胡婷.虎乳灵芝多糖的多级结构及溶液行为研究[D]. 武汉:华中农业大学:2017:32-33.
[26] 王小花.块菌及其发酵体系中多糖的分离纯化、生物活性及结构研究[D].福州:福建农业大学, 2011:48-49.