甘蓝属于十字花科芸薹属植物,在世界各地均有种植。由于它富含叶酸、抗坏血酸、硫代葡萄糖苷和萝卜硫素等生物活性成分,在抗肿瘤、抗氧化及抗炎方面表现突出,因而深受消费者的喜爱。尽管在低温(0~2 ℃)下甘蓝可贮藏3~4月,但在30 ℃左右的环境温度下,甘蓝的叶片组织易发生黄化,同时伴有腐烂黑斑症状的出现,致使其仅有2~4 d的货架期[1]。因此研究者探索了多种处理方法,包括热处理[2]、保鲜涂膜[3]及LED辐照[4]对甘蓝货架期及营养品质的影响,但由于处理过程的繁琐或食品安全等方面的原因,这些方法的应用受到了限制。相比之下,比较推荐的方法为预冷和气调处理,然而这2种方法的应用受制于基础设施的完备性。在实际生产中,甘蓝的采收、流通及市场销售常遭遇高温环境的影响。因此有必要发展有效的采后处理技术,用以控制甘蓝采后的衰败,延长其货架期。
甘蓝叶片组织的鲜绿状态与其叶绿素的水平有关。植物激素乙烯可促进植物中叶绿素的降解[5]。相反,乙烯受体抑制剂1-甲基环丙烯(1-methylcyclopropene,1-MCP)可减缓多种园艺作物中叶绿素的降解。例如,AL-UBEED等[6]研究表明,1-MCP通过抑制叶绿素降解而延长了青菜的货架期。在芹菜和香菜中也得到了同样的结果[7-8]。表明1-MCP可作为一种控制叶菜组织黄化的采后处理措施。然而1-MCP 的这种有益影响常因作物种类、处理浓度及时间等因素的不同而不同。例如MENG等[9]的研究显示,1-MCP处理可抑制白菜的脱帮,但澳大利亚学者发现1-MCP对白菜采后的贮藏特性无影响[10]。可见,1-MCP对蔬菜贮藏特性的影响依赖于其本身的特性。就甘蓝而言,截至目前尚未见1-MCP对其贮藏特性影响的报道。
单一的分析方法往往不能满足整体评价果蔬品质的需要,然而多变量统计分析方法包括主成分分析、偏最小二乘回归分析和通径分析,可分别用于区别主效因子、确定参数间相关性、辨别直接效应与间接效应。为了探查1-MCP对甘蓝采后贮藏特性和货架期的影响,本研究分析了1-MCP对甘蓝采后乙烯生成、呼吸速率、叶绿素降解、生物活性成分、抗氧化能力及亚硝酸盐积累的影响,并结合多变量统计的分析方法,综合评估了1-MCP处理对各参数的影响特点。研究结果不仅可拓展1-MCP的应用范围,并且可为控制常温下甘蓝采后的快速衰败提供一定的理论依据。
1 材料与方法
1.1 试验材料及处理
新鲜牛心甘蓝采购于南京众彩物流批发市场的供货基地,采购后1 h内运至实验室,挑选无机械损伤,无病虫害,大小基本一致的甘蓝为试验材料。
将所选甘蓝随机分成2组,每组50颗。根据预试验的结果,一组用1.0 μL/L 1-MCP在(25±1) ℃下熏蒸12 h,另一组为对照(CK),在无1-MCP的条件下熏蒸同样时间。熏蒸完成后进行通风30 min。随后将所有的甘蓝用带孔塑料薄膜袋包装,每处理设置3个重复。贮藏温度为(25±1) ℃,相对湿度为85%~90%。贮藏期间每2 d取样1次,用干净的刀具切取甘蓝最外面的3层外衣,液氮速冻后置于-70 ℃冰箱,用于相关指标的测定。其中,叶绿素、乙烯和呼吸速率的测定采用同期鲜样进行。
1.2 仪器与设备
MIR-254恒温箱,日本SaIlvo公司产品;UV-1102紫外可见分光光度计,上海天美科学仪器有限公司; A11 Basic液氮研磨器,艾卡(广州)仪器设备有限公司;Sigma 3K15高速冷冻离心机,美国Sigma-Aldrich公司;1260高效液相色谱仪,美国安捷伦科技有限公司;pH计,梅特勒-托利多仪器(中国)有限公司。
1.3 试验方法
1.3.1 总叶绿素(chorophyll,Chl)含量
参考刘红艳等[11]的方法。
1.3.2 乙烯和呼吸速率
乙烯的测定参照王瑶等[12]的方法略有改动。每组取36颗甘蓝,其中每个平行12颗,称重后置于密封箱中。于(25±1) ℃条件下密闭4 h 后取气1 mL,用气相色谱完成测定。色谱条件:FID检测器,柱温70 ℃,N2压力0.5 MPa,H2压力0.3 MPa,空气压力0.5 MPa,重复3次,外标法定量。除了要打开镍转化炉外(375 ℃),呼吸速率测定的其他条件与乙烯相同。
1.3.3 丙二醛(malondialdehyde,MDA)
MDA含量的测定参考高建晓等[13]的方法略有改动。称取3 g甘蓝样品,加入5%三氯乙酸10 mL,研磨后所得匀浆在10 000 × g下离心10 min,取上清液2 mL,加入2 mL 0.67% 硫代巴比妥酸,混合后水浴煮沸30 min,冷却后离心,分别取上清液测定在450、532、600 nm处的吸光值,计算MDA含量(mmol/kg)。
1.3.4 总硫代葡萄糖苷(glucosinolates,Glu)和萝卜硫素(sulforaphane,Sulp)
总硫代葡萄糖苷含量的测定参照WEI等[14]方法,采用苯酚-硫酸法,以葡萄糖做标准曲线。
萝卜硫素的测定参考GUO等[15]的方法略有改动。称取1.0 g甘蓝样品,加入5 mL蒸馏水,于37 ℃水解3 h后加入8 mL二氯甲烷,采用氮吹仪吹干后用2 mL 10%乙腈超声溶解,过0.22 μm有机系膜,HPLC测定。液相色谱分析条件:XDB-C18色谱柱(250 mm × 4.6 mm,5 μm);检测波长254 nm,流速0.6 mL/min,进样量20 μL,柱温30 ℃。流动相A为超纯水,流动相B为乙腈,洗脱程序:0 min~25 min~30 min,10%乙腈~60%乙腈~100%乙腈。
1.3.5 亚硝酸盐(nitrite,Nitr)和叶酸
亚硝酸盐采用盐酸萘乙二胺法[16]。
叶酸参照张毅[17]方法略有改动。称取2 g甘蓝样品置于50 mL离心管遮光,加入10 mL 0.1 mol/L磷酸盐缓冲液(pH 6.5),于离心管,置于氮吹仪上吹氮15 s,之后在90 ℃水浴10 min,后取出离心管,在避光条件下放入冰浴中冷却,随后在10 000×g离心15 min,取离心后的上清液过0.45 μm无机滤膜。高效液相色谱条件:A相为0.1 mol/L KH2OH-KOH溶液(pH 6.5),B相为甲醇;采集数据时间为22 min;色谱柱:C18柱(250 mm × 4.6 mm,5 μm);柱温:30 ℃;流速1 mL/min;检测器紫外检测;波长280 nm;进样量20 μL;梯度洗脱程序[t(A/B),V/V]:0 min(0/100)~3 min(0/100)~8 min(30/70)~13 min(30/70)~17 min(0/100)~22 min(0/100)。
1.3.6 抗坏血酸(ascorbic acid,AsA)和总酚
抗坏血酸的测定采用钼蓝比色法[18],称取1.0 g甘蓝样品,加入5 mL草酸-EDTA溶液研磨成匀浆,(4 ℃,转速为8 000×g条件下离心15 min),取1 mL上清液,冰浴上依次加入4 mL草酸-EDTA溶液、0.5 mL偏磷酸-乙酸、1 mL 5%的H2SO4及2 mL质量分数为5%的钼酸铵溶液。将其混匀置于30 ℃水浴15 min后于760 nm处比色。同时以抗坏血酸含量为横坐标,OD值为纵坐标制作标准曲线。
总酚的测定参考王亚楠等[19]的方法略有改动。称取2 g甘蓝样品,加5 mL 80%(体积分数)乙醇充分匀浆,4 ℃ 12 000×g离心20 min,上清液用于总酚的测定。取0.1 mL上清液,加0.9 mL蒸馏水,0.4 mL Folin试剂,于25 ℃反应3 min,再加入1 mL饱和Na2CO3溶液,25 ℃反应1 h,于760 nm测吸光值。以没食子酸作为标准物质。
1.3.7 抗氧化能力及还原力
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、羟自由基(·OH)及超氧阴离子![]() 清除率的测定参考王亚楠等[19]的方法。还原力(redu)的测定参考JING等[20]的方法。
清除率的测定参考王亚楠等[19]的方法。还原力(redu)的测定参考JING等[20]的方法。
1.4 数据处理
试验数据使用SPSS 20.0进行邓肯氏单因素方差分析(P < 0.05)和相关性分析,使用Simca-p 11.5进行主成分和偏最小二乘分析,使用DPS 7.5进行通径分析。
2 结果与分析
2.1 1-MCP对牛心甘蓝贮藏特性的影响
表1的结果表明,随着贮藏时间的延长,甘蓝表面外衣组织中Chl含量不断下降,相反MDA含量的变化呈增加趋势。然而,1-MCP处理可减缓组织中Chl的降解和MDA的积累,反映出1-MCP处理甘蓝的衰老进程较缓;乙烯释放量的结果表明,采后甘蓝在贮藏第6天出现释放高峰,1-MCP处理明显降低了该峰值,也降低了其他时期组织中乙烯的释放量;采后甘蓝的呼吸高峰出现在贮藏的第2天,之后呈下降趋势,1-MCP处理也降低了采后甘蓝的呼吸速率。Nitr的测定结果显示,在常温贮藏过程中,采后甘蓝中的Nitr有所积累,在贮藏第6天达到最大,相比之下,1-MCP处理维持了组织中较低的Nitr含量。
表1 1-MCP对采后甘蓝衰老指标、生物活性成分及抗氧化能力的影响
Table 1 Effects of 1-MCP on senescence index, bioactive components and antioxidant capacity of postharvest cabbage

注:表中的小写字母表示根据邓肯法差异统计分析的结果(P < 0.05)
指标采收时对照-2 d1-MCP-2 d对照-4 d1-MCP-4 d对照-6 d1-MCP-6 d对照-8 d1-MCP-8 dChl/(mg·kg-1)37.80±0.24a34.13±1.72b39.37±0.33a29.79±0.13c31.25±0.41c23.12±0.19e26.26±0.44d21.15±0.21f23.62±0.04e乙烯/[μL·(kg·h)-1]1.55±0.03d0.99±0.02e0.92±0.14e2.18±0.04c1.37±0.10d4.00±0.06a3.21±0.08b1.53±0.02d0.66±0.01f呼吸/[mg·(kg·h)-1]27.46±0.18f38.39±0.48a31.39±1.57d35.27±0.06ab29.19±0.21e33.59±0.03bc24.09±0.33g32.49±0.18cd24.71±0.01gMDA/(mmol·kg-1)3.66±0.36e4.73±0.07cd4.36±0.20d5.34±0.15c4.49±0.18d6.06±0.77b5.14±0.04c7.46±0.15a6.52±0.24bGlu/(g·kg-1)1.36±0.03a0.76±0.01c0.96±0.10b0.73±0.01cd0.94±0.05b0.57±0.00d0.87±0.05bc0.22±0.03e0.60±0.03dSulp/(mg·kg-1)16.67±0.82ef40.89±0.83b35.88±0.65a32.35±0.12c33.61±0.27c33.34±0.01e17.95±0.61c25.28±0.31f15.09±0.47dNitr/(mg·kg-1)0.82±0.00de0.84±0.00bc0.80±0.00e0.86±0.00ab0.82±0.00cd0.88±0.42a0.85±0.00b0.86±0.00b0.82±0.00de叶酸/(mg·kg-1)1.99±0.02c2.05±0.01b2.33±0.00a1.62±0.01f1.80±0.01d1.29±1.60hi1.69±0.00e1.32±0.01h1.51±0.03gAsA/[mg·(100g)-1]13.69±0.14a11.72±0.42b13.05±0.14a11.27±0.12b13.00±0.18a10.07±2.31c11.96±0.07b9.32±0.23d11.51±0.09b总酚/(μg·g-1)25.05±0.93a21.73±1.66bc23.12±2.76ab17.21±0.35cd19.72±2.22cd16.11±0.31cd19.71±2.18cd15.85±0.41d18.65±1.79cdDPPH·清除率/%91.64±0.88a87.21±0.63bc89.18±1.62ab85.29±0.30cd86.77±0.73bc82.51±2.30de85.35±1.52cd78.97±1.88e81.40±1.91de·OH清除率/%10.67±0.53a9.23±0.59ab10.25±0.15ab7.23±0.62c10.13±0.23ab6.04±0.31cd9.04±0.49b5.51±0.51d8.77±0.61bO-2·清除率/%46.82±2.26a24.60±1.30cd26.69±1.31cd33.97±3.12bc34.79±5.20bc24.16±1.25cd38.73±4.69ab19.15±0.31d34.85±5.44bcredu(OD517)0.52±0.01a0.44±0.00b0.52±0.02a0.43±0.00b0.52±0.00a0.43±0.00b0.51±0.00a0.43±0.00b0.50±0.01a
生物活性成分Glu、Sulp和叶酸的结果显示,在甘蓝的贮藏期间,Glu含量总体呈下降趋势,Sulp和叶酸在贮藏第2天出现峰值后开始下降,然而1-MCP处理缓解了组织中Glu含量的下降,降低了Sulp和叶酸的峰值及其随后的下降率,从而维持了采后牛心甘蓝中较高的生物活性成分。
用DPPH·清除率、·OH清除率及超氧阴离子![]() 清除率及还原力(redu)评价采后甘蓝组织中抗氧化活性的水平,可看出,随着贮藏时间的延长,牛心甘蓝中的抗氧化能力整体呈下降趋势。然而1-MCP处理显著推迟了组织中抗氧化活性的下降程度。
清除率及还原力(redu)评价采后甘蓝组织中抗氧化活性的水平,可看出,随着贮藏时间的延长,牛心甘蓝中的抗氧化能力整体呈下降趋势。然而1-MCP处理显著推迟了组织中抗氧化活性的下降程度。
2.2 主成分分析
由图1-a,图1-b可知,前2个主成分(PC1和PC2)累积贡献率为77.3%,可较好地反映整体数据信息。其中,Chl、Glu、叶酸、AsA、DPPH·清除率及·OH清除率在PC1正坐标处具有较高载荷,MDA和Nitr在PC1负坐标处载荷较高,表明PC1主要反映的是组织衰老及抗氧化活性的情况。PC1很好地区分了同一天内CK和1-MCP处理的样本。说明1-MCP对Chl、Glu、叶酸、AsA、DPPH·清除率、·OH清除率、MDA和Nitr变化的影响较明显。此外,PC1还较好地将CK和1-MCP的样本整体区分开来,即除贮藏第8天外,1-MCP处理组的样本均分布在PC1正坐标区域,而CK中仅有贮藏第2天的样本分布在正坐标区域。
PC2正坐标处载荷较高的指标有呼吸强度和Sulp,PC2负坐标处具有较高载荷的是![]() 清除率及还原力(redu)。表明PC2代表了组织的呼吸速率、萝卜硫素及部分抗氧化能力。PC2同PC1一样,较好地区分了同一天内CK和1-MCP的样本。
清除率及还原力(redu)。表明PC2代表了组织的呼吸速率、萝卜硫素及部分抗氧化能力。PC2同PC1一样,较好地区分了同一天内CK和1-MCP的样本。
聚类分析的结果(图1-c)显示,整个贮藏期的样本可聚为三大类,第一层次为0 d、CK-2 d、1-MCP-2 d和1-MCP-4 d,然后与1-MCP-6 d、1-MCP-8 d聚为第二层次,最后与CK-4 d、CK-6 d和CK-8 d聚为第三层次。这一分类与图1-b中PC1对CK和1-MCP样本的区分结果一致。表明1-MCP处理甘蓝的贮藏特性更接近于0 d的结果,这暗示其衰老进程较对照缓慢。

a-因子载荷;b-得分;c-聚类分析图1 1-MCP对牛心甘蓝因子载荷、得分及聚类分析的影响
Fig.1 Effects of 1-MCP on the PCA loadings, PCA scores and cluster analysis of heart-shaped cabbage
2.3 相关性分析
由图2可看出,叶绿素与Glu、叶酸、AsA、总酚、DPPH·清除率及·OH清除率呈极显著正相关,与MDA呈极显著负相关;乙烯与Nitr呈显著正相关;呼吸强度与Sulp呈极显著正相关;MDA与Glu、叶酸、AsA、总酚及DPPH·清除率之间呈极显著负相关;Glu与叶酸![]() 清除率及redu呈显著正相关,与AsA、总酚、DPPH·清除率及·OH清除率呈极显著正相关;Nitr与叶酸、AsA和总酚呈显著负相关,与·OH清除率和redu呈极显著负相关;叶酸与AsA、总酚、DPPH·清除率及·OH清除率呈极显著正相关;AsA与总酚、DPPH·清除率、·OH清除率及还原力呈极显著正相关,与
清除率及redu呈显著正相关,与AsA、总酚、DPPH·清除率及·OH清除率呈极显著正相关;Nitr与叶酸、AsA和总酚呈显著负相关,与·OH清除率和redu呈极显著负相关;叶酸与AsA、总酚、DPPH·清除率及·OH清除率呈极显著正相关;AsA与总酚、DPPH·清除率、·OH清除率及还原力呈极显著正相关,与![]() 清除率呈显著正相关;总酚与DPPH·清除率和·OH清除率呈极显著正相关,与redu呈显著正相关;DPPH·清除率与·OH清除率呈极显著正相关;·OH清除率和
清除率呈显著正相关;总酚与DPPH·清除率和·OH清除率呈极显著正相关,与redu呈显著正相关;DPPH·清除率与·OH清除率呈极显著正相关;·OH清除率和![]() 清除率与还原力分别呈极显著和显著正相关。
清除率与还原力分别呈极显著和显著正相关。
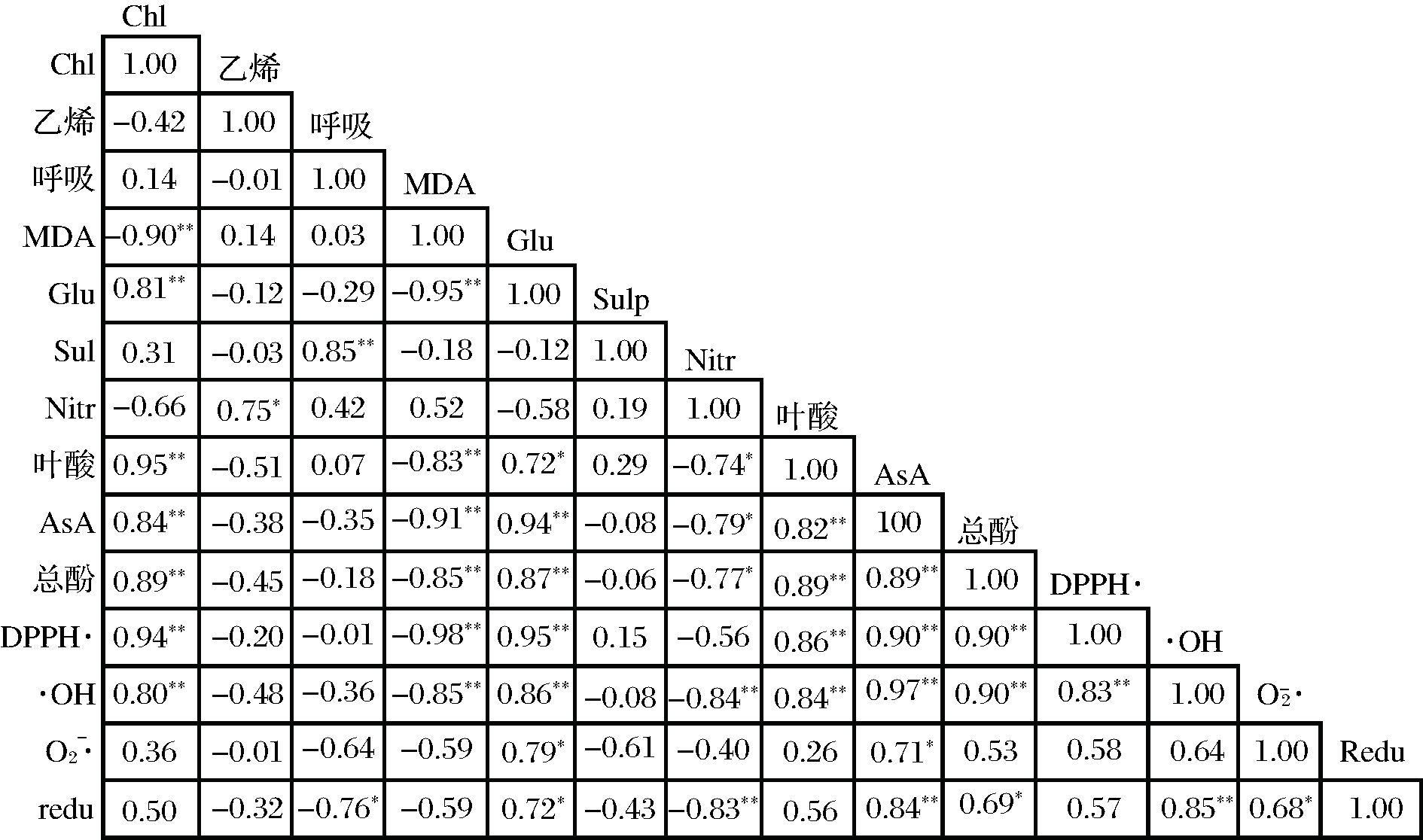
图2 牛心甘蓝叶绿素与其他指标之间的相关性分析
Fig.2 Correlation analysis between chlorophyll and other indexes in heart-shaped cabbage
注:*表示差异显著(P<0.05);**表示差异显著(P<0.01)
2.4 偏最小二乘回归分析
以叶绿素为因变量(Y),其他指标为自变量(X),建立偏最小二乘回归分析模型。由图3-a可知,前2个变量解释了X变量的74.0%以及Y变量的92.6%。其中,Glu、叶酸、AsA、总酚、DPPH·清除率、·OH清除率与叶绿素位于PC1的正坐标处,表明其与叶绿素呈正相关;MDA和Nitr位于PC1的负坐标处,表明其与叶绿素呈负相关,暗示叶绿素含量的下降伴随着组织内MDA和Nitr的积累。
同PCA分析的结果一致,偏最小二乘回归分析的得分也显示,在PC1坐标轴上,可明显区分同一天内CK和1-MCP处理的样本,以及CK和1-MCP处理样本的整体情况;在PC2坐标轴上,也可将同一天的CK和1-MCP处理样本得以区分(图3-b)。图3-c进一步分析了自变量对因变量影响的重要性,根据变量权重 > 1的原则,可得出对因变量叶绿素具有重要影响的自变量有7个,其重要性依次为叶酸>MDA>AsA>DPPH·清除率 > Glu > ·OH清除率。

a-因子载荷;b-得分;c-变量权重图3 以叶绿素为因变量的偏最小二乘回归分析的因子载荷图、得分及变量权重
Fig.3 Loading plot, scores and variable importance of partial least squares regression analysis with chlorophyll as dependent variable
2.5 通径分析
以牛心甘蓝中的总叶绿素作为因变量,进行逐步回归分析,得到的逐步回归方程为:Y=-23.062 432 68-0.180 955 701 79X1+0.251 570 439 70X2-70.317 904 03X6+5.772 336 348X7+1.225 627 962 7X8+1.094 176 761 6X10-1.593 038 077 8X11。式中X1、X2、X6、X7、X8、X10和X11分别代表乙烯、呼吸、Nitr、叶酸、AsA、DPPH·清除率和·OH清除率。调整决定系数R2=0.998,并进行显著性检验,得该方程方差分析的F=714.46,P=0.002 9,说明该回归方差有显著意义,进一步做通径分析。各参数对叶绿素的直接通径系数由大到小依次为DPPH·清除率、·OH清除率、叶酸、Nitr、AsA、呼吸和乙烯。具体来看,DPPH·清除率对叶绿素的直接通径系数高达0.654 7,表明DPPH·清除率对叶绿素有较大的正直接作用,同时,DPPH·清除率通过叶酸、AsA及·OH清除率产生较大的正间接作用;叶酸、AsA及·OH清除率与叶绿素的损失有较高的直接相关性,且这三者主要通过DPPH·清除率起间接作用。乙烯的直接通径系数较小,但通过Nitr和·OH清除率分别对甘蓝叶绿素产生较高的间接作用。另外,呼吸和Nitr对甘蓝叶绿素有一定的负直接作用,而叶酸、AsA及·OH清除率则起一定的正直接作用。
3 讨论
单因素方差分析研究,主要关注因变量在单一因素影响下的变化过程。本研究首先对数据进行了单因素方差分析。结果显示,与对照CK相比,1-甲基环丙烯显著降低了采后牛心甘蓝中的乙烯释放量,与其他果蔬上的研究结果一致[21]。同时,1-MCP处理降低了采后甘蓝的呼吸强度。同样,在李果实采后贮藏过程中也证实了对呼吸强度的抑制伴随着低水平的乙烯释放量[22]。叶绿素的测定结果显示,伴随牛心甘蓝采后衰老进程的发生,组织中的叶绿素含量不断下降,然而1-MCP处理显著减缓了叶绿素的下降。与1-MCP在青菜、芹菜和香菜上的研究结果一致[7]。
表2 以总叶绿素为因变量的通径分析结果
Table 2 The results of path analysis using chlorophyll as dependent variable
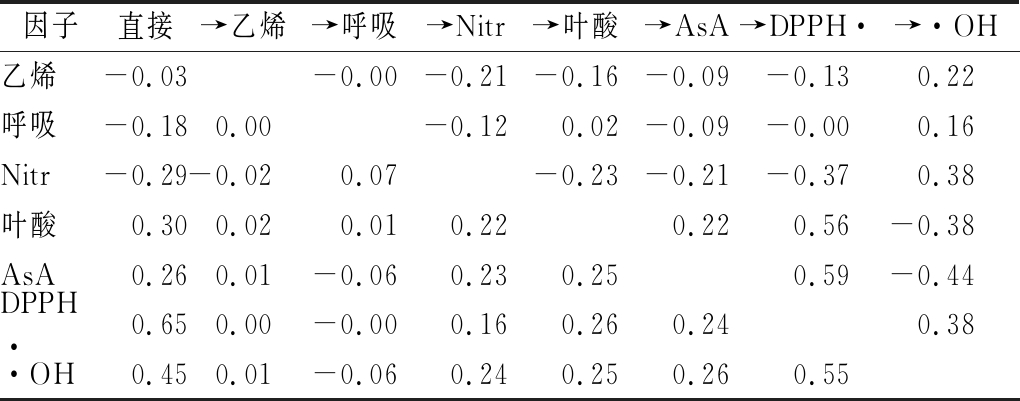
因子直接→乙烯→呼吸→Nitr→叶酸→AsA→DPPH·→·OH乙烯-0.03-0.00-0.21-0.16-0.09-0.130.22呼吸-0.180.00-0.120.02-0.09-0.000.16Nitr-0.29-0.020.07-0.23-0.21-0.370.38叶酸0.300.020.010.220.220.56-0.38AsA0.260.01-0.060.230.250.59-0.44DPPH·0.650.00-0.000.160.260.240.38·OH0.450.01-0.060.240.250.260.55
十字花科蔬菜是多种生物活性成分的绝好来源。例如多数十字花科蔬菜富含酚类、硫代葡萄糖苷和萝卜硫素等物质。CIESLIK等[23]研究显示,采后西兰花中的硫代葡萄糖苷损耗严重。同样在甘蓝的采后也存在硫代葡萄糖苷的损耗,但1-MCP处理减缓了其在衰老过程中的损耗。YUAN等[24]研究也发现,1-MCP处理可更好地保留采后西兰花中硫代葡萄糖苷的含量。另外,1-MCP处理也减缓了组织中萝卜硫素、叶酸含量的下降。这些结果表明1-MCP具有维持采后牛心甘蓝部分生物活性成分的作用。
抗氧化物质为园艺作物中的重要植化成分,它们具有多种作用。当组织中的活性氧簇(reactive oxygen species,ROS)水平超过其清除能力,导致氧化胁迫的发生。氧化胁迫状态与园艺作物的贮藏品质密切相关[19]。本研究中,对甘蓝采后组织抗氧化水平的测定发现,总体上,随着衰老进程的发生,组织的抗氧化能力下降,然而1-MCP处理可显著减缓甘蓝中抗氧化能力的下降。同样,1-MCP也维持了采后西兰花组织中较高的抗氧化水平[21]。高的抗氧化能力有助于保持组织中ROS的平衡状态,进而控制组织中MDA积累。这些结果表明,施加1-MCP可减缓采后甘蓝的衰老进程。
在单因素分析的基础上,本研究使用主成分分析对牛心甘蓝各理化指标进行了降维处理,得到2个具有代表性的主成分。研究结果表明,PC1和PC2共同作用可将每一个样本区分开来。1-MCP对总叶绿素、总硫代葡萄糖苷、叶酸、抗坏血酸、DPPH·清除率、·OH清除率、MDA和亚硝酸盐的影响较明显。基于PC2的影响,表明1-MCP也对呼吸速率、萝卜硫素![]() 清除率及还原力的变化具有影响。进一步结合偏最小二乘回归分析中变量的权重结果,评价了不同参数影响的重要性。研究显示各个参数的影响大小依次为叶酸>MDA>抗坏血酸>DPPH·清除率>总硫代葡萄糖苷>·OH清除率,表明这6个参数对区分1-MCP和CK样本具有重要贡献。通径分析是应用通径系数分析方法,在相关分析与回归分析的基础上,进一步研究因变量与自变量之间的数量关系,并将相关系数分解为直接作用系数和间接作用系数,以揭示各个因素对因变量的相对重要性[25]。通径分析结果显示了各参数对叶绿素的直接通径系数,按照大小依次为DPPH·清除率、·OH清除率、叶酸、亚硝酸盐、抗坏血酸、呼吸和乙烯。可看出,尽管通径分析显示呼吸强度和乙烯为直接因素,但其通径系数较小,这可能与其在牛心甘蓝采后贮藏中出现的呼吸峰和乙烯峰有关。另外可看出,偏最小二乘回归分析法和通径分析确定出的关键参数类别和影响大小上略差异,结合相关分析的结果,总体上显示了1-MCP对采后甘蓝正向的影响有叶酸、抗坏血酸、DPPH·清除率、总硫代葡萄糖苷、·OH清除率,负向的为丙二醛。联合单因素分析的结果,表明1-MCP有利于减缓采后甘蓝抗氧化能力的下降,从而与对照样品得以区分。与本研究的结果类似,SUN等[21]的研究也表明,1-MCP可维持采后芥蓝中较高水平的抗氧化能力。
清除率及还原力的变化具有影响。进一步结合偏最小二乘回归分析中变量的权重结果,评价了不同参数影响的重要性。研究显示各个参数的影响大小依次为叶酸>MDA>抗坏血酸>DPPH·清除率>总硫代葡萄糖苷>·OH清除率,表明这6个参数对区分1-MCP和CK样本具有重要贡献。通径分析是应用通径系数分析方法,在相关分析与回归分析的基础上,进一步研究因变量与自变量之间的数量关系,并将相关系数分解为直接作用系数和间接作用系数,以揭示各个因素对因变量的相对重要性[25]。通径分析结果显示了各参数对叶绿素的直接通径系数,按照大小依次为DPPH·清除率、·OH清除率、叶酸、亚硝酸盐、抗坏血酸、呼吸和乙烯。可看出,尽管通径分析显示呼吸强度和乙烯为直接因素,但其通径系数较小,这可能与其在牛心甘蓝采后贮藏中出现的呼吸峰和乙烯峰有关。另外可看出,偏最小二乘回归分析法和通径分析确定出的关键参数类别和影响大小上略差异,结合相关分析的结果,总体上显示了1-MCP对采后甘蓝正向的影响有叶酸、抗坏血酸、DPPH·清除率、总硫代葡萄糖苷、·OH清除率,负向的为丙二醛。联合单因素分析的结果,表明1-MCP有利于减缓采后甘蓝抗氧化能力的下降,从而与对照样品得以区分。与本研究的结果类似,SUN等[21]的研究也表明,1-MCP可维持采后芥蓝中较高水平的抗氧化能力。
4 结论
单因素方差分析、主成分分析、相关性分析、偏最小二乘回归分析、通径分析这5种多变量分析方法的综合结果表明,与对照相比,1-MCP处理抑制了采后甘蓝中呼吸强度和乙烯的释放水平,维持了组织中较高的抗氧化能力,进而减缓了组织的衰老进程。
[1] HAN N, KU K M, KIM J. Postharvest variation of major glucosinolate and their hydrolytic products in Brassicoraphanus ‘BB1’[J]. Postharvest Biology and Technology, 2019, 154: 70-78.
[2] 曹帅颖,李洋,何晨阳, 等. 热处理及贮藏温度对紫甘蓝花色苷稳定性和抗氧化能力的影响[J].食品研究与开发, 2018, 39(2): 21-27.
[3] BERARD L S. Effects of harvest dates, field frost, and preservative coating on storage disorders of cabbage[J]. Hortscience, 1987, 22: 1 140-1 140.
[4] LEE Y J, HA J Y, OH J E, et al. The effect of LED irradiation on the quality of cabbage stored at a low temperature[J]. Food Science and Biotechnology, 2014, 23: 1 087-1 093.
[5] GOMEZ-LOBATO M E, HASPERUE J H, CIVELLO P M, et al. Effect of 1-MCP on the expression of chlorophyll degrading genes during senescence of broccoli (Brassica oleracea L.)[J]. Scientia Horticulturae, 2012, 144: 208-211.
[6] AL-UBEED H M S, WILLS R B H, BOWYER M C, et al. Comparison of hydrogen sulphide with 1-methylcyclopropene (1-MCP) to inhibit senescence of the leafy vegetable, pak choy[J]. Postharvest Biology and Technology, 2018, 137: 129-133.
[7] HASSAN F A S, MAHFOUZ S A. Effect of 1-methylcyclopropene (1-MCP) on the postharvest senescence of coriander leaves during storage and its relation to antioxidant enzyme activity[J]. Scientia Horticulturae, 2012, 141: 69-75.
[8] MASSOLO J F, FORTE L G, CONCELLON A, et al. Effects of ethylene and 1-MCP on quality maintenance of fresh cut celery[J]. Postharvest Biology and Technology, 2019, 148: 176-183.
[9] MENG J, ZHOU Q, ZHOU X, et al. Ethylene and 1-MCP treatments affect leaf abscission and associated metabolism of Chinese cabbage[J]. Postharvest Biology and Technology, 2019, 157: 110963.
[10] PORTER K L, COLLINS G, KLIEBER A. 1-MCP does not improve the shelf-life of Chinese cabbage[J]. Journal of The Science of Food and Agriculture, 2005, 85: 293-296.
[11] 刘红艳, 胡花丽, 罗淑芬, 等. 6-苄氨基嘌呤处理对鲜切西兰花品质的影响[J]. 江苏农业学报, 2018, 34(1): 186-193.
[12] 王瑶, 罗淑芬, 胡花丽, 等. 外源NO处理对采后鲜莲子品质及乙烯代谢的影响[J]. 现代食品科技, 2019, 35(11):100-108.
[13] 高建晓, 刘丹, 古荣鑫, 等. 6-苄氨基嘌呤处理对上海青贮藏品质的影响[J].食品科学, 2015, 36(4): 247-253.
[14] WEI J, MIAO H, WANG Q. Effect of glucose on glucosinolates, antioxidants and metabolic enzymes in brassica sprouts[J]. Scientia Horticulturae, 2011, 129(4): 535-540.
[15] GUO R, YUAN G, WANG Q. Sucrose enhances the accumulation of anthocyanins and glucosinolates in broccoli sprouts[J]. Food Chemistry, 2011, 129(3): 1 080-1 087.
[16] 刘红艳,胡花丽,罗淑芬,等. 6-苄氨基嘌呤减缓鲜切西兰花的衰老机理分析[J].食品科学, 2016, 37(24): 313-321.
[17] 张毅. 叶菜中叶酸含量的HPLC测定条件优化及不同处理方式对叶酸保留效果研究[D]. 杨凌:西北农林科技大学, 2016.
[18] 史君彦, 高丽朴, 左进华, 等. 纳米膜和PVC膜包装对西兰花贮藏保鲜的影响[J]. 食品工业科技, 2016, 37(19): 255-258.
[19] 王亚楠, 胡花丽, 古荣鑫, 等. 不同薄膜包装对桑葚采后品质的影响[J]. 食品科学, 2014, 35(18): 224-229.
[20] JING G X, HUANG H, YANG B, et al. Effect of pyrogallol on the physiology and biochemistry of litchi fruit during storage[J]. Chemistry Central Journal, 2013, 7: 1-11.
[21] SUN B, YAN H Z, LIU N, et al. Effect of 1-MCP treatment on postharvest quality characters, antioxidants and glucosinolates of Chinese kale[J]. Food Chemistry, 2012, 131: 519-526.
[22] FARCUH M, TOUBIANA D, SADE N, et al. Hormone balance in a climacteric plum fruit and its non-climacteric bud mutant during ripening[J]. Plant Science, 2019, 280: 51-65.
[23] CIESLIK E, LESZCZYNSKA T, FILIPIAK-FLORKIEWICZ A, et al. Effects of some technological processes on glucosinolate contents in cruciferous vegetables[J]. Food Chemistry, 2007, 105: 976-981.
[24] YUAN G F, SUN B, YUAN J, et al. Effect of 1-methylcyclopropene on shelf life, visual quality, antioxidant enzymes and health-promoting compounds in broccoli florets[J]. Food Chemistry, 2010, 118: 774-781.
[25] 王友升, 张萌, 王丹, 等. 减压处理对草莓贮藏效果及活性氧代谢影响的多变量解析[J]. 中国食品学报, 2015, 15(6): 231-238.