甘油,又名丙三醇,是葡萄酒中一种重要的组成成分。在发酵初期,葡萄汁中的糖含量较高,导致环境渗透压较高,发酵过程不能正常进行,因此酵母菌会产生甘油来消除这种不利因素的影响[1-2]。葡萄酒中甘油的含量受酵母菌种[3-5]、含糖量[6-7]、温度[8-9]等因素的影响。在发酵过程中,葡萄汁中约有92%的糖经过酒精发酵产生乙醇,剩下8%发酵产生甘油[10],因此除水和乙醇外,甘油是葡萄酒中含量最多的物质[11-12]。葡萄酒中的甘油能改善葡萄酒的口感[13-14],提高葡萄酒中的甘油含量能明显改进葡萄酒的质量[15-16]。在利益驱动作用下,人为添加甘油来提升葡萄酒质量的现象时有发生,这不仅扰乱了葡萄酒市场的良好秩序,对消费者的利益也造成了损害。
目前检测葡萄酒中甘油含量的方法有高效液相色谱法[17-18]、高碘酸钠氧化法[19-20]、分光光度法[21]、甘油激酶法[22-23]等,通过测定甘油与乙醇的比例[24]或甘油与有机酸的比例[18]判断葡萄酒中是否添加了外源甘油,但不能确定外源甘油的来源,对外源甘油掺假判定存在局限性。葡萄酒中的外源甘油可分为工业甘油和纯化甘油[25]。用甲醇使动植物中的甘油三酯发生酯交换生成的工业甘油中含有副产物3-甲氧基-1,2-丙二醇(3-methoxypropane-1,2-diol, 3-MPD),石油化学品合成的工业甘油中会出现杂质环二甘油(cyclic diglycerols,CycDs)(包括6种同分异构体)[10]。因此,通过对3-MPD和CycDs的检测,可以判定葡萄酒中是否添加外源工业甘油。
本研究以国际葡萄与葡萄酒组织(International Vine and Wine Organization,OIV)方法(OIV-MA-AS315-15)为研究基础,在国内首次开展该方法的验证研究,并将比对样品检测结果与德国联邦风险评估研究所(Bundesinstitut für Risikobewertung,BfR)进行对比,该方法为葡萄酒真实性检测标准体系的进一步完善提供了借鉴意义。
1 材料与方法
1.1 材料与试剂
碳酸钾(分析纯)、无水乙醇(分析纯),北京化工厂;乙醚(分析纯),北京市通广精细化工公司;分子筛、丁烷-1,4-二醇-1,1,2,2,3,3,4,4-(2H)8(纯度99%),美国Sigma-Aldrich;环二甘油混合物[纯度89.3%,包括:顺式-,反式-2,6-二(羟甲基)1,4-二氧杂六环;顺式-,反式-2,5-二(羟甲基)1,4-二氧六环;顺式-,反式-2-二(羟甲基)-6-羟基-1,4-二氧环庚烷]、比对葡萄酒样品(编号1、2、3,其中1、3为干型白葡萄酒,2为甜型桃红葡萄酒),德国BfR实验室提供;3-甲氧基-1,2-丙二醇(纯度98%),日本东京化成工业株式会社。
1.2 仪器与设备
GC/MS-QP2010 Plus岛津气相色谱-质谱联用仪,日本岛津公司;XS205电子分析天平,梅特勒—托利多仪器(上海)有限公司;MX-S涡旋振荡器,大龙兴创实验仪器(北京)有限公司;3K15高速离心机,德国Sigma公司。
1.3 试验方法
1.3.1 标准溶液的配制
准确称取3-MPD标准品10.00 mg、丁烷-1,4-二醇-1,1,2,2,3,3,4,4-(2H)8标准品(内标,Internal Standard,IS)10.00 mg、CycDs标准品11.20 mg,分别转移至10 mL容量瓶中,加入无水乙醇定容至刻度,充分混匀,配制成S0储备液(质量浓度为1 000 mg/L)。
准确移取1.00 mL上述 S0储备液至10 mL容量瓶中,用无水乙醇定容至刻度,充分混匀,配制成S1工作液(质量浓度为100 mg/L)。
准确移取0.10 mL上述 S0储备液至10 mL容量瓶中,用无水乙醇定容至刻度,充分混匀,配制成S2工作液(质量浓度为10 mg/L)。
所需配制的标准溶液如表1所示。
表1 所需标准溶液
Table 1 Required standard solutions
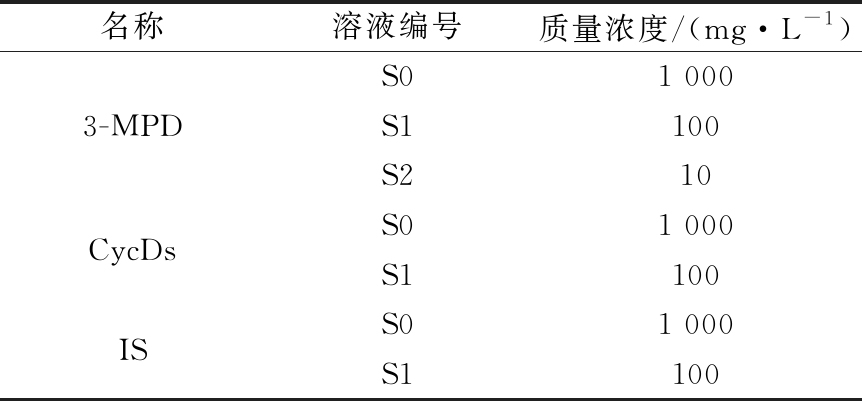
名称溶液编号质量浓度/(mg·L-1)S01 0003-MPDS1100S210CycDsS01 000S1100ISS01 000S1100
1.3.2 标准曲线的配制
在不含目标物质的葡萄酒样品中加入配制好的不同质量浓度、不同体积的标准溶液,加入的标准溶液编号、体积及每个标准曲线点(matrix calibration level, ML 0~5)中标准物质质量浓度如表2所示。
表2 标准曲线配制
Table 2 Standard curve preparation

注:-代表无(下同)
名称加标量/μL标准溶液编号葡萄酒体积/mL葡萄酒中物质质量浓度/(mg·L-1)IS---空白3-MPD--10-CycDs---IS100S11.00ML03-MPD--10-CycDs---IS100S11.00ML13-MPD100S2100.10CycDs50S10.50IS100S11.00ML23-MPD25S1100.25CycDs100S11.00IS100S11.00ML33-MPD50S1100.50CycDs20S02.00IS100S11.00ML43-MPD100S1101.00CycDs30S03.00IS100S11.00ML53-MPD200S1102.00CycDs40S04.00
1.3.3 样品前处理
准确移取10 mL葡萄酒样品和100 μL内标S1工作液(标准曲线样品的配制过程已加入等量内标,无需进行此步骤)至50 mL离心管中。加入10 g K2CO3,涡旋混匀,待K2CO3完全溶解后,冷水降温至20 ℃左右,加入1 mL乙醚,涡旋5 min。4 000 r/min、4 ℃条件下离心5 min,取上清液,加入约120 mg分子筛,加盖保持2 h,期间不时摇匀。取上清液至气相色谱进样瓶中,进行气相色谱-质谱法(gas chromatography-mass spectrometry,GC-MS)分析。
1.3.4 色谱及质谱条件
色谱柱:ZB-Wax plus毛细管柱(60 m×0.25 mm,0.15 μm膜厚);升温程序:90 ℃保持2 min,以10 ℃/min升温至158 ℃,保持6 min,再以4 ℃/min升温至250 ℃,保持5 min,总采集时间为42.8 min,进样口温度250 ℃;载气为氦气,流速1 mL/min;不分流进样,进样量1 μL。
质谱条件:电子轰击离子源;离子源温度230 ℃;选择离子检测模式:0~25 min,m/z 75,m/z 78,m/z 61;25~40 min,m/z 57,m/z 117。
3-MPD定量离子为m/z 75,内标定量离子为m/z 78,CycDs定量离子为m/z 117。
2 结果与分析
2.1 色谱柱选择
分析对比DB-Wax plus毛细管柱(60 m×0.32 mm,0.25 μm膜厚)、ZB-Wax plus毛细管柱(60 m×0.25 mm,0.25 μm膜厚)、ZB-Wax plus毛细管柱(60 m×0.25 mm,0.15 μm膜厚)3种色谱柱的分离性能。结果发现3种色谱柱对3-MPD和内标的分离效果良好,便于定量,但对CycDs的6种组分的分离效果有显著差异:使用前2种色谱柱时不能将CycDs的6个组分完全分离,使用ZB-Wax plus毛细管柱(60 m×0.25 mm,0.15 μm膜厚)能够将目标物质完全分离,峰形良好,如图1所示。

a-DB-Wax(60 m×0.32 mm×0.25 μm);b-ZB-Wax(60 m×0.25 mm×0.25 μm);c-ZB-Wax(60 m×0.25 mm×0.15 μm)图1 不同色谱柱CycDs(10.00 mg/L)色谱图
Fig.1 CycDs(10.00 mg/L)chromatograms of different columns
2.2 方法学评价
2.2.1 线性方程和检出限
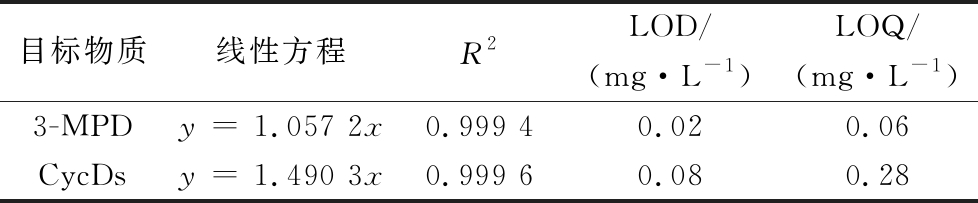
以3-MPD峰面积与内标峰面积之比作为纵坐标,以葡萄酒中3-MPD质量浓度作横坐标,绘制标准曲线;以CycDs峰面积之和与内标峰面积之比作为纵坐标,以葡萄酒中CycDs质量浓度作横坐标,绘制标准曲线。标准曲线方程与R2如表3所示。由表3可
表3 3-MPD和CycDs线性方程、相关系数(R2)、LOD和LOQ
Table 3 Standard curves, correlation coefficients (R2), LODs and LOQs of 3-MPD和CycDs
目标物质线性方程R2LOD/(mg·L-1)LOQ/(mg·L-1)3-MPDy = 1.057 2x0.999 40.020.06CycDsy = 1.490 3x0.999 60.080.28
知,3-MPD和CycDs线性方程分别是y=1.057 2x、y=1.490 3x,R2均>0.999。以3倍信噪比计算仪器的检出限(limit of detection,LOD),10倍信噪比计算仪器的定量限(limit of quantitation,LOQ),3-MPD的检出限和定量限为0.02、0.06 mg/L,CycDs的检出限和定量限为0.08、0.28 mg/L。
2.2.2 回收率
在实验室选择一款不含3-MPD和CycDs的空白葡萄酒样品。按照0.20、0.40、0.60 mg/L 3个水平在空白葡萄酒样品中加入3-MPD标准工作液,按照 0.50、1.00、1.50 mg/L 3个水平在空白葡萄酒样品中加入CycDs标准工作液。每个水平进行了6次测定,计算回收率和相对标准偏差,结果如表4所示。由表4可知,当样品中3-MPD加标水平在0.20~0.60 mg/L时,平均回收率为97.50%~101.11%,RSD为1.70%~6.28%;当样品中CycDs加标水平在0.50~1.50 mg/L时,平均回收率为100.33%~104.67%,RSD为1.46%~7.09%,表明该方法回收率良好。
表4 样品加标回收率(n=6)
Table 4 Recoveries for samples

化合物名称加标量/(mg·L-1)测定值/(mg·L-1)回收率/%RSD/%0.000--3-MPD0.200.20±0.0197.506.280.400.40±0.01100.422.910.600.61±0.01101.111.700.000--CycDs0.500.52±0.03104.676.471.001.00±0.07100.337.091.501.53±0.02102.111.46
2.2.3 精密度分析
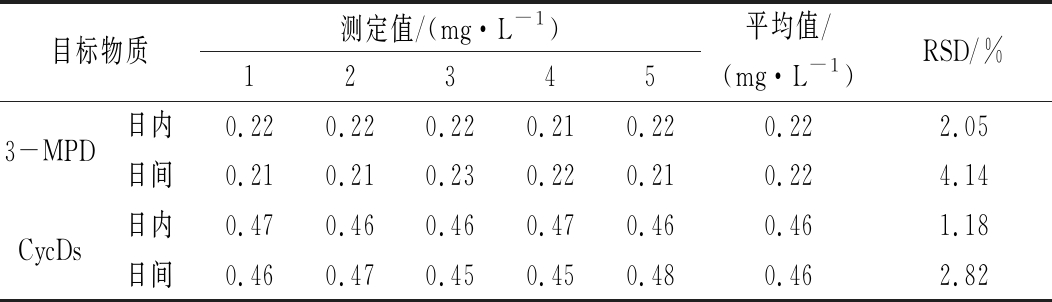
选取比对葡萄酒样品1,经1.3.3处理后,同一天重复测定5次,取平均值,分析方法的日内精密度;连续测定5 d,每天测定5次取平均值,分析方法的日间精密度,结果如表5所示。由表5可知,对于3-MPD,方法的日内精密度和日间精密度分别为 2.05%和4.14%;对于CycDs,方法的日内精密度和日间精密度分别为1.18%和2.82%。
表5 方法日间与日内精密度(n=5)
Table 5 Intra-day and inter-day precisions of the method
目标物质测定值/(mg·L-1)12345平均值/(mg·L-1)RSD/%3-MPD日内0.220.220.220.210.220.222.05日间0.210.210.230.220.210.224.14CycDs日内0.470.460.460.470.460.461.18日间0.460.470.450.450.480.462.82
2.3 实验室间结果比对
德国联邦风险评估研究所(Bundesinstitut für Risikobewertung,BfR)是德意志联邦共和国公法认定的联邦直属有权利能力的机构,其主要研究领域为食品安全、产品安全以及化学品安全,与多个国际性组织和机构展开科研合作。本实验室与BfR对同样的3个葡萄酒样品(编号1、2、3)中可能存在的两类外源工业甘油副产物3-MPD、CycDs进行了定量测定,按照1.3进行标准品溶液和标准曲线的配制,3个比对样品经过前处理后连续测定3次,内标法计算2种物质的含量,结果如表6所示。
由表6可知,1号样品和3号样品均检出3-MPD和CycDs,2号样品两类目标物质均未检出。1号样品3-MPD平均含量为0.21 mg/L,CycDs平均含量为0.47 mg/L。3号样品3-MPD平均含量为0.80 mg/L,CycDs平均含量为0.98 mg/L。2个实验室检测结果无显著性差异(P>0.05),表明该方法能够实现葡萄酒中3-MPD和CycDs含量的准确测定。此外,本实验室与BfR对不同颜色、不同含糖量的葡萄酒样品进行了检测,结果显示该方法适用于不同颜色、不同含糖量的葡萄酒中外源工业甘油副产物的检测。
表6 实验室间比对结果 单位:mg/L
Table 6 Interlaboratory comparison results

注:CNRIFFI代表中国食品发酵工业研究院有限公司;BfR代表德国联邦风险评估研究所;ND代表未检出
目标物质机构样品编号1233-MPDCNRIFFI0.22ND0.79BfR0.20ND0.80CycDsCNRIFFI0.46ND1.03BfR0.47ND0.92
3 结论
本研究验证了一种气相色谱-质谱法测定葡萄酒中外源工业甘油副产物3-MPD和CycDs含量的方法。方法学评价显示,3-MPD在0.10~2.00 mg/L线性良好,方法检出限为0.02 mg/L,加标回收率为97.50%~101.11%,日内精密度与日间精密度分别为2.05%与4.14%;CycDs在0.50~4.00 mg/L线性良好,方法检出限为0.08 mg/L,加标回收率为100.33%~104.67%,日内精密度与日间精密度分别为1.18%与2.82%,方法精密度和准确度良好;与BfR对比,2个实验室检测结果无显著性差异(P>0.05),表明该方法能够实现3-MPD和CycDs含量的准确测定。
本研究实现了国内首次对葡萄酒中外源工业甘油副产物的定量检测,由于外源工业甘油中3-MPD和CycDs的含量尚不明确,无法通过两类副产物的含量反映葡萄酒中非法添加的外源工业甘油的含量,但葡萄酒的发酵过程中不会产生3-MPD和CycDs,因此该方法仍是检验葡萄酒中甘油真实性强有力的工具[10]。国外已有研究表明,葡萄酒酿造过程中酶处理时所使用的试剂中可能含有工业甘油,会导致成品葡萄酒中含有一定量的3-MPD或CycDs,基于此情况,德国葡萄酒管理部门对于葡萄酒中外源工业甘油副产物3-MPD的强制执行限量规定为0.10 mg/L,对CycDs强制执行限量规定为0.50 mg/L。分析表明,我国仍需健全葡萄酒真实性分析方法,进一步完善葡萄酒真实性检测标准体系,加强国内葡萄酒的生产管理和中国葡萄酒市场管理,防范掺假葡萄酒进入国内市场,保护消费者合法权益,营造良好的国内葡萄酒市场环境。
[1] DING Wentao, ZHANG Guochang, LIU Jingjing. 3′ Truncation of the GPD1 promoter in Saccharomyces cerevisiae for improved ethanol yield and productivity[J]. Applied & Environmental Microbiology, 2013, 79(10): 3 273-3 281.
[2] DENADAL E, ALEPUZ P M, POSAS F. Dealing with osmostress through MAP kinase activation[J]. Embo Reports, 2002, 3(8): 735-740.
[3] 郭在力. 菌种及理化条件对冰葡萄酒发酵的影响[D].大连: 大连工业大学, 2016.
[4] GONG Xue, JIANG Lu, LIU Ning, et al. Screening and evaluation of yeast strains for producing wine higher in glycerol and lower in hydrogen sulphide[J]. Food Science, 2015, 36(19): 132-136.
[5] 尤雅, 段长青, 燕国梁. 扁平云假丝酵母与酿酒酵母混合发酵对葡萄酒乙醇含量及香气的影响[J]. 食品科学, 2018, 39(20): 157-165.
[6] 张烨, 孙玉梅, 俞志敏, 等. 糖分对葡萄酒发酵的影响[J]. 食品与发酵工业, 2017, 43(4): 285-290.
[7] BOVO B, NADAI C, VENDRAMINI C, et al. Aptitude of Saccharomyces yeasts to ferment unripe grapes harvested during cluster thinning for reducing alcohol content of wine[J]. International Journal of Food Microbiology, 2016, 236(7): 56-64.
[8] 原苗苗, 赵新节, 孙玉霞. 低温对葡萄酒香气成分和酵母代谢的影响[J]. 食品与发酵工业, 2017, 43(12): 268-276.
[9] ALE C E, BRU E, DE SAAD A M S, et al. Effect of physicochemical factors on glycerol production by simultaneous cultures of wine micro‐organisms using the response surface method[J]. Journal of Applied Microbiology, 2015, 117(5): 1 336-1 347.
[10] FAUHL C, WITTKOWSKI R, LOFTHOUSE J, et al. Gas chromatographic/mass spectrometric determination of 3-methoxy-1,2-propanediol and cyclic diglycerols, by-products of technical glycerol, in wine: Interlaboratory study[J]. Journal of Aoac International, 2004, 87(5): 1 179-1 188.
[11] COMITINI F, GOBBI M, DOMIZIO P, et al. Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae[J]. Food Microbiology, 2011, 28(5): 873-882.
[12] 朱济义, 杜金华, 王秀菊, 等. 葡萄酒中甘油的生成及其影响因素[J]. 酿酒, 2010, 37(2): 23-27.
[13] ZHAO Xiangdong, PROCOPIO S, BECKER T. Flavor impacts of glycerol in the processing of yeast fermented beverages: A review[J]. Journal of Food Science & Technology, 2015, 52(12): 7 588-7 598.
[14] GAWEL R, SLUYTER S V, WATERS E J. The effects of ethanol and glycerol on the body and other sensory characteristics of Riesling wines[J]. Australian Journal of Grape & Wine Research, 2010, 13(1): 38-45.
[15] 郝良敏, 郝良磊, 李晓霞, 等. 酿酒酵母对葡萄酒品质的影响[J]. 河南农业, 2018(27): 43;50.
[16] 李记明, 姜文广. 优质干红葡萄酒中主要质量指标的研究[J]. 中外葡萄与葡萄酒, 2018(6): 18-24.
[17] 刘苑琳, 李辉, 张衡, 等. 葡萄酒活性干酵母直投和活化工艺对酒精发酵的影响[J]. 中国酿造, 2019, 38(9): 102-106.
[18] 刘锐萍, 赵广西, 杨帛, 等. 葡萄酒中有机酸和甘油掺伪鉴别检测方法的研究[J]. 酿酒科技, 2018(1): 41-46.
[19] 陈景桦, 马小琛, 李婷, 等. 优选发酵毕赤酵母与酿酒酵母混合发酵的葡萄酒酿造应用潜力[J]. 食品科学技术学报, 2018, 36(5): 26-34.
[20] 谢诗怡, 韩月, 张烨, 等. 不同有机氮源对葡萄酒发酵的影响[J]. 中国酿造, 2018, 37(4): 38-43.
[21] 张丽萍, 李伟辉, 徐江华. 葡萄酒中乙醇和甘油含量分析方法研究[J]. 食品研究与开发, 2016, 37(1): 174-176.
[22] 赵贝贝, 刘慧燕, 方海田, 等. 基于途径分析的产甘油有孢汉逊酵母菌株的选育[J]. 中国酿造, 2018, 37(7): 132-137.
[23] 刘青, 刘朝霞, 李志勇, 等. 葡萄酒中甘油含量的测定及其在品质鉴别中的应用[J]. 酿酒科技, 2015(1): 77-81.
[24] 刘青, 刘朝霞, 李志勇, 等. 国产葡萄酒中甘油含量的调查与分析[J]. 中国食品卫生杂志, 2015, 27(2): 171-175.
[25] 岳红卫, 郑淼, 郭新光, 等. 葡萄酒真实性及鉴别方法研究[J]. 食品研究与开发, 2017, 38(3): 212-216.