黄曲霉毒素(aflatoxin,AFT)是一类由黄曲霉与寄生曲霉的某些菌株产生的强毒性次级代谢产物[1-2]。目前已分离出的AFT有B1、B2、G1、G2等20多种,其中黄曲霉毒素B1(aflatoxin B1,AFB1)极易污染花生、玉米、大豆以及其他粮油产品,分布范围广,毒性和致癌能力强,与人类的健康密切相关[3]。摄入AFB1的剂量和时间决定了个体的毒性程度,并对罹患肝癌的风险具有累积效应[4]。毋庸置疑,对AFB1的快速高效检测是有效控制AFB1食品污染的关键。
目前检测AFB1最常用的方法是高效液相色谱法[5-7]和液相色谱-质谱法[8-10],这些方法在食品样品中检测AFB1具有高准确性和可重复性,但耗时长、成本高,且预处理过程复杂,很难应用于AFB1污染的现场快速检测[11]。因此,迫切需要建立一种可靠的AFB1的快速定量检测方法,这对保障食品安全和人身健康至关重要。荧光共振能量转移(fluorescence resonance energy transfer,FRET)是一种均相分析检测技术,具有灵敏度高,操作简单方便的优点,目前已被用于检测氯噻啉[12],双酚A[13],蛋白质[14-15]等物质。对于提高FRET的效率,供体和受体的选择尤为关键。相较于传统的有机染料以及半导体量子点等下转换荧光供体,上转换荧光纳米颗粒(up-conversion nanoparticles, UCNPs)因其优异的光化学特性备受研究者青睐,UCNPs在980 nm近红外光激发下,能发出一种短波长、反斯托克斯定律的荧光[16],能避免待测样品的自发荧光所导致的背景干扰[17],因此,UCNPs可在FRET体系中作为一种理想的能量供体。目前,基于UCNPs的FRET方法在食品安全尤其是真菌毒素检测中还鲜有报道。与此同时,金纳米颗粒(gold nanoparticles,AuNPs)的吸收峰与UCNPs的荧光发射光谱有很大程度的重合,可见光吸收范围宽,猝灭效率和消光系数较高[18]。因此,UCNPs与AuNPs可形成FRET体系。
本研究利用UCNPs和AuNPs,构建了一种基于FRET的免疫传感器用于AFB1检测。UCNPs和AuNPs通过AFB1抗原、抗体组装在一起时,发生FRET过程,导致UCNPs荧光猝灭。当AFB1存在时,会与AFB1抗原竞争抗体,抑制了FRET过程。反应体系的荧光强度与AFB1浓度在一定范围内呈正相关,基于此,该方法实现对AFB1的快速定量检测,具有操作简便、灵敏度高的特点。
1 材料与方法
1.1 材料与试剂
六水合氯化钇(YCl3·6H2O)、1-十八烯(1-ODE)、六水合氯化镱(YbCl3·6H2O)、油酸(oleic acid,OA)、六水合物氯化铒(ErCl3·6H2O)、1-乙基-3-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(1-(3-dimethylaminopropy)-3-ethylcarbodiimide hydro chloride,EDC)、聚丙烯酸(acrylicacid acid polymers,PAA)、硫代羟基琥珀酰亚胺(suflo-NHS)、NaOH、氟化铵、柠檬酸三钠、氯金酸、十二水合磷酸氢二钠、二水磷酸二氢钠、无水乙醇、无水甲醇、环己烷、三氯甲烷、浓HCl、硼酸、牛血清白蛋白(borine serum albumin,BSA),国药集团化学试剂有限公司;AFB1标准品、交链孢酚单甲醚(alternariol monomethyl ether, AME)标准品、赭曲霉毒素A (ochratoxin A, OTA)标准品、杂色曲霉毒素(sterigmatocystin, ST)标准品、交链孢酚(alternaria, AOH)标准品,国家标准物质中心;AFB1抗原、AFB1抗体,生工生物工程(上海)股份有限公司。
1.2 仪器与设备
F96PRO型荧光分光光度计,上海棱光技术有限公司;MDL-Ⅲ-980-2W型激光发射器,中国长春新产品光电技术有限公司;UV-1800型紫外可见光分光光度计,日本岛津公司;JEOLJEM-2100型透射电子显微镜,日本电子株式会社;Zetasizer nano型激光粒度散射仪,英国Malvern公司。
1.3 试验原理
基于抗原修饰的UCNPs与抗体修饰的AuNPs之间的荧光共振能量转移构建免疫检测平台。如图1所示,UCNPs和AuNPs分别和AFB1抗原、AFB1抗体偶联,实现功能化。当检测体系中不存在AFB1时,AFB1抗原和抗体的免疫结合拉近了UCNPs和AuNPs的距离(1~10 nm),发生FRET过程,引起UCNPs荧光猝灭;当检测体系中存在AFB1时,AFB1与UCNPs-抗原竞争性地结合AuNPs-抗体,从而抑制了FRET过程。以980 nm激发光激发,体系的荧光信号值随着AFB1含量增加而增加。因此,可根据体系543 nm处荧光值与AFB1的质量浓度绘制标准曲线,实现对AFB1的定量分析。
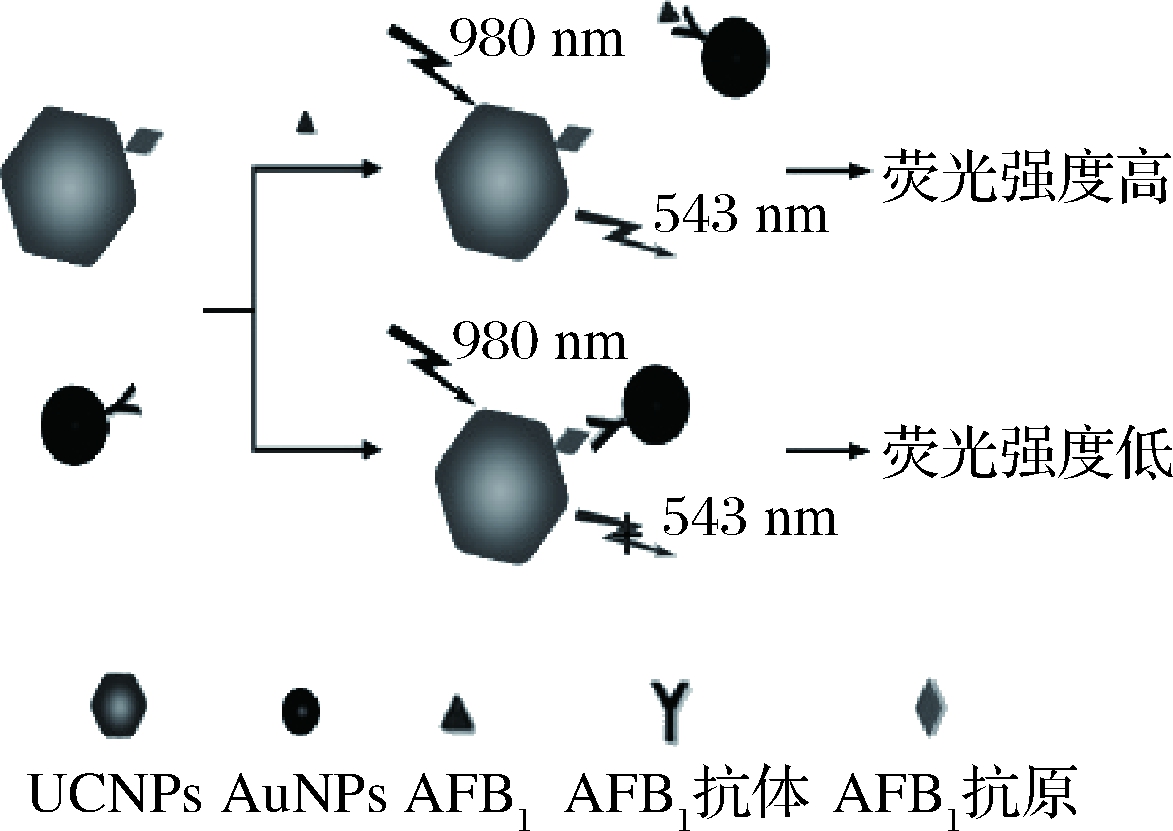
图1 免疫传感器检测黄曲霉毒素B1原理图
Fig.1 Schematic diagram of the immunosensor for the detection of AFB1
1.4 试验方法
1.4.1 水溶性UCNPs的制备
油溶性UCNPs的制备:根据LI等[19]采用的高温热分解法制备油溶性UCNPs。
水溶性UCNPs的制备:OA-UCNPs在水中的分散性极差,需要对材料表面进行PAA修饰转换成水溶性UCNPs进行后续实验[13]。根据DAI等[20]报道的方法将OA-UCNPs转为PAA-UCNPs。
1.4.2 AuNPs的制备
根据文献[21]采用柠檬酸钠还原法制备AuNPs。
1.4.3 能量供体探针的制备
用AFB1抗原对UCNPs进行功能化修饰制备能量供体探针:取0.2 mg UCNPs和EDC(0.75 mg/mL)混合,然后加入sulfo-NHS(0.5 mg/mL)摇床2 h对材料进行活化。离心后用PBS缓冲液(0.01 mol/L,pH=7.4)复溶沉淀。加入含4 μg抗原的PBS缓冲液,摇床2 h后加入1 mL BSA质量分数为1%的PBS缓冲液封闭30 min。离心收集沉淀重悬于PBS缓冲液中,4 ℃避光储存备用。
1.4.4 能量受体探针的制备
用AFB1抗体对AuNPs进行功能化修饰制备能量受体探针:取1 mL AuNPs溶液加入6 μL K2CO3溶液(0.1 mol/L),然后加入6 μg抗体,摇床1 h。加入50 μL 质量分数为10%的BSA溶液封闭2 h。9 000 r/min离心25 min,用BSA质量分数为1%的硼酸盐缓冲液(borate buffer,BB)溶液(2 mmol/L,pH=8.2)清洗1次,重悬于1 mL海藻糖质量分数为5%的BB溶液。
1.4.5 标准曲线的绘制
取100 μL不同质量浓度的AFB1标准溶液(0.05、0.1、0.5、1、5、10、20 ng/mL),分别与450 μL UCNPs-抗原混合,室温下混匀。分别加入450 μL AuNPs-抗体,室温摇床混合2 h。荧光分光光度计测定体系在543 nm处的荧光强度。以荧光强度和AFB1质量浓度绘制标准曲线,并确定检测范围和最低检出限(3σ/S,其中σ为空白多次测量的标准偏差,S为方法的灵敏度,即校准曲线的斜率)。
1.4.6 特异性实验
分别配制质量浓度为20 ng/mL的AFB1、AME、OTA、ST、AOH标准品溶液。利用上述免疫检测方法测定荧光强度,通过比较评价该AFB1免疫传感器的特异性。
1.4.7 加标回收实验
对自来水、花生油样品进行加标回收实验。花生油经适当的前处理:取1 g花生油样于10 mL离心管中,加入4 mL甲醇-水溶液(体积比7∶3),漩涡振荡混匀后再置于摇床中孵育20 min,6 000 r/min离心10 min,取上清液备用。将质量浓度为0.1、1、10 ng/mL AFB1标准溶液分别添加到提取液中,得到待测样品溶液。利用上述免疫传感器检测AFB1的质量浓度,计算回收率。
2 结果与分析
2.1 功能化AuNPs和功能化UCNPs的表征
材料的分散性会影响到纳米材料的功能化修饰和特异性竞争结合,若材料粒径过大会容易导致聚沉,无法满足检测要求[13]。如图2-a所示,功能化AuNPs呈球形,这种纳米材料的尺寸相对均匀、一致,平均粒径为17 nm;如图2-b所示,功能化UCNPs呈现正六边形,在水中的分散性良好,平均粒径为180 nm;如图2-c所示,当体系中不存在目标物时,功能化UCNPs和功能化AuNPs通过抗原-抗体特异性识别发生免疫结合形成AuNPs-UCNPs复合物,平均粒径为200 nm。AuNPs与UCNPs的距离(1~10 nm)满足形成FRET体系的条件。

a-功能化AuNPs;b-功能化UCNPs;c-AuNPs-UCNPs复合物图2 功能化AuNPs、功能化UCNPs、AuNPs-UCNPs复合物的透射电镜图
Fig.2 TEM images of functionized AuNPs, functionized UCNPs and AuNPs-UCNPs nanocomposites
动态光散射(dynamic light scattering,DLS)测得的结果是流体动力学直径,通常测得的粒子尺寸比透射电镜(transmission electron microscope,TEM)测得结果要略大,但仍可用来定性表征粒子的尺寸变化[22]。如图3所示,功能化AuNPs、功能化UCNPs、AuNPs-UCNPs复合材料的粒径分布均接近正态分布,表明这几种材料均呈现良好的分散性,平均水合粒径分别为80、210、295 nm,再次证明功能化AuNPs和功能化UCNPs通过免疫结合形成了AuNPs-UCNPs复合物。
2.2 UCNPs与AuNPs的能量转移
如图4所示,UCNPs在980 nm激发光照射下的荧光发射光谱在525,543和659 nm附近有3个吸收峰,分别对应掺杂Er3+离子2H11/2→4I15/2(绿光区),4S3/2→4I15/2(绿光区)和4F9/2→4I15/2(红光区)的能级跃迁[14]。突出的绿色发射表明UCNPs可作为FRET体系中的能量供体。AuNPs在520 nm附近显示出强而宽的吸收带,因此AuNPs可作为潜在的能量受体或猝灭剂。此外,AuNPs的紫外-可见光吸收光谱与UCNPs的荧光发射光谱有较好的重叠,这使得UCNPs和AuNPs之间发生FRET过程成为可能。
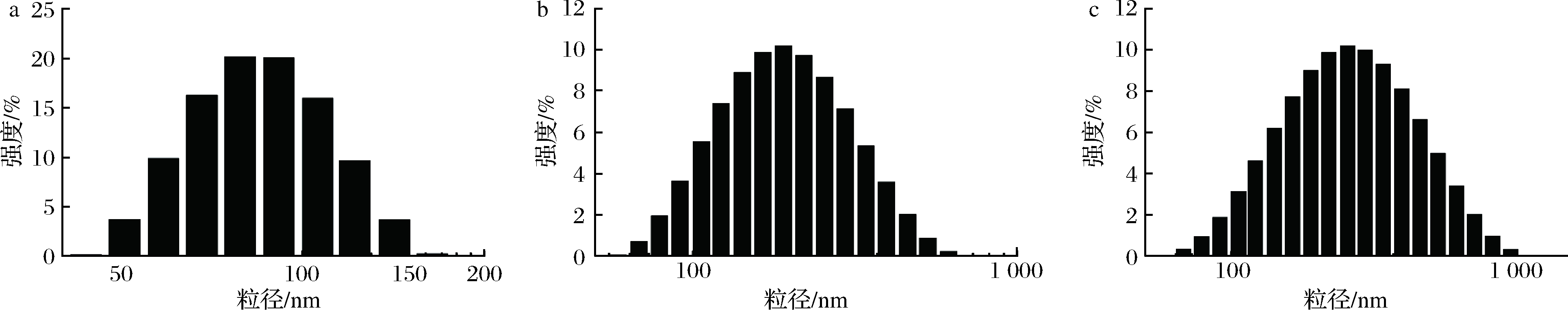
a-功能化AuNPs;b-功能化UCNPs;c-AuNPs-UCNPs复合物图3 功能化AuNPs,功能化UCNPs,AuNPs-UCNPs复合物的水合粒径图
Fig.3 DLS images of functionized AuNPs, functionized UCNPs and AuNPs-UCNPs nanocomposites
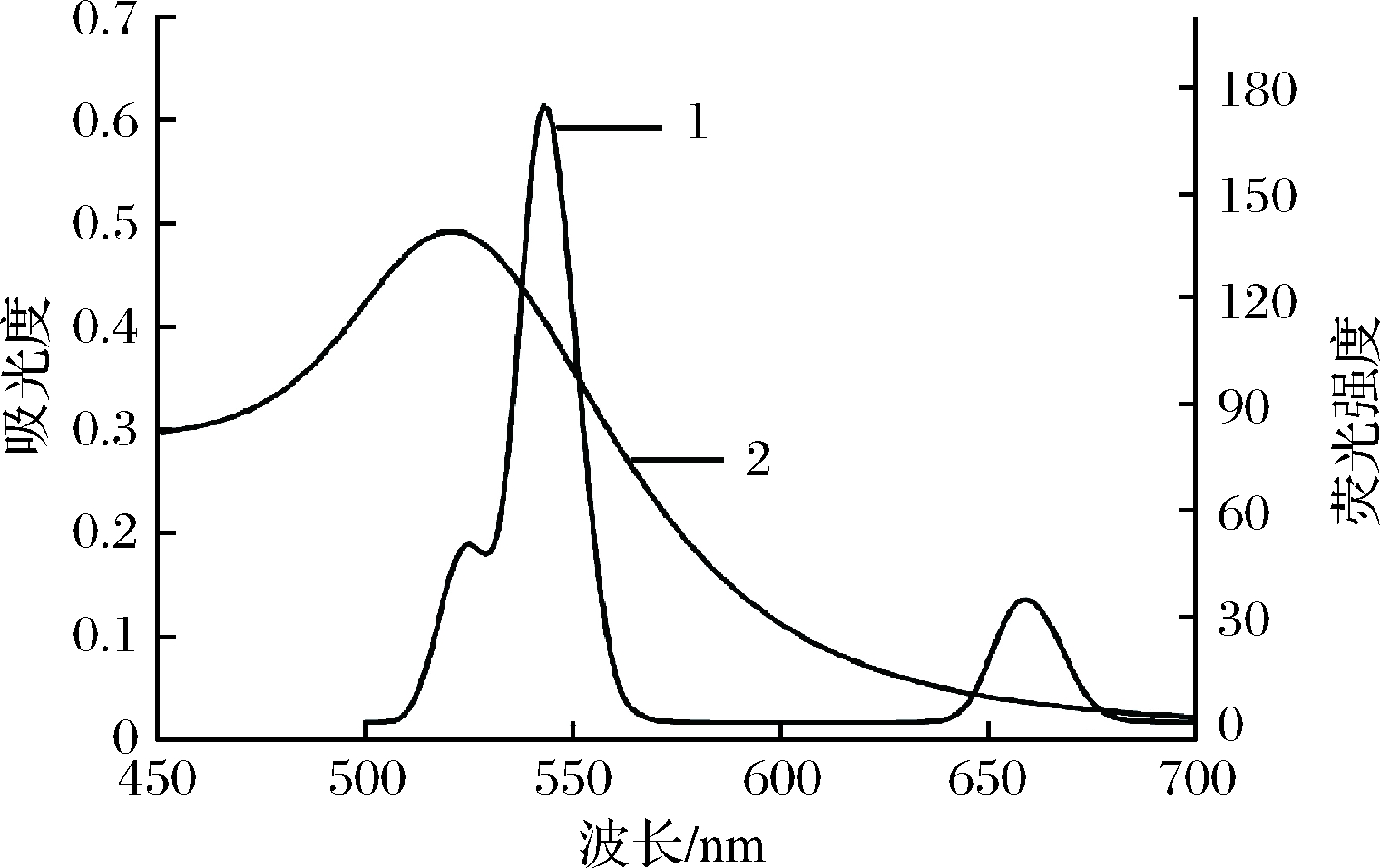
1-UCNPs的荧光发射光谱;2-AuNPs的紫外-可见吸收光谱图4 UCNPs的荧光发射光谱与AuNPs的紫外-可见吸收光谱图
Fig.4 Fluorescence spectra of UCNPs and UV-vis absorption spectra of AuNPs
2.3 工作曲线与检出限
通过AFB1与UCNPs-抗原竞争性地结合AuNPs-抗体,抑制FRET过程,考察不同质量浓度AFB1对体系荧光强度的影响。由图5可知,随着AFB1质量浓度的增加,543 nm处的荧光强度逐渐提高,荧光强度与AFB1质量浓度呈正相关。荧光强度与AFB1质量浓度在0.05~20 ng/mL存在线性关系:y=2.084 ln(x) + 57.278(R2=0.990 9),最低检出限为0.02 ng/mL(3σ/S)。如表1所示,与检测AFB1的其他方法作比较,发现该方法的检测限较低,检测范围较宽,优势明显。
表1 几种检测AFB1的方法比较
Table 1 Comparison of several detection methods of AFB1

方法检测范围/(ng·mL-1)检测限/(ng·mL-1)文献电化学方法0.1~1.10.05[23]高效液相色谱法5~1000.57[24]电化学方法2 000~7 000890[25]高效液相色谱法0.5~50.02[26]电化学方法0.125~160.12[17]荧光共振能量转移法0.05~200.02本研究

图5 不同AFB1质量浓度对应的荧光发射光谱图
Fig.5 Fluorescence spectra corresponding to different AFB1 concentrations
2.4 特异性分析
选用AME、OTA、ST、AOH作为常见的可能存在的共存毒素进行特异性测试和抗干扰能力检测[27-28]。如图6所示,当检测物为AFB1时,AFB1与特异性抗体高效结合,反应体系荧光响应值较高;当检测干扰毒素时,反应体系的荧光响应值不足AFB1信号值的1/30,说明这些干扰毒素不能起到恢复反应体系荧光强度的作用,该AFB1免疫检测方法特异性良好。抗体的特异性识别作用保证了该检测方法的特异性,该检测方法受环境影响较小。
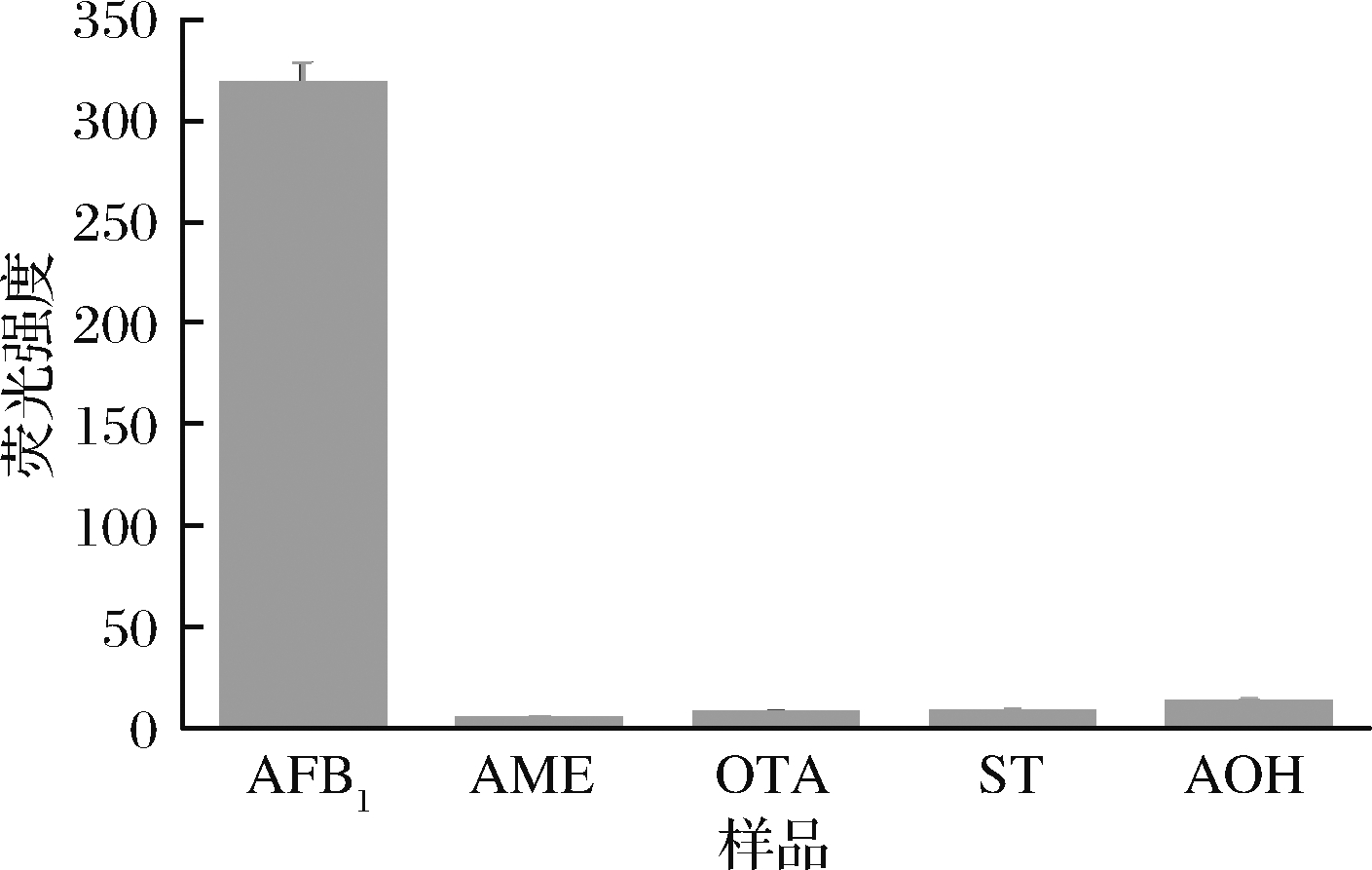
图6 检测不同毒素时反应体系在543 nm处的荧光信号强度
Fig.6 The fluorescence intensity of reaction system at 543 nm when different toxins were detected
2.5 加标回收实验
为进一步检验该检测体系的可靠性与实用性,分别对油相(花生油)和水相(自来水)样品进行了加标回收试验。实验结果如表2所示,利用传感器检测花生油和自来水的加标回收率分别在107%~112%和106%~110%,这说明所建立的方法可用于真实复杂样品中AFB1的测定,准确可靠。
表2 样品中AFB1的加标回收实验(n=3)
Table 2 Recovery results of added standard AFB1 in samples
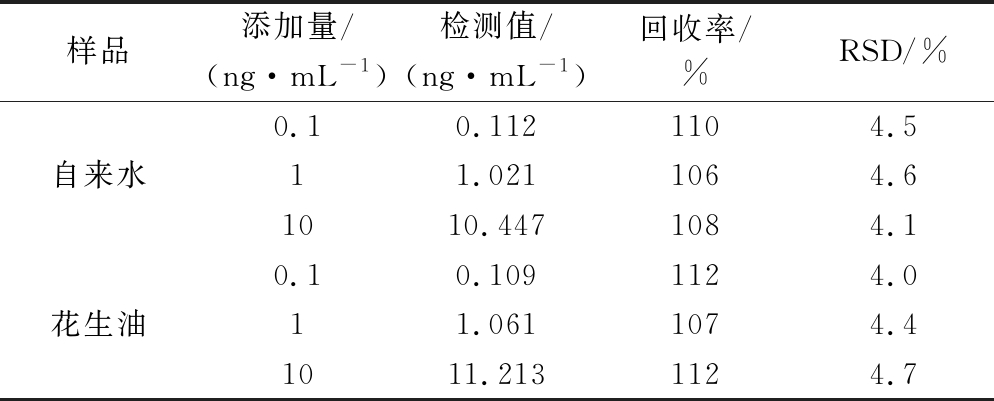
样品添加量/(ng·mL-1)检测值/(ng·mL-1)回收率/%RSD/%0.10.1121104.5自来水11.0211064.61010.4471084.10.10.1091124.0花生油11.0611074.41011.2131124.7
3 结论
本研究制备UCNPs能量供体探针和AuNPs能量受体探针,构建了一种基于FRET的免疫传感器用于检测AFB1。体系中的荧光强度信号值与AFB1质量浓度在0.05~20 ng/mL呈线性正相关:y=2.084 ln(x)+57.278(R2=0.990 9),检测限为0.02 ng/mL。将该方法用于实际样品分析时可获得较好的回收率,可用于食品中AFB1的快速定量检测,为开发灵敏、快速、高选择性的食品安全生物传感器开辟了新的路径。
[1] JAISWAL P, JHA S N, KAUR J, et al. Detection of aflatoxin M1 in milk using spectroscopy and multivariate analyses[J]. Food Chemistry, 2018, 238: 209-214.
[2] SUN L, ZHAO Q. Competitive horseradish peroxidase-linked aptamer assay for sensitive detection of Aflatoxin B1[J]. Talanta,2018,179:344-349.
[3] 郑郁媛,林芬,邱伟,等.黄曲霉毒素毒作用机制研究进展[J]. 赣南医学院学报, 2018, 38(11): 112-116.
[4] OJIAMBO P S, BATTILANI P, CARY J, et al. Cultural and genetic approaches to manage aflatoxin contamination: Recent insights provide opportunities for improved control[J]. Phytopathology, 2018, 108(9): 1 024-1 037.
[5] LI Y F, DU Y, ZHAO J J, et al. A dilute-and-shoot based UPLC-MS/MS method for multimycotoxins analysis in astragali radix[J]. Journal of Aoac International, 2019, 102(4): 1 186-1 193.
[6] DU X, SCHRUNK D E, IMERMAN P M, et al. Evaluation of a diagnostic method to quantify aflatoxins B1 and M1 in animal liver by high-performance liquid chromatography with fluorescence detection[J]. Journal of Aoac International, 2019, 102(5): 1 530-1 534.
[7] LIU Y, LI W, DING Z, et al. Three-dimensional ordered macroporous magnetic photonic crystal microspheres for enrichment and detection of mycotoxins (Ⅱ): The application in liquid chromatography with fluorescence detector for mycotoxins[J]. Journal of Chromatography A, 2019, 1 604:460 475.
[8] HOUISSA H, LASRAM S, SULYOK M, et al. Multimycotoxin LC-MS/MS analysis in pearl millet (Pennisetum glaucum) from Tunisia[J]. Food Control, 2019, 106:106 738.
[9] LI R, MENG C, WEN Y, et al. Fluorometric lateral flow immunoassay for simultaneous determination of three mycotoxins (aflatoxin B1, zearalenone and deoxynivalenol) using quantum dot microbeads[J]. Microchimica Acta, 2019, 186(12):1-9.
[10] OUAKHSSASE A, CHAHID A, CHOUBBANE H, et al. Optimization and validation of a liquid chromatography/tandem mass spectrometry (LC-MS/MS) method for the determination of aflatoxins in maize[J]. Heliyon, 2019, 5(5): e01 565.
[11] ZHAO Z, YANG H, DENG S, et al. Intrinsic conformation response-leveraged aptamer probe based on aggregation-induced emission dyes for aflatoxin B1 detection[J]. Dyes and Pigments, 2019, 171: 107 767.
[12] YOU H, HUA X, FENG L, et al. Competitive immunoassay for imidaclothiz using upconversion nanoparticles and gold nanoparticles as labels[J]. Microchimica Acta, 2017, 184(4): 1 085-1 092.
[13] 许宙, 鲁士珍, 陈茂龙, 等. 基于上转换纳米粒子与金纳米粒子构建荧光共振能量转移体系检测双酚A方法研究[J]. 食品与机械, 2018, 34(9): 83-87.
[14] LI X H, SUN W M, WU J, et al. An ultrasensitive fluorescence aptasensor for carcino-embryonic antigen detection based on fluorescence resonance energy transfer from upconversion phosphors to Au nanoparticles[J]. Analytical Methods, 2018, 10(13): 1 552-1 559.
[15] LONG Q, ZHAO J, YIN B, et al. A novel label-free upconversion fluorescence resonance energy transfer-nanosensor for ultrasensitive detection of protamine and heparin[J]. Analytical Biochemistry, 2015, 477: 28-34.
[16] 高志贤. 食品安全快速检测新技术及新材料[M]. 北京: 科学出版社, 2015.
[17] 张莹莹, 钱志娟, 谢正军, 等. 基于上转换荧光纳米粒子和金纳米粒子间荧光共振能量转移的高灵敏赭曲霉毒素A检测方法研究[J]. 分析测试学报, 2018, 37(1): 31-38.
[18] LI Y, CAI J, LIU F, et al. Construction of a turn off-on fluorescent nanosensor for cholesterol based on fluorescence resonance energy transfer and competitive host-guest recognition[J]. Talanta, 2019, 201: 82-89.
[19] LI Z Q, ZHANG Y. An efficient and user-friendly method for the synthesis of hexagonal-phase NaYF4:Yb, Er/Tm nanocrystals with controllable shape and upconversion fluorescence[J]. Nanotechnology, 2008, 19(34): 345 606.
[20] DAI S L, WU S J, DUAN N, et al. An ultrasensitive aptasensor for Ochratoxin A using hexagonal core/shell upconversion nanoparticles as luminophores[J]. Biosensors & Bioelectronics, 2017, 91: 538-544.
[21] AMBROSI A, CASTA EDA M T, KILLARD A J, et al. Double-codified gold nanolabels for enhanced immunoanalysis[J]. Analytical Chemistry, 2007, 79(14): 5 232-5 240.
EDA M T, KILLARD A J, et al. Double-codified gold nanolabels for enhanced immunoanalysis[J]. Analytical Chemistry, 2007, 79(14): 5 232-5 240.
[22] SHE W, LUO K, ZHANG C, et al. The potential of self-assembled, pH-responsive nanoparticles of mPEGylated peptide dendron-doxorubicin conjugates for cancer therapy[J]. Biomaterials, 2013, 34(5): 1 613-1 623.
[23] 王瑞鑫, 张微, 李书国. 基于纳米材料构建免疫传感器快速测定粮油食品中的黄曲霉毒素B1[J]. 粮食与油脂, 2016, 29(1): 62-66.
[24] 韩现文, 钟其顶, 吕志远, 等. SPE-HPLC/FLD测定高粱中黄曲霉毒素B1方法研究[J]. 酿酒科技, 2014(5): 92-95.
[25] 刘晓伟, 王静静, 潘路路. 基于电化学方法检测花生油中黄曲霉毒素B1[J]. 分析试验室, 2017, 36(4): 452-455.
[26] 刘柱, 陈万勤, 沈潇冰, 等. 多功能柱净化-柱后光化学衍生-高效液相色谱法同时检测玉米和花生中9种真菌毒素[J]. 分析科学学报, 2014, 30(2): 168-172.
[27] 郭婷, 林淑凤, 马良, 等. 基于磁性纳米材料和适配体的荧光传感器检测牛奶中黄曲霉毒素M1[J]. 食品与发酵工业, 2019, 45(5): 218-223.
[28] 刘微, 张景, 李姝荟, 等. 基于交流电动作用的免疫传感器快速高灵敏检测花生油中的黄曲霉毒素B1[J]. 食品与发酵工业, 2019:45(22):248-254.