食源性低聚肽具有增强免疫力、抗氧化、辅助调节血糖、血脂、血压等多种生理功能。有研究证明人体内存在小肽转运系统以及相关的载体蛋白,这打破了蛋白只有被消化成为氨基酸才能被吸收利用的旧观点,与蛋白质和氨基酸相比,低聚肽具有更高的吸收效率,部分小肽可以进入细胞或血液发挥其生理活性[1-2]。乳清蛋白是干酪生产过程中的副产品,含有多种活性成分,具有营养价值高、低脂肪、低胆固醇等特点。乳清蛋白经生物酶解后得到乳清低聚肽,能够改善其乳化性、起泡性等性能,降低或消除致敏性,更易于被人体吸收和利用[3-4]。
血管紧张素转化酶(angiotensin converting enzyme,ACE),是人体血压调节的一种关键限速酶。ACE抑制肽是具有ACE抑制活性的肽类物质,一方面能够阻止ACE催化舒缓激肽的水解,使其具有正常的收缩血管能力,另一方面还能阻止ACE催化血管紧张素Ⅰ转化为具有收缩血管能力的血管紧张素Ⅱ,降血压作用显著[5-6]。此外,与降压药物不同,ACE抑制肽具有安全性高、毒副作用小、可长期食用等优点,因此食源性ACE抑制肽成为近年来的研究焦点。
目前国内外关于乳清低聚肽的ACE抑制作用的研究相对较少,另外,乳清低聚肽作为食品原料,加工条件是否影响其稳定性目前尚不明确。本研究以乳清蛋白粉为原料,通过酶法制备乳清低聚肽,评价乳清低聚肽的ACE抑制作用和体外稳定性,为乳清蛋白粉的高值利用以及乳清低聚肽作为降血压保健食品的应用提供理论与技术支持。
1 材料与方法
1.1 材料与仪器
乳清蛋白粉,北京中食海氏生物技术有限公司;TSKgel G2000 SWXL(300 mm×7.8 mm),东曹(上海)生物科技有限公司;碱性蛋白酶、中性蛋白酶,美国Amresco公司;乙氨酸-乙氨酸-乙氨酸(分子质量189 u)、乙氨酸-乙氨酸-酪氨酸-精氨酸(分子质量451 u)、杆菌酶(分子质量1 450 u)、细胞色素C(分子质量12 500 u)、ACE(50 mU)、马尿酰组氨酰亮氨酸(N-Hippuryl-His-Leu,HHL),美国Sigma-Aldrich公司;甲醇,美国Fisher Scientific公司;三氟乙酸,阿法埃莎(天津)化学有限公司;卡托普利(25 mg/片),北京曙光药业公司。
HH-501型超级恒温水浴锅,常州国宇仪器制造有限公司;LC-20A高效液相色谱仪,日本SHIMADZU公司;DHG-9075A电热恒温鼓风干燥箱,北京陆希科技有限公司;835-50型氨基酸分析仪,日本HITACHI公司;SZC-C脂肪测定仪,上海纤检仪器有限公司;L5/11/P33马弗炉,德国纳博热公司;AB104-N电子天平,梅特勒-托利多仪器(上海)公司。
1.2 方法
1.2.1 乳清低聚肽的制备工艺
称取100 g乳清蛋白粉溶解于1 000 mL去离子水中,90 ℃水浴10 min后冷却至55 ℃,用NaOH溶液调节溶液pH值至8.5,以3 000 U/g蛋白质的酶量加入碱性蛋白酶,酶解反应3 h,酶解过程中加入NaOH溶液保证pH值稳定。然后用HCl溶液调节pH值至7,温度为50 ℃,按照2 000 U/g蛋白质的酶量加入中性蛋白酶,酶解反应2 h。酶解结束后,沸水浴灭酶15 min。冷却至室温后,用离心机10 000×g离心20 min,取上清液用截留分子质量为1 000 u的超滤膜超滤,进行冷冻干燥,即得到乳清低聚肽粉。
1.2.2 基础理化成分测定
总蛋白质:GB 5009.5—2016;酸溶蛋白:GB/T22729—2008;水分:GB 5009.3—2016;灰分:GB 5009.4—2016;脂肪:GB 5009.6—2016[7-11]。
1.2.3 氨基酸组成测定
参照GB 5009.124—2016规定的方法对乳清低聚肽的氨基酸组成进行分析[12]。
1.2.4 分子质量分布测定
通过反相高效液相色谱法(RP-HPLC)进行分子质量分布分析。色谱柱:TSKgel G2000 SWXL 300 mm×7.8 mm;流动相为V(乙腈)∶V(水)=45∶55(含0.1%三氟乙酸);流速0.5 mL/min;进样体积10 μL;检测波长220 nm;柱温30 ℃。用流动相将样品质量浓度配制为1.0 mg/mL,经孔径0.2 μm聚四氟乙烯滤膜过滤后,进行凝胶过滤,用GPC软件处理色谱数据。同时制作相对分子质量标准曲线:以细胞色素C(分子质量12 500 u)、杆菌酶(分子质量1 450 u)、乙氨酸-乙氨酸-酪氨酸-精氨酸(分子质量451 u)、乙氨酸-乙氨酸-乙氨酸(分子质量189 u)为标准品溶液[13]。
1.2.5 ACE抑制活性测定
利用RP-HPLC测定乳清低聚肽的ACE抑制率[14-15]。配制0.05 mol/L的硼酸缓冲液(含0.3 mol/L NaCl,pH 8.3),利用缓冲液配制7.6 mmol/L的HHL溶液和50 mU/mL的ACE溶液。将样品溶液20 μL与ACE溶液30 μL混合,37 ℃预热5 min。加入HHL溶液50 μL,37 ℃反应30 min。反应结束后,立即加入1 mol/L的HCl溶液100 μL终止反应,加入硼酸缓冲液至体积为400 μL,上机进行RP-HPLC检测。色谱条件:流动相A,V(水)∶V(甲醇)=70∶30(含0.1%三氟乙酸和0.05%乙酸);流动相B,V(水)∶V(甲醇)=20∶80(含0.1%三氟乙酸和0.05%乙酸);梯度洗脱条件:0~2.50 min,0%~0%流动相B;2.51~4.50 min,100%~100%流动相B;4.51~15 min,0%~0%流动相B;进样体积100 μL;流速1.0 mL/min;柱温30 ℃;检测波长227 nm。ACE抑制率计算如公式(1)所示:
ACE抑制率![]()
(1)
式中:M为空白对照组中马尿酸的峰面积(mAU·s);N为添加样品组中马尿酸的峰面积(mAU·s)。
1.2.6 酸碱稳定性实验
用去离子水配制2 mg/mL的乳清低聚肽溶液,置于离心管中,分别用1 mol/L HCl和 1 mol/L NaOH调节pH值为2、4、6、8、10,37 ℃水浴锅中放置2 h,冷却至室温后分别测定其ACE抑制活性和分子质量分布[16-17]。
1.2.7 热稳定性实验
用去离子水配制2 mg/mL的乳清低聚肽溶液,置于离心管中,放入水浴锅中,分别于30、40、60、80、100 ℃下水浴中保温2 h,冷却至室温,分别测定其ACE抑制活性和分子质量分布[16-17]。
1.2.8 体外模拟胃肠道消化实验
1.2.8.1 胃蛋白酶消化实验
用去离子水配制2 mg/mL的乳清低聚肽溶液,置于离心管中,用1 mol/L HCl溶液调节pH值为2,在37 ℃水浴条件下预热5 min,加入3%(E/S)胃蛋白酶,混匀后在37 ℃水浴条件下消化3 h,立即沸水浴灭酶10 min,冷却后分别测定其ACE抑制活性和分子质量分布[16-17]。
1.2.8.2 胰蛋白酶消化实验
用去离子水配制2 mg/mL的乳清低聚肽溶液,置于离心管中,用1 mol/L NaOH溶液调节pH值为6.8,在37 ℃水浴条件下预热5 min,加入3%(E/S)胰蛋白酶,混匀后在37 ℃水浴条件下消化3 h,立即沸水浴灭酶10 min,冷却后分别测定其ACE抑制活性和分子质量分布[16-17]。
1.2.8.3 胃蛋白酶消化后再胰蛋白酶消化实验
按照1.2.8.1的方法进行胃蛋白酶消化后,用1 mol/L NaOH溶液调节pH值为6.8,在37 ℃水浴条件下预热5 min,加入3%(E/S)胰蛋白酶,混匀后在37 ℃水浴条件下消化3 h,立即沸水浴灭酶10 min,冷却至室温后分别测定其ACE抑制活性和分子质量分布[16-17]。
1.2.9 数据分析
使用Origin 8.0软件处理数据。实验的所有定量数据均为平均值±标准偏差。
2 结果与分析
2.1 乳清低聚肽的基础理化成分
乳清低聚肽的总蛋白质含量(质量分数)为(71.83±0.37)%,其中酸溶蛋白含量(质量分数)为(61.71±2.42)%,占总蛋白含量的85.9%。研究表明,可溶于酸性溶液的主要是小分子肽类物质及氨基酸,分子质量较大的蛋白质遇酸会产生沉淀[18],这说明乳清低聚肽的主要成分是小分子肽类物质和氨基酸。其余成分中,水分含量(4.86±0.23)%,灰分含量(5.23±0.10)%,脂肪含量(0.21±0.05)%(均为质量分数)(表1)。
表1 乳清低聚肽的基础理化成分
Table 1 Basic physical and chemical components of whey oligopeptides

成分含量(质量分数)/%总蛋白质71.83±0.37酸溶蛋白61.71±2.42水分4.86±0.23灰分5.23±0.10脂肪0.21±0.05
2.2 乳清低聚肽的氨基酸组成
乳清低聚肽的氨基酸组成较为完善,谷氨酸、亮氨酸、天冬氨酸、赖氨酸、苏氨酸、缬氨酸、异亮氨酸和脯氨酸含量比较丰富。此外,必需氨基酸含量也很丰富,高达46.47%(表2)。丰富的氨基酸组成能够对人体起到重要的调节生理机能的作用,例如谷氨酸是一种重要的神经递质,能够维持中枢神经细胞信号传导,参与脑内蛋白质和糖的代谢[19];亮氨酸是一种支链氨基酸,与异亮氨酸和缬氨酸一起能够修复肌肉、控制血糖,并给身体组织提供能量[20]。肽的生理功能与氨基酸的种类和数量有一定关系,梁婷婷等[21]对植物蛋白、红肉蛋白和白肉蛋白酶解产物的氨基酸组成和ACE抑制活性进行了研究,结果表明,疏水性氨基酸含量越高,ACE抑制活性越高。本研究中乳清蛋白低聚肽中疏水性氨基酸含量较多,因此具有潜在的ACE抑制活性。
表2 乳清低聚肽的氨基酸组成
Table 2 Amino acid composition of whey oligopeptide
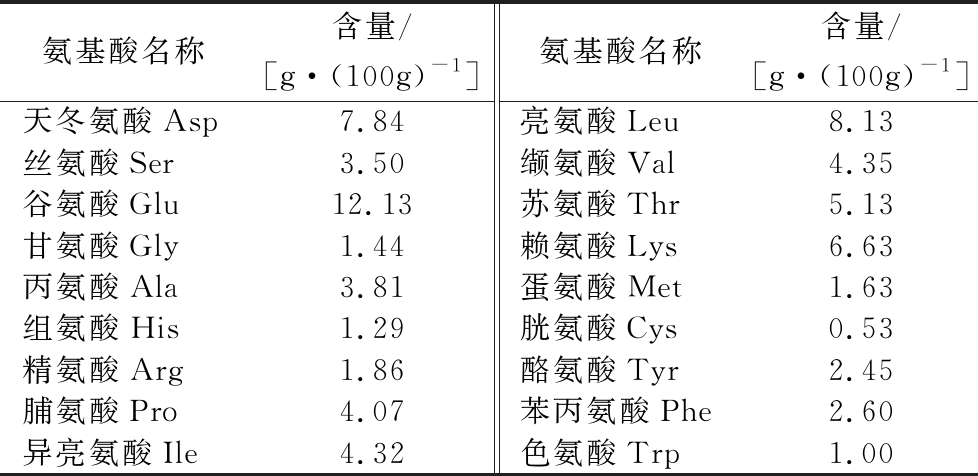
氨基酸名称含量/[g·(100g)-1]氨基酸名称含量/[g·(100g)-1]天冬氨酸Asp7.84亮氨酸Leu8.13丝氨酸Ser3.50缬氨酸Val4.35谷氨酸Glu12.13苏氨酸Thr5.13甘氨酸Gly1.44赖氨酸Lys6.63丙氨酸Ala3.81蛋氨酸Met1.63组氨酸His1.29胱氨酸Cys0.53精氨酸Arg1.86酪氨酸Tyr2.45脯氨酸Pro4.07苯丙氨酸Phe2.60异亮氨酸Ile4.32色氨酸Trp1.00
2.3 乳清低聚肽的ACE抑制作用
乳清低聚肽的ACE抑制活性如图1-A所示,从图1-A中可见,其ACE抑制率呈一定的量效关系,质量浓度为3.0 mg/mL时抑制率达到了90%,半抑制浓度(IC50)值约为1.0 mg/mL,表明乳清低聚肽具有较强的ACE抑制活性。阳性对照降压药卡托普利的ACE抑制率IC50值为0.07 mg/mL,质量浓度为0.2 mg/mL时抑制率达到了90%(图1-B)。HANAFI等[22]通过不同蛋白酶水解得到绿豆水解物,ACE抑制率IC50值为0.13~3.16 mg/mL,BOUGATEF等[23]考察了沙丁鱼蛋白水解物的ACE抑制作用,其IC50值为1.2 mg/mL,与本实验乳清低聚肽的ACE抑制能力相接近。与卡托普利相比,乳清低聚肽ACE抑制活性较弱,但是长期服用降压药物卡托普利有一定的毒副作用,而乳清低聚肽来源于天然食物,安全性高,可长期食用。研究表明,肽的ACE抑制作用与其肽链长度有关,具有ACE抑制作用的肽段往往分子质量较低[24-25]。乳清低聚肽中85%以上的肽段在1 000 u以下,以二肽、三肽为主,能够保持较好的ACE抑制作用。
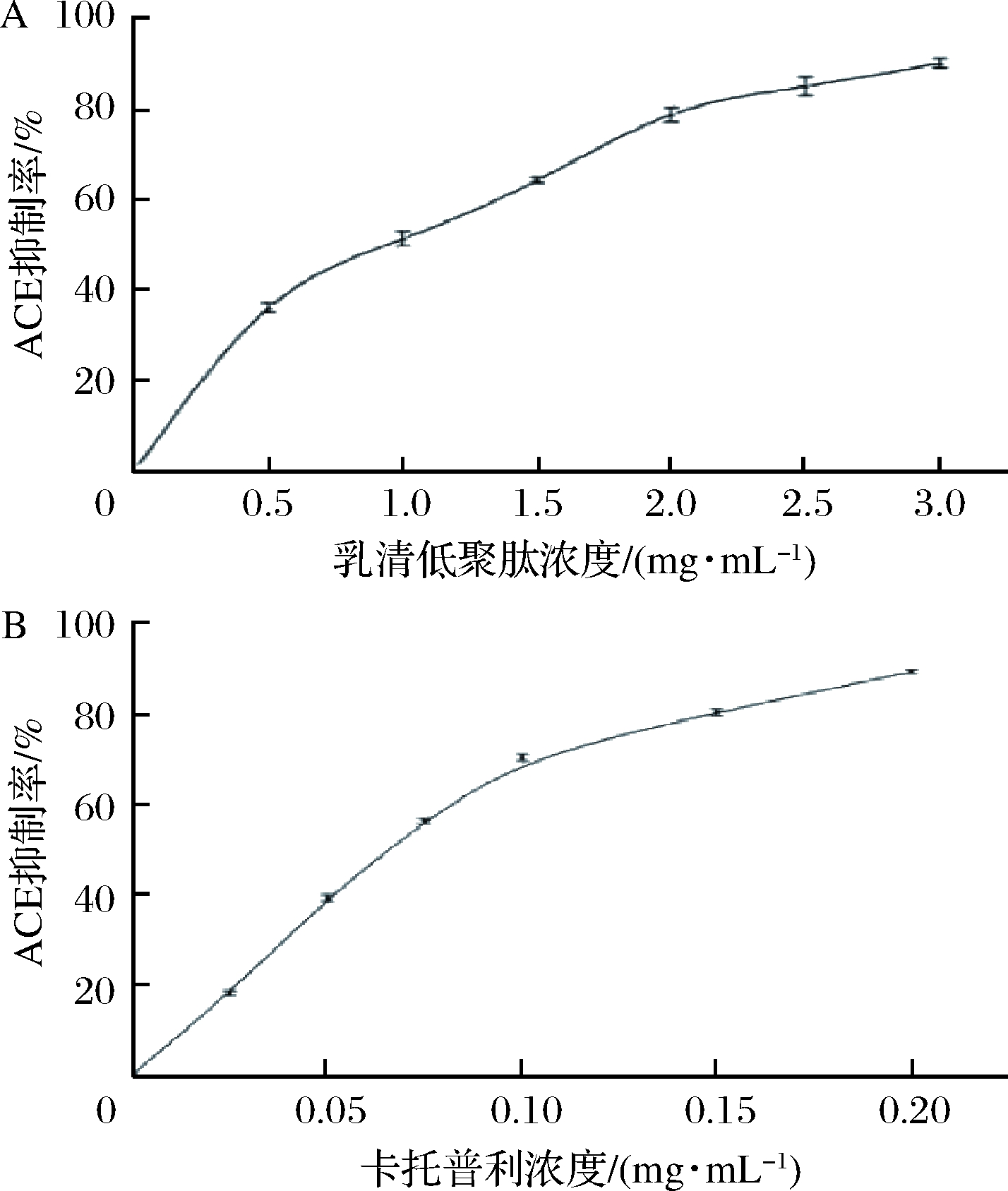
A-乳清低聚肽的ACE抑制能力:B-卡托普利的ACE抑制能力
图1 乳清低聚肽和卡托普利的ACE抑制能力
Fig.1 ACE inhibitiory activities of whey oligopeptides and captopril
2.4 乳清低聚肽的酸碱稳定性
低聚肽的稳定性是决定其能否投入生产应用以及有效作用的重要影响因素。乳清低聚肽经过不同的酸碱处理后,ACE抑制活性如图2所示。在pH 2~10,质量浓度1 mg/mL的乳清低聚肽ACE抑制率在48.26%~50.91%小范围波动。碱性条件下,肽可能发生消旋作用,引起肽链的构象发生变化[26],从而使得活性稍有下降,但活性变化并不显著(P>0. 05),说明乳清低聚肽的ACE抑制活性在酸性和碱性条件下都能保持良好的稳定性。分子质量分布结果如图3和表3所示。在pH 2~10,乳清低聚肽的分子排阻色谱图变化不大,分子质量在1 000 u以下的总含量在93.57%~94.78%波动,各分子质量区间的比例变化不超过2%。由此看出,乳清低聚肽具有较强的酸碱稳定性,小肽尤其是ACE抑制肽受酸碱的影响很小,这也进一步解释了乳清低聚肽经酸碱处理后ACE抑制活性得以保持稳定的原因。周剑敏等[27]对高粱碱溶蛋白ACE抑制肽在pH 2~10的酸碱稳定性进行了研究,结果也表明高粱碱溶蛋白ACE抑制肽在酸性和碱性条件下都能够保持良好的稳定性。
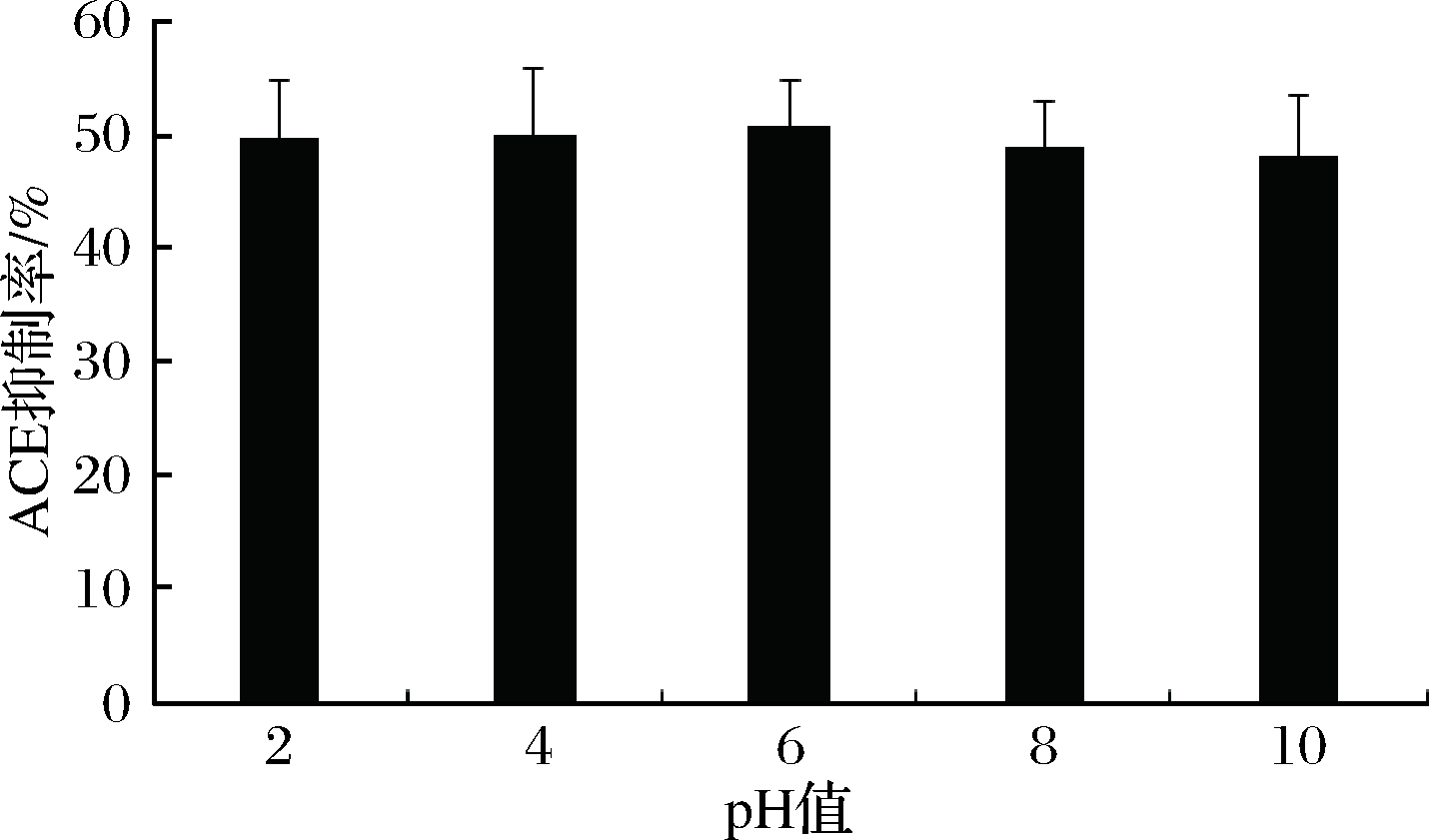
图2 不同pH值下乳清低聚肽的ACE抑制率
Fig.2 ACE inhibitory activities of whey oligopeptides at different pH values
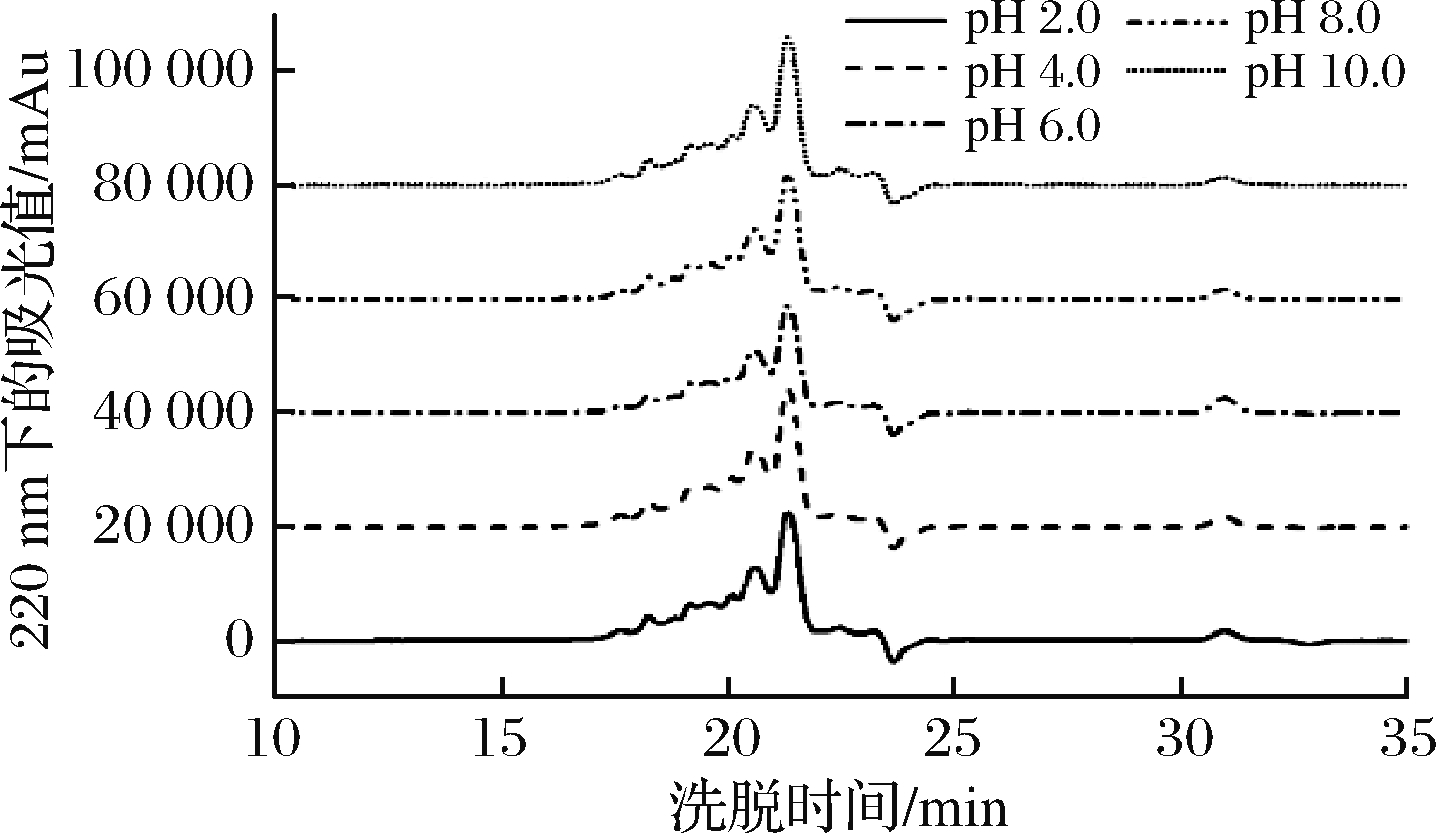
图3 不同pH值下乳清低聚肽的分子排阻色谱图
Fig.3 Molecular exclusion chromatography of whey oligopeptides at different pH values
表3 不同pH值下乳清低聚肽的分子质量分布
Table 3 Molecular weight distributions of whey oligopeptidesat different pH values
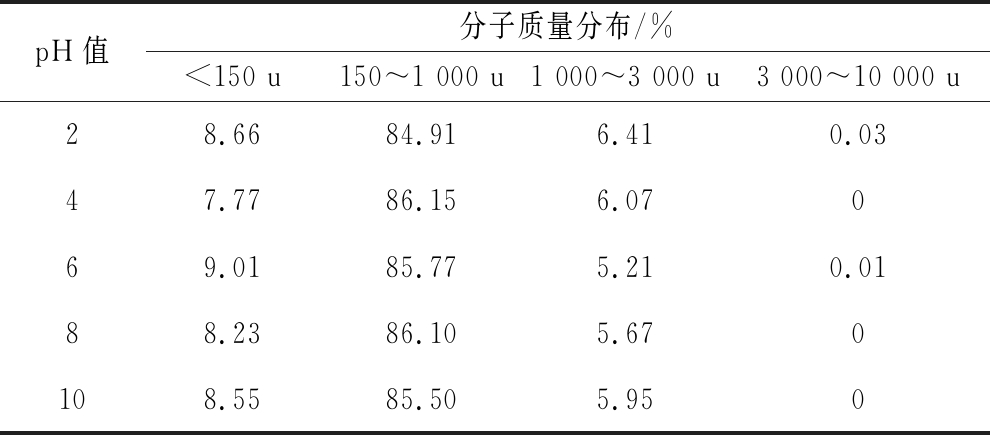
pH值分子质量分布/%<150 u150~1 000 u1 000~3 000 u3 000~10 000 u28.6684.916.410.0347.7786.156.07069.0185.775.210.0188.2386.105.670108.5585.505.950
2.5 乳清低聚肽的热稳定性
乳清低聚肽经过不同的温度处理后,ACE抑制活性如图4所示。温度30~100 ℃时,质量浓度1 mg/mL的乳清低聚肽的ACE抑制率在48.67%~51.29%波动,说明乳清低聚肽的ACE抑制活性受温度影响不显著(P>0. 05),ACE抑制肽在一定温度范围内具有良好的热稳定性。分子质量分布结果如图5和表4所示。在30~80 ℃,乳清低聚肽的分子排阻色谱图变化不大,分子质量在1 000 u以下的总含量在93.75%~94.51%波动,各分子质量区间的比例变化不超过4%。在100 ℃处理后,150~1 000 u的组分所占比例略有降低,小于150 u的组分所占比例略有升高,说明高温处理会使得部分肽段发生降解,但比例变化与其他温度处理下相比不超过4%。这表明,在加工过程中,温度的变化对乳清低聚肽的影响很小。郑婷婷等[28]考察了草鱼鱼鳔胶原肽的热稳定性,结果表明鱼鳔胶原肽具有很好的耐热性,在温度较高的条件下,仍然能保持较高的生物活性,与本研究结果一致。热处理是食品加工过程中常用的手段之一,在高温处理后,乳清低聚肽仍然具有很高的ACE抑制活性,这说明乳清低聚肽可作为一种具有商业潜力的产品。

图4 不同温度条件下乳清低聚肽的ACE抑制率
Fig.4 ACE inhibitory activities of whey oligopeptides at different temperatures

图5 不同温度条件下乳清低聚肽的分子排阻色谱图
Fig.5 Molecular exclusion chromatography of whey oligopeptides at different temperatures
表4 不同温度下乳清低聚肽分子质量分布
Table 4 Molecular weight distributions of whey oligopeptides at different temperatures

温度/℃分子质量分布/%<150 u150~1 000 u1 000~3 000 u3 000~10 000 u309.2084.985.830408.9984.766.230.02607.7186.166.120.01808.7185.066.180.0510011.6782.845.490
2.6 乳清低聚肽的体外消化稳定性
乳清低聚肽经过不同的消化酶处理后,ACE抑制活性如图6所示。相对于未消化的乳清低聚肽而言,分别经胃蛋白酶、胰蛋白酶消化后,质量浓度1 mg/mL时,乳清低聚肽的抑制率基本无变化。先胃蛋白酶后胰蛋白酶消化后,乳清低聚肽的抑制率稍有下降,与未消化组相比,变化不超过4%。这说明乳清低聚肽的ACE抑制活性受消化酶影响不显著(P>0.05),ACE抑制肽具有良好的体外消化稳定性。经过不同的消化模式,乳清低聚肽的分子质量分布结果如图7和表5所示。与未消化组相比,经过不同蛋白酶处理后,乳清低聚肽中分子质量在150~1 000 u的组分所占比例略有降低,小于150 u的总含量略有升高,但升高不到2%。这表明分子质量相对较大的肽段经过消化后分解成小分子质量的肽段或氨基酸,但总体来说乳清低聚肽具有较好的耐消化性,胃肠道蛋白酶对其影响很小。罗鹏等[29]和RUIZ等[30]分别研究了葵花籽ACE抑制肽和曼彻格奶酪ACE抑制肽在模拟胃液和肠液中的稳定性,与本研究一致,经过胃蛋白酶和胰蛋白酶消化作用后,2种ACE抑制肽仍然能保持一定的消化稳定性。
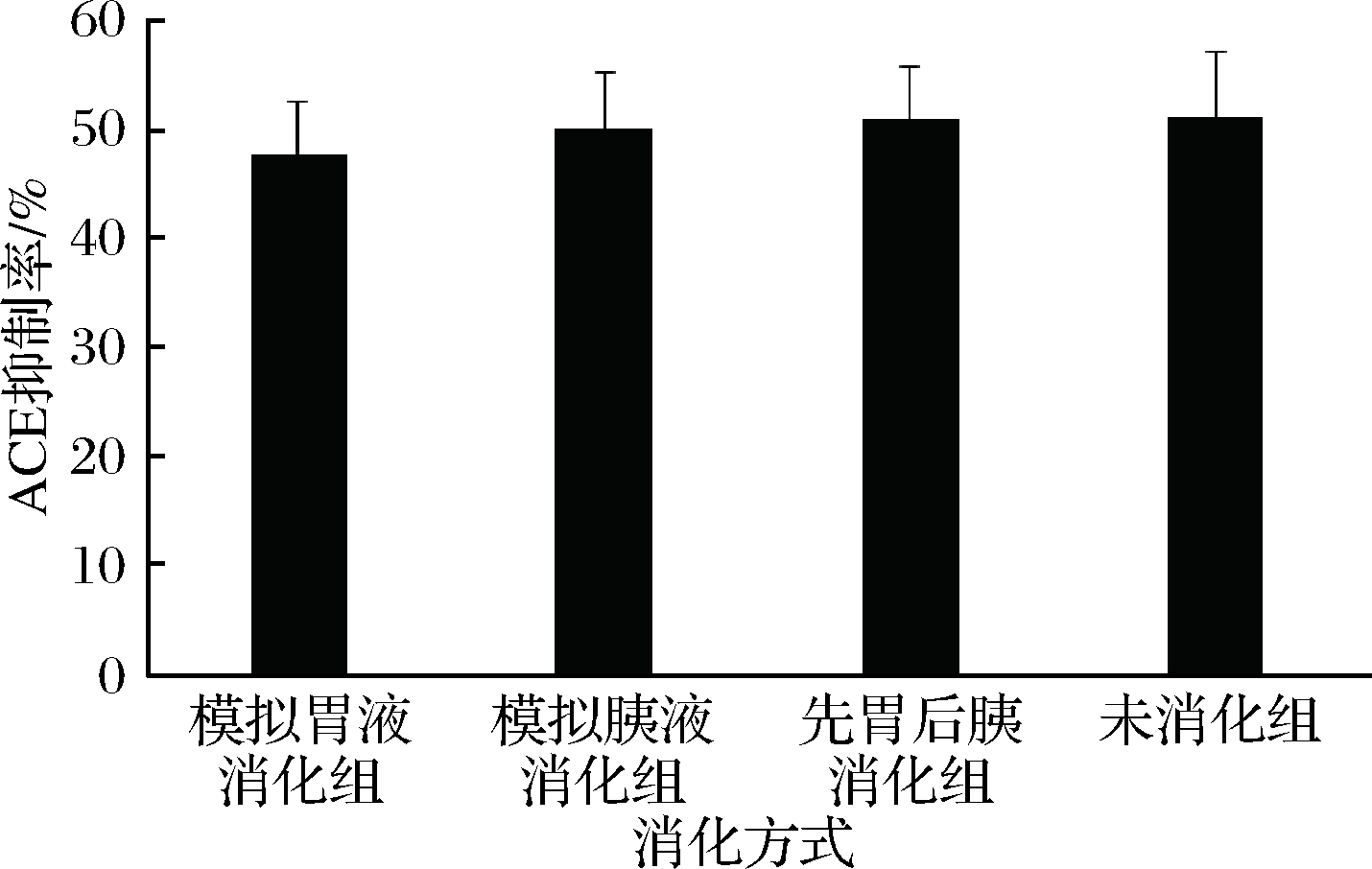
图6 不同消化方式下乳清低聚肽的ACE抑制率
Fig.6 ACE inhibitory activities of whey oligopeptides at different digestion modes
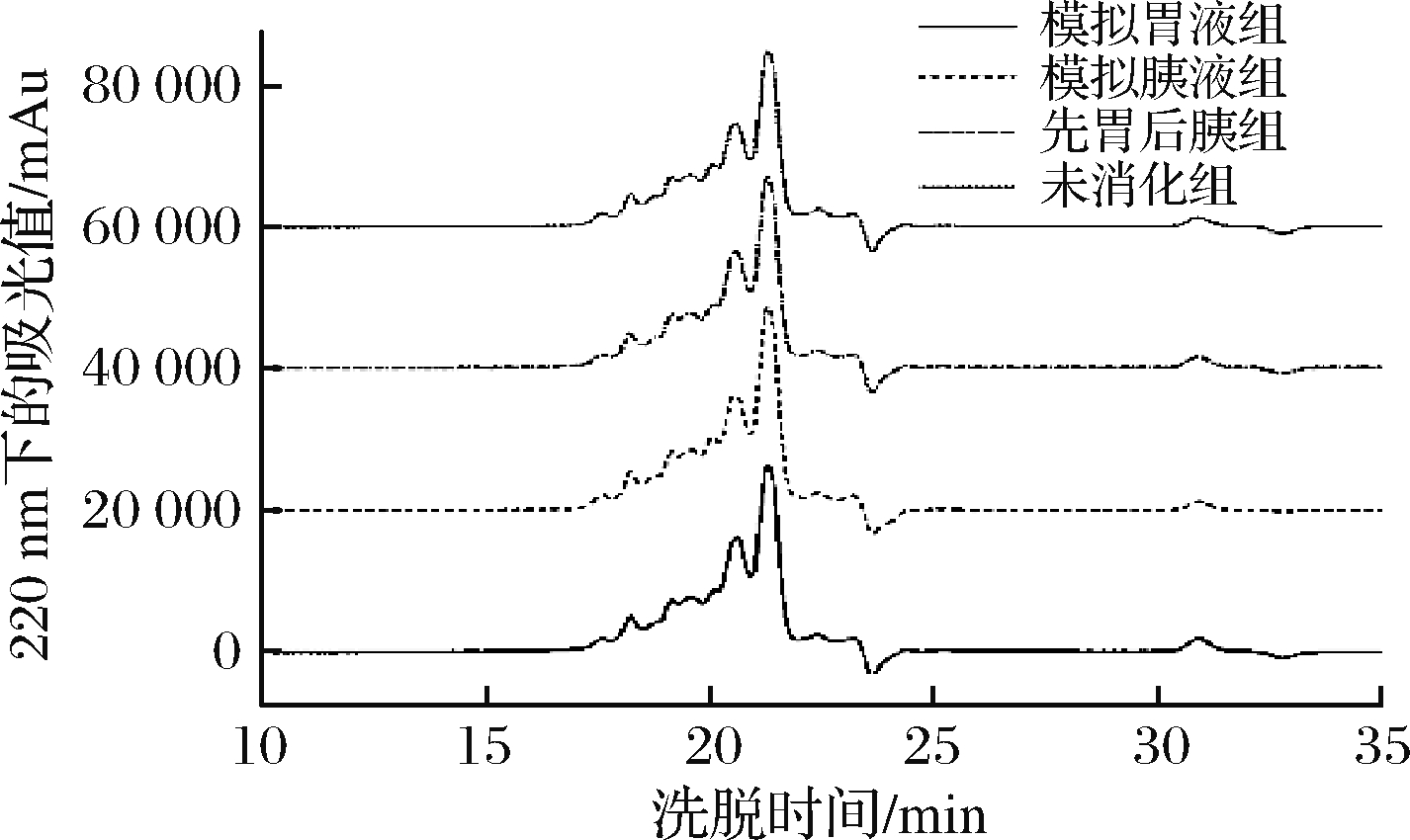
图7 不同消化方式下乳清低聚肽的分子排阻色谱图
Fig.7 Molecular exclusion chromatography of whey oligopeptides at different digestion modes
表5 不同消化方式下乳清低聚肽分子质量分布
Table 5 Molecular weight distributions of whey oligopeptidesat different digestion modes

消化方式分子质量分布/%<150 u150~1 000 u1 000~3 000 u3 000~10 000 u模拟胃液组8.2785.456.260.02模拟胰液组7.7386.026.220.04先胃后胰组8.3686.236.090.02未消化组6.8486.936.210.02
3 结论
本研究以乳清蛋白粉为原料,通过酶解法制得乳清低聚肽,对其基础理化成分、氨基酸组成、ACE抑制活性和体外稳定性进行了探究。实验结果表明,乳清低聚肽的总蛋白质含量为(71.83±0.37)%,酸溶蛋白含量高达(61.71±2.42)%,水分含量为(4.86±0.23)%,灰分含量为(5.23±0.10)%,脂肪含量为(0.21±0.05)%(均为质量分数)。含有丰富的谷氨酸、亮氨酸、天冬氨酸等,必需氨基酸含量为46.47%。
乳清低聚肽具有良好的酸碱稳定性,经过不同的pH处理后,ACE抑制率在48.26%~50.91%波动,分子质量在1 000 u以下的总含量在93.57%~94.78%波动,具有良好的热稳定性,经过不同温度处理后,ACE抑制率在48.67%~51.29%波动,分子质量在1 000 u以下的总含量在93.75%~94.51%波动。对于不同消化方式也具有一定的稳定性,ACE抑制率在47.63%~50.93%波动,分子质量在150~1 000 u的组分所占比例略有降低,小于150 u的总含量略有升高,但升高不到2%。这表明加工过程中的温度和pH的变化对乳清低聚肽自身的组分以及ACE抑制活性的影响很小。乳清低聚肽也基本上不受肠胃环境的影响,能发挥应有的生理功能。本研究证实了乳清低聚肽的ACE抑制作用和体外稳定性,为其在天然功能性保健食品中的应用提供了思路和理论支持。后续将对乳清低聚肽进行分离纯化,深入研究乳清低聚肽中ACE抑制肽的结构和构效关系。
[1] 蔡木易. 食源性肽研究进展[J].北京工商大学学报(自然科学版),2012,30(5):1-10.
[2] WANG Y L, HUANG Q, KONG D, et al. Production and functionality of food-derived bioactive peptides: A review[J]. Mini Reviews in Medicinal Chemistry, 2018, 18(18): 1 524-1 535.
[3] 刘文颖,林峰,谷瑞增,等.乳清低聚肽的制备及其抗氧化活性[J].食品工业科技,2014,35(15):49-53.
[4] 孙敏,郭永泽,李霜,等.乳清蛋白生物活性肽研究进展[J].基因组学与应用生物学,2019,38(12):5 428-5 435.
[5] LIU C, FANG L, MIN W, et al. Exploration of the molecular interactions between angiotensin-I-converting enzyme (ACE) and the inhibitory peptides derived from hazelnut (Corylus heterophylla Fisch.)[J]. Food Chemistry, 2018, 245:471-480.
[6] ZHANG T, LI M, FU X, et al. Purification and charicterization of angiotensin I-converting enzyme (ACE) inhibitory peptides with specific structure X-Pro[J]. European Food Research & Technology, 2019, 245(12): 333-338.
[7] GB 5009.5—2016 食品安全国家标准 食品中蛋白质的测定[S]. 北京:中国标准出版社, 2016.
[8] GB/T 22729—2008 海洋鱼低聚肽粉[S]. 北京:中国标准出版社, 2008.
[9] GB 5009.3—2016 食品安全国家标准 食品中水分的测定[S]. 北京:中国标准出版社, 2016.
[10] GB 5009.4—2016 食品安全国家标准 食品中灰分的测定[S]. 北京:中国标准出版社, 2016.
[11] GB 5009.6—2016 食品安全国家标准 食品中脂肪的测定[S]. 北京:中国标准出版社, 2016.
[12] GB 5009.124—2016 食品安全国家标准 食品中氨基酸的测定[S]. 北京: 中国标准出版社, 2016.
[13] LIU W Y, LU J, GAO F, et al. Preparation, characterization and identification of calcium-chelating Atlantic salmon (Salmo salar L.) ossein oligopeptides[J]. European Food Research and Technology, 2015, 241:851-860.
[14] 张江涛,秦修远,贾福怀,等.卵白蛋白低聚肽的体外抗氧化及ACE抑制作用[J].食品与发酵工业,2019,45(12):67-74.
[15] 张江涛,秦修远,周明,等.林蛙低聚肽的体外抗氧化与ACE抑制作用[J].中国食品添加剂,2019,30(6):46-53.
[16] 秦修远, 刘文颖, 张静波, 等. 豌豆低聚肽硒螯合物的稳定性研究[J].食品与发酵工业, 2019, 45(2): 74-79.
[17] 刘文颖,谷瑞增,林峰,等.海洋骨胶原低聚肽钙配合物的稳定性[J].食品工业科技,2015,36(4):111-115.
[18] 肖志明, 李丽蓓, 邓涛, 等. 饲料原料中酸溶蛋白的测定方法研究[J]. 中国畜牧杂志, 2016, 52(2): 72-75 ;80.
[19] 吕达娜, 林淑瑜, 黄阳, 等. 谷氨酸在晕动病发病机制中的作用及相关药物研究[J]. 中国临床药理学杂志, 2015, 31(14): 1 462-1 465.
[20] 王良峡, 刘若颖, 林福鸿, 等. 支链氨基酸在运动中的作用研究进展[J]. 氨基酸和生物资源, 2015, 37(1): 7-12.
[21] 梁婷婷,佟立涛,蒲华寅,等.动植物源蛋白体外消化产物结构性质及ACE抑制活性[J].食品科学,2018,39(4):6-12.
[22] HANAFI M A, HASHIM S N, CHAY S Y, et al. High angiotensin-I converting enzyme (ACE) inhibitory activity of Alcalase-digested green soybean (Glycine max) hydrolysates. Food Research International, 2018,106:589-597.
[23] BOUGATEF A, NEDJAR-ARROUME N, RAVALLEC-PLÉ R, et al. Angiotensin I-converting enzyme (ACE) inhibitory activities of sardinelle (Sardinella aurita) by-products protein hydrolysates obtained by treatment with microbial and visceral fish serine proteases[J]. Food Chemistry, 2008, 111(2): 350-356.
[24] ZHANG C H, CAO W H, HONG P Z, et al. Angiotensin I-converting enzyme inhibitory activity of Acetes chinensis peptic hydrolysate and its antihypertensive effect in spontaneously hypertensive rats[J]. International Journal of Food Science Technology, 2010, 44(10): 2 042-2 048.
[25] WILSON J, HAYES M, CARNEY B. Angiotensin-I-converting enzyme and prolyl endopeptidase inhibitory peptides from natural sources with a focus on marine processing by-products[J]. Food Chemistry, 2011, 129(2): 235-244.
[26] LIU P, ZHAO M, CAO Y, et al. Purification and identification of anti-oxidant soybean peptides by consecutive chromatography and electrospray ionization-mass spectrometry[J]. Rejuvenation Research, 2014, 17(2):209-211.
[27] 周剑敏,尹方平,于晨,等.高粱碱溶蛋白ACE抑制肽的制备及其稳定性研究[J].中国粮油学报,2019,34(8):66-72.
[28] 郑婷婷,涂宗财,唐平平,等.鱼鳔胶原肽抗氧化稳定性研究[J].食品与机械,2017,33(9):9-14.
[29] 罗鹏,张晓伟,徐晓,等.葵花籽ACE抑制肽的稳定性研究[J].粮食与油脂,2016,29(1):75-77.
[30] RUIZ J  G, RAMOS M, RECIO I. Angiotensin converting enzyme-inhibitory activity of peptides isolated from Manchego cheese. Stability under simulated gastrointestinal digestion[J]. International Dairy Journal, 2004, 14(12):1 075-1 080.
G, RAMOS M, RECIO I. Angiotensin converting enzyme-inhibitory activity of peptides isolated from Manchego cheese. Stability under simulated gastrointestinal digestion[J]. International Dairy Journal, 2004, 14(12):1 075-1 080.