酒精性肝脏疾病(alcoholic liver disease,ALD)是一类酒精诱导的慢性进行性肝病,酒精通过多种途径对肝脏造成损伤。人们日常饮用的白酒不同于酒精,白酒对人体感官和健康的影响是其多组分的共同作用。最近对白酒成分的解析发现,白酒中含有大量潜在的小分子生物活性物质,短链脂肪酸(short-chain fatty acids,SCFAs)及其乙酯、饱和长链脂肪酸及其乙酯、芳香类化合物、杂环类物质等,这些物质具有减轻酒精对肝脏损伤的潜能[1]。其中SCFAs及其乙酯对肠道稳态与人体健康具有重要意义,SCFAs能降低肠道内环境pH值,抑制有害菌生长,为益生菌生长定植提供环境基础,如乙酸、丁酸均有益于益生菌Akkermansia muciniphila的生长[2]。同时,SCFAs还可以保护肠屏障功能,降低肠道通透性,减少内毒素等其他有害肠道代谢物泄露[3],一定程度上能缓解酒精对人体的损伤。
我国销量最高的白酒为浓香型白酒,浓香型白酒因其独特的酿造工艺,含有丰富的SCFAs。泥窖发酵是浓香型白酒传统的工艺特点,素有“千年老窖万年糟”之说[4]。“老窖”是浓香型白酒的泥池等发酵容器经过多年的微生物富集培养而形成,这些长久持续使用的窖池,已经形成了较为固定的微生物群落,它们在很大程度上决定了浓香型白酒的品质和风格。浓香型白酒中SCFAs的产生与窖泥中的菌群有很大的关系,其中梭菌(Clostridium spp.)是窖泥中产生SCFAs及其乙酯的重要菌属[5],除此以外,一些酵母菌与霉菌也是产SCFAs及其乙酯的重要窖泥微生物[6-7]。
本文主要综述了浓香型白酒中SCFAs及其乙酯的发酵产生机制,SCFAs在肠道中的生理作用以及SCFAs在白酒健康中的重要贡献。
1 SCFAs及其乙酯在浓香型白酒中的检测与含量
浓香型白酒中的酸主要为有机酸,含量最高的有机酸为乙酸、己酸、乳酸和丁酸,它们被称为“四大酸”,在浓香型白酒有机酸中的比例达到了90%以上[8]。发酵过程中,相关菌群代谢产生的有机酸与糖发酵产生的乙醇发生酯化反应生成乙酯类物质,进而形成浓香型白酒中“四大酯”:乙酸乙酯、己酸乙酯、乳酸乙酯、丁酸乙酯。四大酸与四大酯占浓香型白酒中酸酯类物质的90%以上,其中乙酸、己酸、丁酸为SCFAs。SCFAs及其乙酯对浓香型白酒的风味贡献显著,在适当浓度下可以使浓香型白酒入口醇厚,回味悠长。不同的酸酯有其自身独特风味,白酒中有机酸及其乙酯的含量与比例也会进一步影响风味与口感。如丁酸具有较浓水果清香、大曲香,乙酸呈醋味,爽口尖利,适宜浓度的己酸乙酯有窖香味。SCFAs的含量需要严格调控在适当浓度范围内,否则会影响白酒的感官风味,如SCFAs过多会压香,造成酒味发酸发涩,口感粗糙尖锐,而过少则可能会使酒味泛苦,带有邪杂味,酒味不纯净[9]。各种有机酸的比例也会影响酒的品质,一般来说,浓香型白酒中己酸的比例高意味着酒质更好[10]。
浓香型白酒中SCFAs及其乙酯的检测仪器也越来越精细。FAN等通过气相色谱闻香器(gas chromatography-olfactometry, GC-O)和气相色谱质谱联用仪(gas chromatography-mass spectrometer, GC-MS)鉴定出有机酸与酯类是洋河酒的两大重要芳香物质,其中己酸、丁酸与己酸乙酯、丁酸乙酯分别在酸类与酯类中占较大比重[11]。YAO等采用全二维气相色谱/飞行时间质谱分析(comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry, GC-GC/TOF-MS)同样验证了己酸及其乙酯在泸州老窖中重要的芳香贡献,并进一步对白酒中潜在生物活性物质做了定量分析,表明己酸乙酯、乙酸乙酯、丁酸乙酯均具有较大占比[12]。表1列举了浓香型白酒中主要SCFAs及其乙酯的含量。
表1 浓香型白酒中主要SCFAs及其乙酯的含量
Table 1 The content of main SCFAs and its ethyl esters in strong aroma-type Baijiu
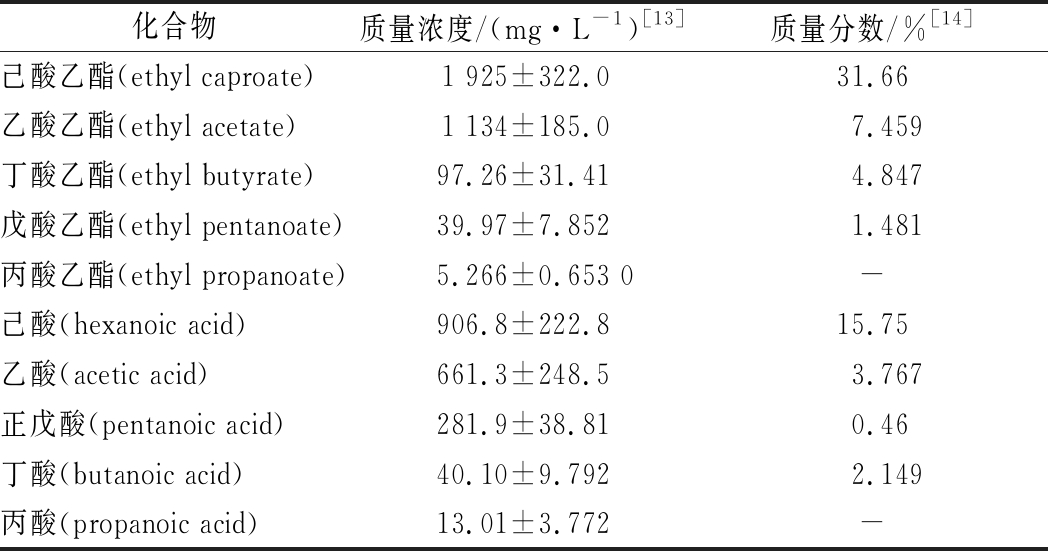
注:质量分数指该物质在白酒风味物质中所占质量分数;-代表未检出
化合物质量浓度/(mg·L-1)[13]质量分数/%[14]己酸乙酯(ethyl caproate)1 925±322.031.66乙酸乙酯(ethyl acetate)1 134±185.07.459丁酸乙酯(ethyl butyrate)97.26±31.414.847戊酸乙酯(ethyl pentanoate)39.97±7.8521.481丙酸乙酯(ethyl propanoate)5.266±0.653 0-己酸(hexanoic acid)906.8±222.815.75乙酸(acetic acid)661.3±248.53.767正戊酸(pentanoic acid)281.9±38.810.46丁酸(butanoic acid)40.10±9.7922.149丙酸(propanoic acid)13.01±3.772-
2 浓香型白酒中SCFAs及其乙酯的产生机制
梭菌属(Clostridium spp.)在浓香型白酒发酵中占有重要地位,它与SCFAs及其乙酯的产生有关。浓香型白酒发酵过程中,梭菌主要存在于窖泥中。何培新等对窖泥纯化培养,证实酪丁酸梭菌(C. tyrobutyricum)、丁酸梭菌(C. butyricum)可代谢产生丁酸与乙酸,克氏梭菌(C. kluyveri)、丙酮丁醇梭菌(C. acetobutylicum)、吲哚梭菌(C. acetobutylicum)主要产生己酸、己酸乙酯,而C. cadaveris的含量与短链脂肪酸乙酯,即乙酸乙酯、丁酸乙酯的合成呈正相关[5]。
除了梭菌属以外,一些酵母与霉菌也能产SCFAs及其酯类,白酒酿造过程中,毕赤酵母可以产乙酸乙酯、丙酸乙酯等酯类,假丝酵母可以产脂肪酸与酯类,其中包含了SCFAs及其酯类[6]。霉菌在酿酒过程中也可以代谢产酯,红曲霉是浓香型白酒中非常重要的特征霉菌,它可以显著地提高浓香型白酒己酸乙酯的生成量[7]。
在浓香型白酒发酵过程中,产生量最高的SCFAs为乙酸、丁酸与己酸。乙酸的生成途径主要有3个:(1)醋酸菌等细菌将酒精氧化成醋酸;(2)发酵过程中,在酒精产生的同时生成乙酸和甘油;(3)糖经过发酵转变为乙醛,两分子乙醛继续反应生成一分子乙酸与一分子乙醇。乙醇和乙酸在发酵过程中几乎是同时出现,在发酵前期时,乙酸的含量最高;在发酵后期,乙酸含量较少[10] (图1-a)。
丁酸的生成途径主要有4种:(1)乙酸与乙醇在丁酸菌作用下合成;(2)在淀粉糖化后,糖酵解生成的丙酮酸也可以合成丁酸;(3)丁酸菌发酵糖类物质或含氮化合物生成丁酸;(4)乳酸发酵产生丁酸[15](图1-b)。
己酸的生成途径主要有2种:(1)在代谢中,兼性厌氧型细菌己酸菌使乙酸与乙醇反应生成己酸与丁酸;(2)产生的丁酸与酒精或乙酸都可合成己酸。己酸主要由窖泥中己酸菌与相关生物酶共同作用下生成。己酸菌在泥土中生存,浓香型白酒发酵中,窖泥中的己酸菌与甲烷菌处在互利共生的关系,窖泥中一定比例的甲烷菌为己酸菌生长提供稳定环境,促进己酸乙酯的生成,减少乳酸乙酯的产生,改善酒质[16] (图1-c)。
在SCFAs的乙酯中乙酸乙酯、丁酸乙酯可以由酸醇直接酯化产生,而己酸乙酯除了直接酯化以外,还可以在己酸菌作用下由乙酸乙酯与乙醇反应生成丁酸乙酯与水,再与乙醇反应生成己酸乙酯。由于己酸乙酯含碳量较多,直接酯化较缓慢,故产己酸乙酯的反应以后者为主[16](图1-d)。
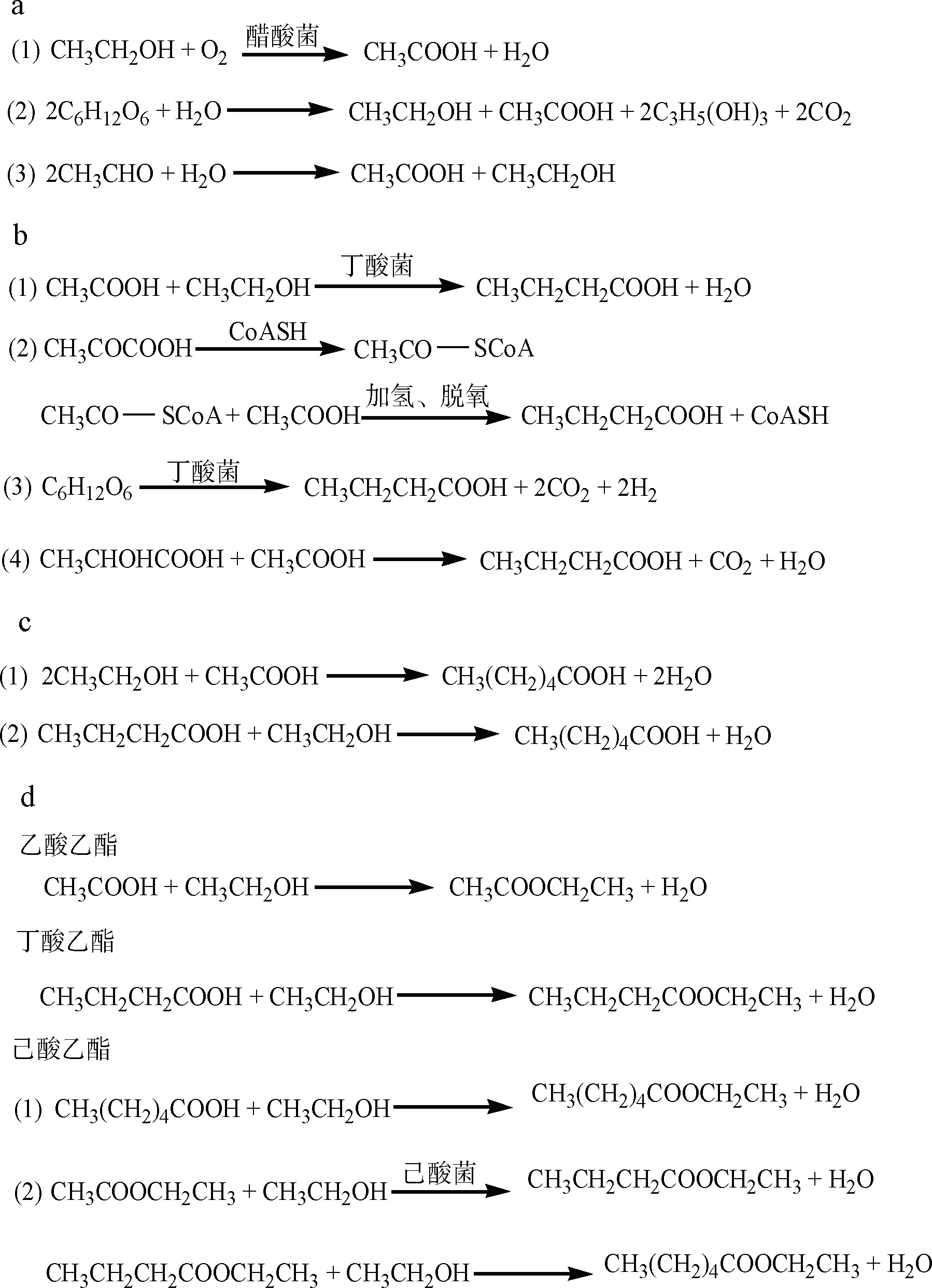
a-乙酸生成途径;b-丁酸生成途径;c-己酸生成途径;d-主要乙酯类生成途径图1 浓香型白酒中主要SCFAs及其乙酯产生途径
Fig.1 Production of main SCFAs and its ethyl esters in strong aroma-type Baijiu
3 SCFAs的生理活性功能
3.1 SCFAs与醉酒度
醉酒,表现为饮酒上头,主要是由乙醇的麻醉作用和乙醛引起的脑缺氧造成的。经常醉酒会对人体造成巨大的伤害,不仅造成肝脏、心脏、胃肠等器官功能紊乱,还会伤害大脑神经,进而影响记忆力与智力。为描述白酒这方面相关特性,引入了“醉度”的概念,“醉度”是反映饮酒后人体生理舒适程度的指标,相同酒精度的白酒,高醉度白酒饮用后醉酒反应更大,醒酒慢,生理研究证实,与高醉度白酒相较而言,饮用低醉度白酒后血液中乙醇代谢更快,对肝脏的损伤更小[17]。有相关研究发现,相同酒精度下的白酒,其醉度很大程度上受白酒中其他微量活性物质的影响,其中乙酸和乙酸乙酯可以促进乙醇代谢,显著降低白酒醉度,且乙酸乙酯存在抗炎、镇痛的功效[18],能有效缓解宿醉后的头疼。酸酯比例与酸酯平衡对醉度也有很重要的影响,研究表明调配酒中杂醇、酸、酯比例在1∶2∶3时醉度最低[17]。由此可见,白酒生产过程中控制一定的醇、酸、酯比例能够减轻乙醇带来的人体损伤。
3.2 SCFAs在肠道内的健康功效
3.2.1 SCFAs与肠道生理环境
SCFAs可以降低肠道pH,减少病原菌的定植,如乙酸可抑制大肠中致病菌志贺菌属的生长[19],乙酸、丙酸、丁酸可以抑制肠道中沙门氏杆菌与大肠杆菌的定植[18]。SCFAs也可以作为某些肠道益生菌的能量来源,促进益生菌的生长。研究发现乙酸益于肠道中双歧杆菌(Bifidobacterium)、乳杆菌(Lactobacillus)、Akkermansia muciniphila等益生菌的增加,丁酸益于Lactobacillus、Akkermansia muciniphila、瘤胃球菌(Ruminococcus)的增加[2]。其中Akkermansia muciniphila是一种革兰氏阴性菌,属于微疣菌门,以黏蛋白为碳源和氮源,可代谢产生SCFAs,有保护肠屏障的功能[20]。
SCFAs还可以影响肠道中水与离子的分泌与吸收,参与维持肠道水和电解质平衡。如丁酸盐可促进肠道对水、中性盐NaCl的吸收,减少Cl-的分泌,从而改善霍乱患者腹泻症状[21]。增加肠道中SCFAs的含量能有效调控肠道微环境,对于维护肠道健康有着重要作用。
3.2.2 SCFAs与肠道屏障
目前有研究发现,SCFAs与肠上皮细胞的相互作用可以保护肠屏障功能。SCFAs可以促进肠上皮细胞的增殖分化与肠黏膜紧密连接蛋白的mRNA的表达,进而保护肠黏膜屏障。SCFAs可以被肠黏膜上皮细胞吸收,作为某些代谢途径中间产物参与代谢,增加了乙酰辅酶A的生成,为肠黏膜上皮细胞增殖、分化提供能量,减少其凋亡,其中丁酸是肠黏膜上皮细胞主要的SCFAs供能来源[22]。SCFAs对于促进肠黏膜紧密连接蛋白的表达,也有较为显著的功效。有实验表明,丁酸盐可以促进肠上皮细胞紧密连接蛋白ZO-1蛋白、Occludin蛋白、Claudin-1蛋白的表达,进而有利于肠黏膜损伤的修复[22-23]。相关研究在分子机制上探究,发现丁酸盐可以调节紧密连接蛋白Claudin-1的转录,即推动促进转录因子SP1(transcription factor SP1, SP1)与Claudin-1启动子结合,增加Claudin-1蛋白的转录,进而增强肠屏障功能[23]。另外,SCFAs可以增加AMP激活的蛋白激酶(AMP-activated protein kinase, AMPK)的活性,促进紧密连接蛋白重组,增加大肠上皮细胞跨膜电阻,调节紧密连接组装从而减小肠道通透性,增强肠道机械屏障功能[24]。
3.2.3 SCFAs参与免疫和炎性反应
SCFAs调节免疫细胞的功能与分化,其分子机制上涉及细胞表面SCFAs受体与细胞内的目标蛋白。研究已发现肠上皮细胞表面SCFAs受体主要有G蛋白偶联受体41(G protein-coupled receptor 41, GPR41)、G蛋白偶联受体43(G protein-coupled receptor 43, GPR43) 及G蛋白偶联受体109A(G protein-coupled receptor 109A, GPR109A)。研究发现丙酸激活GPR41后可以促进巨噬细胞与高吞噬能力树突状细胞(dendritic cells, DC)的产生,减弱辅助型T细胞2(T helper 2 cell, TH2)效应子功能,进而减缓小鼠支气管炎症[25]。SCFAs也能结合并激活GPR43,刺激K+外流引起超级化,激活NLRP3炎性小体,进而保护肠上皮细胞的完整性[26]。SCFAs与GPR41、GPR43结合,活化后的GPR41与GPR43可以激活细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK1/2)和丝裂原活化蛋白激酶(mitogen-activated protein, MAPK)信号通路,诱导趋化因子与细胞因子的快速产生,促进免疫细胞的募集,进而介导炎性反应与免疫保护[27]。SCFAs对GPR43的刺激,在减缓某些炎性反应中是十分必要的,实验发现,GPR43缺陷型小鼠在结肠炎、关节炎、哮喘等疾病中出现未缓解甚至加重的炎症[28],这可能与GPR43激活后增加炎性介质的产生以及免疫细胞的募集有关。GPR109A是结肠中丁酸盐与烟酸的受体,配体激活后的GPR109A可以提高巨噬细胞与DC细胞的抗炎特性,诱导调节性T细胞(regulatory cells, Tregs)和产白介素-10(interleukin-10, IL-10)的T细胞的分化[29]。据报道,GPR109A具有一定的抗癌功效,其在结肠癌患者体内的表达受抑制,结肠内一定浓度的丁酸盐与GPR109A结合后会活化核因子-κB(nuclear factor kappa-B, NF-κB)并诱导结肠癌细胞凋亡[30]。
SCFAs可以抑制胞内组蛋白去乙酰化酶(histone deacetylases, HDACs)的活性,进而影响胞内炎性与免疫反应。CHANG等研究发现丁酸盐抑制组蛋白去乙酰化酶的活性,从而下调了脂多糖诱导的巨噬细胞致炎因子的表达,缓解炎性反应,增强巨噬细胞对肠道菌群的耐受性[31]。另外,丁酸盐通过抑制HDACs的活性,增强组蛋白H3在Treg启动子上乙酰化,诱导Treg生长、分化,形成肠黏膜免疫系统[32]。体外实验也表明,丁酸盐促进T细胞分化为Treg,能够上调抗炎因子的产生,减轻炎性反应[33]。LIN等研究发现丁酸盐通过抑制HDACs活性,调节基因表达,抑制IL-8、单核细胞趋化蛋白-1(monocyte chemotactic protein 1, MCP-1)的转录表达,抑制免疫细胞与炎性因子的大量募集,避免大范围炎症反应[34]。
SCFAs作为能量物质与信号分子,还能为抗体的产生提供能量基础,控制基因表达,表达出血浆B细胞分化必需的分子,维持体内稳态与保护病原特异性抗体反应[35]。
3.3 SCFAs与ALD的联系
ALD与长期过量摄入酒精有关,酒精伤肝途径十分复杂,可以通过影响肠道微生态、机体氧化应激反应、机体免疫炎性反应、机体脂质氧化系统等途径损伤肝脏(图2)。酒精增加肠道通透性,通过下调紧密连接蛋白的表达使肠黏膜屏障功能受损,引起肠道菌群失调,革兰氏阴性菌增加,内毒素脂多糖(lipopolysaccharide, LPS)水平与通透性增加,LPS和一些肠道有害代谢物通过门脉循环进入肝脏。肝脏细胞上的Toll样受体4(Toll like receptor 4, TLR4)识别LPS,LPS/TLR4信号激活枯否细胞,释放促炎因子、趋化因子与活性氧物质,损伤肝细胞,使肝脏发生炎症、坏死和纤维化[36];乙醇代谢产生的有害活性氧抑制肝细胞的抗氧化能力,体内氧化-抗氧化平衡被破坏,促使炎性反应的发生与细胞凋亡;乙醇代谢物乙醛与机体多种蛋白共价结合产生的乙醛蛋白加合物 (acetaldehyde-protein adduct, APA),影响甚至破坏机体内相关蛋白质功能,损害肝细胞;乙醇代谢物乙醛会抑制过氧化酶体增殖剂激活受体(peroxisome proliferators-activated receptors, PPARs)的转录表达,进而抑制肝脏内脂质氧化,造成脂肪堆积,进一步发展成脂肪肝与脂肪性肝炎[37]。
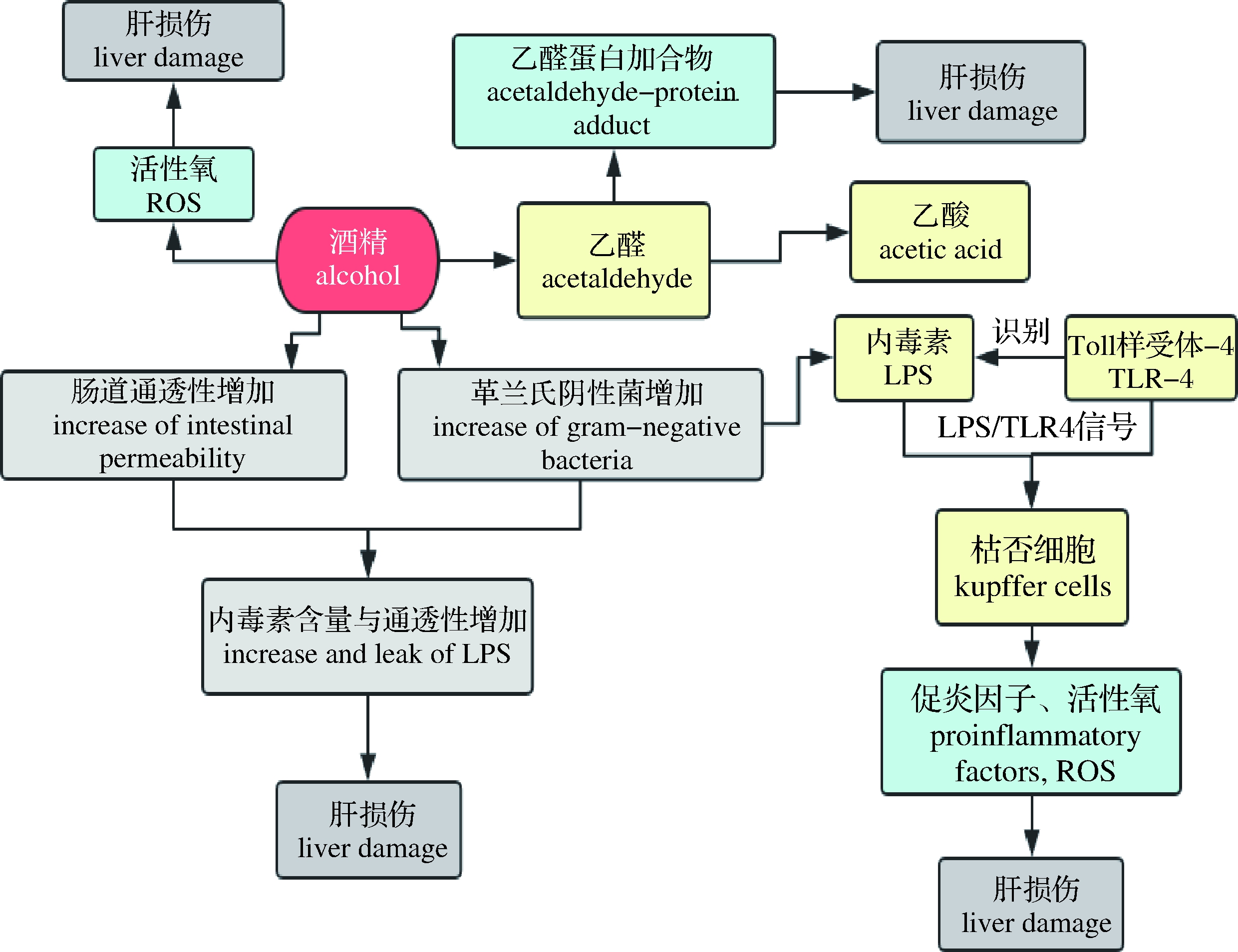
图2 酒精的主要伤肝途径与机制
Fig.2 Pathogenesis of alcohol-induced liver damage
肠道微生态与ALD进展的关系越来越成为疾病治疗的关注点,益生菌治疗已经成为了ALD治疗的新靶标。研究表明益生菌Lactobacillus可以改变肠道菌群的组成,减轻酒精引起的营养不良、肠道通透性增加、细菌易位、内毒素血症,进而缓解ALD进程[38],然而其具体的分子机制仍待探索。其中SCFAs作为肠道微生态中一种重要标志物质,对肠道、肝脏以及ALD发展进程有一定的生物调节意义。在肠道中,SCFAs一定程度上可以改善肠道菌群失调,促进益生菌Christensenellaceae、Blautia、Lactobacillus、Akkermansia muciniphila等菌的生长,而这些益生菌也可以代谢产生SCFAs[39]。同时SCFAs为肠黏膜上皮细胞增殖、分化与相关紧密连接蛋白的表达提供能量,促进紧密连接蛋白组装,保护肠屏障[22-23],减轻LPS和其他有害代谢物泄露诱导的炎性反应[3];肠道中相当数量的SCFAs(尤其是丙酸与丁酸)可以通过门静脉被肝脏吸收[40],参与肝脏中的生化反应。丙酸盐可以促进肝脏内脂肪代谢,减少肝脏脂肪堆积,抑制肝脏脂肪变性[41]。丙酸与丁酸可共同抑制枯否细胞M1MΨ极化,促进枯否细胞M2MΨ极化[42],降低肝细胞中促炎性因子诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)含量,刺激抗炎性因子精氨酸酶(arginase-1, Arg-1)和IL-10的产生,进而抑制肝脏内TLR4/MyD88/NF-κB炎症信号通路,减轻ALD进程中的炎性反应。丁酸通过活化AMPK和抑制HDACs活性提高PPAR-γ转录共激活因子-1α(PPAR-α coactivator-1α, PGC-1α)的表达,恢复了肝脏组织中PPARs水平,可以一定程度上减轻酒精诱导的线粒体功能受损、脂质氧化受阻;实验还发现丁酸可以显著降低肝脏中转化生长因子-β(transforming growth factor-β, TGF-β)水平,抑制其参与的氧化应激与炎性反应,阻止肝纤维化进程[43]。ENDO等研究发现,丁酸盐可以通过激活AMPK和蛋白激酶B进而诱导核转录因子Nrf2的表达与激活,从而帮助肝脏细胞抵抗活性氧、亲电试剂及氧化应激诱导的炎症反应[44]。除此以外,SCFAs还可以通过影响免疫细胞分化参与ALD进程,体外研究发现,丁酸在细胞因子环境下可促进CD4+T细胞分化为Th2、Th22或Treg,抑制CD4+T细胞分化为Th1或Th17,表明丁酸利于产抗炎性因子T细胞的生长分化,进而减轻酒精代谢诱导的炎性反应[33]。
浓香型白酒中具有一定比例的SCFAs及其乙酯,饮用后可以为肠道带来一定量的SCFAs。FANG等给小鼠灌胃相同酒精度的乙醇与白酒,发现白酒灌胃的小鼠肠屏障功能更完整,肝损伤更小[45],其研究进一步表明白酒干预的小鼠肠道中含有更高浓度的SCFAs与更高丰度的肠道菌Akkermansia muciniphila。Akkermansia muciniphila可以降解黏蛋白代谢产生SCFAs,其定植于肠道黏液层中有助于保护黏液层完整性,也可以进一步保护肠屏障[20]。可见白酒中含有的微量物质可减轻酒精对肝的损伤,但灌胃白酒的小鼠肠道中SCFAs的主要来源还不明确,可能主要由白酒本身含有的SCFAs乙酯水解产生,因此适当增加白酒中SCFAs及其乙酯的含量可以为肠道提供SCFAs,发挥其生理活性,进而减轻肝损伤。
4 展望
综上所述,SCFAs作为浓香型白酒中的重要风味物质,对于白酒健康有着极为重要的功效,它能从各个方面影响调节肠道微生态,进而影响机体免疫应答、炎性反应等,与ALD进程联系密切。目前对于浓香型白酒中SCFAs及其乙酯的研究在不断增多,然而白酒中SCFAs及其乙酯对人体影响的具体分子机制仍不明确,白酒中SCFAs及其乙酯进入小鼠肠道远端发挥减轻肝损伤的功效仍然未知。关于控制窖泥微生物进而影响白酒健康效应的研究并不是非常全面,自然窖泥微生物—SCFAs—人体肠道微生物,这三者之间可能存在着某种联系,如何通过控制窖泥微生物强化SCFAs在肠道微生态中的益处尚不清楚。希望可以通过调控窖泥微生物调控白酒中SCFAs及其乙酯的含量与比例,进而减轻过量饮用白酒对于人体健康的影响,并提升白酒的风味与口感,实现白酒健康、风味双导向。
因此还有待通过生理生化研究进一步深化人们对自然窖泥、白酒与人体肠道微生物联系的认识,这对于白酒风味与健康作用的优化具有一定意义,有利于进一步开发出白酒的价值。
[1] FANG Cheng,DU Hai.Compositional differences and similarities between Typical Chinese Baijiu and Western Liquor as revealed by mass spectrometry-based Metabolomics[J].Metabolites,2019,9(1):2.
[2] 王琳琳,王刚,张灏,等.具粘附特性的动物双歧杆菌对便秘模型小鼠血清中胃肠调节肽水平的影响[J].中国食品学报,2019,19(6):13-20.
[3] BAJAJ J S.Alcohol, liver disease and the gut microbiota[J].Nat Rev Gastroenterol Hepatol,2019,16(4):235-246.
[4] 李大和.泸州老窖 国之瑰宝——泸州老窖大曲酒五十年代查定记实[J].酿酒科技,2004(3):77-78.
[5] 何培新,李聪聪,胡晓龙,等.基于HS-SPME-GC-MS的浓香型白酒窖泥中可培养Clostridium spp.挥发性代谢物成分分析[J].轻工学报,2017,32(6):1-11.
[6] 卜光明,周化斌,周茂洪,等.酿造酒中非酿酒酵母的研究进展[J].食品工业科技,2019,40(14):346-352.
[7] 方跃进.红曲霉在我国白酒生产中的作用[J].中国酿造,2013,32(4):133-135.
[8] 刘凡,周新虎,陈翔,等.洋河浓香型白酒发酵过程酒醅微生物群落结构解析及其与有机酸合成的相关性[J].微生物学报,2018,58(12):2 087-2 099.
[9] 张杰,程伟,潘天全,等.浓香型白酒风味成分研究现状及展望[J].酿酒,2019,46(1):29-32.
[10] 刘凡,仇钰莹,周新虎,等.洋河浓香型白酒酒醅中产酸细菌与有机酸合成的相关性研究[J].食品与发酵工业,2018,44(12):22-29.
[11] FAN W L,QIAN M C.Identification of aroma compounds in Chinese ″Yanghe Daqu″ liquor by normal phase chromatography fractionation followed by gas chromatography olfactometry[J].Flavour and Fragrance Journal,2006,21(2):333-342.
[12] YAO Fen,YI Bin,SHEN Caihong,et al. Chemical analysis of the Chinese liquor Luzhoulaojiao by comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J].Scientific Reports,2015,5(1):9 553.
[13] 钱冲,廖永红,刘明艳,等.不同香型白酒的聚类分析和主成分分析[J].中国食品学报,2017,17(2):243-255.
[14] 范文来,聂庆庆,徐岩.洋河绵柔型白酒关键风味成分[J].食品科学,2013,34(4):135-139.
[15] 于卓腾,杭苏琴,姚文,等.肠道产丁酸细菌及其丁酸产生机制的研究进展[J].世界华人消化杂志,2006,14(25):2 531-2 534.
[16] 唐瑞.己酸菌、窖泥与浓香型白酒之间的关系[J].酿酒,2005,33(4):24-27.
[17] 谢佳.杂醇、酸、酯组成及氨基酸对白酒醉度的调节作用[D].广州:华南理工大学,2018.
[18] 谢佳,彭斌,何松贵,等.白酒关键微量成分对醉度及小鼠乙醇代谢和急性酒精性肝损伤的影响[J].中国酿造,2018,37(6):155-160.
[19] FUKUDA S,TOH H,HASE K,et al.Bifidobacteria can protect from enteropathogenic infection through production of acetate[J].Nature,2011,469(7 331):543-547.
[20] 冯泽猛,包显颖,印遇龙.胃肠道黏液层中Akkermansia muciniphila的定殖及其与宿主的相互作用[J].中国农业科学,2016,49(8):1 577-1 584.
[21] VIDYASAGAR S,RAMAKRISHNA B S. Effects of butyrate on active sodium and chloride transport in rat and rabbit distal colon[J].Journal of Physiology,2002,539(1):163-173.
[22] MA Xi,FAN Peixin,LI Linsen,et al.Butyrate promotes the recovering of intestinal wound healing through its positive effect on the tight junctions[J].Journal of Animal Science,2012,90:266-268.
[23] WANG Hongbo,WANG Pengyuan,WANG Xin,et al.Butyrate enhances intestinal epithelial barrier function via up-regulation of tight junction protein Claudin-1 transcription[J].Digestive Diseases and Sciences,2012,57(12):3 126-3 135.
[24] PENG L Y,LI Z R,GREEN R S,et al.Butyrate enhances the intestinal barrier by facilitating tight junction assembly via activation of AMP-activated protein kinase in Caco-2 cell monolayers[J].Journal of Nutrition,2009,139(9):1 619-1 625.
[25] TROMPETTE A,GOLLWITZER E S,YADAVA K,et al.Gut microbiota metabolism of dietary fiber influences allergic airway disease and hematopoiesis[J].Nature Medicine,2014,20(2):159-166.
[26] MACIA L,TAN J,VIEIRA A T.Metabolite-sensing receptors GPR43 and GPR109A facilitate dietary fibre-induced gut homeostasis through regulation of the inflammasome[J].Nature Communications,2015,6:6 734.
[27] KIM M H,KANG S G,PARK J H,et al.Short-chain fatty acids activate GPR41 and GPR43 on intestinal epithelial cells to promote inflammatory responses in mice[J].Gastroenterology,2013,145(2):396-406.
[28] MASLOWSKI K M,VIEIRA A T,KRANICH J.Regulation of inflammatory responses by gut microbiota and chemoattractant receptor GPR43[J].Nature,2009,461(7 268):1 282-1 286.
[29] SINGH N,GURAV A,SIVAPRAKASAM S,et al.Activation of Gpr109a, receptor for niacin and the commensal metabolite butyrate, suppresses colonic inflammation and carcinogenesis[J].Immunity,2014,40(1):128-139.
[30] THANGARAJU M,CRESCI G,LIU K,et al.GPR109A is a G-protein-coupled receptor for the bacterial fermentation product butyrate and functions as a tumor suppressor in colon[J]. Cancer Research,2009,69(7):2 826-2 832.
[31] CHANG P V,HAO L,OFFERMANNS S,et al.The microbial metabolite butyrate regulates intestinal macrophage function via histone deacetylase inhibition[J].Proceedings of the National Academy of Sciences of the United States of America,2014,111(6):2 247-2 252.
[32] FURUSAWA Y,OBATA Y,FUKUDA S,et al.Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells[J]. Nature,2013,504(7 480):446-450.
[33] ZHOU Da,PAN Qin,LIU Xiaolin,et al.Clostridium butyricum B1 alleviates high-fat diet-induced steatohepatitis in mice via enterohepatic immunoregulation[J].Journal of Gastroenterology and Hepatology,2017,32(9):1 640-1 648.
[34] LIN M Y,DE ZOETE M R,VAN PUTTEN J P,et al.Redirection of epithelial immune responses by short-chain fatty acids through inhibition of histone deacetylases[J].Frontiers in Immunology,2015,6:554.
[35] KIM M,QIE Y Q,PARK J,et al.Gut microbial metabolites fuel host antibody responses[J].Cell Host & Microbe,2016,20(2):202-214.
[36] 臧月,王生,刘楠,等.肠道菌群失调介导酒精性肝病发生发展的机制研究进展[J].中国药理学通报,2016,32(4):451-455.
[37] 窦慧馨,张得钧.酒精性肝病分子发病机制研究进展[J].基因组学与应用生物学,2016,35(7):1 643-1 647.
[38] ENGEN P A,GREEN S J,VOIGT R M,et al.The gastrointestinal microbiome: Alcohol effects on the composition of intestinal microbiota[J].Alcohol Res,2015,37(2):223-236.
[39] ZHOU Da,PAN Qin,XIN Fengzhi,et al.Sodium butyrate attenuates high-fat diet-induced steatohepatitis in mice by improving gut microbiota and gastrointestinal barrier[J].World J Gastroenterol,2017,23(1):60-75.
[40] BLOEMEN J G,VENEMA K,VAN DE POLL M C,et al.Short chain fatty acids exchange across the gut and liver in humans measured at surgery[J].Clinical Nutrition,2009,28(6):657-661.
[41] ZHOU Da,FAN Jiangao.Microbial metabolites in non-alcoholic fatty liver disease[J].World J Gastroenterol,2019,25(17):2 019-2 028.
[42] WANG Zhen,ZHANG Xiaoxia, ZHU Lili,et al.Inulin alleviates inflammation of alcoholic liver disease via SCFAs-inducing suppression of M1 and facilitation of M2 macrophages in mice[J].International Immunopharmacology,2020,78:106 062.
[43] MATTACE R G,SIMEOLI R,RUSSO R,et al.Effects of sodium butyrate and its synthetic amide derivative on liver inflammation and glucose tolerance in an animal model of steatosis induced by high fat diet[J].PLoS One,2013,8(7):e68 626.
[44] ENDO H,NIIOKA M,KOBAYASHI N,et al.Butyrate-producing probiotics reduce nonalcoholic fatty liver disease progression in rats: New insight into the probiotics for the gut-liver axis[J].PLoS One,2013,8(5):e63 388.
[45] FANG C,DU H,ZHENG X J,et al.Solid-state fermented Chinese alcoholic beverage (baijiu) and ethanol resulted in distinct metabolic and microbiome responses[J].FASEB Journal,2019,33(6):7 274-7 288.