淀粉是人体生命活动能量的重要来源,其中的葡萄糖分子由α-1,4-糖苷键与α-1,6-糖苷键连接。淀粉来源不同,其直链与支链的比例也不同,这直接影响着淀粉的颗粒形式、结晶度[1]及功能。根据在小肠中消化的难易程度(基于水解时间),可将淀粉分为快速消化淀粉(rapidly digestible starch, RDS)、缓慢消化淀粉(slowly digestible starch, SDS)和抗性淀粉(resistant starch, RS)。RDS的摄入可引起血糖及胰岛素水平的迅速提高,已有研究证明该过程可能是引起 Ⅱ 型糖尿病和肥胖症的原因之一[2];相比之下,富含SDS及RS的食物可在维持饱腹感的同时,缓慢地为机体释放能量,具有调节血糖、降低血脂、促进矿物质吸收和保护肠道等功能,因而被认为是膳食纤维的一种。由于α-1,6-糖苷键的水解速率低于α-1,4-糖苷键的水解速率,可导致淀粉体外消化速率变慢,所以增加分支密度是提高淀粉慢消化性能的策略之一[3]。
经物理改性、化学改性、生物改性(酶法改性)等方式改性处理后,天然淀粉分子重排生成簇状结构,消化速率降低,慢消化性能提高[4]。其中,使用淀粉分支酶的生物改性方法因反应条件温和、底物特异性强、得到的产物安全无污染等优点而得到青睐。但天然存在的SBE存在酶活低、成本高、处理量小、难以工业化等问题,因此利用基因工程技术开发经济实惠、高效的生物酶产品的研究亟待进行。目前SBE已在多种系统中成功异源表达。本文着重分析了近年来有关实现微生物来源的SBE在大肠杆菌、枯草芽孢杆菌中重组表达策略的研究进展,概述了这2种表达系统作为SBE生产工具的适用性特征,并讨论了SBE异源表达工程的未来前景。
1 淀粉分支酶概述
1.1 淀粉分支酶作用机理及来源
淀粉分支酶(starch branching enzyme,SBE, EC 2.4.1.18),又名1,4-α-葡聚糖分支酶(1,4-α-glucan branching enzyme, GBE),是一种集水解、转移、合成为一体的糖基转移酶[5]。SBE含有α-淀粉酶家族共有的三大结构域,即氨基末端α-夹心结构、羧基末端结构域和活性中心α/β桶域[6],主要通过链间转移、链内转移和环化反应3种催化方式与底物发生作用(图1)。对SBE一级序列的分析表明,大部分SBE属于糖苷水解酶家族GH13(glycoside hydrolase family 13),能同时作用于支链淀粉和直链淀粉[7];少部分属于糖苷水解酶家族GH57,仅作用于直链淀粉[8]。其机理是通过内部α-1,4-糖苷键的水解和释放,将切下的非还原末端转移至受体链C-6羟基,在α-葡聚糖中产生α-1,6-糖苷键,使得淀粉直链缩短、支化程度增加,得到新型改性淀粉[7]。
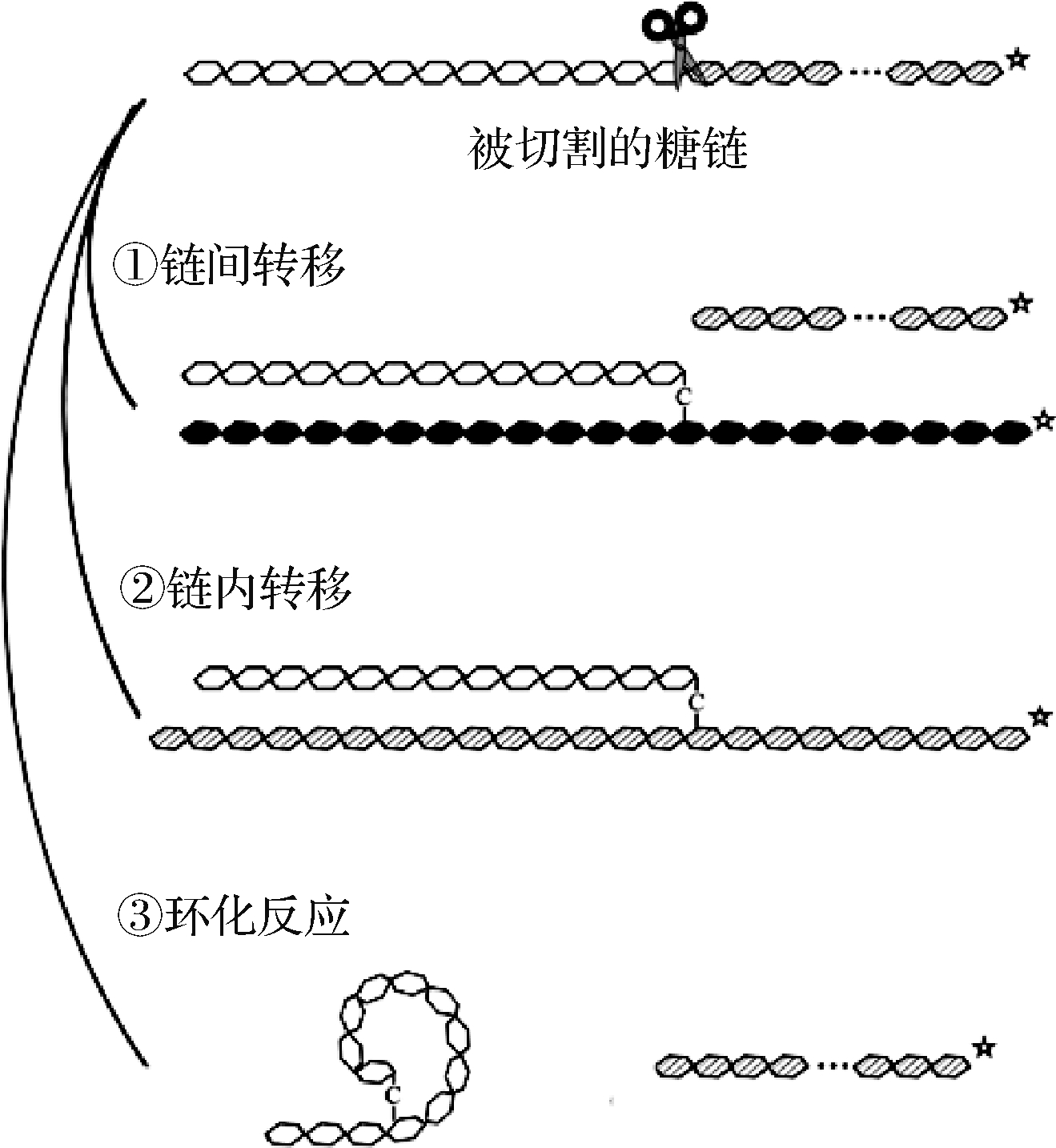
图1 淀粉分支酶作用机理(改编[9])
Fig.1 Mechanism of starch branching enzyme

在动物、植物、细菌、真菌等多种生物编码的SBE中,微生物来源SBE的最适反应温度较高、特异性强、分支化度大、催化方式简单,且易于基因操作,在工业应用中具有特殊优势。目前已经在超嗜热细菌Aquifex aeolicus[10]、嗜热脂肪芽孢杆菌[11]、Thermomonospora curvata[12]等微生物中发现了编码SBE的基因。但微生物来源SBE通常是胞内酶,天然产物的原始产生菌具有产量低等缺点,这使得利用基因工程技术实现该酶的异源表达具有重大意义。
1.2 淀粉分支酶的应用研究现状
近年来,对于改性淀粉的研究越来越成为食品工业中的热点。已有研究表明,经SBE改性后的淀粉,其稳定性和支化程度提高、抗回生特性增强、慢消化性能得到明显改善[13],符合消费者对营养健康的需求。改性淀粉可以作为糖尿病以及肥胖病患者的功能性食品;也可以作为运动饮料的一种成分,因其优良的慢消化性能而维持运动员较长时间的血糖供应[14]。除食品工业外,改性淀粉在医药、水处理、造纸工业、包装材料等领域都被广泛应用,在工业生产中具有重要的意义。
获得SBE一般通过分离纯化天然产物、化学合成和基因工程技术等途径。而野生菌株产生分支酶能力较低,需要对产酶条件进行优化,才能到达较高的产酶水平;化学合成及下游纯化工艺复杂,副产物多,且研发和生产成本高;相比之下,通过基因工程技术途径获得SBE更简便,成本更低,效果更好。目前多种微生物来源的SBE已在细菌等系统中成功重组表达,在国外生产出了一系列用于工业淀粉加工的产品。来自Bacillus stearothermophilus的SBE经Bacillus subtilis异源表达[11],实现了商业化,可在食品中利用[15];其作用的产物——高度支化环状糊精(highly branched cyclic dextrin,HBCD)[16]也是商业产品。此外,还有诺维信公司商业化Branchzyme等。但目前国内囿于技术限制,仍未出现商业化SBE产品,采取各种有效手段,打破技术壁垒是SBE高效表达研究的重要意义。
为了提高目的基因的表达量有几种较常用的手段,如在基因水平上,可以通过提高外源基因的转录水平,即筛选高效启动子及优化核糖体结合位点来提高表达水平;另外表达载体在细胞中的拷贝数和稳定性对外源基因的表达也有明显影响。在蛋白水平上,要分析掌握外源基因在表达系统中的遗传稳定性及不同生物来源的基因在表达系统中表达后加工和修饰的情况。基于淀粉加工用酶基因家族(如α-淀粉酶、普鲁兰酶、环糊精葡萄糖基转移酶、海藻糖合成酶等)异源表达的成功经验对SBE的异源表达进行优化是目前国内工作的重点,SBE在微生物中的异源高效表达策略的研究仍有许多工作等待完成。
2 淀粉分支酶在大肠杆菌的表达策略
目前,研究者已经利用大肠杆菌为宿主表达了大量不同微生物来源的SBE,如Geobacillus thermoglucosidan[17]、Geobacillus mahadia[18]等。大肠杆菌表达系统遗传背景清晰、操作手段成熟、繁殖周期短、生产费用低、产量高,应用范围十分广泛。但大肠杆菌表达系统也存在一定的缺陷,据文献报道,绝大多数微生物来源的SBE都是胞内酶,大肠杆菌无法进行蛋白质转录后的修饰,同时大肠杆菌胞质内还原性环境不利于正确的次级键的形成,部分重组蛋白易形成不溶于水的包涵体。因此,可综合采用多种策略实现SBE在大肠杆菌中的过量表达。
2.1 宿主选择
表达宿主显著影响着外源基因表达产物的表达量及表达活性。以蛋白酶缺陷的大肠杆菌作为宿主,能有效解决外源蛋白在宿主细胞中表达时易被宿主来源蛋白酶降解的问题,促使外源可溶蛋白和分泌表达的蛋白积累量提高。其中,最经典的蛋白酶缺陷型菌株就是BL21系列菌株,为T7表达系统而设计的BL21(DE3)是其中研究最成熟的表达宿主[19]。
鲍春辉等[20]将来源于Geobacillus thermoglucosidans STB02的SBE基因插入质粒pET-20b(+)的T7启动子序列下游,构建了表达载体pET-20b(+)/sbe,转化至宿主大肠杆菌BL21(DE3),经超声后产生的SBE总酶活最高为222.4 U/mL。范琴等[21]将来源于Thermomonospora curvata的SBE基因(TcSBE)重组至pET-22b(+),构建重组大肠杆菌BL21(pET-22b(+)-TcSBE),实现了TcSBE的过量表达,目标分支酶活达90.28 U/mg。LI等[22]从创伤弧菌(Vibrio vulnificus)中筛选出糖原分支酶,构建pET-15b(+)/vvgbe重组质粒转化大肠杆菌BL21(DE3),酶活达53.33 U/mL。以上研究均表明,蛋白酶缺陷型的大肠杆菌菌株是SBE异源表达的理想宿主菌株。
2.2 密码子偏爱性改造
重组蛋白在异源表达系统中的表达可能受密码子利用的影响。大肠杆菌中密码子的使用频率与原宿主细胞存在差异,且缺乏某些种类的tRNA,由此造成翻译困难或效率低下。密码子偏爱性(CUB)和mRNA结构稳定性是mRNA的重要内在特征,与mRNA表达水平呈正相关[23],将目的基因中部分碱基替换,使稀有密码子同义替换为大肠杆菌的偏爱密码子,可以得到表达量显著提高的基因型。
LIU等[24]利用系统密码子优化的方法,对来源于Paenibacillus macerans JFB05-01的野生α-环糊精葡萄糖基转移酶基因的密码子进行优化,并在BL21(DE3)中表达,合成基因菌株的蛋白质量浓度比原始基因菌株(1 710 mg/L)提高了2 520 mg/L,胞外酶活达55.3 U/mL。张晓元等[25]对海藻糖合成酶tres基因进行密码子优化,得基因tres1,分析表明,含pET-26b(+)-tres1表达载体的大肠杆菌海藻糖合成酶活性比含pET-26b(+)-tres的工程菌高60.3%以上。目的基因是表达载体上的重要结构,淀粉加工用酶基因的成功实践表明密码子偏爱性改造可能有利于外源SBE基因在大肠杆菌细胞中获得最佳表达。
2.3 促进外源蛋白高效可溶性表达
在目的基因获取、载体建立等操作的基础上,对目的基因进行表达检测也是异源表达的重要环节,大肠杆菌的培养环境将显著影响外源蛋白在其中的表达。因此,需要采取适宜的培养条件,促进SBE在大肠杆菌中的高效可溶性表达,防止其以包涵体的形式积累。
2.3.1 诱导条件优化
一般而言,组成型启动子具有稳定的基因表达水平,诱导型启动子仅在特定条件下发挥功能。在菌体生长对数早期诱导,菌体量较少,表达受到限制;在对数生长末期进行诱导,营养的消耗及代谢产物的积累使菌体生长受到抑制,表达量下降。诱导剂浓度过低可能导致低效诱导,而浓度过高会产生毒性效应,也可能导致重组蛋白在包涵体中的积累[26]。因此,在大肠杆菌中使用诱导性启动子表达可溶性外源蛋白时,必须严格控制诱导的时间和诱导剂的浓度,以使重组蛋白高效表达。
鲍春辉等[20]选择TB培养基作为发酵培养基,发现在诱导温度25 ℃下,诱导时间为培养12 h后,诱导剂异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalacto pyranoside,IPTG)浓度为0.01 mmol/L时,菌体超声破壁后产生的SBE总酶活达到最高。刘艺婷[27]在BL21(DE3)中表达来源于热葡糖苷酶地芽孢杆菌的SBE,证实了在其他培养条件一定时,诱导剂IPTG浓度为0.005 mmol/L最有利于SBE的胞外生产。KO等[28]使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析表明,在一系列梯度条件中,37 ℃下培养表达SBE的大肠杆菌直至OD600nm达到0.6时,用0.2 mmol/L IPTG诱导5 h,可获得最高总酶活。
2.3.2 发酵参数及培养基优化
大肠杆菌可以在简单又廉价的培养基上生长并达到高细胞浓度,通过选择发酵参数,如温度、时间、pH、接种量等,辅以改善培养基的组成,优化发酵工艺,可以达到提高发酵产率的目的。
DER MAAREL等[29]在大肠杆菌中过表达了来自Aquifex aeolicus的SBE,并报道了其一些基本特性,发现大多数酶存在于包涵体中。大肠杆菌生长的适宜温度为37~39 ℃,但较高的温度易导致可溶性外源蛋白生成包涵体,使表达受阻,低温培养能有效增加可溶性外源蛋白的表达[19]。李阳等[30]通过多阶段温度控制策略提高重组大肠杆菌产SBE的胞外酶活,在无需菌体破壁的情况下获得了较高的胞外酶活(48.2 U/mL)。鲍春辉等[20]以能胞内表达SBE的重组大肠杆菌BL21(DE3)(pET-20b(+)/be)为研究对象,对摇瓶发酵条件如最适发酵培养基、初始pH、发酵温度等进行了优化,得到SBE总酶活最高为222.4 U/mL。多阶段温度控制策略是提高大肠杆菌可溶性表达外源蛋白的有效举措,在此基础上使用培养基优化等基础手段,可以达到高效表达SBE的目的。
2.3.3 使用表面活性剂
外源蛋白在大肠杆菌内表达过程中容易被宿主细胞蛋白酶降解或形成包涵体,表面活性剂可能使大肠杆菌细胞内外膜渗透性增加,有助于加强蛋白分泌,但更加具体的机理尚不清楚。
成成等[31]研究了不同浓度表面活性剂Tween-80、聚乙二醇辛基苯基醚(TritonX-100)等对大肠杆菌生产α-环糊精葡萄糖基转移酶的影响,结果表明,相比未添加表面活性剂时,最终胞外酶活分别提高了4.6和12.67倍。邹纯[32]在培养基中添加Tween-80、Triton X-100、SDS等表面活性剂,探究其对大肠杆菌胞外分泌普鲁兰酶的影响。其中添加Triton X-100可使大肠杆菌产生最大总酶活,为对照组的1.45倍。目前,添加表面活性剂已在某些重组淀粉加工用酶异源表达活性提高的研究中得到了有效应用,在SBE的效果仍待探索。
3 淀粉分支酶在枯草芽孢杆菌中的表达策略
枯草芽孢杆菌由于其非致病性,分泌可溶性蛋白质的强大能力以及良好的发酵基础和生产技术,成为原核表达系统中外源蛋白表达和分泌的理想宿主[33],是认证的食品安全微生物(generally recognized as safe, GRAS)。CHOI等[11]对从表达SBE的枯草芽孢杆菌中获得的发酵产物BE-01和BE-02进行了标准的毒理学测试,证实了二者在食品生产中的安全性。一般来说,枯草芽孢杆菌分泌异源蛋白质的能力较低,为了克服这个问题,研究者采取了各种手段,如使用强启动子、酶分子定向进化等。目前,SBE在枯草芽孢杆菌中虽已成功异源表达,但表达量及酶活均较低。
3.1 使用启动子多拷贝序列
多拷贝策略通过提高基因拷贝数来提高目的蛋白表达量,是实现蛋白质更高效表达的途径。多拷贝策略主要分为表达盒多拷贝、目的基因多拷贝、启动子多拷贝等。相比于表达盒和目的基因,启动子仅有20~100 bp的长度,在多拷贝的过程中不会过多地增加宿主细胞的负担[34]。
由于单个启动子提供的核糖核酸聚合酶(ribonucleic acid polymerase,RNAP)的结合位点较少,即使使用一个强启动子来指导重组蛋白的合成,该产品的产率可能依旧较低[35]。设计多启动子表达系统,组合使用多个启动子控制同一基因的转录,是提高重组蛋白产量的一种很有前途的方法。
ZHANG等[36]研究出的双启动子PHpaII-PamyQ系统不仅在胞外α-环糊精葡萄糖基转移酶的产生中表现出最好的性能,而且还可以高效介导胞外普鲁兰酶和α-环糊精葡萄糖基转移酶的合成,这表明了该系统的普遍适用性。KANG等[37]在PHpaII启动子下游串联一个组成型启动子(枯草芽孢杆菌NA64的amyR2启动子或地衣芽孢杆菌的blma启动子),用以表达4-α-糖基转移酶,与含单个PHpaII的枯草芽孢杆菌系统相比,含串联启动子的表达系统目的产物的产量分别提高11和12倍。SONG等[38]通过评估涉及不同启动子(PHpaII和P43)和宿主组合的各种表达系统,优化了调控元件和宿主菌株,最终重组枯草芽孢杆菌支链淀粉酶的表达水平达到初始的6.28倍。
目前多个相同或不同启动子串联提高异源蛋白表达量策略已在枯草芽孢杆菌表达系统中得到了相关应用,本实验室将3个Pgrac启动子串联用以介导SBE的生产,重组枯草芽孢杆菌SBE表达水平为初始的1.5倍。随着越来越多启动子元件的识别和功能表征,可以更合理地对单个启动子序列进行串联,从而减少实验的盲目性和后续筛选过程的工作量。
3.2 外源蛋白基因改造
3.2.1 随机突变
在蛋白质基因中引进随机突变通常是蛋白质功能进化的有效策略,如采用物理诱变、化学诱变等多种方式,使含目的基因的质粒发生突变,转化受体菌获得突变体;或采用易错PCR技术向基因中引入随机突变等。在已有经验的基础上,本实验室运用体外分子进化的策略,使用NaNO2诱变获取突变质粒并转化枯草芽孢杆菌受体菌,进一步筛选最终获得1株SBE高产菌株,酶活性为出发菌株的10倍。
3.2.2 定点突变
通过在DNA水平上的碱基替换改变蛋白质特定位点的氨基酸序列,称为基因的定点突变,可以有目的地改变核苷酸序列或特定的氨基酸,从而研究基因与蛋白质的结构和功能之间的关系。李兆丰等[39]采用定点突变的方法将来源于G.thermoglueosidan的SBE的第349位甲硫氨酸(Met)分别突变成苏氨酸(Thr)或丝氨酸(Ser),所得2株突变体产物酶活相比于野生淀粉分支酶活力都提高了60%。LIU等[40]发现来自G.thermoglucosidans STB02的SBE中,丙氨酸310(Ala310)位于保守区域Ⅱ,当用其他多种氨基酸取代Ala310后,突变酶活性下降10%~25%,表明Ala310对于来自G.thermoglucosidans STB02的SBE的催化活性至关重要。
此外,通过酶分子定点饱和突变可以构建高质量突变体文库,对特定靶点进行组合突变,实现酶分子的定向进化。为促进嗜热酸性α-淀粉酶基因在Bacillus subtilis WB600中的高效分泌表达,袁林等[41]对信号肽Yfk N的2个氨基酸位点进行饱和突变,得到的重组枯草芽孢杆菌的胞外α-淀粉酶活力为出发菌株的1.33倍。本实验室基于序列比对及前期随机突变结果,对SBE基因进行定点饱和突变,SBE酶活性较出发菌株提高30%。
3.3 优化信号肽
将所需靶蛋白分泌到培养基中的第一步是跨细胞膜转运,可细胞膜转移的蛋白质通常具有N-末端信号肽,包含3个不同的区域:带正电的N-末端结构域、疏水性核心区域和带负电荷的C-末端区域(具有信号肽酶切割位点)[42]。将蛋白质递送到正确的位置后,信号肽被信号肽酶降解。在细菌中,普通分泌途径是从细胞质中输出蛋白质最重要的方式[43],在许多细菌中还存在双精氨酸途径[44]。信号肽的性质显著影响宿主培养上清中蛋白的最终产量,因此,为靶蛋白寻找最佳信号肽是有效分泌生产过程中最关键的步骤之一。但目前尚无法预测在特定表达宿主中,哪个信号肽将最适合特定靶蛋白的表达[45]。
如YAO等[46]研究中,通过筛选173种枯草芽孢杆菌信号肽获得α-淀粉酶最佳信号肽SP YojL,所得重组菌株产生的细胞外α-淀粉酶活性比对照高3.5倍。WATANABE等[47]以谷氨酸棒杆菌为宿主,异源表达来自嗜热芽孢杆菌的α-淀粉酶,在405种候选信号肽中发现CGR0949信号肽可获得最高的α-淀粉酶产量。
经验和证据表明,异源蛋白质的分泌效率与信号肽高度相关,尽管具体的设计规则仍然难以捉摸,优化信号肽的方法仍有望提高其他酶在枯草芽孢杆菌系统中的表达量。继续优化信号肽这项工作将加快SBE等蛋白产品的工艺优化,也是本实验室对于SBE研究的工作计划之一。
3.4 改进诱导方法与培养条件
液体发酵中的各种物理化学参数,如培养温度、pH值、接种量、诱导时间、添加剂种类等,都会对SBE的产量产生巨大影响。通过优化这些参数,可以提高SBE在枯草芽孢杆菌中的产量。
杨韵霏等[48]将来自地衣芽孢杆菌的麦芽糖淀粉酶基因克隆至枯草芽孢杆菌中异源表达,并研究得到最适诱导温度为45 ℃,最适诱导剂浓度为1%,最适诱导时间为接种培养9 h后。王驰等[49]在B.subtilis WB600中表达SBE,通过两阶段温度控制策略,胞外酶活力与单一温度条件下的最高水平相比提高了1.4倍;在此基础上添加体积分数0.05%的Tween-80,可将胞外酶活由47.1 U/mL进一步提高到65.8 U/mL。ZHANG等[50]为提高来自B.naganoensis的普鲁兰酶在B.subtilis WB600中表达的酶活性,从接种量、pH值等角度出发,优化了重组枯草芽孢杆菌生产普鲁兰酶的最佳发酵条件,优化后产物的酶活性比优化前提高144%。改进诱导方法与培养条件的策略对于提高微生物蛋白酶产物表达量及表达活性具有一定的通用性,在淀粉加工用酶类产物的研究中均取得了良好的效果,是本实验室正在进行的研究工作。
4 结论
我国淀粉年总产量达上千万吨,广泛应用于食品、制药、造纸、化工等行业。尽管我国已跻身世界淀粉强国行列,但国内企业主要生产销售传统淀粉产品,具有较高附加值的淀粉品种少、产量低,与国际水平相比仍有较大的差距。使用SBE对淀粉进行改性是综合利用淀粉的重要手段之一。
SBE的异源表达可通过多种表达宿主完成,其中大肠杆菌研究深入,背景清晰,且具有易于培养、成本低、操作简单等优势,因而成为SBE原核表达的主要表达宿主;SBE在枯草芽孢杆菌中的重组表达也较为广泛。大肠杆菌异源表达的SBE多存在于包涵体内,实现SBE的高效胞外分泌表达是其研究的重点之一。枯草表达系统较传统的大肠杆菌系统,研究尚不成熟,但它在活性蛋白分泌、下游处理简化、安全性提高等方面则表现出显著优势,由此决定其更适合应用于食品领域,具有较大的研究与应用潜力。实践证明,枯草表达系统能成功表达的外源蛋白质种类繁多,表达产物能保持其理化性质和生物活性。另外,在枯草表达系统运用中,仍存在表达效率和稳定性不佳等问题,因此,对表达效率、稳定性、后期纯化难度等的有效评价和优化,仍是SBE异源表达研究中的重点。除了大肠杆菌和枯草芽孢杆菌,其他细菌也被应用于SBE的异源表达,如地衣芽孢杆菌、解淀粉芽孢杆菌等。
在国外实现SBE商业化的背景下,国内针对SBE生产的研究仍处于起步阶段,且大多基于国外的零散介绍和借鉴。创新的关键不仅在于企业自身的努力,还需要基础研究的推动。作者所在团队在现有理论的支持下,立足开发优良宿主菌株和表达载体,同时挖掘不同微生物来源的高性能SBE编码基因,结合体外酶分子定向进化及高效发酵生产工艺,不断提高SBE的表达量及活性。随着人们对蛋白质研究的日益深入,基因工程手段的逐渐完善,在微生物中异源表达SBE的技术会越来越成熟,成本逐渐降低,改性淀粉将拥有更加光明的应用前景。
[1] COPELAND L, BLAZEK J, SALMAN H, et al. Form and functionality of starch[J]. Food Hydrocolloids, 2009, 23(6): 1 527-1 534.
[2] SALERM N J, MANSON J E, STAMPFER M J, et al. Dietary fiber, glycemic load, and risk of non-insulin-dependent diabetes mellitus in women[J]. The Journal of the American Medical Association, 1997, 277(6): 472-477.
N J, MANSON J E, STAMPFER M J, et al. Dietary fiber, glycemic load, and risk of non-insulin-dependent diabetes mellitus in women[J]. The Journal of the American Medical Association, 1997, 277(6): 472-477.
[3] ZHANG G, HAMAKER B R. Slowly digestible starch: Concept, mechanism, and proposed extended glycemic index[J]. Critical Reviews in Food Science and Nutrition, 2009, 49(10): 852-867.
[4] GO R M, MARK A E, MALDE A K, et al. Binding of starch fragments to the starch branching enzyme: Implications for developing slower-digesting starch[J]. Biomacromolecules, 2015, 16(8):2 475-2 481.
[5] TETLOW I J, EMES M J. A review of starch-branching enzymes and their role in amylopectin biosynthesis[J]. International Union of Biochemistry and Molecular Biology Life, 2014, 66(8): 546-558.
[6] ABAD M C, BINDERUP K, RIOS-STEINER J, et al. The X-ray crystallographic structure of Escherichia coli branching enzyme[J]. Journal of Biological Chemistry, 2002, 277(44):42 164-42 170.
[7] DIJKHUIZEN L, KRALJ S, VAN DER MAAREL M J E C, et al. The unique branching patterns of deinococcus glycogen branching enzymes are determined by their N-terminal domains[J]. Applied and Environmental Microbiology, 2009, 75(5): 1 355-1 362.
[8] PALOMO M, PIJNING T, BOOIMAN T, et al. Thermus thermophilus glycoside hydrolase family 57 branching enzyme: Crystal structure, mechanism of action and products formed[J]. Journal of Biological Chemistry, 2011, 286(5): 3 520-3 530.
[9] 李才明, 李阳, 顾正彪, 等. 麦芽糊精的支化修饰及其特性研究进展[J]. 中国食品学报, 2018, 18(10): 1-8.
[10] TAKATA H,OHDAN K,TAKAHA T,et al. Properties of branching enzyme from hyperthermophilic bacterium, Aquifex aeolicus, and its potential for production of highly-branched cyclic dextrin[J]. Journal of Applied Glycoscience, 2003, 50(1): 15-20.
[11] CHOI S S, DANIELEWSKA NIKIEL B, KOJIMA I, et al. Safety evaluation of 1,4-α-glucan branching enzymes from Bacillus stearothermophilus and Aquifex aeolicus expressed in Bacillus subtilis[J]. Food Chem Toxicol, 2009, 47(8): 2 044-2 051.
[12] FAN Qin,XIE Zhengjun,ZHAN Jinling, et al. A glycogen branching enzyme from Thermomonospora curvata: Characterization and its action on Maize starch[J]. Starch - St rke, 2016, 68(3-4): 355-364.
rke, 2016, 68(3-4): 355-364.
[13] JOBLING S. Improving starch for food and industrial applications[J]. Current Opinion in Plant Biology, 2003, 7(2):210-218.
[14] 马尔克·乔斯·埃利塞·科尔内利斯·凡德马雷拉, 多伊德·哈科博·宾纳玛, 辛迪·塞梅因, 等. 新型可缓慢消化的贮存碳水化合物: 荷兰, CN101631474[P]. 2010-01-20.
[15] PARIZA M W, JOHNSON E A. Evaluating the safety of microbial enzyme preparations used in food processing: Update for a new century[J]. Regulatory Toxicology & Pharmacology, 2001, 33(2): 173-186.
[16] RYOYAMA K, KIDACHI Y, YAMAGUCHI H, et al. Anti-tumor activity of an enzymatically synthesized α-1,6 branched α-1,4-glucan, glycogen[J]. Journal of the Agricultural Chemical Society of Japan, 2004, 68(11): 2 332-2 340.
[17] BAN Xiaofeng, LI Caiming, GU Zhengbiao, et al. Expression and biochemical characterization of a thermostable branching enzyme from Geobacillus thermoglucosidans[J]. Journal of Molecular Microbiology and Biotechnology, 2016,26(5): 303-311.
[18] MOHTAR N S, RAHMAN M B A, RAHMAN R N Z R A, et al. Expression and characterization of thermostable glycogen branching enzyme from Geobacillus mahadia Geo-05[J].Peerj,2016, 4(12): e2 714.
[19] KAUR J, KUMAR A, KAUR J. Strategies for optimization of heterologous protein expression in E. coli : Roadblocks and reinforcements[J]. International Journal of Biological Macromolecules, 2018, 106: 803-822.
[20] 鲍春辉, 顾正彪, 李才明, 等. 重组大肠杆菌产淀粉分支酶的发酵条件探索[J]. 食品工业科技, 2014, 35(15): 155-158,162.
[21] 范琴, 谢正军, 金征宇, 等. Thermomonospora curvata淀粉分支酶的过量表达及其催化反应机理研究[J]. 现代食品科技, 2016, 32(6): 70-76.
[22] LI Lingling, SU Lingqia, HU Fan, et al. Recombinant expression and characterization of the glycogen branching enzyme from Vibrio vulnificus and its application in starch modification[J]. International Journal of Biological Macromolecules, 2019,155: 987-994.
[23] VICTOR M P, ACHARYA D, BEGUM T, et al. The optimization of mRNA expression level by its intrinsic properties—Insights from codon usage pattern and structural stability of mRNA[J]. Genomics, 2019, 111(6),1 292-1 297.
[24] LIU Hua, LI Jianghua, DU Guocheng, et al. Enhanced production of α-cyclodextrin glycosyltransferase in Escherichia coli by systematic codon usage optimization[J]. Journal of Industrial Microbiology & Biotechnology, 2012, 39(12):1 841-1 849.
[25] 张晓元, 郝荣华, 刘飞, 等. 密码子优化提高海藻糖合成酶基因在大肠杆菌中的表达水平[J]. 食品与药品, 2019, 21(1): 1-6.
[26] TOLIA N H, JOSHUA TOR L. Strategies for protein coexpression in Escherichia coli[J]. Nature Methods, 2006, 3(1): 55-64.
[27] 刘艺婷.淀粉分支酶在大肠杆菌中的分泌表达及其分子改造研究[D].无锡:江南大学, 2017.
[28] KO Y T, CHUNG P S, SHIH Y C, et al. Cloning, characterization, and expression of mungbean (Vigna radiata L.) starch branching enzyme Ⅱ cDNA in Escherichia coli[J]. Journal of Agricultural & Food Chemistry, 2009, 57(3): 871-879.
[29] DER MAAREL M J, VOS A, SANDERS P, et al. Properties of the glucan branching enzyme of the hyperthermophilic bacterium Aquifex aeolicus[J]. Biocatalysis and Biotransformation, 2010, 21(4-5):199-207.
[30] 李阳, 李兆丰, 任俊彦, 等. 一种提高淀粉分支酶在大肠杆菌中胞外分泌表达的方法:中国,CN107119026A[P]. 2017-09-01.
[31] 成成, 李兆丰, 李彬, 等. 利用重组大肠杆菌生产α-环糊精葡萄糖基转移酶[J]. 生物加工过程, 2009, 7(3): 56-63.
[32] 邹纯.重组Bacillus deramificans普鲁兰酶的高效胞外表达及其应用[D].无锡:江南大学, 2016.
[33] 余小霞, 田健, 刘晓青, 等. 枯草芽孢杆菌表达系统及其启动子研究进展[J]. 生物技术通报, 2015, 31(2): 35-44.
[34] 吴志伟, 徐立新, 佟金, 等. 多拷贝策略在增强目的基因表达中的应用[J]. 生命科学研究, 2016, 20(2): 166-170.
[35] ÖZTÜRK S, ERGÜN B G, ÇAL K P. Double promoter expression systems for recombinant protein production by industrial microorganisms[J]. Applied Microbiology and Biotechnology, 2017, 101(20): 7 459-7 475.
K P. Double promoter expression systems for recombinant protein production by industrial microorganisms[J]. Applied Microbiology and Biotechnology, 2017, 101(20): 7 459-7 475.
[36] ZHANG Kang, SU Lingqia, DUAN Xuguo, et al. High-level extracellular protein production in Bacillus subtilis using an optimized dual-promoter expression system[J]. Microbial Cell Factories, 2017, 16(1): 32.
[37] KANG H K, JANG J H, SHIM J H, et al. Efficient constitutive expression of thermostable 4-α-glucanotransferase in Bacillus subtilis using dual promoters[J]. World Journal of Microbiology and Biotechnology, 2010, 26(10):1 915-1 918.
[38] SONG Wan, NIE Yao, MU Xiaoqing, et al. Enhancement of extracellular expression of Bacillus naganoensis pullulanase from recombinant Bacillus subtilis : Effects of promoter and host[J]. Protein Expression and Purification, 2016, 124: 23-31.
[39] 李兆丰, 顾正彪, 刘艺婷, 等. 一种提高淀粉分支酶活力的方法:中国, CN106190998A[P]. 2016-08-25.
[40] LIU Yiting, LI Caiming, GU Zhengbiao, et al. Alanine 310 is important for the activity of 1,4-α-glucan branching enzyme from Geobacillus thermoglucosidans STB02[J]. International Journal of Biological Macromolecules, 2017, 97: 156-163.
[41] 袁林, 曾静, 郭建军, 等. 极端嗜热酸性α-淀粉酶PFA在枯草芽孢杆菌中的高效分泌表达[J]. 食品科学, 2018, 39(18): 100-108.
[42] SONG Y F, NIKOLOFF J M, ZHANG D W. Improving protein production on the level of regulation of both expression and secretion pathways in Bacillus subtilis[J]. Journal of Microbiology & Biotechnology, 2015, 25(7): 963-977.
[43] TSIRIGOTAKI A, DE GEYTER J, SOSTARIC N, et al. Protein export through the bacterial Sec pathway[J]. Nature Reviews Microbiology, 2017, 15(1): 21-36.
[44] PALMER T, BERKS B C. The twin-arginine translocation (Tat) protein export pathway[J]. Nature Reviews Microbiology,2012, 10(7): 483-496.
[45] FREUDL R. Signal peptides for recombinant protein secretion in bacterial expression systems[J]. Microbial Cell Factories, 2018, 17(1): 52.
[46] YAO Dongbang, SU Lingqia, LI Na, et al. Enhanced extracellular expression of Bacillus stearothermophilus α-amylase in Bacillus subtilis through signal peptide optimization, chaperone overexpression and α-amylase mutant selection[J]. Microbial Cell Factories, 2019, 18(1): 69.
[47] WATANABE K, TSUCHIDA Y, OKIBE N, et al. Scanning the Corynebacterium glutamicum R genome for high-efficiency secretion signal sequences[J]. Microbiology, 2009, 155(3): 741-750.
[48] 杨韵霏, 李由然, 张梁, 等. 细菌麦芽糖淀粉酶在枯草芽孢杆菌中的诱导型异源表达[J]. 微生物学通报, 2017, 44(2): 263-273.
[49] 王驰, 李柱, 李才明, 等. 两阶段温度控制策略以及助剂促进淀粉分支酶的胞外表达[J]. 食品与发酵工业, 2016, 42(8): 19-24.
[50] ZHANG Yu, NIE Yao, ZHOU Xia, et al. Enhancement of pullulanase production from recombinant Bacillus subtilis by optimization of feeding strategy and fermentation conditions[J]. AMB Express, 2020, 10(1):11.