冠突散囊菌(Eurotium cristatum)是广泛存在于茯砖茶中并使其产生特征风味的优势菌种[1],属于散囊菌目发菌科散囊属的一种真菌[2],因其在生长繁殖过程中会产生金黄色的闭囊壳,故俗称“金花菌”。因冠突散囊菌具有降脂、抗氧化、抗肿瘤和抗衰老等生理活性[3-6],使得人们越来越青睐对冠突散囊菌的研究。冠突散囊菌生长时通常会代谢产生大量的色素物质[7],初期主要色素为黄色素,随着培养时间的增长会伴随着黑色素的产生,但其研究鲜见报道。黑色素广泛存在于动植物和微生物中,是所有已知生物色素中存在最多、最广的一类色素[8],研究表明,黑色素具有独特的生理功能[9],如避免光对生物体的伤害[10]、强抗氧化性[11-13]、抗癌[14-15]、抗辐射[16]、免疫调节[17-19]等作用,因此黑色素具有广阔的应用前景。
本试验拟采用响应面试验设计的方法对冠突散囊菌胞外黑色素发酵条件进行优化,探讨各因素之间交互作用对黑色素含量的影响,并对其稳定性进行研究,旨在为微生物源天然功能性色素的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
冠突散囊菌(Eurotium cristatum),由湖南安化白沙溪茶厂的茯砖茶中分离获得。
冠突散囊菌发酵培养基:马铃薯200 g/L,葡萄糖20 g/L,蒸馏水1 L。
培养条件:装液量120 mL,转速140~220 r/min,培养温度24~32 ℃,培养时间10 d。
NaOH、Na2SO3、H2O2和浓HCl(化学纯),由国药集团化学试剂有限公司提供。
1.2 仪器与设备
ZQPL-200全温振荡培养箱,天津市莱玻特瑞仪器设备有限公司;XMTD 数显恒温水浴锅,上海浦东物理光学仪器厂;CF16RXⅡ型高速冷冻离心机,日本株式会社日立高新技术科学有限公司;FD-1A-50冷冻干燥机,北京博医康实验仪器有限公司;UH5300型分光光度计,日本株式会社日立高新技术科学有限公司。
1.3 试验方法
1.3.1 冠突散囊菌胞外黑色素发酵液的制备及黑色素的提取
黑色素发酵液的制备:取活化后的冠突散囊菌菌种接种于装有120 mL发酵培养基的500 mL三角瓶中,置28 ℃摇床中,180 r/min,培养10 d,过滤得冠突散囊菌发酵液。
黑色素的提取:据前期试验得出的最优提取工艺进行提取,准确量取冠突散囊菌发酵液50 mL,加入70 mL 1 mol/L 的NaOH溶液,在74 ℃水浴中搅拌提取,趁热过滤,再酸沉(用6 mol/L HCl调滤液至pH值为2.5 后置于74 ℃水浴中静置4 h,使冠突散囊菌胞外黑色素絮凝使其沉淀),然后离心去除上清液得到黑色沉淀物,用蒸馏水洗至中性,冷冻干燥后得到黑色素粗品,依次采用乙酸乙酯、氯仿和乙醇分别对黑色素粗品进行萃取提纯,冷冻干燥后得到冠突散囊菌胞外黑色素。
1.3.2 色素吸收光谱的测定
取一定量上述黑色素溶于1 mol/L 的NaOH溶液中,并以1 mol/L的NaOH溶液作参比液,用紫外-可见分光光度计于200~800 nm进行光谱扫描[20],测定黑色素的最大吸收峰值λmax。再用1 mol/L 的NaOH溶液将黑色素溶液稀释10、20、30、40、50倍,用分光光度计在λmax处测定各稀释液的吸光度。记录各稀释倍数的吸光度数据计算其线性相关性。
1.3.3 冠突散囊菌胞外黑色素发酵条件优化
1.3.3.1 培养温度对冠突散囊菌胞外黑色素含量的影响
将冠突散囊菌发酵培养基(自然pH),接种冠突散囊菌后分别置于24、26、28、30、32 ℃摇床中转速为180 r/min培养10 d,取发酵液与等体积的1 mol/L 的NaOH于74 ℃水浴中搅拌提取,反应结束后5 000 r/min离心10 min,取上清液测定其在λmax处吸光值,吸光值越高表示黑色素含量越高。每个处理组3个重复。
1.3.3.2 培养基pH对冠突散囊菌胞外黑色素含量的影响
将冠突散囊菌发酵培养基用0.1 mol/L HCl和0.1 mol/L NaOH 调节培养基pH值为5、6、7、8、9,接种冠突散囊菌后于28 ℃摇床中转速为180 r/min培养10 d,取发酵液与等体积的1 mol/L 的NaOH于74 ℃水浴中搅拌提取,反应结束后5 000 r/min离心10 min,取上清液测定其在λmax处吸光值,吸光值越高表示黑色素含量越高。每个处理组3个重复。
1.3.3.3 摇床转速对冠突散囊菌胞外黑色素含量的影响
将冠突散囊菌发酵培养基接种冠突散囊菌后于28 ℃摇床中分别以转速140、160、180、200、220 r/min培养10 d,取发酵液与等体积的1 mol/L 的NaOH于74 ℃水浴中搅拌提取,反应结束后5 000 r/min离心10 min,取上清液测定其在λmax处吸光值,吸光值越高表示黑色素含量越高。每个处理组3个重复。
1.3.4 响应面法对冠突散囊菌胞外黑色素发酵条件的优化
以培养温度、培养基pH、摇床转速作自变量,冠突散囊菌黑色素吸光值为因变量进行响应面试验,确定冠突散囊菌黑色素的最佳发酵条件参数。试验因素水平编码见表1。
表1 响应面试验因素水平与编码
Table 1 Factor level and coding of response surface test

编码转速(A)/(r·min-1)温度(B)/℃pH (C)-116026601802871200308
1.3.5 冠突散囊菌胞外黑色素稳定性的研究
1.3.5.1 光照对冠突散囊菌胞外黑色素稳定性的影响
取黑色素溶液分为3份,2份分别于自然光、黑暗环境中放置3 d,每隔1 d取样测定其在λmax处吸光值,另一份置于紫外灯下,每30 min取样测定其在λmax处吸光值,观察光照对冠突散囊菌胞外黑色素稳定性的影响。
1.3.5.2 温度对冠突散囊菌胞外黑色素稳定性的影响
取黑色素溶液分为4份,1份置于室温(25 ℃)中避光保存,其余3份分别置于50、70、100 ℃水浴锅中避光保温,每30 min取样,待溶液降温至室温后测定其在λmax处吸光值,观察温度对冠突散囊菌胞外黑色素稳定性的影响。
1.3.5.3 氧化剂、还原剂对冠突散囊菌胞外黑色素稳定性的影响
以H2O2为氧化剂、Na2SO3为还原剂,配置质量分数为0.5%、1%、1.5%、2%、2.5%的H2O2溶液,0.1%、0.3%、0.5%、1%、1.5%的Na2SO3溶液,分别量取2 mL加入到8 mL黑色素溶液,于室温中避光放置1 h后测定其在λmax处吸光值。
1.3.5.4 金属离子对冠突散囊菌胞外黑色素稳定性的影响
配置0.05 mol/L的MgCl2、NaCl、ZnCl2、CaCl2、FeCl3、CuCl2溶液,分别量取2 mL加入到8 mL黑色素溶液,于室温中避光放置1 h测定其在λmax处吸光值,观察金属离子对冠突散囊菌胞外黑色素稳定性的影响。
1.3.6 数据分析
利用Origin 8.5、Design-Expert 10.0.3和SPSS 22.0数据处理系统对试验结果进行分析。
2 结果与分析
2.1 色素吸收光谱的确定
图1为冠突散囊菌胞外黑色素紫外-可见光谱图,该种黑色素在紫外可见光区域里,吸收值随着波长的增大而降低,且在298 nm处有最大吸收峰,这一特征与吴世玉等[21],CHENG等[22]和SELVAKUMAR等[23]的结果十分相似。色素溶液线性关系表明不同浓度的色素溶液在298 nm 处与吸光值具有良好的线性关系,其回归方程为y=-0.015 9x+1.924,R2=0.991 3,说明采用吸光度来研究色素稳定性是合理可行的。
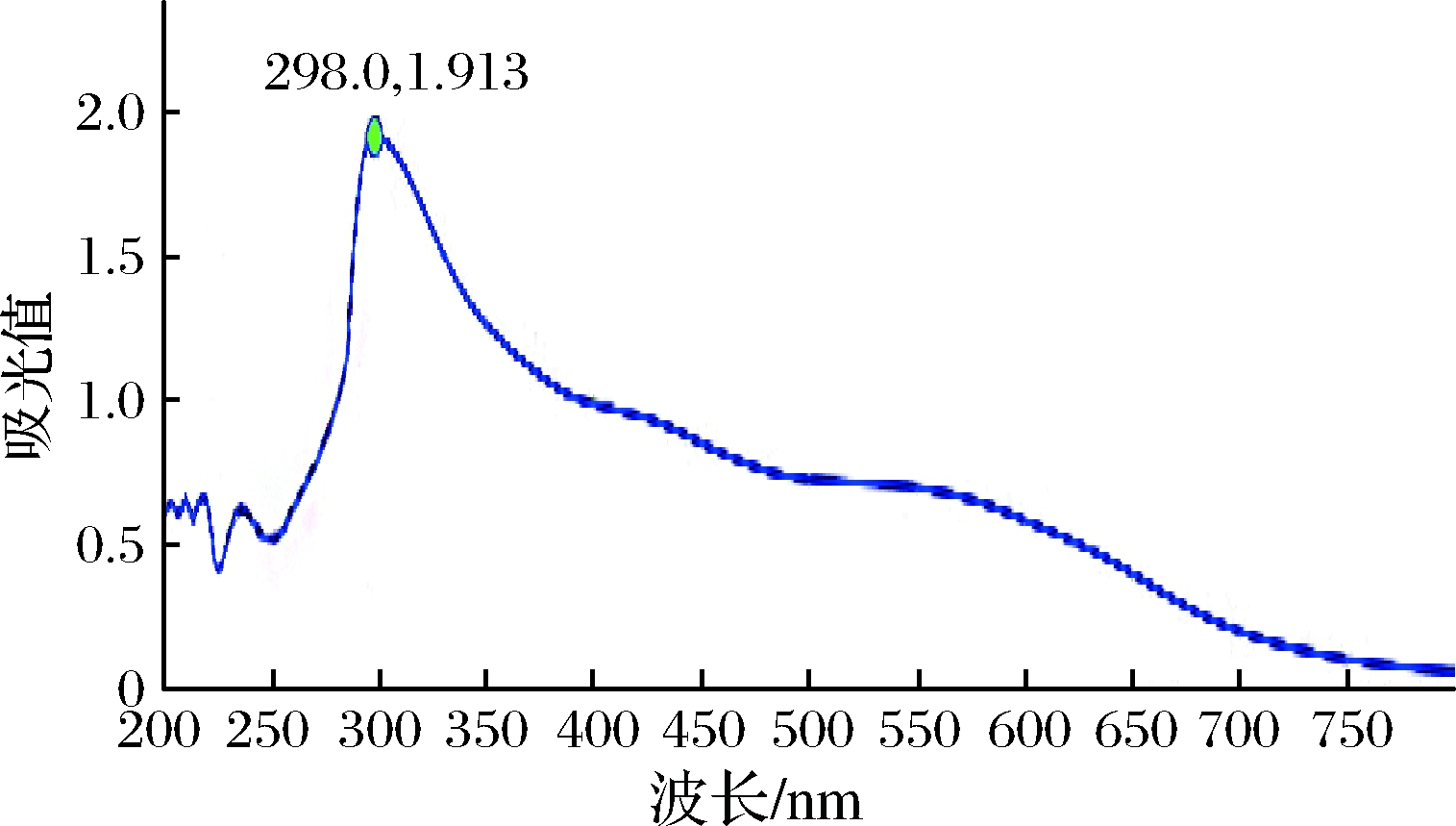
图1 冠突散囊菌胞外黑色素的紫外-可见吸收光谱图
Fig.1 UV-absorption spectrum of extracellular melanin of Eurotium cristatum
2.2 冠突散囊菌胞外黑色素发酵条件优化
2.2.1 培养温度对冠突散囊菌胞外黑色素含量的影响
不同培养温度对冠突散囊菌胞外黑色素含量影响结果如图2所示。由图2可知,冠突散囊菌胞外黑色素的吸光值随着温度的升高呈现先上升后下降的趋势,当温度为28 ℃时,吸光值达到最大1.107。根据郭劲霞等[24]的研究发现,温度对冠突散囊菌的生长有双重效应。当温度高于28 ℃时,冠突散囊菌生长受到抑制,过高温度在一定程度上也会影响微生物代谢的酶系[25],从而影响黑色素的生成。

图2 培养温度对冠突散囊菌胞外黑色素含量的影响
Fig.2 Effect of extracellular melanin content of Eurotium cristatum in culture temperature
注:不同字母代表差异显著(P<0.05)(下同)
2.2.2 培养基pH对冠突散囊菌胞外黑色素含量的影响
不同培养基pH对冠突散囊菌胞外黑色素含量影响结果如图3所示。由图3可知,冠突散囊菌胞外黑色素的吸光值随着pH的升高呈先上升后下降的趋势,当pH为7时,吸光值达到最大1.1。在微生物的生长和代谢过程中,培养基pH起着重要的作用,陈云兰[26]研究发现冠突散囊菌在偏酸性的条件下生长较好,偏碱性的环境会导致菌株生长缓慢,影响黑色素的生成。

图3 pH对冠突散囊菌胞外黑色素含量的影响
Fig.3 Effect of extracellular melanin content of Eurotium cristatum in pH
2.2.3 摇床转速对冠突散囊菌胞外黑色素含量的影响
摇床转速对冠突散囊菌胞外黑色素含量影响结果如图4所示。由图4可知,冠突散囊菌胞外黑色素的吸光值随着摇床转速的增大呈先上升后下降的趋势,当摇床转速为180 r/min时,吸光值达到最大1.067。适宜的摇床转速能提高溶氧量,有利于冠突散囊菌的生长及黑色素的生成[27],过高的转速可导致真菌菌丝体破碎自溶[28],不利于黑色素的生成。

图4 转速对冠突散囊菌胞外黑色素含量的影响
Fig.4 Effect of rotational speed on extracellular melanin content of Eurotium cristatum
2.3 响应面试验
根据Box-Benhnken采样原理,选择转速、温度、pH进行3因素3水平的响应面分析试验。响应面试验结果如表2所示。
表2 响应面试验设计与结果
Table 2 Design and results of response surface test
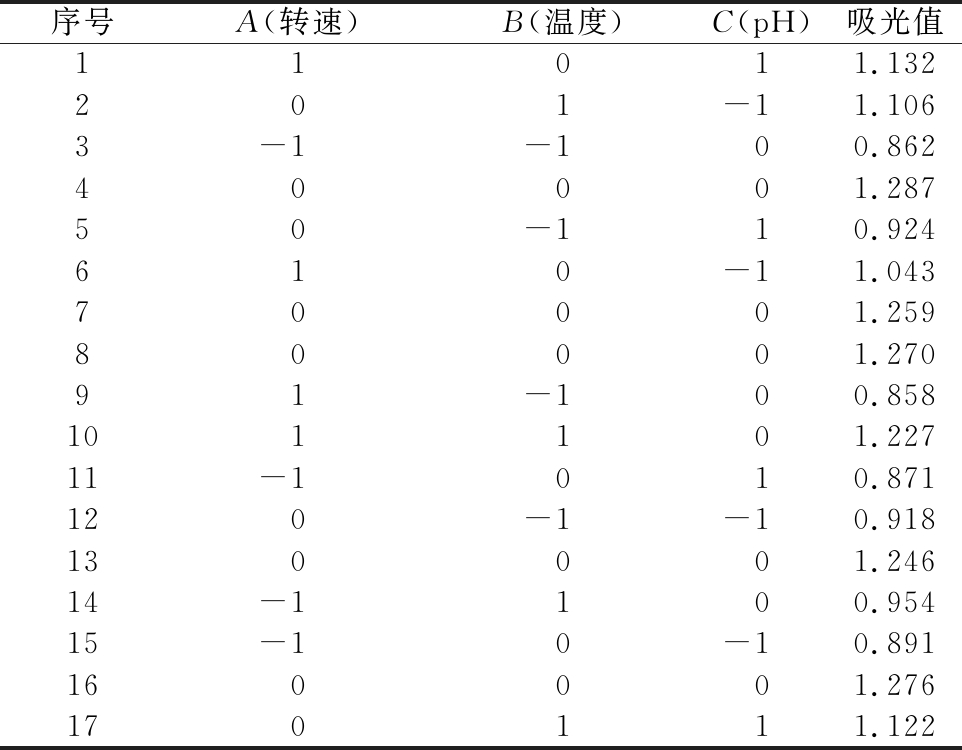
序号A(转速)B(温度)C(pH)吸光值11011.132201-11.1063-1-100.86240001.28750-110.924610-11.04370001.25980001.27091-100.858101101.22711-1010.871120-1-10.918130001.24614-1100.95415-10-10.891160001.276170111.122
利用Design-Expert 10.0.3软件对实验数据进行分析,得到二次多项回归方程:吸光值=1.267 6+0.085 25×A+0.105 875×B+0.011 375×C+0.069 25×AB+0.027 25×AC+0.002 5×B-0.162 8×A2-0.129 55×B2-0.120 55×C2
模型方差分析如表3所示。由表3可知,模型的F=75.39,P<0.000 1差异极显著,并且失拟项P=0.082 0>0.05;回归模型的决定系数R2=0.989 8,校正系数![]() 表明该模型与试验结果拟合较好,可以用该模型来分析和预测黑色素最优发酵条件。通过比较各因素的F值可知,发酵条件对吸光值影响大小顺序为B(温度)>A(转速)>C(pH)。
表明该模型与试验结果拟合较好,可以用该模型来分析和预测黑色素最优发酵条件。通过比较各因素的F值可知,发酵条件对吸光值影响大小顺序为B(温度)>A(转速)>C(pH)。
表3 响应面拟合回归方程的方差分析结果
Table 3 Analysis of variance results of response surface fitting regression equation

注:![]() 表示差异显著P<0.05,**表示差异极显著,P<0.01
表示差异显著P<0.05,**表示差异极显著,P<0.01
方差来源平方和自由度方差F值P值显著性回归模型0.4490.04975.39<0.000 1显著A0.05810.05889.16<0.000 1**B0.09010.090137.53<0.000 1**C1.035E-00311.035E-0031.590.248 1AB0.01910.01929.420.001 0*AC2.970E-00312.970E-0034.560.070 2*BC2.500E-00512.500E-0050.0380.850 3A20.1110.11171.14<0.000 1**B20.07110.071108.37<0.000 1**C20.06110.06193.84<0.000 1**残差4.564E-00376.521E-004失拟项3.571E-00331.190E-0034.790.082 0不显著纯误差9.932E-00442.483E-004合计0.4516
响应面和等高线图如图5所示,等高线图呈现椭圆状,交互作用显著,等高线图呈现圆状,交互作用不显著。根据Design-Expert 10.0.3 软件运行结果,最优发酵条件组合为转速 184.096 r/min、温度 29.145 ℃、pH 6.771,在此条件下模型预测的理论吸光值为1.294。
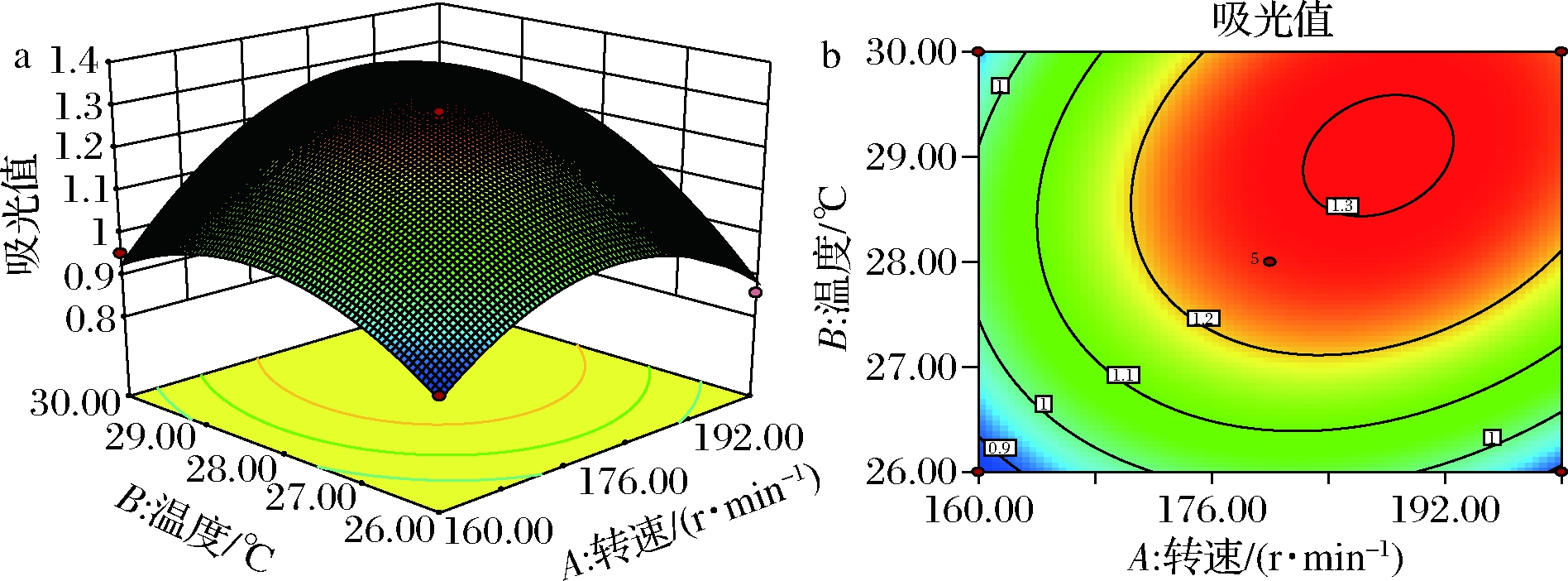

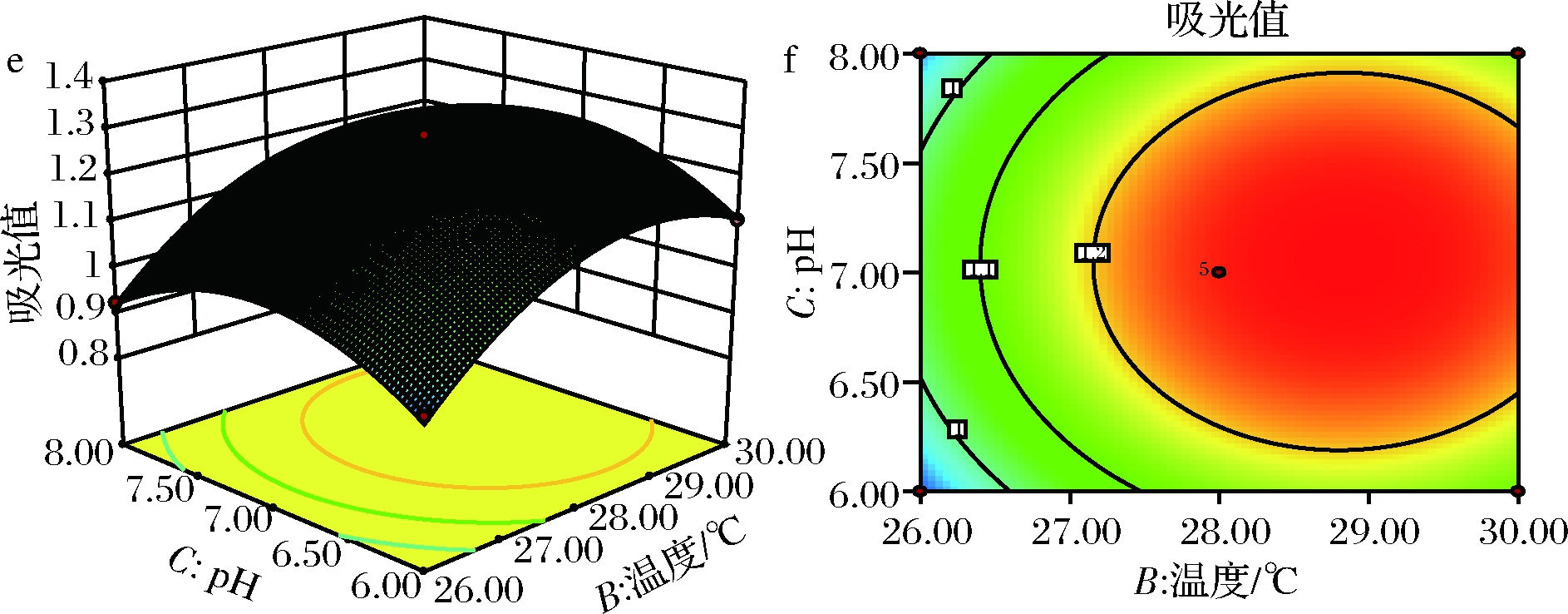
a-温度、转速对吸光值影响的响应曲面;b-温度、转速对吸光值影响的等高线;c-pH、转速对吸光值影响的响应曲面;d-pH、转速对吸光值影响的等高线;e-pH、温度对吸光值影响的响应曲面;f-pH、温度对吸光值影响的等高线
图5 温度、pH和转速的交互作用对吸光值的影响
Fig.5 Effect of absorbance on interaction between temperature, pH and speed
考虑到操作的可行性,将最优发酵条件修改为转速 184 r/min、温度 29 ℃、pH 6.8并进行验证性试验,在该条件下黑色素吸光值为1.273,在该发酵条件下提取获得冠突散囊菌胞外黑色素4.27 g/L。
2.4 冠突散囊菌胞外黑色素稳定性的研究
2.4.1 光照对冠突散囊菌胞外黑色素稳定性的影响
由表4可知,自然光对该色素稳定性有一定影响,冠突散囊菌胞外黑色素在自然光照条件下,随着时间的延长,色素逐渐降解,吸光度降低,放置3 d后,色素损失率为14.12%;避光保存对该色素稳定性较好,冠突散囊菌胞外黑色素在黑暗条件下保存3 d,其损失率仅为4.33%;紫外光对该色素稳定性有较大的影响,冠突散囊菌胞外黑色素在紫外灯下,随着时间的延长,溶液吸光度降低,3 h后色素损失率达到19.69%。试验表明,光照会对冠突散囊菌产生不利影响,该种色素应避光保存,且不具备良好的抗紫外辐射能力。
表4 不同光处理对黑色素稳定性的影响
Table 4 Effect of melanin stability in different light treatment

注:1、2、3代表自然光的时间,d;紫外光的时间,h
光照条件0123自然光0.970±0.0030.932±0.0040.893±0.0030.833±0.002黑暗 0.970±0.0030.962±0.0020.942±0.0020.928±0.003紫外光0.970±0.0030.912±0.0020.864±0.0040.779±0.003
2.4.2 温度对冠突散囊菌胞外黑色素稳定性的影响
由表5可知,于室温中保存的该色素稳定性较好,其溶液吸光值并无明显变化;随着温度上升,该色素稳定性下降,冠突散囊菌胞外黑色素处于100 ℃时,随着时间的增长,吸光值降低,90 min时其损失率为24.64%,但在70 ℃和50 ℃环境下,其损失率均低于10%,说明冠突散囊菌胞外黑色素具有一定的耐热性,该色素在应尽量在低于70 ℃时使用,避免高温受热。
表5 温度对黑色素稳定性的影响
Table 5 Effect of melanin stability in temperature
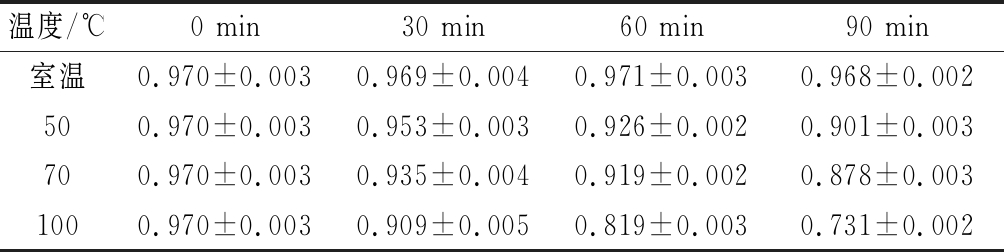
温度/℃0 min30 min60 min90 min室温0.970±0.0030.969±0.0040.971±0.0030.968±0.002500.970±0.0030.953±0.0030.926±0.0020.901±0.003700.970±0.0030.935±0.0040.919±0.0020.878±0.0031000.970±0.0030.909±0.0050.819±0.0030.731±0.002
2.4.3 氧化剂、还原剂对冠突散囊菌胞外黑色素稳定性的影响
由表6可知,随着H2O2溶液质量分数的增加,黑色素吸光值呈下降趋势,当质量分数为2.5%时,其损失率达39.42%,说明该种黑色素容易被H2O2氧化褪色,在使用过程中应尽量避免与强氧化剂接触。当加入低质量分数的Na2SO3时,黑色素吸光值呈下降趋势,当Na2SO3质量分数为0.3%时,其损失率为11.26%,说明黑色素发生了一定程度的降解,但Na2SO3质量分数继续增大时,黑色素溶液吸光值变化不大,说明该种黑色素有一定的耐还原性。
表6 氧化剂、还原剂对黑色素稳定性的影响
Table 6 Effect of melanin stability in oxidants and deoxidizer
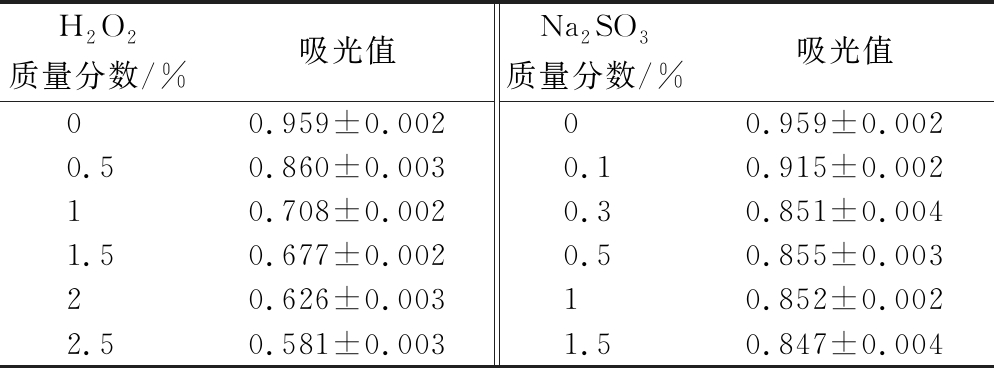
H2O2质量分数/%吸光值Na2SO3质量分数/%吸光值00.959±0.00200.959±0.0020.50.860±0.0030.10.915±0.00210.708±0.0020.30.851±0.0041.50.677±0.0020.50.855±0.00320.626±0.00310.852±0.0022.50.581±0.0031.50.847±0.004
2.4.4 金属离子对冠突散囊菌胞外黑色素稳定性的影响
由表7可知, 该种黑色素对0.05 mol/L的金属离子有着较好的稳定性,但不同金属离子的影响程度不同,Na+对溶液无明显影响,Mg2+、Zn2+、Fe3+具有增效作用,其中Fe3+作用效果最好,Ca2+、Cu2+具有降效作用,使用过程中应尽量减少与这含2种离子的化合物接触。
表7 金属离子对黑色素稳定性的影响
Table 7 Effect of melanin stability on metal ions
金属离子对照Mg2+Na+Zn2+Ca2+Fe3+Cu2+吸光值0.959±0.0020.990±0.0030.978±0.0031.048±0.0020.939±0.0021.287±0.0040.920±0.002
3 结论
本试验在单因素的基础上,利用响应面法对冠突散囊菌胞外黑色素发酵条件进行了优化,并建立了可靠的二次多项模型。通过方差分析表明,模型的拟合度较好,得到最优发酵条件为转速 184 r/min、温度 29 ℃、pH 6.8,在该发酵条件下提取获得冠突散囊菌胞外黑色素4.27 g/L。所得黑色素在70 ℃以下耐热性强, Mg2+、Zn2+、Fe3+对其的稳定性有增强作用,该黑色素应避光保存,在使用过程中应避免与强氧化剂和还原剂接触。
[1] 吴凯为.冠突散囊菌发酵刺五加茶的制备及品质分析[D].锦州:渤海大学,2019.
[2] 邹敏敏,董其惠,黄彦,等.冠突散囊菌发酵黑毛茶提取液的研究[J].生物加工过程,2019,17(4):409-417.
[3] CHEN Kaijiang,ZHEN Zeng,HUANG Yahui,et al.Chemical compositions of Pu'er tea fermented by Eurotium cristatum and their lipid-lowering activity[J].Food Science and Technology,2018,98:204-211.
[4] YAO Yani,WU Mengyao, HUANG Yingjie,et al.Appropriately raising fermentation temperature beneficial to the increase of antioxidant activity and gallic acid content in Eurotium cristatum-fermented loose tea[J].LWT-Food Science and Technology,2017,82:248-254.
[5] 覃金球.冠突散囊菌发酵液对金黄色葡萄球菌及其生物被膜的作用[D].南宁:广西医科大学,2019.
[6] 袁超,袁丹丹,王淼,等.黑茶益生菌种“金花”菌基因组测序及分析[J].食品与药品,2016,18(4):259-262.
[7] 郑欣欣.茯砖茶中“金花”菌产孢机制及其功能性研究[D].西安:陕西科技大学,2015.
[8] 祝雷强,蒋立勤,金湖欣.天然黑色素的生理功效、提取及应用研究进展[J].中国食物与营养,2013,19(3):72-74.
[9] CHEN Jianyi,WANG Chenjiaozi, SHU Canwei,et al.Isolation and characterization of a melanin from Rhizoctonia solani, the causal agent of rice sheath blight[J].Journal of the Agricultural Chemical Society of Japan, 2015, 50 (11):2 951-2 954.
[10] ANDRZEJ S,POSTLETHWAITE A E.Skin under the sun:When melanin pigment meets vitamin D[J].Endocrinology,2015, 156(1):1-4.
[11]  UKASZ
UKASZ  .Antioxidant, antibacterial properties and the light barrier assessment of raw and purified melanins isolated from Citrullus lanatus (watermelon) seeds[J].Herba Polonica, 2018,64(2):25-36.
.Antioxidant, antibacterial properties and the light barrier assessment of raw and purified melanins isolated from Citrullus lanatus (watermelon) seeds[J].Herba Polonica, 2018,64(2):25-36.
[12] MA Yinpeng,BAO Yihong,KONG Xianghui,et al.Optimization of melanin extraction from the wood ear medicinal mushroom, auricularia auricula-judae(Agaricomycetes), by response surface methodology and its antioxidant activities in vitro[J]. International journal of medicinal mushrooms,2018,20(11):1 087-1 095.
[13] BARCENA A,BRUNO M,GENNARO A,et al. Melanins from two selected isolates of Pseudocercospora griseola grown in-vitro: Chemical features and redox activity[J].Journal of Photochemistry and Photobiology B,2018,186(7):207-215.
[14] YE Ziyang,LU Ying,ZONG Shuai,et al.Structure, molecular modification and anti-tumor activity of melanin from Lachnum singerianum[J].Process Biochemistry,2019,76(9):203-212.
[15] SHI Fang,LI Jinglei,YE Ziyang,et al.Antitumor effects of melanin from Lachnum YM226 and its derivative in H22 tumor-bearing mice[J].Med Chem Comm,2018,9(6):1 059-1 068.
[16] LI Shenglan,YANG Liuqing, LI Jinglei,et al.Structure, molecular modification, and anti- radiation activity of melanin from Lachnum YM156 on ultraviolet B-induced injury in mice[J].Applied Biochemistry and Biotechnology,2019,188(2):555-567.
[17] OBERG F,HASEEB A,AHNFELT M,et al.Herbal melanin activates TLR4/NF-κB signaling pathway[J].Phyto-medicine,2009, 16(5):477-484.
[18] PUGH N D,BALACHANDRAN P,LATA H,et al.Melanin: Dietary mucosal immune modulator from Echinacea and other botanical supplements[J].International Immunopharmacology,2005,5(4):637-647.
[19] 雷敏.鱿鱼墨黑色素及黑色素铁生物活性的研究[D].青岛:中国海洋大学,2008.
[20] 张艳荣,王庆庆,刘通,等.木耳黑色素碱法提取工艺优化及表征[J].食品科学,2016,37(12):27-32.
[21] 吴世玉,孟祥敏,刘俊梅,等.林蛙卵黑色素的理化性质及其抗氧化活性研究[J].食品研究与开发,2018,39(14):25-29.
[22] CHENG Fuyuan, HSU Fengwen,CHANG Hishan,et al.Effect of different acids on the extraction of pepsin-solubilised collagen containing melanin from silky fowl feet[J].Food Chemistry,2009,113(2):563-567.
[23] SELVAKUMAR P,RAJASEKAR S,PERIASAMY K,et al.Isolation and characterization of melanin pigment from Pleurotus cystidiosus (telomorph of Antromycopsis macrocarpa)[J].World Journal of Microbiogy&Biotechnology,2008,24(10):2 125-2 131.
[24] 郭劲霞,邹自征,刘蓉,等.冠突散囊菌液体培养条件的正交优化[J].安徽农业科学,2015,43(27):246-247;250.
[25] 刘善鑫,刘素纯,李再贵.冠突散囊菌发酵燕麦对阿魏酸含量的影响[J].中国酿造,2018,37(6):165-169.
[26] 陈云兰.茯砖茶“金花菌”的分类鉴定及其对茯砖茶品质的影响[D].南京:南京农业大学,2004.
[27] 满丽莉,向殿军.响应面法优化枯草芽孢杆菌MX-6产纳豆激酶发酵条件[J].食品研究与开发,2019,40(21):214-219.
[28] 杨然,张笑雨,刘朋肖,等.耐热木聚糖酶菌株的筛选鉴定及发酵条件分析[J].食品科学,2019,40(18):101-107.