类胡萝卜素是天然色素的总称,是一种呈黄色、橙红色或者红色的多烯类化合物,已被 FAO和 WHO等国际组织认定为 A类营养色素,广泛应用于食品、药品和化妆品等领域[1-2]。类胡萝卜素主要存在于一些高等植物和微生物中,人体自身不能合成,主要从日常膳食中摄取[3]。能够合成类胡萝卜素的微生物较多,主要有酵母菌、霉菌、藻类和光合细菌等,其中酵母菌主要是红酵母属中的胶红酵母(Rhodotorula mucilaginosa)、深红酵母(Rhodotorula rubra)及小红酵母[Rhodotorula minuta (Saito) Harrison]等具有产类胡萝卜素的能力[4-5]。类胡萝卜素也是类异戊二烯化合物的前体物质,能够形成多种香气物质(如2,2,6-三甲基环己酮、芳樟醇、β-大马酮和β-紫罗兰酮等),而此类物质又是果酒中的一种重要的香气成分,在果酒酿造中具有重要作用[6]。
近几年,对于猕猴桃酿造果酒的研究越来越多,主要集中在利用猕猴桃不同品种酿造果酒、猕猴桃专用酿酒酵母的筛选、降酸、防止VC损失和香气不足等方面,其中酸度较高和香气不足是猕猴桃果酒存在的主要问题[7]。针对猕猴桃酒香气不足这一方面,有研究者提出利用非酿酒酵母和酿酒酵母混合发酵,既能丰富猕猴桃酒中的香气成分,也能提高它的发酵速率[8]。王星辰[9]研究了胶红酵母和酿酒酵母混合发酵对葡萄酒的增香效果,得出混合发酵能显著提高葡萄酒中品种香气(C6-化合物、C13-去甲类异戊二烯和萜烯类)和发酵类香气(高级醇、乙酸酯、脂肪酸乙酯、脂肪酸及苯乙基类)的含量。孙明雪等[10]通过调控类异戊二烯合成途径,来提高酿酒酵母中芳樟醇的产量,从而增加果酒中香气物质的含量。ANDRIANI等[11]研究了葡萄酒中类异戊二烯含量的变化,发现β-大马酮的含量从发酵结束到陈酿3个月后显著增加。MENDES-PINTO[12]论述了葡萄酒中类胡萝卜素与类异戊二烯化合物之间的关系,提出了开发传感模型来探究葡萄酒中某些化学成分和芳香化合物。王琦[13]研究了枸杞酒发酵过程中类胡萝素降解产物对香气的影响,并构建了枸杞酒香气质量评价模型,研究类异戊二烯化合物对枸杞酒的香气的贡献,枸杞发酵后共检测出8种类异戊二烯化合物,其中7种的气味活性值均>1,对枸杞酒的香气均有贡献。
但是红酵母在猕猴桃酒中的应用尚未见报道,所以本文对该株产类胡萝卜素的酵母进行鉴定及发酵条件优化,使其和酿酒酵母混合发酵,研究其对猕猴桃酒风味的影响,为猕猴桃酒的生产提供理论依据。
1 材料与试剂
1.1 实验材料与菌种来源
秦美猕猴桃,购于雅安市雨城区农贸市场。
菌株J36从四川农兴源农业开发有限责任公司-欣妙酒庄发酵罐酒脚中分离所得,于(4±1)℃冰箱中保藏。
酿酒酵母:EC1118活性干酵母,上海康禧食品饮业有限公司。
1.2 培养基与试剂
YPD培养基:称取40 g/L葡萄糖,10 g/L蛋白胨,10 g/L酵母膏,溶解于1 000 mL蒸馏水中,115 ℃灭菌20 min。
无水葡萄糖、蛋白胨、酵母膏、NaCl、偏重亚硫酸钾、NaOH、柠檬酸、无水Na2CO3、CuSO4·5H2O、KI、碘、领苯二甲酸氢钾、硫代硫酸钠等为分析纯,万科化学试剂公司;乙醇、乙酸正丁酯、甲醇、4-甲基-2-戊醇等为色谱纯,上海阿拉丁试剂公司。
1.3 仪器与设备
D-37520离心机,Thermo Fisher;PHS-3C型酸度计,杭州奥立龙仪器有限公司;SPX-250生化培养箱,上海申贤恒温设备厂;HR40-IIA2生物安全柜,南京温诺仪器设备有限公司;CX21双目光源生物显微镜,奥林巴斯有限公司;7890A/59750气相色谱/质谱联用仪,Agilent Technologies。
1.4 实验方法
1.4.1 菌种活化
菌株J36活化:将试管斜面保存的菌株J36在马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基中纯化3次,挑取2环接种于装有10 mL酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养液的试管中,28 ℃,120 r/min摇床暗箱培养24 h。然后按照10%的接种量接种于装有100 mL YPD培养液的三角瓶(250 mL)中,28 ℃,120 r/min摇床暗箱培养3 d,用无菌生理盐水将菌落总数调至约1×107 CFU/mL,备用。
酿酒酵母活化:称取1g EC1118活性干酵母,接种于装有100 mL YPD培养液的三角瓶(250 mL)中,28 ℃,120 r/min摇床暗箱培养1 d,4 000 r/min离心10 min,去上清液,用无菌生理盐水将沉淀悬浮,并利用显微镜计数法将菌落总数调至约1×107 CFU/mL,备用。
1.4.2 菌株J36的鉴定
将活化好的菌液送往成都擎科梓熙生物技术有限公司进行序列测定。测序后在NCBI网站中利用 BLAST 程序进行同源序列比较分析,挑选几株相似度较高和较低的菌株,在Clustal XP软件中进行序列比对,采用 MEGAX64 软件构建系统发育树[14]。
1.4.3 菌株J36的基本特性分析
1.4.3.1 温度适应范围
将J36种子液按2%的接种量接种,分别置于15、18、21、24、27和30 ℃的温度下培养,每隔24 h取样,利用稀释平板涂布法测定生长曲线。
1.4.3.2 pH适用范围
分别用柠檬酸和无水Na2CO3将培养基的pH调至2、3、4、5和6,将J36种子液按2%的接种量接种,每隔24 h取样,利用稀释平板涂布法测定生长曲线。
1.4.3.3 SO2耐受性
用偏重亚硫酸钠将SO2质量浓度调至100、150、200、250和300 mg/L,将J36种子液按2%的接种量接种,每隔24 h取样,利用稀释平板涂布法测定生长曲线。
1.4.3.4 酒精耐受性
用无水乙醇将酒精体积分数调为8%、10%、12%、14%和16%,将J36种子液按2%的接种量接种,每隔24 h取样,利用稀释平板涂布法测定生长曲线。
1.4.4 菌株J36和酿酒酵母混合发酵对猕猴桃酒风味物质的影响
样品前处理:新鲜猕猴桃去皮打浆,加入100 mg/kg的果胶酶,于40 ℃培养箱中酶解4 h,用偏重亚硫酸钠将SO2调整到80 mg/kg,离心,备用。
猕猴桃酒酿造:将猕猴桃汁用白砂糖调节可溶性固形物至24 °Brix,接入菌株J36和酿酒酵母,选取最佳发酵条件进行猕猴桃酒的酿造,并以酿酒酵母单菌种发酵作为对照组(由于菌株J36不具有酒精发酵能力,故不设对照组);主发酵期间,每天摇匀2~3次,每隔24 h称重并测定可溶性固形物,当可溶性固形物不再变化时,及时倒灌,将猕猴桃酒和酵母泥与沉淀分离,然后将酒装满,置于阴凉、干燥、通风处陈酿30 d,测定猕猴桃酒中的基本理化指标和挥发性成分,探究菌株J36和酿酒酵母混合发酵对猕猴桃酒品质的影响。
1.5 分析方法
1.5.1 猕猴桃酒的理化指标检测
参考GB/T 15038—2006,对猕猴桃酒的理化指标进行检测,酒精度采用密度瓶法,总糖用斐林滴定法,总酸的测定用酸碱滴定法,SO2的测定采用直接碘量法,VC用2,6-二氯靛酚滴定法。
1.5.2 猕猴桃酒的理化指标检测
参照CARC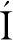 A-CARPINTERO等[15]的方法,略有修改。
A-CARPINTERO等[15]的方法,略有修改。
固相微萃取:在25 mL的顶空瓶中加入1 g NaCl,4 mL酒样和100 μL质量浓度为1 788 mg/L的乙酸正丁酯作为内标,置于40 ℃水浴锅中平衡10 min,然后将老化的固相微萃取头插入顶空瓶中,萃取40 min,GC进样口解析5 min,对猕猴桃酒中的挥发性成分进行分析。
气相色谱的条件:分流方式为不分流,色谱柱为 19091S-433(30 m×0.25 mm)。程序升温为 40 ℃保持8 min,以 5 ℃/min 的升温速度升至200 ℃,保持1 min,再以10 ℃/min 的升温速度升至280 ℃,保持5 min。载气为He,体积流量为1.2 mL/min,进样口温度为250 ℃。
质谱的条件:电离方式EI,电离电压 70 eV,灯丝流量为 0.25 mA,连接杆温度为280 ℃,电子倍增器电压为1 500 V,扫描范围为 30~350 AMU,离子源温度为 250 ℃。
1.5.3 猕猴桃酒的理化指标检测
参照葡萄酒评比标准,邀请14名具有酿酒专业知识的人员,男生7名,女生7名,对陈酿后的猕猴桃酒进行感官评定,评分标准如表1所示。
表1 感官评定表
Table 1 Sensory evaluation table

指标评价标准评分/分外观淡黄色,澄清,透明,无悬浮物,无沉淀15~11(15分)淡黄色,无悬浮物,无沉淀10-5有明显的沉淀或悬浮物质<5香气具有猕猴桃清新的果香,酒香浓郁,无异味30~25(30分)具有猕猴桃果香,酒香一般,无异味24~19猕猴桃果香及酒香较淡,无异味18~11无猕猴桃果香酒香平淡不协调,有异味<10口感酒体饱满,酒质柔和,回味绵长40~31(40分)酒体较为饱满,口味协调30~21酒体清淡,口味一般,具有不突出的酸涩味20~11酒体寡淡,口味粗糙,酸涩味较重<10典型性猕猴桃风味浓郁,特征明显,典型性强15~13(15分)猕猴桃风味纯正,特征较为明显,典型性较强12~10猕猴桃风味不明显,特征一般,典型性一般9~7猕猴桃风味缺乏,无猕猴桃酒特征,典型性弱<6
1.5.4 数据分析
数据采用SPSS 9.0软件分析,Origin 8.5软件作图。
2 结果与分析
2.1 菌株J36的鉴定结果
2.1.1 形态学鉴定
菌株J36在YPD培养基中,28 ℃,培养3 d,结果如图1-A所示,菌落颜色为红色,形状为圆形,黏稠,表面光滑湿润,中央和边缘颜色均一,易被挑起。菌株J36在YPE培养基中,28 ℃,摇床培养3 d后,菌液颜色为橙红色。挑取少许菌液进行涂片,并在显微镜下观察,结果如图1-B所示,细胞颜色为亮白色,细胞为球形,单个或者成对,为出芽生殖。综上所述,菌株J36具有酵母的典型特征,且菌落为红色,故此判定菌株J36属于红酵母属。

A-J36菌落形态;B-J36在显微镜下的形态
图1 菌株J36的形态特征
Fig.1 Morphological characteristics of strain J36
2.1.2 分子生物学鉴定
将菌株J36 ITS序列输入NCBI网站的BLAST程序中,和GenBank数据库中的序列进行比对分析,利用MEGAX64软件构建系统发育树,如图2所示。将序列上传至GenBank,获得菌株J36的登录号为SUB5943209。在BLAST中通过同源性比较得出,菌株J36与Rhodotorμla mucilaginosa 的相似性为100%,从发育树中可以看出,菌株J36与Rhodotorμla mucilaginosa的进化关系最近,故此可以判定菌株J36属于红酵母属中的胶红酵母(Rhodotorμla mucilaginosa)。

图2 菌株J36系统发育树
Fig.2 Phylogenetic tree of strain J36
2.2 菌株J36的基本特性分析
2.2.1 温度适应范围
温度是影响微生物生长繁殖的重要因素,每种微生物都有其最适生长温度,温度不同微生物细胞内的生物活性物质也会发生变化,如温度升高,蛋白质、核酸等物质发生变性,细胞逐渐死亡,温度降低,微生物的生长受到抑制[16];如图3所示,在15~30 ℃,随着温度升高,菌株J36的菌落总数也随之增加,在27 ℃和30 ℃时,菌落总数相差不大,说明菌株J36的最适生长温度为27~30 ℃,在24 ℃时,培养96 h,其菌落总数能达到1×108 CFU/mL;而在果酒发酵中,温度过高,容易导致醋酸菌污染,在低温下(20~25 ℃)果酒的香气成分保留程度较高[17],故而选择24 ℃作为果酒发酵温度。
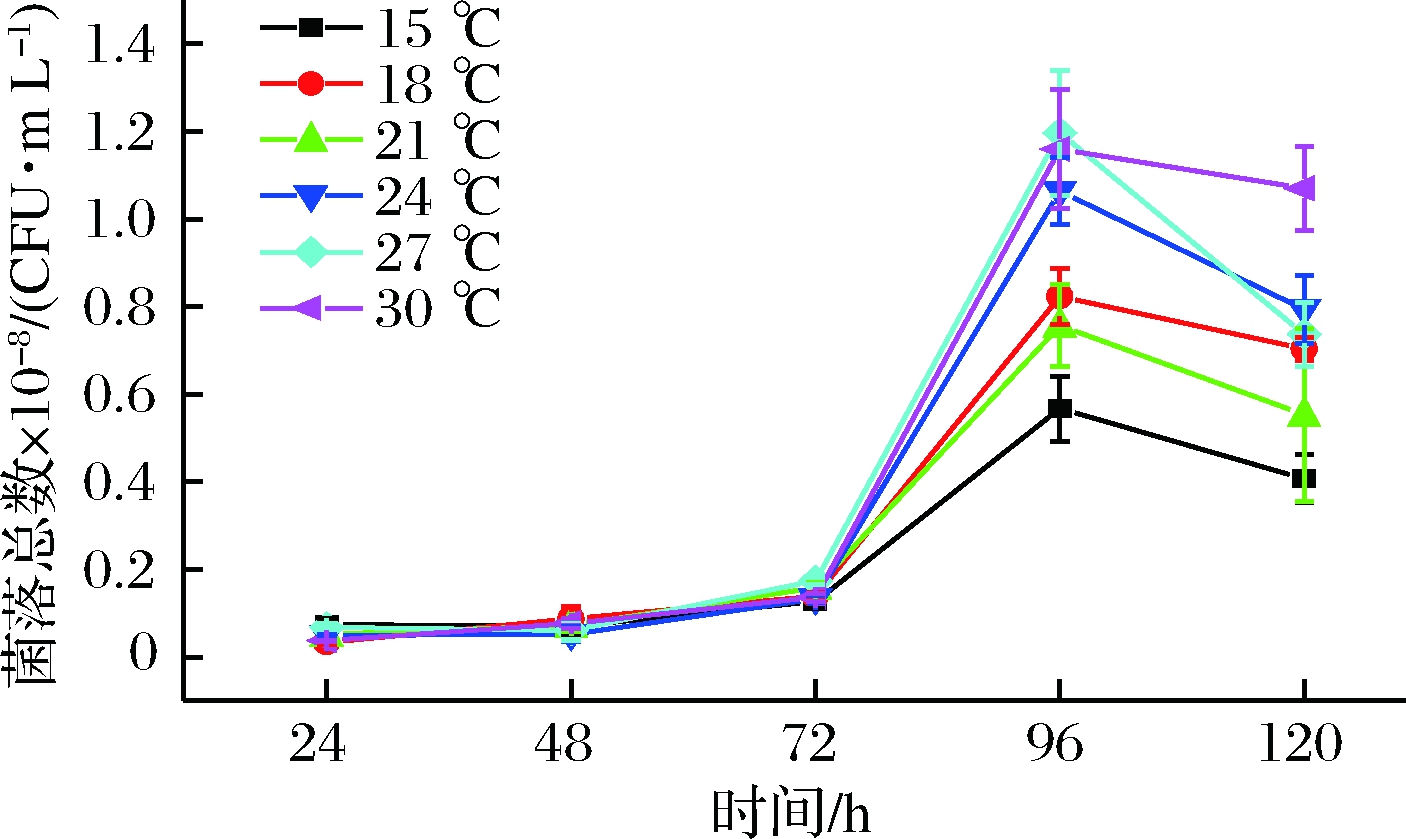
图3 菌株J36在不同温度下的生长曲线
Fig.3 Growth curve of strain J36 at different temperatures
2.2.2 pH值适用范围
在果酒发酵中,pH值的大小直接影响酵母菌还原糖过程中所起催化作用的酶的活性,pH值太低或者太高都会使酶的活性下降,甚至变性而完全失活[18]。菌株J36在不同pH值中的生长情况如图4所示,随着pH值逐渐减小,菌株J36的生长明显受到抑制,在pH 2~4时,生长缓慢;96 h时,菌落总数达到最大,之后逐渐减少,并且在pH 2时,只能存活2~3 d。

图4 菌株J36在不同pH值中的生长曲线
Fig.4 Growth curves of strain J36 at different pH values
2.2.3 SO2耐受性
SO2在果酒当中起着至关重要的作用,比如作为防腐剂能够抑制果酒在发酵过程中杂菌的生长,作为抗氧化剂能够抑制氧化酶的生成从而防止原料氧化,还有增酸、澄清和溶解等作用[19];但是不同酵母菌对不同SO2浓度的耐受能力也不一样,菌株J36在不同SO2浓度下的生长情况如图5所示,随着SO2浓度的增加,菌株J36的菌落总数明显减少,但在300 mg/L SO2质量浓度下能够正常生长,说明菌株J36能够耐受300 mg/L SO2。
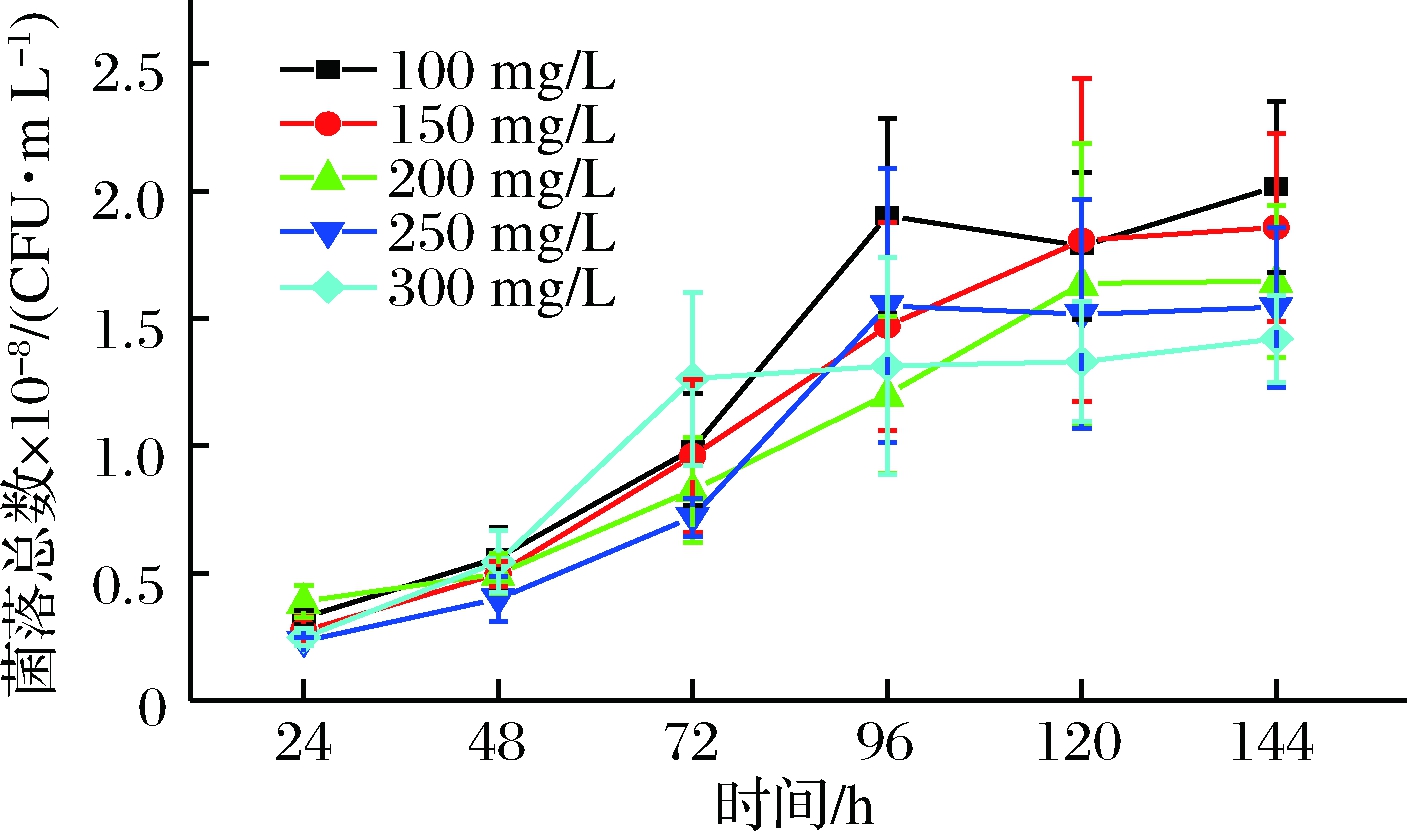
图5 菌株J36在不同质量浓度SO2中的生长曲线
Fig.5 Growth curve of strain J36 in different SO2concentration
2.2.4 酒精耐受性
菌株J36在不同酒精体积分数中的生长情况如图6所示,菌落总数随着时间延长数量在不断减少,说明酒精会对酵母细胞产生毒害作用,酒精浓度越高越明显[20],在16%酒精体积分数下,从接种到发酵72 h,酵母数量急剧减少,96 h后酵母全部死亡;但是在12%酒精体积分数时,却表现出不同的特征,菌落总数总是大于8%和10%的酒精体积分数,这可能和菌株J36的来源有关;在14%酒精体积分数下,J36能够存活1周左右。
图6 菌株J36在不同酒精体积分数中的生长曲线
Fig.6 Growth curve of strain J36 in different alcohol concentration
2.3 菌株J36和酿酒酵母混合发酵对猕猴桃酒风味物质的影响
2.3.1 基本理化指标分析
猕猴桃酒的基本理化指标分析如表2所示,和单菌种发酵相比,混合发酵对猕猴桃酒的酒精度、总糖和总酸影响不大,但对抗坏血酸的保留和总SO2有一定的影响。
表2 猕猴桃酒的基本理化指标分析
Table 2 Analysis of basic physical and chemical indexes of kiwifruit wine

接种比例酒精度/%vol总糖质量浓度/(g·L-1)总酸质量浓度/(g·L-1)抗坏血酸质量浓度/(mg·L-1)总SO2质量浓度/(mg·L-1)酿酒酵母10.6851.5110.89359.7729.01酿酒酵母∶J3610.621.4310.56363.9527.31
2.3.2 菌株J36和酿酒酵母混合发酵对猕猴桃酒风味物质的影响
由表3可知,将菌株J36和酿酒酵母混合发酵,并以猕猴桃原料中的挥发性成分和酿酒酵母单菌种发酵中的挥发性成分作对比,利用顶空固相微萃取技术和气相-质谱联用技术(headspace solid-phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)在猕猴桃原料和猕猴桃酒样中共检测出58种香气物质,香气种类主要包括27种酯类,15种萜烯类,6种芳香族化合物和3种酸类等。在猕猴桃原料中主要有酯类9种,萜烯类3种;单菌种发酵中主要有酯类11种,萜烯类7种;混合发酵中主要有酯类22种,萜烯类10种。三者共有的物质为正己酸乙酯、苯甲酸甲酯、苯甲酸乙酯、辛酸乙酯、月桂酸乙酯、癸酸乙酯、大马士酮、2,4-二叔丁基苯酚和油酸,这些物质可能对猕猴桃香气的典型性具有重要的作用。在猕猴桃原料中相对含量较高的主要是苯甲酸甲酯12.64%和苯甲酸乙酯2.56%;在单菌种发酵中相对含量较高的是苯甲酸甲酯18.37%,苯乙醇5.83%,辛酸乙酯3.16%,苯甲酸乙酯2.44%,正己酸乙酯1.17%,苯乙酸乙酯1.02%;在混合发酵中相对含量较高的是苯甲酸甲酯16.37%;9-癸酸乙酯7.73%,苯乙醇7.92%,癸酸乙酯5.52%,辛酸乙酯4.63%。由此可见,猕猴桃酒中的主要香气成分为苯甲酸甲酯、苯甲酸乙酯、苯乙醇、辛酸乙酯、正己酸乙酯和癸酸乙酯,这与郭静等和刘拉平等[21-22]的研究结果基本一致。其中,苯甲酸甲酯具有浓郁的冬青油和尤南迦油香气,苯乙醇主要贡献玫瑰香、紫罗兰香和茉莉花香,辛酸乙酯主要贡献果香、菠萝、梨和花香,苯甲酸乙酯主要贡献果香,正己酸乙酯主要贡献花香和果香,苯乙酸乙酯主要贡献玫瑰和花香,9-癸酸乙酯和癸酸乙酯主要贡献蜡味和果香。萜类物质虽然相对含量较低,但是他们香味独特,对猕猴桃风味有积极的贡献,如右旋萜二烯具有甜橙和柑橘类香气,4-萜烯醇具有胡椒香、泥土香和木材类香气,α-法尼烯具有青香、花香并伴有香脂香气和大马士酮具有复杂的花香、热带水果和煮苹果香气等。
表3 菌株J36和酿酒酵母混合发酵对猕猴桃酒风味物质的影响
Table 3 Effect of mixed fermentation of strain J36 and Saccharomyces cerevisiae on flavor substances of kiwifruit wine
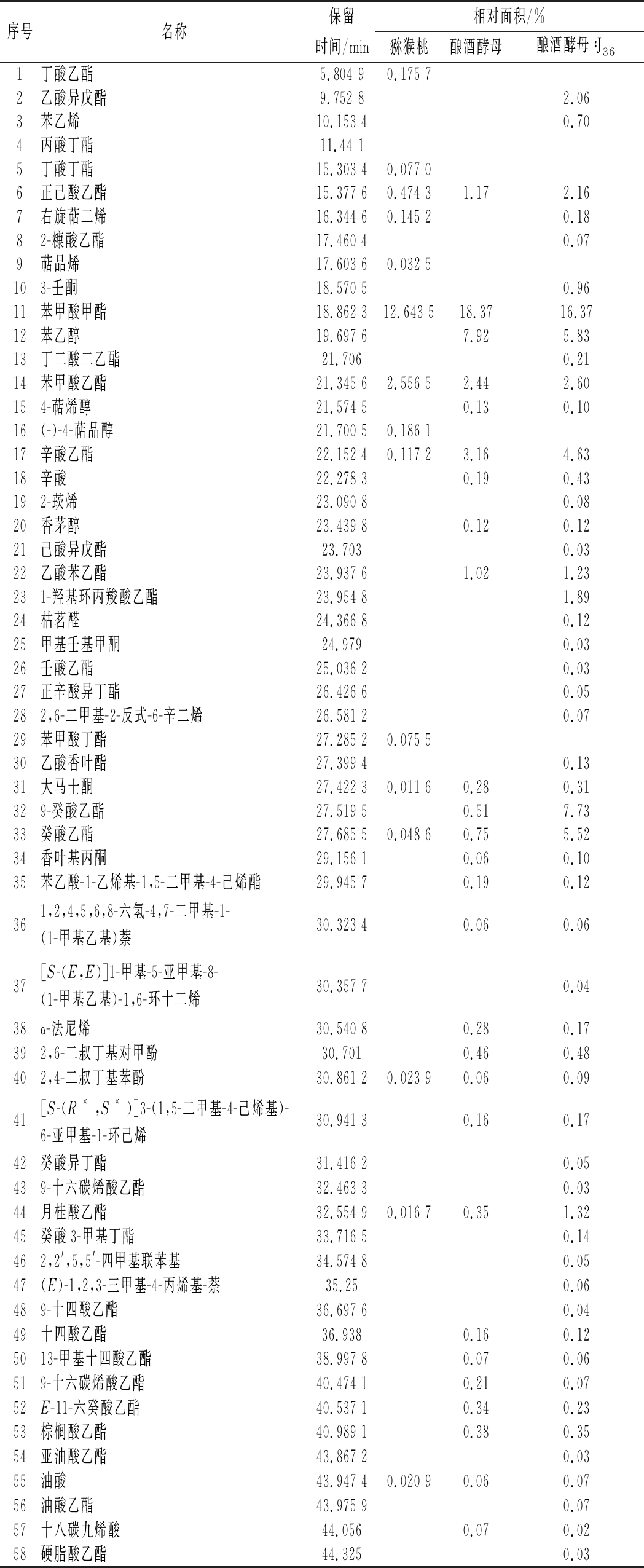
序号名称保留相对面积/%时间/min猕猴桃酿酒酵母酿酒酵母∶J361丁酸乙酯5.804 90.175 72乙酸异戊酯9.752 82.06 3苯乙烯10.153 40.70 4丙酸丁酯11.44 15丁酸丁酯15.303 40.077 06正己酸乙酯15.377 60.474 31.172.16 7右旋萜二烯16.344 60.145 20.18 82-糠酸乙酯17.460 40.07 9萜品烯17.603 60.032 5103-壬酮18.570 50.96 11苯甲酸甲酯18.862 312.643 518.3716.37 12苯乙醇19.697 67.925.83 13丁二酸二乙酯21.7060.21 14苯甲酸乙酯21.345 62.556 52.442.60 154-萜烯醇21.574 50.130.10 16(-)-4-萜品醇21.700 50.186 117辛酸乙酯22.152 40.117 23.164.63 18辛酸22.278 30.190.43 192-莰烯23.090 80.08 20香茅醇23.439 80.120.12 21己酸异戊酯23.7030.03 22乙酸苯乙酯23.937 61.021.23 231-羟基环丙羧酸乙酯23.954 81.89 24枯茗醛24.366 80.12 25甲基壬基甲酮24.9790.03 26壬酸乙酯25.036 20.03 27正辛酸异丁酯26.426 60.05 28 2,6-二甲基-2-反式-6-辛二烯26.581 20.07 29苯甲酸丁酯27.285 20.075 530 乙酸香叶酯27.399 40.13 31大马士酮27.422 30.011 60.280.31 329-癸酸乙酯27.519 50.517.73 33癸酸乙酯27.685 50.048 60.755.52 34香叶基丙酮29.156 10.060.10 35苯乙酸-1-乙烯基-1,5-二甲基-4-己烯酯29.945 70.190.12 361,2,4,5,6,8-六氢-4,7-二甲基-1-(1-甲基乙基)萘30.323 40.060.06 37[S-(E,E)]1-甲基-5-亚甲基-8-(1-甲基乙基)-1,6-环十二烯30.357 70.04 38α-法尼烯30.540 80.280.17 392,6-二叔丁基对甲酚30.7010.460.48 402,4-二叔丁基苯酚30.861 20.023 90.060.09 41[S-(R*,S*)]3-(1,5-二甲基-4-己烯基)-6-亚甲基-1-环己烯30.941 30.160.17 42癸酸异丁酯31.416 20.05 439-十六碳烯酸乙酯32.463 30.03 44月桂酸乙酯32.554 90.016 70.351.32 45癸酸3-甲基丁酯33.716 50.14 462,2',5,5'-四甲基联苯基34.574 80.05 47(E)-1,2,3-三甲基-4-丙烯基-萘35.250.06 489-十四酸乙酯36.697 60.04 49十四酸乙酯36.9380.160.12 5013-甲基十四酸乙酯38.997 80.070.06 519-十六碳烯酸乙酯40.474 10.210.07 52E-11-六癸酸乙酯40.537 10.340.23 53棕榈酸乙酯40.989 10.380.35 54亚油酸乙酯43.867 20.03 55油酸43.947 40.020 90.060.07 56油酸乙酯43.975 90.07 57十八碳九烯酸44.0560.070.02 58硬脂酸乙酯44.3250.03
3 感官评定
将14名品评员的品评数据进行统计,对猕猴桃酒的色泽、香气、口感和典型性4个方面进行综合评价,如图7所示,在香气和口感方面,酿酒酵母与菌株J36混合发酵的猕猴桃酒得分最高,具有猕猴桃酒的果香,酒体饱满,口味协调;酿酒酵母单菌种发酵的猕猴桃酒果香果香较淡,酒体清淡;在色泽和典型性方面都没有较大差别。综合香气物质分析和感官品评结果,混合发酵不仅使猕猴桃酒的香气更加丰富,对猕猴桃酒的品质也有较大提升。
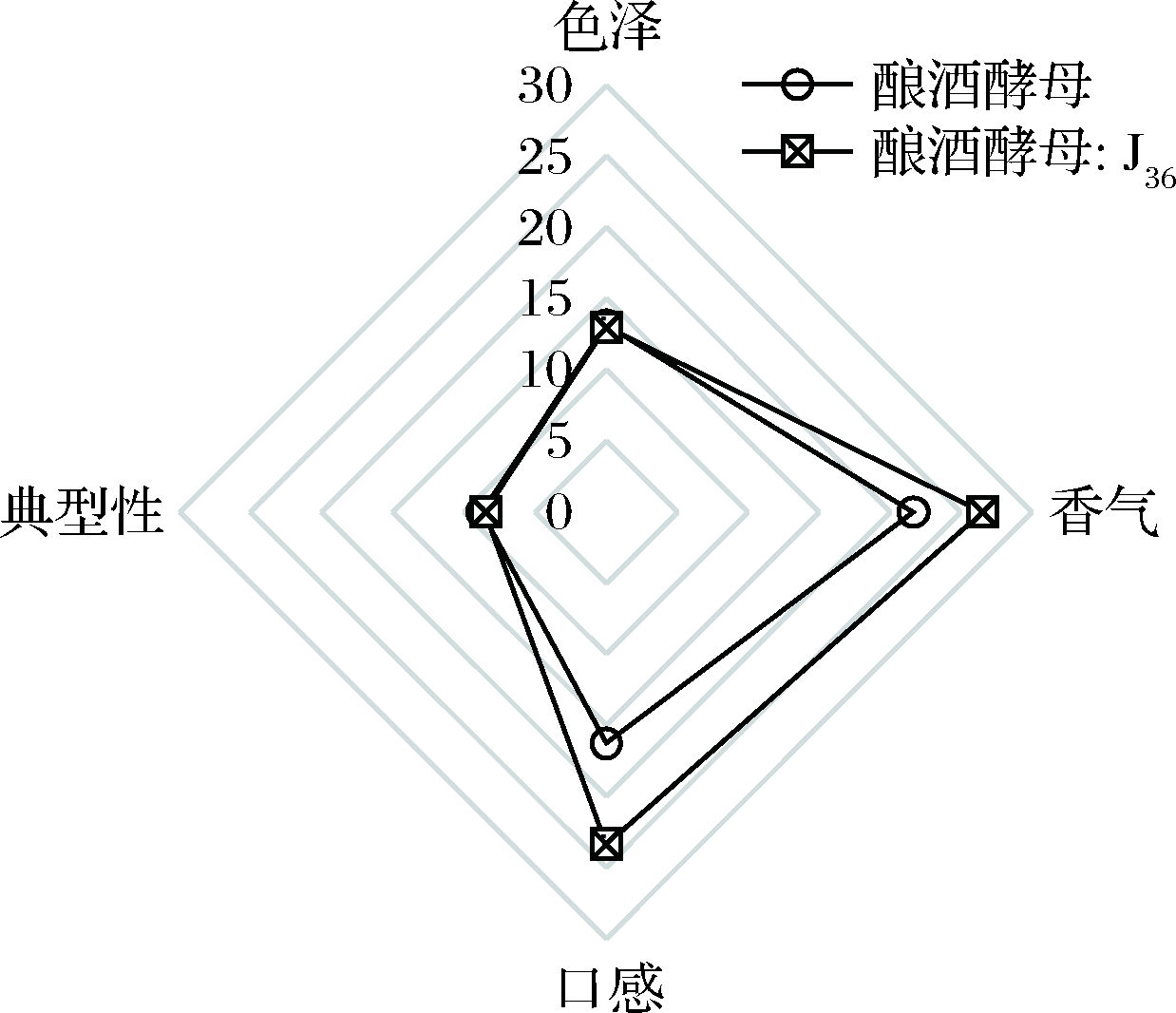
图7 猕猴桃酒的感官分析雷达图
Fig.7 Sensory analysis radar chart of riwifruit wine
4 结论
本研究将猕猴桃发酵罐中筛选的菌株J36进行形态学鉴定和分析生物学鉴定,确定该株菌为胶红酵母,然后对它的温度、pH值、SO2和酒精度进行耐受实验,结果表明菌株J36在24~30 ℃和pH 5~6均能较好生长,能够耐受质量浓度为300 mg/L的SO2和体积分数为14%的酒精。利用顶空固相微萃取(HS-SPME)和气相色谱质谱联用仪(GC-MC)测定了猕猴桃原料和猕猴桃酒中的挥发性成分,共检测出58种香气物质,香气种类主要包括27种酯类,15种萜烯类,6种芳香族化合物和3种酸类等。同时,和酿酒酵母单菌种发酵相对比,混合发酵中的菌株J36产生的类胡萝卜素能够分解成多种萜烯类物质,对猕猴桃酒的风味有极大贡献。感官分析得出,酿酒酵母与菌株J36混合发酵的猕猴桃酒香气丰富,口味协调,感官评价最好;综合香气物质分析和感官品评结果,混合发酵不仅使猕猴桃酒的香气更加丰富,对猕猴桃酒的品质也有较大提升。
[1] 王岁楼,卫军,陈春涛,等.红酵母类胡萝卜素发酵研究[J].郑州轻工业学院学报, 2000, 15(2): 3-7.
[2] 范永仙,许尧兴.微生物生产类胡萝卜素的研究进展[J].食品与发酵工业, 2003, 29(7): 69-74.
[3] 孔维宝,杨洋,陈冬,等.1株类胡萝卜素产生菌的鉴定及其发酵培养基的优化[J].食品科学,2018, 39(24):115-122.
[4] 张坤生.利用红酵母发酵生产类胡萝卜素及其功能性质研究[D].天津:天津科技大学, 2005.
[5] 张闯.红酵母发酵生产类胡萝卜素的研究[D].大连:大连工业大学, 2011.
[6] 郝宏蕾,朱旭芬,曾云中.类异戊二烯的生物合成及调控[J].浙江大学学报(农业与生命科学版), 2002, 28(2):224-230.
[7] 朱克永,隋明.猕猴桃加工工艺及开发利用趋势[J].食品研究与开发, 2018, 39(22): 220-224.
[8] 张鑫,左勇,张晶,等.猕猴桃果酒风味物质研究进展[J].食品工业科技, 2018,39(17): 305-308.
[9] 王星晨.基于优选胶红酵母与酿酒酵母混合酒精发酵的葡萄酒增香酿造研究[D].杨凌:西北农林科技大学, 2018.
[10] 孙明雪,刘继栋,堵国成,等.调控酿酒酵母类异戊二烯合成途径强化芳樟醇合成[J].生物工程学报, 2013, 29(6): 751-759.
[11] ANDRIANI A, ALESSANDRA F, FEDERICA B, et al. Key norisoprenoid compounds in wines from early-harvested grapes in view of climate change[J]. Food Chemistry, 2018, 268: 143-152.
[12] MENDES-PINTO M M. Carotenoid breakdown products the norisoprenoids in wine aroma[J]. Archives of Biochemistry & Biophysics, 2009, 483(2): 236-245.
[13] 王琦.枸杞发酵酒类胡萝卜素降解对香气影响的研究[D].银川:宁夏大学, 2015.
[14] CRUPI P, COLETTA A, ANTONACCI D. Analysis of carotenoids in grapes to predict norisoprenoid varietal aroma of wines from ApuLia[J]. Journal of Biotechnology, 2010, 150(17): 9 647-9 656.
[15] GARC A-CARPINTERO E G, S
A-CARPINTERO E G, S NCHEZ-PALOMO E, GONZ
NCHEZ-PALOMO E, GONZ LEZ-VI
LEZ-VI AS M A. Aroma characterization of red wines from cv. Bobal grape variety grown in La Mancha region[J]. Food Research International, 2011, 44(1): 61-70.
AS M A. Aroma characterization of red wines from cv. Bobal grape variety grown in La Mancha region[J]. Food Research International, 2011, 44(1): 61-70.
[16] 李爱江,张敏,辛莉. 发酵生产过程中发酵条件对微生物生长的影响[J].农技服务, 2007,24(4):128;136.
[17] 白天华,刘延琳.低温发酵条件下黑比诺干红葡萄酒香气成分的研究[J].中国酿造, 2009(9):153-155.
[18] 尚磊.低pH环境下酿酒酵母的生理差异性研究[D].杨凌:西北农林科技大学, 2018.
[19] 黄小忠,曹庆国,陈庶,等.二氧化硫对火棘果酒发酵过程的影响[J].天津农业科学,2017,23(12):46-48;55.
[20] 杨建刚,马跃,肖冬光,等.酿酒酵母酒精耐性研究进展[J].酿酒科技, 2006(11):86-89.
[21] 郭静,岳田利,袁亚宏,等.基于SPME-GC/MS的猕猴桃酒香气成分研究[J].西北农林科技大学学报(自然科学版), 2007, 35(6):89-93.
[22] 刘拉平,史亚歌,岳田利,等.猕猴桃果酒香气成分的固相微萃取GC/MS分析[J].酿酒科技, 2007(5):105-107.