中国白酒历史悠久,是世界六大蒸馏酒之一[1],主要由水、乙醇和风味成分组成,其中风味成分占2%左右,不同香型白酒之间的差异主要表现在风味成分的含量和组成上[2]。老白干香型位居十二香型之一,以香气清雅、自然协调、绵柔醇和、回味悠长的特点而闻名[3]。从风味成分上来看,老白干酒中富含乙酸乙酯和乳酸乙酯,两者比例高达1∶1.5~2,远高于其他香型白酒,正是得益于其独特的酿造工艺和特殊的大曲微生物群落结构[4]。因此,保证老白干酒品质的稳定不仅需要有成熟的酿造工艺,还需要有标准的大曲生产工艺和品质稳定的大曲,实现标准化、专业化制曲,是白酒产业工业化的必然趋势[5]。近年来,国内学者对老白干酒的风味成分[6-7]和主要酿造微生物[8-9]的研究已取得了较为突出的成果,帮助老白干酒完善了一套标准、科学、稳定的酿造工艺,但对大曲的研究还停留在单一的微生物分离和特性研究上[8,10],对大曲微生物群落与风味成分之间的关系还未见报道,很难为解决大曲品质的稳定问题提供有力帮助。
老白干大曲以小麦为原料,经过加水润湿、粉碎后压成块状,人为控制条件培育而成[11],能为酿酒提供丰富的酶和微生物,是酿酒生产的糖化剂、发酵剂、酒化剂和生香剂,在后续酿酒过程中占据着重要的地位,其质量直接关系到老白干酒的产量和质量[12-14]。有研究表明,细菌可能是制曲过程中微生物演替的驱动力[15],大曲中的微生物不仅参与白酒生产主要代谢途径,还能产生部分风味成分或其前体物质,丰富白酒中的风味成分,对白酒中的风味成分形成具有很大帮助[16-18]。因此有必要研究老白干大曲中微生物的群落结构及其与风味成分的关系。目前,已有学者通过分析微生物与风味成分的相关性确定了白酒的核心微生物群[19],但在大曲这方面还未见应用。
本研究采用高通量测序技术对老白干大曲中的微生物进行测序,确定大曲中微生物群落结构和动态变化,同时利用顶空固相微萃取-气相色谱-质谱联用技术跟踪检测大曲中风味成分的变化,最后通过分析微生物与风味成分之间的相关性来确定大曲中的核心微生物群,解析核心微生物群与风味成分的关系,以期为后续强化大曲微生物的研究奠定基础,同时也能为大曲标准化生产提供参考。
1 材料与方法
1.1 大曲样品采集
大曲样品,采集自河北衡水老白干酒业股份有限公司大曲厂。春季开始跟踪取同一曲房曲架上相近位置的曲块,分别取0、5、10、15、20、30(出房曲)、120 d(成品曲)7种,每种取2个共14个样品,均采用相同方法进行后续处理。曲块在无菌环境粉碎,过40目筛。粉碎时为避免机器自身发热导致损失样品中的风味成分,每3 s关闭1次机器,待冷却后再次开启,循环4~5次即可。粉碎后的大曲采用四分法取样,每个样品取2份各50 g,一份置于-20 ℃用于风味成分分析,一份置于-80 ℃用于微生物多样性分析。
1.2 仪器与试剂
7890A-5975C气相色谱-质谱联用仪、20 mL 顶空瓶,美国Agilent公司;50/30 μm DVB/CAR/PDMS萃取头,美国Supelco公司;HJ-2A磁力加热搅拌器,上海维诚仪器有限公司;FA2004电子天平,天津天马衡基仪器有限公司。
色谱纯标准品:癸酸乙酯(110-38-3)、己酸乙酯(123-66-0)、乙偶姻(513-86-0)、β-石竹烯(87-44-5)、(+)-香橙烯(489-39-4)、香叶基丙酮(3796-70-1)、α-石竹烯(6753-98-6)、香树烯(25246-27-9)、正构烷烃标准溶液,美国Sigma-Aldrich公司;乙酸(64-19-7)、乙醛(75-07-0)、异戊醛(590-86-3)、愈创木酚(90-05-1)、苯酚(108-95-2)、苯乙醇(60-12-8)、乙酸乙酯(141-78-6)、丙酮(67-64-1)、正己醇(111-27-3)、辛醇(111-87-5)、异戊醇(123-51-3)、2,3-丁二醇(513-85-9)、3-辛醇(589-98-0)、川芎嗪(1124-11-4),百灵威科技有限公司;NaCl (分析纯),天津市化学试剂一厂。
1.3 风味成分的检测与鉴定
大曲中挥发性化合物的检测使用顶空固相微萃取配合气相色谱质谱联用仪,检测方法参照王敏等[20]测定白酒中风味物质的方法,优化部分参数而成。
1.3.1 色谱条件
HP-5MS色谱柱(30 m×0.25 mm×0.25 μm),柱温40 ℃保持3 min,以4 ℃/min升至150 ℃保持1 min,以6 ℃/min升至250 ℃保持3 min。注射模式:不分流进样;载气:He(>99.999%);载气流量:1 mL/min,溶剂延迟12 min,解吸附8 min。
1.3.2 质谱条件
离子源为EI源,离子源温度230 ℃,电子能量70 eV,四极杆温度150 ℃,接口温度250 ℃,电子倍增器电压1 080 V,扫描范围(m/z)35~350 u。质谱分析数据库为NIST14(Agilent公司)。
1.3.3 萃取方法
10 g大曲水浴加热浸提。提取温度80 ℃,乙醇体积分数75%,提取时间1.5 h,料液比1∶15 (g∶mL)。在顶空瓶中加入5 mL大曲提取液和2.5 g NaCl,采用固相微萃取的方法,通过萃取头水浴加热萃取,萃取时间60 min,萃取温度60 ℃,平衡时间5 min,解吸附时间8 min。
1.3.4 保留指数测定
取0.1 μL正构烷烃混标,按照上述方法进样分析,记录每个正构烷烃对应的保留时间和样品各个色谱峰的保留时间,各挥发性化合物保留指数的计算如公式(1)所示:
(1)
式中:RI,挥发性化合物的保留指数;n,该化合物碳标的原子数;RTx,该化合物的保留时间;RTn,碳数n正构烷烃的保留时间;RTn+1,碳数n+1正构烷烃的保留时间。
1.4 微生物多样性分析
1.4.1 基因组DNA的提取和PCR扩增
用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophorosis,SDS-PAGE)方法提取DNA,琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样本DNA于离心管中,使用无菌水稀释样本至1 ng/μL。以稀释后的基因组DNA为模板,根据测序区域的选择,使用带Barcode的特异引物(Phusion® High-Fidelity PCR Master Mix with GC Buffer,New England Biolabs公司)和高效高保真酶进行聚合酶链式反应(polymerase chain reaction,PCR),确保扩增效率和准确性。细菌所用引物为338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GACTACHVGGGTWTCTAAT-3′);真菌所用引物为ITS3F (5′-GCATCGATGAAGAACGCAGC-3′)和ITS4R(5′-TCCTCCGCTTATTGATA TGC-3′)。
1.4.2 PCR产物的混样和纯化
PCR产物用20 g/L质量浓度的琼脂糖凝胶进行电泳检测;根据PCR产物浓度进行等量混样,充分混匀后使用1×TAE质量浓度为20 g/L的琼脂糖胶电泳纯化PCR产物,剪切回收目标条带。
1.4.3 文库构建和上机测序
使用Ion Plus Fragment Library Kit 48 rxns(Thermofisher 公司)建库试剂盒构建文库,经过Qubit定量和文库检测合格后,使用Ion S5TMXL(Thermofisher公司)上机测序。测序得到的原始数据(raw data),存在一定比例的干扰数据(dirty data),为了使信息分析的结果更加准确、可靠,首先对原始数据进行拼接、过滤,得到有效数据(clean data)。然后基于有效数据进行OTUs(operational taxonomic units)聚类和物种分类分析。根据OTUs聚类结果,对OTUs进行丰度、Alpha多样性计算。对不同样本在97%一致性阈值下的Alpha多样性分析指数(Shannon、Chao1、goods coverage)进行统计。
1.5 风味成分热图的绘制和聚类分析
热图和聚类分析可以明晰风味成分的动态变化规律,也可以看出各个样本之间的相似度。使用MSD化学工作站处理气质联用数据,得到风味成分在各个样本中的含量和种类,再使用OmicShare云平台(https://www.omicshare.com)对所有样本进行聚类分析和热图(heatmap)绘制。
1.6 核心微生物与风味成分的关系确定
参考王鹏等[19]的方法,将检测到的风味成分和丰度前20的细菌属和真菌属作为变量,7个时间段检测到的风味成分含量和微生物含量(取平行样品的均值)分别对应每个变量,通过SPSS 24.0计算变量之间的Spearman 相关系数(ρ),选取微生物与风味成分之间系数绝对值>0.8且相关性显著的部分作为研究微生物与风味成分相关性的可视化对像。对于微生物之间的共现性分析,选取微生物之间系数绝对值>0.8且相关性显著的部分作为可视化对像。使用Cytoscape 3.6.1对大曲微生物与风味成分的相关性和微生物之间的相互关系进行可视化图形的绘制。
前二十的选取:选取7个时间段样品丰度排名前2位的微生物共14个,继续对比7个样品丰度排名第3的微生物,选取丰度排名前6的微生物(如有相同微生物,则选取下一排名)。所有微生物丰度均是每个时间段平行样品的平均值(前10方法同此)。
2 结果与分析
2.1 制曲过程中的微生物多样性
对样品测序后进行嵌合体过滤,得到有效数据(clean reads)。如表1所示,16S rDNA序列测序结果共得到1 121 768条高质量的序列,平均每个样本具有(80 126±180)条;ITS结果共得到1 099 830条高质量的序列,平均每个样本具有(78 559±13 455)条。所有样品覆盖率均在0.990以上,说明测序深度足够深,得到的数据质量也科学可靠。
表1 测序数据处理统计
Table 1 Statistical table of sequencing data processing
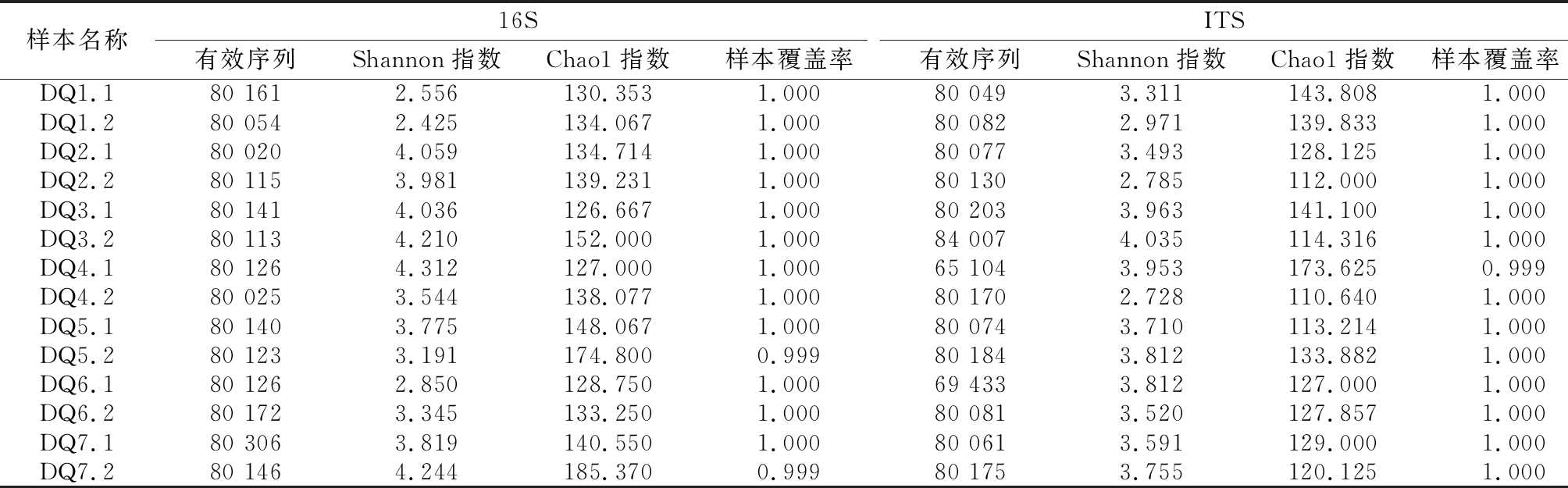
样本名称16SITS有效序列Shannon指数Chao1指数样本覆盖率有效序列Shannon指数Chao1指数样本覆盖率DQ1.180 1612.556130.3531.00080 0493.311143.8081.000DQ1.280 0542.425134.0671.00080 0822.971139.8331.000DQ2.180 0204.059134.7141.00080 0773.493128.1251.000DQ2.280 1153.981139.2311.00080 1302.785112.0001.000DQ3.180 1414.036126.6671.00080 2033.963141.1001.000DQ3.280 1134.210152.0001.00084 0074.035114.3161.000DQ4.180 1264.312127.0001.00065 1043.953173.6250.999DQ4.280 0253.544138.0771.00080 1702.728110.6401.000DQ5.180 1403.775148.0671.00080 0743.710113.2141.000DQ5.280 1233.191174.8000.99980 1843.812133.8821.000DQ6.180 1262.850128.7501.00069 4333.812127.0001.000DQ6.280 1723.345133.2501.00080 0813.520127.8571.000DQ7.180 3063.819140.5501.00080 0613.591129.0001.000DQ7.280 1464.244185.3700.99980 1753.755120.1251.000
对有效数据进行α多样性分析,可以明晰大曲微生物群落多样性[21]。Shannon指数用来估算样品中微生物的多样性,值越大,说明群落多样性越高;Chao1指数是用Chao1算法估计群落中含OTU数目的指数,在生态学中常用来估计物种总数,值越大代表物种总数越多[22](均一化时选取的数据量为cutoff=44 218)。
根据物种注释结果,选取每个分组在各分类水平(phylum、genus)上最大丰度前10的物种,绘制物种相对丰度统计图(图1),细菌门主要有蓝藻门(Cyanobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria),其中蓝藻门(Cyanobacteria)(93.91%)在0 d占据绝对优势,厚壁菌门(Firmicutes)(64.12%~70.71%)和变形菌门(Proteobacteria)(4.64%~19.55%)在5~10 d逐渐占据优势,15~30 d厚壁菌门(Firmicutes)(17.95%~35.61%)和放线菌门(Actinobacteria)(57.55%~74.12%)占优势,经过90 d的储存期后,厚壁菌门(Firmicutes)(79.40%)占据绝对优势,放线菌门(Actinobacteria)(15.29%)次之;优势真菌门主要有子囊菌门(Ascomycota)和毛霉门(Mucoromycota)。属水平上,共检测到78个细菌属和54个真菌属,其中细菌属乳杆菌属(Lactobacillus)(6.39%~45.90%)、魏斯氏菌属(Weissella)(1.43%~25.69%)和真菌属伊萨酵母属(Issatchenkia)(7.59%~74.68%)、曲霉属(Aspergillus)(7.25%~71.57%)在整个制曲过程中为优势菌属。乳杆菌属(Lactobacillus)在酿造过程中有着举足轻重的地位,老白干酒含有远高于其他香型酒的乳酸乙酯就是得益于此[4];魏斯氏菌属(Weissella)对有机酸、酯类及短链脂肪酸等风味成分的合成具有重要作用,是参与食品发酵的重要微生物[23]。伊萨酵母属(Issatchenkia)和曲霉属(Aspergillus)是大曲中常见的两种真菌,对合成醇类、脂类等物质有较大帮助。unidentified_Cyanobacteria(93.79%)和链格孢属(Alternaria)(48.46%)仅在0 d占优势,它们可能来自于原料,随着制曲时间逐渐消散。链霉菌属(Streptomyces)从15 d(1.31%)开始出现,到20 d(48.30%)迅速增长成为优势菌,之后逐渐减少。链霉菌属(Streptomyces)具有很强的萜烯类物质合成能力,对白酒风味具有很大贡献[24]。同时发现,30 d 与120 d菌落结构差异相对较大,因为30 d以后,大曲会从曲房转移到大曲仓库进行90 d的存储(老熟)过程,在此期间,大曲水分含量逐渐降低,且存储环境(温度、湿度)与曲房有较大差异,所以会导致微生物群落结构发生较大变化。
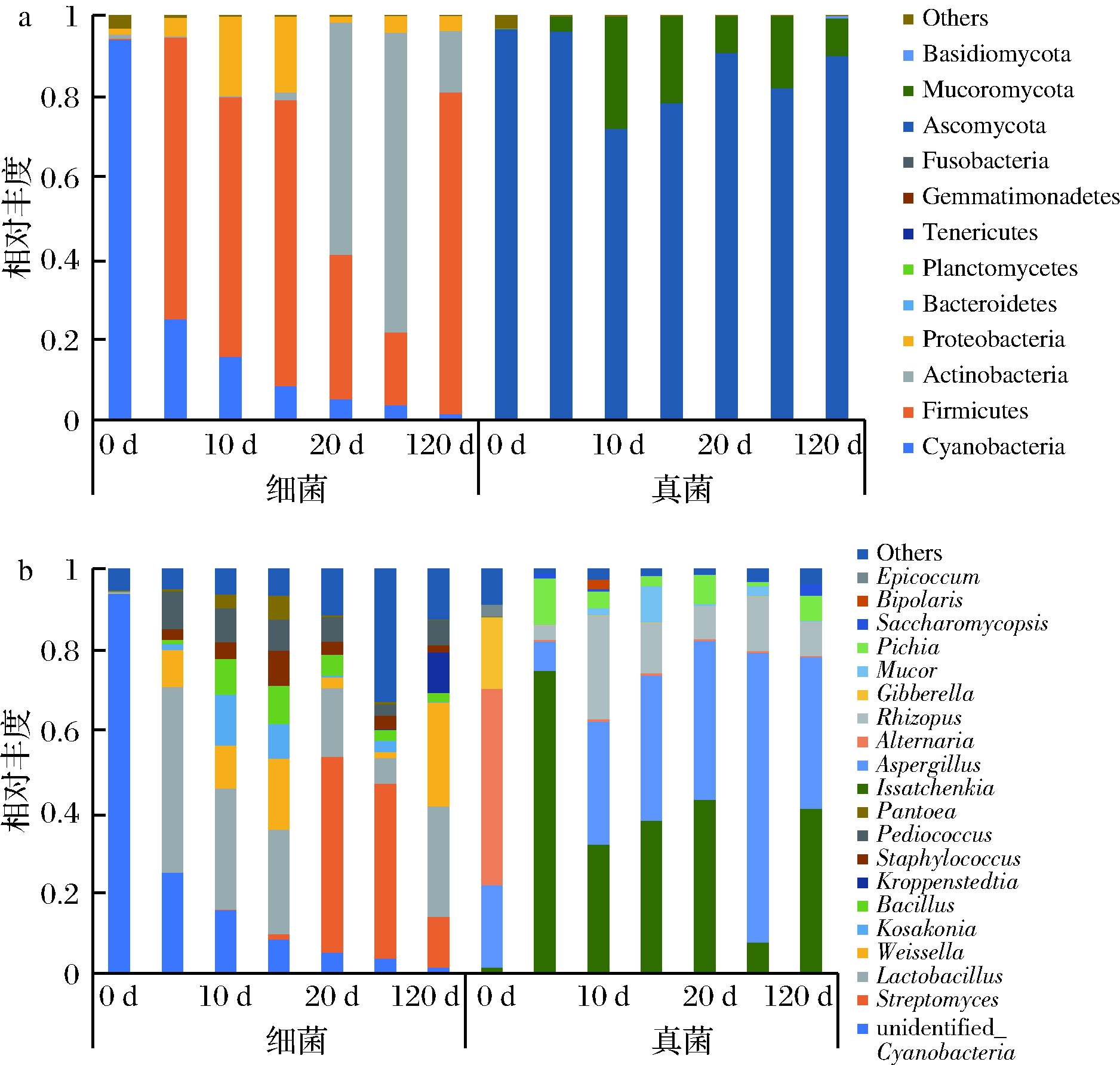
a-门水平前10分布情况;b-属水平前10分布情况
图1 制曲过程中的微生物在门水平和属水平前10的分布情况
Fig.1 Distribution of microorganisms at the phylum and genus levels (top10)during Daqu making
2.2 制曲过程中风味成分的变化
通过顶空固相微萃取-气相-质谱联用技术检测大曲中的风味成分,并进行半定量分析。如表2所示,共检测到99种风味成分,其中包含12种酯类、11种酮类、9种萜烯类、5种碳氢化合物、9种酸类、18种醛类、4种酚类、3种芳香类、1种呋喃类、16种醇类、7种吡嗪类、2种吡喃类和2种吡啶类。将检测到的风味成分绘制成热图(heatmap),并对其进行聚类分析(图2),结果显示,风味成分在制曲过程中的演变趋势比较明显,重要酯类物质(乙酸乙酯、乳酸乙酯、己酸乙酯等)主要在30~120 d的储存过程中合成。而属于健康因子的诸多萜烯类物质,则主要合成于5~15 d。吡嗪、吡啶、吡喃等物质主要合成于10~15 d。其他酸、醛、醇等白酒中常见物质则在5~30 d合成。由此可知,5~15 d是制曲过程中的风味物质高产期,30~120 d的储存期则是重要酯类物质的合成期。
表2 大曲中的风味成分
Table 2 Flavor compounds in Daqu
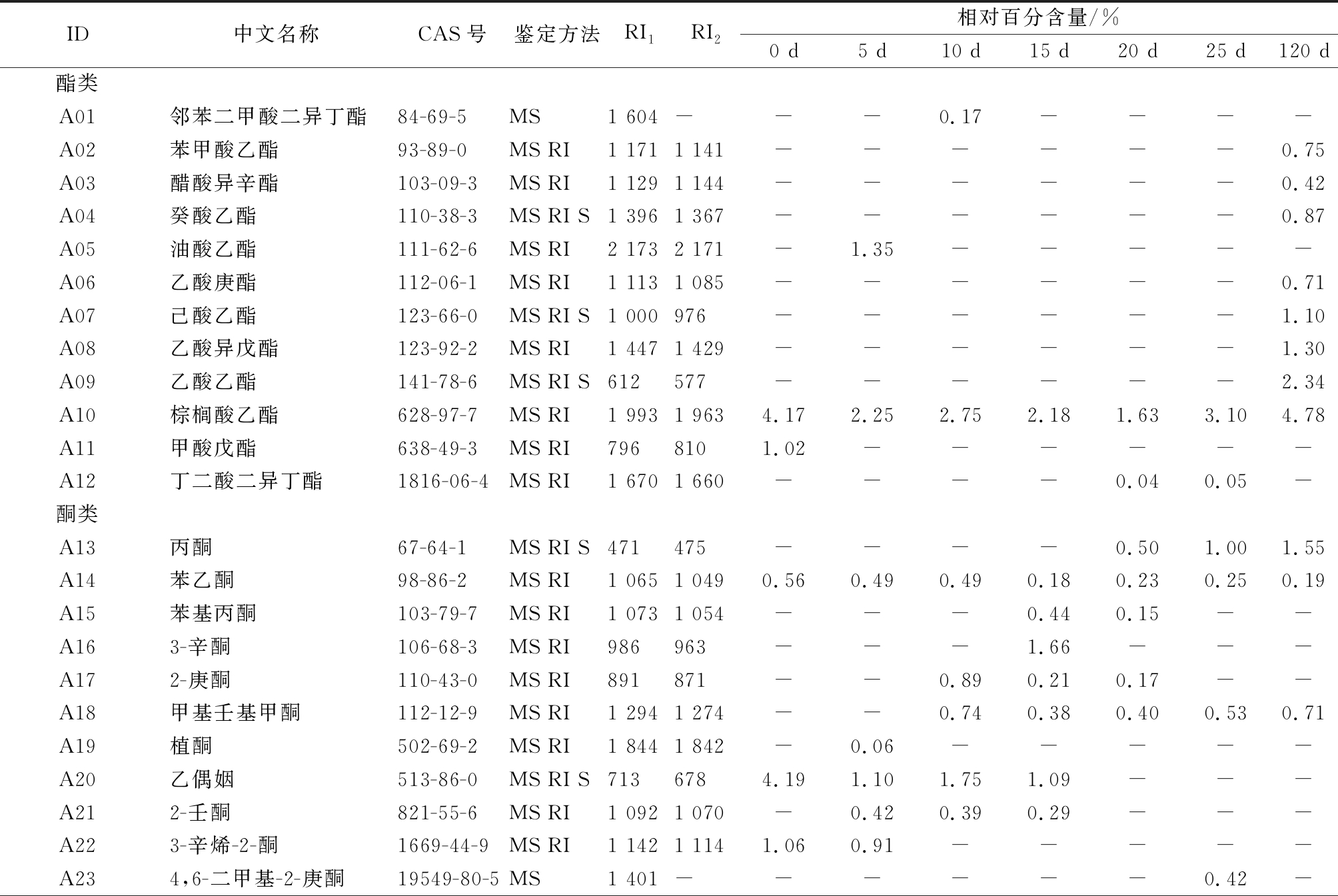
ID中文名称CAS号鉴定方法RI1RI2相对百分含量/%0 d5 d10 d15 d20 d25 d120 d酯类A01邻苯二甲酸二异丁酯84-69-5MS1 604---0.17----A02苯甲酸乙酯93-89-0MS RI1 1711 141------0.75A03醋酸异辛酯103-09-3MS RI1 1291 144------0.42A04癸酸乙酯110-38-3MS RI S1 3961 367------0.87A05油酸乙酯111-62-6MS RI2 1732 171-1.35-----A06乙酸庚酯112-06-1MS RI1 1131 085------0.71A07己酸乙酯123-66-0MS RI S1 000976------1.10A08乙酸异戊酯123-92-2MS RI1 4471 429------1.30A09乙酸乙酯141-78-6MS RI S612577------2.34A10棕榈酸乙酯628-97-7MS RI1 9931 9634.172.252.752.181.633.104.78A11甲酸戊酯638-49-3MS RI7968101.02------A12丁二酸二异丁酯1816-06-4MS RI1 6701 660----0.040.05-酮类A13丙酮67-64-1MS RI S471475----0.501.001.55A14苯乙酮98-86-2MS RI1 0651 0490.560.490.490.180.230.250.19A15苯基丙酮103-79-7MS RI1 0731 054---0.440.15--A163-辛酮106-68-3MS RI986963---1.66---A172-庚酮110-43-0MS RI891871--0.890.210.17--A18甲基壬基甲酮112-12-9MS RI1 2941 274--0.740.380.400.530.71A19植酮502-69-2MS RI1 8441 842-0.06-----A20乙偶姻513-86-0MS RI S7136784.191.101.751.09---A212-壬酮821-55-6MS RI1 0921 070-0.420.390.29---A223-辛烯-2-酮1669-44-9MS RI1 1421 1141.060.91-----A234,6-二甲基-2-庚酮19549-80-5MS1 401------0.42-
续表2
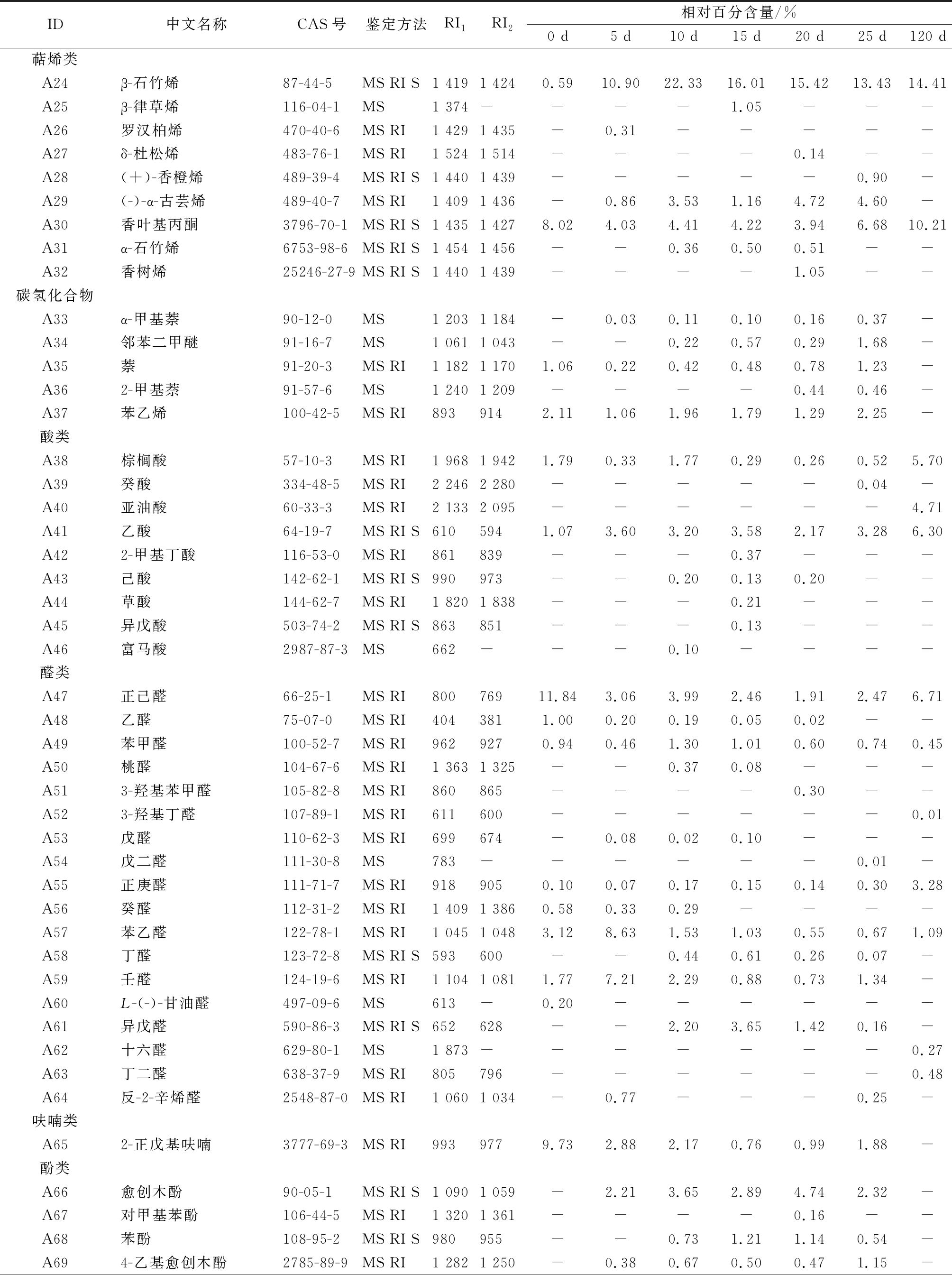
ID中文名称CAS号鉴定方法RI1RI2相对百分含量/%0 d5 d10 d15 d20 d25 d120 d萜烯类A24β-石竹烯87-44-5MS RI S1 4191 4240.5910.9022.3316.0115.4213.4314.41A25β-律草烯116-04-1MS1 374----1.05---A26罗汉柏烯470-40-6MS RI1 4291 435-0.31-----A27δ-杜松烯483-76-1MS RI1 5241 514----0.14--A28(+)-香橙烯489-39-4MS RI S1 4401 439-----0.90-A29(-)-α-古芸烯489-40-7MS RI1 4091 436-0.863.531.164.724.60-A30香叶基丙酮3796-70-1MS RI S1 4351 4278.024.034.414.223.946.6810.21A31α-石竹烯6753-98-6MS RI S1 4541 456--0.360.500.51--A32香树烯25246-27-9MS RI S1 4401 439----1.05--碳氢化合物A33α-甲基萘90-12-0MS1 2031 184-0.030.110.100.160.37-A34邻苯二甲醚91-16-7MS1 0611 043--0.220.570.291.68-A35萘91-20-3MS RI1 1821 1701.060.220.420.480.781.23-A362-甲基萘91-57-6MS1 2401 209----0.440.46-A37苯乙烯100-42-5MS RI8939142.111.061.961.791.292.25-酸类A38棕榈酸57-10-3MS RI1 9681 9421.790.331.770.290.260.525.70A39癸酸334-48-5MS RI2 2462 280-----0.04-A40亚油酸60-33-3MS RI2 1332 095------4.71A41乙酸64-19-7MS RI S6105941.073.603.203.582.173.286.30A422-甲基丁酸116-53-0MS RI861839---0.37---A43己酸142-62-1MS RI S990973--0.200.130.20--A44草酸144-62-7MS RI1 8201 838---0.21---A45异戊酸503-74-2MS RI S863851---0.13---A46富马酸2987-87-3MS662---0.10----醛类A47正己醛66-25-1MS RI80076911.843.063.992.461.912.476.71A48乙醛75-07-0MS RI4043811.000.200.190.050.02--A49苯甲醛100-52-7MS RI9629270.940.461.301.010.600.740.45A50桃醛104-67-6MS RI1 3631 325--0.370.08---A513-羟基苯甲醛105-82-8MS RI860865----0.30--A523-羟基丁醛107-89-1MS RI611600------0.01A53戊醛110-62-3MS RI699674-0.080.020.10---A54戊二醛111-30-8MS783------0.01-A55正庚醛111-71-7MS RI9189050.100.070.170.150.140.303.28A56癸醛112-31-2MS RI1 4091 3860.580.330.29----A57苯乙醛122-78-1MS RI1 0451 0483.128.631.531.030.550.671.09A58丁醛123-72-8MS RI S593600--0.440.610.260.07-A59壬醛124-19-6MS RI1 1041 0811.777.212.290.880.731.34-A60L-(-)-甘油醛497-09-6MS613-0.20------A61异戊醛590-86-3MS RI S652628--2.203.651.420.16-A62十六醛629-80-1MS1 873-------0.27A63丁二醛638-37-9MS RI805796------0.48A64反-2-辛烯醛2548-87-0MS RI1 0601 034-0.77---0.25-呋喃类A652-正戊基呋喃3777-69-3MS RI9939779.732.882.170.760.991.88-酚类A66愈创木酚90-05-1MS RI S1 0901 059-2.213.652.894.742.32-A67对甲基苯酚106-44-5MS RI1 3201 361----0.16--A68苯酚108-95-2MS RI S980955--0.731.211.140.54-A694-乙基愈创木酚2785-89-9MS RI1 2821 250-0.380.670.500.471.15-
续表2

注:RI1,在色谱柱的线性保留指数;RI2,文献中参考线性保留指数;S,标准品定性;“-”表示未报到或未检出
ID中文名称CAS号鉴定方法RI1RI2相对百分含量/%0 d5 d10 d15 d20 d25 d120 d芳香类A70辛弗林94-07-5MS1 301-0.030.040.100.060.110.140.27A71邻二甲苯95-47-6MS RI887862---0.28---A721,4-二氯苯106-46-7MS RI1 02199518.839.816.935.753.641.16-醇类A73苯乙醇60-12-8MS RI S1 1161 0820.8613.111.531.190.761.40-A74乙醇64-17-5MS RI S4274235.739.4011.549.749.1116.8624.94A75正戊醇71-41-0MS RI7657443.06------A76木糖醇87-99-0MS S2 2902 242------2.37A77苄醇100-51-6MS RI1 0361 005--0.230.07---A78正己醇111-27-3MS RI S868852-1.31--0.27--A79辛醇111-87-5MS RI S789785--0.330.200.210.38-A80异戊醇123-51-3MS RI S736706---5.482.703.12-A812-甲基丁醇137-32-6MS RI739726-0.250.901.710.94--A821,3-环己二醇504-01-8MS894---0.10----A832,3-丁二醇513-85-9MS RI S7887473.161.341.631.091.20--A843-辛醇589-98-0MS RI S994985-----0.37-A85山梨醇608-66-2MS801-------3.30A86环丁醇2919-23-5MS RI730717--0.050.581.270.410.05A871-辛烯-3-醇3391-86-4MS RI9809593.426.183.203.102.364.71-A88喇叭茶醇5986-49-2MS RI1 9401 980---0.470.250.63-吡嗪类A892,6-二甲基吡嗪108-50-9MS RI915880-0.180.370.780.881.430.74A902,5-二甲基吡嗪123-32-0MS RI917883---1.000.51--A91川芎嗪1124-11-4MS RI S1 0891 072-0.402.545.8319.0612.54-A922,3-二甲基吡嗪5910-89-4MS RI925892---0.600.690.54-A933-乙基-2,5-甲基吡嗪13360-65-1MS RI1 0821 056---0.580.360.22-A942-乙基-6-甲基吡嗪13925-03-6MS RI1 003976--0.310.43---A95三甲基吡嗪14667-55-1MS RI1 004977-3.283.828.417.763.33-吡喃类A962-乙氧基-3,4-二氢吡喃103-75-3MS2 237----0.03---A976-甲基-3,4-二氢吡喃16015-11-5MS2 601--0.520.310.18---吡啶类A984-苯基吡啶939-23-1MS2 201------0.07-A993-苯基吡啶1008-88-4MS RI1 4711 459--0.31----
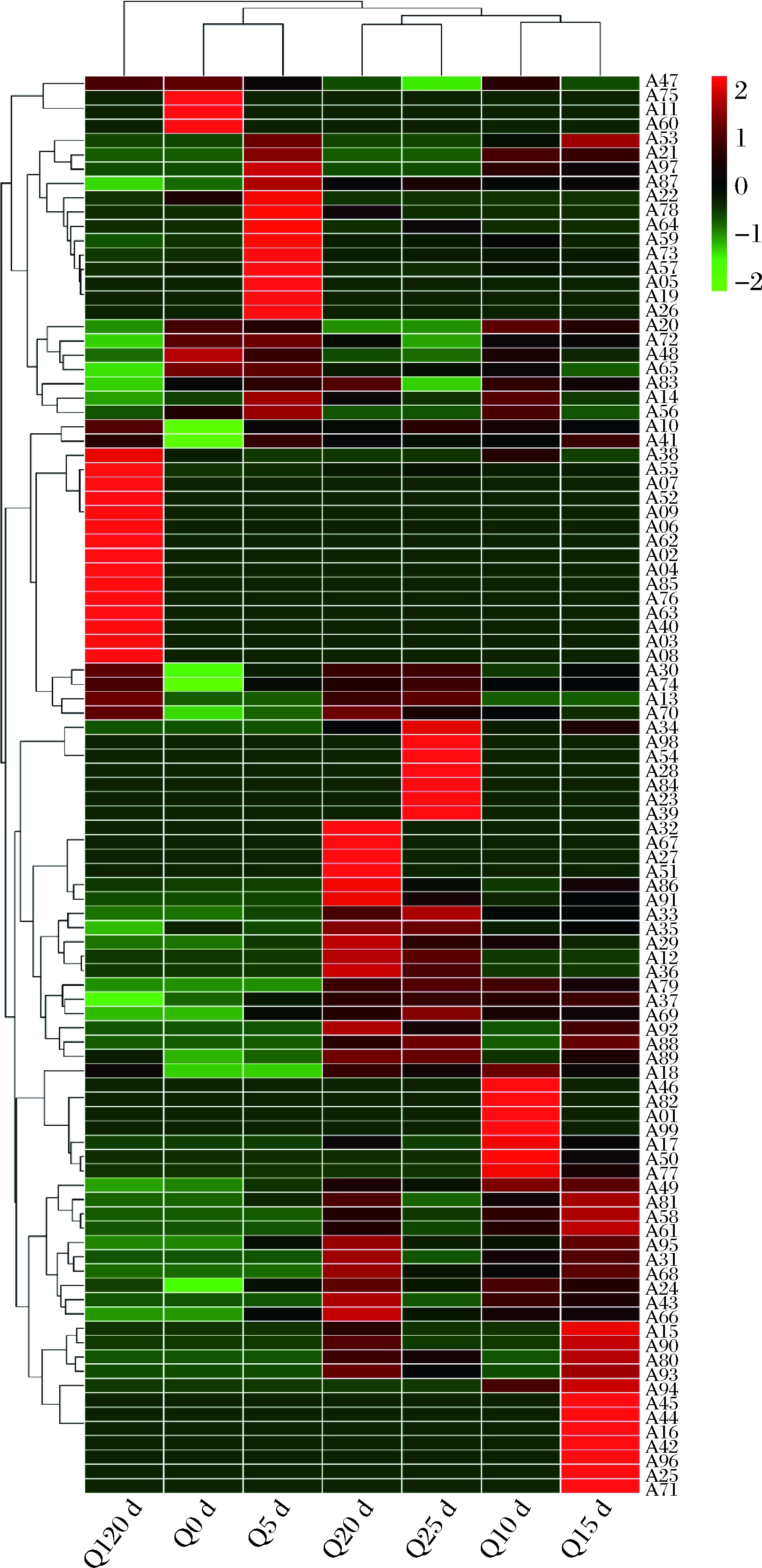
图2 制曲过程中风味成分的变化热图
Fig.2 Heatmap of flavor compounds during Daqu making
2.3 核心微生物的确定及其与风味成分的关系
通过计算微生物与风味成分之间的Spearman相关系数,选择符合要求的数据进行相关性网络图的绘制。由图3可知,芽孢杆菌属(Virgibacillus)是连接数最大的一个属(6个,包含4个正相关2个负相关),属于芽孢杆菌目,其代谢产物包含一些白酒中的微量物质(如乳酸[25]),对白酒风味有一定影响,是白酒酿造过程中的重要微生物[26-27]。unidentified_Cyanobacteria、
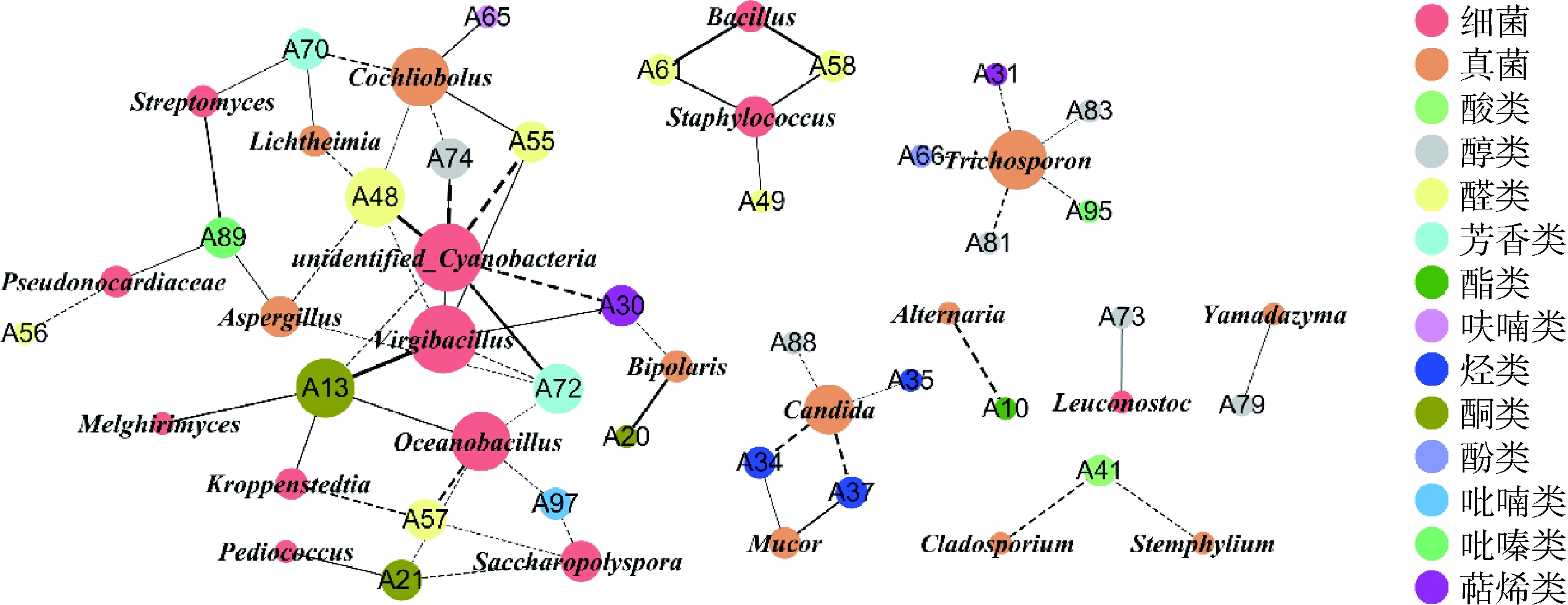
图3 微生物和风味成分的相关性网络图
Fig.3 Correlation network between microbial genera and flavor compounds
注:节点大小表示此节点连接数的多少;实线代表正相关;虚线代表负相关;连接线的粗细代表相关性的强弱(图4同)
丝孢酵母属(Trichosporon)、旋孢腔菌属(Cochliobolus)、假丝酵母属(Candida)和海洋杆菌属(Oceanobacillus)连接数也相对较多,与醇、酸、酮、酯类化合物有显著的相关性。证明在制曲过程中,对风味成分影响较大的微生物属是芽孢杆菌属(Virgibacillus)、unidentified_Cyanobacteria、丝孢酵母属(Trichosporon)、旋孢腔菌属(Cochliobolus)、假丝酵母属(Candida)和海洋杆菌属(Oceanobacillus)。
为探究微生物彼此之间的相互作用关系,计算微生物之间的Spearman相关系数,选择符合要求的数据进行共现性网络分析图的绘制(图4)。共得到39个有效节点(nodes)和204个边(edges)。连接数较多的菌属包括小球菌属(Pediococcus)、枝孢属(Cladosporium)、赤霉菌属(Gibberella)、匐柄霉属(Stemphylium)、链格孢属(Alternaria)、附球菌属(Epicoccum)、旋孢腔菌属(Cochliobolus)、不动杆菌属(Acinetobacter)、Saccharomycopsis、丝孢酵母属(Trichosporon)、unidentified_Cyanobacteria、镰刀菌属(Fusarium)、克罗彭斯特菌属(Kroppenstedtia)、海洋杆菌属(Oceanobacillus)、芽孢杆菌属(Virgibacillus)、迈勒吉尔霉菌属(Melghirimyces)、假丝酵母属(Candida)、青霉菌属(Penicillium)、泛菌属(Pantoea)和Kosakonia,大多数分布在芽孢杆菌目(Bacillales)、格孢菌目(Pleosporales)、乳杆菌目(Lactobacillales)和酵母目(Saccharomycetales)4个目中。其中,小球菌属(Pediococcus)具有最多的连接数(9个),且有5个菌与其具有显著的负相关性。结合图2分析可知,对风味成分贡献较大的核心微生物属包括芽孢杆菌属(Virgibacillus)、unidentified_Cyanobacteria、丝孢酵母属(Trichosporon)、旋孢腔菌属(Cochliobolus)、海洋杆菌属(Oceanobacillus)、假丝酵母属(Candida)。
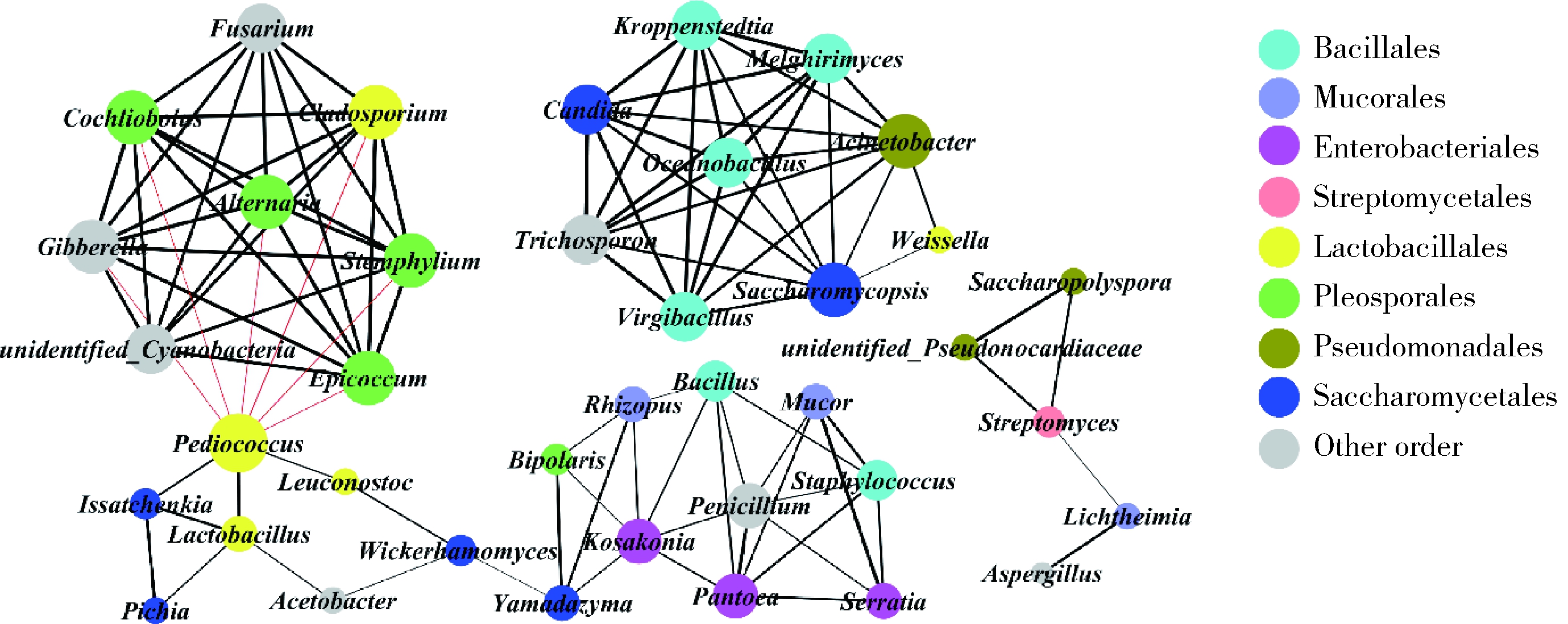
图4 大曲中微生物之间的共现性网络图
Fig.4 Correlation network of co-occurring microbial genera in Daqu
对检测到的风味成分和丰度前20的微生物分别进行主成分分析,通过提取微生物和风味成分的第1主成分进行相关性分析,可以验证所得核心微生物群是否对风味成分有较大贡献[19]。如图5所示,上述所得核心微生物群与风味成分具有显著相关性(R2=0.636 8,P<0.05),说明本次研究所得的6种微生物属所组成的核心微生物群对大曲风味成分有较大影响,是制曲过程中的重要微生物,同时也为后续白酒酿造提供了丰富的风味成分和前体物质,对白酒形成独特风味有重大贡献。
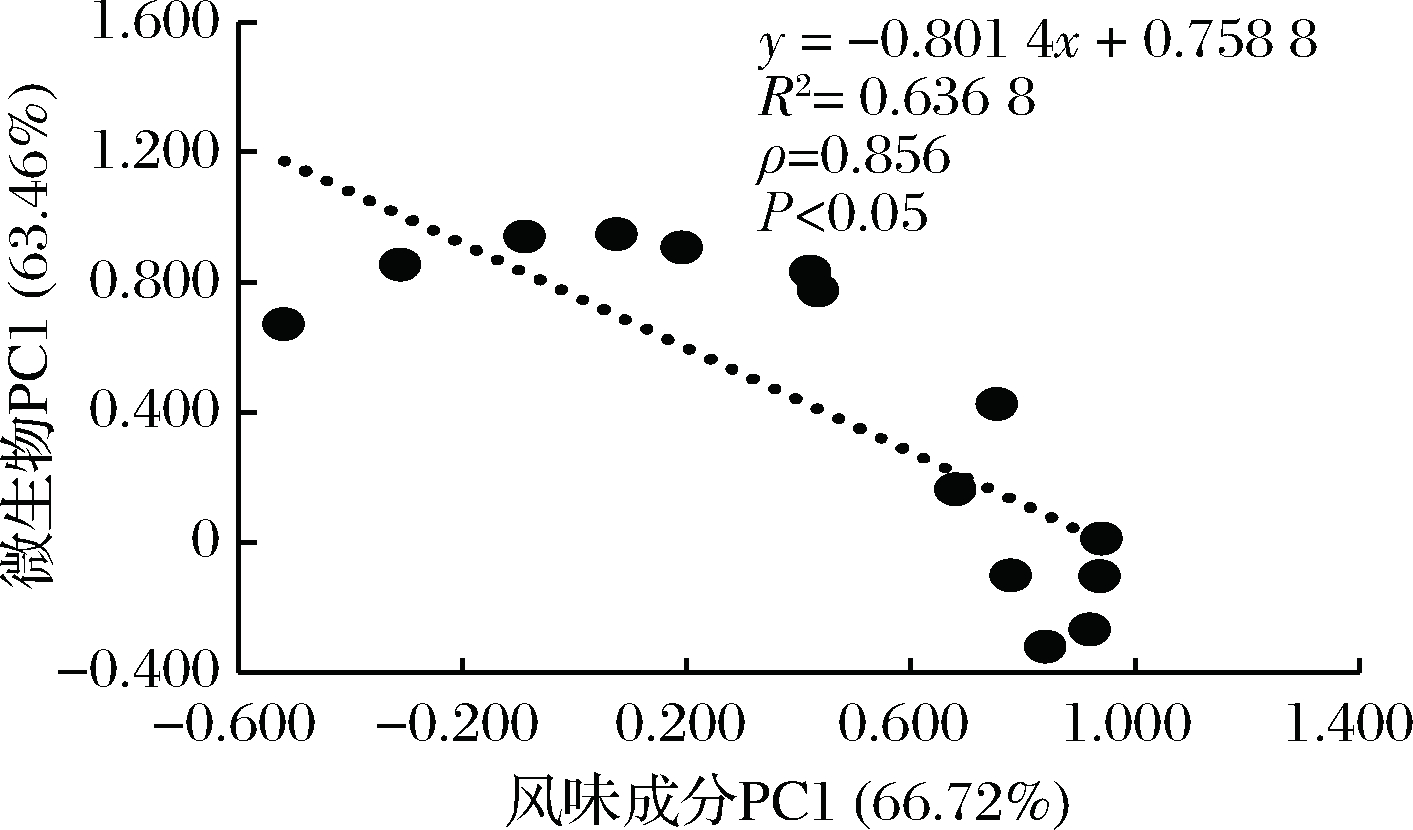
图5 微生物第1主成分与风味成分第1主成分的相关性
Fig.5 Correlation between microorganisms PC1 and flavor compounds PC1
3 讨论与结论
白酒发酵作为多微共酵发酵方式的典型代表,具有参与微生物种类多、工艺复杂和不易控制等特点。而作为影响白酒质量关键因素的大曲同样具有复杂的微生物群落结构,大曲微生物的研究是近年来白酒研究的热点之一,其对于大曲现代化和标准化生产具有非常重要的意义。
本研究通过对老白干大曲样品进行高通量测序,共检测到78个细菌属和54个真菌属,其中优势细菌属为乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)和链霉菌属(Streptomyces),优势真菌属为伊萨酵母属(Issatchenkia)和曲霉属(Aspergillus)。气质分析结果可知,老白干香型大曲中除酯类、醇类和酸类等常见物质外,萜烯类和吡嗪类物质也较为丰富(表2)。酱香型大曲中风味成分主要是酸类、芳香族、醇类及酯类[28],优势细菌主要包括由芽孢杆菌目(Bacillales)、肠杆菌目(Enterobacteriales)、乳酸杆菌目(Lactobacillales)和放线菌目(Actinomycetales)4个目,优势真菌是酵母目(Saccharomycetales)、肉座菌目(Hypocreales)、散子囊菌目(Eurotiales)和丝孢酵母目(Trichosporonales)4个目[29];浓香型大曲中的风味成分主要是酸类、酯类、醇类和醛类[30],传统培养技术鉴定得到的优势菌为地衣芽孢杆菌(Bacillus licheniformis)、谢瓦氏曲霉(Aspergillus chevalieri)、米曲霉(Aspergillus oryzae),聚合酶链式反应-变形梯度凝胶电泳(polymerase chain reaction denatured gradient gel electrophoresis,PCR-DGGE)鉴定得到的优势菌为葡萄球菌(Staphylococcus)、高温放线菌(Thermoactinomyces)、地衣芽孢杆菌(Bacillus licheniformis)、多枝横梗霉(Lichtheimia ramose)[31];清香型大曲中风味成分比较突出的是醇类和酮类[32],微生物主要组成为扣囊覆膜酵母(Saccharomycopsis fibuligera)、乳酸菌(Lactobacillus)、芽孢杆菌(Bacillus)[33]。由此可知,大曲中微生物群落结构对大曲中的风味成分有较大影响,不同香型白酒大曲中的微生物组成和风味物质种类都不一样。老白干香型大曲与其他主要香型大曲相比,有属于自己独特的核心微生物和风味成分,这也是构成老白干香型白酒独特风味的主要因素之一。同时发现,老白干大曲中并没有检测到乳酸乙酯和乙酸乙酯,这可能与检测下限有关,也说明了酒体中的这两种风味成分主要是在酒醅发酵过程中形成的。风味物质热图聚类分析结果表明,5~15 d是制曲过程中的风味物质高产期;30~120 d的储存期则是重要酯类物质的合成期。根据相关性网络图可知,芽孢杆菌属(Virgibacillus)、unidentified_Cyanobacteria、丝孢酵母属(Trichosporon)、旋孢腔菌属(Cochliobolus)、海洋杆菌属(Oceanobacillus)、假丝酵母属(Candida)6种微生物属对风味成分有较大贡献,但其中只有unidentified_Cyanobacteria一种是优势菌属(图1),这与之前王鹏等[19]报道的白酒发酵过程中的核心微生物群则大多数由丰度较大的菌属组成并不是很一致。丰度较低的微生物也有可能对风味物质有较大的贡献,比如在浓香型酒醅中,梭菌纲微生物丰度一直较低,但对酒醅风味物质贡献却巨大[35]。因此,微生物丰度大小与其对风味成分的贡献之间的相关性还有待进一步研究,后续还要与该微生物关联的风味成分的阈值等相关因素关联起来。
总之,通过研究制曲过程中微生物多样性及其与风味成分的关系,能够进一步了解大曲核心微生物对风味成分的贡献情况,同时可以结合微生物培养技术改良大曲生产工艺,弥补某类微生物缺陷,为大曲标准化生产提供参考,也为下一步研究酿酒过程中的微生物多样性以及白酒风味物质的形成过程奠定基础。
[1] 徐岩,范文来,葛向阳,等.科学认识中国白酒中的生物活性成分[J].酿酒科技,2013(9):1-6.
[2] 郭学武,范恩帝,马冰涛,等.中国白酒中微量成分研究进展[J].食品科学,2020,41(11):267-276.
[3] 文淑婷,李艳.白干酒曲中酵母菌多样性分析[J].食品科学,2018,39(24):182-189.
[4] 张志民.衡水老白干香型的初步研究[J].酿酒,1998(2):14-17.
[5] 曹健君,张肖克,黄平.中国白酒工业技术进步与发展[J].酿酒科技,2005(5):22-28.
[6] 丁云连,范文来,徐岩,等.老白干香型白酒香气成分分析[J].酿酒,2008,35(4):109-113.
[7] 霍丽娜,王运霄,李达.老白干香型原酒的微量成分与风格特点分析[J].酿酒科技,2015,256(10):44-46.
[8] 王庆宇,吴荣荣,安惠玲,等.老白干香型白酒大曲微生物分离培养基的选择[J].酿酒科技,2015(7):56-57;62.
[9] 丁海梅.干酪乳杆菌在老白干香型白酒中的应用[D].天津:天津科技大学,2013.
[10] 孙鹏飞.衡水老白干酒中产酸微生物的分离鉴定及特性研究[D].石家庄:河北科技大学,2016.
[11] 傅金泉,黄建平.我国酿酒微生物研究与应用技术的发展(上)[J].酿酒科技,1996(4):21-27.
[12] 范文来,徐岩.大曲酶系研究的回顾与展望[J].酿酒,2000(2):35-40.
[13] 范文来,徐岩,刁亚琴.浓香型大曲水解酶系及测定方法的研究[J].酿酒,2002(5):25-31.
[14] 范文来,徐岩,陆红珍,等.浓香型大曲的酯化能力与酯分解率研究[J].酿酒,2003,30(1):10-12.
[15] DU H, WANG X S, ZHANG Y H, et al. Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter [J].International Journal of Food Microbiology,2019,297:32-40.
[16] 郭学武,范恩帝,马冰涛,等.中国固态发酵白酒中功能细菌研究进展[J].食品与发酵工业,2020,46(1):280-286.
[17] 汪文鹏,李永博,吴树坤,等.高温大曲中产吡嗪芽孢杆菌的分离鉴定及发酵产物分析[J].中国酿造,2017,36(6):63-66.
[18] 林建春,吴群,徐岩.清香型白酒发酵过程中酵母群落结构及其与尿素代谢的关系[J].微生物学通报,2017,44(11):2 522-2 529.
[19] 王鹏,吴群,徐岩.中国白酒发酵过程中的核心微生物群及其与环境因子的关系[J].微生物学报,2018, 58(1):142-153.
[20] 王敏,张煜行,李泽霞,等.顶空固相微萃取-气质联用法分析衡水老白干酒风味物质[J].酿酒科技,2015(9):111-114.
[21] LI B, ZHNAG X X, GUO F, et al. Characterization of tetracycline resistant bacterial community in saline activated sludge using batch stress incubation with high-throughput sequencing analysis[J]. Water Research,2013,47(13):4 207-4 216.
[22] 马龙,邢军,李安,等.开菲尔粒发酵过程酵母菌多样性和动态规律[J].中国乳品工业,2019,47(9):24-28.
[23] 李巧玉,方芳,堵国成,等.魏斯氏菌在发酵食品中的应用[J].食品与发酵工业,2017,43(10):241-247.
[24] 杨帆,陈良强,林琳,等.一株放线菌的分离鉴定及其代谢产物研究[J].酿酒科技,2014(9):42-44.
[25] 朱文淼,肖敏,刘复今.固态发酵白酒生产中芽孢杆菌属细菌产乳酸特性及降乳研究[J].食品与发酵工业,1996(4):38-41;15.
[26] MENG X, WU Q, WANG L, et al. Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Bacillus licheniformis for Chinese Maotai-flavor liquor making[J]. Journal of Industrial Microbiology & Biotechnology,2015, 42 (12): 1 601-1 608.
[27] WANG P, WU Q, JIANG X J, et al. Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J]. International Journal of Food Microbiology,2017,250:59-67.
[28] 汪玲玲.酱香型白酒微量成分及大曲香气物质研究[D].无锡:江南大学,2013.
[29] 李登勇,黄钧,丁晓菲,等.酱香大曲间微生物群落结构时空特征的表征[J].食品工业科技,2018,39(23):139-145.
[30] 张春林.泸州老窖大曲的质量、微生物与香气成分关系[D].无锡:江南大学,2012.
[31] 黄晓宁,黄晶晶,李兆杰,等.浓香型和酱香型大曲微生物多样性分析[J].中国酿造,2016,35(9):33-37.
[32] 马茹菲,马玉帛,佟世生,等.不同清香型大曲理化生化指标和挥发性成分分析[J].酿酒科技,2019(3):70-75.
[33] 周森,胡佳音,崔洋,等.应用高通量测序技术解析清香型大曲微生物多样性[J].中国食品学报,2019,19(6):244-250.
[34] 高江婧,任聪,刘国英,等.浓香型白酒酒醅风味物质和微生物菌群结构随发酵时间的变化规律[J].食品与发酵工业,2019,45(20):1-6.