植物多酚是具有苯环并结合多个羟基化学结构的物质总称,主要包括黄酮类化合物、酚酸类化合物和其他类化合物,因其具有较强的抗氧化以及清除自由基的能力[1],能够预防高血糖、高血脂、心脑血管等慢性疾病、降低癌症风险以及抵抗神经性疾病[2],被广泛应用于食品、药理、营养、生化等领域[3]。植物多酚广泛存在于植物的皮、根、叶、果实及果皮中,如绿原酸、表没食子儿茶素没食子酸酯(epigallo-catechin gallate,简称EGCG)、芦丁、槲皮素、鼠尾草酸主要存在于金银花、茶叶、银杏、山楂叶、迷迭香等植物的花、叶中,含量丰富。EGCG、芦丁、槲皮素属于典型黄酮类化合物,鼠尾草酸和绿原酸是酚酸类化合物。将富含多酚化合物的物质开发成功能性的食品,对人类健康具有重要作用。
植物多酚被人体吸收才能发挥其生物活性,但其被人体吸收受分子的极性和分子大小的影响[4]。分子的极性常用油水分配系数来表征,表征化合物亲脂性和透过生物膜的能力,是预测跨膜转运的重要参数[5],现已被广泛用来预测多酚在生物体内的膜渗透性[6-8]。植物多酚若要被人体消化吸收,须以分子形式透过生物膜,即须具备一定的亲水性及亲脂性。多酚被机体消化和利用的程度可以用生物可接受率和生物利用度来衡量。生物可接受率是指营养素被机体摄入后,经胃、小肠消化后,营养元素及可被小肠吸收利用的功能成分量占摄入总量的比值。生物利用度是营养素进入人体循环的量的比例,即营养素由胃肠道吸收,经过肝脏而到达体循环血液中的量占摄入量的百分比[9]。
体外模拟消化模型常被用来研究生物活性物质在体外实验条件下模拟人体内消化道消化吸收过程的一种方法,可以快速准确地对多酚的生物可接受率、生物利用度和生物活性进行测![]() 等[11]利用体外消化模型研究添加1%和5%咖啡酸的面包的生物可接受率及生物利用度,结果证实面包中的咖啡酸、丁香酸和香草酸等多酚化合物使面包具有较高抗氧化活性,但生物可利用度较低。食物经过胃肠消化后多酚含量会发生显著的变化并影响其抗氧化活性。发芽的糙米经过体外模拟消化的胃、肠消化阶段后,多酚和黄酮的释放量显著增加,抗氧化能力显著提高[12]。面包、豆芽等食品经过胃肠消化阶段后多酚含量增加是因为大部分多酚是以结合多酚形式存在的,但对于不同结构、不同极性的单体多酚经过消化阶段,多酚含量和抗氧化性会发生哪些变化、能否被机体吸收和利用还不清楚。本实验选择5种具有代表性的不同极性的植物多酚,分析其在人体胃肠液的不同pH条件下油水分配系数,预测其跨膜转运能力,通过体外模拟体系分析多酚的生物可接受率和生物利用度,为正确认识人体对植物多酚的生物活性利用提供理论基础,为植物多酚功能性食品的开发提供理论依据。
等[11]利用体外消化模型研究添加1%和5%咖啡酸的面包的生物可接受率及生物利用度,结果证实面包中的咖啡酸、丁香酸和香草酸等多酚化合物使面包具有较高抗氧化活性,但生物可利用度较低。食物经过胃肠消化后多酚含量会发生显著的变化并影响其抗氧化活性。发芽的糙米经过体外模拟消化的胃、肠消化阶段后,多酚和黄酮的释放量显著增加,抗氧化能力显著提高[12]。面包、豆芽等食品经过胃肠消化阶段后多酚含量增加是因为大部分多酚是以结合多酚形式存在的,但对于不同结构、不同极性的单体多酚经过消化阶段,多酚含量和抗氧化性会发生哪些变化、能否被机体吸收和利用还不清楚。本实验选择5种具有代表性的不同极性的植物多酚,分析其在人体胃肠液的不同pH条件下油水分配系数,预测其跨膜转运能力,通过体外模拟体系分析多酚的生物可接受率和生物利用度,为正确认识人体对植物多酚的生物活性利用提供理论基础,为植物多酚功能性食品的开发提供理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料
表没食子儿茶素没食子酸酯(纯度≥98%)、鼠尾草酸(纯度≥98%)、绿原酸(纯度≥98%)、槲皮素(纯度≥98%)、芦丁(纯度≥98%),南京道斯夫生物科技有限公司;透析袋(MD34),美国联合碳化透析袋,上海桥星贸易有限公司。α-淀粉酶(≥3 700 U/mg)、胃蛋白酶(3 000~3 500 U/mg)、胰蛋白酶(≥300 U/mg),1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),1-正辛醇等试剂均为分析纯,生工生物工程(上海)股份有限公司。
1.1.2 设备
T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;低温离心机,赛默飞世尔科技中国有限公司;雷磁PHS-3C pH计,上海仪电科学仪器股份有限公司;ZD-85气浴恒温振荡器,常州国华电器有限公司;安捷伦1260型高效液相色谱仪,安捷伦科技有限公司。
1.2 实验方法
1.2.1 多酚油水分配系数的测定
配制pH值为1.5、5.8、7.8的磷酸盐缓冲溶液,取正辛醇与各pH值的磷酸盐缓冲液等体积混合,振荡12 h,在室温下静置24 h,上层溶液即为磷酸盐缓冲液饱和的正辛醇,下层溶液即为正辛醇饱和的磷酸盐缓冲液。用水饱和的正辛醇溶液配制饱和的EGCG、鼠尾草酸、绿原酸、槲皮素、芦丁溶液10 mL,3 000 r/min条件下离心10 min,取上清液5 mL,再加入等体积pH相同的正辛醇饱和的磷酸盐缓冲液,置于锥形瓶中。将正辛醇-水混合物先超声30 min,再在气浴恒温振荡器中(37 ℃、200 r/min)振摇1 h,取出后避光静置2 h。取原正辛醇多酚溶液(ρ总)和振荡后的上层溶液(饱和正辛醇中溶解的多酚,ρ0),用0.45 μm滤膜过滤后置于进样瓶中,用高效液相色谱仪测定。水相浓度ρW=ρ总-ρ0,按照分配系数的公式:lgP=lg ρ0/ρW计算其表观油水分配系数[13]。
1.2.2 高效液相色谱法测定多酚的油水分配系数
使用安捷伦TC-C18柱(4.6 mm×250 mm,5 μm)。绿原酸、槲皮素、芦丁、鼠尾草酸使用的流动相为乙腈-0.4%磷酸溶液(体积比13∶87)、甲醇-0.4%磷酸溶液(体积比45∶55)、甲醇-0.4%磷酸溶液(体积比35∶65)、乙腈-0.1%磷酸溶液(体积比60∶40);EGCG的流动相:A:乙腈-乙酸- EDTA-2Na (体积比90∶8∶2,定容至1 000 mL),B乙腈-乙酸- EDTA-2Na (体积比80∶18∶2,定容至1 000 mL),梯度条件:100% A保持10 min,100% A→68%A 5 min;0% B→32%B;15 min后→100%A。柱温30 ℃、流速1.0 mL/min、进样量:10 μL,检测波长依次为327、368、360、230和278 nm。
1.2.3 DPPH自由基清除能力的测定
参照MANOHAR等[14]的方法。将0.5 mL多酚待测液与3 mL 50 μmol/L的DPPH乙醇溶液混合,放置在室温下避光反应30 min,在波长517 nm处测定其吸光度,并且按公式(1)计算DPPH自由基清除率:
DPPH自由基清除率![]()
(1)
式中:AC为对照的吸光度,AS为样品的吸光度。
1.2.4 还原能力(铁氰化钾法)
参照赵文思等[15]的方法,将0.5 mL待测液与2.5 mL磷酸盐缓冲液(pH 6.6,0.2 mol/L)和2.5 mL 1%铁氰化钾充分混合,放置在50 ℃温度下加热20 min,快速冷却,再向溶液中加入10%三氯乙酸 2.5 mL,在3 000 r/min转速下离心10 min,取上清液2.5 mL,加入2.5 mL蒸馏水,与0.5 mL 0.1% 三氯化铁溶液,充分混匀,随后静置10 min,在700 nm下测吸光度,用吸光度A700可直接表示还原能力,且吸光度越大还原能力越强。
1.2.5 体外模拟人体口腔、胃、肠消化处理
体外模拟消化过程参照文献[16]中的方法。准确称取12.50 mg各多酚样品与25 mL蒸馏水混匀,置于气浴恒温振荡器(37 ℃、100 r/min)中振荡10 min,取出一半样品进行低温冷冻离心(4 ℃,10 000 r/min,10 min),取上清液10 mL,置于-20 ℃条件下保存备用,作为未消化样品;另一半样品进入消化模拟阶段,分别为口腔消化(0.119 g Na2HPO4,0.009 5 g KH2PO4,0.4 g NaCl加蒸馏水定容到50 mL,溶液pH调至6.75,加入0.455 g α-淀粉酶)、胃消化(用1 mol/L盐酸将消化液pH调至1.5~2.0,加入10 mL 4 mg/mL的胃蛋白酶溶液)、小肠消化(10 mL 1.2 mg/mL胰酶和2.4 mg/mL猪胆盐混合液,用0.1 mol/L NaHCO3调pH为7.4),分别取出10 mL经胃、肠液消化的样品进行低温冷冻离心(4 ℃,10 000 r/min,10 min),置于-20 ℃条件下保存备用,作为胃、肠消化样品;取20 mL模拟肠消化样品放入烧杯中,再放入装有10 mL 0.05 mol/L KH2PO4(pH 7.0)的透析袋,在 37 ℃、100 r/min条件下振荡4 h,透析袋中的成分为可吸收样品(in),透析袋外样品为不可吸收样品(out),迅速进行低温冷冻离心(4 ℃,10 000 r/min,10 min),从in取上清液10 mL,从out中取上清液7 mL,放置于-20 ℃条件下保存备用。
1.2.6 多酚含量和总抗氧化能力的测定
经过胃肠消化阶段后各多酚的含量采用高效液相法测定,方法同1.2.2。以DPPH方法表征多酚的总抗氧化能力。
1.2.7 多酚、抗氧化性的生物可接受率和生物利用度理论计算
根据![]() 等[11] 的方法,多酚生物可接受率指数(phenolics bioaccessibility index,PAC)、多酚生物利用度指数(phenolics bioavailability index,PAV)、抗氧化性生物可接受率指数(antioxidant bioaccessibility index,BAC)、抗氧化性生物利用度指数(antioxidant bioavailability index,BAV)计算公式如下:
等[11] 的方法,多酚生物可接受率指数(phenolics bioaccessibility index,PAC)、多酚生物利用度指数(phenolics bioavailability index,PAV)、抗氧化性生物可接受率指数(antioxidant bioaccessibility index,BAC)、抗氧化性生物利用度指数(antioxidant bioavailability index,BAV)计算公式如下:
多酚生物可接受率指数![]()
(2)
多酚生物利用度指数![]()
(3)
抗氧化性生物可接受率指数![]()
(4)
抗氧化性生物利用度指数![]()
(5)
式中:ρ肠为多酚经过小肠消化后保留的多酚含量,mg/mL;ρ未消化为多酚的初始质量浓度,mg/mL;ρIN为透析袋中总多酚的量,mg/mL;A肠为多酚经过小肠消化后保留的抗氧化活性;A未消化为多酚的初始抗氧化活性;AIN为透析袋中多酚的抗氧化活性。
1.3 数据统计分析
每个试验重复3次,结果表示为平均值±SD。数据统计分析采用Statistix 8.1 (分析软件, St Paul, MN) 软件包中Linear Models程序进行,差异显著性(P<0.05)分析使用Tukey HSD程序,采用Sigmaplot 11.0 软件作图。
2 结果与分析
2.1 pH值对不同植物多酚亲水亲油性的影响
油水分配系数是用于表示化合物亲脂性和透过生物膜能力的重要参数,常用于评价药物在人体胃肠道的吸收和转运情况[17]。根据油水分配系数lgP的范围,可以判断多酚的亲水/亲油性,能否跨膜转运和被吸收的情况。当lgP<0,化合物显示水溶性,lgP>0,化合物则表现出脂溶性,当lgP<-2时,化合物亲水性太强,不能穿过脂质膜;当lgP>3,则化合物的疏水性太强,很难从细胞膜另一侧释放出来并进入附近的血管或淋巴管[18]。人体内胃肠道pH值范围在1.4~8.0[19],因此,选择pH 1.5、5.8、7.8分别代表胃液、十二指肠液、小肠液的pH值,其与多酚的结构、含量变化及在胃肠道吸收程度有很大的影响。表1为鼠尾草酸、槲皮素、芦丁、EGCG和绿原酸在pH 1.5、5.8、7.8的标准曲线及线性浓度范围,表2为5种多酚在3个pH值条件下的油水分配系数。由表2可知,在pH 1.5、5.8、7.8时,鼠尾草酸和槲皮素的lgP为[0,3],芦丁的lgP值[-1,1],说明这3种多酚在胃肠环境中具有良好的亲脂亲水性,多酚化合物可以穿过细胞膜并从细胞膜另一侧释放出来,被人体吸收利用;EGCG和绿原酸在pH 1.5和pH 5.8时,lgP值在[-1,1],能被人体吸收利用,而在pH 7.8时,lgP在[-3,0],因其水溶性较强而不易穿过肠黏膜并被人体吸收。pH对多酚化合物亲水亲油性的影响,本质原因可以归结为pH对其结构稳定性的影响。如:EGCG在pH 2~6稳定,在中性和碱性水溶液中极不稳定,羟基去质子化生成过氧化物和氧化产物或者二聚体[20];绿原酸在酸性条件下较为稳定,呈分子形态存在,在偏中性和弱碱性条件下呈解离态或其同分异构体形式存在[21]。因此,EGCG和绿原酸在pH 7.8亲水性较强与其羟基质子化或解离有关。
表1 不同极性植物多酚在不同pH值下油水分配系数标准曲线
Table 1 Standard curve of oil and water partition coefficientof plant polyphenols with different polarities at various pH values
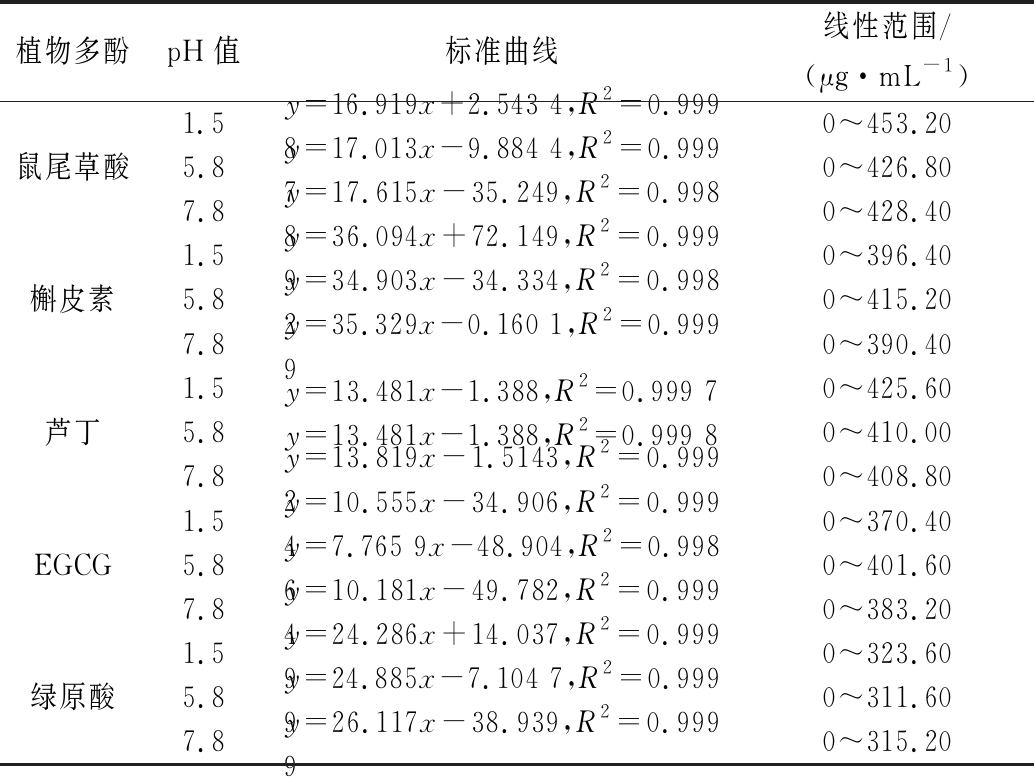
植物多酚pH值标准曲线线性范围/(μg·mL-1)1.5y=16.919x+2.543 4,R2=0.999 80~453.20鼠尾草酸5.8y=17.013x-9.884 4,R2=0.999 70~426.807.8y=17.615x-35.249,R2=0.998 80~428.401.5y=36.094x+72.149,R2=0.999 90~396.40槲皮素5.8y=34.903x-34.334,R2=0.998 20~415.207.8y=35.329x-0.160 1,R2=0.999 90~390.401.5y=13.481x-1.388,R2=0.999 70~425.60芦丁5.8y=13.481x-1.388,R2=0.999 80~410.007.8y=13.819x-1.5143,R2=0.999 20~408.801.5y=10.555x-34.906,R2=0.999 40~370.40EGCG5.8y=7.765 9x-48.904,R2=0.998 60~401.607.8y=10.181x-49.782,R2=0.999 40~383.201.5y=24.286x+14.037,R2=0.999 90~323.60绿原酸5.8y=24.885x-7.104 7,R2=0.999 90~311.607.8y=26.117x-38.939,R2=0.999 90~315.20
表2 不同极性植物多酚在不同pH值下油水分配系数
Table 2 Oil-water partition coefficient of plant polyphenols with different polarities at various pH values
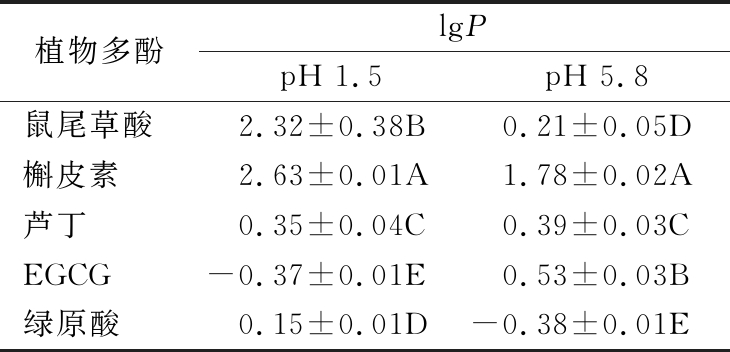
注:字母A~E表示不同多酚在相同的pH值差异显著(P<0.05)
植物多酚lgPpH 1.5pH 5.8pH 7.8鼠尾草酸2.32±0.38B0.21±0.05D0.96±0.02B槲皮素2.63±0.01A1.78±0.02A1.40±0.01A芦丁0.35±0.04C0.39±0.03C-0.72±0.01CEGCG-0.37±0.01E0.53±0.03B-1.13±0.01D绿原酸0.15±0.01D-0.38±0.01E-2.33±0.03E
2.2 不同极性植物多酚抗氧化能力的比较
不同极性植物多酚对DPPH自由基清除能力和对亚铁离子的还原能力如图1所示。鼠尾草酸、槲皮素、芦丁、EGCG和绿原酸对DPPH自由基的清除率分别为(63.09±2.59)%、(79.20±1.08)%、(71.92±1.87)%、(89.60±1.30)%和(80.24±1.52)%,差异显著(P<0.05);对Fe2+还原能力为( 0.70±0.02)、(0.82±0.01)、(0.72±0.02)、(1.16±0.06)和(0.91±0.07) mmol/L,差异显著(P<0.05)。多酚化合物因具有供氢或电子并具有螯合金属的能力而具有较强的抗氧化能力[22]。在5种极性不同的酚类化合物中,EGCG的自由基清除能力和还原能力最强,而鼠尾草酸的最弱,这可能与酚类化合物中酚羟基的数据有关。EGCG是酯型黄酮类化合物,具有8个羟基,可以清除大量的自由基,包括单线态氧、超氧阴离子、过氧自由基和羟自由基[22],因此,水溶性的EGCG表现出较强的自由基清除能力和亚铁离子还原能力;鼠尾草酸是一种酚型的二萜类化合物,苯环上有2个羟基易离子化成为良好的供氢体。EGCG和鼠尾草酸具有较强的羟自由基的清除能力。EGCG亚铁离子还原能力表征的是多酚样品总的还原能力,还原能力越强,抗氧化活性就越高。EGCG的苯环上有多个活泼的邻位羟基,可将Fe3+还原为Fe2+, 因此其表现出较强的亚铁离子还原能力。

图1 不同极性植物多酚抗氧化能力
Fig.1 Antioxidant capacity of different plant polyphenols with various polarities
注:字母A~C表示各组多酚的羟自由基清除率差异显著(P<0.05)字母a~c表示亚铁离子还原能力差异显著(P<0.05)
2.3 多酚含量的生物可接受率和生物利用度
生物可接受率指数和生物利用度指数可以表征多酚进入小肠及穿过小肠黏膜进入血液中的比例,一般地,多酚只有保持其完整的结构才能被吸收后发挥其生物活性[17]。多酚含量的生物可接受率和生物利用度如图2所示,鼠尾草酸、槲皮素、芦丁、EGCG和绿原酸5种多酚含量的生物可接受率分别为0.45±0.04、0.32±0.00、1.05±0.03、0.15±0.00、0.38±0.01,生物利用度分别为0.18±0.00、0.65±0.02、0.50±0.01、0.17±0.00、0.33±0.01,多酚生物利用度差异显著(P<0.05)。由此可知,对多酚的生物活性利用度高低的顺序依次为槲皮素>芦丁>绿原酸>鼠尾草酸>EGCG。

图2 不同多酚体外模拟多酚含量的生物可接受率和生物利用度
Fig.2 In vitro bioacceptability and bioavailability of polyphenols contents of different polyphenols with various polities
注: 字母A~D表示不同多酚的生物可接受率差异显著(P<0.05);字母a~c表示不同多酚的生物利用度差异显著(P<0.05)
相同质量的酚类化合物经过胃肠道消化过程后,酚类物质含量发生了显著的变化(P<0.05)。酚类含量的变化可能与所采用的体外消化测试模型有关,此模型主要涉及了参与消化的机械力(以振摇的方式实现)和化学力(体液pH值、消化酶类),并未涉及到微生物在肠道中对食物消化吸收的影响,因此,此模型检测的数据不能完全预测多酚在人体吸收的程度。此外,酚类化合物经过口腔、胃消化和小肠消化3个阶段后,受到酸(pH 1.5的胃液)、碱(pH 7.4的NaHCO3小肠液)的水解作用和酶(淀粉酶、胃蛋白酶、胰蛋白酶)的作用,结构会发生变化,如图3所示。鼠尾草酸是亲脂性较强的酚酸类化合物,经过消化过程后,在色谱图上产生了2个明显的主峰,说明有部分鼠尾草酸结构发生了变化,其他4种多酚的色谱图也有类似变化。从多酚含量的生物可接受率看,芦丁的多酚生物可接受率>1,这可能是由于芦丁在水相中溶解度很小,经过胃肠消化阶段后,溶解度增加所致;其余4种多酚生物可接受率均<1,说明经过胃肠消化后,多酚因酸和酶的水解作用含量下降,BOHN等的研究结果也证实了这一点[23]。鼠尾草酸和绿原酸的多酚生物可接受率指数较高,这说明胃肠道消化液对绿原酸和鼠尾草酸的影响小,而对EGCG、槲皮素和芦丁的影响比较显著(P<0.05),在胃肠道环境中,酚酸类化合物的结构比黄酮类化合物的结构更稳定。李俶等研究了7 种多酚单体在消化过程中的稳定性[24],发现单个酚酸类成分受胃液pH的影响较小,而类黄酮成分在胃液中则发生降解;酚类化合物在肠道的碱性环境中可以水解[25],黄酮类结构相比酚酸类结构对胃肠道消化液的pH值更敏感,大部分多酚成分在肠液中不稳定。在小肠消化阶段,胰蛋白酶、胆汁盐、脂肪酶、淀粉酶等使黄酮类非极性多酚形成水溶性的混合胶束[23],这个可能是导致多酚的生物可接受率较低的原因。在pH 1.5、5.8条件下,5种多酚单体的lgP在[-1, 2],具有较好的亲水亲油性,可以穿过胃肠道黏膜跨膜转运;在模拟肠道环境(pH 7.8)中,鼠尾草酸、槲皮素和芦丁的lgP为[-1,2],具有良好的亲水亲油性,但EGCG和绿原酸的lgP<-1,亲水性较强,不能跨肠道黏膜转运而进入到血液中这也是其生物可利用度低的主要原因。研究表明口服茶多酚中,不超过5%能进入小鼠的体循环,大约1.68%消化的茶多酚中只有0.16%能进入到血液中,1.1%出现在尿液中,0.42%出现在粪便中[26]。槲皮素一般以糖苷键的形式与糖相连而存在,分子的大小和极性导致其很难穿过肠膜,标准的槲皮素分子在小肠的吸收度大约为24%[27],这与本实验的研究结果(槲皮素的多酚生物利用度约21%)非常接近,但BISCHOFF报道65%~81%的槲皮素能穿过小肠上皮细胞进入肝脏并被进一步代谢利用[28],其生物利用度远高于本实验结果。绿原酸的亲水性较强,穿透小肠黏膜进入血液的能力也较弱,因此,其生物利用度也较低,但王晓梅等也证实绿原酸可以很好地穿透胃、小肠和大肠均能吸收,且在胃和小肠中可以原结构吸收进入血液[29]。绿原酸在pH 1.5、pH 5.8条件下,-1

图3 不同多酚体外模拟消化后HPLC的变化
Fig.3 Changes of different polyphenols in high performance liquid chromatography after in vitro digestion
2.4 多酚抗氧化活性的生物可接受率和生物利用度
多酚的抗氧化活性是其引起消费者关注的重要因素之一,多酚经过消化系统后结构发生变化,多酚含量下降,检测抗氧化活性的变化是必要的。如图4所示,鼠尾草酸、槲皮素、芦丁、EGCG和绿原酸5种多酚的抗氧化性生物可接受率指数分别为0.17±0.00、0.31±0.01、0.14±0.00、1.77±0.03、2.18±0.00,多酚的抗氧化性生物可接受率指数差异显著(P<0.05),且绿原酸和EGCG的抗氧化性生物可接受率>1,这可能与其所含酚羟基基团数量有关,这与图1多酚对DPPH自由基清除能力和亚铁离子还原能力的结果相一致,此外,也可能与其在肠液环境中具有较强的亲水性有关(如表1数据所示),如EGCG在碱性条件下可以生成黄烷-3-醇二聚体和醌类二聚体,绿原酸(5-O-咖啡酰奎宁酸)可能转变成其同分异构体3-或4-O-咖啡酰奎宁酸[30],具有较强的抗氧化性,因此EGCG和绿原酸抗氧化性生物可接受率较高。
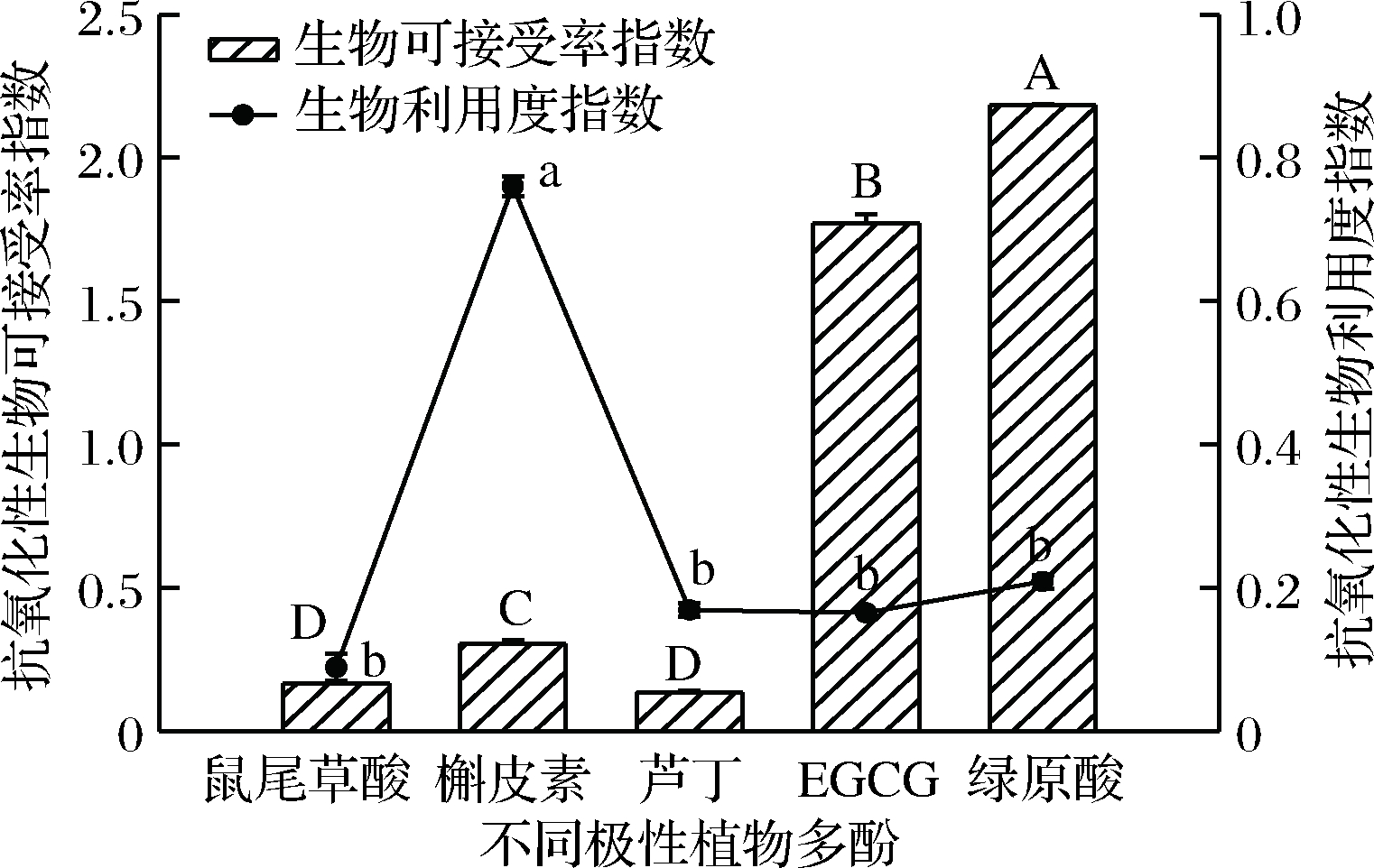
图4 不同多酚体外模拟抗氧化性的生物可接受率和生物利用度
Fig.4 In vitro bioacceptability and bioavailability of antioxidant activity of different polyphenols with various polities
注:字母A~D表示抗氧化性生物可接受率差异显著(P<0.05);字母a~c表示抗氧化性生物利用度差异显著(P<0.05)
抗氧化性生物利用度指数分别为0.09±0.01、0.76±0.01、0.16±0.01、0.17±0.01、0.21±0.03,多酚的抗氧化性生物利用度的大小顺序为槲皮素>绿原酸>EGCG>芦丁>鼠尾草酸。槲皮素的抗氧化性生物利用度显著高于其他多酚(P<0.05),这可能与槲皮素具有较高的多酚生物可接受率指数和多酚生物利用度指数有关,槲皮素可能经过胃肠消化体系后,因结构未受影响而以原结构吸收,所以其保留了很强的抗氧化性。EGCG虽然具有较高的抗氧化性生物可接受率指数,但其抗氧化性生物利用度很低,这与EGCG亲水性较强而不能穿过渗透膜有关。芦丁在体内主要为酯水解的Ⅰ相代谢,其利用率会降低;槲皮素在体内为Ⅱ相代谢,槲皮素经Ⅱ相代谢后以槲皮素或其他化合物而被肠道重吸收[31],因此其利用率和抗氧化性会高于芦丁。
通过模拟体外消化系统,可以从理论上推断5种多酚化合物的生物利用程度,但多酚化合物在肠道中还会受微生物作用而发生降解作用,如槲皮素会被产气荚膜梭菌(C. perfringens)和脆弱类杆菌(B. fragilis)、大肠杆菌(E. coli)等菌属降解[32];绿原酸经口摄入后可以到达结肠,并被细菌酯酶代谢生成咖啡酸和阿魏酸,二氢咖啡酸和二氢叶酸是其在血浆中和尿液中的主要代谢产物,且绿原酸在人体中的生物利用度主要取决于结肠中的微生物菌群对其转化程度[33]。EGCG进入肠道后,先被肠道微生物迟缓埃格特菌(Eggerthella lenta)分解生成1-(3,4-二羟苯基)-3-(2,4,6-三羟苯基)丙烷-2-醇,再被普氏梭杆菌(Flavonifractor plautii)分解生成5-(3,4-二羟基苯基)-γ-戊内酯和4-羟基-5-(3,4-羟苯基)戊酸,并表现出强抗氧化性。槲皮素可被肠道微生物分解为高藜芦酸、3-(3-羟苯基)丙酸、3,4-二羟基苯甲酸和4-羟基苯甲酸[34]。
3 结论
绿原酸、芦丁、鼠尾草酸、EGCG、槲皮素5种多酚广泛分布于植物食品原料中。在pH 1.5和pH 5.8条件下,绿原酸、芦丁、EGCG的-1
[1] PADE L, DASGUPTA T, D'MELLO P M.Evaluation of the effect of polarity of plant polyphenols and reaction conditions on formation of suppamolecular lipid complex by sophisticatied chromatographic method[J]. World Journal of Pharmacy And Pharmaceutical Science, 2017, 6(12): 1 074-1 088.
[2] SHIVASHANKARA K S, ACHARYA S N. Bioavailability of dietary polyphenols and the cardiovascular diseases[J].The Open Nutraceuticals Journal, 2010, 3: 227-241.
[3] WANG Sunan, MELNYK J P, TSAO R, et al. How natural dietary antioxidants in fruits, vegetables and legumes promote vascular health[J]. Food Research International, 2011, 44(1): 14-22.
[4] DUPAS C, BAGLIERI M, ORDONAUD C, et al. Chlorogenic acid is poorly absorbed, independently of the food matrix: A Caco-2 cells and rat chronic absorption study[J]. Molecular Nutrition & Food Research, 2006, 50, 1 053-1 060.
[5] 米楠,苏慕君,臧可昕. 阿齐沙坦油水分配系数的测定[J]. 药物评价研究, 2013,36(6): 452-454.
[6] 钟玲, 臧志和, 鲁朝江. 芦丁的溶解度及油水分配系数研究[J]. 中国药业, 2009, 18(19): 10-12.
[7] 刘蔓, 李辉, 丁劲松. 黄癸素平衡溶解度和表观油水分配系数的测定[J]. 中国新药杂志, 2018, 27(2): 225-228.
[8] ROLEIRA F M F, SIQUET C, ![]() E, et al. Lipophilic phenolic antioxidants: Correlation between antioxidant profile, partition coefficients and redox properties[J]. Bioorganic & Medicinal Chemistry, 2010, 18(16): 5 816-5 825.
E, et al. Lipophilic phenolic antioxidants: Correlation between antioxidant profile, partition coefficients and redox properties[J]. Bioorganic & Medicinal Chemistry, 2010, 18(16): 5 816-5 825.
[9] 赖珺, 廖正根, 杨明福, 等. 生物利用度的研究进展[J].中国实验方剂学杂志, 2010, 16(18): 226-229.
[10] 周笑犁, 吴珊珊, 林栋,等. 体外模拟消化对蓝莓皮渣粗提物抗氧化成分及其活性的影响[J]. 食品研究与开发,2018, 39(4): 26-32.
![]() M, GAWLIK-DZIKI U, DZIKI D, et al. Wheat bread enriched with green coffee-In vitro bioaccessibility and bioavailability of phenolics and antioxidant activity[J]. Food Chemistry, 2017, 221: 1 451-1 457.
M, GAWLIK-DZIKI U, DZIKI D, et al. Wheat bread enriched with green coffee-In vitro bioaccessibility and bioavailability of phenolics and antioxidant activity[J]. Food Chemistry, 2017, 221: 1 451-1 457.
[12] 赵旭,李佳,高树成,等. 体外模拟消化对发芽糙米多酚及抗氧化活性的影响研究[J]. 粮食加工, 2018,43(5)5: 42-46.
[13] 施洋,孙芸,谢莉,等. 石榴皮中活性成分鞣花酸的平衡溶解度与油水分配系数的测定[J]. 新疆医科大学学报,2016, 39(2):145-148.
[14] MANOHAR C M, XUE J, MURAYYAN A, et al. Antioxidant activity of polyphenols from ontario grown onion varieties using pressurized low polarity water technology[J]. Journal of Functional Foods, 2017 31: 52-62.
[15] 赵文思,李茜倩.FRAP法测定大枣枣皮红色素的总抗氧化能力[J].郑州大学学报,2011,32(3):28-30.
[16] KABAK B, OZBEY F.Assessment of the bioaccessibility of aflatoxins from various food matrices using an in vitro digestion model, and the efficacy of probiotic bacteria in reducing bioaccessibility[J]. Journal of Food Composition and Analysis, 2012, 27(1): 21-31.
[17] DRESSMAN J B, AMIDON G L, REPPAS C, et al. Dissolution testing as a prognostic tool for oral drug absorption: Immediate release dosage forms [J]. Pharm Res, 1998, 15(1): 11-22.
[18] CHEN Guanlin, CHEN Songgen, ZHAO Yingying, et al. Total phenolic contents of 33 fruits and their antioxidant capacities before and after in vitro digestion[J]. Industrial Crops and Products, 2014, 57:150-157.
[19] 张慧杰,王萌,陈丽娜,等. 12 种黄酮化合物油水分配系数的测定[J]. 中成药, 2016, 38(8): 1 708-1 711.
[20] ZENG Liang, MA Mengjun, LI Chen, et al. Stability of tea polyphenols solution with different pH at different temperatures[J]. International Journal of Food Properties, 2016, 20(1): 1-18.
[21] 闫明,韦迎春,孟瑾,等. pH对热毒宁栓中绿原酸、栀子苷体外直肠渗透性的影响[J]. 中国中药杂志,2015,40(8):149 3-1 496.
[22] SINGH B N, SHANKAR S, SRIVASTAVA R K. Green tea catechin, epigallocatechin-3-gallate (EGCG): Mechanisms, perspectives and clinical applications[J]. Biochemical Pharmacology, 2011, 82: 1 807-1 821.
[23] BOHN T. Dietary factors affecting polyphenol bioavailability[J].Nutrition Reviews,2014,72(7):429-452.
[24] 李俶, 王谢祎, 翟宇鑫, 等. 多酚化合物体外模拟消化的稳定性分析[J]. 食品科学, 2016, 37(13): 1-5.
[25] CELEP, CHAREHSAZ M, AKYÜZ Z S, et al. Effect of in vitro gastrointestinal digestion on the bioavailability of phenolic components and the antioxidant potentials of some Turkish fruit wines[J]. Food Research International, 2015,78: 209-215.
[26] CAI Zhuoyu, LI Xumin, LIANG Jinpei, et al. Bioavailability of tea catechins and its improvement[J]. Molecules,2018, 23, 2 309-2 346.
[27] KASIKCI M B, BAGDATLIOGLU N. Bioavailability of Quercetin[J]. Current Research in Nutrition and Food Science, 2016, 4(2): 146-151.
[28] BISCHOFF S C, Quercetin: Potentials in the prevention and therapy of disease[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2008, 11 (6): 733-740.
[29] 王晓梅, 奚宇, 范新光, 等. 绿原酸的生物利用率和抗氧化活性研究进展中国食品学报,2019, 19(1): 271-279.
[30] 朱鹏, 苗潇磊, 陈勇. 绿原酸、隐绿原酸和新绿原酸在中性和碱性pH条件下的降解动力学[J]. 药学学报,2016, 51(1): 122-126.
[31] 闫海霞. 鼠尾草酸在大鼠体内的药物动力学及代谢研究[D]. 沈阳:沈阳药科大学,2008.
[32] ZHANG Zhichao, PENG Xichun, LI Shaoting, et al. Isolation and identification of quercetin degrading bacteria from human fecal microbes[J]. PLOS ONE, 2014,9(3): e90 531.
[33] LUDWIG I A, PAZ DE PEA M, CONCEPCIN C, et al. Catabolism of coffee chlorogenic acids by human colonic microbiota[J]. Biofactors, 2013,39(6): 623-632.
[34] ROSARIA S, ANDREA S, CESARE M. Ginsenosides, catechins, quercetin and gut microbiota: Current evidence of challenging interactions[J]. Food & Chemical Toxicology, 2019,123:42-49.