黑枸杞属于茄科枸杞属,是一种著名的药用浆果[1]。主要分布于中国西北部、高加索和中亚地区[2]。研究表明,黑枸杞富含花青素、黄酮类化合物、多糖、蛋白质、不饱和脂肪、氨基酸、必需元素和酚类等[3]。其中,花青素具有多种药理活性,包括抗辐射[1]、抗氧化[4]、抗炎[5]、降血脂[6]以及预防老年痴呆和治疗神经紊乱[7]等。黑枸杞花青素是一种很有前景的天然色素,可作为功能性食品成分和营养补充剂。但是黑枸杞花青素性质不稳定,容易降解,这限制了其在食品工业中的应用。
微胶囊化是一种将活性成分包埋在壁材内形成微胶囊的技术。微胶囊的壁材选择是微胶囊制备的关键一步,它决定了微胶囊的品质和性能。天然生物聚合物,包括淀粉、蛋白类和天然树胶是可食用的,作为微胶囊壁材也是安全的。麦芽糊精、阿拉伯树胶和明胶等,已成功地用作包埋花青素提取物的壁材[8]。麦芽糊精是一种具有溶解度高、黏度低、成膜能力强和干燥性能好等优点的水解淀粉。阿拉伯树胶是一种具有成膜能力和乳化性能的水胶体,常用来克服黏性问题,并通过包埋技术来保护敏感成分不被氧化。明胶是一种具有良好兼容性、易溶于水和易成膜等优点的水解蛋白。DAS等[7]通过改性糯米淀粉,获得了一种新型壁材,显著提高了紫米花青素的稳定性。研究发现改性糯米淀粉对花青素的包埋效果极佳。
黑枸杞花青素微胶囊技术大多采用单一的壁材包埋,很少使用复合壁材,也仅仅是通过包埋率来筛选微胶囊壁材,而没有考虑到微胶囊的稳定性和缓释特性。喷雾干燥法包埋花青素是一种较优的技术,能保护酚类化合物不被热降解。本文采用喷雾干燥法制备微胶囊,通过包埋率、稳定性、外观形貌和释放特性,研究不同壁材对喷雾干燥制得的黑枸杞花青素微胶囊的影响,从糯米淀粉(rice starch,RS)、改性糯米淀粉(modified rice starch,MRS)、改性淀粉复合麦芽糊精(modified rice starch-maltodextrin,MRS-MD)、改性淀粉复合明胶(modified rice starch-gelatin,MRS-GL)、改性淀粉复合阿拉伯树胶(modified rice starch-gum arabic,MRS-GA)中筛选出适合黑枸杞花青素的微胶囊壁材,旨在通过微胶囊技术稳定黑枸杞花青素,将其更好地应用于食品中。
1 材料与方法
1.1 试剂与材料
黑枸杞花青素,秦仁堂;糯米淀粉,重庆沁心食品有限公司;麦芽糊精,重庆佰研生物科技有限公司;明胶,成都市科龙化工试剂厂;阿拉伯胶,重庆奥怡生物技术有限公司;无水乙醇、HCl、K2S2O5、NaCl、KCl、NaHCO3、NaH2PO4、CaCl2、KH2PO4、NH4Cl、MgCl2,均为分析纯,重庆钛新化工有限公司;α-淀粉酶(酶活力≥4 000 U/g),成都好校友生物科技有限公司;胃蛋白酶(酶活力≥250 000 U/g),重庆九德生物科技有限公司;胰蛋白酶(酶活力≥250 000 U/g),上海颖心实验室设备有限公司。
1.2 仪器与设备
GP-P2000 喷雾干燥仪,上海顾信生物科技有限公司;721G 紫外分光光度计,上海仪电分析仪器有限公司;KQ5200DE 超声波清洗器,昆山市超声仪器有限公司;Bante210 pH计,上海般特仪器制造有限公司。
1.3 试验方法
1.3.1 黑枸杞花青素微胶囊制备
以RS、MRS、MRS-MD、MRS-GL、MRS-GA为壁材,其中复合壁材的比例为5∶1、4∶1、3∶1、2∶1、1∶1、1∶2、1∶3、1∶4、1∶5[m(改性淀粉):m(其他壁材)],以黑枸杞花青素为芯材,制备5种不同壁材的花青素微胶囊。将黑枸杞花青素用蒸馏水溶解,配制成质量浓度为10 g/L芯材溶液。将芯材溶液分别与不同壁材混合[m(花青素)∶m(壁材)=1∶20],直至最终固形物含量达到10%,搅拌至所有材料完全溶解。然后将混合液以6%的泵速、160 ℃的出口温度进行喷雾干燥,即得黑枸杞花青素微胶囊[9]。将微胶囊粉末在室温下避光干燥保存,以备进一步实验。
1.3.2 包埋率测定
采用MAHDAVI等[10]描述的方法测定微胶囊的包封效率,包埋率的计算方法见公式(1):
包埋率![]()
(1)
式中:TAC,总花青素含量(1 mL蒸馏水加到100 mg样品中,研碎,加入10 mL乙醇,超声提取5 min。20 ℃,5 000 r/min离心3 min,上清液用0.45 μm滤膜过滤测花青素),mg/g;SAC,表面花青素含量(100 mg样品,加入10 mL乙醇漩涡10 s。20 ℃,5 000 r/min离心3 min,上清液用0.45 μm滤膜过滤测花青素),mg/g。
以包埋率为指标找出3种复合壁材的最优配比,然后用最优配比制备出的微胶囊进行后续试验。
1.3.3 稳定性试验
1.3.3.1 储存动力学
5 mg黑枸杞花青素溶于10 mL 40%(体积分数)的乙醇溶液。将5种不同壁材的微胶囊(含等量的黑枸杞花青素)也溶于10 mL 40%的乙醇溶液。然后将上述溶液置于15 mL的透明玻璃瓶中。为了评价黑枸杞花青素在不同条件下的稳定性,将上述玻璃瓶分别置于黑色盒子(避光条件),常温正常照度条件培养箱(正常条件)和紫外光照条件。每星期测定1次,共测定6个星期。所有样品溶液pH均为3,储存温度均为25 ℃。为了快速测量花青素降解情况,用紫外可见分光光度计测量储存周期内的520 nm处的吸光值。采用相对花青素浓度进行评价,计算如公式(2)所示:
(2)
式中:Ct,某测量时间的相对花青素浓度;A(t0),初始时间花青素在520 nm处的吸光值;A(t),某测量时间花青素在520 nm处的吸光值。
分别利用零级(Ct=C0-kt)、一级(lnCt=lnC0-kt)和二级(1/Ct=1/C0+kt)动力学模型对相对花青素浓度进行拟合。求出系数k,算出动力学方程模型。研究不同壁材对花青素降解规律的影响。
1.3.3.2 储存期间总花青素含量、褐化指数和聚合色素的变化
参考DORRIS等[11]的方法,总花青素含量采用示差法测量。褐化指数(browning index,BI,常用A520 nm/A420 nm表示)是一种测定富含花青素植物天然颜色质量的指标。聚合色素比例(percent polymeric color,PPC)采用重亚硫酸盐漂白法进行测定。取0.2 mL的2% K2S2O5添加到3 mL的花青素溶液中,然后用紫外可见分光光度计进行测定。采用公式(3)~公式(5)计算颜色密度、聚合颜色和PPC值:
颜色密度=[(A520 nm-A700 nm)+(A420 nm-A700 nm)]×DF
(3)
聚合颜色![]()
(4)
(5)
式中:A,漂白前的样品吸光度;A′,漂白后的样品吸光度;DF,稀释倍数,10。
1.3.4 微胶囊形貌
在10 kV能量下,采用扫描电镜对黑枸杞花青素微胶囊粉末进行形态研究[10]。将粉末样品均匀洒在粘有导电胶带的样品底座上,在真空条件下涂覆一层薄金,以放大倍数2 000×和10 000×来观察其微观结构形貌。
1.3.5 体外消化试验
1.3.5.1 消化液的制备
体外消化模型采用胃液和肠液模拟胃肠道消化情况。消化液的制备参考HUR等[12]的方法,无机盐、酸、酶等配方详见表1。消化液的pH用1 mol/L的HCl或1 mol/L的NaOH 进行调节。具体的消化顺序为:(1)向60 mL胃液模拟溶液中分别加入15 mg黑枸杞花青素和微胶囊(含等量的黑枸杞花青素),混合2 h; (2)加入60 mL肠液模拟肠道环境,并混合4 h。上述混合条件为:样品于300 mL三角瓶中以150 r/min的转速在37 ℃下消化。模拟胃液消化时,每隔0、10、20、30、60、120 min收集10 mL消化液;模拟肠道消化时,每隔0、10、20、30、60、90、120、180、240 min收集10 mL消化液。5 000 r/min离心10 min,过滤后滤液于-20 ℃冰箱保存以便后续分析。
表1 消化系统液成分配制
Table 1 Digestion system liquid composition preparation
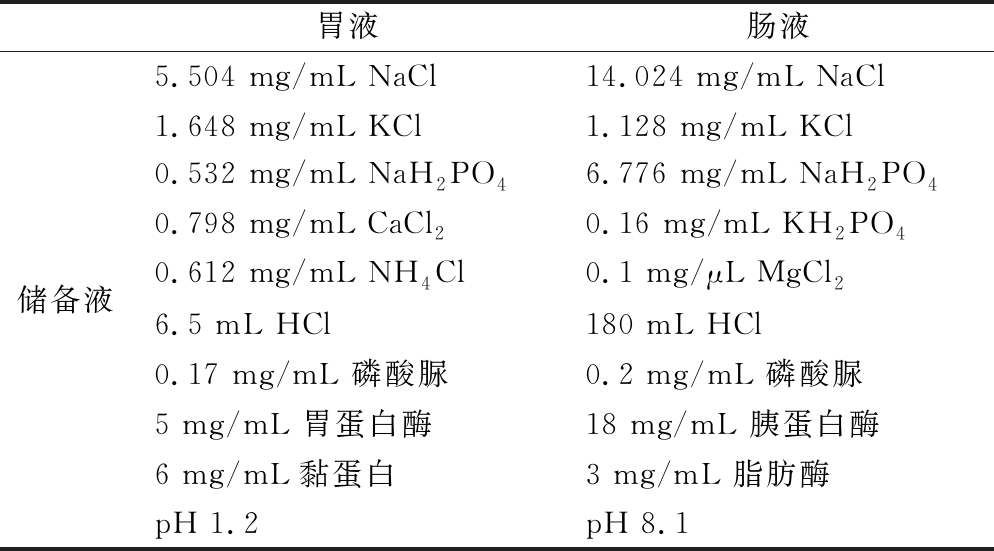
胃液肠液储备液5.504 mg/mL NaCl14.024 mg/mL NaCl1.648 mg/mL KCl1.128 mg/mL KCl0.532 mg/mL NaH2PO46.776 mg/mL NaH2PO40.798 mg/mL CaCl20.16 mg/mL KH2PO40.612 mg/mL NH4Cl0.1 mg/μL MgCl26.5 mL HCl180 mL HCl0.17 mg/mL 磷酸脲0.2 mg/mL 磷酸脲5 mg/mL 胃蛋白酶18 mg/mL 胰蛋白酶6 mg/mL黏蛋白3 mg/mL 脂肪酶pH 1.2pH 8.1
1.3.5.2 微胶囊释放特性
冻存的消化液在室温下解冻,然后5 000 r/min离心5 min,分析上清液花青素含量。根据公式(6)计算花青素残存率:
花青素残存率![]()
(6)
式中:Ar(t0),初始消化时间的花青素含量,mg/L; Ar(t),某消化时间的花青素含量,mg/L。
2 结果与分析
2.1 黑枸杞花色苷微胶囊包埋效率
以RS为壁材的花青素微胶囊包埋效率为(70.8±0.21)%,以MRS为壁材的花青素微胶囊包埋率为(78.9±0.53)%。表2为混合壁材的不同配比对微胶囊包埋率的影响,当m(MRS)∶m(MD)为1∶4时,复合壁材MRS-MD的包埋率最高(79.7±0.39)%;当m(MRS)∶m(GL)为2∶1时,复合壁材MRS-GL的包埋率较高(83.7±0.19)%;当m(MRS)∶m(GA)为3∶1时,复合壁材MRS-GA的包埋率为(82.2±0.57)%。所以从中选取复合壁材的适宜配比:m(MRS)∶m(MD)为1∶4、m(MRS)∶m(GL)为2∶1、m(MRS)∶m(GA)为3∶1,并与单一壁材RS、MRS通过后续试验研究不同壁材对黑枸杞花青素微胶囊的影响。5种不同壁材的微胶囊的包埋效率从大到小排序为MRS-GLa、MRS-GAb、MRS-MDc、MRSc、RSd。与天然淀粉相比,改性淀粉具有较好的溶解性和较低的黏度,可提高微胶囊的包埋效率[7]。以改性淀粉复合明胶为壁材制备出的微胶囊包埋率最高。这可能是因为,以单一淀粉为壁材来包埋花青素会缺乏一定的界面特性,所以通常会与其他的壁材(蛋白质或树胶)结合使用[13-14]。明胶是蛋白类物质,阿拉伯树胶是由糖蛋白和多糖组成。明胶或阿拉伯树胶与改性淀粉结合可提高微胶囊的包埋效率。这与SUN等[15]和RAJABI等[16]报道的结果相似。因此包埋效率与壁材的种类有一定的相关性。不同的壁材具有不同物理性能(例如成膜性及乳化性),这些物理性能会影响包埋黑枸杞花青素的效率。
表2 不同比例壁材的微胶囊包埋效率 单位:%
Table 2 Microencapsulation efficiency of different proportions of wall materials
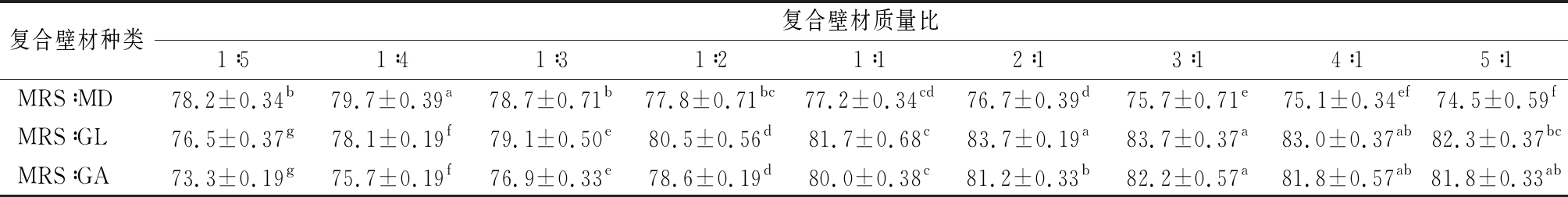
注:同一行小写字母表示显著差异(P<0.05)
复合壁材种类复合壁材质量比1∶51∶41∶31∶21∶12∶13∶14∶15∶1MRS∶MD78.2±0.34b79.7±0.39a78.7±0.71b77.8±0.71bc77.2±0.34cd76.7±0.39d75.7±0.71e75.1±0.34ef74.5±0.59fMRS∶GL76.5±0.37g78.1±0.19f79.1±0.50e80.5±0.56d81.7±0.68c83.7±0.19a83.7±0.37a83.0±0.37ab82.3±0.37bcMRS∶GA73.3±0.19g75.7±0.19f76.9±0.33e78.6±0.19d80.0±0.38c81.2±0.33b82.2±0.57a81.8±0.57ab81.8±0.33ab
2.2 稳定性分析
2.2.1 花色苷微胶囊储存期降解动力学分析
未包埋的黑枸杞花青素(LRA)以及微胶囊在紫外加速条件、避光条件和正常条件下存储了6个星期,随着存储时间的延长花青素含量均逐渐降解[17]。在本实验中使用一种快速简便的方法测量花青素的相对含量。花青素相对含量不仅与总花青素有关,也受花青素降解产物影响[18]。通过3种动力学模型(零级、一级、二级动力学)拟合可得出不同贮存条件下花青素的降解规律,降解动力学模型拟合结果见表3。通过拟合方程的回归系数R2可知,二级动力学模型拟合出的方程回归系数要大于零级和一级动力学模型,表明二级动力学模型更能反映出花青素的降解规律。测量的数据很好的拟合了二级动力学方程,这与GHIDOUCHE等[19]的研究结果也是相一致的。
表3 花青素微胶囊在不同条件下的降解动力学级数
Table 3 Degradation kinetics of anthocyanins under different conditions

Ct=C0-ktlnCt=lnC0-kt1/Ct=1/C0+ktLRA(a)Ct=1.0-0.111tlnCt=-0.161t1/Ct=1.0+0.230tR2=0.863R2=0.964R2=0.994LRA(b)Ct=1.0-0.057tlnCt=-0.067t1/Ct=1.0+0.079tR2=0.969R2=0.982R2=0.984LRA(c)Ct=1.0-0.076tlnCt= -0.097t1/Ct=1.0+0.122tR2=0.897R2=0.956R2=0.985MRS-GL(a)Ct=1.0-0.030tlnCt=-0.037t1/Ct=1.0+0.040tR2=0.994R2=0.998R2=0.998MRS-GL(b)Ct=1.0-0.027tlnCt=-0.028t1/Ct=1.0+0.030tR2=0.959R2=0.970R2=0.979MRS-GL(c)Ct=1.0-0.028tlnCt=-0.031t1/Ct=1.0+0.033tR2=0.975R2=0.980R2=0.982MRS(a)Ct=1.0-0.059tlnCt=-0.070t1/Ct=1.0+0.083tR2=0.949R2=0.972R2=0.982MRS(b)Ct=1.0-0.037tlnCt=-0.041t1/Ct=1.0+0.045tR2=0.989R2=0.996R2=0.997
在所有储存条件下,花青素均随时间的延长而发生降解。降解速率(k)是由拟合的线性方程的斜率所确定的。通过比较不同储存条件下的降解速率,发现正常条件以及紫外加速条件下的降解速率均大于避光条件。由此可知,正常光线以及紫外加速条件会对花青素的稳定性产生极大影响,这可能是因为环境因素破坏了花青素分子的骨架结构。目前,有众多研究报道了微胶囊壁材对花青素降解的影响。通过降解速率(k)可知,在同一储存条件下,花青素的稳定性也会受到微胶囊壁材的影响,其中未包埋的花青素与5种微胶囊的降解速率从小到大顺序为MRS-GL、MRS-GA、MRS-MD、MRS、RS、LRA,降解速率越小稳定性越高。综上所述,以改性淀粉-明胶为壁材制备的微胶囊具备最好的稳定性。通过结合包埋率与稳定性的结果,分析可知,微胶囊的包埋效率与稳定性具有极大的相关性。微胶囊的包埋效率越高,贮藏稳定性越好,这与LI等[20]的研究结果一致。与未包埋的黑枸杞花青素相比,微胶囊化后可显著增加花青素的稳定性。这些结果表明,黑枸杞花青素经过包封剂包埋之后可有效阻隔环境因素的不利影响。5种微胶囊和未包埋的黑枸杞花青素的降解速率不同,说明不同壁材对花青素的保护作用也不同。这些与CALVO等[13]的研究结果类似。
续表3

注:a,紫外加速条件;b,避光放置;c,正常条件
Ct=C0-ktlnCt=lnC0-kt1/Ct=1/C0+ktMRS(c)Ct=1.0-0.041tlnCt=-0.046t1/Ct=1.0+0.052tR2=0.976R2=0.986R2=0.989MRS-GA(a)Ct=1.0-0.040tlnCt=-0.045t1/Ct=1.0+0.050tR2=0.964R2=0.972R2=0.975MRS-GA(b)Ct=1.0-0.030tlnCt=-0.032t1/Ct=1.0+0.035tR2=0.991R2=0.993R2=0.993MRS-GA(c)Ct=1.0-0.031tlnCt=-0.033t1/Ct=1.0+0.037tR2=0.980R2=0.988R2=0.993MRS-MD(a)Ct=1.0-0.056tlnCt=-0.066t1/Ct=1.0+0.077tR2=0.975R2=0.992R2=0.997MRS-MD(b)Ct=1.0-0.033tlnCt=-0.037t1/Ct=1.0+0.040tR2=0.962R2=0.969R2=0.972MRS-MD(c)Ct=1.0-0.037tlnCt=-0.041t1/Ct=1.0+0.045tR2=0.974R2=0.984R2=0.989RS(a)Ct=1.0-0.079tlnCt=-0.100t1/Ct=1.0+0.126tR2=0.933R2=0.973R2=0.987RS(b)Ct=1.0-0.045tlnCt=-0.051t1/Ct=1.0+0.057tR2=0.972R2=0.981R2=0.984RS(c)Ct=1.0-0.047tlnCt=-0.053t1/Ct=1.0+0.061tR2=0.943R2=0.966R2=0.980
2.2.2 总花青素含量变化
为了进一步研究花青素在储存期间的稳定性,本试验测定了花青素含量的变化情况。总花青素含量在3种贮存条件下的变化情况如图1所示。3种储存条件中,避光条件下总花青素含量变化最小。与黑枸杞花青素微胶囊相比,未包埋的黑枸杞总花青素含量显著降低。贮藏6个星期后,未包埋的黑枸杞花青素在紫外条件、避光条件和正常条件下的花青素含量为20.04、40.86、33.90 mg/L,分别降解了68.56%、35.90%和46.81%。总花青素含量的变化也受到壁材的影响,其中用MRS-GL和MRS-GA包埋的花青素微胶囊的总花青素含量降低较慢,且与其他壁材包埋的花青素微胶囊和未包埋的花青素中总花青素含量变化具有显著差别(P<0.05)。其中,用MRS-GL为壁材包埋的花青素微胶囊的总花青素含量在紫外条件、避光条件和正常条件下分别只降解了28.35%、17.85%、18.64%。由图1可知,改性淀粉与明胶混合后对花青素具有较好的保护性能。这可能是因明胶结构中疏水性氨基酸残基(例如脯氨酸、羟脯氨酸和丙氨酸)的存在,可减少空气中的水分以及热对花青素的影响[21]。同时明胶具有较高的机械强度、较强的热稳定性和较优的阻隔水的能力[22]。
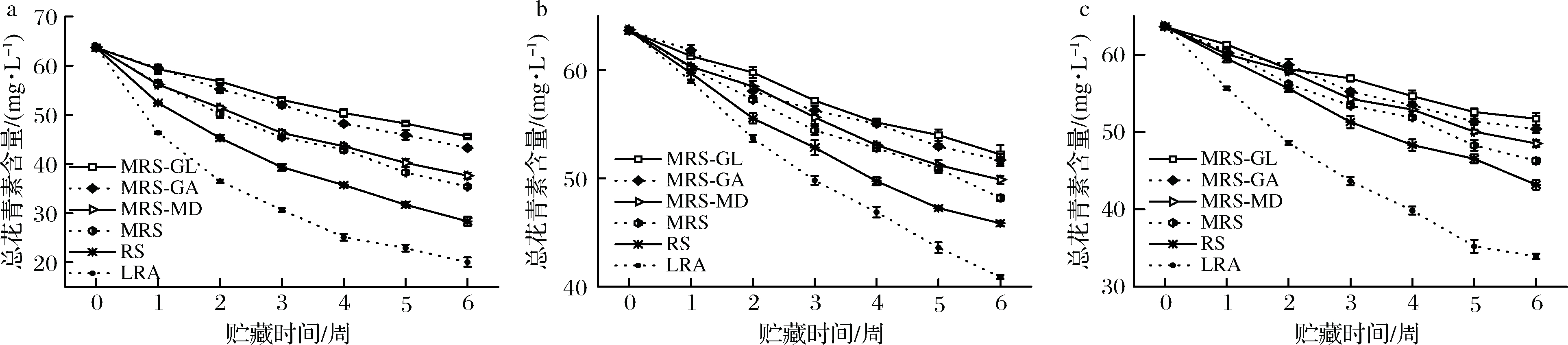
a-紫外条件;b-避光条件;c-正常条件图1 不同贮存条件下总花青素含量的变化情况
Fig.1 Changes in total anthocyanin content under different storage conditions
2.2.3 聚合色素与褐化指数分析
聚合色素与褐化指数也是评价花青素稳定性的两项重要指标。图2和图3为储存条件、时间和壁材的不同对上述两项指标的影响。由图2可知,PPC随着时间的延长而增加。PPC的增加可能是因储存期间花色苷分子间的相互作用形成了聚合物。聚合色素的形成在整个花青素溶液的褪色过程中起着重要作用。此外,与微胶囊相比,未包埋花青素的PPC增加显著。如正常条件下,未包埋黑枸杞花青素的PPC增加到了62.95%,这明显高于以MRS-GL为壁材制备的花青素微胶囊(P<0.05)。
由图3可知,BI随着时间的延长而逐渐降低,这与WROLSTAD等[18]的研究结果相似。BI在紫外条件均比避光条件和正常条件下降低的速率快,且用MRS-GL、MRS-GA、MRS-MD、MRS、RS包埋的花青素微胶囊BI值均比未包埋花青素BI值降低的慢(P<0.05)。这些结果均说明微胶囊可有效保护花青素,防止降解,且MRS-GL与MRS-GA表现了最佳的保护性能。
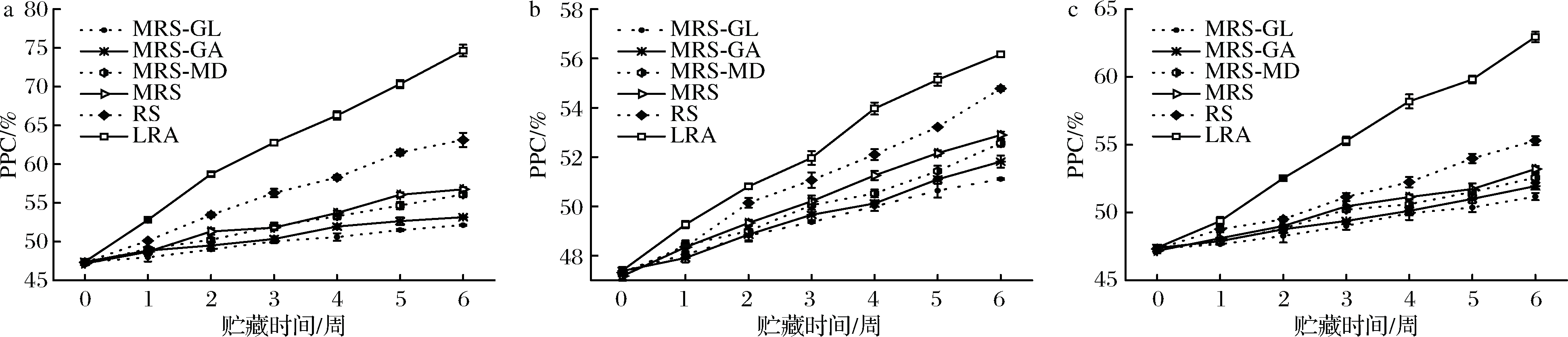
a-紫外条件;b-避光条件;c-正常条件图2 不同贮存条件下PPC的变化情况
Fig.2 Changes in PPC under different storage conditions
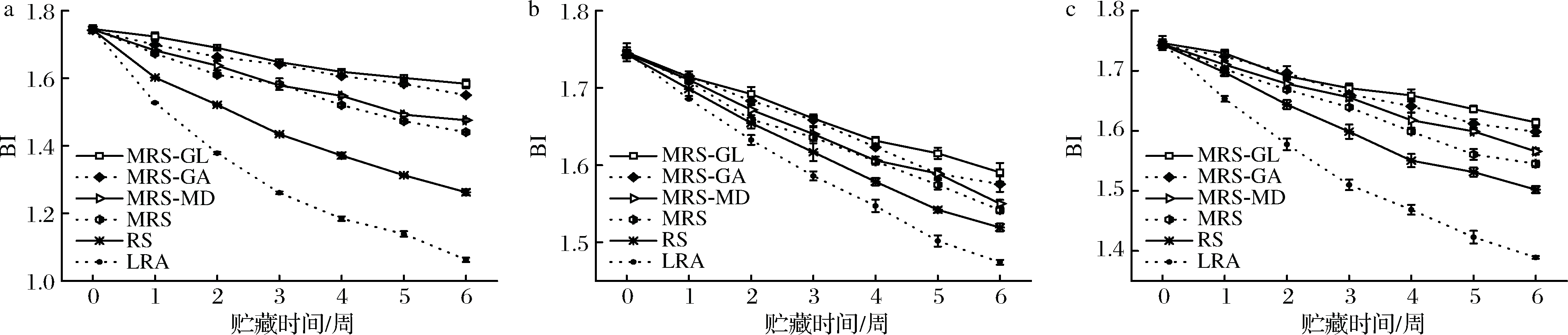
a-紫外条件;b-避光条件;c-正常条件图3 不同贮存条件下BI的变化情况
Fig.3 Changes in BI under different storage conditions
图4是BI、相对花青素浓度和总花青素含量相关关系的三维散点图。在储存过程中,BI随着储存时间的延长而不断下降,同时相对花青素浓度和总花青素含量也不断降低。BI与相对花青素浓度、总花青素含量成正比。图5是PPC、相对花青素浓度和总花青素含量相关关系的三维散点图。在储存过程中,PPC随着储存时间的延长而不断上升,相对花青素浓度和总花青素含量不断降低。PPC与相对花青素浓度、总花青素含量成反比。这些研究结果表明,PPC和BI与花青素具有密切相关性,可作为评价花青素稳定性的重要指标。
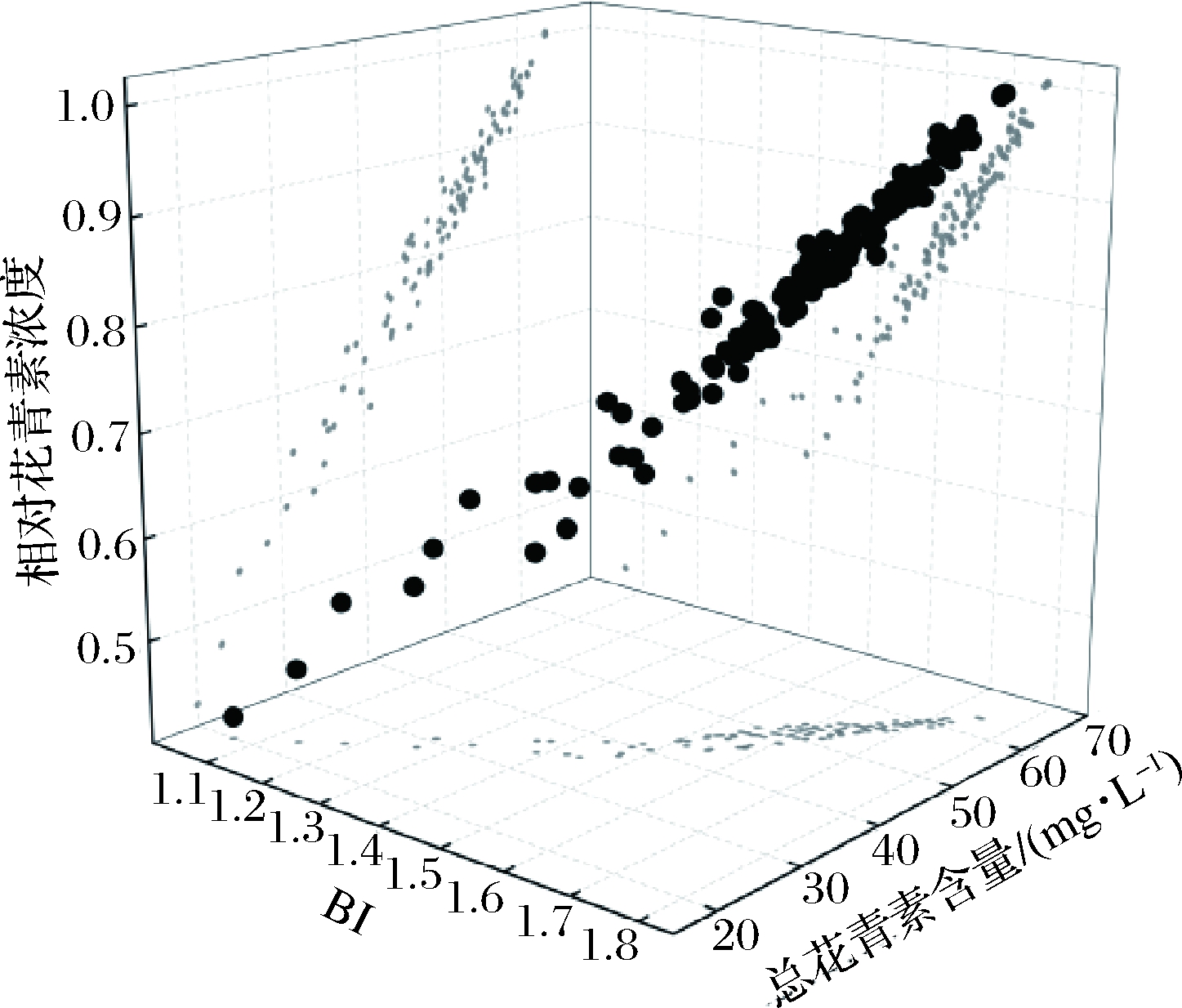
图4 BI、相对花青素浓度和花青素含量相关关系的三维散点图
Fig.4 Three-dimensional scatter plot of the relationship between BI, relative anthocyanin concentration and anthocyanin content
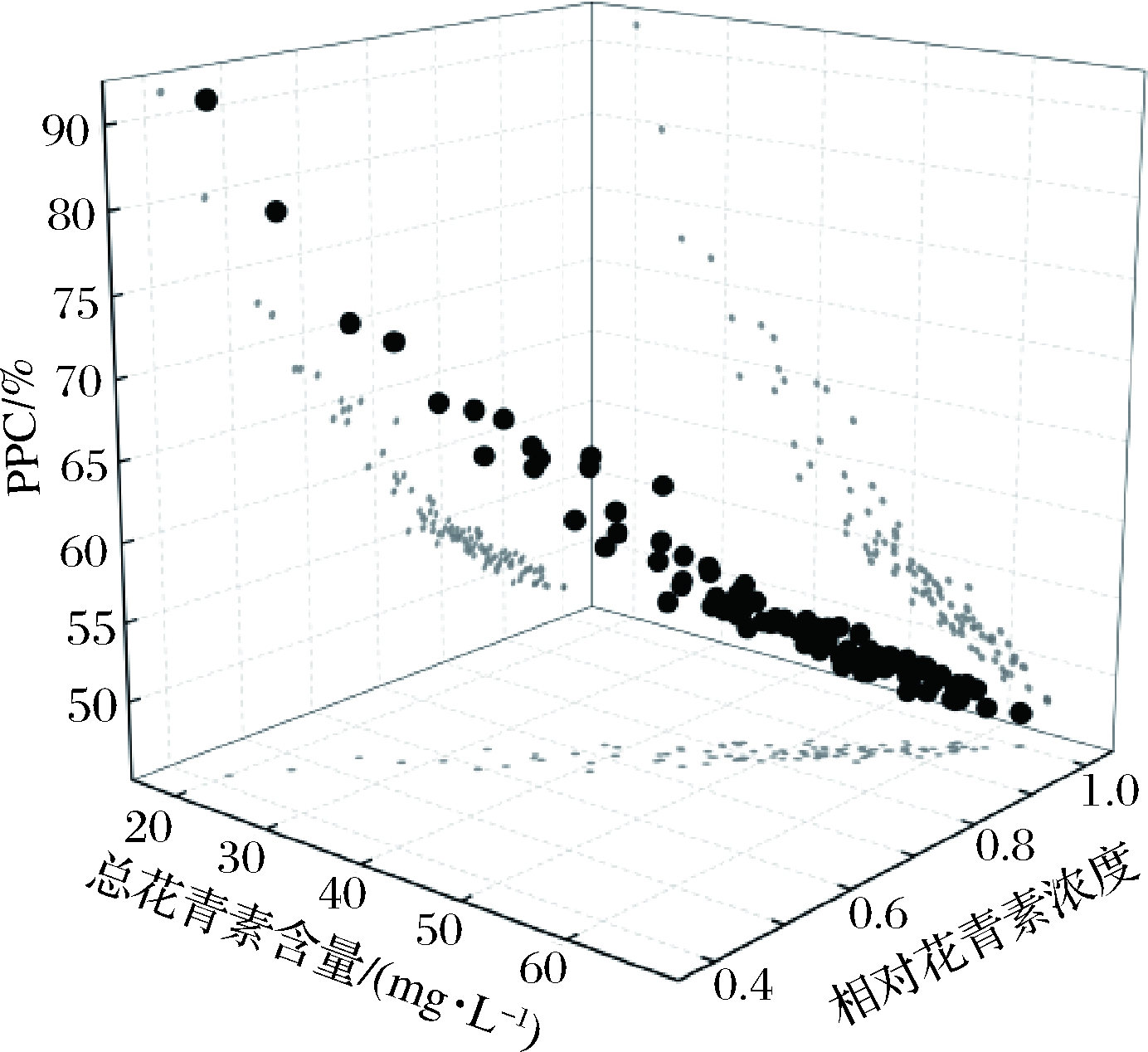
图5 PPC、相对花青素浓度和花青素含量相关关系的三维散点图
Fig.5 Three-dimensional scatter plot of PPC, relative anthocyanin concentration and anthocyanin content
2.3 微胶囊形貌
花青素是亲水性着色剂,特别适合与果胶、树胶等水基凝胶复配或与麦芽糊精、淀粉等极性固体基质相结合[10]。由图6可知,以RS和MRS为壁材的微胶囊均呈现为棱角分明的多边体,大小分布较均匀,其中RS微胶囊颗粒之间易发生团聚。而以MRS-MD、MRS-GL、MRS-GA为壁材的部分微胶囊为光滑的圆球形,大小分布不均一,基本无团聚。部分颗粒表面发生皱缩,这可能是因为喷雾干燥过程中水分迅速蒸发,微胶囊膨胀,失水太快导致壁材不均匀收缩,麦芽糊精极易溶于水,在壁材表面形成许多小孔,水分通过这些孔道蒸发出来,从而使微胶囊表面凹陷形成糟皱。花青素微胶囊基本无破损孔洞。结合前面的结果可知,微胶囊的外观形貌、微胶囊包埋率和颗粒稳定性,这三者之间具有相关性。微胶囊表面越圆润和光滑,则包埋效率越高、贮藏稳定性也越好。颗粒表面越光滑,外界环境条件对黑枸杞花青素的降解影响就越小。这与TOLUN等[23]的观察结果相似。

图6 黑枸杞花色苷微胶囊形貌
Fig.6 Morphology of anthocyanin microcapsules
2.4 花青素微胶囊的释放特性
经过唾液消化后,微胶囊在模拟胃肠道释放过程中可分为2个阶段,即胃部阶段和肠道阶段。由图7可知,花青素微胶囊的释放具有相似的特点。在模拟胃部条件下,前30 min内缓慢释放,然后趋于平稳。黑枸杞花青素在pH 1.2的环境中几乎没有降解发生。可能是由于胃液的强酸性,花青素可稳定地以2-苯基苯并吡喃阳离子形式存在,且释放的花青素始终保持较高稳定性。而当花青素到达pH 8.1肠道时,由于pH迅速上升至中性,花青素分子转化为醌式结构、半缩酮和查儿酮等形式,稳定性显著下降。转移至肠道条件时,未包埋花青素在培养期间,残存率持续下降,而RS、MRS、MRS-MD、MRS-GA、MRS-GL5种壁材制备的花青素微胶囊中的花青素以及未包埋的花青素在前30 min内快速下降。2 h后MRS-MD、MRS-GA、MRS-GL、MRS、RS和未包埋的花青素残存率分别为50.3%、42.6%、41.1%、34.6%、28.5%、14.2%。MRS-MD最能提高黑枸杞花青素生物利用度,根据在肠道消化液中的稳定性从大到小排序为MRS-MDa、MRS-GAb、MRS-GLc、MRSc、RSd、LRAe。4 h后,5种微胶囊与未包埋的花青素者之间没有显著的差异(P>0.05),这可能是因为长时间的肠液消化导致微胶囊破裂,壁材的保护作用降低,花青素降解速率加快。以单一的天然淀粉或改性淀粉制备的微胶囊表面的花青素含量较高,易受消化液的影响而发生降解。当改性淀粉与麦芽糊精复合使用后,花青素在胃肠道消化中的生物利用度最好。改性淀粉与麦芽糊精可以在被包裹的花青素周围形成致密层,减少其在胃肠道模拟液中降解。虽然明胶与改性淀粉也可在花青素周围形成一层致密层,但是明胶是蛋白类物质,胃和肠道模拟液中含有胃蛋白酶和胰蛋白酶。在消化过程中明胶易受蛋白酶的作用而分解并形成裂缝和孔洞,造成消化液进入微胶囊内腔,失去壁材对花青素的保护作用。这些与SUN等报告的结果相似[15]。总体来说,当花青素荷载到壁材颗粒上后,稳定性得到提高,增加了其在肠道上的吸收浓度和时间,能够更好地保证其在人体内的吸收利用。
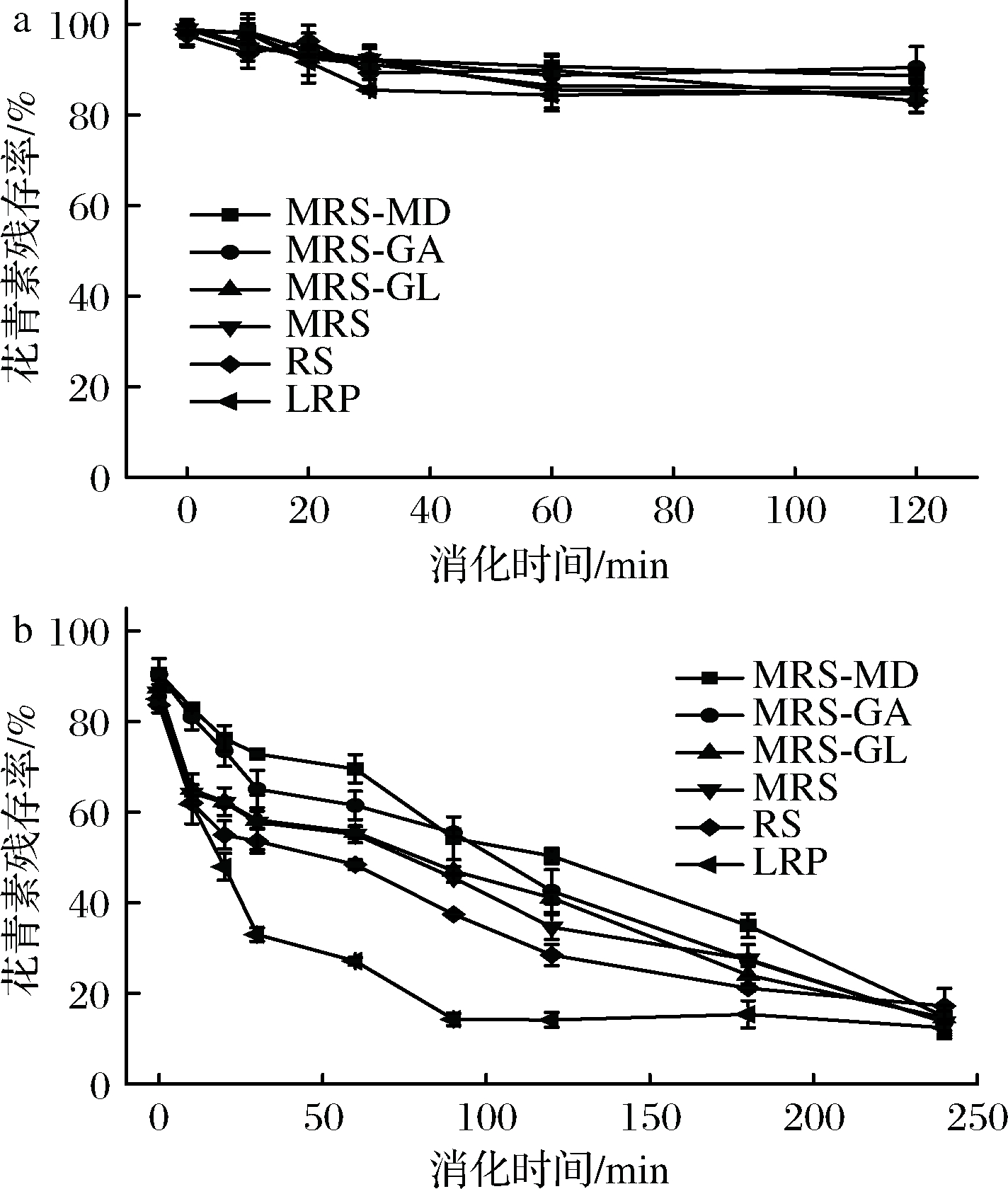
a-胃消化;b-肠道消化图7 模拟胃肠道消化条件下花青素的残存率
Fig.7 shows the residual rate of anthocyanins under gastrointestinal digestive conditions
3 结论
以黑枸杞花青素为芯材,RS、MRS、MRS-GL、MRS-GA、MRS-MD为壁材,利用喷雾干燥法制备了5种微胶囊。总体来说,不同壁材会显著影响微胶囊的包埋效率、贮藏稳定性、外观形貌及缓释特性。其中利用MRS-GL的复合壁材制备黑枸杞花青素微胶囊的包埋效果最好,包埋率高达83.7%。根据降解动力学模拟试验,二级动力学能较好地模拟花青素的降解过程。其中,MRS-GL和MRS-GA制备的微胶囊显著提高了黑枸杞花青素的稳定性,对其起到了较好的保护作用。此外,储藏过程中花青素含量、相对花青素浓度和PPC、BI之间呈现较好的相关关系。MRS-GL、MRS-GA、MRS-MD为壁材的部分微胶囊呈现为光滑的圆球形,大小分布不均一,基本无团聚。5种微胶囊和未包埋的黑枸杞花青素经过胃消化花青素含量趋于平稳,基本未降解;而经过肠道消化后,由于消化液偏碱性,花青素残存率逐渐降低。微胶囊化后,可显著提高黑枸杞花青素在肠道中的生物利用度,其中MRS-MD包埋的微胶囊花青素残存率降低的最慢。对于黑枸杞花青素,这项研究可能会提供适合黑枸杞花青素微胶囊化的壁材信息,为其微胶囊化及在食品工业中的应用提供一定参考。
[1] DUAN Y, CHEN F, YAO X, et al. Protective effect of lycium ruthenicum murr. against radiation injury in mice[J]. International Journal of Environmental Research and Public Health, 2015, 12(7): 8 332-8 347.
[2] LIU Z, SHU Q, WANG L, et al. Genetic diversity of the endangered and medically important Lycium ruthenicum Murr. revealed by sequence-related amplified polymorphism (SRAP) markers [J]. Biochemical Systematics and Ecology, 2012, 45:86-97.
[3] ZHANG G, CHEN S, ZHOU W, et al. Rapid qualitative and quantitative analyses of eighteen phenolic compounds from Lycium ruthenicum Murray by UPLC-Q-Orbitrap MS and their antioxidant activity [J]. Food Chemistry, 2018, 269:150-156.
[4] WU T, LYU H, WANG F, et al. Characterization of Polyphenols from Lycium ruthenicum fruit by UPLC-Q-TOF/MSE and their antioxidant activity in Caco-2 cells[J]. Journal of Agricultural and Food Chemistry, 2016, 64(11): 2 280-2 288.
[5] PENG Q, LIU H, SHI S, et al. Lycium ruthenicum polysaccharide attenuates inflammation through inhibiting TLR4/NF-B-kappa signaling pathway[J]. International Journal of Biological Macromolecules, 2014, 67:330-335.
[6] LIN J, ZHANG Y, WANG X, et al. Lycium ruthenicum extract alleviates high-fat diet-induced nonalcoholic fatty liver disease via enhancing the AMPK signaling pathway [J]. Molecular Medicine Reports, 2015, 12(3): 3 835-3 840.
[7] DAS A B, GOUD V V, DAS C. Microencapsulation of anthocyanin extract from purple rice bran using modified rice starch and its effect on rice dough rheology [J]. International Journal of Biological Macromolecules, 2019, 124:573-581.
[8] GOMES ROCHA J D C, RIBEIRO DE BARROS F A, PERRONE I T, et al. Microencapsulation by atomization of the mixture of phenolic extracts [J]. Powder Technology, 2019, 343:317-325.
[9] NORKAEW O, THITISUT P, MAHATHEERANONT S, et al. Effect of wall materials on some physicochemical properties and release characteristics of encapsulated black rice anthocyanin microcapsules [J]. Food Chemistry, 2019, 294:493-502.
[10] MAHDAVI S A, JAFARI S M, ASSADPOOR E, et al. Microencapsulation optimization of natural anthocyanins with maltodextrin, gum Arabic and gelatin[J]. International Journal of Biological Macromolecules, 2016, 85:379-385.
[11] DORRIS M R, VOSS D M, BOLLOM M A, et al. Browning Index of anthocyanin-rich fruit juice depends on pH and anthocyanin loss more than the gain of soluble polymeric pigments[J]. Journal of Food Science, 2018, 83(4): 911-921.
[12] HUR S J, DECKER E A, MCCLEMENTS D J. Influence of initial emulsifier type on microstructural changes occurring in emulsified lipids during in vitro digestion[J]. Food Chemistry, 2009, 114(1): 253-262.
[13] CALVO P,HERNANDEZ T,LOZANO M,et al.Microencapsulation of extra-virgin olive oil by spray-drying: Influence of wall material and olive quality[J].European Journal of Lipid Science and Technology,2010,112(8):852-858.
[14] GHARSALLAOUI A,ROUDAUT G,CHAMBIN O,et al.Applications of spray-drying in microencapsulation of food ingredients: An overview[J].Food Research International,2007,40(9):1 107-1 121.
[15] SUN X,XU Y,ZHAO L,et al.The stability and bioaccessibility of fucoxanthin in spray-dried microcapsules based on various biopolymers[J].Rsc Advances,2018,8(61):35 139-35 149.
[16] RAJABI H,GHORBANI M,JAFARI S M,et al.Retention of saffron bioactive components by spray drying encapsulation using maltodextrin, gum Arabic and gelatin as wall materials[J].Food Hydrocolloids,2015,51:327-337.
[17] MARISA RIBEIRO A, ESTEVINHO B N, ROCHA F. Spray drying encapsulation of elderberry extract and evaluating the release and stability of phenolic compounds in encapsulated powders[J].Food and Bioprocess Technology,2019,12(8):1 381-1 394.
[18] WROLSTAD R E, DURST R W, LEE J. Tracking color and pigment changes in anthocyanin products[J]. Trends in Food Science & Technology, 2005, 16(9): 423-428.
[19] GHIDOUCHE S, REY B, MICHEL M, et al. A Rapid tool for the stability assessment of natural food colours [J]. Food Chemistry, 2013, 139(1-4): 978-985.
[20] LI Y,WU L,WENG M,et al.Effect of different encapsulating agent combinations on physicochemical properties and stability of microcapsules loaded with phenolics of plum (Prunus salicina lindl.)[J]. Powder Technology,2018,340:459-464.
[21] ARSLAN S,ERBAS M,TONTUL I,et al.Microencapsulation of probiotic Saccharomyces cerevisiae var. boulardii with different wall materials by spray drying[J].LWT-Food Science and Technology,2015,63(1): 685-690.
[22] GOMEZ G M, GIMENEZ B,LOPEZ-CABALLERO M E,et al.Functional and bioactive properties of collagen and gelatin from alternative sources: A review[J].Food Hydrocolloids,2011,25(8):1 813-1 827.
[23] TOLUN A,ALTINTAS Z,ARTIK N.Microencapsulation of grape polyphenols using maltodextrin and gum arabic as two alternative coating materials: Development and characterization[J].Journal of Biotechnology,2016,239:23-33.