随着社会的不断发展,消费者对饮食的要求不断在改变,低脂肪高蛋白的肉类受到许多人的青睐,消费者对鱼和鱼糜制品的需求不断增加。一些小杂鱼由于大小、风味、质地或颜色等因素未被充分利用,但是通过鱼糜技术和重组技术,这些低值鱼都可以转化为高价值产品。
鱼糜是把鱼肉切碎后连续洗涤而获得的浓缩的肌原纤维蛋白。在这一系列过程中,鱼肉中的肌浆蛋白和脂肪、色素以及一些不受欢迎的气味物质会被去除。但是,某些鱼类制作成的鱼糜,特别是一些小杂鱼混合制作成的鱼糜,它们的凝胶性能通常比较差。卡拉胶是从某些种类的红海藻中提取获得的天然多糖,它们主要以3种形式存在:κ-卡拉胶、ι-卡拉胶和λ-卡拉胶。其中,κ-卡拉胶主要通过从热带海藻——长心卡帕藻中提取而获得。因为κ-卡拉胶具有理想的稳定、增稠等特性,近年来受到越来越多的关注,在符合使用标准的前提下被广泛应用于化妆品、食品加工和药品领域。卡拉胶是天然胶体中唯一具有蛋白质反应性的胶体,添加卡拉胶可以显著提高猪肉肌原纤维蛋白的乳化能力、凝胶硬度、弹性和保水性[1]。从天然的长心卡帕藻中提取出的κ-卡拉胶凝胶强度通常比较低,而一些阳离子,比如Ca2+、NH4+、K+等能提高κ-卡拉胶凝胶化的能力[2],形成硬且脆的凝胶,其中K+对κ-卡拉胶的影响最明显。赵春波等[3]用部分KCl代替NaCl,发现猪肉肠的保水率随着添加量的增加而增加。猪肉肌球蛋白的凝胶强度和持水性随着κ-卡拉胶/K+凝胶体系添加量的增加而提高,凝胶空间网络结构变得更加紧密并且表面粗糙程度降低[4]。随着K+添加量的增加,卡拉胶-猪肉肌原纤维蛋白混合凝胶的硬度、黏着性、弹性和黏聚性有不断减小的趋势[5]。虽然已有部分κ-卡拉胶/K+凝胶体系对肉制品影响的研究,但主要集中在猪肉和鸡肉制品中,对于鱼糜类制品的研究依然不足并且不深入。肉制品中卡拉胶的添加量通常为0.5%~1.0%[6]。尚一平[7]研究发现,添加量从0.2%开始,香肠的硬度随着添加量的增加而增大。添加量在0.2%~0.4%时,硬度的增长最快,而添加量为0.4%~0.6%时,硬度的增长稍趋平缓,但仍在上升。添加过量的卡拉胶会降低肉制品的感官品质,同时有研究表明,过量的卡拉胶对人体健康会产生影响。因此,本实验选择0.4%、0.7%、1.0%(均为质量分数)3个不同添加量,探究κ-卡拉胶/K+凝胶体系是否会对杂鱼鱼糜的凝胶强度、持水性、微观结构、蛋白质二级结构和流变等性质产生影响,从宏观和微观不同角度分析并探究其机制,从而为鱼糜类重组产品的生产加工提供理论性的指导和建议。
1 材料与方法
1.1 材料与试剂
冷冻鱼糜,2019年购于石狮正源水产科技开发有限公司;NaCl、KCl等(分析纯),上海阿拉丁生化科技股份有限公司;κ-卡拉胶,梯希爱化成工业发展有限公司。
1.2 仪器与设备
低温培养箱(LRH-100 CL),上海一恒;流变仪(MCR301),奥地利安东帕;分析天平(AL104-IC),梅特勒-托利多;电子分析天平(FA2004),南京东迈;质构仪(TA.XT Plus),英国SMS;台式高速冷冻离心机(H1850R),湘仪集团;卤素水分测定仪(HB43-S),梅特勒-托利多;傅里叶变换红外光谱仪(Nicolet iS20),赛默飞世尔;切碎机(QSJ-B02R1),小熊电器;场发射扫描电子显微镜(S-4800),日本日立。
1.3 实验方法
1.3.1 鱼糜凝胶的制备
制备鱼糜凝胶参考ZHANG等[8]的方法并进行适当修改。将冷冻鱼糜从-60 ℃冰箱转移到4 ℃低温培养箱中放置2~3 h,直到中心温度达到-5 ℃左右。将鱼糜切成小块后,放入切碎机中搅拌3 min,再与3.0% NaCl混合均匀后搅拌4 min。分别加入0.4%、0.7%和1%(均为质量分数)的κ-卡拉胶或0.4%、0.7%和1%(均为质量分数)的κ-卡拉胶+KCl[m(κ-卡拉胶):m(KCl)=10∶3]混合均匀后搅拌1 min。最后加入冰水调节最终水分含量至80 %,然后搅拌1 min。在整个搅拌的过程中,将切碎机置于碎冰中,控制温度低于10 ℃。将搅拌后的鱼糜浆装入直径为2.5 cm的离心管中,离心(4 ℃,1 000×g,3 min),去除鱼糜浆中的气泡。把离心后的鱼糜浆在90 ℃下加热30 min后放入碎冰中冷却30 min,置于4 ℃低温培养箱中保存直至测试。
1.3.2 凝胶强度测定
鱼糜凝胶的破断力(breaking force,BF)和断裂形变(breaking deformation,BD)通过质构仪进行测定,测定方法参考BENJAKUL等[9]的方法并进行适当修改。在分析前,把鱼糜凝胶切成2.5 cm直径和2.5 cm高度的圆柱体,在室温(25 ℃)下平衡30 min。将圆柱体的鱼糜凝胶放置于配备有P/5S球形探头的质构仪中,以恒定(60 mm/min)的下降速度垂直地压入凝胶样品的切割表面,下压高度为15 mm,触发力为5 g。通过力-形变曲线可以获得第1次力的峰值即为破断力,通过力-形变曲线可以获得起点和第1次力的峰值点的距离即为断裂形变BD(mm)。凝胶强度(gel strength,GS)的计算如公式(1)所示[9]:
GS/(g·mm)=BF×BD
(1)
1.3.3 持水性测定
持水性(water holding capacity,WHC)测定:将鱼糜凝胶切成5 mm左右薄片,称重(M1)后用双层滤纸包裹,离心(4 ℃,2 600×g,10 min),离心后的样品称重(M2)。持水性计算如公式(2)所示[10]:
(2)
式中:M1,样品的初始质量,g;M2,样品离心后的质量,g。
1.3.4 温度扫描测定
参考MORENO等[11]的方法作适当修改。将鱼糜浆放到配备有平行板(直径50.0 mm;间隙1.0 mm)的流变仪上来测量动态黏弹性参数,即储能模量(G′)与温度(T)的关系。用硅油覆盖样品,减少水分蒸发。温度为20~85 ℃,加热速率是1 ℃/min,频率和应变分别为0.1 Hz和1%[12]。
1.3.5 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)
使用傅里叶变换红外光谱测定κ-卡拉胶/K+凝胶体系对鱼糜蛋白的二级结构产生的变化之前,先要将鱼糜凝胶进行冷冻干燥去除水分。取1 mg冷冻干燥后的凝胶样品和100 mg KBr充分混合后研磨成非常细的粉末,然后使用压片机将其压缩成薄片。在室温为25 ℃的干燥的环境中以光谱分辨率为4 cm-1进行测试,扫描32次,波数为4 000~400 cm-1。使用PeakFit 4.12对获得的图上的曲线进行多次拟合[13]。
1.3.6 扫描电子显微镜(scanning electron microscope,SEM)
使用扫描电子显微镜对含有和不含有κ-卡拉胶/K+凝胶体系的鱼糜凝胶进行研究。在室内温度下,使用消毒过的剃须刀片将鱼糜凝胶切成2~3 mm厚度的薄片,取中间部分用2.5%(体积分数)的戊二醇在0.2 mmol/L磷酸盐缓冲液(pH 7.2)中固定3 h后,用蒸馏水将样品清洗干净。固定的鱼糜凝胶样品在25%,50%,70%,80%,90%和100%(体积分数)的乙醇中分别进行15 min脱水,对脱水后的鱼糜凝胶样品使用二氧化碳作为过渡液进行临界点干燥,把干燥好的鱼糜凝胶样品安装在青铜短管上使用金进行溅射镀膜。最后,使用加速电压为3 kV的扫描电子显微镜来分析鱼糜凝胶样品的微观结构[14]。
1.3.7 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
根据PETCHARAT等[14]和LAEMMLI[15]的方法作适当修改。分别取鱼肉和鱼糜凝胶样品3 g,切碎后加入27 mL的SDS溶液,均质1 min后85 ℃水浴加热1 h,随后3 500 ×g离心20 min。双缩脲法测定上清液的蛋白质浓度。与上样缓冲液混合后煮沸5 min,上样量为10 μL,使用4%~20%的商业预制胶进行电泳。电泳结束后将预制胶在含有0.1%考马斯亮蓝R-250的染色液中染色,脱色液脱色后照胶。
1.3.8 数据处理
使用SPSS 20.0进行统计分析,用OriginPro 8和Prism 8进行做图。
2 结果与分析
2.1 κ-卡拉胶(kappa-carrageenan,KC)/K+对鱼糜凝胶强度的影响
图1显示了κ-卡拉胶/K+凝胶体系(KC/KC+KCl)对鱼糜凝胶强度的影响。与空白组(添加量为0)样品对比,KC和KC+KCl都能较大程度地提高杂鱼鱼糜的凝胶强度且差异显著(P<0.05)。对于分别添加了KC和KC+KCl的2组鱼糜凝胶,其凝胶强度的增加表现出相同的趋势,都随着添加量的增加而增加。在同一组中,添加量为0.4%和0.7%的鱼糜凝胶强度之间差异不显著(P>0.05),但是当添加量继续增加到1%时,KC组和KC+KCl组的凝胶强度分别达到392.4 g·mm和457.3 g·mm,与空白组样品的凝胶强度(222.5 g·mm)相比差异显著(P<0.05)。通常,静电相互作用是蛋白质与阴离子多糖之间的主要相互作用[16]。κ-卡拉胶在混合凝胶体系中可能充当活性填料,填充在鱼糜凝胶的空隙中,冷却之后形成可以结合水分的凝胶片段[17-18]。在相同的添加量水平下,KC组和KC+KCl组两者之间都表现出显著的差异(P<0.05)。阳离子增强κ-卡拉胶凝胶化的能力按Li+ < Na+≤Mg2+,Ca2+ < NH4+< K+的顺序排列[2]。因此K+增强了κ-卡拉胶的凝胶化能力,形成硬且脆的凝胶,影响鱼肉蛋白的凝胶性能。从而使得在相同添加量水平下,KC+KCl组相比较KC组更能增加鱼糜凝胶的凝胶强度。所以,添加KC和KC+KCl都可以有效提高鱼糜凝胶的凝胶强度,且加入K+的KC效果更好。

图1 不同添加量的κ-卡拉胶/K+凝胶体系-鱼糜复合凝胶的凝胶强度
Fig.1 Gel strength of κ-carrageenan/K+ gel system-surimi composite gel with different addition level
注:不同字母(a~c表示KC组;u~w表示KC+KCl组;A~B表示在相同添加量的情况下KC和KC+KCl组之间的比较)代表显著性差异(P<0.05)(下同)
2.2 κ-卡拉胶/K+凝胶体系对鱼糜凝胶持水性的影响
图2显示了鱼糜凝胶持水性在添加和不添加KC/KC+KCl的情况下受到的影响。持水性是凝胶系统最重要的功能特性之一,持水性的高低与肉的味道、嫩度、颜色和肉质的其他特征密切相关。鱼糜凝胶的持水性主要由蛋白质和水之间的相互作用以及这些相互作用的数量来决定[19]。持水性越好,表示更多的水被结合或者保留在鱼糜凝胶网络中。
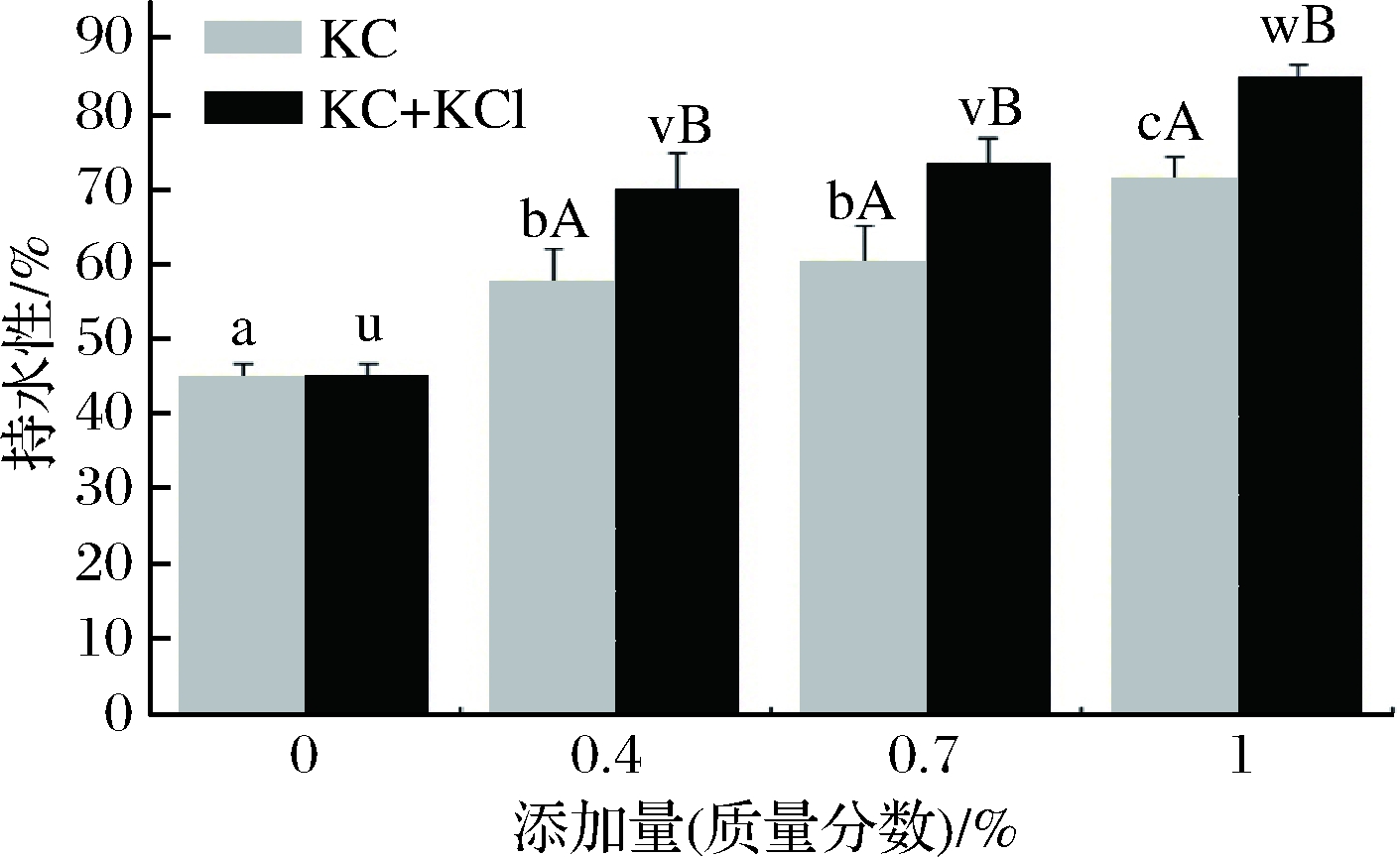
图2 不同添加量的κ-卡拉胶/K+凝胶体系-鱼糜复合凝胶的持水性
Fig.2 Water holding capacity of κ-carrageenan/ K+gel system-surimi composite gel with different addition level
添加KC和KC+KCl可以使得鱼糜凝胶的持水性得到明显的改善,并且在相同添加物的组中,持水性随着添加量的增加而上升。在添加物相同的同一组之间,添加量为0.4%和0.7%的杂鱼鱼糜凝胶持水性之间的差异不显著(P>0.05)。但是,当添加量达到1%时,添加KC和KC+KCl的鱼糜凝胶的持水性分别达到71.7%和85.1%,与对照组鱼糜凝胶的持水性相比差异显著(P<0.05)。κ-卡拉胶是亲水胶体,分子结构中有许多亲水的基团能够与水发生作用。在90 ℃高温下,κ-卡拉胶呈液体状态进入鱼糜凝胶的孔隙中发生内聚相互作用,冷却后形成的片段可以结合水分嵌入凝胶网络中。鱼糜凝胶网络对水分的保持主要取决于凝胶的强度,MAO等[20]研究发现,当鱼糕形成的凝胶网络致密时,凝胶强度会增加,此时鱼糕的持水性比较高。因此,添加适当的κ-卡拉胶在鱼糜中可以保留住更多的水分。在相同添加量水平下,KC组和KC+KCl组两者之间都表现出显著的差异(P<0.05)。K+的存在进一步加强了鱼糜和κ-卡拉胶的协同关系,使得形成的凝胶网络孔隙中嵌入更多结合了水的κ-卡拉胶凝胶片段,因此KC+KCl比KC对鱼糜凝胶持水性的提升更显著。
3.3 温度扫描分析
该实验阐明了κ-卡拉胶和κ-卡拉胶+KCl对杂鱼鱼糜凝胶形成能力的影响。储能模量(G′)通常用作凝胶形成的指标,用于研究鱼糜凝胶动态流变学特性。
含有和不含有不同添加量的KC或KC+KCl的杂鱼鱼糜的储能模量(G′)随温度的变化情况如图3所示。在升温过程中,对照组样品的G′通常由3个阶段组成,呈现出先升高后降低再升高的趋势。对于含有KC或KC+KCl的鱼糜,观察到和空白样品相似的储能模量曲线。添加了KC或KC+KCl的凝胶样品显示出比空白样品更高的G′。由于温度开始升高,20~32 ℃为凝胶预备阶段,在这个阶段中,内源性谷氨酰胺转移酶催化S1亚片段的展开和变性,导致肌球蛋白头部-头部相互作用从而形成蛋白质聚集体的早期阶段[21],表明G′的增加是因为在低温下通过氢键形成了初步的蛋白质网络结构,并且蛋白质分子之间发生了交联[22]。32~53 ℃为凝胶劣化阶段,当温度达到53 ℃时,G′达到最低点,由于内源性蛋白水解酶的作用,肌球蛋白轻链亚基解离使得鱼糜的黏性增强,从而导致G′的降低。53~90 ℃为凝胶强化阶段,此时G′再次增加,这可能是由于蛋白质分子之间的交联数量由于解离而得到增加,以及发生了变性的肌球蛋白重链和肌动球蛋白,共同导致了热不可逆的凝胶网络形成[23]。由图3可知,随着添加量的增加,同一组添加物的G′随着添加量的增加而增加,并且显著高于空白样品的G′。添加量为1%时,鱼糜的G′最大,这是因为更多的κ-卡拉胶使得凝胶网络结构更加致密,导致网络结构增强。添加量相同时,KC+KCl组的G′均高于KC组,并且初始值也都比KC组的初始值高,这是由于K+增强了κ-卡拉胶的凝胶化能力,形成硬且脆的凝胶,填充到凝胶的空隙中,从而进一步增强了鱼糜凝胶的网络结构,使得G′增加,这与先前添加KC和KC+KCl对鱼糜凝胶强度的影响结果相符合,进一步说明了KC和KC+KCl可以作为活性填料填充到凝胶的孔隙中,增加鱼糜的G′,特别是使用加入了K+的κ-卡拉胶时效果尤为明显。
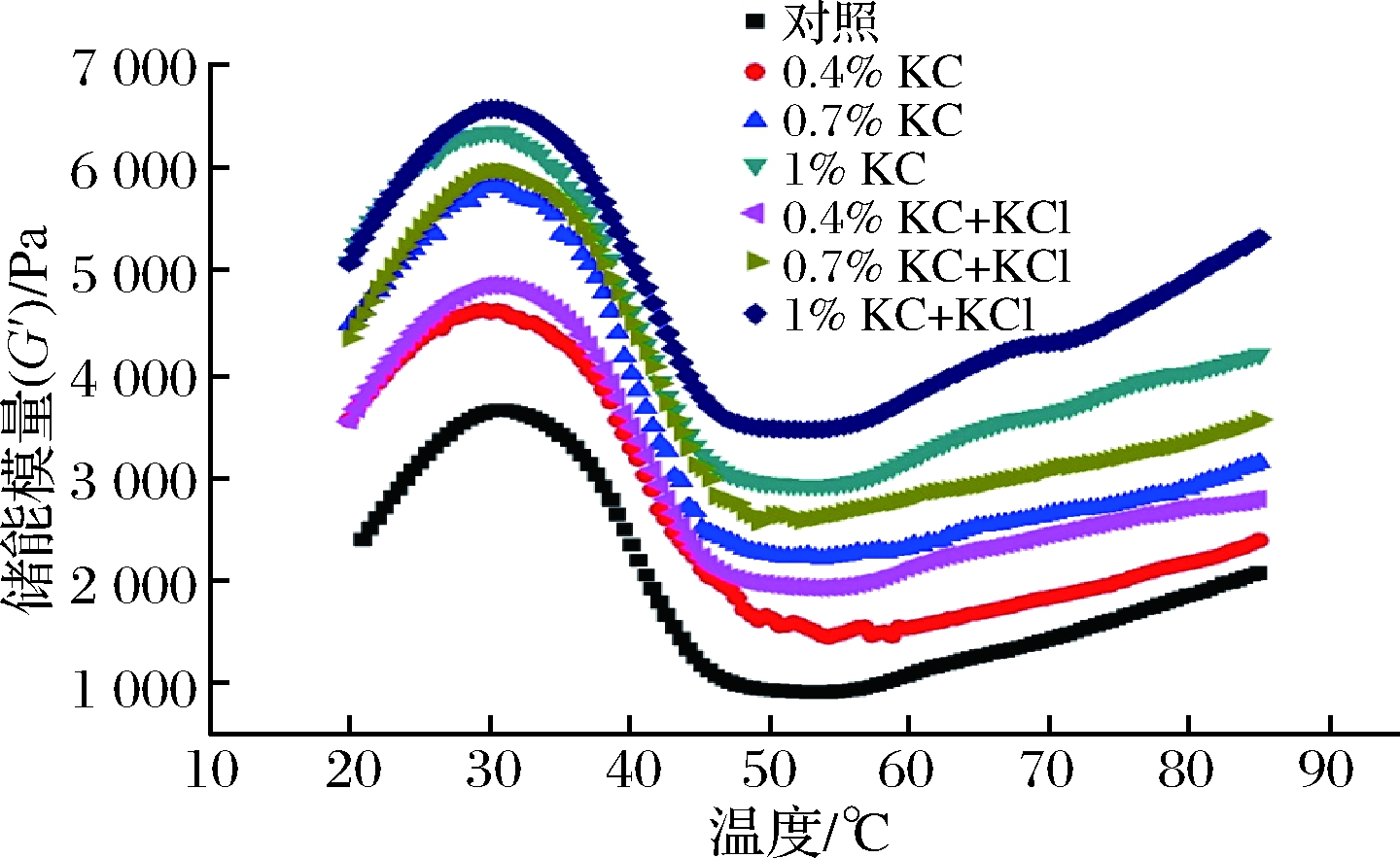
图3 温度对κ-卡拉胶/K+凝胶体系-鱼糜流变特性的影响
Fig.3 Effect of temperature on rheological properties of κ-carrageenan / K+ gel system-surimi
2.4 傅里叶变换红外光谱分析
蛋白质空间构象的基础是蛋白质的二级结构,蛋白质的功能特性的变化与二级结构的变化密不可分[24]。研究蛋白质二级结构的常用方法之一就是FTIR,蛋白质酰胺Ⅰ带(1 700~1 600 cm-1)对蛋白质二级结构的区域变化很敏感,所以具有较高的研究意义。表1是不同波数所对应的二级结构[25]。表2是根据各特征峰的面积计算出的二级结构的含量。
表1 不同波数对应的蛋白质二级结构
Table 1 Protein secondary structure at different wavelengths

波数/cm-1二级结构名称 1 600~1 640β-折叠1 640~1 650无规则卷曲1 650~1 660α-螺旋1 660~1 700β-转角
由表2可以看出,添加了κ-卡拉胶/K+凝胶体系的鱼糜蛋白二级结构含量发生了一些变化。β-折叠的含量随着添加量的增加而增加,蛋白质发生聚集并形成凝胶。α-螺旋含量的减少说明了肌球蛋白展开,疏水基团暴露,而疏水相互作用可以促进凝胶化进程,α-螺旋含量减少,鱼糜蛋白凝胶的强度增加[26]。通常,α-螺旋含量的减少会导致凝胶持水性的降低。但是,冷却后的κ-卡拉胶/K+凝胶体系成为结合水的凝胶片段嵌入蛋白质的三维网状结构中[27],导致持水性并没有因为α-螺旋含量的减少而降低,这与2.2中κ-卡拉胶/K+凝胶体系能提高鱼糜凝胶持水性的结论相符合,而结合了水的κ-卡拉胶凝胶片段的嵌入使得蛋白质的三维网状结构从无序变得有序,由表2也可以发现无规则卷曲的含量随着κ-卡拉胶/K+凝胶体系的增加而降低,说明蛋白质的三维网状结构从无序变得有序,而均匀有序的网络结构可以提高凝胶的强度。因此,κ-卡拉胶/K+凝胶体系的添加可以改变鱼糜蛋白的二级结构。添加KC+KCl比添加KC对于二级结构含量的变化的影响更大一些,一方面是因为K+可以改善κ-卡拉胶的凝胶特性,使得嵌入三维网状结构的κ-卡拉胶凝胶片段具有更高的凝胶强度,从而使得凝胶网络结构更强。另一方面可能是K+促进了加热的鱼糜蛋白发生交联,此时β-折叠的含量增加,从而使得凝胶网络更加致密,提高了凝胶网络的强度。
表2 添加和不添加κ-卡拉胶/K+凝胶体系对鱼糜蛋白二级结构含量的影响 单位:%
Table 2 Changes of secondary structure content of myofibrillar protein with and without κ-carrageenan/K+gel system

注:表中数值为平均值±标准差。不同字母代表显著性差异(P<0.05)
添加物β-折叠无规则卷曲α-螺旋β-转角空白38.63±0.25c28.37±0.30a24.73±0.45a8.27±0.12c0.4% KC39.00±0.41c26.86±0.80b24.54±0.42a9.6±0.13c0.7% KC41.75±0.09b22.60±0.34c15.24±0.55b20.41±0.92b1% KC43.76±0.36a15.34±0.71d11.83±0.48c29.07±0.92a空白38.63±0.25d28.37±0.30a24.73±0.45a8.27±0.12d0.4% KC+KCl40.39±0.90c26.34±0.46b18.92±0.85b14.35±0.90c0.7% KC+KCl41.87±0.13b21.55±0.20c12.72±0.49c23.86±0.26b1% KC+KCl43.82±0.45a13.88±0.58d11.66±0.34d30.64±0.72a
2.5 微观结构分析
扫描电子显微镜是观察蛋白质微观结构的常用手段之一。图4是添加或不添加κ-卡拉胶/K+凝胶体系的鱼糜蛋白的微观结构图。由图4可以看出,空白对照组的空间结构不完整,断裂较多孔隙较大并且表面非常粗糙;κ-卡拉胶/K+凝胶体系的添加使得鱼糜凝胶网络结构变得完整减少了断裂,蛋白质之间相互交联起来,表面变得光滑平整。随着添加量的增加,鱼糜凝胶网络结构变得均匀有序,孔隙也变得更小,鱼糜凝胶的网络结构得到加强,凝胶强度得到提升。从添加0.4% κ-卡拉胶的复合凝胶的微观结构图(图4-a)可以看出,κ-卡拉胶在冷却后形成的结合水分的片段嵌入了凝胶的网络结构中,这样既可以增强鱼糜凝胶的凝胶强度,还可以提高鱼糜凝胶的持水性。由图4-a~图4-g可以看出,当添加量相同时,κ-卡拉胶+KCl的鱼糜凝胶结构更加均匀致密,孔隙也相对较小并且分布均匀。这可能是K+使得κ-卡拉胶的凝胶能力增强后,部分κ-卡拉胶与蛋白质的交联程度进一步增强,从而形成了孔隙变小且均匀有序的三维网络结构,提高了鱼糜的凝胶强度。

a-空白对照组;b-添加0.4% κ-卡拉胶;c-添加0.4%κ-卡拉胶+KCl;d-添加0.7% κ-卡拉胶;e-添加0.7%κ-卡拉胶+KCl;f-添加1% κ-卡拉胶;g-添加1% κ-卡拉胶+KCl图4 κ-卡拉胶/K+凝胶体系-鱼糜复合凝胶的微观结构图(×5 000)
Fig.4 Microstructure of κ-carrageenan / K+ gel system-surimi composite gel(×5 000)
2.6 κ-卡拉胶凝胶体系对鱼糜蛋白的影响
κ-卡拉胶/K+凝胶体系对鱼糜蛋白聚集与降解的影响的SDS-PAGE图谱如图5所示。鱼糜凝胶的蛋白网络主要是由鱼类的肌原纤维蛋白形成,而肌原纤维蛋白容易受到温度的影响。鱼糜蛋白中主要的蛋白是肌球蛋白重链(myosin heavy chain,MHC,约200 kDa)和肌动蛋白(actin,约43 kDa)[28-29]。由图5可以看出,鱼糜浆未加热处理时,可以看到清晰的MHC条带和肌动蛋白条带。90 ℃加热30 min的样品都发生了蛋白水解,由图5可以看出强烈的蛋白水解作用,添加KC或KC+KCl的样品的MHC均消失,与空白样品结果相同。这个结果表明,蛋白质的ε-(γ-谷氨酰)赖氨酸分子之间的交联由内源性转谷氨酰胺酶诱导形成,非二硫键的共价键形成后在鱼糜中起作用,使得肌原纤维蛋白被降解[30]。此外,还可以看出肌动蛋白条带没有发生明显的变化。因此,添加κ-卡拉胶/K+凝胶体系对鱼糜凝胶的蛋白质交联没有显著影响。
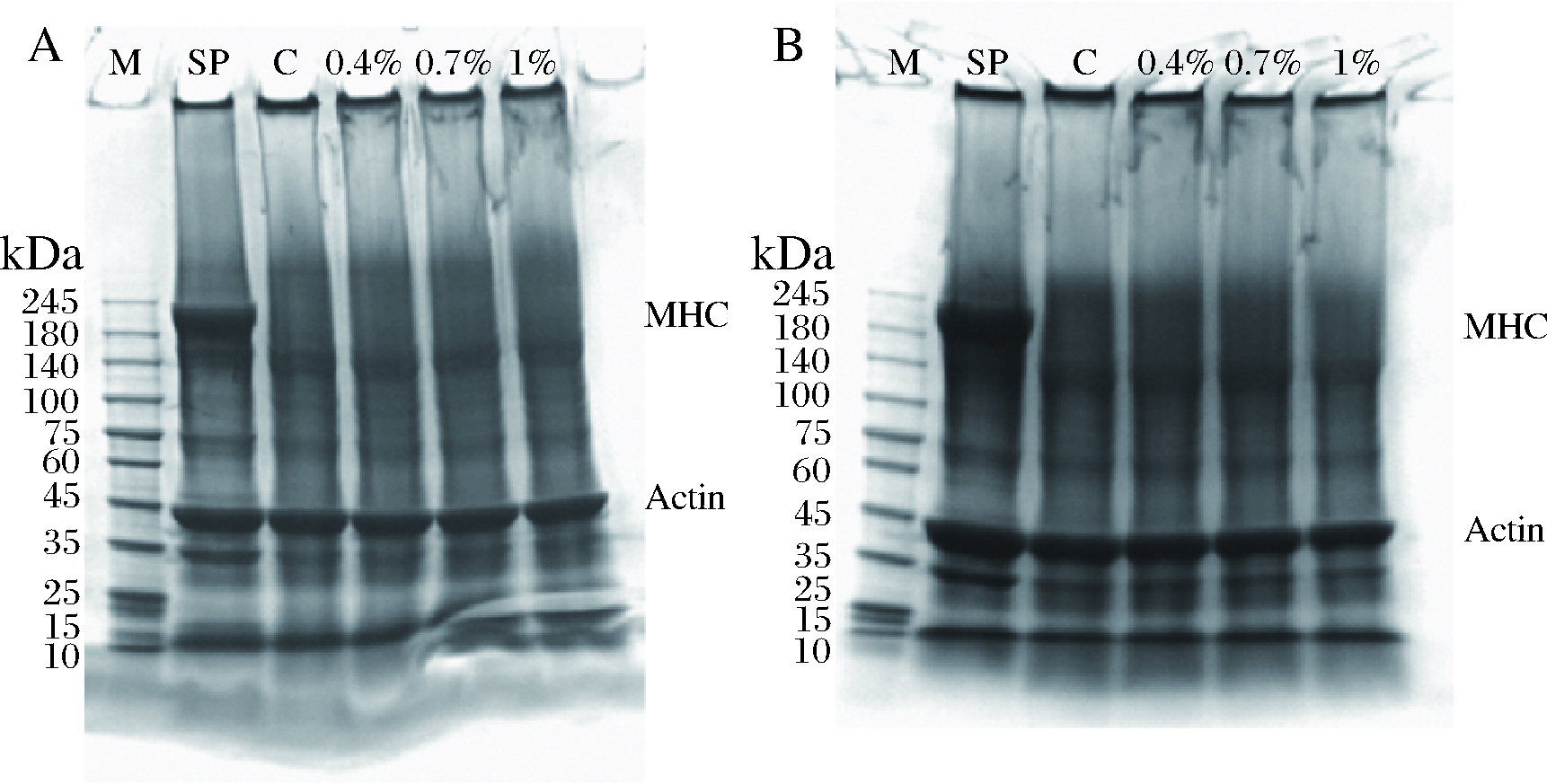
图5 κ-卡拉胶/K+凝胶体系对鱼糜蛋白质SDS-PAGE条带的影响
Fig.5 Effect of κ-carrageenan/K+ gel system on SDS-PAGE band of surimi protein
注:MHC:肌球蛋白重链;actin:肌动蛋白。M:Marker;SP:鱼糜浆;C:空白样品;0.4%~1%代表添加量;A代表添加KC;B代表添加KC+KCl
4 结论
本实验在鱼糜中加入κ-卡拉胶/K+凝胶体系,从宏观和微观不同角度去探究鱼糜凝胶特性的变化。结果表明,κ-卡拉胶/K+凝胶体系可以显著提高鱼糜凝胶的持水性、凝胶强度和鱼糜的G′。这是由于κ-卡拉胶在混合凝胶体系中可能充当活性填料,填充在鱼糜凝胶的空隙中,冷却之后形成可以结合水分的凝胶片段。添加量的增加,使得更多的κ-卡拉胶填充到鱼糜凝胶的空隙中,而且κ-卡拉胶/K+凝胶体系可能会与鱼糜中的肌原纤维蛋白发生交联从而强化了鱼糜凝胶网络。从SEM和FTIR的结果可知,κ-卡拉胶/K+凝胶体系的添加使得鱼糜蛋白的二级结构发生改变,β-折叠含量增加,α-螺旋含量降低,使得鱼糜蛋白的三维网络结构变得光滑而且均匀致密。随着κ-卡拉胶/K+凝胶体系添加量的增加,三维网络结构中嵌入更多结合水分的凝胶片段,使得凝胶网络结构得到增强。除此以外,由于卡拉胶具有蛋白质反应性,卡拉胶的强阴离子基团可以和蛋白质的极性部分发生反应,使得蛋白质和卡拉胶凝胶体系更好的结合在一起,从而提高鱼糜凝胶的持水性、凝胶强度和G′,凝胶网络结构得到增强。而添加K+可以使得影响更加显著,这是因为K+可以增强κ-卡拉胶地凝胶化能力,形成硬且脆的凝胶,影响鱼肉蛋白的凝胶性能。但是,κ-卡拉胶/K+凝胶体系对鱼肉蛋白的聚合和降解都没有显著影响。
[1] 贾娜,陈倩,韩齐,等. 食用胶对猪肉肌原纤维蛋白功能特性的影响[J]. 食品工业科技, 2013, 34(23): 282-285.
[2] ROBAL M, BRENNER T, MATSUKAWA S, et al. Monocationic salts of carrageenans: Preparation and physico-chemical properties[J]. Food Hydrocolloids, 2017, 63: 656-667.
[3] 赵春波,张秋会,马长明,等. 氯化钾替代部分食盐对猪肉乳化肠品质的影响[J]. 肉类工业, 2019(1): 15-19.
[4] 潘腾,宋君红,吴建平,等. 钾离子对肌球蛋白-κ-卡拉胶凝胶特性的影响[J]. 中国食品学报, 2017, 17(11): 44-52.
[5] 马云,董秋颖,郎正. 卡拉胶和肌原纤维蛋白混合凝胶质构特性的研究[J]. 食品研究与开发, 2010, 31(1): 42-46.
[6] 李彦涛,姜一民. 卡拉胶与肉制品[J]. 肉类工业, 2004(9): 46-47.
[7] 尚一平. 卡拉胶的性能及其在肉类工业中的应用[J]. 肉类工业, 2006 (12): 31-32.
[8] ZHANG T, XUE Y, LI Z, et al. Effects of deacetylation of konjac glucomannan on Alaska pollock surimi gels subjected to high-temperature (120 ℃) treatment[J]. Food Hydrocolloids, 2015, 43: 125-131.
[9] BENJAKUL S, VISESSANGUAN W, SRIVILAI C. Gel properties of bigeye snapper (Priacanthus tayenus) surimi as affected by setting and porcine plasma proteins[J]. Journal of Food Quality, 2001. 24: 453-471.
[10] MAJUMDAR R K, SAHA A, DHAR B, et al. Effect of garlic extract on physical, oxidative and microbial changes during refrigerated storage of restructured product from Thai pangas (Pangasianodon hypophthalmus) surimi[J]. Journal of Food Science and Technology, 2015,52(12): 7 994-8 003.
[11] MORENO H M, BARGIELA V, TOVAR C A, et al. High pressure applied to frozen flying fish (Parexocoetus brachyterus) surimi: Effect on physicochemical and rheological properties of gels[J]. Food Hydrocolloids, 2015, 48: 127-134.
[12] JI L, XUE Y, ZHANG T, et al. The effects of microwave processing on the structure and various quality parameters of Alaska pollock surimi protein-polysaccharide gels[J]. Food Hydrocolloids, 2017, 63: 77-84.
[13] LIN X, YANG W, XU D, et al. Effect of electron irradiation and heat on the structure of hairtail surimi[J]. Radiation Physics and Chemistry, 2015, 114: 50-54.
[14] PETCHARAT T, BENJAKUL S. Effect of gellan incorporation on gel properties of bigeye snapper surimi[J]. Food Hydrocolloids, 2018, 77: 746-753.
[15] LAEMMLI. Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[16] MONTEO P,HURTADO J L,PÉREZ-MATEOS M. Microstructural behaviour and gelling characteristics of myosystem protein gels interacting with hydrocolloids[J]. Food Hydrocolloids, 2000, 14(5): 455-461.
[17] 杨玉玲,周光宏,徐幸莲,等. 肌球蛋白与卡拉胶混合胶凝机理的研究[J]. 食品与发酵工业, 2006, 32(1): 6-10.
[18] VERBEKEN D, NEIRINCK N, VAN DER MEEREN P, et al. Influence of kappa-carrageenan on the thermal gelation of salt-soluble meat proteins[J]. Meat Science, 2005, 70(1): 161-166.
[19] LAKSHMANAN R, PARKINSON J A, PIGGOTT J R. High-pressure processing and water-holding capacity of fresh and cold-smoked salmon (Salmo salar)[J]. LWT- Food Science and Technology, 2007, 40(3): 544-551.
[20] MAO L, WU T. Gelling properties and lipid oxidation of kamaboko gels from grass carp (Ctenopharyngodon idellus) influenced by chitosan[J]. Journal of Food Engineering, 2007, 82(2): 128-134.
[21] JIANG J, XIONG Y L. Extreme pH treatments enhance the structure-reinforcement role of soy protein isolate and its emulsions in pork myofibrillar protein gels in the presence of microbial transglutaminase[J]. Meat Science, 2013, 93(3): 469-476.
[22] ZHANG L, XUE Y, XU J, et al. Effects of high-temperature treatment (-100 ℃) on Alaska Pollock (Theragra chalcogramma) surimi gels[J]. Journal of Food Engineering, 2013, 115(1): 115-120.
[23] CHEN H H, XU S Y, WANG Z. Interaction between flaxseed gum and meat protein[J]. Journal of Food Engineering, 2007, 80(4): 1 051-1 059.
[24] 卢雁,张玮玮,王公轲. FTIR用于变性蛋白质二级结构的研究进展[J]. 光谱学与光谱分析, 2008, (1): 88-93.
[25] ZHANG L, ZHANG F, WANG X. Changes of protein secondary structures of pollock surimi gels under high-temperature (100 ℃ and 120 ℃) treatment[J]. Journal of Food Engineering, 2016, 171: 159-163.
[26] GUO X Y, PENG Z Q, ZHANG Y W, et al. The solubility and conformational characteristics of porcine myosin as affected by the presence of L-lysine and L-histidine[J]. Food Chem, 2015, 170: 212-217.
[27] ZHAO X, HAN G, WEN R,Z et al. Influence of lard-based diacylglycerol on rheological and physicochemical properties of thermally induced gels of porcine myofibrillar protein at different NaCl concentrations[J]. Food Res Int, 2020, 127: 108 723.
[28] G MEZ-ESTACA J, MONTERO P, G
MEZ-ESTACA J, MONTERO P, G MEZ-GUILLÉN M C. Shrimp (Litopenaeus vannamei) muscle proteins as source to develop edible films[J]. Food Hydrocolloids, 2014, 41: 86-94.
MEZ-GUILLÉN M C. Shrimp (Litopenaeus vannamei) muscle proteins as source to develop edible films[J]. Food Hydrocolloids, 2014, 41: 86-94.
[29] BLANCO-PASCUAL N, FERN NDEZ-MART
NDEZ-MART N F, MONTERO M P. Effect of different protein extracts from dosidicus gigas muscle co-products on edible films development[J]. Food Hydrocolloids, 2013, 33(1): 118-131.
N F, MONTERO M P. Effect of different protein extracts from dosidicus gigas muscle co-products on edible films development[J]. Food Hydrocolloids, 2013, 33(1): 118-131.
[30] BUAMARD N, BENJAKUL S. Improvement of gel properties of sardine (Sardinella albella) surimi using coconut husk extracts[J]. Food Hydrocolloids, 2015, 51: 146-155.