果胶是存在于高等植物的原代细胞壁和中间薄片中的多糖,主要由线性骨架组成,主要成分是部分甲酯化的α-1,4-D-聚半乳糖醛酸[1-2]。降解柑橘囊衣所用到的酶有果胶酶和纤维素酶[3],聚半乳糖醛酸酶属于果胶酶的一类,聚半乳糖醛酸酶的应用十分广泛,现已应用于食品、饲料、废水处理、造纸、纺织等行业[4];在食品加工工业中,广泛应用在果蔬汁的加工、果酒酿造、去除果皮等行业[5-6]。食品加工生产过程中使用的聚半乳糖醛酸酶往往是通过微生物发酵产生的,随着果蔬行业的快速发展以及环保的推进,果蔬清洁加工领域新型酶制剂的开发成为工业发展的重点,对于任何一种酶制剂来说都需要探究酶学性质,才能发挥酶最大的使用价值。在前期的研究过程中课题组从脐橙果园土壤中筛选出了1株棘孢木霉[7-8],相关的报道也说明棘孢木霉可应用到食品领域[9-10],通过研究发现它可以产出降解柑橘囊衣的酶,因此分析该菌种可能既产聚半乳糖醛酸酶又产纤维素酶,而木霉菌产聚半乳糖醛酸酶的研究几乎没有,该菌种产聚半乳糖醛酸酶对于降解柑橘囊衣的效果显著,研究该酶的特性可以促进果蔬行业的改革,减少环境的压力,具有重要意义。
本文研究聚半乳糖醛酸酶的特性,对该酶进行部分纯化并研究其理化特性、分子质量大小以及动力学等酶学性质,以期为果蔬清洁加工领域新型酶制剂的开发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种
棘孢木霉菌(Trichoderma asperelham)(14 636),本实验室筛选保存。
1.1.2 培养基
橘粉培养基(g/L):橘皮粉9.12,NH4NO3 6.42、(NH4)2SO4 2.14、MgSO4 0.60、NaCl 1.00,KH2PO41.00,K2HPO41.00,去离子水1 000 mL[5]。
1.1.3 主要试剂
果胶,阿拉丁试剂有限公司;3,5-二硝基水杨酸,生工生物工程股份有限公司;D-半乳糖醛酸,Sigma;海藻酸钠、戊二醛、CaCl2、酒石酸钾钠等,永大化学试剂有限公司。
1.1.4 仪器与设备
UV2900紫外分光光度计,上海舜宇恒平科技仪器有限公司;EL20实验室pH计,梅特勒-托利多仪器有限公司;SB-5200超声波清洗机,宁波新芝生物科技股份有限公司;HZ85-2型磁力搅拌机,北京中兴伟业仪器有限公司。
1.2 实验方法
1.2.1 聚半乳糖醛酸酶粗酶液制备
将筛选活化的棘孢木霉于30 ℃、160 r/min的恒温振荡培养箱下培养72 h,经过3800 r/min离心20 min后过0.22 μm滤膜后得粗酶液。
1.2.2 聚半乳糖醛酸酶活性的测定
(1)酶活测定:通过二硝基水杨酸法[11-12]测定聚半乳糖醛酸酶活性。聚半乳糖醛酸酶活力计算如公式(1)所示:
酶活![]()
(1)
式中:A1,试验组 OD 值所对应标准曲线上还原糖量;A2,对照组 OD 值所对应标准曲线上还原糖量;N,酶液稀释倍数;3,测定酶活力时取了反应液的1/3;t,反应所需时间,h。
相对酶活计算如公式(2)所示:
相对酶活![]()
(2)
(2)蛋白含量测定:蛋白质含量测定采用考马斯亮蓝 G250 法,并且以牛血清蛋白作为标准品[13]。
1.2.3 聚半乳糖醛酸酶的纯化
首先将发酵液经过饱和度为20%的(NH4)2SO4沉淀后,离心取上清液继续加入(NH4)2SO4使其饱和度达到80%,离心得其沉淀;溶解于50 mmol/L乙酸乙酸钠缓冲溶液(pH 4.8),在相同的缓冲溶液下进行透析,多次更换缓冲溶液直至透析液中无![]() 用BaCl2检测[14]。
用BaCl2检测[14]。
1.2.4 聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)检测
以低分子质量蛋白Marker为标记,采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳测定聚半乳糖醛酸酶的分子质量。另外用含有质量浓度2.5 g/L果胶的凝胶进行聚半乳糖醛酸酶活性检测,用质量浓度2 g/L的钌红作为染液[15]。
1.2.5 温度对聚半乳糖醛酸酶活性和稳定性的影响
将聚半乳糖醛酸酶置于30~70 ℃的环境中,测定最佳反应温度,通过在30~70 ℃下水浴保温1 h测定酶活,以确定聚半乳糖醛酸酶的温度稳定性。
1.2.6 pH对聚半乳糖醛酸酶活性和稳定性的影响
将聚半乳糖醛酸酶置于pH 3~8的缓冲溶液中,以测定最佳反应pH,通过在pH 3~8的缓冲溶液中水浴保温1 h测定酶活,以确定聚半乳糖醛酸酶的pH稳定性。
1.2.7 缓冲液对聚半乳糖醛酸酶活性的影响
通过在pH 4.8和离子强度(50.0 mmol/L)恒定的乙酸乙酸钠缓冲液、柠檬酸缓冲液和柠檬酸-磷酸氢二钠缓冲液中分别进行该酶活性测定,研究了不同缓冲液对聚半乳糖醛酸酶活性的影响。
1.2.8 聚半乳糖醛酸酶动力学参数的测定
通过在1~20 g/L不同底物质量浓度、48 ℃和pH 4.8的条件下,测定了聚半乳糖醛酸酶的米氏常数(Km)和最大速度(Vmax)。用Lineweavereburk图(1/[S]对1/[V])计算了聚半乳糖醛酸酶的Km值和Vmax值,计算如公式(3)所示:
(3)
1.2.9 底物特异性
在不同底物(包括果胶、木聚糖和羧甲基纤维素)的质量浓度为5 g/L的溶液中测定了聚环化酶的底物特异性。
1.2.10 金属离子和表面活性剂对聚半乳糖酶活性的影响
在浓度为1 mmol/L金属离子(1∶1)条件下,测定不同金属离子(Co2+、Mn2+、Mg2+、Zn2+、Cu2+、Ca2+、Ba2+、Li2+和Fe2+)对聚半乳糖醛酸酶活性的影响(以氯盐的形式存在)。同时分析了100 mmol/L吐温-80、Tritonx-100和十二烷基硫酸钠(sodium docecyl sulfate,SDS)等不同表面活性剂对聚半乳糖醛酸酶活性的影响[16]。
1.2.11 聚半乳糖醛酸酶的贮藏稳定性
在4 ℃和30 ℃的下放置30 d,每隔5 d测定1次酶活。
1.2.12 统计分析
数据分析软件采用SPSS 17.0软件分析显著性差异;做图采用Origin 2017软件;所有的试验进行3次平行。
2 结果与分析
2.1 棘孢木霉半乳糖醛酸酶的部分纯化分析
聚半乳糖醛酸酶的部分纯化结果如表1所示,纯化倍数达2.1倍,回收率达94.53%,随着蛋白含量变低,比酶活变大,杂蛋白随着分离纯化的进行被分离出去。
表1 棘孢木霉多聚半乳糖醛酸酶的部分纯化结果
Table 1 Partial purification of polygalacturonase from Trichoderma asperellum

纯化步骤总酶活/U总蛋白/mg比酶活/(U·mg-1)纯化倍数回收率/%粗酶5 76048.00120.001.0100.00(NH4)2SO4沉淀5 59526.83208.521.797.13透析5 44521.15257.412.194.53
SDS-PAGE电泳图以及活性检测如图1所示,计算得出分子质量为50.46、34.21、31.66、29.29 kDa。通过活性检测也证明具有降解活性的分子质量为29.29~50.46 kDa。实验结果测定的聚半乳糖醛酸酶其分子质量范围与其他学者研究的结果一致,如草酸青霉菌CZ 1028、枯草芽孢杆菌PB1和黑曲霉MTCC 3323产的聚半乳糖醛酸酶分子质量分别为38、43.1、34、69 kDa[17-19]。
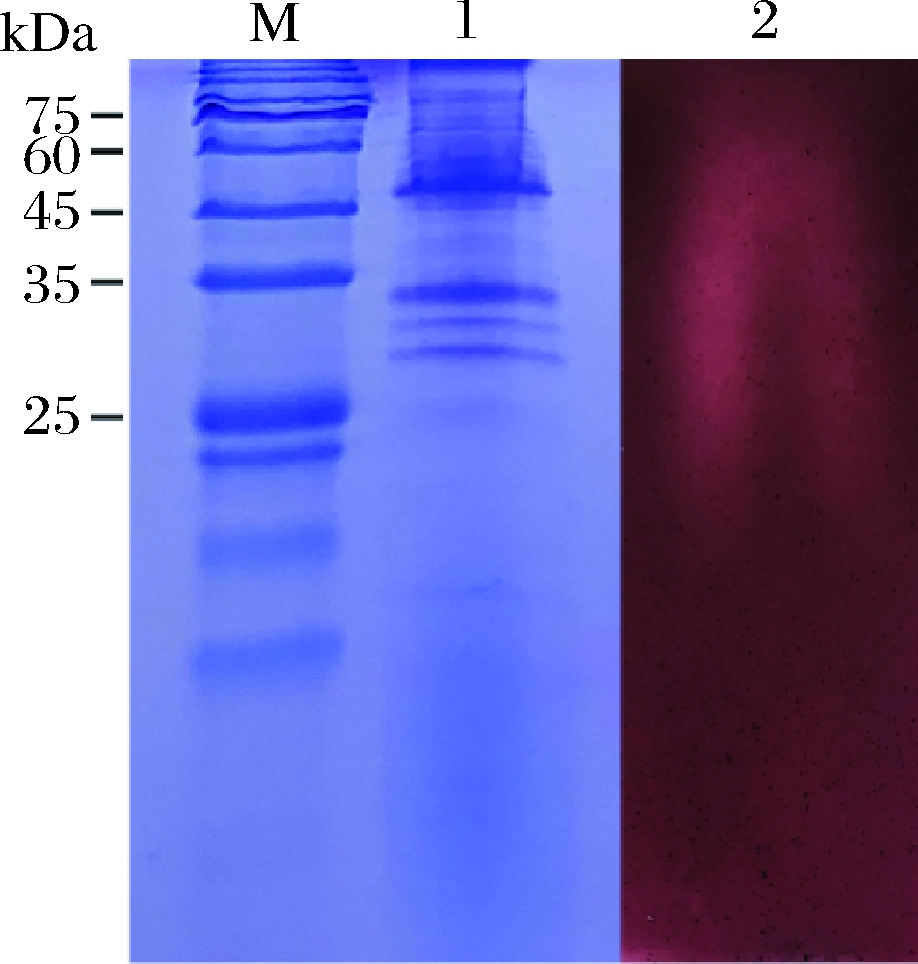
M-标准蛋白;1-部分纯化的聚半乳糖醛酸酶;2-聚半乳糖醛酸酶的酶谱分析图1 聚半乳糖醛酸酶的SDS-PAGE分析和活性检测
Fig.1 SDS-PAGE analysis and activity detection of polygalacturonase
2.2 pH对酶活性和稳定性的影响
由图2-A得出聚半乳糖醛酸酶的最适反应pH为4.0,pH向碱性方向迁移时酶活急剧下降,在pH 7.0时几乎丧失了初始活性的65.0%,说明该酶属酸性酶,结果与NITURE[20]相似。图2-B表明,在pH 3.0~5.0保温60 min仍保持80%的活性,稳定性较好。活性中心氨基酸的质子化导致酶的天然结构发生不可逆转的变化而影响酶活性[21-22]。与Sigma公司的商品酶进行比较发现该酶的最适反应pH与商品酶相接近,但稳定性上在pH为3和5时该酶酶活仅损失20%左右,而商品酶损失50%左右[23]。
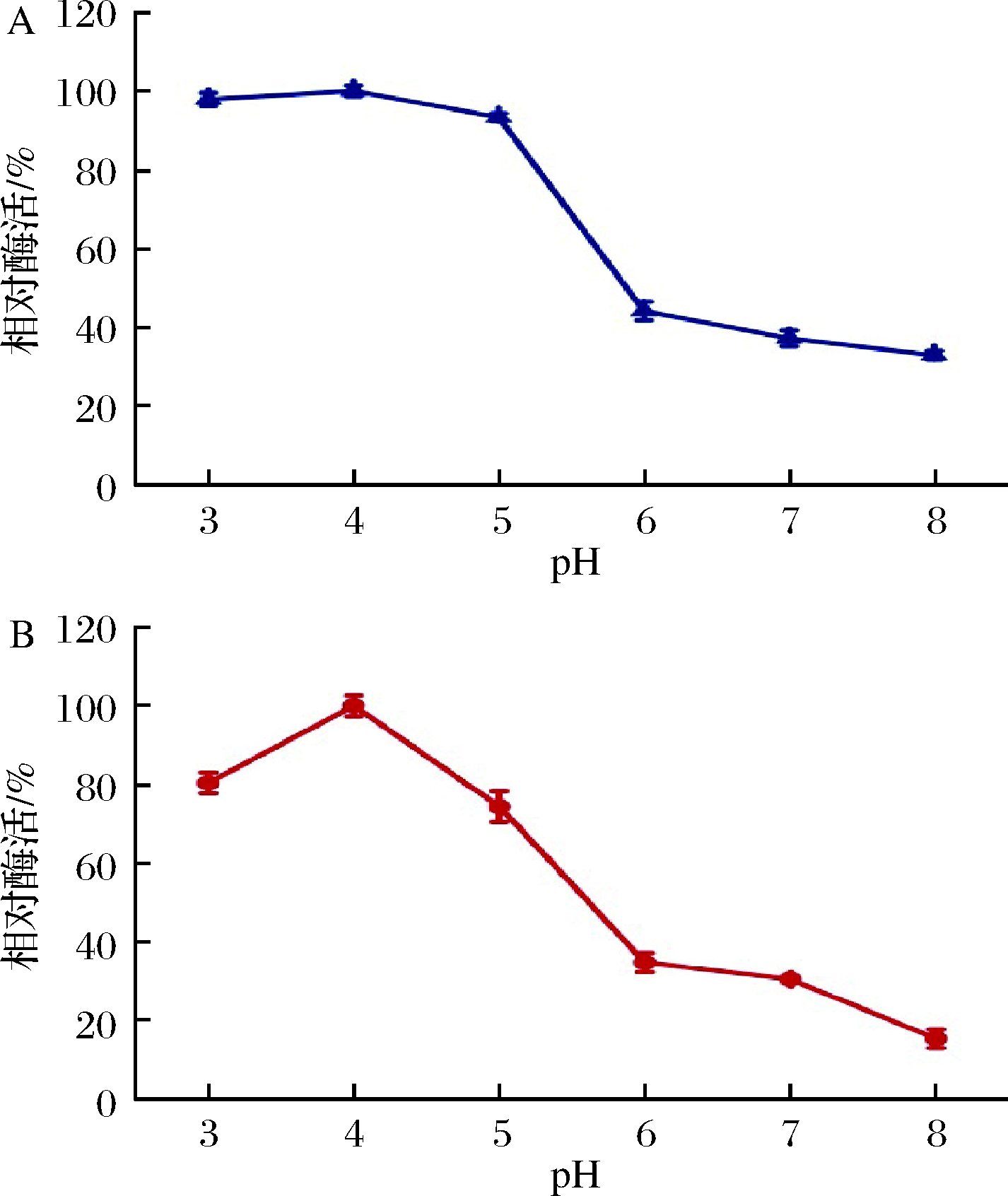
A-pH对酶活性的影响;B-pH对酶稳定性的影响图2 pH对棘孢木霉聚半乳糖醛酸酶活性和稳定性的影响
Fig.2 Effect of pH on the activity and stability of polygalacturonase from Trichoderma asperellum
2.3 温度对酶活性和稳定性的影响
通过图3-A观察到,聚半乳糖醛酸酶的最适反应温度是40 ℃,但温度的升高会使酶分子发生三维结构的变化导致酶变性失活[16],这与真菌产聚半乳糖醛酸酶的行为几乎是一致的[24-25]。图3-B中酶在30~50 ℃下保温60 min后,酶活性依然保持在80%以上,而在60~70 ℃保温60 min后,酶活性下降了50%以上,说明该酶在30~50 ℃稳定性较好。这可归因于纯化酶在高温下的三级结构的变性[26-27]。在与Sigma公司以及北京东华强盛生物技术有限公司的进行比较,该酶的最适温度为40 ℃,而商品酶是30 ℃,在温度30 ℃时保持90%以上的活性说明该酶在高温条件下仍能保持较好活性。在50~70 ℃商品酶酶活损失超过了80%,该酶的酶活损失小于60%,该酶在较高温度下稳定性较好[23,28]。
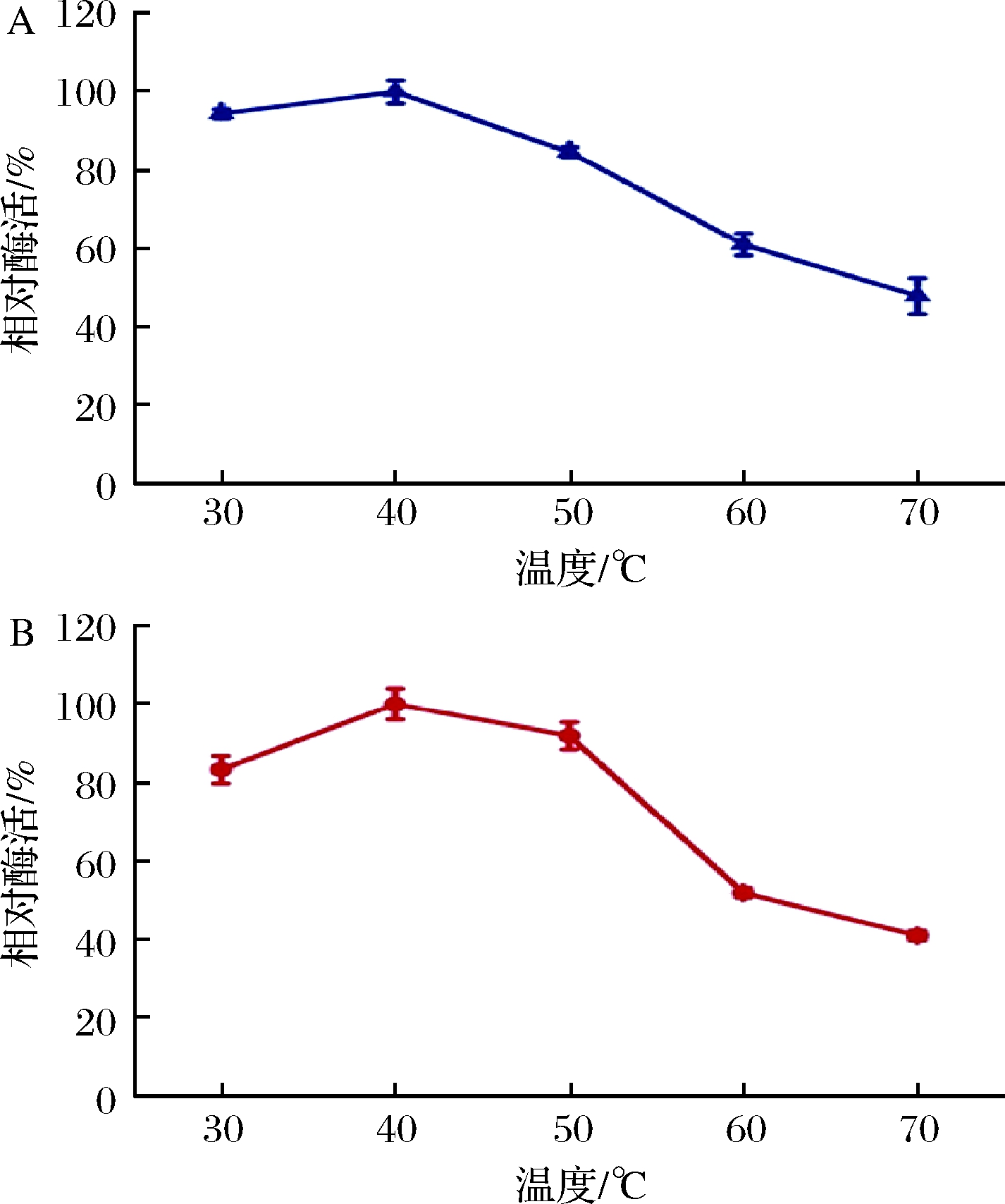
A-温度对酶活性的影响;B-pH对酶稳定性的影响图3 温度对棘孢木霉聚半乳糖醛酸酶活性和稳定性的影响
Fig.3 Effect of temperatures on the activity and stability of polygalacturonase from Trichoderma asperellum
2.4 缓冲液对聚半乳糖醛酸酶活性的影响
酶与底物反应取决于带电分子的运动,缓冲液的离子是将底物的带电基团与酶的活性位点结合的重要标准。由图4可知,乙酸缓冲液较适用于果胶与聚半乳糖醛酸酶的结合以及酶活性部位带电基团的移动。
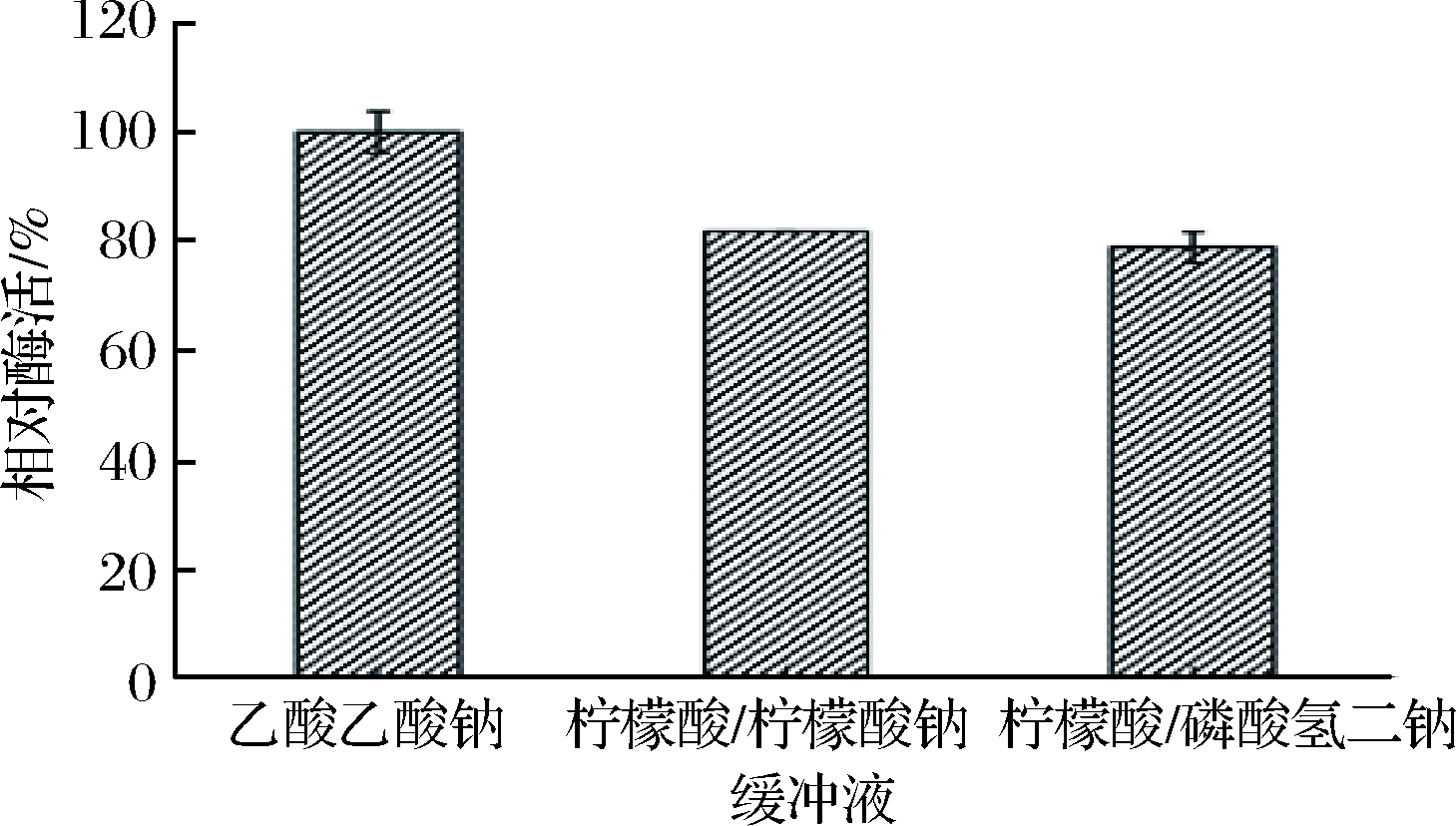
图4 不同缓冲液对棘孢木霉聚半乳糖酶活性的影响
Fig.4 Influence of different buffers on the activity of polygalacturonase from Trichoderma asperellum
2.5 底物特异性和动力学参数
由图5-A可知,部分纯化的聚半乳糖醛酸酶对果胶具有较高的特异性,而对羧甲基纤维素(carboxymethyl cellulose,CMC)和木聚糖无酶活性;通过图5-B计算聚半乳糖醛酸酶的米氏常数Km值为0.74 mg/mL,Vmax为3 100 μg/min。其测定结果与CHENG等[17]研究的草酸青霉菌产聚半乳糖醛酸酶的Km值1.27 mg/mL和SILVA等[29]研究的利迪链霉菌CZ1028产聚半乳糖醛酸酶的Km值(1.63 mg/mL)相比较表明棘孢木霉产的聚半乳糖醛酸酶与底物的亲和能力较好。
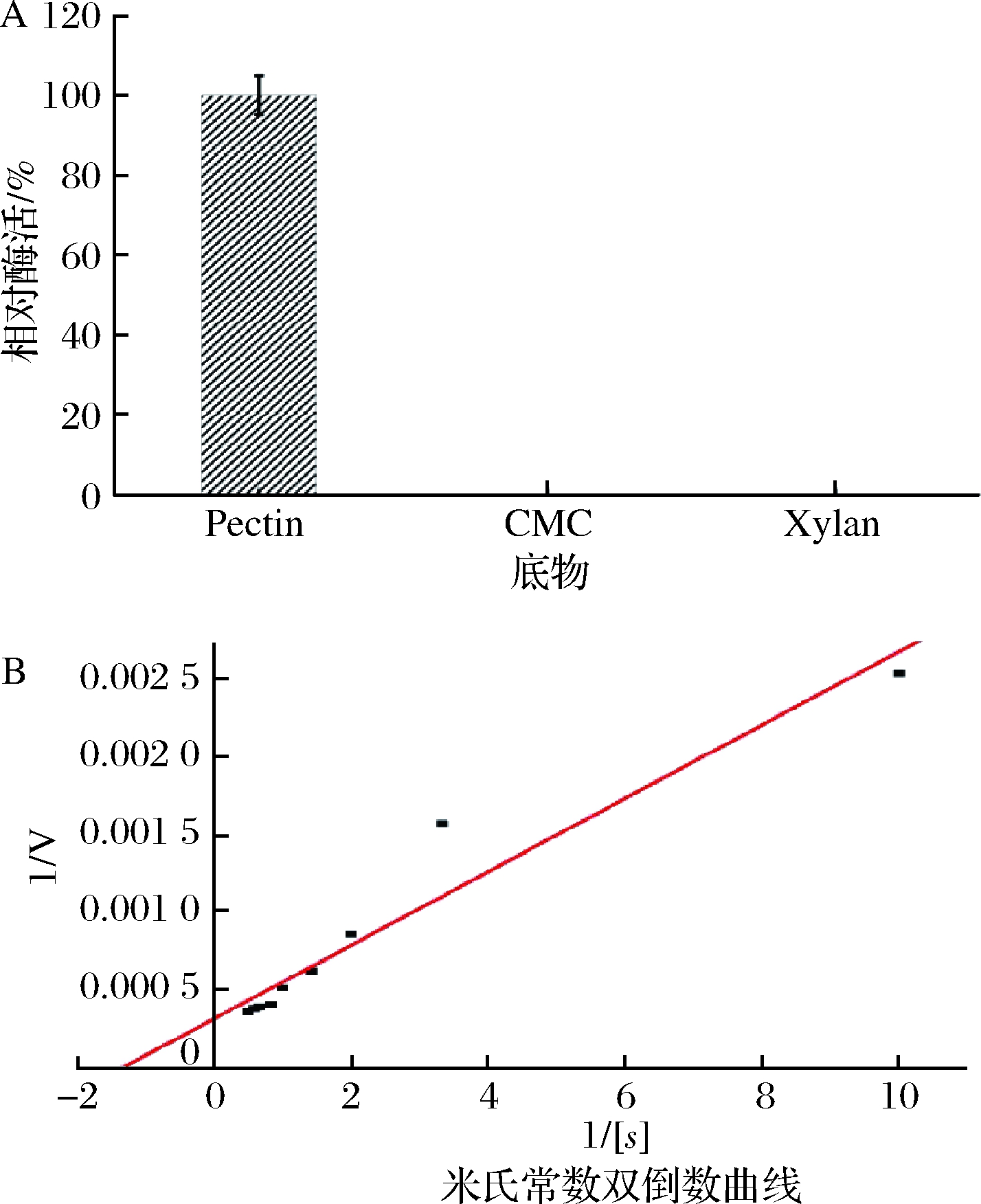
A-底物特异性;B-动力学参数图5 棘孢木霉聚半乳糖醛酸酶的底物特异性及动力学参数
Fig.5 Substrate specificity and kinetic parameters of polygalacturonase from Trichoderma asperellum
2.6 贮藏稳定性
由图6-A可知,聚半乳糖醛酸酶在4、30 ℃下储存30 d后酶活保留率为初始酶活的70.0%以上,相比之下在4 ℃条件下贮藏性能较好。这就表明在4 ℃和30 ℃这样一个宽泛温度的环境下具有良好的贮存特性,可以大大节约了贮存的成本。NAWAZ等[30]在研究α-葡萄糖苷酶时也发现该酶游离状态下在4、 30 ℃下储存30 d其酶活也保持在70%左右。
在此基础上还进行了发酵液pH变化的测定,测定结果如图6-B所示,表明在贮藏过程中发酵液的pH逐渐下降,但在4、30 ℃下两者的pH相差并不大。更加验证了该酶在酸性的条件下可以发挥良好的酶活特性。
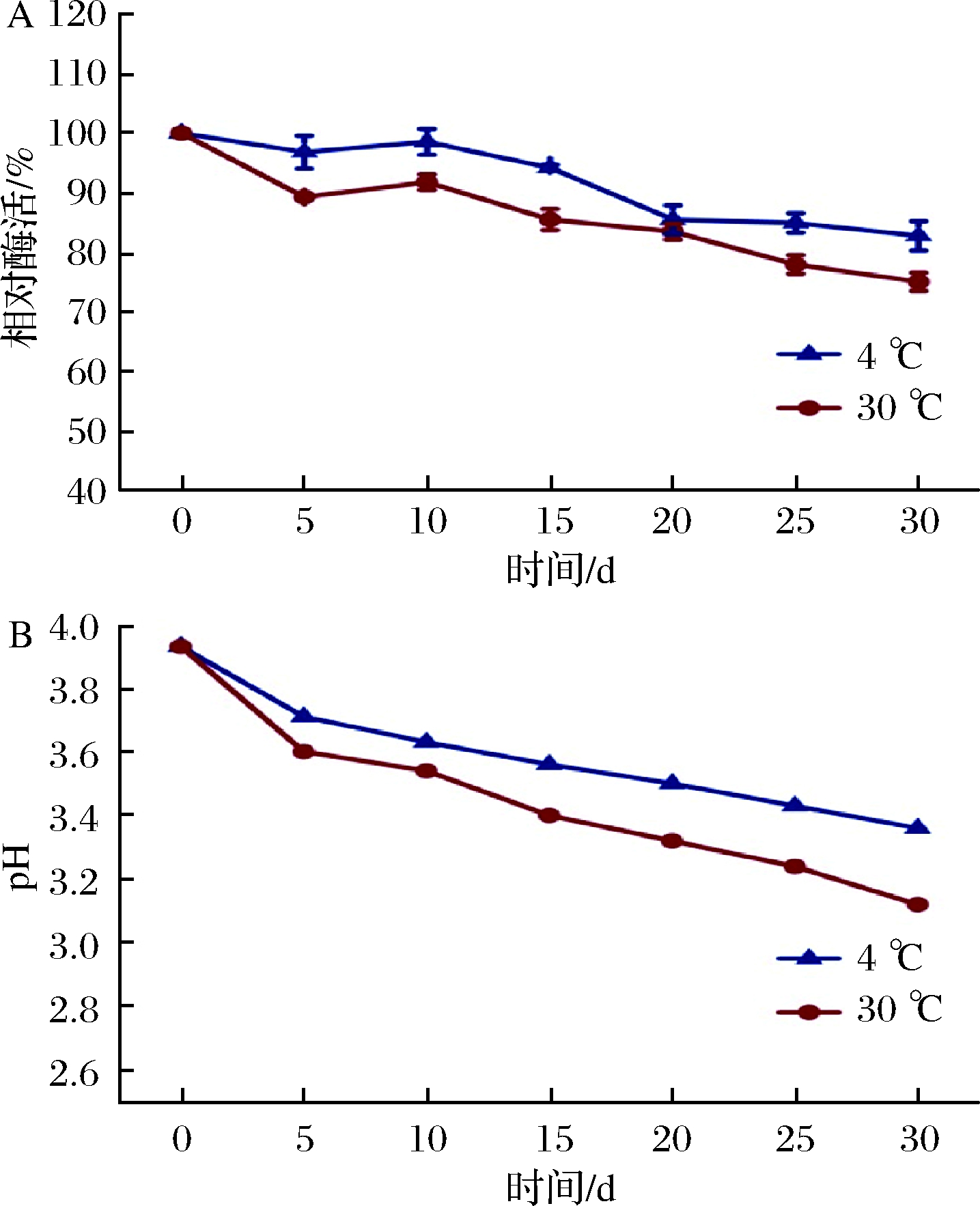
A-贮藏稳定性;B-pH变化图6 聚半乳糖酶在不同温度下的贮藏稳定性以及pH变化
Fig.6 Storage stability and pH changes of polygalacturonase from Trichoderma asperellum at different temperatures
2.7 金属离子和表面活性剂对聚半乳糖酶活性的影响
由图7-A可知,Mn2+、Mg2+、Cu2+、Ca2+对聚半乳糖醛酸酶有激活效果,其中Ca2+激活效果最好;而Co2+、Zn2+、Ba2+、Li+、Fe2+对聚半乳糖醛酸酶显现抑制作用,其中Zn2+抑制性最强。这种抑制作用可归因于羧基的“嵌段”,其可捕获酶分子并因此阻止酶水解反应的进行[31]。由图7-B可知,在表面活性剂中Tritonx-100明显提高了酶的活性,而吐温-80和SDS则抑制聚半乳糖醛酸酶的活性,约丧失37.8%和47.04%的活性。
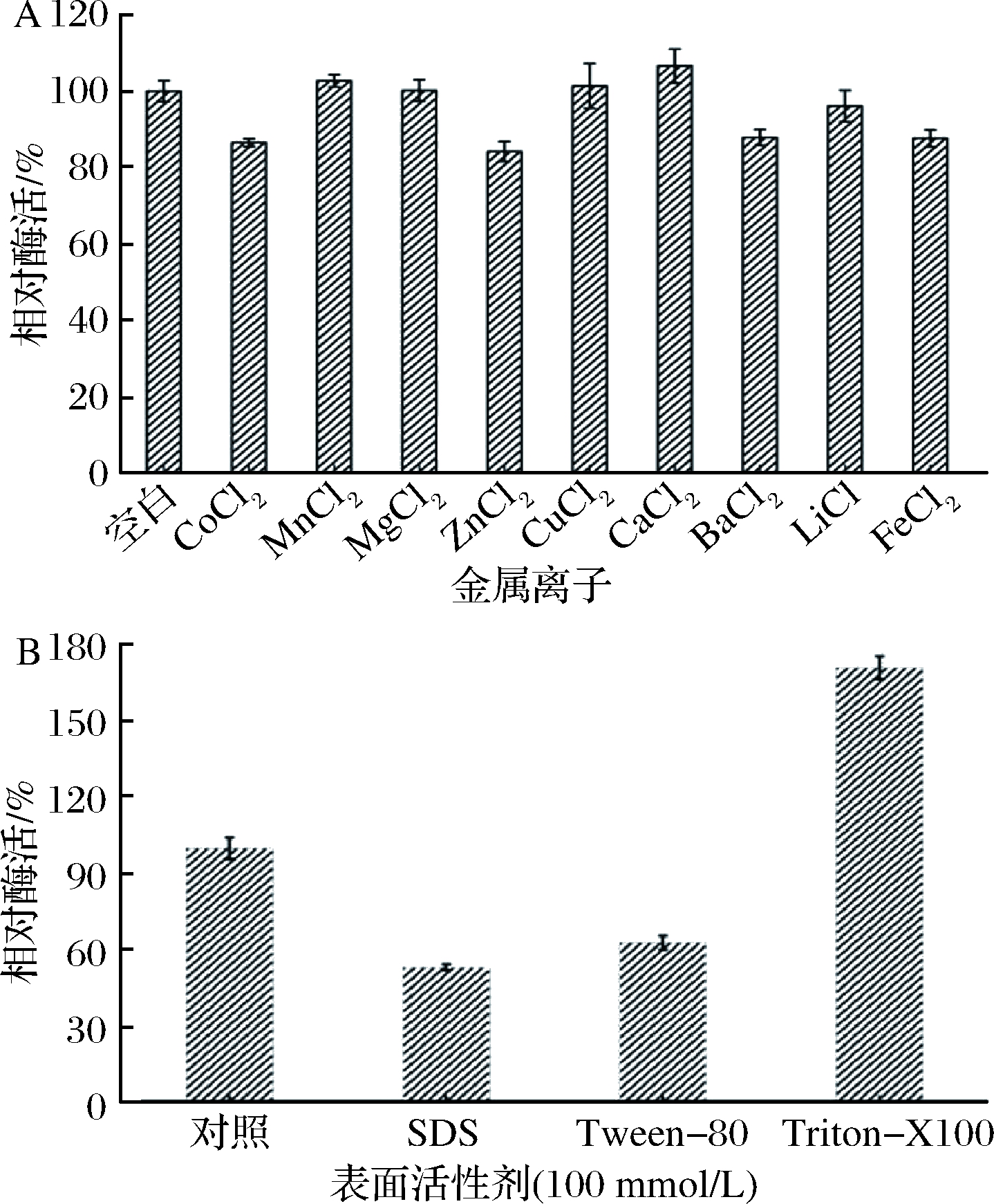
A-金属离子;B-表面活性剂图7 金属离子和表面活性剂对棘孢木霉聚半乳糖醛酸酶活性的影响
Fig.7 Effect of metal ions and detergents on the activity of polygalacturonase from Trichoderma asperellum
3 结论
本文以课题组筛得的Trichoderma asperelham (保藏号为 CGMCC No:14636) 所产聚半乳糖醛酸酶为研究对象,结果表明该酶在乙酸乙酸钠的缓冲溶液环境下酶活反应较好,通过(NH4)2SO4沉淀和透析袋透析后获得分子质量在29.29~50.46 kDa的纯化酶,该酶比酶活为257.41 U/mg,纯化倍数为2.1倍。该酶的最适反应pH为4,在pH 3.0~5.0保温60 min其酶活仍保持80%以上,具有了良好的耐酸性;最适反应温度为40 ℃,在30~50 ℃保温60 min其酶活仍保留80%以上,热稳定性较好;并且该酶纯化后对果胶具有较高的特异性;表面活性剂Tritonx-100和Mn2+、Mg2+、Cu2+、Ca2+金属离子对该酶具有一定的激活作用;通过计算该酶的米氏常数Km值为0.74 mg/mL,Vmax为3 100 μg/min,与底物的亲和力较好;并且本研究发现该酶的贮藏性能较好,在4、 30 ℃下储存30 d其酶活也保持在70%左右,可为果蔬清洁加工领域新型酶制剂的开发提供理论依据。
[1] NAIDU G S N, PANDA T. Production of pectolytic enzymes:A review[J]. Bioprocess Engineering, 1998, 19(5):355-361.
[2] GUMMADI N S, PANDA T. Purification and biochemical properties of micro-bial pectinases:A review[J]. Process Biochemistry, 2003,38(7): 987-996.
[3] PAG N A, CONDE J, IBARZ A, et al. Albedo hydrolysis modelling and digestion with reused effluents in the enzymatic peeling process of grape fruits[J]. Journal of the Science of Food and Agriculture, 2010, 90(14):2 433-2 439.
N A, CONDE J, IBARZ A, et al. Albedo hydrolysis modelling and digestion with reused effluents in the enzymatic peeling process of grape fruits[J]. Journal of the Science of Food and Agriculture, 2010, 90(14):2 433-2 439.
[4] KASHYAP D, VOHRA P, CHOPRA S, et al. Applications of pectinases in the commercial sector: A review[J]. Bioresour Technol, 2001,77(3): 215-227.
[5] VAN BUREN J P. Causes and prevention of turbidity in apple juice[J]. Processed Apple Products, 1989:97-120.DOI:10.1007/978-1-4684-8225-6_5.
[6] DEY T B, ADAK S, BHATTACHARYA P, et al. Purification of polygalacturonase from Aspergillus awamori nakazawa MTCC 6652 and its application in apple juice clarification[J]. LWT-Food Science and Technology,2014,59(1): 591-595.
[7] 龙艳珍,吴菲菲,李化强,等.真空冷冻干燥棘孢木霉菌株工艺优化研究[J].食品研究与开发,2019,40(2):144-148.
[8] 尹锦辉,吴菲菲,赵良忠,等.酶法去除脐橙白皮层的产酶培养基优化研究[J].中国南方果树,2016,45(5):44-49;51.
[9] SANTOS-VILLALOBOS S D L, GUZM N-ORTIZ D A, G
N-ORTIZ D A, G MEZ-LIM M A,et al. Potential use of Trichoderma asperellum (Samuels, Liechfeldt et Nirenberg) T8a as a biological control agent against anthracnose in mango (Mangifera indica L.)[J]. Biological Control, 2013, 64(1):37-44.
MEZ-LIM M A,et al. Potential use of Trichoderma asperellum (Samuels, Liechfeldt et Nirenberg) T8a as a biological control agent against anthracnose in mango (Mangifera indica L.)[J]. Biological Control, 2013, 64(1):37-44.
[10] ADE R, NASARUDDIN N, HENDARTO H, et al. Endophytic association of Trichoderma asperellum within Theobroma cacao suppresses vascular streak dieback incidence and promotes side graft growth[J]. Mycobiology, 2016, 44(3):180-186.
[11] MILLER G L. Use of dinitrosalycilic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 1959,31(3): 426-428.
[12] 王小敏,吴文龙,闾连飞,等.分光光度计法测定果胶酶活力的方法研究[J].食品工业科技,2007,28(5):227-229.
[13] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(12):248-254.
[14] 赵祥颖,刘建军,刘丽萍,等.硫酸铵对DNS试剂测定几丁质酶活力的影响[J].食品与生物技术学报,2009,28(4):555-558.
[15] RIED J L, COLLMER A. Activity stain for rapid characterization of pectic enzymes in isoelectric focusing and sodium dodecyl sulfate-polyacrylamide gels[J]. Applied & Environmental Microbiology, 1985, 50(3):615-622.
[16] REHMAN H U, AMAN A, NAWAZ M A, et al. Characterization of pectin degrading polygalacturonase produced by Bacillus licheniformis KIBGE-IB21[J]. Food Hydrocolloids, 2015, 43:819-824.
[17] CHENG Z, CHEN D, LU B, et al. A novel acid-stable endo-polygalacturonase from Penicillium oxalicum CZ1028: Purification, characterization, and application in the beverage industry[J]. Journal of Microbiology and Biotechnology, 2016, 26(6):989.
[18] ZHOU M, WU J, WANG T, et al. The purification and characterization of a novel alkali-stable pectate lyase produced by Bacillus subtilis PB1[J]. World Journal of Microbiology and Biotechnology, 2017, 33(10):190.
[19] KANT S, VOHRA A, GUPTA R. Purification and physicochemical properties of polygalacturonase from Aspergillus niger MTCC 3323[J]. Protein Expression and Purification, 2013, 87(1):11-16.
[20] NITURE S K.Comparative biochemical and structural characterizations of fungal polygalacturonases[J]. Biologia, 2008, 63(1):1-19.
[21] JAYANI R S, SAXENA S, GUPTA R. Microbial pectinolytic enzymes: A review[J]. Process Biochemistry, 2005, 40(9):2 931-2 944.
[22] MCDERMID A S, MCKEE A S, MARSH P D. Effect of environmental pH on enzyme activity and growth of Bacteroides gingivalis W50[J]. Infection and Immunity, 1988, 56(5):1 096-1 100.
[23] 林建城,杨文杰,朱丽华,等.商品果胶酶(Aspergillus niger)的催化动力学研究[J].甘肃农业大学学报,2006,41(4):81-85.
[24] PEDROLLI D B, CARMONA E C. Purification and characterization of the exopolygalacturonase produced by Aspergillus giganteusin submerged cultures[J].Journal of Industrial Microbiology & Biotechnology,2010, 37(6):567-573.
[25] PEDROLLI D B, MONTEIRO A P, GOMES E, et al. Pectin and pectinases: Production, characterization and industrial application of microbial pectinolytic enzymes[J]. Open Biotechnology Journal, 2009, 3(1):9-18.
[26] KOBAYASHI T, HIGAKI N, YAJIMA N, et al. Purification and properties of a galacturonic acid-releasing exopolygalacturonase from a strain of Bacillus[J]. Bioscience Biotechnology and Biochemistry, 2001, 65(4):842-847.
[27] MEI Y, CHEN Y, ZHAI R, et al. Cloning, purification and biochemical properties of a thermostable pectinase from Bacillus halodurans M29[J]. Journal of Molecular Catalysis B: Enzymatic, 2013, 94:77-81.
[28] 张跃,钟芳,麻建国.商品果胶酶中PE和PG的热性质[J].哈尔滨商业大学学报(自然科学版),2007,23(6):736-739;746.
[29] SILVA D, MARTINS E D, LEITE R S, et al. Purification and characterization of an exo-polygalacturonase produced by Penicillium viridicatum RFC3 in solid-state fermentation[J]. Process Biochemistry,2007,42(8): 1 237-1 243.
[30] NAWAZ M, KARIM A, AMAN A, et al. Continuous degradation of maltose: Improvement in stability and catalytic properties of maltase (α-glucosidase) through immobilization using agar-agar gel as a support[J]. Bioprocess and Biosystems Engineering, 2015, 38(4):631-638.
[31] YUAN P, MENG K, LUO H, et al. A novel low-temperature active alkaline pectate lyase from Klebsiella sp. Y1 with potential in textile industry[J]. Process Biochem,2011,46(10): 1 921-1 926.