牡蛎是我国沿海地区的四大养殖贝类之一,也是我国卫生部门批准的第一批药食同源的海产品之一[1]。福建地处沿海,近年来牡蛎养殖量逐年增加,产量约占全国的40%,是国内最大的养殖省份[2]。开发利用牡蛎壳日益受到关注。
牡蛎壳中,碳酸钙占总质量的90%~95%,钙元素含量达40%左右[3-5],是一种良好的自然生物钙源。以牡蛎壳为原料制备成各种食药级钙剂的研究受到广泛关注,已有以牡蛎壳为原料制备的各种钙制剂[1,6-12]。不同钙制剂不仅含钙量不同,钙的吸收率也不同,常用的葡萄酸钙、乳酸钙、碳酸钙等补钙剂的吸收率分别为27%、32%、39%[13],高的含钙量和吸收率使碳酸钙补钙剂具有更好的市场前景。
但碳酸钙补钙剂需通过胃酸分解解离出Ca2+,才可被消化吸收,过程中产生的CO2会引发嗳气,不适用于胃溃疡等消化道疾病患者,故改进天然碳酸钙晶体结构和组成,对扩大碳酸钙补钙剂的可适用人群具有良好的研究价值。
碳酸钙主要有方解石、文石、球霰石等3种热力学稳定性依次下降的晶体结构,天然形成的牡蛎壳碳酸钙是多糖、蛋白质等有机基质含量较少的热稳定的方解石和文石,热力学不稳定的球霰石碳酸钙一般只有在实验室中添加适当的晶型控制剂调控才能形成[14-15]。球霰石具有高比表面积、低密度、易溶性、易分散性、良好的生物安全性等特点,作为食药级钙剂具有更好的吸收性和可利用性[16]。近年来,国内外相继有蔗糖、淀粉等糖类和牛血清白蛋白、胃蛋白酶等蛋白质类作为晶型控制剂调控仿生矿化形成球霰石型碳酸钙的研究报道[17-21]。
胰蛋白酶是一种水溶性的蛋白水解酶,能特异性水解碱性氨基酸羧基形成的肽键,Ca2+对其具有保护和激活作用,临床上主要应用于消化道溃疡、炎症、创伤性损伤等[22-26]。以牡蛎壳为原料,胰蛋白酶为调控剂制备键合胰蛋白酶的球霰石超微细碳酸钙的研究至今未见报道。
论文探索了牡蛎壳经粉碎、乳酸溶提活性钙后,在胰蛋白酶调控下采用碳化法制备球霰石型的超细碳酸钙工艺,并通过扫描电镜、红外光谱等手段表征分析了产品组成与形貌特征,以期为牡蛎壳的开发利用,制备适用于消化道溃疡人群的新型食药级补钙制剂提供依据。
1 材料与方法
1.1 材料与试剂
近江牡蛎壳,福建泉州恒达制药有限公司;99.9% CO2气体,泉州市丰泽区东流焊接材料经营部。
乙二胺四乙酸二钠(分析纯),北京鼎国昌盛生物技术有限责任公司;氯化钠(分析纯)、氨水(分析纯),西陇科学股份有限公司;乳酸(药典级)、胰蛋白酶(生物试剂),罗恩试剂;钙羧酸指示剂(分析纯),阿拉丁试剂;其他试剂均为分析纯,国药集团;实验用水为去离子水。
1.2 仪器与设备
DGG-9123A型电热恒温鼓风干燥箱,上海森信实验仪器有限公司;DF-101S 集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;JY3002电子天平,上海舜宇恒平科学仪器有限公司;AR124CN分析天平,奥豪斯仪器(常州)有限公司;DFY-200摇摆式高速万能粉碎机,温岭市林大机械有限公司;FE28 pH计,梅特勒-托利多仪器有限公司;YP-2压片机,上海山岳科学仪器有限公司;NICOLET iS 10红外光谱仪,Thermo Fisher SCIENTIFIC;ZEISS MERLIN Compact扫描电镜,德国Zeiss公司;STA 409 PC热重分析仪,NETZSCH。
1.3 实验方法
1.3.1 牡蛎壳的预处理
近江牡蛎壳用自来水冲洗,并用刷子刷去附着的泥沙及其他杂质,反复冲洗干净后用蒸馏水浸泡1 h,滤干后在电热恒温鼓风干燥箱中80 ℃烘干6 h,再用万能粉碎机粉碎至粉末状,过100 目筛,装瓶备用。
1.3.2 牡蛎壳乳酸溶提液的钙含量测定
采用EDTA滴定法[12]:取25 mL牡蛎壳乳酸溶提稀释液于锥形瓶并用氨水调至pH 12~13,再加入适量钙羧酸指示剂,充分摇匀后用EDTA标准溶液滴定,当溶液由玫瑰红色变为亮蓝色,终止滴定并记录消耗的EDTA标准液体积,每个样品平行滴定2次,取平均值计算牡蛎壳活性钙的溶提率如公式(1)所示:
(1)
式中:c,EDTA标准溶液浓度,mol/L;V,滴定消耗的EDTA标准溶液体积,mL;n,乳酸溶提液稀释倍数;V总,乳酸溶提液总体积,mL;M,钙摩尔质量,g/mol;m,牡蛎壳粉质量,g。
1.3.3 乳酸溶提牡蛎壳活性钙的工艺条件优化
先用单因素实验考察乳酸浓度、反应温度、反应时间、搅拌速度等因素对牡蛎壳活性钙溶提率的影响,确定各因素的较佳取值。在此基础上,再用正交实验对工艺条件进一步优化。所有实验均做3个平行组。
1.3.4 胰蛋白酶调控的牡蛎壳纳米碳酸钙制备
在优化工艺条件下,用乳酸溶提牡蛎壳活性钙,溶提液过滤后,根据碳酸二级解离常数(pKa2=10.2)和胰蛋白酶等电点(pI=10.1~10.8),为了保证反应体系中的胰蛋白酶带负电,能与Ca2+键合反应并碳化成碳酸钙,溶提液先用氨水调节溶液至pH 11~12,再按不同比例的酶钙质量比分别加入适量胰蛋白酶,搅拌溶解完全后,在25 ℃下,以1 L/min的流速持续通入CO2气体5 min,碳化制备碳酸钙,所得产品用去离子水充分洗涤后用恒温鼓风干燥箱在105 ℃下干燥至恒重。同时为了节约成本,碳化后母液中的胰蛋白酶可以回收循环利用。
1.3.5 碳酸钙产品表征
1.3.5.1 扫描电镜形貌分析
扫描电镜分析和测定碳酸钙产品形貌即粒径。样品采用直接分散法:将导电胶剪成合适大小,直接粘在铜片上,待测样品借助外物直接散落在导电胶上,用吸耳球轻轻吹试样,除去未附着在导电胶上的样品。接着进样,选择合适的放大倍数观察样品的外观形貌及粒径大小。
1.3.5.2 红外光谱定性分析
取100~200 mg KBr粉末于玛瑙研钵中,再加入约2 mg的碳酸钙样品,充分研磨后,取样压片,以KBr空白片剂作参照,在波长4 000~400 cm-1内扫描红外光谱,分析鉴定产物特征官能团。
1.3.6 数据统计分析
用Excel 2007软件对单因素实验数据进行显著性分析,实验结果以平均值±标准差表示;正交实验结果用SPSS 18.0软件进行显著性差异分析,以P<0.05 表示差异显著;用Grapher 8.0 软件进行作图。
2 结果与分析
2.1 单因素法考察乳酸溶提牡蛎壳活性钙的工艺条件
2.1.1 温度对乳酸溶提牡蛎壳活性钙的影响
分别取牡蛎壳粉10.00 g,按m(牡蛎壳)∶V(乳酸溶液)=1∶20 的固液比加入1.0 moL/L的乳酸溶液后,在不同反应温度下,300 r/min搅拌反应30 min,测定分析牡蛎壳活性钙的溶提率,考察温度对牡蛎壳活性钙溶提率的影响。结果如图1所示,温度对活性钙溶提率的影响呈钟罩型趋势,温度低于55 ℃时,钙溶提率随着温度升高而升高;温度高于65 ℃时,钙溶提率随温度升高而下降;在55 ℃与65 ℃下,钙溶提率分别为39.22%、39.28%,溶提效果相当并取得良好效果。对实验数据进行单因素方差分析,显示温度对乳酸溶提牡蛎壳活性钙的影响具有显著性。
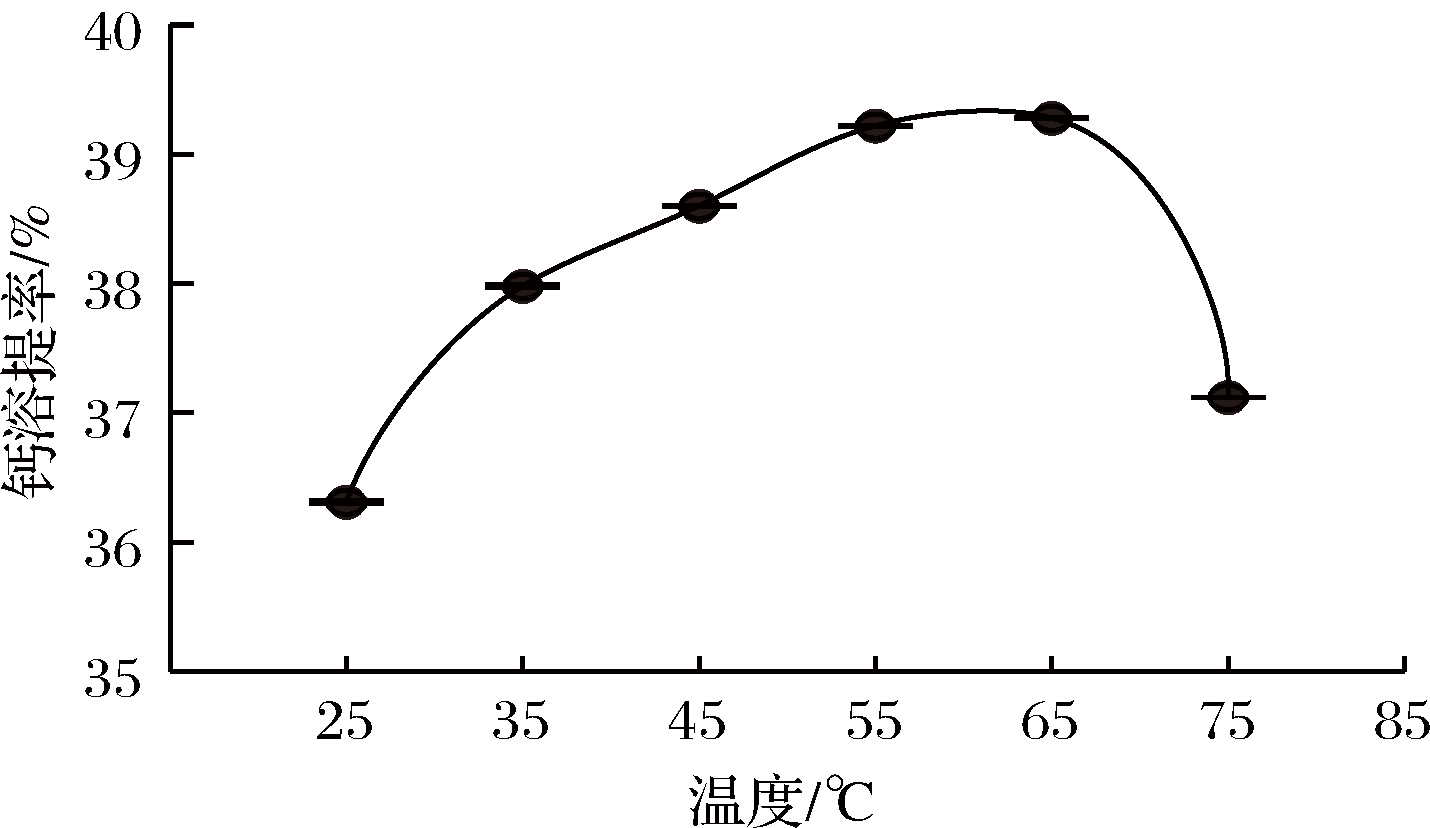
图1 温度对乳酸溶提牡蛎壳活性钙的影响
Fig.1 Effect of temperature on calcium extraction rate of oyster shell by lactic acid
温度升高加快体系溶质分子的运动速度,有助于牡蛎壳碳酸钙的溶解,提高其与乳酸的化学反应速度;但温度升高到一定程度,对放热反应产生抑制,不利于活性钙的溶提。根据实验结果,结合节能减排,确定55 ℃为较佳牡蛎壳活性钙的溶提温度。
2.1.2 反应时间对乳酸溶提牡蛎壳活性钙的影响
分别取牡蛎壳粉10.00 g,按1∶20固液比加入1.0 moL/L的乳酸溶液,在55 ℃、300 r/min下分别搅拌反应不同时间后,测定分析牡蛎壳活性钙的溶提率,考察反应时间对牡蛎壳活性钙溶提率的影响。由图2可见,除了反应时间30 min,钙溶提率为39.22%;其他反应时间下,乳酸对牡蛎壳活性钙的溶提率均在38.92%~38.99%之间波动,溶提效果基本稳定,单因素方差分析显示反应时间对钙溶提率的影响不显著,确定乳酸溶提牡蛎壳活性钙反应时间为30 min。
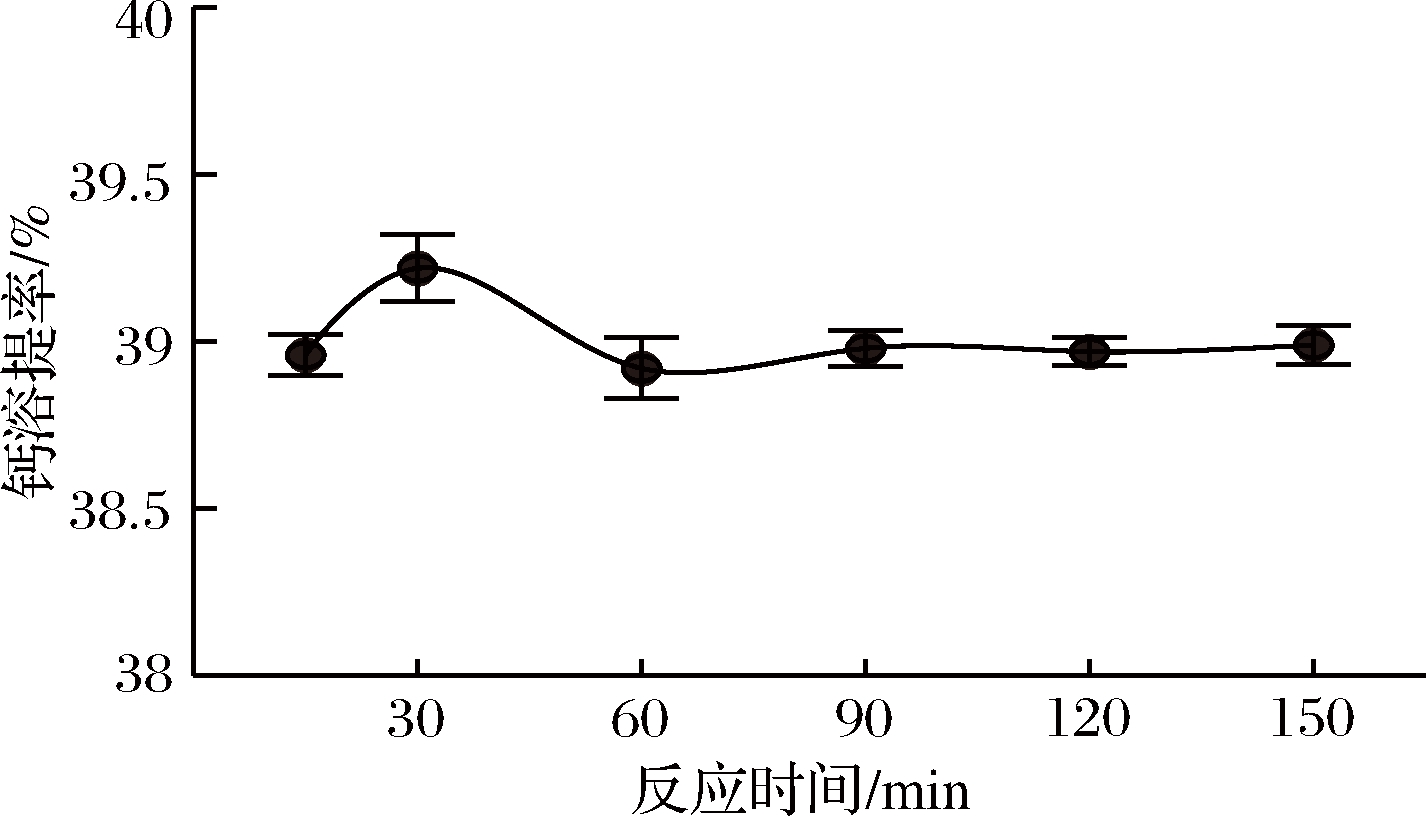
图2 反应时间对乳酸溶提牡蛎壳活性钙的影响
Fig.2 Effect of reaction time on calcium extraction rate of oyster shell by lactic acid
2.1.3 乳酸浓度对乳酸溶提牡蛎壳活性钙的影响
分别取牡蛎壳粉10.00 g,按1∶20固液比分别加入不同浓度的乳酸溶液,在55 ℃、300 r/min下分别搅拌反应30 min后,测定分析牡蛎壳活性钙的溶提率,考察乳酸浓度对牡蛎壳活性钙溶提率的影响。图3表明,当乳酸浓度低于1.5 moL/L时,牡蛎壳活性钙的溶提率随着乳酸浓度升高快速提升;乳酸浓度在1.5~2.5 moL/L范围内,随着乳酸浓度升高钙溶提率上升缓慢并趋于平稳,乳酸浓度为2 moL/L时,溶提率最大,为39.28%;乳酸浓度大于2.5 moL/L时,牡蛎壳活性钙的溶提率随着乳酸浓度升高呈轻微下降趋势。单因素方差分析显示乳酸浓度对牡蛎壳钙溶提率的影响具有显著性。
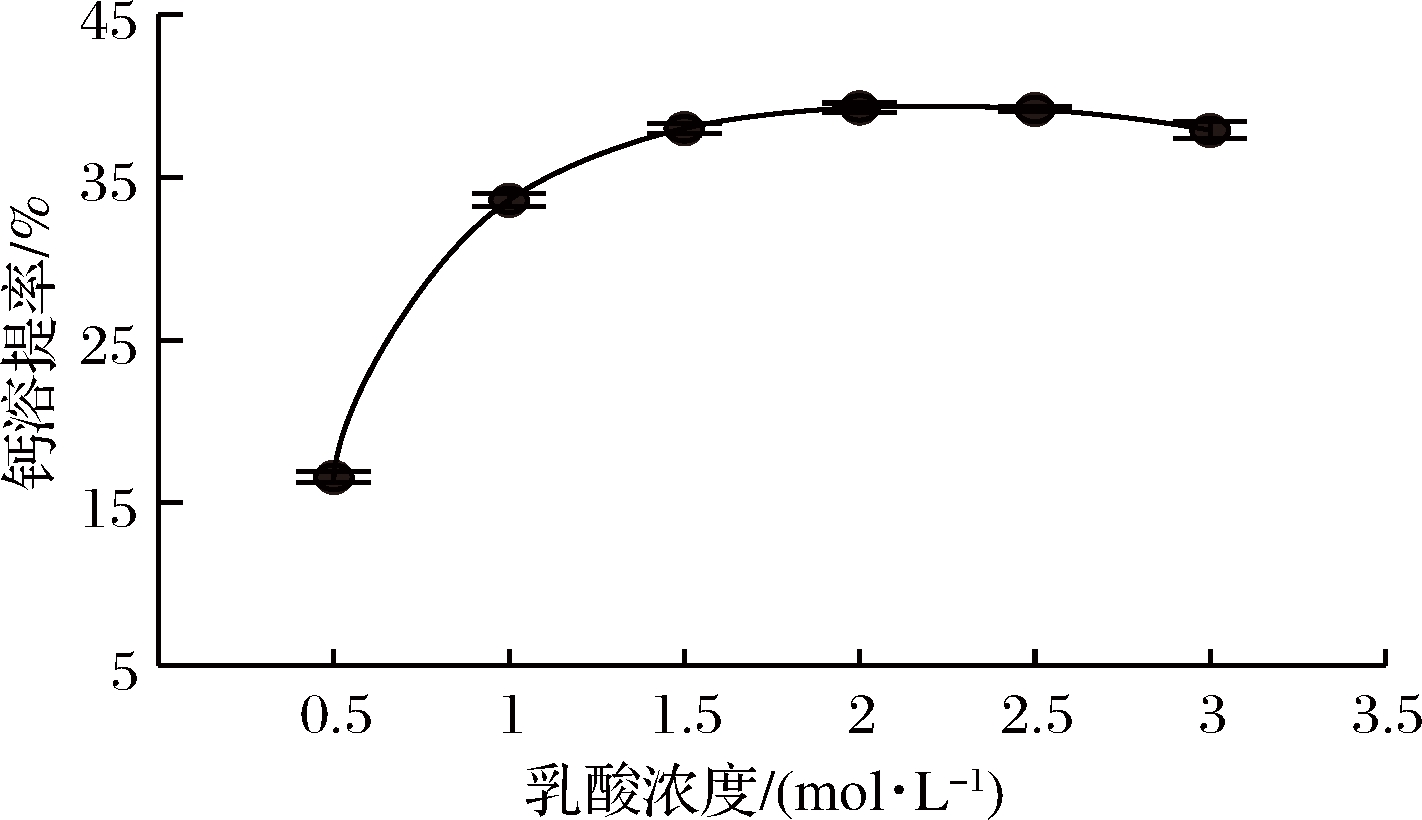
图3 乳酸浓度对乳酸溶提牡蛎壳活性钙的影响
Fig.3 Effect of lactic acid concentrations on calcium extraction rate of oyster shell by lactic acid
乳酸浓度对牡蛎壳钙溶提率影响遵循反应物浓度对反应效率的影响。当加入低于1 moL/L的乳酸溶液时,反应体系的乳酸量不足,导致牡蛎壳活性钙不能完全溶提出来;加入1 moL/L的乳酸溶液,乳酸与牡蛎壳碳酸钙刚好能达到理论完全反应比例,但由于反应的可逆性及牡蛎壳中少量杂质影响,该乳酸浓度仍不能把牡蛎壳活性钙完全溶提;加入1 moL/L<浓度<2 moL/L的乳酸溶液,体系中的乳酸适当过量,可保证牡蛎壳活性钙被完全溶提出;当乳酸浓度为2 moL/L时,牡蛎壳活性钙溶提效果最好,溶提率达39.28%;但随着加入乳酸浓度进一步升高,乳酸过量时,乳酸之间容易发生聚合反应,反而影响牡蛎壳活性钙的溶提效果。故确定2 moL/L的乳酸浓度为较佳提取浓度。
2.1.4 搅拌速度对乳酸溶提牡蛎壳活性钙的影响
分别取牡蛎壳粉10.00 g,按1∶20固液比加入2.0 moL/L的乳酸溶液,55 ℃下,在不同搅拌速度下反应30 min后,测定分析牡蛎壳活性钙的溶提率,考察搅拌速度对牡蛎壳活性钙溶提率的影响。图4显示,搅拌速度低于300 r/min时,牡蛎壳活性钙的溶提率随着搅拌转速逐渐增加而升高,当搅拌转速为300 r/min时,钙的溶提率最大,达39.28%;而搅拌速度高于300 r/min时,牡蛎壳活性钙的溶提率表现出快速下降趋势。单因素方差分析显示搅拌速度对牡蛎壳钙溶提率的影响具有显著性。
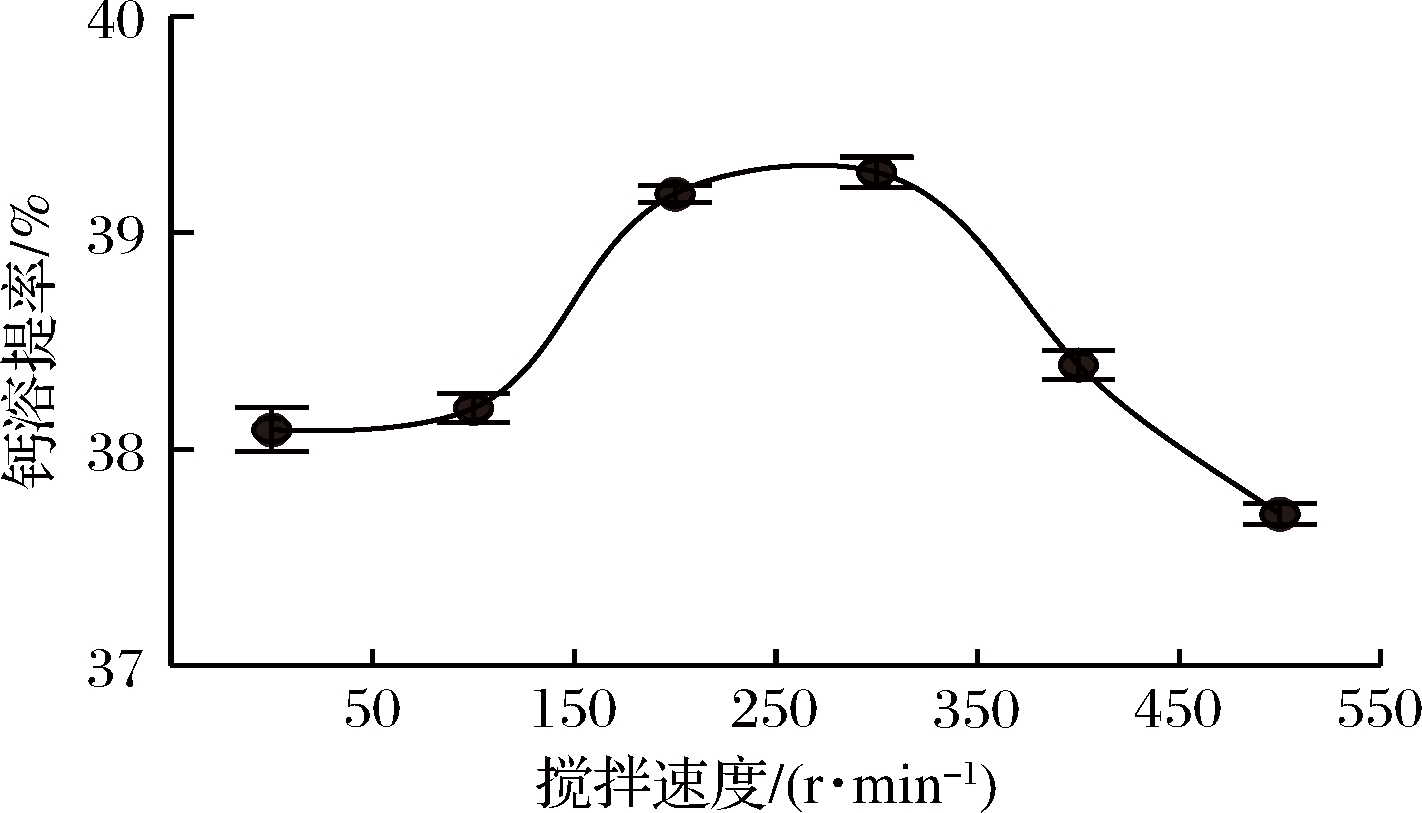
图4 搅拌速度对乳酸溶提牡蛎壳活性钙的影响
Fig.4 Effect of stirring speed on calcium extraction rate of oyster shell by lactic acid
搅拌有助于乳酸和牡蛎壳粉在反应体系中的分散,适当搅拌有助于两者之间的充分接触,提高反应;但随着搅拌速度提高,一方面会导致两者接触时间缩短,不利于反应,另一方面也会加速乳酸自身的聚合反应,不利于牡蛎壳碳酸钙的溶提。故确定较佳搅拌速度为300 r/min。
2.2 正交试验优化乳酸溶提牡蛎壳活性钙的工艺条件
根据单因素实验结果,固定反应时间30 min,以对钙溶提率有显著性影响的乳酸浓度、反应温度、搅拌速度等为考察因素,每个因素在单因素实验确定的较佳值周边选择3个水平,按L9(34)正交表进行试验设计组合出9个实验方案,以牡蛎壳活性钙的溶提率为考察指标,确定出不同浓度乳酸溶液提牡蛎壳活性钙的最佳工艺条件。具体的实验方案及实验结果极差分析见表1,实验结果的SPSS方差显著性分析见表2。
由表1可知,乳酸溶提牡蛎壳活性钙的最佳工艺条件是乳酸浓度为2 moL/L,温度为50 ℃,搅拌速度为350 r/min,乳酸溶提牡蛎壳活性钙的溶提率可达39.46%。通过R值可知,3个因素对钙溶提率的影响主次顺序为:搅拌速度>乳酸浓度>温度。表2分析结果显示,3个因素对钙溶提率均有显著性影响。
表1 乳酸提取牡蛎壳活性钙的正交实验方案及实验结果
Table 1 The schemes and results of orthogonal experiments about calcium of oyster shell extracted by lactic acid
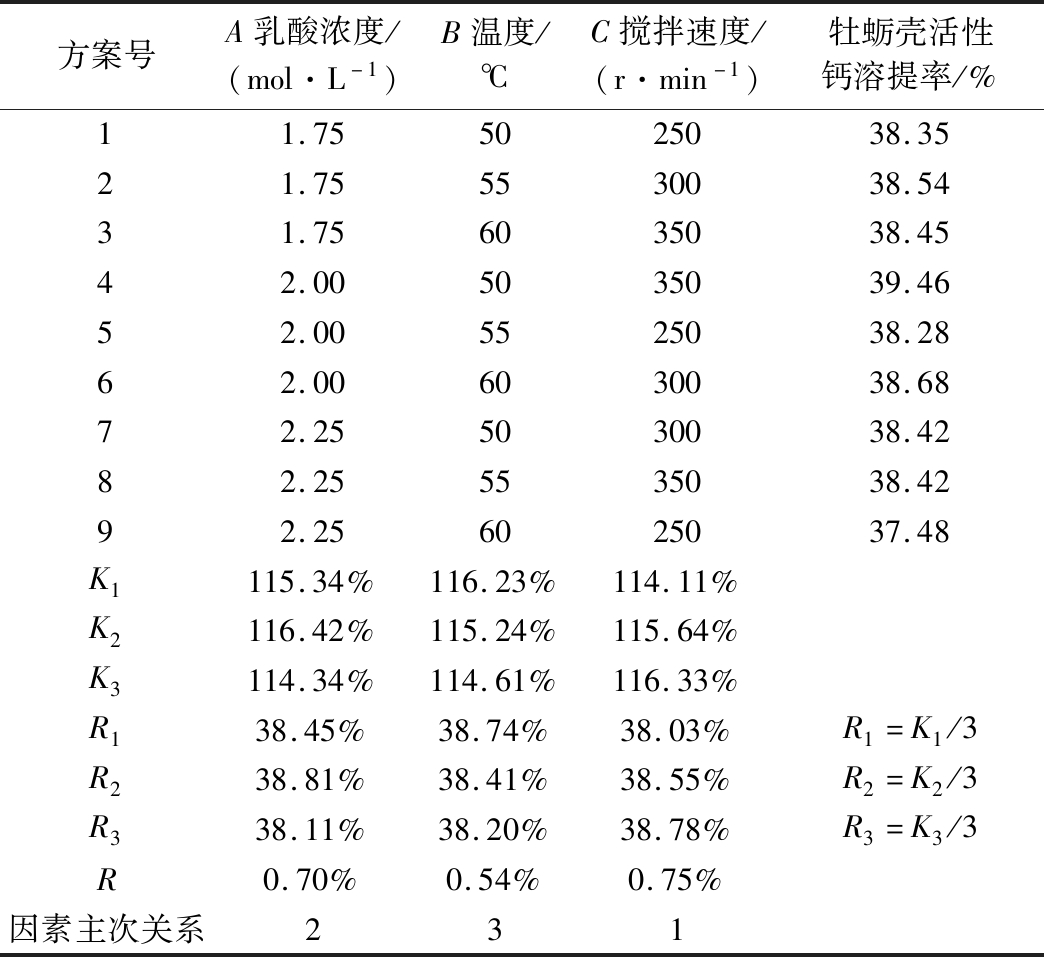
方案号A乳酸浓度/(mol·L-1)B温度/℃C搅拌速度/(r·min-1)牡蛎壳活性钙溶提率/%11.755025038.3521.755530038.5431.756035038.4542.005035039.4652.005525038.2862.006030038.6872.255030038.4282.255535038.4292.256025037.48K1115.34%116.23%114.11%K2116.42%115.24%115.64%K3114.34%114.61%116.33%R138.45%38.74%38.03%R1=K1/3R238.81%38.41%38.55%R2=K2/3R338.11%38.20%38.78%R3=K3/3R0.70%0.54%0.75%因素主次关系231
表2 正交试验结果方差统计分析
Table 2 Statistical analysis of variance of orthogonal test results
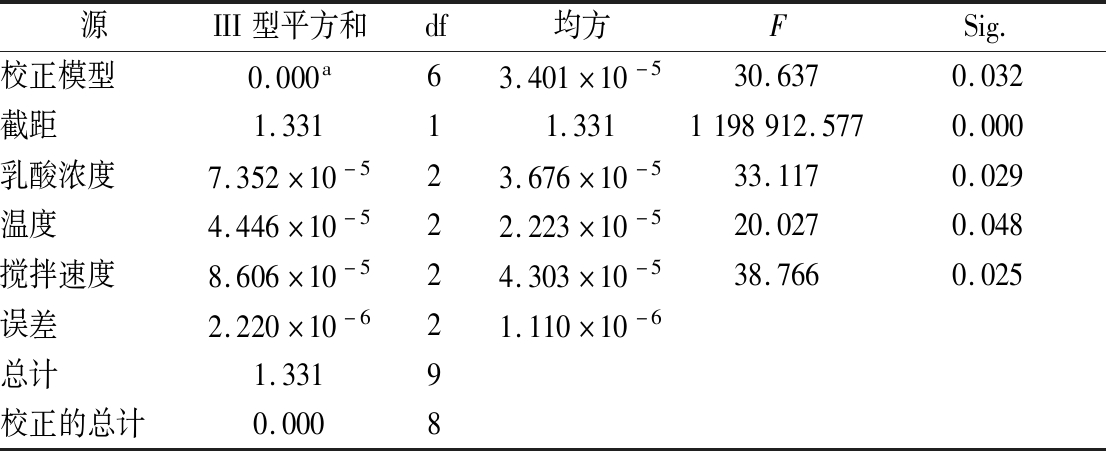
源III型平方和df均方FSig.校正模型0.000a63.401×10-530.6370.032截距1.33111.3311198912.5770.000乳酸浓度7.352×10-523.676×10-533.1170.029温度4.446×10-522.223×10-520.0270.048搅拌速度8.606×10-524.303×10-538.7660.025误差2.220×10-621.110×10-6总计1.3319校正的总计0.0008
注:a. R2=0.989(调整 R2=0.957)
图5中的a、b、c、d、e、f分别是未加胰蛋白酶、按0.1∶1、0.15∶1、1∶1、2∶1、3∶1的酶钙质量比添加胰蛋白酶调控制备的牡蛎壳碳酸钙的SEM图像。
2.3 胰蛋白酶调控对牡蛎壳纳米碳酸钙的形貌影响
根据1.3.4的牡蛎壳纳米碳酸钙制备方法,分别按0∶1、0.1∶1、0.15∶1、1∶1、2∶1、3∶1的酶钙质量比,往牡蛎壳活性钙乳酸溶提液中加入胰蛋白酶,搅拌溶解完全后,碳化法制备碳酸钙,制备产品充分洗涤后置于105 ℃的恒温鼓风干燥箱中干燥至恒重。对样品进行扫描电镜、外红光谱测试分析,研究胰蛋白酶调控对牡蛎壳纳米碳酸钙的形貌和结构的影响。
2.3.1 扫描电镜形貌分析
采用扫描电镜(SEM)测定分析不同量胰蛋白酶调控下制备的牡蛎壳碳酸钙产品的形貌和粒径差别。
从图5-a中可见,牡蛎壳乳酸溶提钙液在未添加胰蛋白酶的情况下,碳化形成的碳酸钙是由许多纳米级的球状颗粒紧密团聚而成的直径为5 ~ 10 μm的微球,外观形貌与王芬等用CaCl2溶液碳化法制备的碳酸钙相似[16];图5-b、5-c显示,按0.1∶1和0.15∶1的酶钙质量比加入不同量的胰蛋白酶调控,碳化制备的碳酸钙微球粒径虽有所下降,但尺度仍在1 μm以上。物质之间一般按摩尔比例相互作用,考虑胰蛋白酶分子量为24 000 Da,跟Ca2+相比,比较大,故提高了酶钙质量比至1∶1、2∶1、3∶1,由图5-d、5-e、5-f可见,碳酸钙微球粒径随着胰蛋白酶添加量增大明显减小,纳米颗粒的团聚由紧密趋向蓬松,微球大小均一性也越来越好。由图5-f可知,按3∶1酶钙质量比添加了胰蛋白酶调控碳化制备碳酸钙,可制备得到大小均一、粒径300~400 nm的蓬松微球。SEM表征结果说明胰蛋白酶的添加能有效分散纳米碳酸钙,防止纳米碳酸钙的团聚,这对补钙制剂或食品钙强化剂的开发具有重大的意义,将有助于提高钙的吸收利用。

a→f-酶钙质量比:0∶1、0.1∶1、0.15∶1、1∶1、2∶1、3∶1
图5 不同量胰蛋白酶调控下制备的碳酸钙的扫描电镜图
Fig.5 Scanning electron microscope of calcium carbonate prepared under the control of different amounts of trypsin
2.3.2 红外光谱分析
不同晶型的碳酸钙具有不同的红外光谱特征峰,方解石碳酸钙的红外特征吸收峰主要在1 462、876和712 cm-1;文石碳酸钙特征吸收峰在1 485、1 082、875、712和700 cm-1;球霰石的特征吸收峰为1 490~1 420、1 085 cm-1、1 070、870~830和743 cm-1。方解石、文石和球霰石的主要鉴别位点分别在712、700和743 cm-1 [16-17]。
采用红外光谱测定分析不同胰蛋白酶量调控制备的纳米碳酸钙晶型差别。牡蛎活性钙乳酸溶提液未加胰蛋白酶碳化制备的碳酸钙的红外图谱如图6所示,产品在1 459、1 084、876和745 cm-1等处出现明显特征峰。1 459 cm-1应该是球霰石碳酸钙![]() 的反对称伸缩振动吸收峰,1 084、876和745 cm-1分别为球霰石碳酸钙
的反对称伸缩振动吸收峰,1 084、876和745 cm-1分别为球霰石碳酸钙![]() 的对称伸缩振动、面外弯曲振动和面内弯曲振动吸收峰,说明制备的产品以球霰石型碳酸钙为主。
的对称伸缩振动、面外弯曲振动和面内弯曲振动吸收峰,说明制备的产品以球霰石型碳酸钙为主。
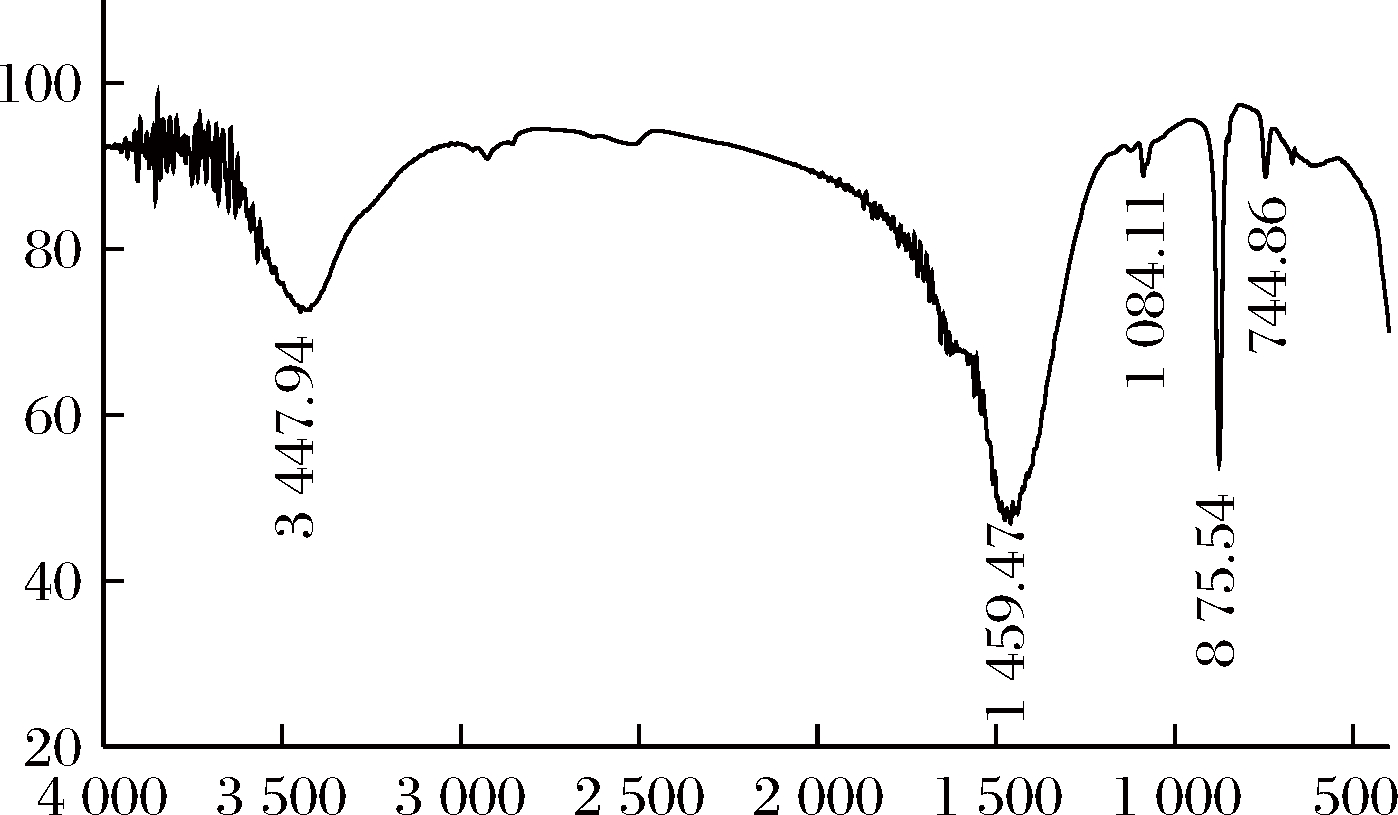
图6 未加胰蛋白酶的碳酸钙红外谱图
Fig.6 Infrared spectrum of calcium carbonate without trypsin
而按3∶1酶钙质量比添加了胰蛋白酶后,碳化制备的牡蛎壳碳酸钙的红外谱图如图7所示,产品在1 583、1 428、1 315、1 122、1 045、859和750 cm-1等处出现特征峰。其中,1 428 cm-1处的分裂峰应该是球霰石碳酸钙![]() 的反对称伸缩振动吸收峰,1 122和1 045 cm-1附近的分裂峰、859和750 cm-1等应该分别为球霰石碳酸钙
的反对称伸缩振动吸收峰,1 122和1 045 cm-1附近的分裂峰、859和750 cm-1等应该分别为球霰石碳酸钙![]() 的对称伸缩振动、面外弯曲振动和面内弯曲振动吸收峰;而1 583和1 315 cm-1的特征峰应该是碳酸钙在碳化结晶过程中键合部分胰蛋白酶的酰胺键特征峰。红外谱图说明胰蛋白酶调控下制备的碳酸钙晶型没有改变,但碳酸钙纳米颗粒在团聚成微团时会夹杂部分有机质胰蛋白酶,降低微团的致密性和阻止微团粒径增长。为了进一步验证样品中夹杂有胰蛋白酶,取适量样品用稀酸溶解后,测定280 nm处吸光度值并换算出产品中的胰蛋白酶质量占比为(26.35%±2.18%),与马晓明等[21]用胃蛋白酶调控制备的碳酸钙产品含25.62%胃蛋白酶比较接近。
的对称伸缩振动、面外弯曲振动和面内弯曲振动吸收峰;而1 583和1 315 cm-1的特征峰应该是碳酸钙在碳化结晶过程中键合部分胰蛋白酶的酰胺键特征峰。红外谱图说明胰蛋白酶调控下制备的碳酸钙晶型没有改变,但碳酸钙纳米颗粒在团聚成微团时会夹杂部分有机质胰蛋白酶,降低微团的致密性和阻止微团粒径增长。为了进一步验证样品中夹杂有胰蛋白酶,取适量样品用稀酸溶解后,测定280 nm处吸光度值并换算出产品中的胰蛋白酶质量占比为(26.35%±2.18%),与马晓明等[21]用胃蛋白酶调控制备的碳酸钙产品含25.62%胃蛋白酶比较接近。

图7 加胰蛋白酶的碳酸钙红外谱图
Fig.7 Infrared spectrum of calcium carbonate with trypsin
蔗糖、牛血清白蛋白等糖类和蛋白质类物质作为晶型控制剂调控球霰石型碳酸钙的形成,主要是因为添加剂中的—OH、—COOH等极性官能团和C—O等极性键会与碳酸钙发生作用,诱导球霰石型的生成[17,20]。研究显示胰蛋白酶调控下对牡蛎壳活性钙乳酸溶提液碳化制备的碳酸钙晶型没有影响,可能是因为体系介质中本来就含带—OH、—COOH等极性官能团和C—O极性键的乳酸,可诱导球霰石型碳酸钙的生成,故添加胰蛋白酶调控只影响碳酸钙微团的致密性和粒径,不影响晶型。
3 结论
牡蛎壳洗净粉碎成100目粉末,乳酸溶提活性钙液后通入CO2,可碳化制备球霰石型纳米颗粒团聚而成的微球。单因素结合正交试验确定了乳酸溶提牡蛎壳活性钙的最佳工艺条件:反应时长为30 min,乳酸浓度为2 moL/L,温度为50 ℃,搅拌速度为350 r/min,在此最佳条件下,牡蛎壳活性钙的溶提率可达39.46%,乳酸基本能将牡蛎壳中的钙溶解出来。单因素实验数据方差分析显示乳酸浓度、温度、搅拌速度均对钙溶提率有显著性影响,但反应时间对钙溶提率没有显著性影响;正交试验结果表明乳酸浓度、温度、搅拌速度等3个因素对钙提取率的影响主次顺序为:搅拌速度>乳酸浓度>温度。
考察牡蛎壳活性钙乳酸溶提液在胰蛋白酶调控下,碳化结晶生成的碳酸钙的形貌及粒径等的变化。扫描电镜和红外光谱的结果表明,与没有胰蛋白酶调控下制备的碳酸钙晶体比较,胰蛋白酶调控下制备的碳酸钙晶型没有改变,均为球霰石型;但在胰蛋白酶存在下,碳酸钙纳米颗粒在团聚成微球时会夹杂键合部分有机质胰蛋白酶,使纳米颗粒团聚蓬松,团聚而成的微球粒径由5~10 μm下降至300~400 nm,且大小较均一。得到的产品如果开发为补钙制剂或食品钙强化剂时,将更容易被溶解、吸收。
[1] 秦贞苗,邓静英,张丹蕾,等.超微粉碎对牡蛎壳粉体学性质和溶出度的影响[J].中国药房,2019,30(16):2 216-2 220.
[2] 林丹,孙敏秋,张克烽,等.福建牡蛎产业发展形势分析[J].中国水产,2019(3):53-57.
[3] LEVI-KALISMAN Y,FALINI G,ADDADI L,et al.Structure of the nacreous organic matrix of a bivalve mollusk shell examined in the hydrated state using cryo-TEM[J].Journal of Structural Biology,2001,135(1):8-17.
[4] 杨韵,徐波.牡蛎的化学成分及其生物活性研究进展[J].中国现代中药,2015,17(12):1 345-1 349.
[8] 赵晖,宣卫红,封家蕊,等.废弃贝壳循环再生利用技术研究进展[J].金陵科技学院学报,2019,35(1):34-39.
[6] 陈聪,刘淇,魏玉西,等.牡蛎壳丙酸钙的非煅烧法制备工艺及其抑菌活性研究[J].食品工业科技,2010,31(3):245-247.
[7] 范峥,杨栩,关嘉庆,等.以废弃牡蛎壳为原料制备食品级醋酸钙[J].食品工业科技,2015,36(10):254-258.
[8] 杨栩,蒙芸.以牡蛎壳为原料制备食品级乳酸钙[J].当代化工,2015,44(2):237-239.
[9] 邓勤,赖家凤,梁兴唐,等.牡蛎壳制备柠檬酸钙的工艺研究[J].食品工业科技,2017,38(11):251-254.
[10] 王家明,魏玉西,殷邦忠,等.以牡蛎壳为钙源的谷氨酸螯合钙制备工艺研究[J].中国海洋药物,2010,29(2):22-26.
[11] 邵江娟,王唯,陈斌寅,等.以牡蛎壳为钙源的L-天冬氨酸螯合钙的合成及其生物利用度研究[J].南京中医药大学学报,2012,28(4):371-373.
[12] 李文艳. 牡蛎壳为原料制备纳米碳酸钙及表面改性的研究[D].西安:西北大学,2009.
[13] 李佳,韩丽娜,韦玮,等.牡蛎在补钙方面的研究进展[J].内蒙古中医药,2019,38(3):90-91.
[14] 刘文,李天华,张滕军,等.牡蛎壳中钙的改性及吸附特性的研究[J].材料导报,2012,26(18):88-92.
[15] 汪小红,张群,董晓庆,等.超声辅助的荔枝状球霰石的制备与表征[J].人工晶体学报,2013,42(10):2 164-2 169.
[16] 王芬,余军霞,肖春桥,等.CO2碳化法制备微米级球霰石型食品碳酸钙的研究[J].硅酸盐通报,2017,36(1):43-50;56.
[17] 欧阳志远,杨磊,刘艳茹,等.镁离子/蔗糖体系中碳酸钙结晶的仿生合成初步研究[J].电子显微学报,2019,38(3):264-270.
[18] 丁唯嘉,安英格,杨林,等.3种变性淀粉与CaCO3相互作用的红外光谱研究[J].光谱学与光谱分析,2005,25(5):701-704.
[19] PÉREZ-VILLAREJO L,TAKABAIT F,MAHTOUT L,et al.Synthesis of vaterite CaCO3 as submicron and nanosized particles using inorganic precursors and sucrose in aqueous medium[J].Ceramics International,2018(44):5 291-5 296.
[20] LIU Y,CHEN Y,HUANG X,et al.Biomimetic synthesis of calcium carbonate with different morphologies and polymorphs in the presence of bovine serum albumin and soluble starch[J].Materials Science and Engineering C,2017(79):457-464.
[21] 马晓明,司媛媛,杨林,等.胃蛋白酶指导下水醇体系中碳酸钙的仿生合成与表征[J].厦门大学学报(自然科学版),2011,50(4):742-747.
[22] 熊科,邓蕾,柳佳芸,等.蛋白酶水解底物特异性机制研究进展[J].食品与发酵工业,2019,45(19):292-298.
[23] 岳晓禹,范露露,蔡青和,等.猪胰脏中胰蛋白酶提取条件优化[J].中国酿造,2019,38(9):130-133.
[24] 伊涛. 内镜下胰蛋白酶局部注射法治疗消化性溃疡出血的效果探究[J].当代医药论丛,2020,18(1):165-166.
[25] 张伟. 注射用胰蛋白酶配合关节镜手术治疗膝骨性关节炎临床研究[J].系统医学,2019,4(19):49-51.
[26] 许永,尚雷,马超,等.注射用胰蛋白酶配合手术治疗股骨粗隆骨折临床研究[J].中外医疗,2019(32):38-40.