油莎豆 (Cyperus esculentus L.) 又名油莎草、油莎果、地下板栗、地下核桃,为一年生作物[1]。由于具有适应性广、产量大、含油量高的生物学特点,同时集粮、油、牧、饲为一体,油莎豆在经济、环保、社会各方面都具有极高的利用价值[2]。油莎豆中营养成分丰富,尤其油脂含量较高。而油莎豆油中含有大量单不饱和脂肪酸和多不饱和脂肪酸,如油酸、亚油酸、亚麻酸等,是一种高营养价值植物油[3]。同时,通过对多种油料作物的能源利用潜力进行综合评估,表明油莎豆是适宜我国种植的理想油料作物[4]。
油莎豆原料经压榨或浸出法得到的油被称为毛油。毛油中含有较多胶溶性杂质,包括磷脂、黏液质、蛋白质等,这些杂质的存在使油脂稳定性下降,不利于储藏和加工,且会对油脂的其他精炼程序造成不良影响[5]。因此,为了去除杂质,提高油脂稳定性,脱胶便成为精制过程中的必要环节。常见的脱胶方法为水化脱胶,但该方法只能够去除水化磷脂,而非水化磷脂依然保留在油中。酸法脱胶是通过加酸使非水化磷脂转化为水化磷脂,再转移到水相中去除[6]。因此,本实验采用酸法脱胶对毛油进行脱胶处理。此外,经过脱胶后的油中还存在大量游离脂肪酸,易使油脂酸败水解、氧化,稳定性降低,使油脂风味、储藏等都受影响。为降低酸值,在脱胶后需要进行脱酸处理,以获得优质精制油用于食用生产[7]。毛油常见的脱酸方法为碱炼脱酸法,但该法脱酸时使用苛性碱,油脂在碱作用下容易发生水解,造成油脂损耗[8]。酯化法脱酸是通过加入醇中和油中的游离脂肪酸,从而降低游离脂肪酸的含量[9]。因此,本实验采用酯化法对脱胶油进行脱酸处理。
目前有关油莎豆毛油脱胶和脱酸的研究较少,因此,本实验采取索氏提取法获得油莎豆毛油,通过单因素试验和正交试验分别研究油莎豆油脱胶和脱酸的最优工艺条件,并对精炼前后油的理化性质、脂肪酸组成、主要官能团结构和热力学性质进行分析,以期为油莎豆油的精炼以及油莎豆的综合利用提供参考。
1 材料与方法
1.1 材料与仪器设备
1.1.1 原料与试剂
油莎豆,购自河北省定州市;石油醚(沸程60~90 ℃)、正己烷、活性炭、CuSO4、Al2O3、KNO3、甲醇、甲醇钠、NaOH、KOH、Na2CO3、酚酞、乙醇、甲苯、三氯乙酸、2,4-二硝基苯肼、三氯甲烷、冰乙酸、KI、Na2S2O3、氯仿、淀粉指示剂、韦氏试剂等均为市售分析纯。
1.1.2 仪器
FW135型中草药粉碎机,天津市泰斯特仪器有限公司;RE-52AA型旋转蒸发器、SHZ-Ⅲ型循环水真空泵,上海亚荣生化仪器厂;7890A-5975C型气相色谱-质谱联用仪,安捷伦科技(中国)有限公司;DZF-6020型真空干燥箱,上海齐欣科学仪器有限公司;DF-101S恒温加热磁力搅拌器,河南予华仪器有限公司;UV-1200 型紫外可见分光光度计,翱艺仪器(上海)有限公司;LD5-2A型离心机,上海医用离心机厂;LICHEN 2.5-10型马弗炉,上海力辰科技仪器有限公司;Nicolet IS10傅里叶变换红外光谱仪,赛默飞世尔公司;Q200M DSC差示扫描量热仪,美国TA公司。
1.2 试验方法
1.2.1 油莎豆油的提取
油莎豆油的提取按照GB 5009.6—2016《食品中脂肪的测定》采用索氏提取法进行。准确称取烘干粉碎后的油莎豆粉移入滤纸筒内。将滤纸筒放入索氏抽提器的抽提筒内,连接已干燥至恒重的接收瓶,由抽提器冷凝管上端加入正己烷至瓶内容积的2/3处,调整温度至80 ℃,于水浴上加热,回流抽提6 h。提取结束时,经过滤、旋转蒸发去除溶剂后,得到油莎豆毛油,提取率为29.46%。
1.2.2 油莎豆油脱胶工艺的优化
1.2.2.1 脱胶工艺操作要点
参考牛玉芝[10]的方法,取适量油莎豆油于二颈烧瓶中,置于恒温磁力搅拌器上,加热到一定温度,预热5 min后,加入一定量磷酸,连续搅拌,然后加入3%油质量的同温蒸馏水,搅拌一定时间后,沉降、离心得到脱胶油[6]。由于毛油中胶体物质以磷脂为主,磷脂含量高低是评价脱胶效果的重要指标,通过测定油脂中磷脂的含量来反映脱胶效果,结果用脱胶率表示,如公式(1)所示:
脱胶率![]()
(1)
式中:ω1,脱胶前磷脂质量分数,mg/g;ω2,脱胶后磷脂质量分数,mg/g。
1.2.2.2 单因素试验
(1)脱胶时间对脱胶率的影响:设定脱胶温度为70 ℃、磷酸添加量(质量分数,下同)为0.2%,研究不同脱胶时间(10、20、30、40、50 min)对油莎豆油脱胶率的影响。
(2)脱胶温度对脱胶率的影响:设定脱胶时间为30 min、磷酸添加量为0.2%,研究不同脱胶温度(40、50、60、70、80 ℃)对油莎豆油脱胶率的影响。
(3)磷酸添加量对脱胶率的影响:设定脱胶时间为30 min、脱胶温度为60 ℃,研究不同H3PO4添加量(0.1%、0.15%、0.2%、0.25%、0.3%)对油莎豆油脱胶率的影响。
1.2.2.3 正交试验
在单因素试验的基础上,以脱胶时间、脱胶温度、磷酸添加量的3个不同水平,设计L9(33)正交试验,以优化最佳的脱胶工艺条件。
1.2.3 油莎豆油脱酸工艺的优化
1.2.3.1 脱酸工艺操作要点
参考孙协军等[9]的方法,取适量上述脱胶油于锥形瓶中,置恒温磁力搅拌器上。加热到一定温度,预热5 min后,按一定醇油物质的量比向锥形瓶中加入甲醇和一定量浓H2SO4进行酯化反应,当油皂分离,停止搅拌,转移至分液漏斗中,加热水洗涤至下层水样呈中性,分离出废水,将上层油样收集至离心管中,2 500 r/min离心5 min后取出,吸取上清液,真空干燥脱除残留甲醇,得到脱酸油。由于游离脂肪酸的存在会使油脂发生酸败,酸值的高低是评价脱酸效果的重要指标,通过测定油脂中的酸值来反映脱酸效果,结果用脱酸率来表示,如公式(2)所示:
脱酸率![]()
(1)
式中:ω3,脱酸前磷脂质量分数,mg/g;ω4,脱酸后磷脂质量分数,mg/g。
1.2.3.2 单因素试验
(1)脱酸温度对脱酸率的影响:设定脱酸时间60 min、醇油物质的量比10∶1、浓H2SO4添加量3%(体积分数),研究不同脱酸温度(40、50、60、70、80 ℃)对油莎豆油脱酸率的影响。
(2)脱酸时间对脱酸率的影响:设定脱酸温度60 ℃、醇油物质的量比10∶1、浓H2SO4添加量3%,研究不同脱酸时间(40、50、60、70、80 min)对油莎豆油脱酸率的影响。
(3)浓H2SO4添加量对脱酸率的影响:设定脱酸温度60 ℃、脱酸时间60 min、醇油物质的量比10∶1,研究不同浓H2SO4添加量(2%、2.5%、3%、3.5%、4%)对油莎豆油脱酸率的影响。
(4)醇油物质的量比对脱酸率的影响:设定脱酸温度60 ℃、脱酸时间60 min、浓H2SO4添加量3%,研究不同醇油物质的量比(6∶1、8∶1、10∶1、12∶1、14∶1)对油莎豆油脱酸率的影响。
1.2.3.3 正交试验
在单因素试验的基础上,选择脱酸时间、脱酸温度、醇油物质的量比、浓H2SO4添加量的3个不同水平上设计L9(34)正交试验,以优化最佳的脱酸工艺条件。
1.2.4 油莎豆油的分析与表征
1.2.4.1 理化特征分析
皂化值按照GB/T 5534—2008《动植物油脂 皂化值的测定》进行;碘值按照GB/T 5532—2008《动植物油脂 碘值的测定》测定;酸价按照GB 5009.229—2016《食品安全国家标准 食品中酸价的测定》进行;过氧化值按照GB/T 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》进行;磷脂按照 GB/T 5537—2008《粮油检验 磷脂含量的测定》进行。
1.2.4.2 差示热量扫描(differential scanning calorimetry,DSC)分析
取10 μL油样于铝制微型坩埚中,将坩埚封口,环境气体为高纯度N2,流速50 mL/min,以空坩埚作为空白对照。以50 ℃为初始温度,保持3 min后,以10 ℃/min的速率降至-70 ℃并保持3 min,再以10 ℃/min的速率升至50 ℃,记录其放热与吸热曲线。
1.2.4.3 红外光谱分析
以KBr作为载体,采用涂布法,扫描波数范围400~4 000 cm-1,分辨率4 cm-1,扫描32次,以KBr盐窗作为背景采集。扣除背景后,对红外光谱图进行分析。
1.2.4.4 GC-MS分析
样品甲酯化按照GB 5009.168—2016的方法处理。GC条件:Agilent HP-5MS气相色谱柱(30 m×250 μm×0.25 μm);载气为高纯度N2;起始温度为120 ℃,保持1 min后,采用程序升温的方式,升高至240 ℃,保持3 min;进样量为1 μL;分流比为20∶1;柱流量为1 mL/min。MS条件:全扫描方式;接口温度250 ℃,离子源温度230 ℃,四级杆温度为150 ℃;质谱扫描质荷比(m/z)为50~550 μ。经过GC-MS分析后,所得各组分峰相关信息通过NIST 11.L检索库进行对比定性,同时各成分含量以峰面积归一法计算[11-12]。
2 结果与分析
2.1 脱胶工艺优化
2.1.1 单因素试验
2.1.1.1 脱胶时间对脱胶率的影响
由图1-a可知,随着时间增加,脱胶率呈先上升后下降趋势,并且在30 min时达到最大值。LIU等[11]研究表明,磷脂从浸润到完成水化需要一定的时间才能达到水与油混合的目的。同时,略微延长时间可使磷脂充分凝聚形成胶体,促进脱胶正向进行[14]。若脱胶时间过长,可能会发生逆反应,使已凝聚的磷脂重新分散至水体中,从而出现脱胶率降低结果,同时造成油脂乳化,这与张红等[12]对菜籽油的脱胶研究结果一致。因此脱胶时间选择30 min为宜。
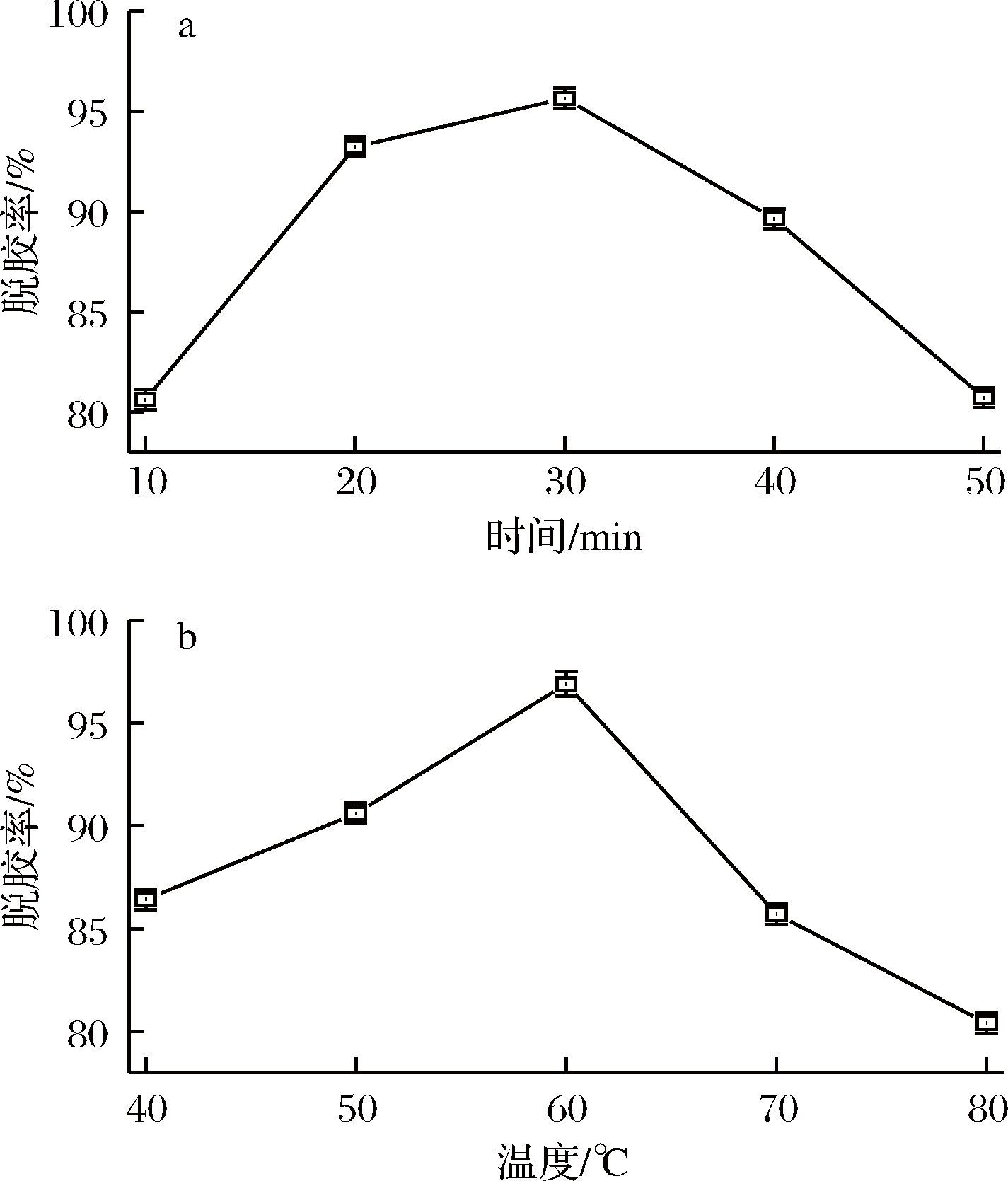
图1 脱胶时间(a)和温度(b)对脱胶效果的影响
Fig.1 Effect of time and temperature on degumming result
2.1.1.2 脱胶温度对脱胶率的影响
由图1-b可知,随着温度升高,脱胶率呈先升高后下降趋势,且在60 ℃时达到最大值。COSTA等[13]对于不同脱胶方式效果的研究表明,在温度较低时,升高温度,可降低油的黏度,使磷脂水合能力增强,易凝聚形成胶体,使其在后续离心等过程中易于被去除。同时,磷脂形成胶体的过程可逆,超过胶体凝聚的临界温度后,已形成的胶体可能会重新离解分散,导致磷脂含量增加,脱胶率降低[14]。因此脱胶温度选择60 ℃为宜。
2.1.1.3 磷酸添加量对脱胶率的影响
由图2可知,随着磷酸添加量增加,脱胶率呈先上升后下降趋势,且在质量分数0.15%时出现最大值。这是由于磷脂包括水化磷脂与非水化磷脂,利用磷脂的双亲性,磷酸可辅助其将非水化磷脂转化为水化磷脂,再经过凝聚形成胶体将其去除[15]。通过增加磷酸添加量,可以使磷酸与磷脂的接触几率增大,水化磷脂转化率提高,当使用0.15%磷酸时,便可将大多非水化磷酸转化为水化磷酸,此时油脂中磷脂含量最低,脱胶率最高,与GHAZANI等[16]的研究结果相似。若继续添加磷酸,多余的游离磷酸可能会破坏已经凝聚的磷脂胶体,从而出现脱胶率下降的现象。因此磷酸添加量(质量分数)选择0.15%为宜。
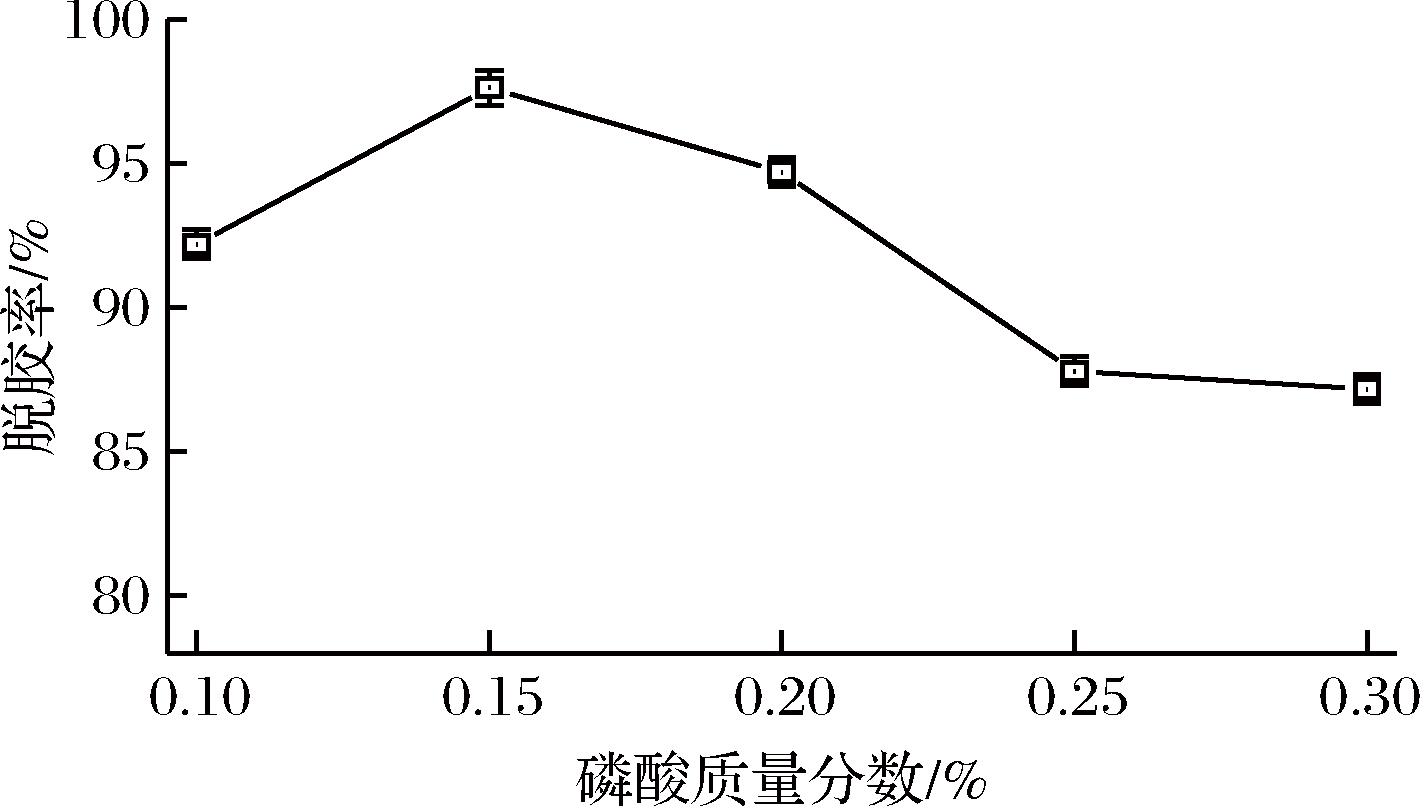
图2 磷酸添加量对脱胶效果的影响
Fig.2 Effect of phosphoric acid concentration on degumming result
2.1.2 正交试验优化
根据单因素试验的结果,设计脱胶时间、脱胶温度、磷酸添加量的3个不同水平,进行L9(33)正交试验,试验设计及结果见表1。
表1 脱胶工艺的正交实验设计及结果
Table 1 Design and results of orthogonal test design of degumming
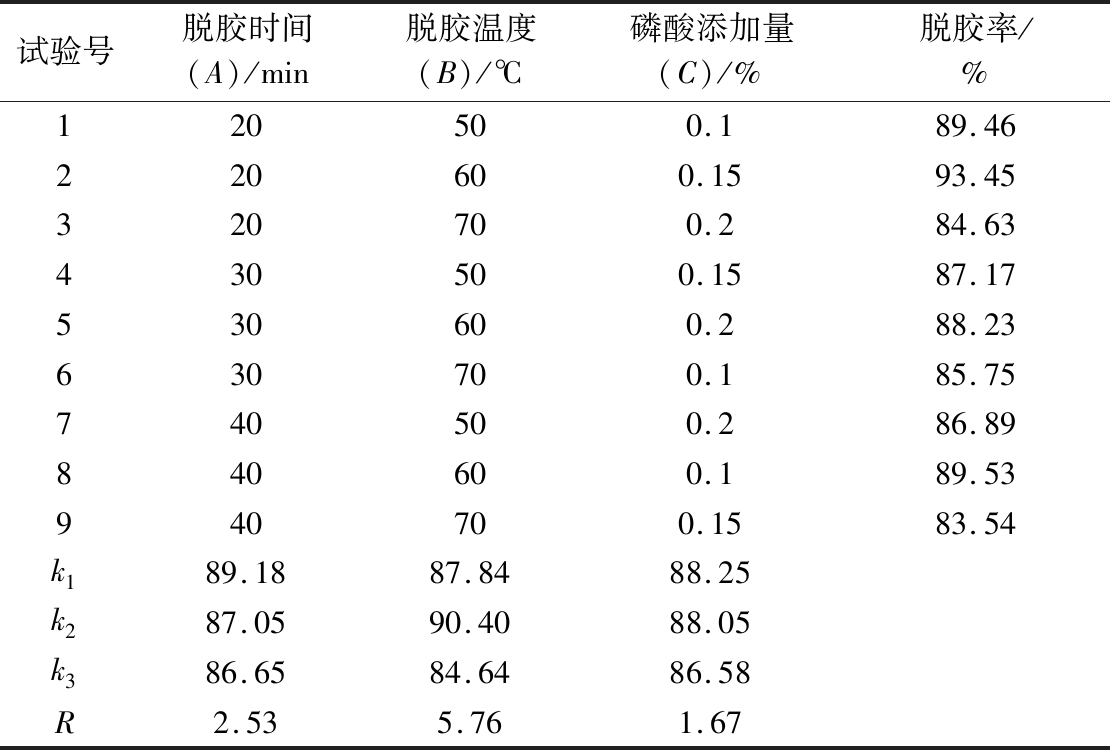
试验号脱胶时间(A)/min脱胶温度(B)/℃磷酸添加量(C)/%脱胶率/%120500.189.46220600.1593.45320700.284.63430500.1587.17530600.288.23630700.185.75740500.286.89840600.189.53940700.1583.54k189.1887.8488.25k287.0590.4088.05k386.6584.6486.58R2.535.761.67
由表1可知,各因素对脱胶率影响大小的主次顺序为:B>A>C,即脱胶温度对脱胶率的影响最大,其次是脱胶时间,磷酸添加量的影响最小,最佳工艺组合为A1B2C1,即脱胶时间20 min,脱胶温度60 ℃,磷酸添加量(质量分数)0.10%。为了验证工艺可行性,在该条件下进行3次平行验证实验,测得磷脂含量为(0.98±0.05)mg/g,此时脱胶率为92.85%。该工艺的脱胶率与单因素实验结果相比较明显缩短了脱胶时间,减少了能耗。因此,该脱胶工艺可以作为最佳工艺组合进行油莎豆毛油的脱胶处理。
2.2 脱酸工艺优化
2.2.1 单因素试验结果
2.2.1.1 脱酸温度对脱酸率的影响
由图3-a可知,随着反应温度升高,油莎豆油的脱酸率呈现先上升后下降趋势,并在60 ℃时出现最高值。SAKA等[17]的研究表明随温度升高,酯化反应速率加快,温度持续升高,反应逐渐趋于平稳,但当反应温度高于甲醇沸点时,甲醇损失增加,导致酯化反应体系中底物减少,从而使脱酸率降低。因此脱酸时间选择60 ℃为宜。
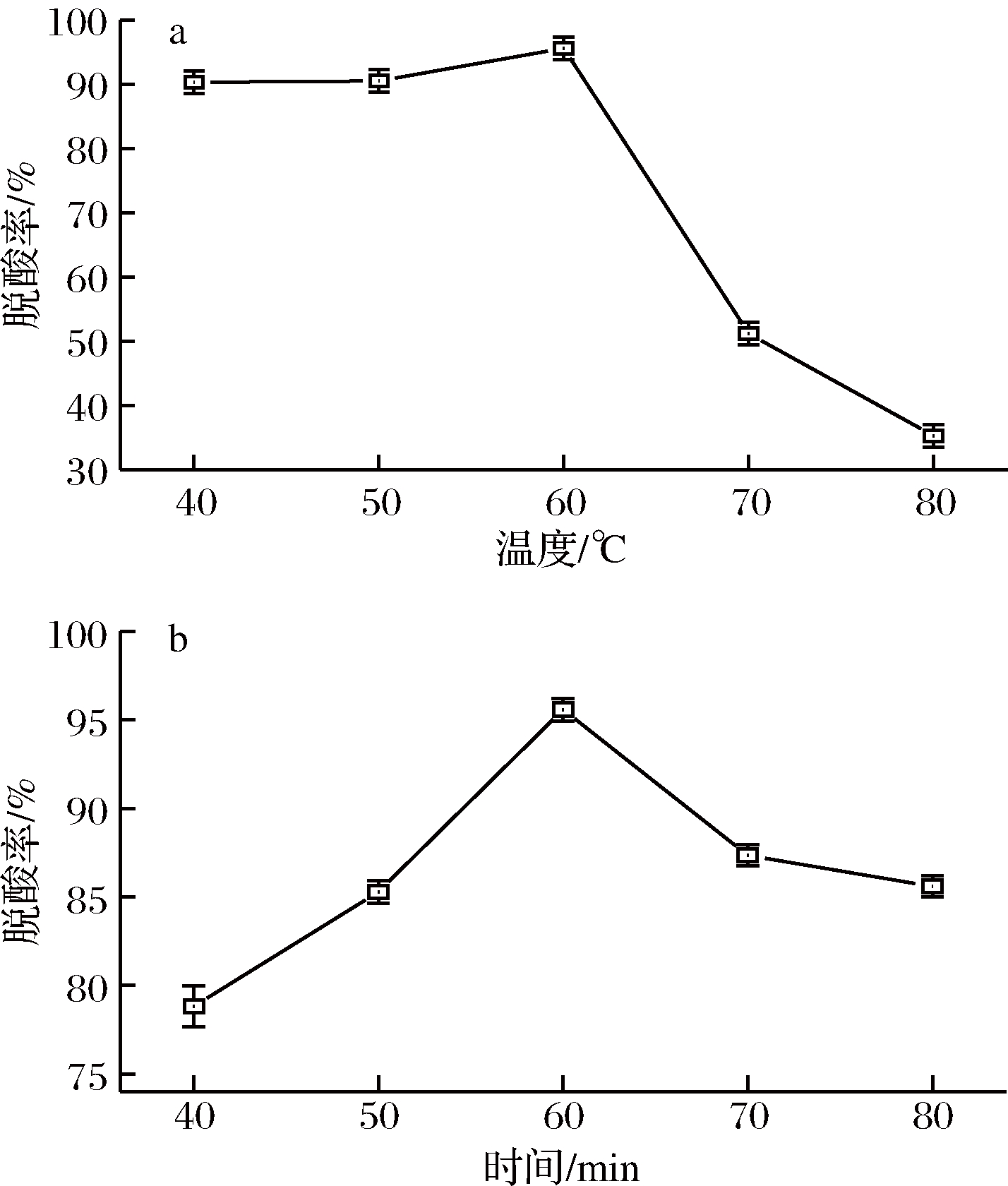
图3 脱酸温度(a)和时间(b)对脱酸效果的影响
Fig.3 Effect of temperature and time on deacidification results
2.2.1.2 脱酸时间对脱酸率的影响
由图3-b可知,随着时间延长,脱酸率呈现先上升后下降趋势,并在60 min时出现最高值。这是由于酯化反应为可逆反应,随时间延长,反应持续向正反应方向进行,产物增加,底物减少;KOUZU等[18]的研究表明,当产物过多时不利于正反应进行,达到60 min后,脱酸率降低;同时,游离脂肪酸在甲醇中的溶解量也趋于饱和,正反应进行缓慢,不利于酯化反应。因此脱酸时间选择60 min为宜。
2.2.1.3 浓H2SO4添加量对脱酸率的影响
由图4-a可知,随着催化剂用量增大,脱酸率呈现先上升后下降趋势,并在浓H2SO4添加质量分数为3%时出现最高值。这是由于浓H2SO4作为酯化反应的催化剂,加快反应速率,促使酯化反应向正反应方向进行;同时作为失水剂,减少副产物中的水分含量,提高酯的纯度;但当浓H2SO4过量时,在一定程度上会降低该体系的脱酸率,在该反应温度和时间下过量的浓H2SO4可能使油脂发生炭化,从而导致副反应的发生,降低酯化反应速率,使脱酸率降低[19]。董英等[20]用浓H2SO4为催化剂对米糠毛油进行脱酸处理时,也得出了类似结论。因此浓H2SO4添加质量分数选择3%为宜。
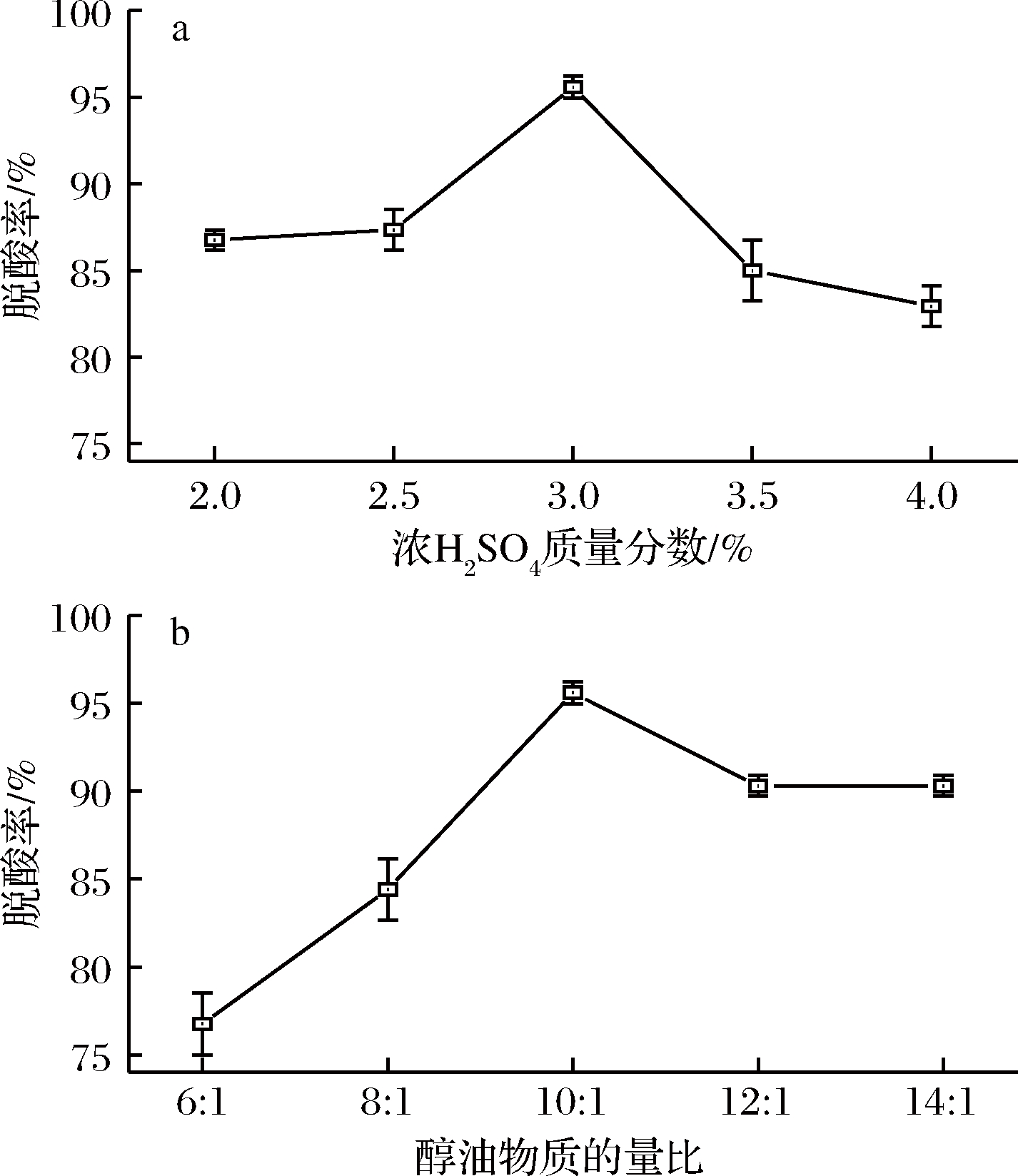
图4 浓H2SO4添加量(a)和 醇油物质的量比(b)对脱酸效果的影响
Fig.4 Effect of H2SO4 concentration and methanol to oil molar ratio on deacidification results
2.2.1.4 醇油物质的量比对脱酸率的影响
由图4-b可知,随着醇油物质的量比增大,脱酸率呈现先上升后下降的趋势,并在醇油物质的量比为10∶1时出现最高值。这是由于随醇油物质的量比增大,甲醇增多,有利于酯化反应向正反应方向进行。孙协军等[9]的研究表明,当甲醇过量时会使油中的游离脂肪酸和催化剂浓度相对降低,不利于反应物分子与催化剂活性中心接触,且会使此反应体系中的流体性质发生改变,从而不利于酯化反应进行,降低脱酸率。因此醇油物质的量比选择10∶1为宜。
2.2.2 正交试验优化
根据单因素试验的结果,设计脱酸时间、脱酸温度、醇油物质的量比、浓H2SO4量添加量4因子在3个不同水平,进行L9(34)正交试验,试验设计及结果见表2。
由表2可知,各因素对油莎豆脱胶油酸值影响大小的主次顺序为A>D>C>B,即温度>醇油物质的量比>浓H2SO4添加量>时间,最佳酯化反应条件为A2B3C3D1。为了验证该工艺条件的可行性,通过3次验证实验,得到的酸值为(0.36±0.01)mg KOH/g,脱酸率为95.78%。鉴于反应时间对脱酸率的影响相对较低,为了节约能耗,将脱酸时间由70 min减少为60 min,即在脱酸温度60 ℃,浓H2SO4添加量(质量分数)3%,醇油物质的量比为10∶1条件下进行3次验证实验,得到的酸值为(0.35±0.01)mg KOH/g,脱酸率为95.62%,表明减少脱酸时间没有对脱酸率产生显著影响,该工艺脱酸效果良好,可作为最佳工艺组合用于油莎豆脱胶油的脱酸处理。
表2 脱酸工艺的正交实验设计及结果
Table 2 Design and results of orthogonal test design of deacidification
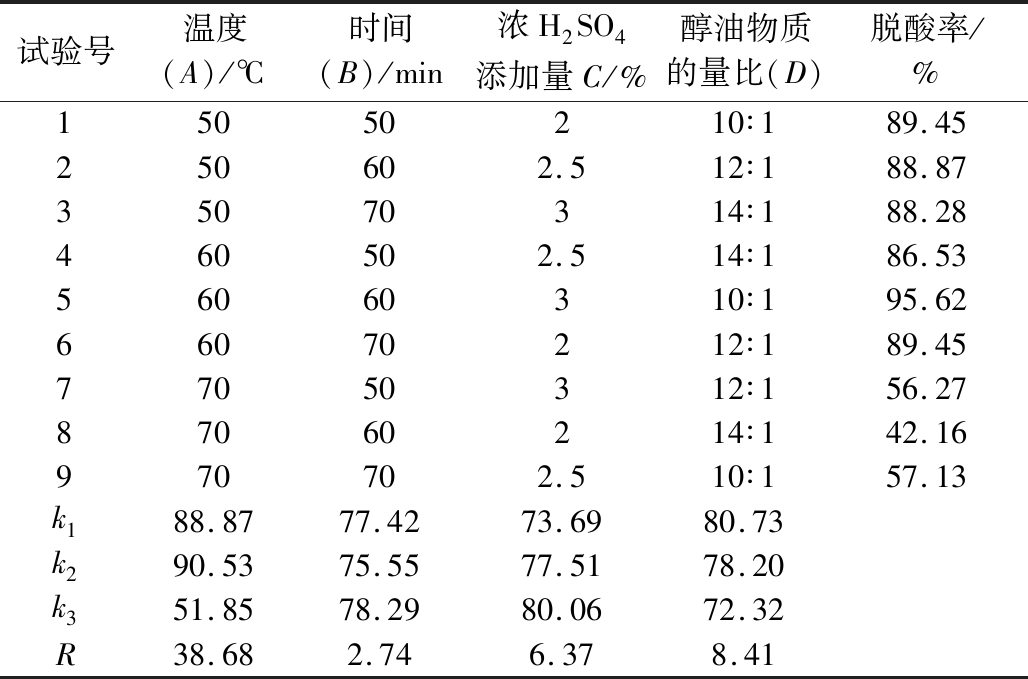
试验号温度(A)/℃时间(B)/min浓H2SO4添加量C/%醇油物质的量比(D)脱酸率/%15050210∶189.45250602.512∶188.8735070314∶188.28460502.514∶186.5356060310∶195.6266070212∶189.4577050312∶156.2787060214∶142.16970702.510∶157.13k188.8777.4273.6980.73k290.5375.5577.5178.20k351.8578.2980.0672.32R38.682.746.378.41
2.3 油莎豆油理化特征分析
由表3可知,油莎豆毛油经过脱胶和脱酸处理后,其皂化值、碘值差异不显著,说明脱胶和脱酸工艺没有对油莎豆油的分子量分布和脂肪酸饱和度产生影响。而酸值、过氧化值和磷脂含量显著降低,尤其酸值和过氧化值均符合GB 2716—2018《食品安全国家标准 植物油》中关于酸值(<4 mg KOH/g)和(≤0.25 g/100 g)的限量要求。此外,精制后的油透明澄清,色泽较淡,具有油脂特有的风味,这表明油莎豆毛油通过降低磷脂、酸值和过氧化值含量提高了油脂的品质。冉军舰等[21]在对樱桃仁毛油进行脱胶和脱酸处理时也得出类似结论。
表3 油莎豆毛油与精制油理化特征值比较
Table 3 Physical and chemical characteristic values of C.esculentus oil and refined oils

油样皂化值/(mgKOH·g-1)碘值/[gI2·(100g)-1]过氧化值/[g·(100g)-1]酸值/(mgKOH·g-1)磷脂含量/(mg·g-1)毛油181.06±2.1361.22±1.750.66±0.037.11±0.4524.45±0.12精制油176.03±1.8759.73±1.370.21±0.02∗0.35±0.01∗0.93±0.06∗
注:*表示诧异显著,P<0.05
2.4 GC-MS分析
由图5和表4可知,油莎豆毛油和精制油的主要脂肪酸组成相同,分别为棕榈酸、亚油酸、油酸、十二烷酸、反-9-十八碳烯酸和硬脂酸。由此可知,精制过程未对油莎豆油所含脂肪酸造成破坏,满足进一步加工的要求。此外,本实验获得的油莎豆油的脂肪酸组成与侯朝雷等[22]的报道相一致。
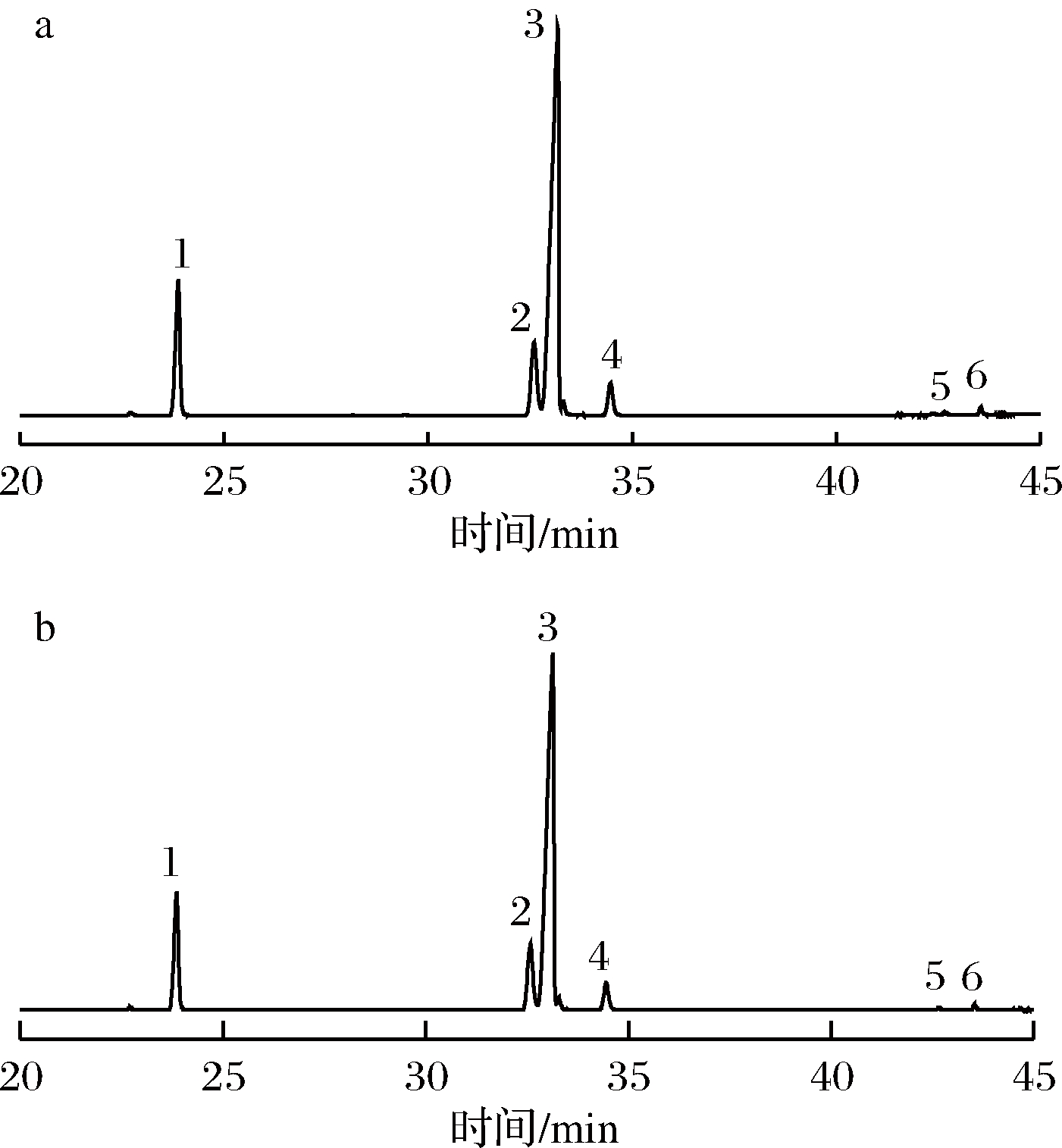
a-油莎豆毛油; b-精制油
1-棕榈酸;2-亚油酸;3-油酸;4-硬脂酸;5-二十烷酸;6-反-9-十八碳烯酸
图5 精制前后油样脂肪酸甲酯总离子流图
Fig.5 Total ionic flow diagram of fatty acid methyl ester extracted from the original and refining oils
表4 精制前后油样的脂肪酸组成及含量 单位:%
Table 4 Fatty acid composition and content of the original and refining oils
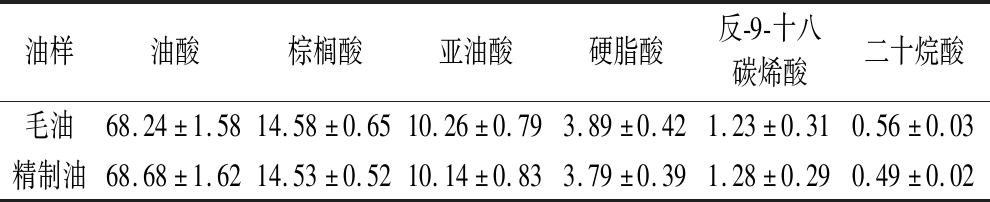
油样油酸棕榈酸亚油酸硬脂酸反-9-十八碳烯酸二十烷酸毛油68.24±1.5814.58±0.6510.26±0.793.89±0.421.23±0.310.56±0.03精制油68.68±1.6214.53±0.5210.14±0.833.79±0.391.28±0.290.49±0.02
2.5 DSC分析
DSC分析是一种应用较广泛的热分析法,与传统方法相比,样品试用量少,可以快速表征油脂的热力学特性[23]。图6是油莎豆毛油和精制油的结晶与熔融过程的DSC曲线。油莎豆毛油和精制油的吸热与放热曲线整体形状、峰型均相似,仅肩峰位置存在微小差异。升温过程中,2个油样的起始温度均在-65 ℃左右,出现1个主要吸热峰,峰值温度为-49 ℃左右。降温过程中,2个油样的起始温度均在2 ℃左右,出现1个主要放热峰,峰值温度为-5 ℃左右。表明脱胶和脱酸工艺没有对油莎豆油的热力学性质产生影响,这与2.4中油莎豆油的脂肪酸组成没有受到脱胶和脱酸工艺影响的结论相一致。
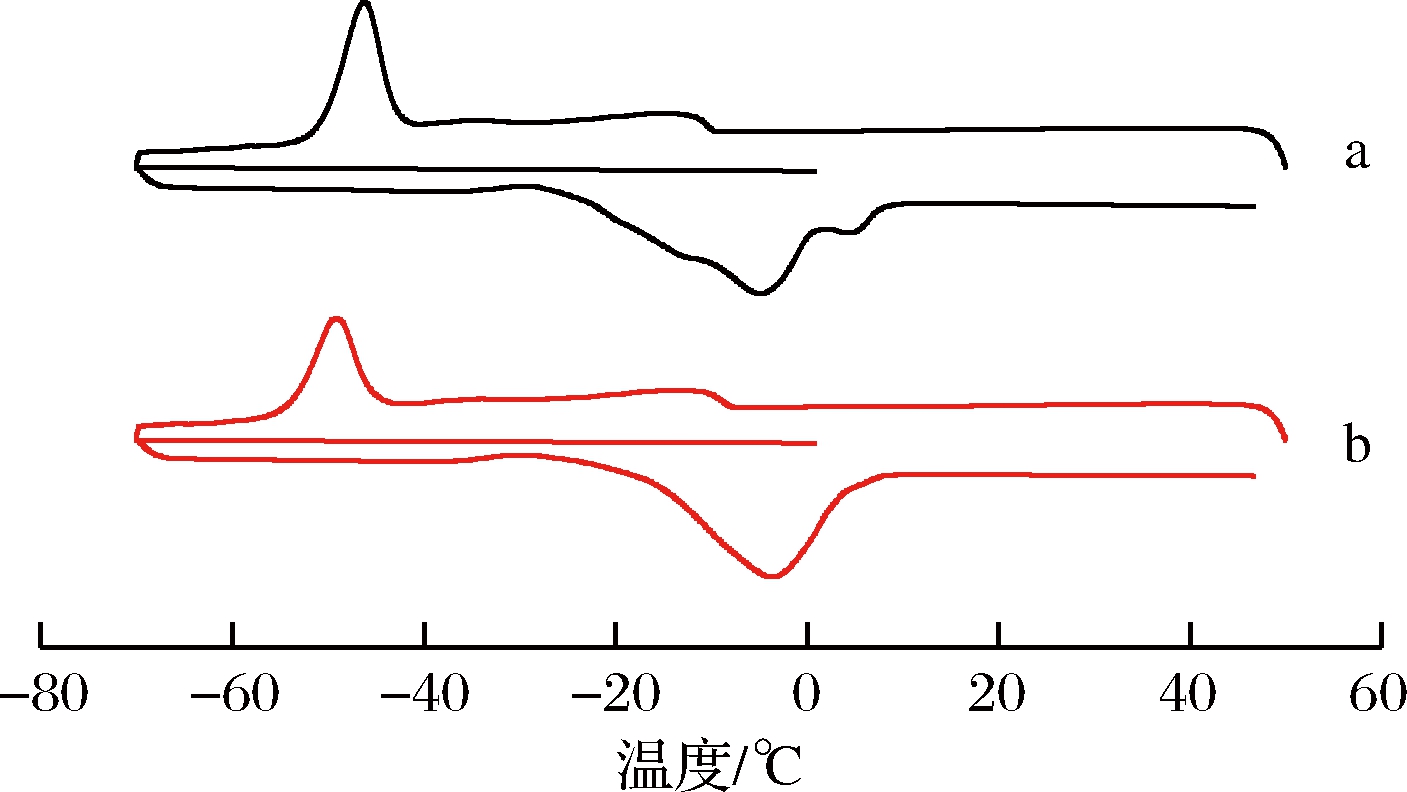
a-油莎豆毛油; b-精炼油
图6 精炼前后油样DSC图
Fig.6 DSC curves of the original and refining oils
2.6 红外光谱分析
由图7可知,油莎豆毛油和精制油结构相同,均在3 005 cm-1附近出现甘油三酯中不饱和烃基中的![]() C—H的伸缩振动,2 925、2 854 cm-1附近出现甘油三酯中的甲基和亚甲基C—H的反伸缩振动和伸缩振动,1 747附近出现甘油三酯中酯键C
C—H的伸缩振动,2 925、2 854 cm-1附近出现甘油三酯中的甲基和亚甲基C—H的反伸缩振动和伸缩振动,1 747附近出现甘油三酯中酯键C![]() O的伸缩振动,1 465和1 385 cm-1附近出现甘油三酯中的甲基和亚甲基C—H的弯曲振动,1 163 cm-1附近出现甘油三酯中的酯基C—O—C的伸缩振动,723 cm-1附近出现羰基的伸缩振动。SIUDEM[24]等认为,可以通过对精炼前后油脂的红外光谱进行对比分析,判断精炼工艺是否对油脂的分子组成产生影响。本研究结果表明,油莎豆油精炼前后具有相同的官能团吸收峰,即经过脱胶与脱酸过程的油莎豆油脂肪酸结构未发生明显变化,说明精炼工艺对油莎豆油分子没有产生影响。
O的伸缩振动,1 465和1 385 cm-1附近出现甘油三酯中的甲基和亚甲基C—H的弯曲振动,1 163 cm-1附近出现甘油三酯中的酯基C—O—C的伸缩振动,723 cm-1附近出现羰基的伸缩振动。SIUDEM[24]等认为,可以通过对精炼前后油脂的红外光谱进行对比分析,判断精炼工艺是否对油脂的分子组成产生影响。本研究结果表明,油莎豆油精炼前后具有相同的官能团吸收峰,即经过脱胶与脱酸过程的油莎豆油脂肪酸结构未发生明显变化,说明精炼工艺对油莎豆油分子没有产生影响。
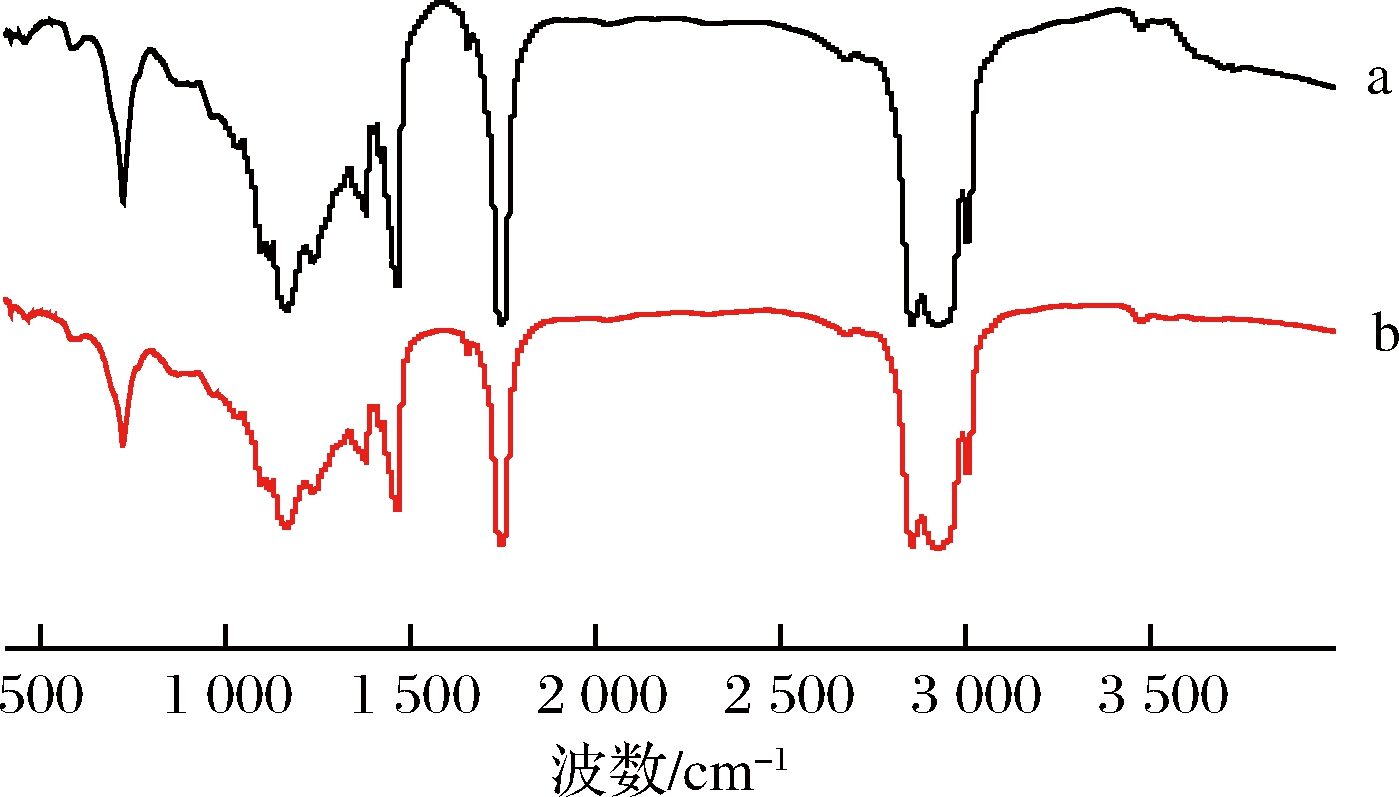
a-油莎豆毛油; b-精炼油
图7 精炼前后油样红外光谱图
Fig.7 FT-IR spectra of the original and refining oils
3 结论
本研究通过索氏提取法提取油莎豆毛油,对其进行精炼处理,通过单因素试验和正交试验得到最佳的脱胶工艺条件为脱胶时间20 min、温度60 ℃、磷酸添加量(质量分数,下同)0.10%,此条件下油莎豆脱胶油磷脂含量为(0.98±0.05)mg/g,脱胶率为92.85%;最佳的脱酸工艺条件为脱酸温度60 ℃、时间60 min、浓H2SO4添加量3%,醇油物质的量比10∶1,此条件下油莎豆脱酸油酸值为(0.35±0.01)mg KOH/g,脱酸率为95.62%。该酸值和过氧化值含量均符合GB 2716—2018《植物油》中对酸值和过氧化值的限量要求。通过对油莎豆毛油及其精制油的理化性质、GC-MS、DSC、红外光谱分析可知,本实验精炼工艺对油莎豆油的脂肪酸组成、官能团结构、热力学性质未产生明显影响。因此,油莎豆毛油经过脱胶和脱酸工艺后,磷脂和酸值含量明显下降,达到了食用油的品质要求,本研究脱胶和脱酸工艺适用于油莎豆毛油的精炼生产。
[1] FOLLAK S,BELZ R,BOHREN C,et al.Biological flora of central Europe:Cyperus esculentus L[J].Perspectives in Plant Ecology,Evolution and Systematics,2016,23:33-51.
[2] 倪培德. 油脂加工技术[M].北京:化学工业出版社,2018.
[3] BARMINAS J T,MAINA H M,TAHIR S,et al.A preliminary investigation into the biofuel characteristics of tigernut (Cyperus esculentus) oil[J].Bioresource Technology,2001,79(1):87-89.
[4] 王瑞元,王晓松,相海.一种多用途的新兴油料作物——油莎豆[J].中国油脂,2019,44(1):1-4.
[5] KUMAR P K P,KRISHNA A G G.Effect of different deacidification methods on phytonutrients retention in deacidified fractionated palm oil[J].Journal of the American Oil Chemists’ Society,2015,92(5):645-658.
[6] RAJAM L,KUMAR D R S,SUNDARESAN A,et al.A novel process for physically refining rice bran oil through simultaneous degumming and dewaxing[J].Journal of the American Oil Chemists’ Society,2005,82(3):213-220.
[7] GONÇALVES C B,RODRIGUES C E C,MARCON E C,et al.Deacidification of palm oil by solvent extraction[J].Separation and Purification Technology,2016,160:106-111.
[8] HABAKI H,HAYASHI T,EGASHIRA R.Deacidification process of crude inedible plant oil by esterification for biodiesel production[J].Journal of Environmental Chemical Engineering,2018,6(2):3 054-3 060.
[9] 孙协军,李秀霞,励建荣,等.盐藻油脱色和酯化脱酸研究[J].中国食品学报,2017,17(2):127-133.
[10] 牛玉芝. 黄连木油的精炼研究[D].郑州:河南工业大学,2012.
[11] LIU K T,GAO S,CHUNG T W,et al.Effect of process conditions on the removal of phospholipids from Jatropha curcas oil during the degumming process[J].Chemical Engineering Research and Design,2012,90(9):1 381-1 386.
[12] 张红,王凤霞,刘美霞,等.影响油菜籽毛油脱胶因素的研究[J].云南化工,2019,46(10):39-41.
[13] COSTA E,FONSECA A M,ALVIM-FERRAZ M D C,et al.Effect of Crambe abyssinica oil degumming in phosphorus concentration of refined oil and derived biodiesel[J].Renewable Energy,2018,124:27-33.
[14] PAISAN S,CHETPATTANANONDH P,CHONGKHONG S.Assessment of water degumming and acid degumming of mixed algal oil[J].Journal of Environmental Chemical Engineering,2017,5(5):5 115-5 123.
[15] CHEW S C,TAN C P,NYAM K L.Optimization of degumming parameters in chemical refining process to reduce phosphorus contents in kenaf seed oil[J].Separation and Purification Technology,2017,188:379-385.
[16] GHAZANI S M,MARANGONI A G.Minor components in canola oil and effects of refining on these constituents:A review[J].Journal of the American Oil Chemists’ Society,2013,90(7):923-932.
[17] SAKA S,KUSDIANA D.Biodiesel fuel from rapeseed oil as prepared in supercritical methanol[J].Fuel,2001,80(2):225-231.
[18] KOUZU M,KASUNO T,TAJIKA M,et al.Calcium oxide as a solid base catalyst for transesterification of soybean oil and its application to biodiesel production[J].Fuel,2007,87(12):2 798-2 806.
[19] BHOSLE B M,SUBRAMANIAN R.New approaches in deacidification of edible oils—a review[J].Journal of Food Engineering,2004,69(4):481-494.
[20] 董英,林琳,徐斌,等.利用米糠毛油制备生物柴油及其燃料性能[J].中国粮油学报,2008,23(4):163-168.
[21] 冉军舰,卢奎,张玲丽,等.樱桃仁油的精炼工艺研究[J].中国粮油学报,2007(6):122-124.
[22] 侯朝雷,相海,曾祥菊,等.油莎豆油的脂肪酸组成及其提取工艺研究进展[J].粮油食品科技,2018,26(3):32-35.
[23] PARDAUIL J R J,SOUZA L K C,MOLFETTA F A,et al.Determination of the oxidative stability by DSC of vegetable oils from the Amazonian area[J].Bioresource Technology,2011,102(10):5 873-5 877.
[24] SIUDEM P,WAWER I,PARADOWSKA K.Rapid evaluation of edible hemp oil quality using NMR and FT-IR spectroscopy[J].Journal of Molecular Structure,2019,1 177:204-208.