牡丹(Paeonia suffruticosa Andr.)为芍药科、芍药属植物,是原产我国的传统名花与药用植物,具有抗氧化、免疫调节等多种生物活性[1]。1960~1970年人们发现牡丹籽中含有“油”,开始利用牡丹籽进行粉碎榨油,2011年,我国卫生部正式批准牡丹籽油为新资源食品,油用牡丹种植及开发利用获得迅猛发展。油用牡丹籽提取油后剩余大量饼粕,含有大量的生物活性物质[2-5]。目前对牡丹籽粕的研究较少,主要转化为饲料后用于养殖,附加值较低,造成较大的浪费。
多糖是一类重要的天然生物活性物质,具有抗氧化[6-7]、抗肿瘤[8]、增强免疫[9-10]、降血脂、降血糖[11-12]、抑菌[13]等生物学功能,在临床上被用于治疗多种疾病[14]。牡丹中含有大量的多糖,目前研究较多的是牡丹丹皮多糖[15]、牡丹籽果荚多糖[16]、牡丹雄蕊多糖[17]和牡丹叶片多糖[18]等,鲜见有牡丹籽粕多糖(peony seed dreg polysaccharides,PSDP)的系统研究[19]。研究主要集中在分离提取方法探索与工艺优化,较少研究者进行了结构、清除自由基等研究。
硒化多糖通过化学修饰方法将多糖与无机硒结合成有机硒化合物[20],使硒和多糖的生理活性和药理功能得到优化,增强多糖的抗氧化活性[21]。人工合成的硒化多糖有硒化米胚多糖[22]、梭柄松苞菇富硒多糖[23]和莲藕多糖[24]等,对于硒化牡丹籽粕多糖(selenium-containing peony seed dreg polysaccharides,Se-PSDP)及其抗氧化的研究还鲜有报道。
利用水提醇沉法从牡丹籽粕中提取粗多糖PSDP,之后经离子交换层析制得牡丹籽粕多糖PSDPⅠ、PSDPⅡ及PSDP Ⅲ,对PSDP Ⅲ进行硒化修饰后获得具有1,1-二苯基-2-三硝基苯肼(1,1-diphengl-2-picrylhydrqzy,DPPH)自由基清除能力、·OH清除能力和DNA氧化损伤抑制活性的Se-PSDP Ⅲ。通过建立H2O2诱导的RAW264.7巨噬细胞氧化损伤模型,从细胞水平研究Se-PSDP Ⅲ可能的抗氧化作用,为Se-PSDP的进一步开发利用奠定了理论基础,同时为牡丹籽粕的综合高值化利用提供参考。
1 材料与方法
1.1 材料与设备
牡丹籽粕,山西智华牡丹生物科技公司;巨噬细胞系RAW 264.7,中科院上海生命科学院;超氧化物岐化酶(superoxide,SOD)检测试剂盒,谷胱甘肽过氧化物酶(glutathione peroxide,GSH-Px)检测试剂盒,南京建成生物工程研究所;邻菲罗啉,索莱宝生物科技有限公司;FeSO4、H2O2、亚硒酸钠,上海生物工程有限公司。
Allegra 64R高速冷冻离心机,美国Beckman公司;AKATA Pure 25蛋白纯化系统,美国GE公司;Sunrise-Basic酶标仪,瑞士TECAN公司;DMI3000B倒置荧光显微镜,德国LEICA公司。
1.2 实验方法
1.2.1 牡丹籽粕多糖的制备及硒化修饰
经超临界萃取油脂后得到的牡丹籽粕,经热水浸提、Sevag法脱蛋白[25]、透析、乙醇沉淀和冷冻干燥后得到牡丹籽粕粗多糖。采用DEAE-Sepharose FF离子交换层析对粗多糖进行分级:首先用双蒸水平衡层析柱,按照质量浓度1.0 mg/mL进行上样,分别采用双蒸水、0.2 mol/L NaCl、0.4 mol/L NaCl进行洗脱,H2SO4-苯酚法检测多糖含量,将收集的多糖溶液透析,冷冻干燥。采用HNO3-亚硒酸钠法[26],按照多糖-亚硒酸钠质量比5∶4在70 ℃下反应10 h,制得Se-PSDP多糖,紫外分光光度法检测硒含量。
1.2.2 RAW264.7巨噬细胞培养
将RAW264.7巨噬细胞接种于含体积分数10%胎牛血清的RPMI 1640培养基中,37 ℃、体积分数5% CO2细胞培养箱中培养,当细胞的融合度达到80%~90%时,用质量浓度2.5 g/L胰酶消化,用于后续实验。
1.2.3 Se-PSDP Ⅲ对RAW264.7巨噬细胞活力的影响
将RAW264.7的细胞密度调整为2×105个/mL,接种于96孔板中,每孔200 μL,置于37 ℃、体积分数5% CO2细胞培养箱中培养24 h后弃去培养基,加入含Se-PSDP Ⅲ、体积分数10%胎牛血清的RPMI 1640培养基。Se-PSDP Ⅲ的终质量浓度分别为0、100、200、300、400和500 μg/mL,每个浓度设置3个重复孔。培养24 h后加入CCK8溶液,继续培养3 h,于450 nm波长处检测吸光度,细胞存活率计算如公式(1)所示:
细胞存活率![]()
(1)
1.2.4 H2O2诱导RAW264.7巨噬细胞氧化损伤模型的建立
将RAW264.7的细胞密度调整为2×105个/mL,接种于96孔板中,每孔200 μL,置于37 ℃、体积分数5% CO2细胞培养箱中培养24 h后弃去培养基,加入含H2O2、体积分数10%胎牛血清的RPMI 1640培养基。H2O2的终浓度分别为0、0.1、0.2、0.3和0.4 mmol/L,每个浓度设置3个重复孔。培养24 h后加入CCK8溶液,继续培养3 h,于450 nm波长处检测吸光度,细胞存活率计算如公式(2)所示:
细胞存活率![]()
(2)
1.2.5 DPPH自由基清除率检测[27]
分别取20 μL质量浓度为0.5、1.0和4.0 mg/mL的多糖样品,加入60 μmol/L的DPPH溶液 (以体积分数95%乙醇作为溶剂) 100 μL,在室温下密封避光反应60 min,然后检测517 nm波长处的吸光度,清除率计算如公式(3)所示:
DPPH自由基清除率![]()
(3)
式中:As,实验组吸光度;Ab,用体积分数95%乙醇代替DPPH后的吸光度;Ac,用双蒸水代替样品后的吸光度;每组做3次重复实验,以质量浓度200 μg/mL VC作为阳性对照。
1.2.6 ·OH清除率检测
取40 μL浓度为2 mmol/L的FeSO4,加入40 μL浓度为2 mmol/L的邻菲罗啉及80 μL多糖样品后,加入40 μL体积分数0.03%的H2O2启动反应,37 ℃孵育60 min,于536 nm波长处检测吸光度,清除率计算如公式(4)所示:
·OH清除率![]()
(4)
式中:As,实验组吸光度;An,用双蒸水代替多糖后的吸光度;Ab,用双蒸水代替H2O2后的吸光度;每组做3次重复实验。
1.2.7 DNA氧化损伤抑制实验
取8 μL PUC18质粒DNA,加入2 μL 2 mmol/L FeSO4与8 μL待测组分,轻轻混匀后,加入2 μL 0.1 mmol/L H2O2启动反应,37 ℃水浴10 min,质量浓度10 g/L琼脂糖凝电泳分析,以双蒸水代替样品作为损伤组。
1.2.8 RAW264.7巨噬细胞内活性氧(reactive oxygen species,ROS)水平的检测
将RAW264.7巨噬细胞以2×105个/mL的密度接种于6孔板中,无血清培养液同步化饥饿培养24 h后,分为对照组、H2O2组(0.2 mmol/L H2O2)和H2O2+Se-PSDP Ⅲ组(0.2 mmol/L H2O2+100 μg/mL Se-PSDP Ⅲ),分别培养24 h。用无血清培养基按体积比1∶1 000稀释DCFH-DA探针,使其终浓度为10 μmol/L,之后每孔加入1 mL稀释好的DCFH-DA,37 ℃避光孵育40 min后,用磷酸盐缓冲液(phospate buffer saline,PBS)洗涤细胞3次。将6孔板置于荧光倒置显微镜下观察细胞光镜下及荧光激发状态下的形态。
1.2.9 Se-PSDP Ⅲ对RAW264.7巨噬细胞内抗氧化酶活力的调节
将RAW264.7巨噬细胞以2×105个/mL的密度接种于6孔板中,无血清培养液同步化饥饿培养24 h后,分为对照组、H2O2组(0.2 mmol/L H2O2)、H2O2+ Se-PSDP Ⅲ组(0.2 mmol/L H2O2+100 μg/mL Se-PSDP Ⅲ)组,分别培养24 h,收集细胞,加入细胞裂解液,冰上裂解30 min,4 ℃,12 000 r/min,离心15 min,收集上清液,按照试剂盒说明书对SOD及GSH-Px活力进行检测。
2 结果与分析
2.1 牡丹籽粕多糖的制备与硒化修饰
利用DEAE-Sepharose FF离子交换层析对牡丹籽粕粗多糖进行分级,分别采用双蒸水、0.2 mol/L NaCl和0.4 mol/L NaCl进行洗脱,获得牡丹籽粕多糖PSDPⅠ、PSDPⅡ和PSDP Ⅲ,得率分别为4.1%、3.6%和31%。其中PSDP Ⅲ得率最高(图1-a),且Se-PSDP Ⅲ较PSDP Ⅲ表现出更强的DPPH清除能力(图1-b)。后续以Se-PSDP Ⅲ为研究对象并测得其硒含量为1.1 mg/g。
2.2 Se-PSDP Ⅲ及H2O2对RAW264.7巨噬细胞活力的影响
由图2-a可知,与空白组相比,质量浓度100、200、300、400和500 μg/mL的Se-PSDP Ⅲ对巨噬细胞存活率无明显影响,说明该浓度可以用于后续的ROS实验。由图2-b可知,0.1、0.2 mmol/L的H2O2对巨噬细胞存活率影响较小,故后续实验选择浓度为0.2 mmol/L的H2O2建立氧化损伤细胞模型。
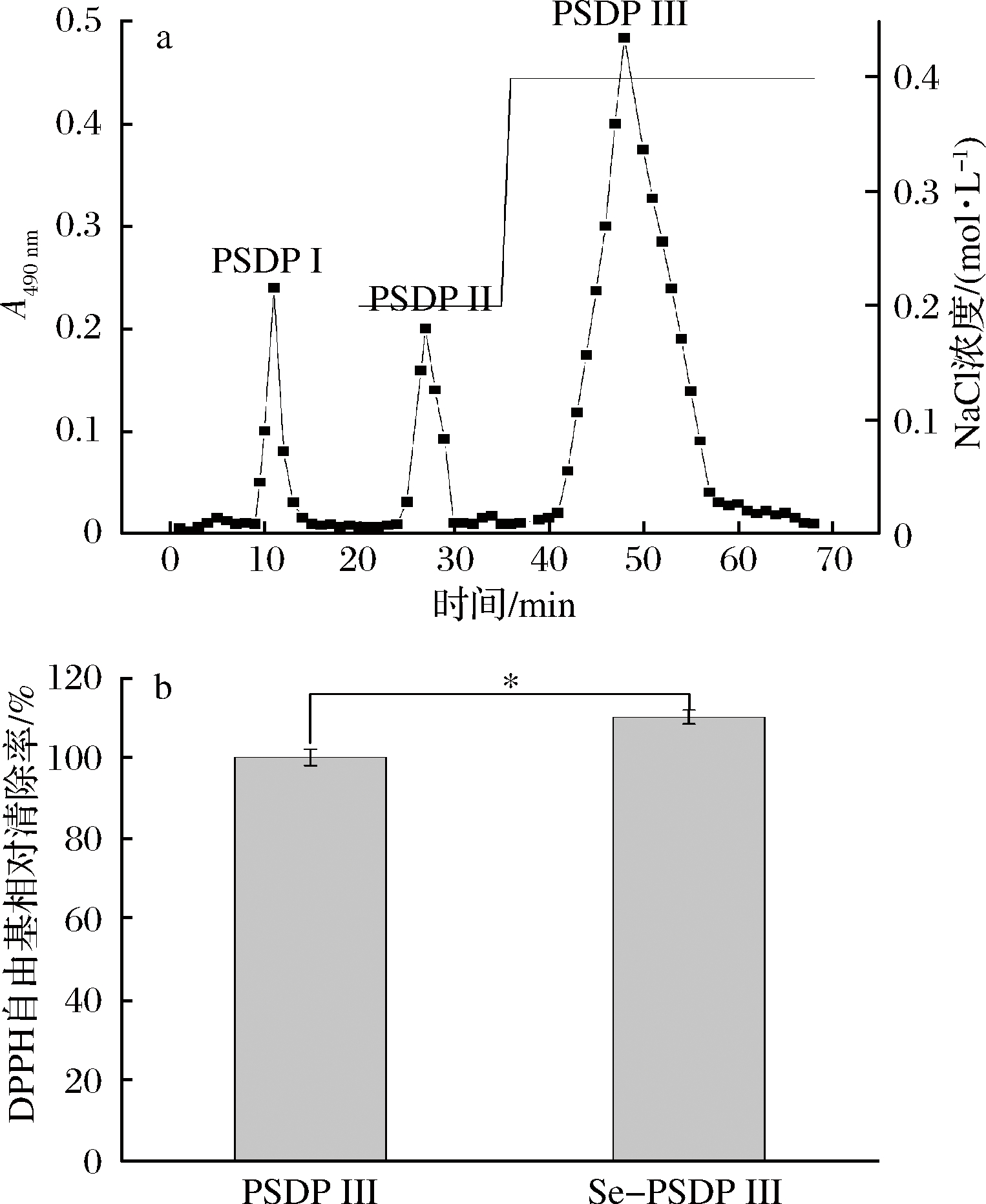
a-DEAE-Sepharose FF阴离子交换色谱图; b-Se-PSDP Ⅲ与PSDP的DPPH清除率比较
图1 PSDPⅢ阴离子交换色谱图和Se-PSDP Ⅲ与PSDPⅢ的DPPH清除率比较图
Fig.1 Elution profile of PSDP Ⅲ on DEAE-Sepharose FF chromatography and comparison of DPPH scavenging activity between Se-PSDP Ⅲ and PSDP Ⅲ
注:*表示具有显著性差异(P<0.05)(下同)
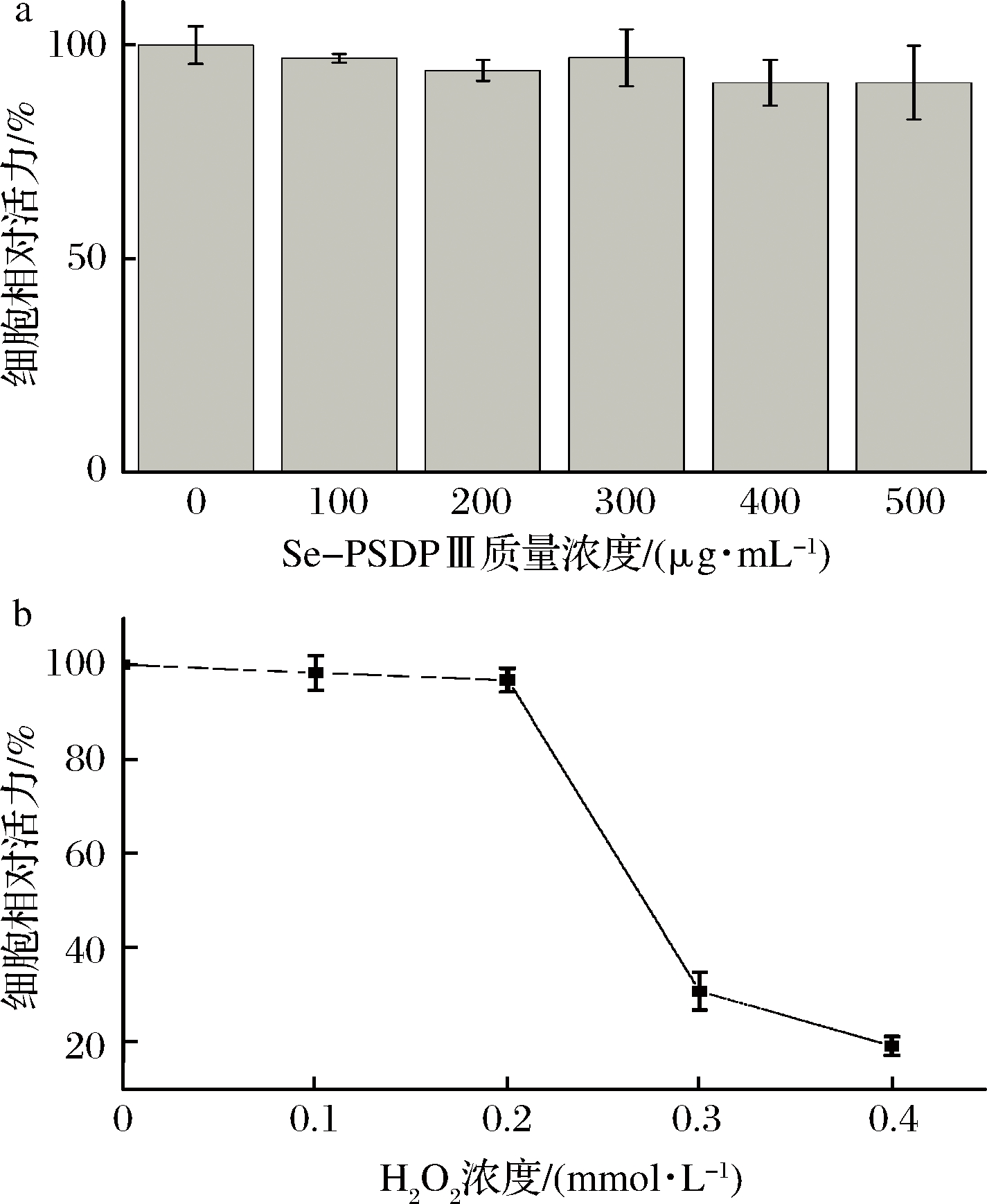
a-Se-PSDP Ⅲ; b-H2O2
图2 Se-PSDP Ⅲ和H2O2对RAW264.7巨噬细胞活力的影响
Fig.2 Relative cell viability of RAW264.7 induced by Se-PSDP Ⅲ and H2O2
2.3 DPPH自由基和·OH清除能力
如图3-a所示,Se-PSDP Ⅲ对DPPH自由基的清除能力呈现出一定的浓度依赖性,且4 mg/mL的Se-PSDP Ⅲ与200 μg/mL的VC作用相当,对DPPH的清除率可达到80%左右。由图3-b可知,Se-PSDP Ⅲ表现出较强的·OH清除能力,并且具有一定的浓度依赖性。当质量浓度为4 mg/mL时,Se-PSDP Ⅲ的·OH清除率为93.7%。
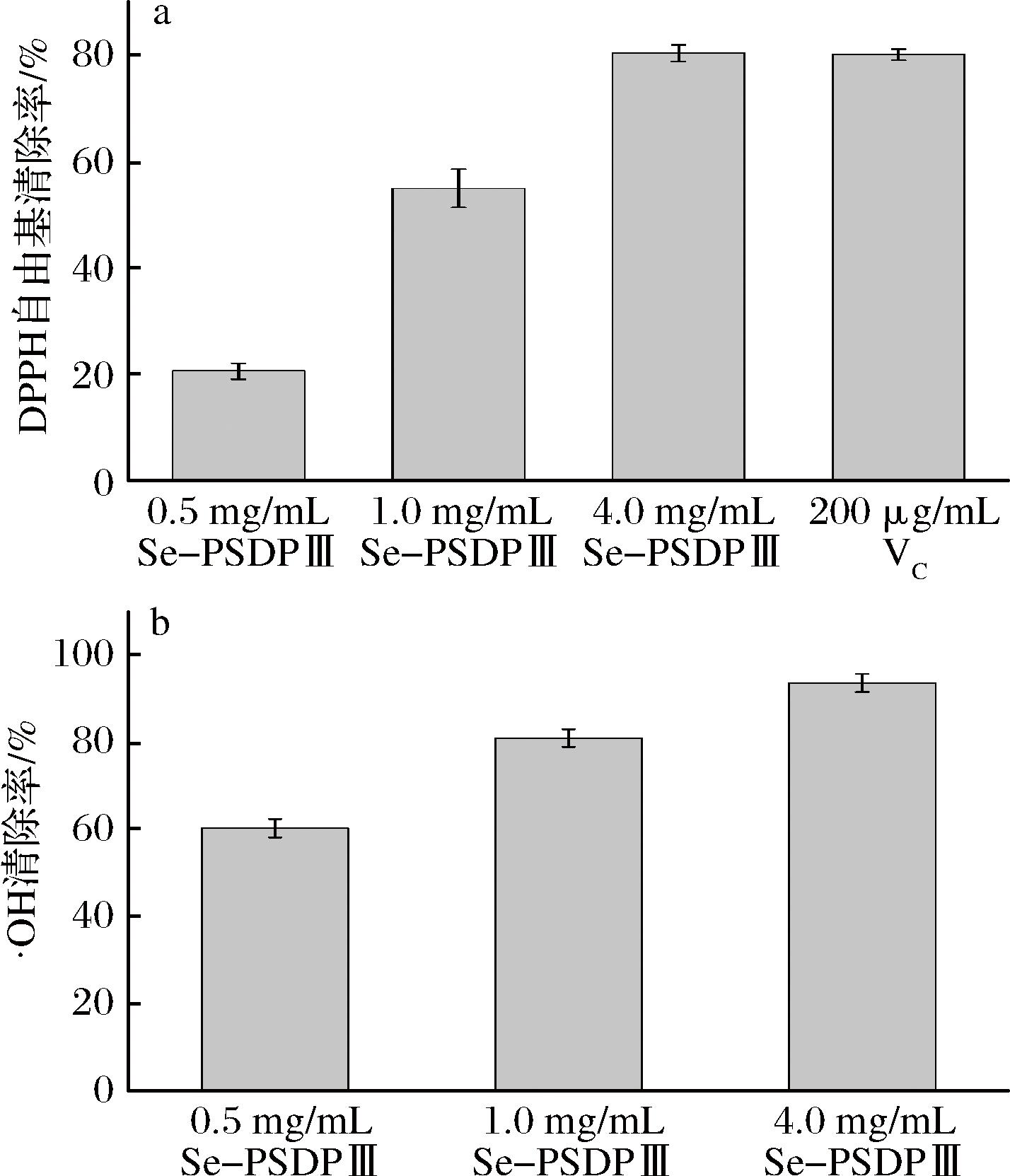
a-DPPH自由基清除率; b-·OH清除率
图3 Se-PSDP Ⅲ的DPPH自由基和·OH清除率
Fig.3 DPPH and hydroxyl radical scavenging activities of Se-PSDP Ⅲ
2.4 Se-PSDP Ⅲ对DNA氧化损伤的抑制作用
如图4所示,泳道2为无损伤组,质粒DNA结构完好,超螺旋结构质粒DNA(supercoiled DNA, scDNA)含量最高。泳道3为损伤组,DNA氧化损伤严重,scDNA基本消失,质粒DNA被损伤成为线性结构(linear DNA,lDNA)。泳道1为Se-PSDP Ⅲ保护组,在lDNA下方出现了少量的scDNA,这表明DNA氧化损伤程度有所降低,说明Se-PSDP Ⅲ具有一定的抑制DNA氧化损伤的能力。
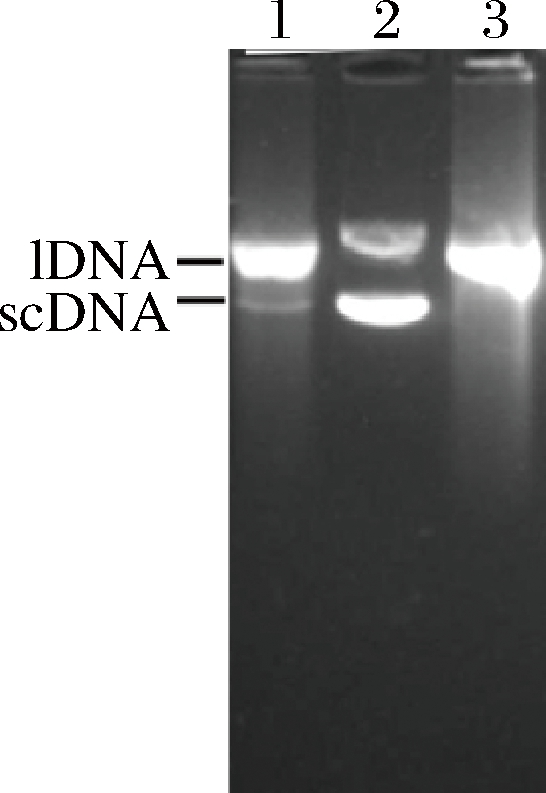
1-H2O2+ FeSO4+ Se-PSDP Ⅲ;2-PUC18;泳道3 H2O2+ FeSO4
图4 Se-PSDP Ⅲ抑制DNA氧化损伤的能力
Fig.4 Protective effect of Se-PSDP Ⅲ on oxidation-induced DNA damage
2.5 Se-PSDP Ⅲ对H2O2诱导的RAW264.7巨噬细胞内活性氧水平的影响
活性氧是指化学性质活泼的具有含氧基团的化合物。ROS过度增加或持续存在可对细胞形成氧化应激,造成多种损伤。H2O2是研究ROS的重要工具,H2O2可迅速穿过细胞膜,通过Fention反应,生成·OH,·OH激发链式反应,产生更多的ROS,可用于模拟ROS对RAW264.7巨噬细胞的氧化损伤。如图5所示,0.2 mmol/L H2O2处理的RAW264.7巨噬细胞相较对照组细胞具有更强的荧光强度。0.2 mmol/L H2O2和100 μg/mL Se-PSDP Ⅲ处理组的细胞与对照组基本一样,细胞内几乎检测不到荧光。该结果表明Se-PSDP Ⅲ可以有效降低RAW264.7巨噬细胞中的ROS水平。

图5 DCFH-DA探针法检测RAW264.7巨噬细胞内活性氧(×100)
Fig.5 Intracellular ROS in RAW264.7 macrophages indicated as green fluorescence by DCFH-DA
2.6 Se-PSDP Ⅲ对H2O2介导的RAW264.7巨噬细胞内抗氧化酶活力影响
细胞内存在完善的抗氧化防御体系,能够直接清除自由基,使自由基处于动态平衡。如SOD、GSH-Px等。Se-PSDP Ⅲ对RAW264.7巨噬细胞内抗氧化酶活力的影响如图6所示。

a-SOD的相对酶活力; b-GSH-Px的相对酶活力
图6 Se-PSDP Ⅲ对H2O2诱导的RAW264.7巨噬细胞内SOD和GSH-Px活力的影响
Fig.6 Effect of Se-PSDP Ⅲ on SOD and GSH-Px activities in RAW264.7 stimulated by H2O2
与对照组相比,H2O2处理的RAW264.7巨噬细胞内抗氧化酶活力都有所下降,而质量浓度100 μg/mL的Se-PSDP Ⅲ可使胞内SOD相对活力从82.6%升高到97.5%,GSH-Px相对活力从95.3%升高到113.3%,差异具有显著性。该结果表明Se-PSDP Ⅲ对H2O2介导的RAW264.7巨噬细胞内抗氧化酶活性具有正向调节作用。
3 结论与讨论
牡丹籽粕粗多糖经阴离子交换柱层析后制得PSDPⅠ、PSDPⅡ和PSDP Ⅲ,其中PSDP Ⅲ得率较高,PSDP Ⅲ经硒化修饰后抗氧化活性得到一定程度的提高,且稳定性和重现性也较好,所以将牡丹籽粕硒化多糖Se-PSDP Ⅲ作为后续研究对象。牡丹籽粕硒化多糖Se-PSDP Ⅲ具有较强的DPPH自由基清除能力、·OH清除能力及DNA氧化损伤抑制能力。Se-PSDP Ⅲ可以降低氧化损伤后巨噬细胞内ROS的水平,提高胞内SOD与GSH-Px的活性。细胞内ROS的水平及SOD与GSH-Px的活性是评价细胞氧化应激水平的关键指标,表明Se-PSDP Ⅲ可能是通过调节细胞氧化还原系统,对H2O2引起的巨噬细胞氧化损伤起到保护作用。本研究将为牡丹籽粕多糖在食品、保健品、美容、医药等领域的进一步开发利用奠定理论基础,为牡丹籽粕的高值化利用提供参考。
[1] 李凯,周宁,李赫宇.牡丹花、牡丹籽成分与功能研究进展[J].食品研究与开发,2012,33(3):228-230.
[2] 王芸.牡丹籽油营养成分及功能作用的研究[D].济南:山东大学,2012:10-14.
[3] 刘普,李亮,邓瑞雪,等.凤丹籽饼粕单萜苷类成分的研究[J].中国药学杂志,2013,48(17):1 445-1 448.
[4] 刘普,许艺凡,刘佩佩,等.紫斑牡丹籽饼粕单萜苷类成分的分离鉴定[J].食品科学,2017,38(18):87-92.
[5] 曾超,殷钟意,莫芙蓉,等.牡丹籽粕超微粉碎工艺及营养成分变化研究[J].食品研究与开发,2017,38(14):75-80.
[6] 李珊珊,祝贺,祁玉丽,等.人参果多糖的分离纯化及体外抗氧化活性研究[J].食品工业科技,2018,39(4):73-76;99.
[7] 倪慧艳,陈伟,宋文静.黄芪多糖抗氧化作用研究[J].中医学报,2017,32(9):1 705-1 707.
[8] ZONG A,LIU Y,ZHANG Y,et al.Anti-tumor activity and the mechanism of SIP-S:A sulfated polysaccharide with anti-metastatic effect[J].Carbohydrate Polymers,2015,129(7):50-54.
[9] 许女,李向明,谢瑞杰,等.鸡腿菇多糖的提取及生物活性的研究[J].中国食品学报,2013,13(7):34-39.
[10] XUE M,SUN H,CAO Y,et al.Mulberry leaf polysaccharides modulate murine bone-marrow-derived dendritic cell maturation[J].Human Vaccines and Immunotherapeutics,2015,11(4):946-950.
[11] LI S P,ZHANG G H,ZENG Q,et al.Hypoglycemic activity of polysaccharide,with antioxidation,isolated from cultured C ordyceps mycelia[J].Phytomedicine,2006,13(6):428-433.
[12] 汤彬,薛平,李祥,等.南方红豆杉多糖的含量测定及体外降血糖活性研究[J].食品工业科技,2013,34(9):128-131;136.
[13] 韦琮智,丛新奇,叶淑红.银杏多糖的抑菌性研究[C]//中国食品科学技术学会第十三届年会论文摘要集.北京:中国食品科学技术学会,2016:212-213.
[14] 刘淑贞,周文果,叶伟建,等.活性多糖的生物活性及构效关系研究进展[J].食品研究与开发2017,38(18):211-218.
[15] 廖洪梅,戴玲.丹皮多糖PSM2bA的结构研究[J].天然产物研究与开发,2011,23(4):600-605;628.
[16] 王洪政, 李媛媛,刘伟,等.响应面法优化牡丹果荚多糖提取工艺及其抗氧化活性评估[J].植物研究,2015,35(1):127-132.
[17] 刘帅. 牡丹雄蕊多糖的提取、分离纯化及结构鉴定[D].青岛:青岛农业大学,2012:42-43.
[18] 朱月,钟尉,赵雪梅,等.紫斑牡丹叶片多糖对羟自由基清除能力的比较[J].江苏农业科学,2016,44(11):341-342.
[19] 郭香凤,史田,马雪情,等.微波辅助提取牡丹籽粕多糖工艺优化及其体外抗氧化活性[J].食品工业科技,2018,39(1):167-171.
[20] STAAF M,YANG Z,HUTTUNEN E,et al.Structural elucidation of the viscous exopo1ysaccharide produced by Lactobacillus helveticus Lb161[J].Carbohydr Res,2000,326(2):113-119.
[21] 高玉杰,吕海涛.浒苔硒多糖的制备及其活性研究[J].化学与生物工程,2012,29(5):40-45.
[22] 罗敏,陈德经,韩 豪,等.硒化米胚多糖的抗氧化性[J].食品科学,2018,39(19):58-63.
[23] 刘韫滔,曾思琪,唐倩倩,等.两种梭柄松苞菇富硒多糖的制备及其降血糖和抗氧化活性研究[J].现代食品科技,2016,32(10):60-65.
[24] 胡卫成,沈婷,张建梅,等.一种硒化莲藕多糖的制备方法,201710418708.2[P].2017.08.04
[25] 赵淑杰,郑丽宁,路飘飘,等.Sevag法脱鹿药多糖蛋白工艺条件优化[J].中国兽药杂志,2017,51(4):25-29.
[26] 陈红伟,吴俊伟,曾杨梅,等.硒酸化白术多糖在制备药物或保健品中的应用:重庆,CN108272816A[P].2018-07-13.
[27] 武翠玲,吴日帮,刘丹,等.鲮鱼皮胶原肽的制备及其抗氧化活性的检测[J].生物工程学报,2016,32(12):1 727-1 734.