螺旋藻(Spirulina platensis)又称钝顶节旋藻(Arthrospira platensis),是一种蓝绿藻,其含有蛋白质、碳水化合物、必需脂肪酸、维生素、矿物质和色素,如类胡萝卜素、叶绿素和藻蓝蛋白等[1-2]。多糖作为最重要活性成分之一,受到国内外研究学者极大关注,其具有增强免疫、抗肿瘤、抗氧化、降胆固醇等多种生物活性和功能,在食品、医药、化妆品等领域具有广阔的应用前景[3-6]。天然多糖通常采用浸渍、热回流提取,经脱蛋白、脱色、透析等一系列分离程序,再经柱层析得到高纯度的多糖。然而,上述操作和工艺存在耗时长、能耗高、成本昂贵,使用有毒溶剂,对人体健康和环境有害。因此,不利于在食品、医药、化妆品等领域的广泛应用。
目前,三相分配体系(three-phase partitioning,TPP)作为一种简便、快速和绿色的萃取方法已广泛应用于天然产物中多糖、蛋白质、酶、酶抑制剂、油脂和小分子等提取和分离[7-8]。此外,该技术在室温下易于大规模进行,因此适用于对温度敏感的生物活性分子提取和分离[9]。在典型的TPP体系中,硫酸铵作为无机盐相,叔丁醇作为有机相,通常用于从粗提物或悬浮液中分离生物活性分子[8,10-11]。叔丁醇由于其高沸点、低可燃性以及显著地促进水分子缔合和拥挤效应[10]而被广泛应用于TPP。尽管叔丁醇对皮肤和眼睛有一定的毒性和刺激性,但仍被广泛应用于各种TPP体系[12]。与叔丁醇相比,碳酸二甲酯具有较低的皮肤刺激性和毒性[13-14],被认为是一种较为绿色的溶剂[15-16]。PANADARE等[17]使用碳酸二甲酯作为叔丁醇的替代溶剂,建立了一种以碳酸二甲酯为有机相、柠檬酸钠为盐相的新型TPP体系,用于苦瓜过氧化物酶的提取和纯化。近年来,本课题组利用叔丁醇、硫酸铵三相体系从螺旋藻多糖粗提液中萃取分离螺旋藻多糖(polysaccharides of Spirulina platensis,PSP)[18]。然而,目前尚未有研究报道基于碳酸二甲酯和柠檬酸钠的新型TPP萃取分离PSP。
因此,本研究以碳酸二甲酯为有机相,柠檬酸钠为盐相,采用新型TPP萃取分离PSP,通过单因素试验和响应面法优化,研究了碳酸二甲酯与粗提液体积比、柠檬酸钠质量浓度、温度和pH值等提取工艺参数对PSP和蛋白质含量的影响,并与叔丁醇和硫酸铵形成TPP制备的PSP理化性质和体外抗氧化活性进行了比较研究。
1 材料和方法
1.1 材料、试剂与仪器
螺旋藻,甘肃省微藻技术创新中心。
课题组前期研究[18]所用叔丁醇和硫酸铵的TPP体系制备的PSP,在本研究中命名为PSP-T。
碳酸二甲酯、柠檬酸钠、苯酚、浓硫酸、葡萄糖均为分析纯。透析袋(分子截留量8~12 kD),单糖标准品(D-来苏糖、D-葡萄糖、D-半乳糖、D-甘露糖、L-鼠李糖和D-木糖)、三氟乙酸,成都德思特生物技术有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、6-羟基-2,5,7,8-四甲基色烷-2-羧酸((R)-(+)-6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid, Trolox)、H2O2、2,2-联氮-双(3-乙基苯并噻唑-6-磺酸)二铵盐(2,2′-azino-bisc3-ethylbenzothiazoline-6-sulfonic acid,ABTS),上海源叶生物科技有限公司。
PL-203电子天平,梅特勒-托利多仪器有限公司;Alpha-1860Plus紫外可见分光光度计,上海谱元仪器有限公司;GC-MS6800气相色谱质谱联用仪,江苏天瑞仪器股份有限公司;GPC-IR高温凝胶渗透色谱仪,北京亿路达机电设备有限公司;Nicolet iS50红外光谱仪,美国Thermo Scientific。
1.2 实验方法
1.2.1 螺旋藻多糖粗提液的制备
参照前期研究方法制备螺旋藻多糖粗提液[18]。
1.2.2 基于碳酸二甲酯和柠檬酸钠的TPP萃取PSP
采用碳酸二甲酯为有机相,柠檬酸钠为盐相,参考PANADARE等[17],略作改动。将给定量的柠檬酸钠(0.1~0.5 g/mL)加入10 mL多糖粗提液中,搅拌溶解后,加入2.5~20 mL碳酸二甲酯。随后,将混合物置于20~40 ℃的振荡培养箱中30 min,4000 r/min离心10 min,形成透明相。收集下相,在蒸馏水中透析48 h(MWCO:8 k~12kDa),冻干得到部分纯化的PSP-D,考察碳酸二甲酯与多糖粗提液体积比、柠檬酸钠质量浓度(g/mL)、温度、pH值对PSP-D萃取效果的影响。通过添加1 mol/L HCl或1 mol/L NaOH水溶液,调整体系pH值。PSP-D的萃取得率采用公式(1)计算:
萃取得率![]()
(1)
式中:m,为螺旋藻粉末质量;ρ和V分别为PSP在下相中的质量浓度和体积。
1.2.3 响应面优化三相萃取条件
采用响应面中Box-Behnken设计(Box-Behnken design,BBD),优化碳酸二甲酯与多糖粗提液体积比(A)、柠檬酸钠质量浓度(B,g/mL)、温度(C,℃)和pH(D)操作参数对TPP工艺的影响。以4个因素为自变量,以PSP-D的萃取得率(Y,%)为响应值。
表1为整个实验设计及自变量和测定响应值。对BBD实验得到的数据进行回归分析,通过以下二阶多项式模型发现响应函数与变量的相关性。
(2)
式中:Y,响应值(PSP-D萃取得率,%);A0、Ai、Aii和Aij分别为截距项、线性项、二次项和交互项的变量系数(i≠j)。采用Design Expert V8.0.6.1 软件对RSM优化实验的设计和数据进行分析。
1.2.4 理化性质分析
以葡萄糖为标准品,采用苯酚-硫酸法测定多糖含量[19]。
三氟乙酸分别水解PSP-D和PSP-T,衍生化后,用气相色谱法测定其单糖组成。单糖标准品也按照上述步骤进行测定。
采用高效尺寸排阻色谱法(high performance size-exclusion chromatography,HPSEC)结合多角度激光散射(Multi-angle laser light scattering, MALLS,DAWN HELLOS II λ=658 nm)测定平均分子量(Mw),PSP-D和PSP-T的分子质量(Mn)和分子质量分布(Mw/Mn)。
采用傅里叶变换-红外光谱(Fourier transform infrared spectrossopy,FTIR)对干燥后PSP-D和PSP-T与光谱纯KBr颗粒研磨压片后,在500~4 000 cm-1的波数范围内测定。
1.2.5 多糖体外抗氧化活性测定
配制不同质量浓度(0~2.0 mg/mL)的PSP-D和PSP-T多糖溶液,并以Vc作为阳性对照,在室温下用UV-1601分光光度计测定吸光度。根据羟自由基(·OH)清除活性、DPPH自由基清除活性、Trolox当量抗氧化能力和铁离子还原/抗氧化能力测定,比较二者的体外抗氧化活性[20]。
1.2.6 数据分析
所有实验均重复3次,数据分析采用![]() 使用OriginPro软件8.0版(OriginLab Corp.,MA,USA)方差分析(ANOVA)进行统计分析(P<0.05,差异有统计学意义)。
使用OriginPro软件8.0版(OriginLab Corp.,MA,USA)方差分析(ANOVA)进行统计分析(P<0.05,差异有统计学意义)。
2 结果和分析
2.1 基于碳酸二甲酯和柠檬酸钠的TPP体系制备PSP-D
以碳酸二甲酯为有机相,柠檬酸钠为盐相的TPP从螺旋藻多糖粗提液中提取PSP-D。研究了碳酸二甲酯与螺旋藻多糖粗提液体积比、柠檬酸钠质量浓度、pH值和温度对PSP-D的萃取得率的影响。
2.1.1 碳酸二甲酯和多糖粗提液体积比对PSP-D萃取效果的影响
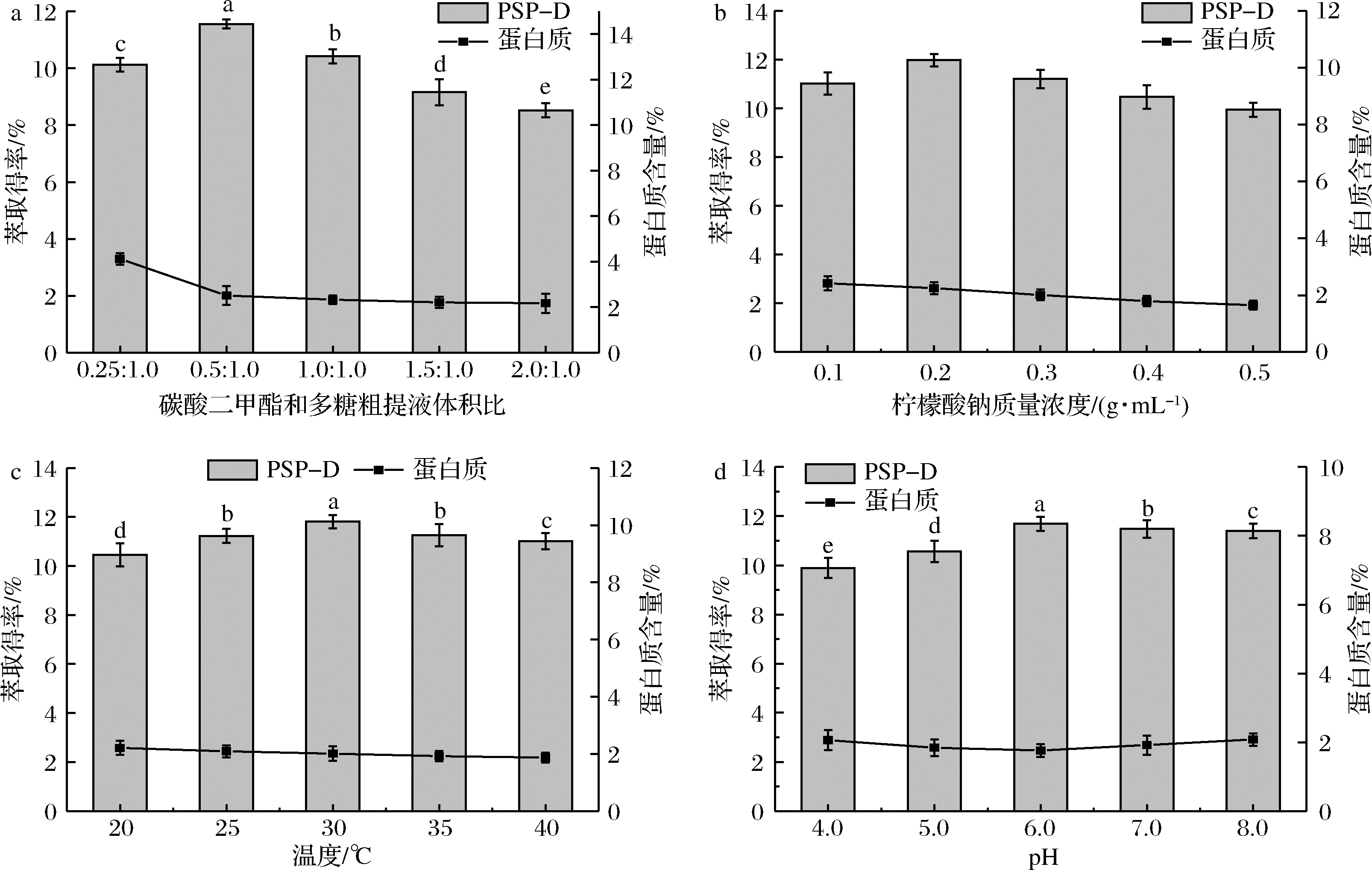
固定柠檬酸钠质量浓度为0.2 g/mL、pH值6.0和温度25 ℃,图1-a显示了碳酸二甲酯和多糖粗提液体积比(0.25∶1.0、0.5∶1.0、1.0∶1.0、1.5∶1.0和2.0∶1.0)对PSP-D萃取得率的影响。随着碳酸二甲酯与多糖粗提液体积比例的增加,PSP-D的萃取得率值呈现先增大后逐渐减小的趋势,当碳酸二甲酯与多糖粗提液比例为0.5∶1.0时,PSP-D的萃取得率达到最高为61.30%。结果表明,碳酸二甲酯作为一种抗溶剂和促进水分子缔合剂在TPP中起着重要作用。碳酸二甲酯与柠檬酸钠在水溶液中协同作用,通过改变水的结构,可以形成较强的分子间键合。这不仅有助于增加水溶性多糖在溶液中溶解度,而且有助于大分子蛋白质从下相中沉淀出来[17]。因此,随着碳酸二甲酯用量的增加,富集在下相中的水溶性PSP-D增加,导致PSP-D的萃取得率增加;但碳酸二甲酯体积的增加会降低PSP-D的萃取得率,可能是由于碳酸二甲酯的促进水分子缔合和拥挤效应所致。同时,随着碳酸二甲酯和多糖粗提液体积比的增加,下相中蛋白质的含量逐渐下降。推测碳酸二甲酯体积的增加可以通过与沉淀蛋白的结合来增加沉淀蛋白的浮力,从而导致更多蛋白质聚集在中间相,使下相中蛋白质含量呈下降趋势,因此,确定碳酸二甲酯和多糖提取液体积比为0.5∶1.0,作为后续的萃取分离实验条件。
2.1.2 柠檬酸钠质量浓度对PSP-D萃取效果的影响
当碳酸二甲酯与多糖粗提液比0.5∶1.0、pH 6.0和温度25 ℃保持恒定时,研究柠檬酸钠质量浓度(0.1、0.2、0.3、0.4和0.5 g/mL)对下相中PSP-D的萃取得率和蛋白质含量的影响,结果如图1-b所示。随着柠檬酸钠质量浓度逐渐增加,PSP-D的萃取得率呈现先增加后减小的趋势。柠檬酸钠在TPP中具有盐溶效应,这可能有利于PSP-D在下相中的有效分配。然而,随着柠檬酸钠质量浓度的不断增加,柠檬酸钠的盐析效应在TPP过程中起着重要作用。该效应削弱了PSP-D与水分子在下相中形成的氢键网络,甚至破坏了氢键网络,从而降低了PSP-D的萃取得率。同时,当柠檬酸钠质量浓度从0.1 g/mL增加到0.5 g/mL时,可溶性蛋白质含量呈下降趋势。在高质量浓度下,柠檬酸钠促进了蛋白质的稳定性,更多的游离蛋白质富集在中间相,导致下相中可溶性蛋白质含量降低。因此,柠檬酸钠质量浓度0.2 g/mL被视为后续TPP试验的最佳盐浓度。
a-碳酸二甲酯和多糖粗提液体积比的影响; b-柠檬酸钠质量浓度的影响; c-温度的影响; d-pH的影响
图1 不同参数对PSP-D萃取效果的影响
Fig.1 Effects of different parameters on extraction yield of PSP-D in the lower aqueous phase
2.1.3 温度对PSP-D萃取效果的影响
较高的温度可以加速TPP过程中的传质速度。本文研究了温度在20~40 ℃对PSP-D的萃取得率和蛋白质含量的影响。如图1-c所示,PSP-D的萃取得率随温度从20 ℃升高到40 ℃呈现先显著升高后略有降低的趋势;如COIMBA等[21]所述,TPP体系中温度的升高有助于多糖的分子结构暴露出更多亲水羟基,这些羟基有助于形成强氢键或与水分子的连接,进一步使下相富集更多的PSP-D。TAN等[22]研究结果表明,30 ℃的温度有利于TPP同时纯化芦荟多糖和蛋白质,提高了芦荟多糖的提取率。然而,在较高温度下,少量碳酸二甲酯可降低与柠檬酸钠的协同效应,从而使PSP-D的萃取得率降低。除了较低的促进水分子缔合和拥挤效应外,碳酸二甲酯在较高温度下的作用可以降低PSP-D的萃取得率。同时,随着温度的升高,下相中蛋白质含量从2.21%下降至1.87%。因此,在本研究中,将温度设置为30 ℃进行后续实验。
2.1.4 pH对PSP-D萃取效果的影响
pH值作为一个重要因素可以影响大分子的电离基团并改变其表面电荷。碳酸二甲酯与多糖粗提液比为0.5∶1.0、柠檬酸钠质量浓度为0.2 g/mL、温度为30 ℃,研究pH值对PSP-D萃取效果的影响。如图1-d所示,在pH 6.0时,PSP-D的萃取得率最大,蛋白质含量为1.76%。随着pH值从6.0增加到8.0,PSP-D的萃取得率略有下降,蛋白质含量略有增加;如前期研究所述,叔丁醇和硫酸铵组成的TPP体系的最佳pH值为7.0,这与现有的碳酸二甲酯和柠檬酸钠组成的TPP体系相似[20]。因此,pH 6.0被认为是PSP-D分配的最佳pH值。
2.2 响应面优化设计
2.2.1 优化TPP工艺参数
采用响应面优化设计的4因子BBD优化TPP工艺参数,以获得PSP-D最大萃取得率。表1给出了工艺变量和实验数据。PSP-D的萃取得率值在8.53%~12.05%,当碳酸二甲酯与多糖粗提液体积比为0.5∶1.0、柠檬酸钠质量浓度为0.2 g/mL,温度为30 ℃,体系pH为6.0时,最大萃取得率为12.05%。对实验数据进行多元回归分析,得到以下二阶多项式方程:
表1 三相分配法萃取分离螺旋藻多糖Box-Behnken实验设计和结果
Table 1 Box-Behnken experimental design and the results for extraction yield of PSP-D from Spirulina platensis by using TPP
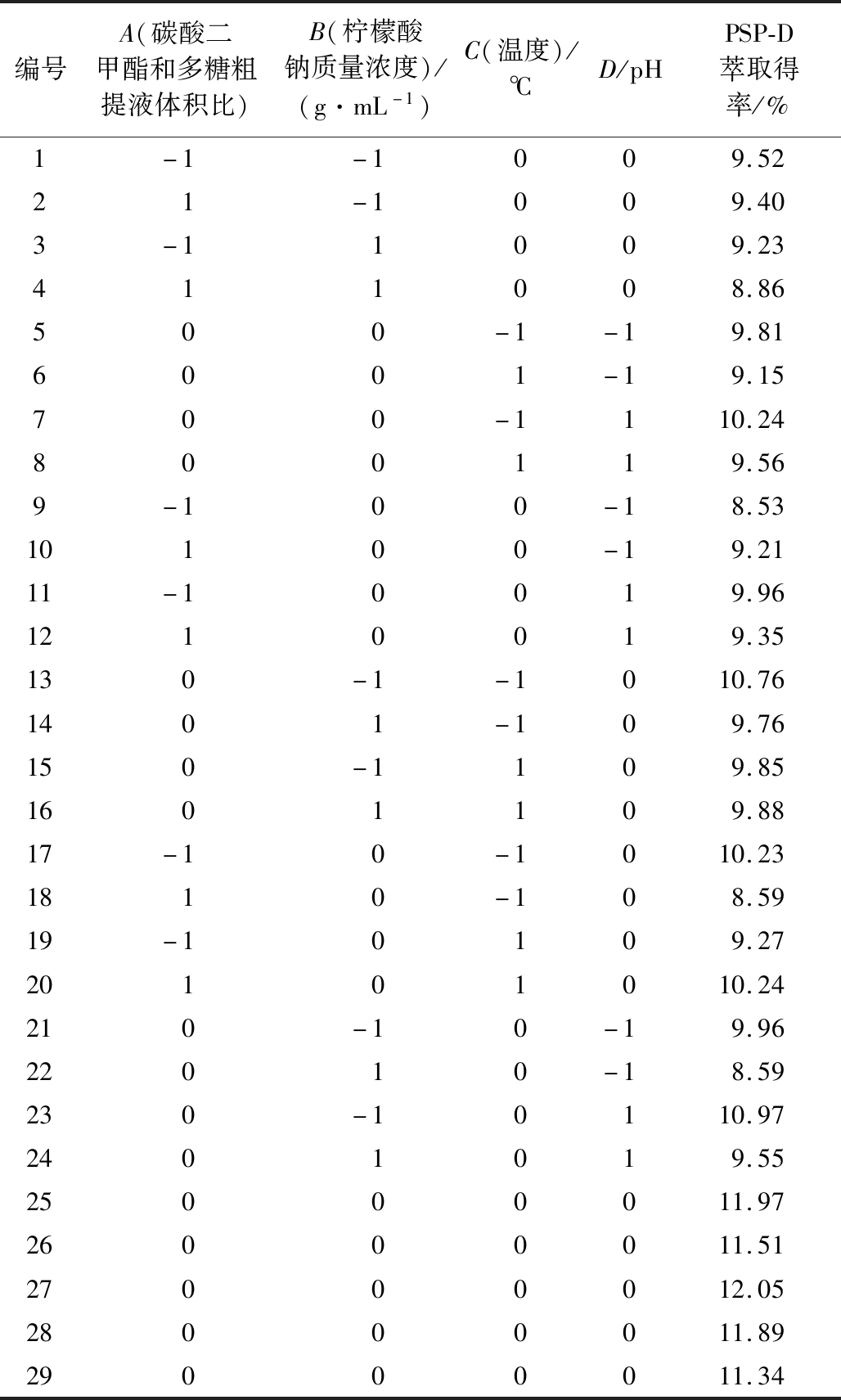
编号A(碳酸二甲酯和多糖粗提液体积比)B(柠檬酸钠质量浓度)/(g·mL-1)C(温度)/℃D/pHPSP-D萃取得率/%1-1-1009.5221-1009.403-11009.23411008.86500-1-19.816001-19.15700-1110.24800119.569-100-18.5310100-19.2111-10019.961210019.35130-1-1010.761401-109.76150-1109.851601109.8817-10-1010.231810-108.5919-10109.2720101010.24210-10-19.9622010-18.59230-10110.972401019.5525000011.9726000011.5127000012.0528000011.8929000011.34
Y=11.752-0.091A-0.383B-0.120C+0.365D-0.063AB+0.653AC-0.323AD+0.258BC-0.013BD-0.006CD-1.430A2-0.938B2-0.812C2-1.120D2
(3)
方差分析可用于模型显著性和适用性分析。一般来说,P值越小,其对应系数的显著性就越高。如表2所示,模型F值为13.586,其P值<0.000 1,说明该模型具有高度显著性。回归系数R2为0.93,进一步证实了模型的准确性和响应与自变量之间的良好相关性。同时,调整后的决定系数![]() 也表明该模型具有较高的显著性。此外,失拟项F值和变异系数的拟合值分别为1.66和3.79。一次项系数(B、D)、交互作用系数(AC)和二次项系数(A2、B2、C2、D2)为极显著(P<0.01)。因此,碳酸二甲酯与多糖粗提液体积比(A)和温度(C)的相互作用对TPP提取PSP-D的过程具有极显著的影响。
也表明该模型具有较高的显著性。此外,失拟项F值和变异系数的拟合值分别为1.66和3.79。一次项系数(B、D)、交互作用系数(AC)和二次项系数(A2、B2、C2、D2)为极显著(P<0.01)。因此,碳酸二甲酯与多糖粗提液体积比(A)和温度(C)的相互作用对TPP提取PSP-D的过程具有极显著的影响。
表2 PSP-D萃取得率的二次多项式模型的回归系数及其显著性分析
Table 2 Regression coefficient estimation and their significant analysis for the quadratic polynomial model of PSP-D yield
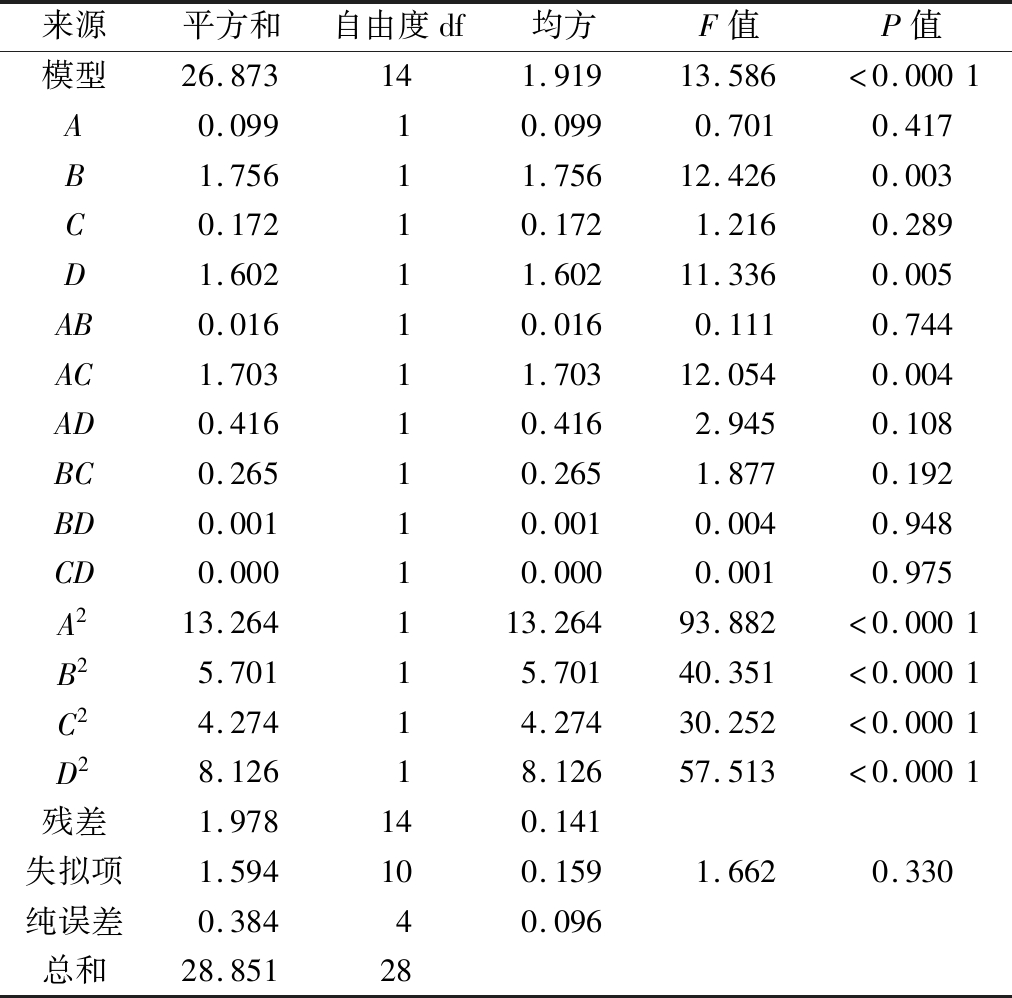
来源平方和自由度df均方F值P值模型26.873141.91913.586<0.0001A0.09910.0990.7010.417B1.75611.75612.4260.003C0.17210.1721.2160.289D1.60211.60211.3360.005AB0.01610.0160.1110.744AC1.70311.70312.0540.004AD0.41610.4162.9450.108BC0.26510.2651.8770.192BD0.00110.0010.0040.948CD0.00010.0000.0010.975A213.264113.26493.882<0.0001B25.70115.70140.351<0.0001C24.27414.27430.252<0.0001D28.12618.12657.513<0.0001残差1.978140.141失拟项1.594100.1591.6620.330纯误差0.38440.096总和28.85128
2.2.2 响应面分析
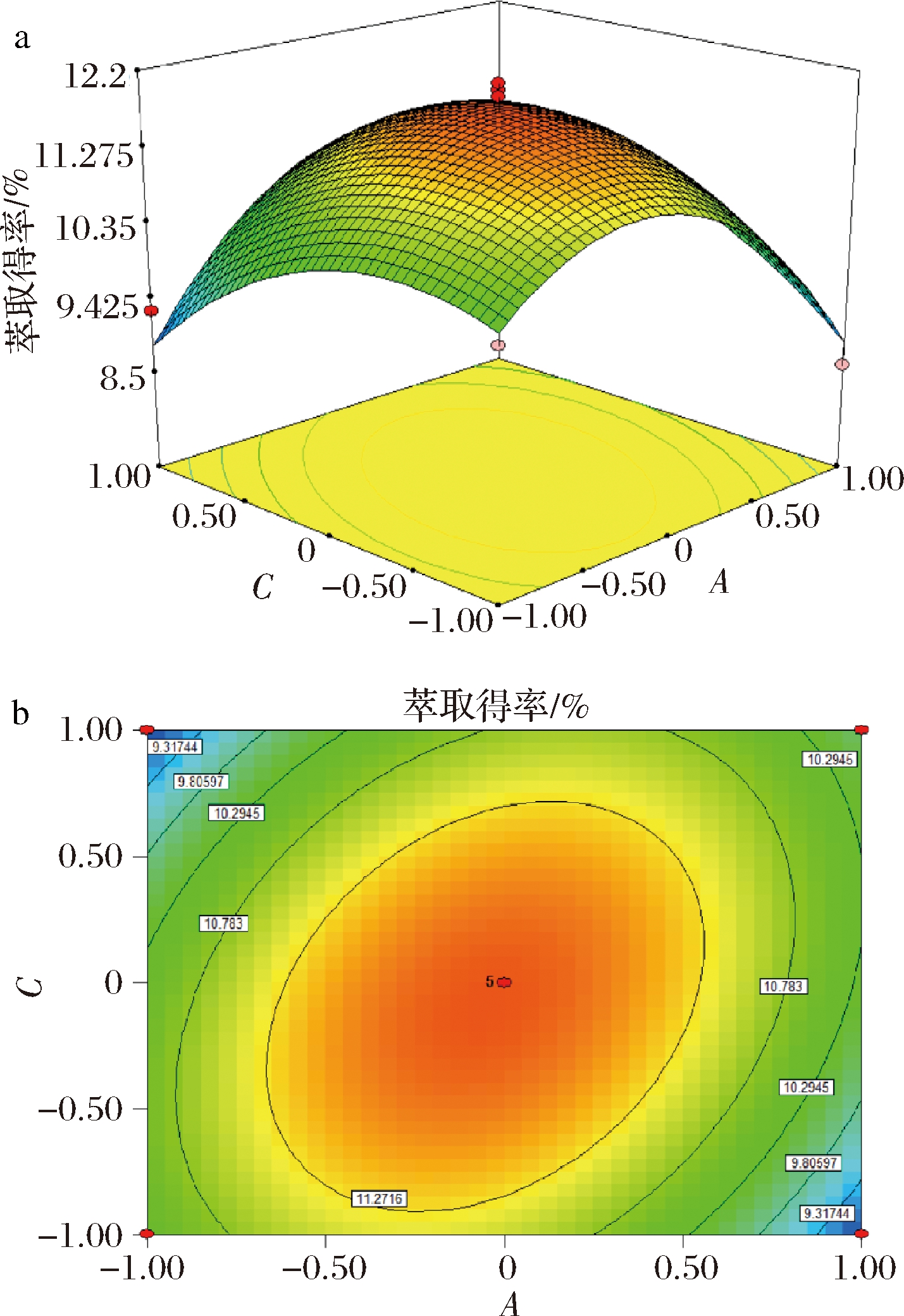
响应面3D和2D等高线图可反映响应值与过程变量水平之间的关系以及2个变量之间的相互作用。结果如图2所示,PSP-D的萃取得率随2个变量的增大先增大后减小,在碳酸二甲酯与多糖粗提液体积比为0.6∶1.00、温度29.59 ℃时,PSP-D的萃取得率达到最大值,并且椭圆等高线图进一步表明碳酸二甲酯与多糖粗提液体积比(A)和温度(C)显著,与表2的结果一致。
2.2.3 优化条件验证
根据方差分析和响应面图对萃取条件进行优化和验证,结果表明,基于现有TPP体系的PSP-D的优化条件为:碳酸二甲酯与多糖粗提液体积比为0.6∶1.00、柠檬酸钠质量浓度为0.177 9 g/mL和温度29.59 ℃和pH 6.18。在此条件下,所建模型预测的PSP-D的最大萃取得率为11.84%。考虑到实际生产的可操作性,对最佳工艺条件进行了修正:碳酸二甲酯与多糖粗提液的体积比为0.6∶1.0,柠檬酸钠质量浓度为0.18 g/mL,温度为30 ℃,pH 6.0。为了验证RSM模型的可靠性,在改进的优化条件下进行了3次重复验证实验。结果表明,PSP-D的萃取得率为(11.90±0.12)%(n=3),接近预测值(11.84%)。因此,基于响应面的BBD被认为是一种优化TPP工艺条件的方法。
a-响应面图; b-等高线图
图2 碳酸二甲酯与多糖粗提液体积比和温度相互作用响应面图和等高线图
Fig.2 Response surface plots and contour plots showing the effects of dimethyl carbonate to crude extract ratio and temperature on the extraction yield of PSP-D
2.3 PSP-D特性
表3总结了采用2种不同的TPP体系从螺旋藻多糖粗提液中制备的PSP-D和PSP-T的含量、单糖组成和分子量大小。优化实验条件获得的PSP-D和PSP-T的萃取得率分别为11.90%和9.25%,说明用碳酸二甲酯和柠檬酸钠形成的TPP体系优于叔丁醇和硫酸铵形成的TPP体系。PSP-D的多糖含量为87.49%,略高于PSP-T的86.17%。PSP-D蛋白质含量低于PSP-T,说明以碳酸二甲酯为有机溶剂的TPP比以叔丁醇为溶剂的TPP更有助于分离富集多糖和蛋白质,这进一步证实了碳酸二甲酯和柠檬酸钠的TPP体系分离富集多糖的优越性。
如表3所示,PSP-D和PSP-T为杂多糖,由不同摩尔比的鼠李糖、甘露糖、葡萄糖组成。葡萄糖是PSP-D和PSP-T分子结构中的主要单糖。结果表明,采用2种不同的TPP体系从螺旋藻多糖粗提液中提取的PSP-D和PSP-T具有不同的化学成分。根据HPSEC-MALLS分析,从含叔丁醇和硫酸铵的TPP体系中得到的PSP-T重均分子量Mw为3.597×104,数均分子量为Mn=2.189×104,Mw/Mn=1.643。从含碳酸二甲酯和柠檬酸钠的TPP系统中得到的PSP-D重均分子量Mw为5.164×104,Mw/Mn=1.847。PSP-T的Mw和Mw/Mn值均低于PSP-D,说明在碳酸二甲酯和柠檬酸钠的TPP体系中,PSP-D的解聚较少。
表3 不同三相体系萃取螺旋藻多糖的含量、单糖组成和分子量
Table 3 Chemical compositions and physiochemical properties of PSP-D and PSP-T from Spirulina platensis by various TPP systems
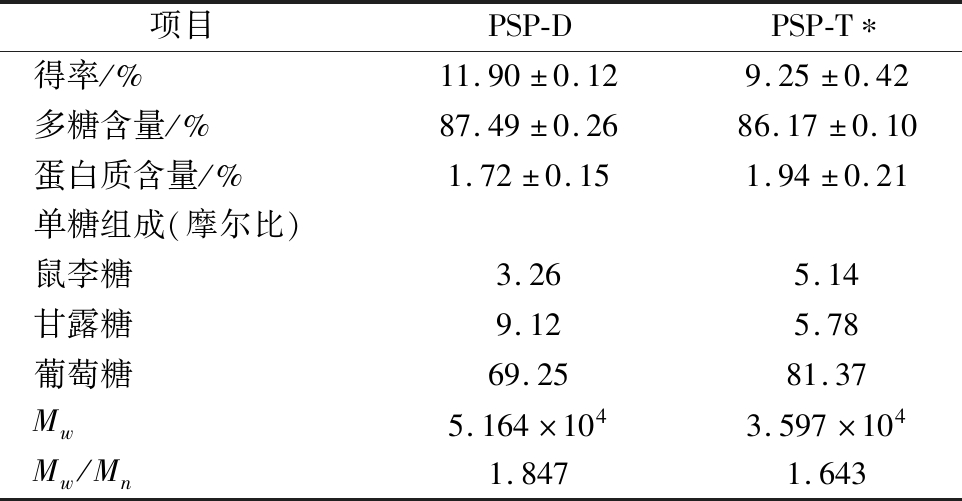
项目PSP-DPSP-T∗得率/%11.90±0.129.25±0.42多糖含量/%87.49±0.2686.17±0.10蛋白质含量/%1.72±0.151.94±0.21单糖组成(摩尔比)鼠李糖3.265.14甘露糖9.125.78葡萄糖69.2581.37Mw5.164×1043.597×104Mw/Mn1.8471.643
注:*为前期研究结果
图3为PSP-D和PSP-T红外光谱,二者具有相似的特征吸收峰,说明二者化学结构类似,在3 385(或3 394)cm-1处宽而强的峰和2 925(或2 929)cm-1处弱的峰分别归因于O—H和C—H伸缩振动峰;1 652(或1 635)cm-1和1 385(或1 391)cm-1在1 000~1 200 cm-1范围内的强吸收带是由于PSP-D和PSP-T中C—O—C和C—O—H基团的拉伸振动引起的,此外,在约861(或858)cm-1处观察到特征峰,这表明吡喃糖存在于α构型中。
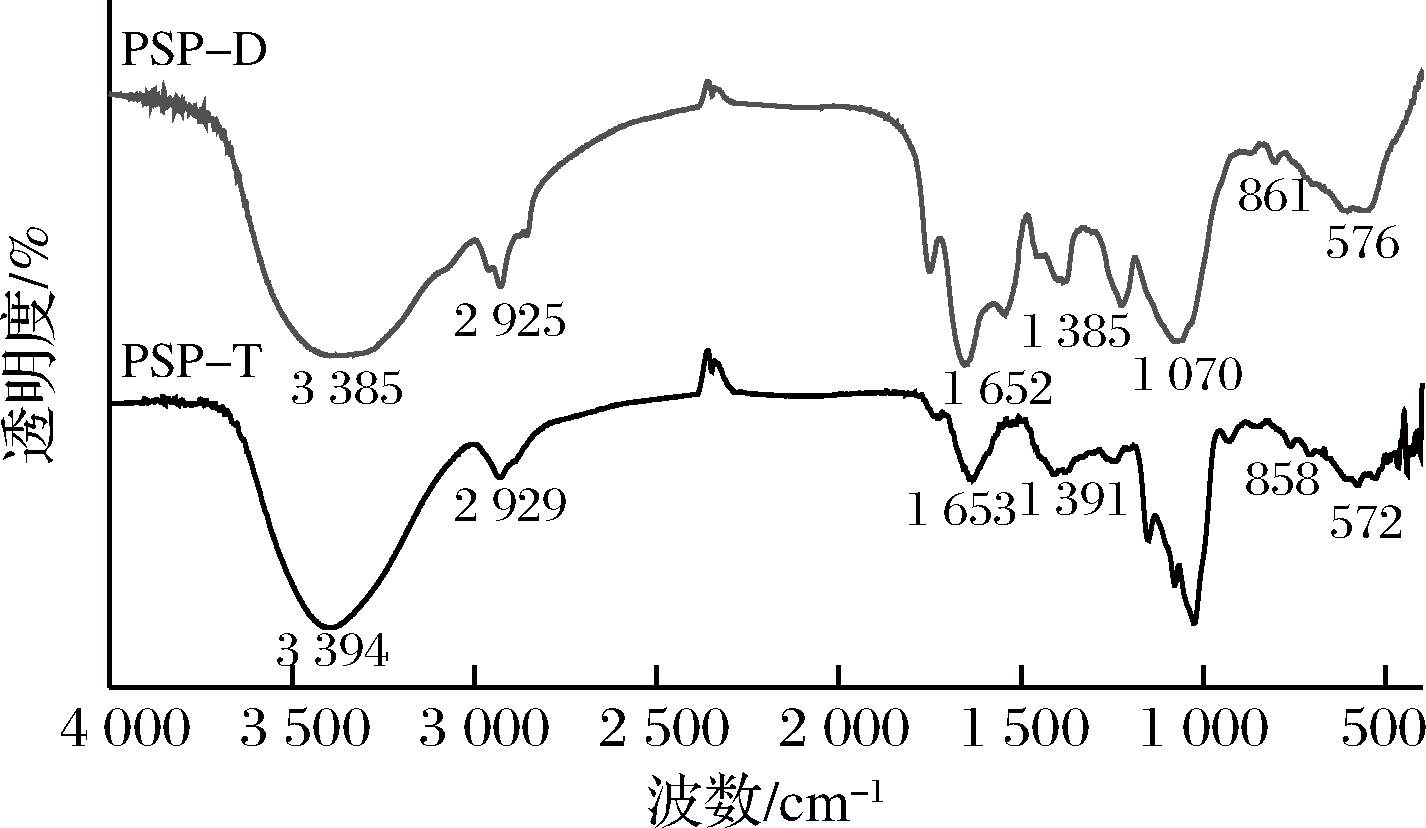
图3 PSP-D和PSP-T红外光谱
Fig.3 FTIR spectra of PSP-D and PSP-T
2.4 体外抗氧化活性
图4显示了PSP-D和PSP-T对DPPH自由基和·OH的清除能力及Trolox当量抗氧化能力和铁离子还原/抗氧化能力。如图4-a和图4-b所示,PSP-D和PSP-T对DPPH自由基和·OH的清除能力随质量浓度从0 mg/mL增加到2.0 mg/mL呈剂量依赖性增加,在质量浓度为2.0 mg/mL时,对DPPH和·OH的清除能力分别为85.42%和86.59%,略高于PSP-T(分别为82.19%和84.16%),但均低于VC(分别为98.89%和98.45%)。PSP-D和PSP-T清除DPPH自由基的IC50分别为0.80和0.86 mg/mL,PSP-D和PSP-T清除·OH能力的IC50分别为0.72和0.78 mg/mL。结果表明,在试验浓度范围内,PSP-D具有更强的清除自由基能力。
如图4-c所示,PSP-D的Trolox当量抗氧化能力和铁离子还原/抗氧化能力分别为384.62 μmol Trolox/g和29.45 μmol Fe2+/g,略大于PSP-T(分别为372.59 μmol Trolox/g和23.56 μmol Fe2+/g)。结果表明,PSP-D具有比PSP-T更强的抗氧化能力,这与DPPH自由基和·OH清除能力的结果一致。这可能是由于PSP-D比PSP-T具有更高的多糖含量,从而有助于提高体外抗氧化活性。另外,单糖组成、化学结构和链构象也与抗氧化活性有关[23]。综上所述,用碳酸二甲酯和柠檬酸钠从现有TPP体系中获得的PSP-D在体外表现出良好的自由基清除能力和抗氧化能力。
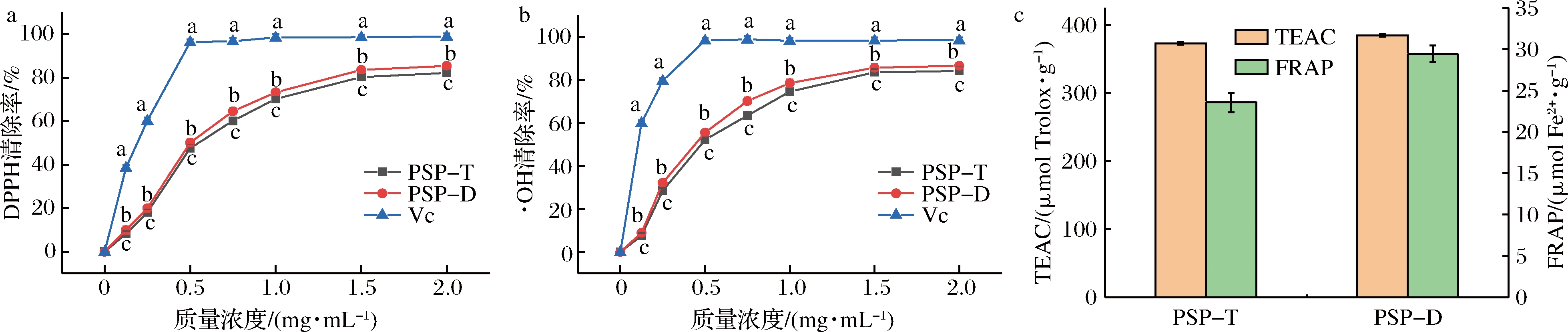
a-DPPH自由基清除自由活性; b-·OH清除率; c-Trolox当量抗氧化能力测定和铁离子还原/抗氧化能力测定
图4 PSP-D和PSP-T样品体外抗氧化活性
Fig.4 In vitro antioxidant activities of the PSP-D and PSP-T
3 结论
本研究采用碳酸二甲酯和柠檬酸钠组成的TPP体系,从螺旋藻多糖粗提液中萃取分离PSP-D。在碳酸二甲酯与多糖粗提液体积比为0.6∶1.0、柠檬酸钠质量浓度为0.18 g/mL、温度30 ℃、pH 6.0的优化条件下,PSP-D的最大萃取得率为(11.90±0.12)%,其含糖量高于叔丁醇和硫酸铵形成TPP制备的PSP-T。二者具有不同的化学组成和分子量,但其主要结构特征没有改变。此外,体外抗氧化实验表明,PSP-D比PSP-T具有更强的清除自由基和抗氧化能力,因此,新形成的以碳酸二甲酯为溶剂的TPP体可取代叔丁醇为溶剂的TPP体系,可获得较高得率和含量的多糖。
[1] RODRIGUES R D,DE CASTRO F C,DE SANTIAGOAGUIAR R S,et al.Ultrasound-assisted extraction of phycobiliproteins from, Spirulina,(Arthrospira),platensis,using protic ionic liquids as solvent[J].Algal Research,2018,31:454-462.
[2] AMANDA,DE,SOUSA,et al.Extraction of biomolecules from Spirulina platensis using non-conventional processes and harmless solvents[J].Journal of Environmental Chemical Engineering,2017,5(3):2 101-2 106.
[3] CHAIKLAHAN R,CHIRASUWAN N,TRIRATANA P,et al.Polysaccharide extraction from Spirulina sp.and its antioxidant capacity[J].International Journal of Biological Macromolecules,2013,58:73-78.
[4] HOSEINI S M,KHOSRAVI-DARANI K,MOZAFARI M R.Nutritional and medical applications of Spirulina microalgae[J].Mini Reviews in Medicinal Chemistry,2013,13(8):1 231-1 237.
[5] QIAN Z G.Cellulase-assisted extraction of polysaccharides from Cucurbita moschata and their antibacterial activity[J].Carbohydrate Polymers,2014,101:432-434.
[6] KURD F,SAMAVATI V.Water soluble polysaccharides from Spirulina platensis:Extraction and in vitro anti-cancer activity[J].International Journal of Biological Macromolecules,2015,74:498-506.
[7] PAULE B J A,MEYER R,MOURA-COSTA L F,et al.Three-phase partitioning as an efficient method for extraction/concentration of immunoreactive excreted-secreted proteins of Corynebacterium pseudotuberculosis[J].Protein Expression and Purification,2004,34(2):311-316.
[8] YAN J K,WANG Y Y,QIU W Y,et al.Three-phase partitioning as an elegant and versatile platform applied to nonchromatographic bioseparation processes[J].Critical Reviews in Food Science and Nutrition,2018,58(14):2 416-2 431.
[9] SHAH S,SHARMA A,GUPTA M N.Extraction of oil from Jatropha curcas L.seed kernels by enzyme assisted three phase partitioning[J].Industrial Crops and Products,2004,20(3):275-279.
[10] PIKE R N,DENNISON C.Protein fractionation by three phase partitioning (TPP) in aqueous/t-butanol mixtures[J].Biotechnology and Bioengineering,1989,33(2):221-228.
[11] KETNAWA S,BENJAKUL S,MARTINEZALVAREZ O,et al.Three-phase partitioning and proteins hydrolysis patterns of alkaline proteases derived from fish viscera[J].Separation and Purification Technology,2014:174-181.
[12] MCGREGOR D.Tertiary-Butanol:A toxicological review[J].Critical Reviews in Toxicology,2010,40(8):697-727.
[13] NARAYAN A V,MADHUSUDHAN M C,RAGHAVARAO K.Extraction and purification of ipomoea peroxidase employing three-phase partitioning[J].Applied Biochemistry and Biotechnology,2008,151(2-3):263.
[14] SAMOR C,BASAGLIA M,CASELLA S,et al.Dimethyl carbonate and switchable anionic surfactants:two effective tools for the extraction of polyhydroxyalkanoates from microbial biomass[J].Green Chemistry,2015,17(2):1 047-1 056.
C,BASAGLIA M,CASELLA S,et al.Dimethyl carbonate and switchable anionic surfactants:two effective tools for the extraction of polyhydroxyalkanoates from microbial biomass[J].Green Chemistry,2015,17(2):1 047-1 056.
[15] TUNDO P,SELVA M.The chemistry of dimethyl carbonate[J].Accounts of Chemical Research,2002,35(9):706-716.
[16] LANJEKAR K,RATHOD V K.Utilization of glycerol for the production of glycerol carbonate through greener route[J].Journal of Environmental Chemical Engineering,2013,1(4):1 231-1 236.
[17] PANADARE D C,RATHOD V K.Extraction of peroxidase from bitter gourd (Momordica charantia) by three phase partitioning with dimethyl carbonate (DMC) as organic phase[J].Process Biochemistry,2017,61:195-201.
[18] 罗光宏,马明辉,张喜峰,等.三相萃取体系分离富集螺旋藻多糖及其结构特征分析[J].食品与发酵工业,2019,45(6):147-152.
[19] DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.
[20] WANG Z B,CHEN B B,LUO L,et al.Fractionation,physicochemical characteristics and biological activities of polysaccharides from Pueraria lobata roots[J].Journal of the Taiwan Institute of Chemical Engineers,2016,67:54-60.
[21] DE OLIVEIRA COIMBRA C G,LOPES C E,CALAZANS G M T.Three-phase partitioning of hydrolyzed levan[J].Bioresource Technology,2010,101(12):4 725-4 728.
[22] TAN Z J,WANG C Y,YI Y J,et al.Three phase partitioning for simultaneous purification of aloe polysaccharide and protein using a single-step extraction[J].Process Biochemistry,2015,50(3):482-486.
[23] TIAN L,ZHAO Y,GUO C,et al.A comparative study on the antioxidant activities of an acidic polysaccharide and various solvent extracts derived from herbal Houttuynia cordata[J].Carbohydrate Polymers,2011,83(2):537-544.