植物蛋白饮料(plant protein beverage)是指以富含蛋白的植物果实、种子或果仁等为原料制成的饮料,近年来以“天然、健康、绿色、营养”的理念成为饮料市场的新兴产品[1]。植物蛋白饮料种类繁多,根据配料表中的主要成分进行分类,包括豆奶(浆)、花生露(乳)和果仁露等,这些植物蛋白饮料含有丰富的营养成分,包含了人体所需的蛋白质、脂肪和微量元素等,具有独特的风味,因而备受消费者的喜爱。但是一些不法商贩由于经济利益的驱使,将低成本的植物原料掺入到产品中以次充好,比如在核桃乳中掺入价格远远低于核桃的大豆、花生等成分[2-3],使其成本大大降低。这种制假、掺假的恶劣行为不仅会损害消费者的经济利益,还会对身体造成不同程度的损害。如果消费者对掺入的成分过敏,在不知情的情况下误食后可能会产生过敏反应,甚至危及生命[4-5]。因此,植物源性饮料掺假问题需要食品安全监管部门重点关注,通过有效预防植物蛋白饮料掺假,才能构建更加健康经济的食品安全环境。
目前,在检测植物蛋白饮料掺假问题的方法中,分子生物学方法是较为重要的手段[6],其中包括酶联免疫技术[7]、DNA条形码技术[8]、聚合酶链式反应(polymerase chain reaction, PCR)和实时荧光定量PCR技术(real-time fluorescent quantitative polymerase chain reaction,RT-qPCR)[9]等。2017年7月,国家食品药品监督管理总局颁布了食品补充检验方法《植物蛋白饮料中植物源性成分鉴定(BJS 201707)》,为监管植物蛋白饮料掺假的情况提供了重要技术保障[10]。
本研究试图建立3种植物成分的实时荧光PCR检测方法所需阳性质粒,用于核桃、花生和大豆成分的特异性检测,并验证其方法特异性和检验灵敏度,研究出一种准确、灵敏、高效的实时荧光PCR反应体系,解决植物蛋白饮料在日常监管工作中缺乏标准物质的难题,为植物蛋白饮料掺假检测提供技术支持。
1 材料与方法
1.1 主要试剂
TaqManTM Universal Master Mix Ⅱ, with UNG,App ied Biosystems公司; PrimeSTAR®HS DNA Polymerase,TaKaRa公司;BioReady rTa,Bioer公司;Qiagen DNeasy mericon Food Kit,Qiagen公司;核桃、花生、大豆的引物和探针序列均引自补充检验方法《植物蛋白饮料中植物源性成分鉴定(BJS 201707)》[10],济南博尚生物技术有限公司(Biosune)合成,见表1。
表1 实时荧光PCR检测引物、探针
Table 1 Specific primers and probes sequences in RT-qPCR
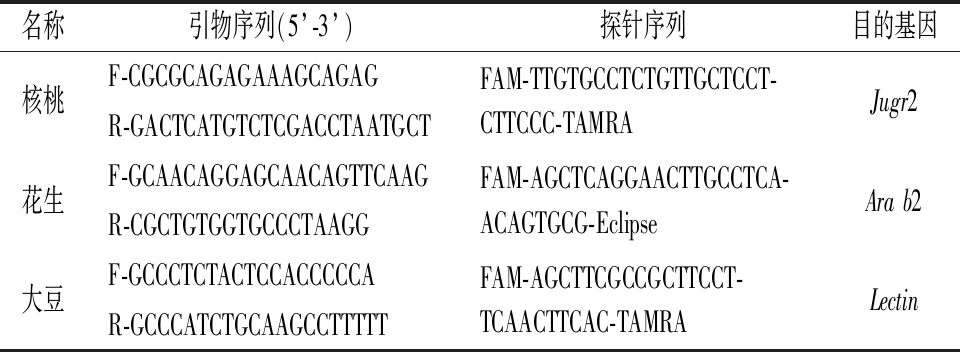
名称引物序列(5’-3’)探针序列目的基因核桃F-CGCGCAGAGAAAGCAGAGR-GACTCATGTCTCGACCTAATGCTFAM-TTGTGCCTCTGTTGCTCCT-CTTCCC-TAMRAJugr2花生F-GCAACAGGAGCAACAGTTCAAGR-CGCTGTGGTGCCCTAAGGFAM-AGCTCAGGAACTTGCCTCA-ACAGTGCG-EclipseArab2大豆F-GCCCTCTACTCCACCCCCAR-GCCCATCTGCAAGCCTTTTTFAM-AGCTTCGCCGCTTCCT-TCAACTTCAC-TAMRALectin
1.2 主要仪器
7500 FAST实时荧光PCR仪,美国 ABI 公司;NanoDrop 2000c生物紫外可见分光光度计,美国 Thermo Fisher公司;高速冷冻离心机,德国Eppendorf公司,生物安全柜,美国NuAire公司。
1.3 基因组DNA的提取
使用试剂盒Qiagen DNeasy mericon Food Kit 提取植物 DNA,使用 紫外可见分光光度计检测 DNA 的浓度及质量,将 DNA 稀释到 10~100 ng/μL,-20 ℃保存备用。
1.4 阳性质粒分子的构建
根据设计的PCR引物,选取核桃源性成分Jugr2基因、花生源性成分Ara b2基因和大豆源性成分Lectin基因特异性序列,对这3种植物的基因组分别进行PCR扩增,PCR扩增产物通过琼脂糖凝胶电泳进行分离,再用胶回收试剂盒进行纯化。将PCR纯化产物与pMD19-T载体进行连接,然后将连接产物加入感受态细胞中进行转化,构建相应阳性质粒分子,序列合成由济南博尚生物技术有限公司完成。
1.5 实时荧光PCR检测
荧光PCR反应体系: PCR反应预混液12.5 μL,上下游引物(10 μmol/L)各1 μL,探针(10 μmol/L)1 μL,DNA模板(10~100 ng/μL)2 μL,用灭菌去离子水补足至总体积25 μL。荧光PCR反应程序为:50 ℃ 2 min;95 ℃ 15 min;40个循环(95 ℃ 15 s,60 ℃ 1 min)。
试验结果用软件ABI 7500 FAST Software v2.0.1进行分析,根据《植物蛋白饮料中植物源性成分鉴定(BJS 201707)》[10]中结果判定与表述部分,当扩增循环数(cycle threshold,Ct)≤35.0时,判定被检样品为阳性。
2 结果与分析
2.1 阳性质粒分子构建
为构建核桃、花生和大豆的特异性检测标准分子,分别将核桃源性成分Jugr2基因、花生源性成分Arab2基因和大豆源性成分Lectin基因进行PCR扩增,再通过琼脂糖凝胶电泳进行分离,上样量为8 μL,每个样品设置2个平行。由图1可知,核桃Jugr2基因、花生Arab2、大豆Lectin基因长度分别为91、72和118 bp,将扩增片段克隆到pMD19-T载体上,从而得到3个标准质粒分子。
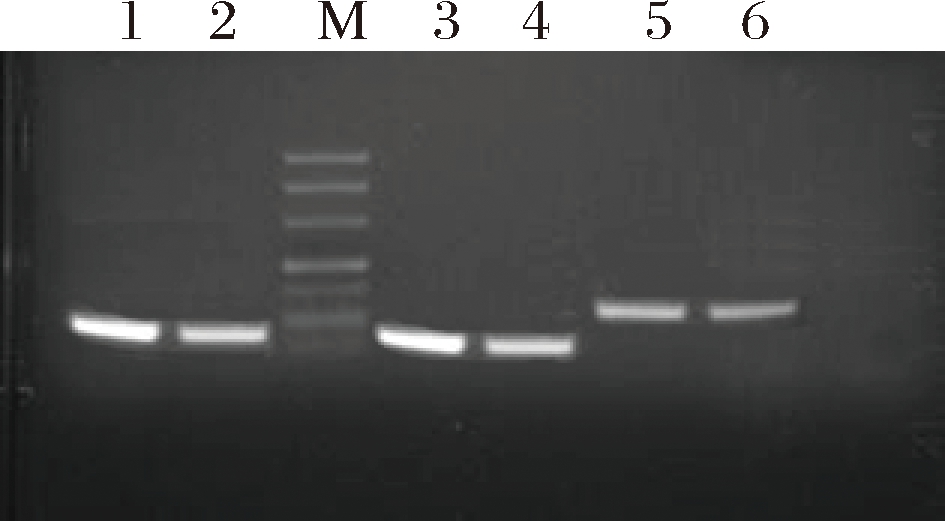
1, 2: 核桃Jugr2基因PCR扩增产物; M: DL500; 3, 4: 花生Arab2基因PCR扩增产物; 5, 6: 大豆Lectin基因PCR扩增产物
图1 核桃、花生和大豆PCR扩增琼脂糖凝胶电泳图
Fig.1 Agarose gel electrophoresis of walnut, peanut and soybean amplified by PCR
2.2 阳性质粒分子的特异性
按照1.5的荧光PCR反应体系,荧光PCR反应模板分别为核桃、花生和大豆阳性质粒分子,同时做质量控制,以其对应的基因组DNA作为阳性对照,不含核桃、花生和大豆的DNA作为阴性对照,灭菌去离子水作为空白对照,进行阳性质粒分子特异性验证。
由图2的扩增曲线可知,植物基因组DNA、构建的阳性质粒分子均为阳性,核桃Jugr2基因及其阳性质粒分子的Ct值分别为21、13个循环;花生Ara b2基因及其阳性质粒分子的Ct值分别为23、14个循环;大豆Lectin基因及其阳性质粒分子的Ct值分别为20、13个循环。阴性对照无增幅说明基因组间无交叉污染,空白对照无增幅说明反应体系无污染,因此构建的3种质粒分子均具有良好的特异性,可以作为阳性对照使用。
2.3 阳性质粒分子的灵敏度
将核桃、花生和大豆质粒分别进行10倍梯度稀释,自质量浓度100 ng/μL稀释至10-6 ng/μL,使用稀释后的质粒作为模板进行荧光PCR扩增,每个稀释度设置3个平行,用于灵敏度的验证,结果见图3。
标准中规定当Ct值≤35时,判定结果为阳性,由图2可知,3种阳性质粒分子的检出限均可达到10-5 ng/μL,具有较高的检测灵敏度。还可发现,稀释度越高平台期越低,可能是由于质量浓度太低导致反应体系中形成大量引物二聚体,使引物很快消耗完,从而形成扩增曲线的平台期很低。

a-核桃;b-花生;c-大豆
图2 阳性质粒分子特异性检测图
Fig.2 Results of specificity of positive plasmid
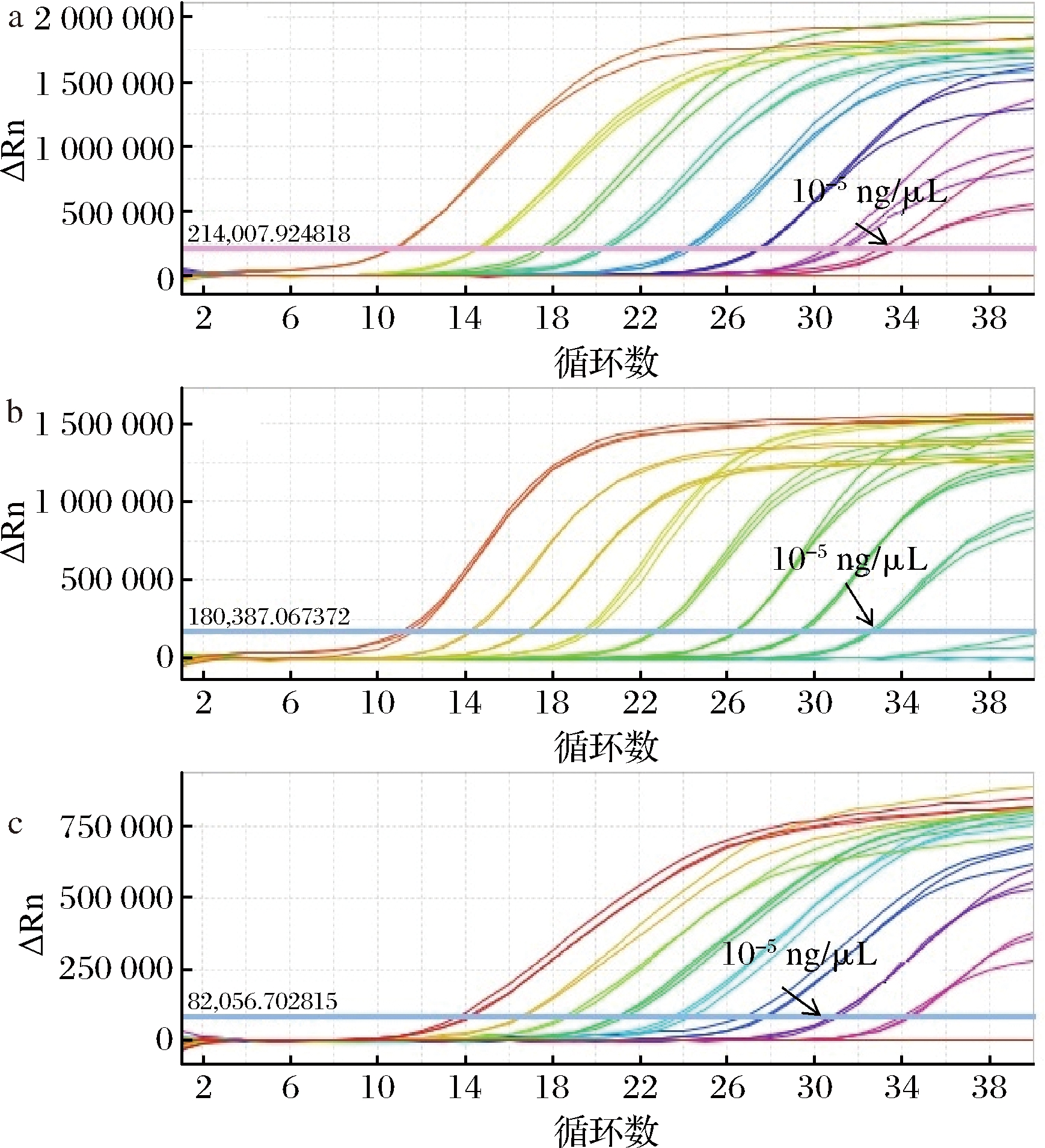
a-核桃;b-花生;c-大豆
图3 阳性质粒分子灵敏度检测结果
Fig.3 Results of sensitivity of positive plasmid
2.4 标准曲线的绘制
将质粒DNA标准物质从质量浓度100 ng/μL稀释至10-2 ng/μL,使用稀释后的质粒作为模板进行荧光PCR扩增,每个稀释度设置3个平行,以质量浓度为横轴,Ct值为纵轴,建立标准曲线(图4)[11]。
以核桃、花生和大豆阳性质粒分子建立的标准曲线的扩增效率分别为93.299%、123.623%、132.975%,且相关线性系数R2均在0.99以上,实验结果表明3种阳性质粒分子均具有良好的线性关系,可以作为阳性标准物质用于样品的定量分析。

a-核桃;b-花生;c-大豆
图4 阳性质粒分子标准曲线
Fig.4 Standard curve of positive plasmid
2.5 三种品牌PCR预混液对荧光PCR反应结果的影响
将3个阳性质粒分子从质量浓度100 ng/μL稀释至10-6 ng/μL,用10倍稀释产物作为模板,选取Appied Biosystems、TaKaRa和Bioer三种品牌的PCR预混液对实时荧光PCR反应结果进行比较分析[12],见图5~图7。
根据检测结果可知,所有目的基因都可以在40个循环内得到典型的S型动力学曲线,曲线指数期增长明显,扩增曲线平行性、重复性和PCR反应效率较好,相邻浓度扩增曲线之间Ct值都十分接近,保证了定量结果的准确性[13]。
由图5~图7可知,利用Appied Biosystems、TaKaRa和Bioer三种品牌的PCR预混液分别进行实时荧光PCR反应,核桃阳性质粒的反应灵敏度分别为10-5、10-4和10-3 ng/μL,花生阳性质粒的反应灵敏度分别为10-5、10-4和10-2 ng/μL,大豆阳性质粒的反应灵敏度分别为10-5、10-4和10-3 ng/μL。3种预混液的灵敏度略有不同,分析其原因可能是由于Appied Biosystems酶中含有尿嘧啶N糖基化酶(uracil N-glycosylase,UNG)[14],能够将脱氧尿嘧啶替换为胸腺嘧啶,以区分扩增产物和模板。在变性步骤前增加50 ℃保温,使前面的扩增产物对尿嘧啶DNA糖基化酶(uracil-DNA glycocasylase,UDG)敏感,所以可处理以破坏残余产物,起到防止残留污染,防止非模板DNA的扩增,从而降低了假阳性率,保证其较高的灵敏度。

a-Appied Biosystem; b-TaKaRa; c-Bioer(下同)
图5 三种品牌PCR预混液实时荧光PCR反应效果比较(核桃)
Fig.5 Comparation of the effective of real-time fluorescence PCR reaction of three commercial PCR premixed liquid (walnut)
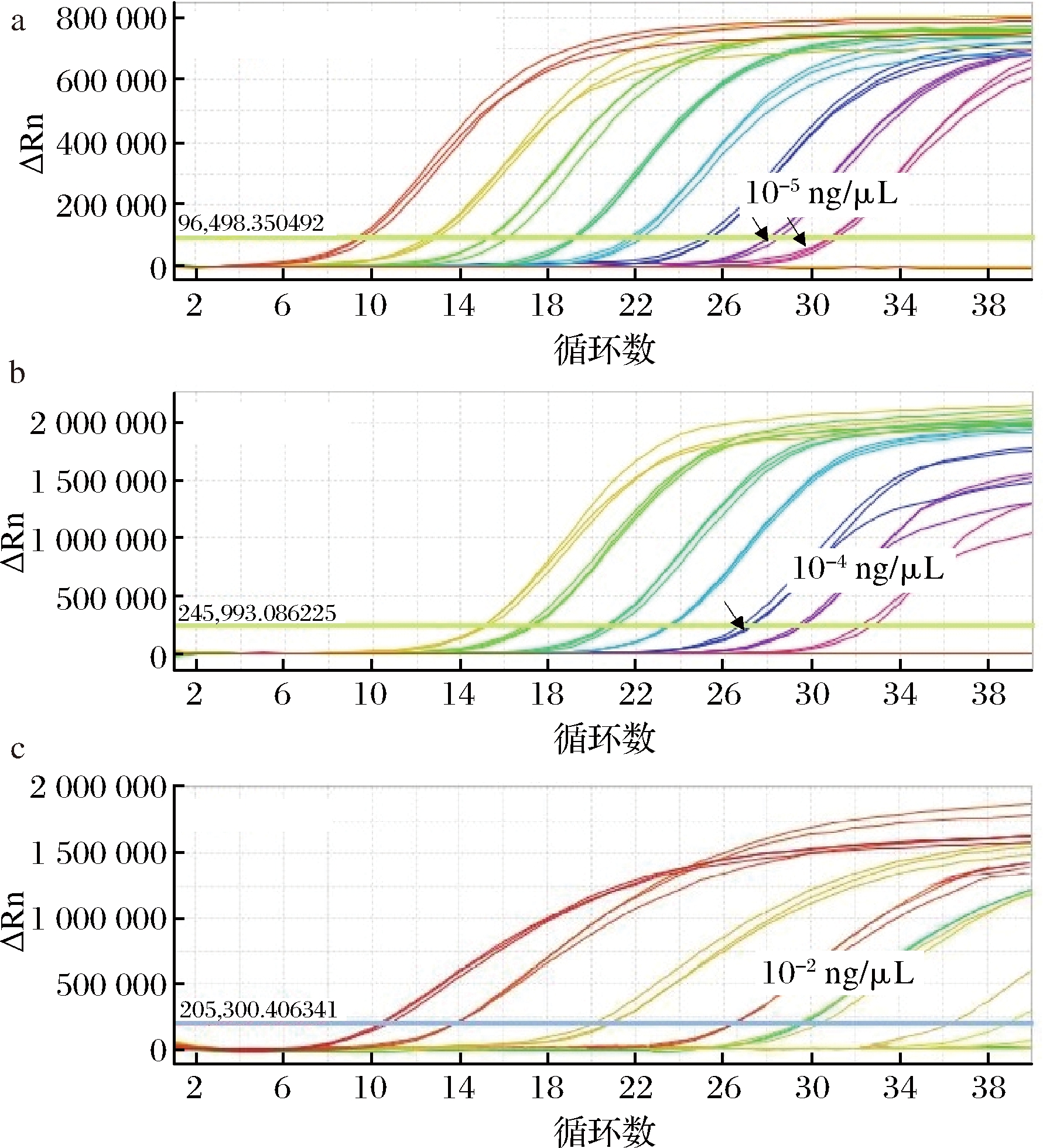
图6 三种品牌PCR预混液实时荧光PCR反应效果比较(花生)
Fig.6 Comparation of the effective of real-time fluorescence PCR reaction of three commercial PCR premixed liquid (peanut)

图7 3种品牌PCR预混液实时荧光PCR反应效果比较(大豆)
Fig.7 Comparation of the effective of real-time fluorescence PCR reaction of three commercial PCR premixed liquid (soybean)
3 结论与讨论
在应用荧光PCR技术进行植物源性成分检测时,都需要阳性物质作为对照,确保实验结果的有效性[15]。标准物质可以作为阳性对照,还可以绘制标准曲线用于样品的定量分析,但考虑到目前我国用的标准物质大多购于国外,不仅价格昂贵,且品种少、货期长,不能满足日常检验的需求。为解决这一难题,本研究构建3种阳性质粒分子以代替基体标准物质,使其可不受原材料限制从而对植物源性成分进行检测[16]。由于Jugr2基因、Ara b2基因和Lectin基因分别是核桃、花生和大豆成分的内源基因,具有良好的稳定性,因此选取这3种基因进行质粒的构建,同时验证了其方法特异性和检验灵敏度。另外比较了不同品牌PCR预混液对反应效率的影响,研究发现3种品牌的PCR预混液均具有较高的灵敏度。本研究为荧光PCR反应液的选择提供了技术依据,且阳性对照不再依赖于核桃、花生和大豆材料的供应,解决了食品监管工作中缺乏阳性对照的难题,对于植物源性成分的鉴定具有重要意义和广阔的应用前景。
[1] 郭明月. 植物蛋白饮料稳定性及其测定方法综述[J].饮料工业,2014,17(12):34-37.
[2] 魏晓璐,黄鑫,冯悦,等.核桃乳(露)饮品中花生、大豆成分的PCR检测方法[J].食品工业科技,2014,35(13):288-291;295.
[3] 张敬敬,宋合兴,刘博,等.核桃乳中掺大豆乳的鉴别研究[J].现代食品科技,2013,29(4):881-884;811.
[4] 赵益菲,布冠好,左颖昕.植物蛋白过敏原及其物理脱敏方法的研究进展[J].粮食与油脂,2017,30(5):8-11.
[5] 丁清龙,曾晓琮,周露,等.广东省植物源性饮料掺假情况摸底调查[J].食品安全质量检测学报,2018,9(12):2 953-2 957.
[6] 刘爽,师晶晶.分子生物技术在食品检测中的应用[J].现代食品,2018(8):112-113.
[7] 侯瑾,李迎秋.酶联免疫吸附技术在食品安全检测中的应用[J].中国调味品,2017,42(6):165-169.
[8] PARVATHY V A,SWETHA V P,SHEEJA T E,et al.Detection of plant-based adulterants in turmeric powder using DNA barcoding[J].Pharmaceutic Biology,2015,53(12):1.
[9] 窦丽芳,李梦迪,方慧文.实时荧光PCR技术在食品检验领域的应用[J].食品安全导刊,2015(21):137-141.
[10] 总局关于发布《植物蛋白饮料中植物源性成分鉴定》食品补充检验方法的公告[J].中国食品卫生杂志,2017,29(4):453.
[11] 郑世超,郭颖慧,董海龙,等.3种动物源性成分阳性标准分子的构建与应用[J].食品研究与开发,2018,39(3):168-174.
[12] 梁文,许丽,李兰英,等.转基因大豆质粒DNA标准物质的研制[J].实验室研究与探索,2016,35(5):18-21;45.
[13] 郭颖慧,郑世超,霍胜楠.3种动物源性成分阳性质粒构建及检测研究[J].食品研究与开发,2018,39(6):135-142.
[14] 鲍洪波,王晋芳,钱世钧.尿嘧啶N基糖化酶(UNG)的研究进展[J].中国生物工程杂志,2003,23(1):43-47.
[15] 刘晋,邓汉超,王学林,等.转基因水稻标准质粒分子的构建与分析[J].中国种业,2016(12):52-55.
[16] TAVERNIERS I,BOCKSTAELE E,LOOSE M.Cloned plasmid DNA fragments as calibrators for controlling GMOs:different real-time duplex quantitative PCR methods[J].Anal Bioanal Chem,2004,378(5):1 198-1 207.