颜色是消费者对食品感官评价的重要指标之一, 随着时间的改变,食品在生产、贮藏、运输过程中因化学和物理等原因可改变食品的颜色,为此,化学类色素的使用成为保持食品良好色泽的主要手段[1]。在市场上广泛应用的化学类色素大多为偶氮类化合物,与天然色素相比价格更低,稳定性更好[2]。但是偶氮类合成着色剂在人体内偶氮还原酶的作用下所释放的芳香胺具有多重危害,不仅会造成头痛以及儿童多动症,甚至可能引发癌症[3]。碱性橙、酸性橙、碱性嫩黄O等高毒的工业染料与人体接触以及食用后更是具有“三致”等危害[4-5]。
我国监督检测部门参考的国家标准GB2760—2014中明确分类了不同食品所允许添加的人工合成着色剂的最大限量,国家发布的食品整治办[2009]29号文件中将碱性橙、酸性橙、碱性嫩黄O等工业染料列为禁用食品添加剂[6]。但仍有不法商贩非法添加,对食品安全造成威胁。
在近年对食品中人工合成着色剂和禁用工业染料的测定方法研究中,张兰天等[7]采用直接稀释法对饮料中的人工合成色素进行提取,利用高效薄层色谱法进行测定;YI等[8]利用高效毛细管电泳对食品中色素进行测定;宋新等[9]利用示波极谱法对熟肉中的5种水溶性着色剂进行测定。许多学者利用高效液相色谱法对不同食品基质中的禁用工业染料和人工合成着色剂进行了前处理和测定方法的优化和建立[10-15]。采用固相萃取法,利用高效液相色谱-串联质谱法对不同基质中的多种禁用工业染料进行方法优化及测定,可提高检测效率[16-19]。目前,市面上同时应用人工合成着色剂和禁用工业染料的食品主要为液体饮料和腐竹等豆制品,在熟肉制品和酱类中应用较少。我国现行国家标准GB5009.35—2016[20]和GB/T23496—2009[21]则是利用聚酰胺吸附方法和浓缩提取法对着色剂和工业染料进行提取,其前处理过程复杂,样品回收率低,并且国标中聚酰胺吸附法不适用于腐竹等豆制品的提取和测定。国家禁用工业染料及着色剂的测定已分别制定了不同的标准,但只针对一种或几种色素的提取使用,则较为繁琐,无法对样品同时提取并兼顾10种色素测定条件,耗时耗力。因此,建立一种同时测定着色剂和禁用工业染料的快捷且便利的高效液相色谱法显得尤为重要。
1 材料与方法
1.1 仪器和设备
UltiMate 3000高效液相色谱仪配DAD检测器,自动进样器,柱温箱;冷冻高速离心机,赛默飞世尔科技中国有限制公司;Agela Venusil XBP-C18色谱柱,博纳艾杰尔科技;MIULAB多管涡旋混合仪,杭州米欧仪器有限公司;超纯水机,济南太平玛环保设备有限公司;200 g快速开盖万能高速粉碎机,上海比朗仪器有限公司;流动相过滤器,津腾;KQ-250DE型数控超声波清洗器,昆山市超声仪器有限公司;0.45 μm PTFE滤膜,津腾。
1.2 化学试剂
甲醇,正己烷(色谱纯)、德国默克;乙酸铵、乙酸锌(均为分析纯),天津市永大化学试剂有限公司;亚铁氰化钾(分析纯),天津市标准科技有限公司;超纯水;胭脂红(1 mg/mL)、日落黄(1 mg/mL)、诱惑红(1 mg/mL)、酸性红(1 mg/mL)、亮蓝(1 mg/mL),中国科学计量院;碱性橙2(0.25 g)、碱性橙21(0.25 g)、碱性橙22(0.25 g)、酸性橙2(0.25 g)、碱性嫩黄O(0.25 g),北京曼哈格。
1.3 标准溶液的配制
准确称取1.2小节中的固体标准品,用1∶1甲醇水溶解并定容,配制为1 mg/mL单个标准溶液。移取适量单标溶液,用1∶1甲醇水定容,配制为100 μg/mL的10种混合标准储备液。
标准曲线:准确移取100 μg/mL混合标准溶液,配制质量浓度为0.1、0.5、1.0、5.0、10.0、25.0 μg/mL的标准系列溶液。
1.4 沉淀剂的配制
亚铁氰化钾溶液:称取10.6 g亚铁氰化钾,用纯水溶解并定容至100 mL[22]。
乙酸锌溶液:称取21.9 g乙酸锌,加纯水溶解并定容至100 mL[22]。
1.5 色素提取方法
饮料类:准确称取5.00 g样品,含二氧化碳的饮料在50 ℃水浴条件下超声30 min,驱除二氧化碳和乙醇,使用80%甲醇水提取色素,定容至25 mL,超声20 min,放置涡旋仪涡旋2 min,含有固体果粒的饮料需使用离心机离心。取上清液经0.45 μm滤膜过滤,上机。
配制酒类:准确称取5.00 g样品,50 ℃水浴声条件下超声30 min驱除乙醇,用80%甲醇水提取色素,定容至25 mL,超声20 min,放置涡旋仪涡旋2 min。取混合溶液经0.45 μm滤膜过滤,上机。
干制豆制品类:取适量干制豆制品至高速粉碎机粉碎,准确称取1.00 g样品,加入1.4小节中2种沉淀剂各0.5 mL,用80%甲醇水定容至25 mL,超声20 min,放置旋转振荡涡旋器70 r/min涡旋约2 min,将低温冷冻离心机设置为9 000 r/min,4℃,离心4 min。取上清液经0.45 μm滤膜过滤,上机。
1.6 色谱条件
Agela Venusil XBP-C18 (250 mm×4.6 mm, 5 μm) 色谱柱;碱性橙2、碱性嫩黄O’波长为449 nm;碱性橙21、碱性橙22、酸性橙2波长为485 nm;胭脂红、日落黄、诱惑红、酸性红波长均为254 nm;亮蓝波长628 nm;流动相20 mmol/L醋酸铵溶液-甲醇(梯度洗脱条件见表1);柱温25 ℃;进样量10 μL;流速1.0 mL/min。
表1 5种人工合成着色剂和5种禁用工业染料的梯度洗脱程序
Table 1 Gradient elution procedures for 5 synthetic colorants and 5 prohibited industrial dyes

时间/min流动相A/%流动相B/%080206.0703021.0307033.0109033.1802038.08020
注:流动相A为20 mmol/L醋酸铵溶液,流动相B为色谱纯甲醇
2 结果与分析
2.1 色谱柱的选择
实验根据1.6小节中所优化的色谱条件对同等性能的C18色谱柱,分别为SUNTEKTM YWG-C18 (250 mm×4.6 mm, 10 μm) 色谱柱、OMNI Hubble-C18 (250 mm×4.6 mm, 5 μm) 色谱柱、Agela Venusil XBP-C18 (250 mm×4.6 mm, 5 μm) 色谱柱进行比对。因生产厂家不同、色谱柱固定相填料规格大小、内径不同、装填人员不同等产生的偶然性差异对试验的准确性均会有一定的影响。当使用OMNI Hubble-C18色谱柱时,除酸性橙和碱性橙21以外其他目标峰分离良好,但酸性橙2和碱性橙21分离度未达到1.5,未满足方法学试验系统适应性要求;当使用SUNTEKTM YWG-C18时,只有5种目标物出峰;使用Agela Venusil XBP-C18色谱柱时,10种目标物在25 min内完全出峰,分离度均>1.5,无拖尾。故选择Agele Venusil XBP-C18色谱柱进行分离测定(3种色谱柱分离度对比见图1、图2和图3)。
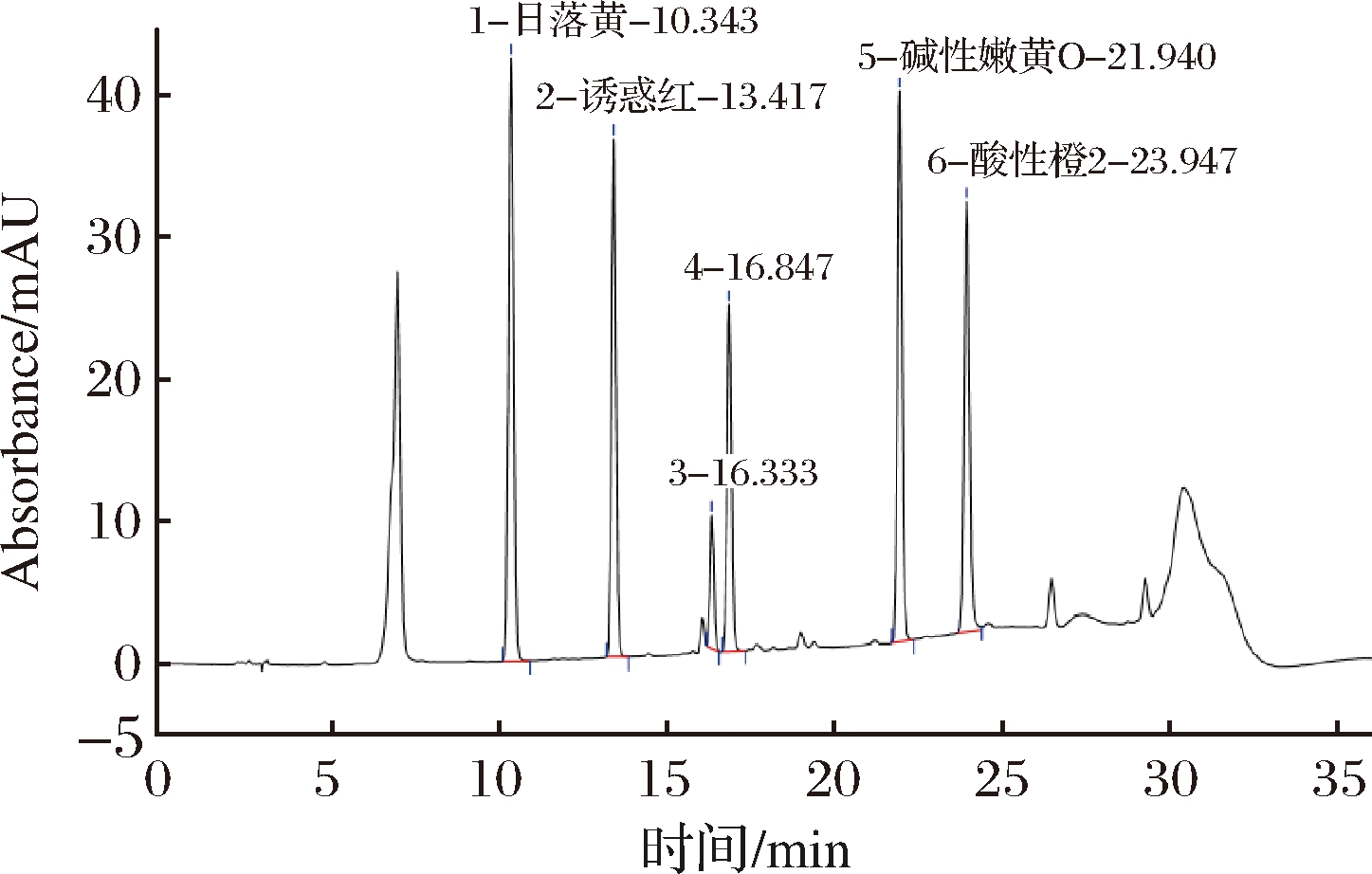
图1 SUNTEKTM YWG-C18色谱图
Fig.1 SUNTEKTM YWG-C18 column
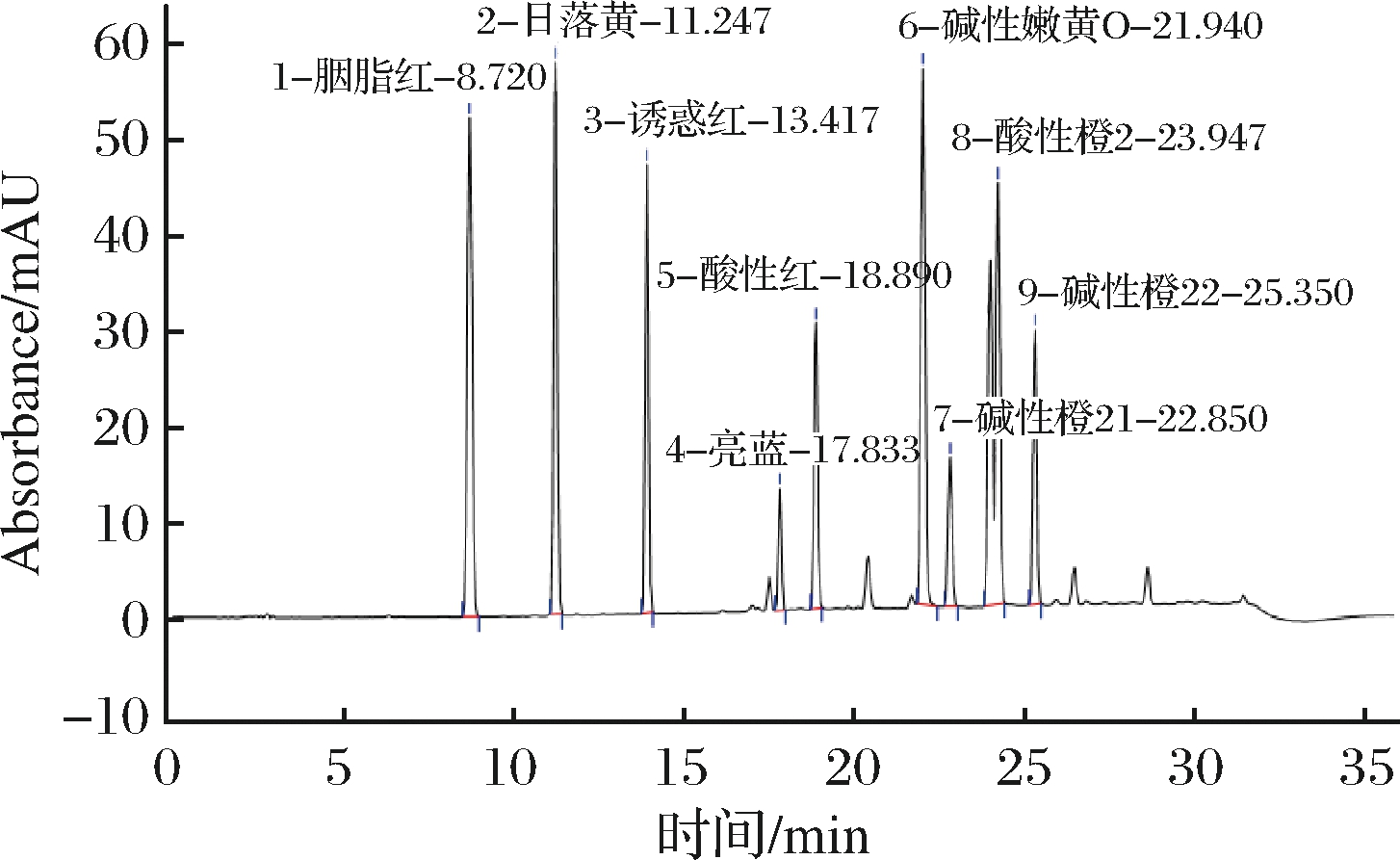
图2 OMNI Hubble-C18色谱图
Fig.2 OMNI Hubble-C18 column
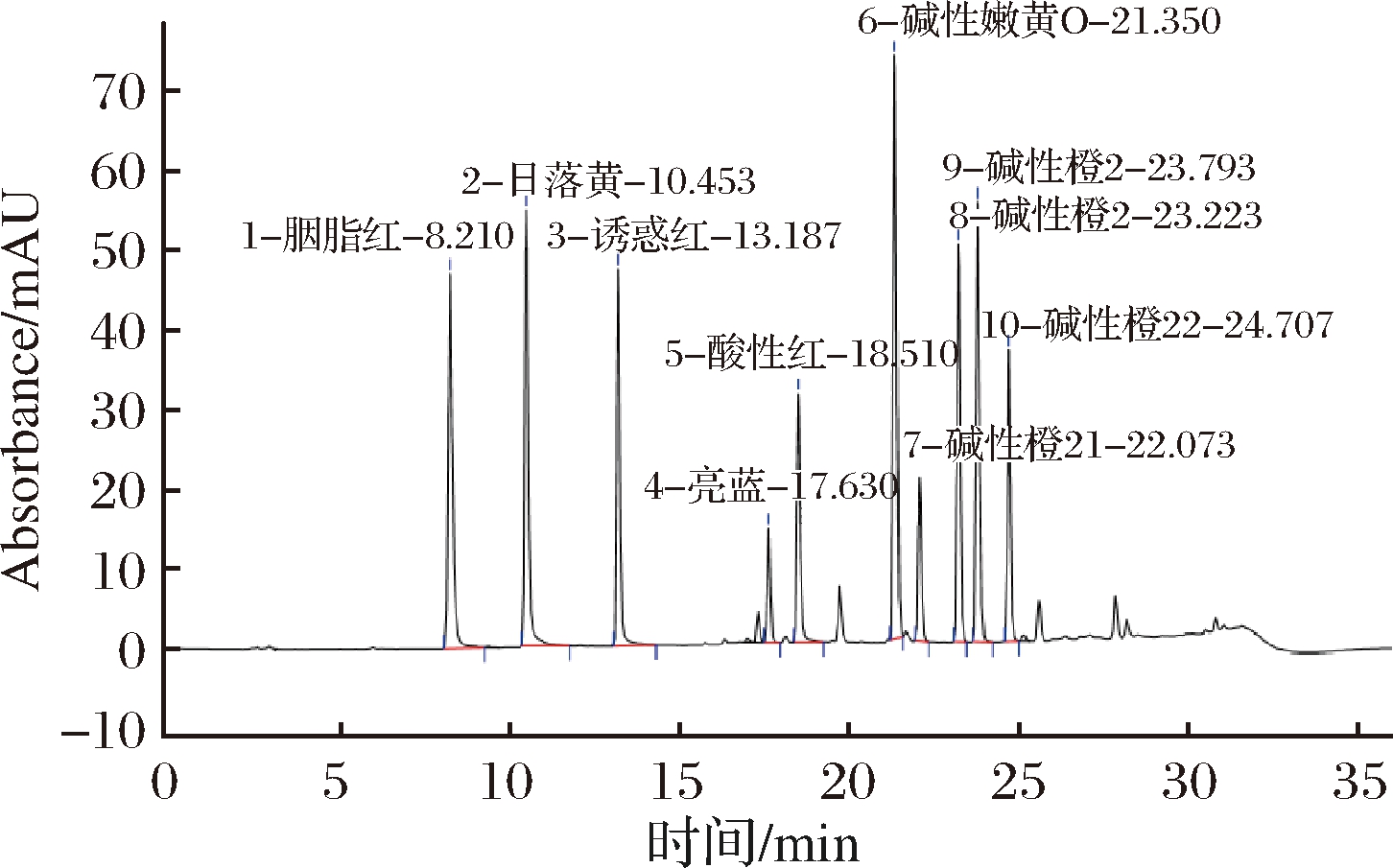
图3 Agela Venusil XBP-C18色谱图
Fig.3 Agela Venusil XBP-C18 column
2.2 柱温的影响
分别选取20、25、28、30、35 ℃进行试验。柱温为30 ℃时,胭脂红、日落黄、诱惑红均未出峰;柱温为28 ℃时胭脂红、日落黄、诱惑红出峰极不稳定,由此可见除柱温箱设置温度外,外界环境温度也有一定影响;柱温为20 ℃时,酸性橙2和碱性橙21出峰重合;柱温为25 ℃和35 ℃时出,10种目标物均可出峰,但考虑到较高的温度对色谱柱使用寿命有一定的影响,故选择25 ℃为最佳试验温度。
2.3 提取溶剂的选择
利用直接萃取法对萃取溶剂进行对比。直接萃取法与现行国家标准中提取着色剂使用的聚酰胺吸附法及提取禁用工业染料的浓缩萃取法相[20-21]比,前处理便捷,兼顾了10种色素的提取率。由于实验中测定的5种水溶性人工合成着色剂(胭脂红、日落黄、诱惑红、亮蓝、酸性红)和5种禁用工业染料(碱性嫩黄O、碱性橙2、碱性橙21、碱性橙22、酸性橙2)在水和醇类试剂中提取效果差异较大,为了保证良好的提取效果,根据国家标准[20-21],以及其他检验方法[11-18]设定不同的溶剂及提取比例。选取空白含量的液体果茶为基质,配制7种提取溶剂。分别称取14份样品各5.0 g至50 mL离心管中进行加标试验,每种2个平行样比对,分别加入25 μg/mL标准溶液各1 mL,并用相对应的提取溶剂定容至25 mL。根据7种溶剂提取回收率发现,酸性红、诱惑红和酸性橙2在7种提取溶剂中提取效果比较稳定。随着甲醇比例的降低,碱性橙21、碱性橙2、碱性橙22、碱性嫩黄O四种极性较弱的化合物提取效果较差,回收率逐渐降低。但水溶液比例增大时,对极性较强的水溶性着色剂比较友好;反之,当只使用色谱纯甲醇进行提取时,极性较强的水溶性化合物提取效果较差,回收率较低,但碱性橙21、碱性橙2、碱性橙22、碱性嫩黄O等极性较弱的化合物提取效果较好。当使用氨化甲醇[20]进行提取时,碱性嫩黄O和碱性橙22提取效果较差,回收率较低;当使用甲醇∶水(7∶3)为萃取溶剂时,碱性橙22回收率较低;经过比对,甲醇∶水(8∶2)时,10种化合物回收率均在85%以上,故选择80%甲醇水作为最终试验提取溶剂(7种提取溶剂回收率比对结果见表2)。
表2 七种提取溶剂加标回收率 单位:%
Table 2 The recovery results of the 7 extraction solvents
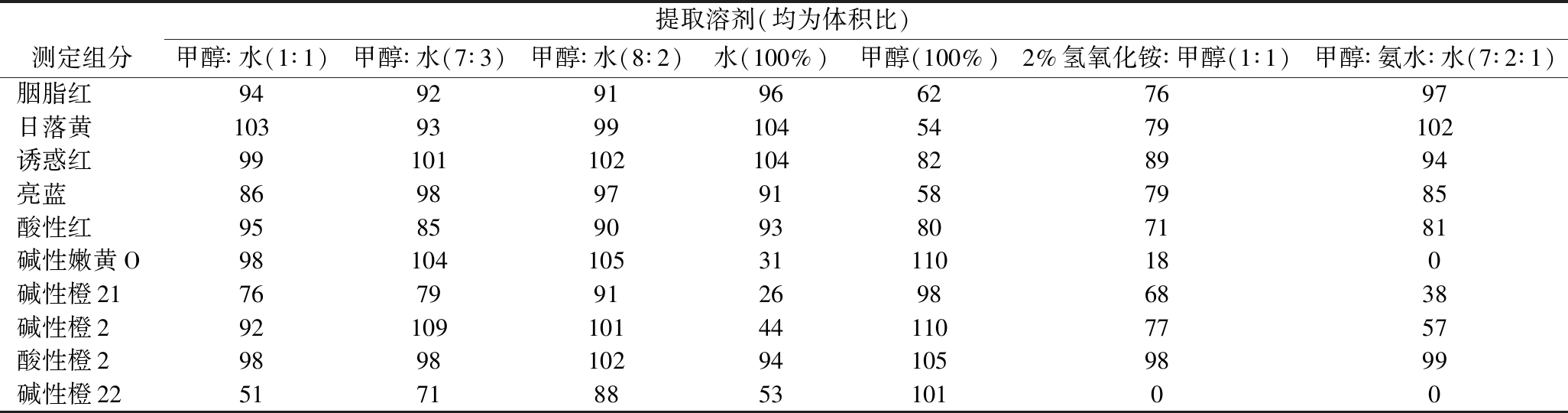
提取溶剂(均为体积比)测定组分甲醇∶水(1∶1)甲醇∶水(7∶3)甲醇∶水(8∶2)水(100%)甲醇(100%)2%氢氧化铵∶甲醇(1∶1)甲醇∶氨水∶水(7∶2∶1)胭脂红94929196627697日落黄10393991045479102诱惑红99101102104828994亮蓝86989791587985酸性红95859093807181碱性嫩黄O9810410531110180碱性橙2176799126986838碱性橙292109101441107757酸性橙29898102941059899碱性橙225171885310100
2.4 蛋白沉淀剂添加量的影响
当前国家标准中对豆制品中着色剂提取方法还未完善。实验采取溶剂萃取后进行蛋白沉淀处理,由于豆制品基质复杂,含有大量的大豆蛋白,若不对蛋白质进行沉淀而上机检测,容易有较多的杂质,干扰降低其准确性,造成色谱柱堵塞从而减短色谱柱使用寿命,故对豆制品进行蛋白质沉淀处理减少杂质干扰。根据2.4小节中以果汁为基质得出最佳提取溶剂为80%甲醇水,选取空白含量腐竹粉粹后作为基质,以亚铁氰化钾和乙酸锌溶液为沉淀剂,对腐竹中的大豆蛋白进行沉淀。分别称取6份样品分为3组,进行加标,每组包括加标样品与加标平行样品进行对照,3组分别添加沉淀剂量0.5、1.0、2.0 mL(结果见图4)。根据图4中3组对比得出结论,当沉淀剂添加量逐渐加大时,测定组分的回收率有一定幅度的降低。当选择加入0.5 mL沉淀剂时,回收率超过75%,故选择2种沉淀剂的添加量为0.5 mL。
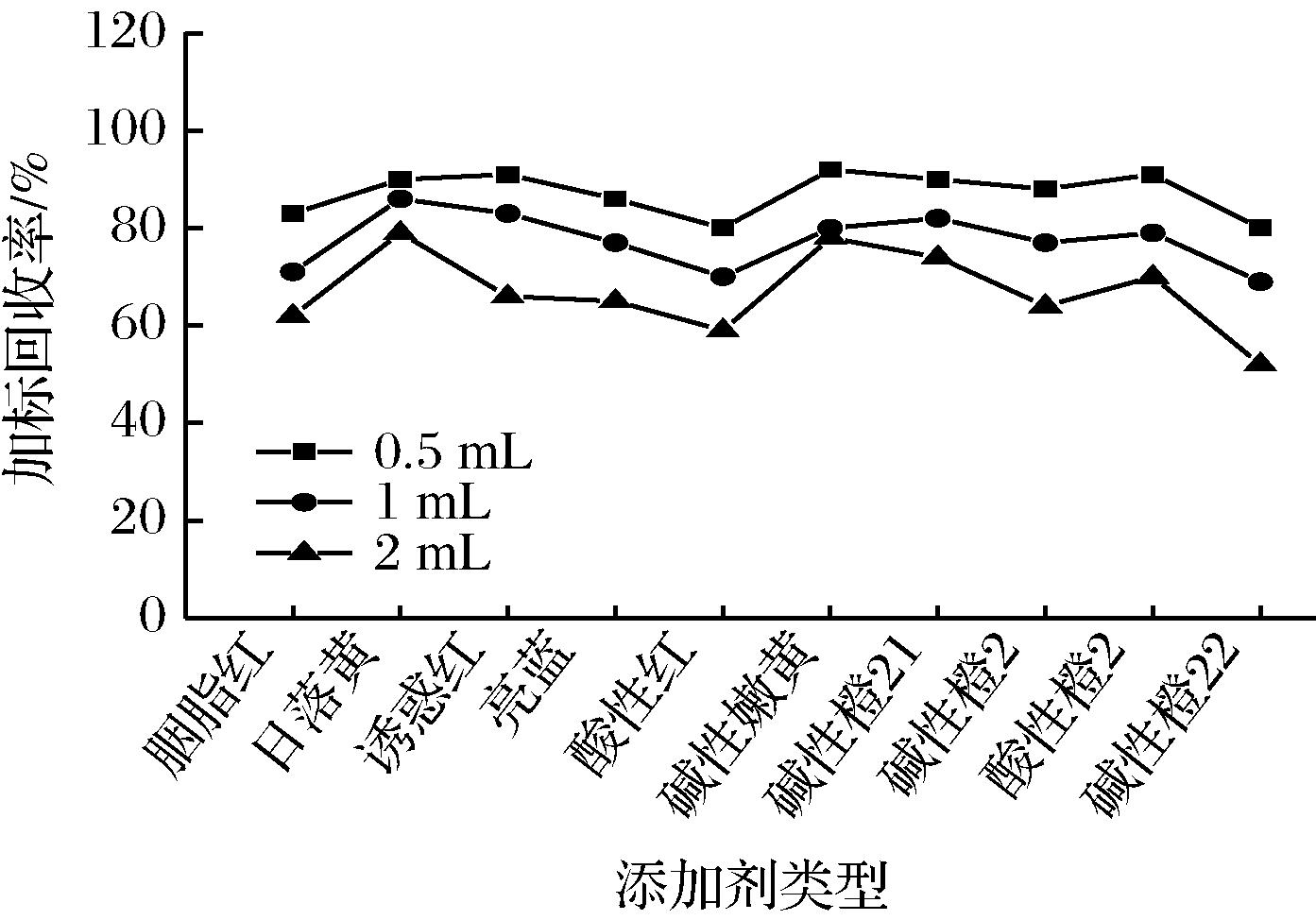
图4 沉淀剂不同添加量回收率对比
Fig 4 Comparison of recovery rate of different precipitants added
2.5 方法学验证
根据每种组分的截距和斜率计算得出线性回归方程,线性范围见1.3小节中配制出的标准系列点建立标准曲线,得出每种测定组分相关性均>0.999,显示线性良好。以S/N=3为基准,得出方法检出限,以S/N=10为基准,得出方法定量限结果见表3。根据公式(1)计算出样品最终含量。
表3 线性回归方程、相关系数、线性范围、检出限、定量限
Table 3 Linear regression equation, correlation coefficient, linear range, detection limit, quantification limit
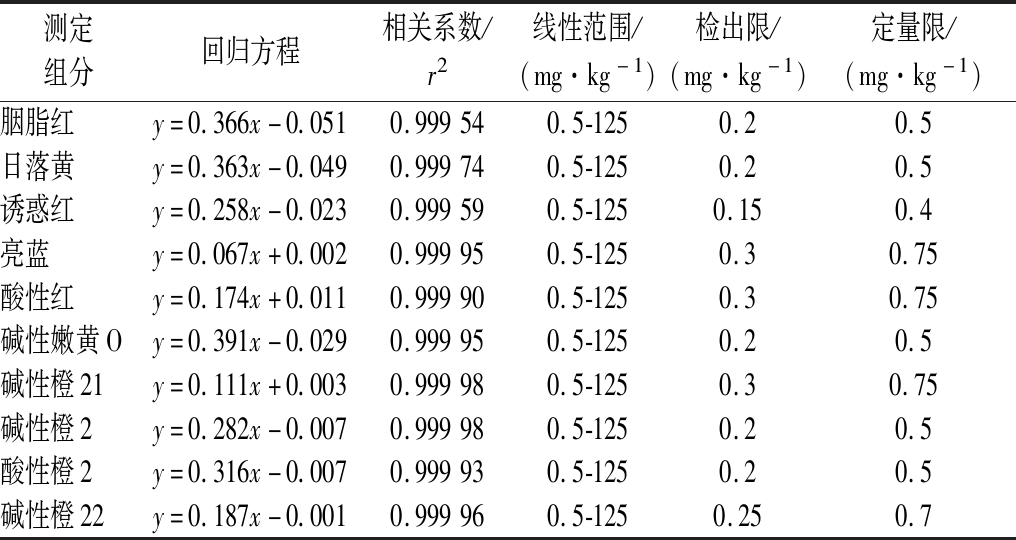
测定组分回归方程相关系数/r2线性范围/(mg·kg-1)检出限/(mg·kg-1)定量限/(mg·kg-1)胭脂红y=0.366x-0.0510.999540.5-1250.20.5日落黄y=0.363x-0.0490.999740.5-1250.20.5诱惑红y=0.258x-0.0230.999590.5-1250.150.4亮蓝y=0.067x+0.0020.999950.5-1250.30.75酸性红y=0.174x+0.0110.999900.5-1250.30.75碱性嫩黄Oy=0.391x-0.0290.999950.5-1250.20.5碱性橙21y=0.111x+0.0030.999980.5-1250.30.75碱性橙2y=0.282x-0.0070.999980.5-1250.20.5酸性橙2y=0.316x-0.0070.999930.5-1250.20.5碱性橙22y=0.187x-0.0010.999960.5-1250.250.7
(1)
式中:x,试样中各组分的含量;mg/kg;ρ,试样溶液各得测组分的浓度,μg/mL;V,试样提取液的体积,mL;m,试样的质量,g。
以茶饮料为基质,分别取1、5、10 mg/kg三个点进行加标,计算其回收率,10种组分平均回收率均>85%;日内精密度RSD值为0.76%~4.10%,日间精密度RSD为1.09%~5.29%(结果见表4)。结果表明仪器重复性及再现性良好。
表4 平均回收率、日内精密度(n=6)、日间精密度(n=6)
Table 4 Average recovery rate, intra-day precision (n=6), inter-day precision (n=6)
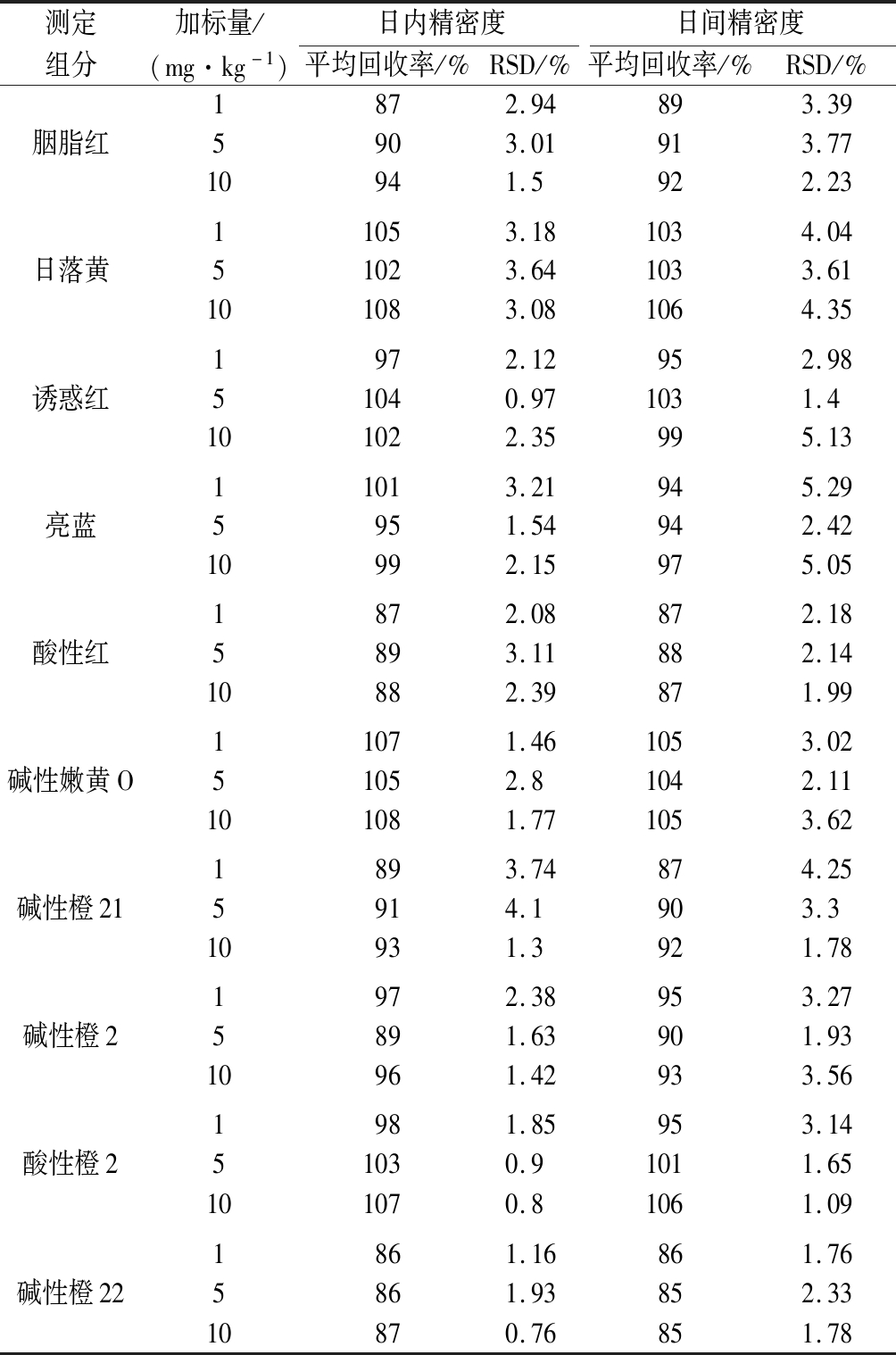
测定加标量/日内精密度日间精密度组分(mg·kg-1)平均回收率/%RSD/%平均回收率/%RSD/%1872.94893.39胭脂红5903.01913.7710941.5922.2311053.181034.04日落黄51023.641033.61101083.081064.351972.12952.98诱惑红51040.971031.4101022.35995.1311013.21945.29亮蓝5951.54942.4210992.15975.051872.08872.18酸性红5893.11882.1410882.39871.9911071.461053.02碱性嫩黄O51052.81042.11101081.771053.621893.74874.25碱性橙215914.1903.310931.3921.781972.38953.27碱性橙25891.63901.9310961.42933.561981.85953.14酸性橙251030.91011.65101070.81061.091861.16861.76碱性橙225861.93852.3310870.76851.78
3 结论
本研究建立了对饮料、配制酒及干制豆制品中的5种偶氮类着色剂和5种工业染料同时测定的高效液相色谱法,对3种不同类型的食品前处理方法及测定的色谱条件进行优化,对当前国标中未能对食品中着色剂和工业染料同时提取这一缺点进行了研究。与我国现行国家标准相比,前处理过程更加便捷,回收率良好,大大的节省时间与耗材,根据方法学验证表明结果准确且灵敏度高,为检测食品中色素含量提供了可靠依据。
[1] BONAN S, FEDRIZZI G, MENOTTA S, et al. Simultaneous determination of synthetic dyes in foodstuffs and beverages by high-performance liquid chromatography coupled with diode-array detector[J]. Dyes and Pigments,2013, 99(1): 36-40.
[2] DE ![]() SIQUEIRA BENTO W, LIMA BP, PAIM APS. Simultaneous determination of synthetic colorants in yogurt by HPLC[J]. Food Chem,2015,183: 154-160.
SIQUEIRA BENTO W, LIMA BP, PAIM APS. Simultaneous determination of synthetic colorants in yogurt by HPLC[J]. Food Chem,2015,183: 154-160.
[3] LI R,WANG Y,TAN J, et al. Simultaneous determination of synthetic edible pigments in beverages by titania-based RP-HPLC[J]. Arabian Journal of Chemistry, 2020, 13(2): 3 875-3 881.
[4] 王宏伟,刘素丽,赵梅,等.食品中非法添加工业染料危害的研究进展[J].食品安全质量检测学报,2019,10(01): 1-7.
[5] 李巧玲,田晶.食用合成色素的安全性评价及对策[J].食品工业,2017,38(11): 268-271
[6] GB2760—2014,食品安全标准 食品添加剂使用标准[S].北京:中国标准出版社,2014.
[7] 张兰天,王红,王利军等.高效薄层色谱法同时快速检测饮料中26种人工色素的研究[J].食品工业,2014,35(8):238-242.
[8] YI J, ZENG L, WU Q, et al. Sensitive simultaneous determination of synthetic food colorants in preserved fruit samples by capillary electrophoresis with contactless conductivity detection[J]. Food Analytical Methods. 2018,11(6): 1 608-1 618.
[9] 宋新,纪双利,杨丽,等.示波极谱法在食品合成食用色素测定中的应用[J].中国食品卫生杂志,2009,21(5):422-423.
[10] 杨园园,许乾丽,黎殊. HPLC法同时测定辣椒面中碱性橙2,21,22和酸性橙Ⅱ的含量[J].中国调味品,2018,43(6): 165-167.
[11] 刘莉萍,毕思远,龚达浩,等. HPLC法测定食品中的防腐剂和合成着色剂[J].食品工业,2018,39(1):266-269.
[12] 迟秋池.多种食品基质中12种水溶性人工合成色素测定方法研究[D].上海:上海交通大学,2014.
[13] 王蕾.蜜饯中添加剂的检测方法优化及应用[D].邯郸:河北工程大学,2018.
[14] 郝鹏飞,徐琴,吕宁,等.液相色谱同时测定腌渍蔬菜中的10种合成色素[J].食品研究与开发,2013,34(22):64-67.
[15] 刘敏,李小林,别玮,等.固相萃取-高效液相色谱法同时测定调味品中15种工业合成染料[J].色谱,2011,29(2): 162-167.
[16] 宋丹萍.食品中10种色素的高效液相色谱—质谱检测方法研究[D].成都:四川师范大学,2015.
[17] 张海君,何微娜,倪承珠,等.超高效液相色谱-串联质谱法测定虾干中12种工业染料[J].中国卫生检验杂志,2019,29(6):658-661;668.
[18] 刘思洁,范明,姜楠,等.超高效液相色谱-串联质谱法测定食品中酸性橙Ⅱ、碱性橙2和碱性嫩黄[J].中国卫生检验杂志,2013,23(12):2 593-2594;2638.
[19] 胡江涛,何成艳,刘兴睿,等.固相萃取-超高效液相色谱串联质谱法同时测定食品中8种禁用色素[J].安徽农业科学,2020,48(01): 204-207.
[20] GB 5009.35—2016 食品安全国家标准 食品中合成着色剂的测定[S].北京:中国标准出版社,2016.
[21] GB/T 23496—2009 食品中禁用物质的检测 碱性橙染料 高效液相色谱法[S].北京:中国标准出版社,2009.
[22] GB/T 22221—2008 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定 高效液相色谱法[S]. 北京:中国标准出版社,2008.