番茄红素是一类具有较强抗氧化性的类胡萝卜素,国际上相关产品研发已经成为新药研究的热点。番茄红素的生产方法主要包括植物提取法、化学合成法以及发酵法。由于提取法以西红柿等为原料来萃取,成本过高,而化学合成法中残留的化学试剂对番茄红素品质有一定影响,相比之下发酵法是最具潜力的生产方法[1-3]。
目前,国内外对于番茄红素的研究主要集中在代谢途径的改造与调控等方面[4]。ZHU等[5]在构建大肠杆菌中异源表达甲羟戊酸途径,经100 L发酵罐高密度发酵后产量达到了34.3 mg/g DCW。JIN等[6]通过对代谢途径相关基因进行组合与敲除,成功筛选到1株产量提高近4倍的高产菌株。这些研究中大多采用诱导型启动子,需要添加诱导剂来进行表达,造成生产工艺复杂、成本较高等问题。由于大肠杆菌中性能优良的组成型启动子较少,无法满足代谢调控的需要。因此,本研究利用番茄红素的合成作为表征系统,对大肠杆菌启动子进行筛选。
启动子是基因表达调控的顺式作用元件,也是基因工程表达载体的一个重要元件。外源基因在大肠杆菌中表达的强弱主要取决于表达载体中启动子的性能。启动子在转录水平上所发挥的重要作用,不仅决定了基因的表达水平,也决定了基因表达的时空顺序[7-9]。大肠杆菌染色体上也存在着许多调控其自身基因表达的启动元件,这些启动子也可以应用于外源基因的表达调控[10]。根据文献报道,大肠杆菌中一些受转录因子调控的基因,其启动子表现出较高的表达强度。这是由于含有这类启动子的质粒在宿主中σ32浓度水平较正常细胞要高, 可以提高重组菌的表达水平[11],有利于外源基因的转录[12],提高目标产物的产量。
本课题组在前期研究中构建了1株能够生产番茄红素的大肠杆菌工程菌pTrc99aEBI。由于pTrc99a属于诱导型质粒,会增加生产番茄红素的工艺流程和生产成本,不利于未来的工业化生产。因此在本研究中,通过选择大肠杆菌中17个转录因子相关基因的启动子序列,以编码番茄红素合成基因的CrtEBI为报告基因,通过构建表达番茄红素合成基因的组成型质粒,优化番茄红素的代谢途径。
1 材料与方法
1.1 材料
1.1.1 实验材料
克隆菌株Escherichia coli DH5α及表达菌株E.coli BL21(DE3),广东省微生物研究所;pACYCDuet-1质粒,本实验室;PCR引物及目的基因,苏州金唯智公司;胰蛋白胨、酵母粉,Oxoid 公司;DNA marker、Primer Star Max、DNA polymerase PrimeSTAR® HS DNA Polymerase with GC Buffer,Takara公司;质粒提取试剂盒、凝胶DNA回收试剂盒,天根生化科技(北京)有限公司;番茄红素标准品(色谱纯),北京索莱宝科技有限公司;其他药品或试剂,进口或国产分析纯或色谱纯。
1.1.2 实验仪器
PCR仪、离心机,Eppendorf公司;电泳仪,北京六一生物科技有限公司;凝胶成像系统,美国BIO-RAD公司;高效液相色谱仪,美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 培养基和溶液的配制
LB液体培养基(g/L):蛋白胨10,酵母粉5,NaCl 10;LB固体培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,琼脂15。
抗生素工作质量浓度:氯霉素34 mg/L,氨苄青霉素 50 mg/L;诱导剂工作浓度:异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG) 0.1 mmol/L。
1.2.2 菌株和质粒
本实验所用菌株和质粒如表1所示。
表1 本研究使用的菌株和质粒
Table 1 Strains and plasmids used in this study

菌株或质粒信息来源菌株 E.coliDH5αF-φ80dlacZΔM15Δ(lacZYA-argF)U169endA1recA1hsdR17(rk-mk+)supE44λ-thi-1gyrA96relA1phoA实验室保存 E.coliBL21(DE3)F-ompTgaldcmonhsdSB(rB-mB-)λ(DE3[lacIlacUV5-T7gene1ind1sam7nin5])实验室保存质粒 pTrc99aEBIpTRC99a,Ampr,Ptrc,CrtEBI实验室保存 pACYCDuet-1Cmr,PT7实验室保存 pACYC-Pskp-EBIpACYC,Cmr,Pskp,CrtEBI本研究 pACYC-Posmy-EBIpACYC,Cmr,Posmy,CrtEBI本研究 pACYC-Phdea-EBIpACYC,Cmr,Phdea,CrtEBI本研究 pACYC-Pyifa-EBIpACYC,Cmr,Pyifa,CrtEBI本研究 pACYC-Plpp-EBIpACYC,Cmr,Plpp,CrtEBI本研究 pACYC-Pompf-EBIpACYC,Cmr,Pompf,CrtEBI本研究 pACYC-Pmglb-EBIpACYC,Cmr,Pmglb,CrtEBI本研究 pACYC-Prpoh-EBIpACYC,Cmr,Prpoh,CrtEBI本研究 pACYC-Pmarr-EBIpACYC,Cmr,Pmarr,CrtEBI本研究 pACYC-Pihfb-EBIpACYC,Cmr,Pihfb,CrtEBI本研究 pACYC-Pfnr-EBIpACYC,Cmr,Pfnr,CrtEBI本研究 pACYC-Pfkpa-EBIpACYC,Cmr,Pfkpa,CrtEBI本研究 pACYC-Pdnak-EBIpACYC,Cmr,Pdnak,CrtEBI本研究 pACYC-Parca-EBIpACYC,Cmr,Parca,CrtEBI本研究 pACYC-Prpod-EBIpACYC,Cmr,Prpod,CrtEBI本研究 pACYC-Prpof-EBIpACYC,Cmr,Prpof,CrtEBI本研究 pACYC-Pgros-EBIpACYC,Cmr,Pgros,CrtEBI本研究
1.2.3 目的基因的克隆
以实验室保存的基因组或空载体为模版,按表2中相应的配对引物,分别通过PCR扩增得到载体片段pACYCDuet-1、目的基因CrtEBI及启动子片段Pskp、Posmy、Phdea、Pyifa、Plpp、Pompf、Pmglb、Prpoh、Pmarr、Pihfb、Pfnr、Pfkpa、Pdnak、Parca、Prpod、Prpof、Pgros。
表2 本研究使用的引物
Table 2 Primers used in this study
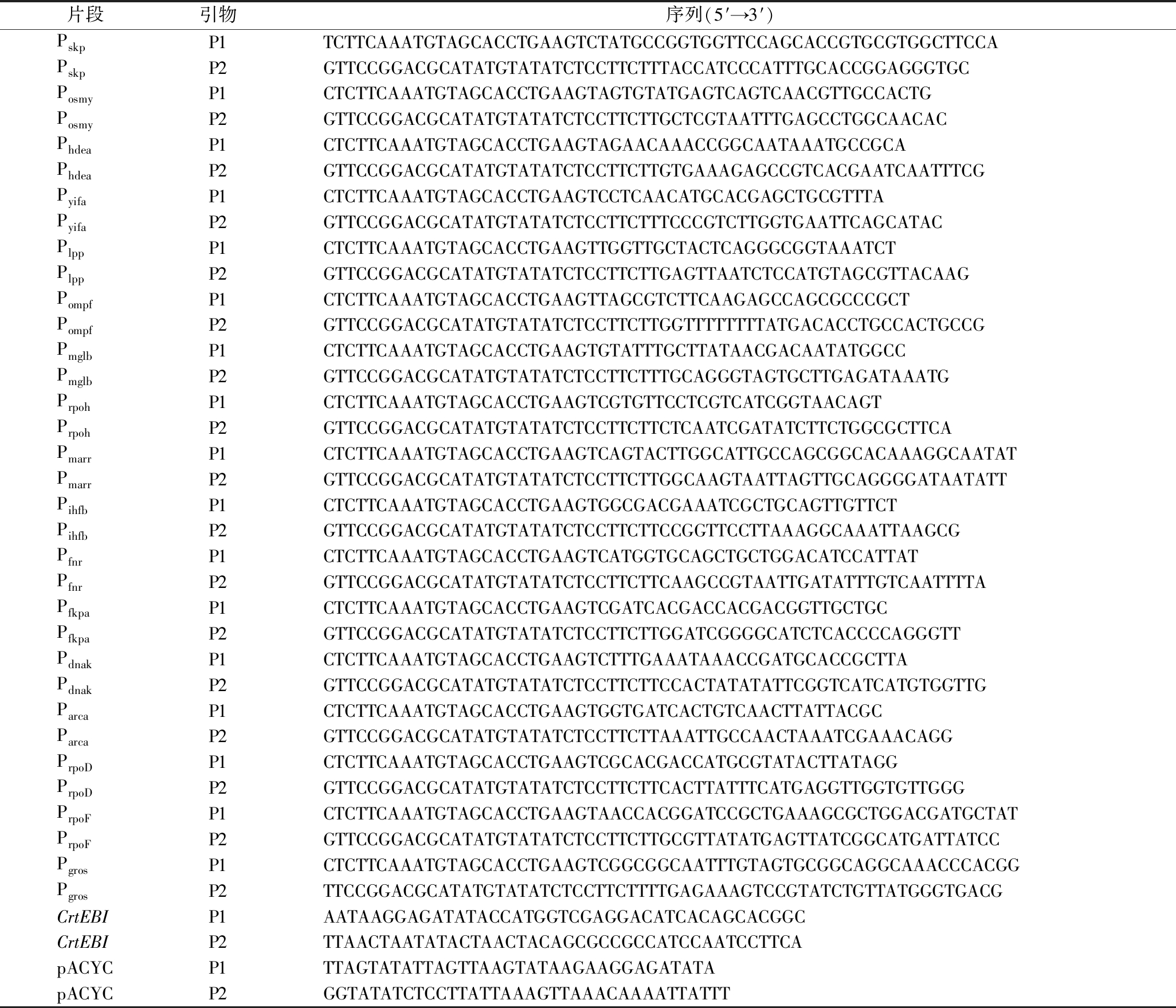
片段引物序列(5′→3′)PskpP1TCTTCAAATGTAGCACCTGAAGTCTATGCCGGTGGTTCCAGCACCGTGCGTGGCTTCCAPskpP2GTTCCGGACGCATATGTATATCTCCTTCTTTACCATCCCATTTGCACCGGAGGGTGCPosmyP1CTCTTCAAATGTAGCACCTGAAGTAGTGTATGAGTCAGTCAACGTTGCCACTGPosmyP2GTTCCGGACGCATATGTATATCTCCTTCTTGCTCGTAATTTGAGCCTGGCAACACPhdeaP1CTCTTCAAATGTAGCACCTGAAGTAGAACAAACCGGCAATAAATGCCGCAPhdeaP2GTTCCGGACGCATATGTATATCTCCTTCTTGTGAAAGAGCCGTCACGAATCAATTTCGPyifaP1CTCTTCAAATGTAGCACCTGAAGTCCTCAACATGCACGAGCTGCGTTTAPyifaP2GTTCCGGACGCATATGTATATCTCCTTCTTTCCCGTCTTGGTGAATTCAGCATACPlppP1CTCTTCAAATGTAGCACCTGAAGTTGGTTGCTACTCAGGGCGGTAAATCTPlppP2GTTCCGGACGCATATGTATATCTCCTTCTTGAGTTAATCTCCATGTAGCGTTACAAGPompfP1CTCTTCAAATGTAGCACCTGAAGTTAGCGTCTTCAAGAGCCAGCGCCCGCTPompfP2GTTCCGGACGCATATGTATATCTCCTTCTTGGTTTTTTTTATGACACCTGCCACTGCCGPmglbP1CTCTTCAAATGTAGCACCTGAAGTGTATTTGCTTATAACGACAATATGGCCPmglbP2GTTCCGGACGCATATGTATATCTCCTTCTTTGCAGGGTAGTGCTTGAGATAAATGPrpohP1CTCTTCAAATGTAGCACCTGAAGTCGTGTTCCTCGTCATCGGTAACAGTPrpohP2GTTCCGGACGCATATGTATATCTCCTTCTTCTCAATCGATATCTTCTGGCGCTTCAPmarrP1CTCTTCAAATGTAGCACCTGAAGTCAGTACTTGGCATTGCCAGCGGCACAAAGGCAATATPmarrP2GTTCCGGACGCATATGTATATCTCCTTCTTGGCAAGTAATTAGTTGCAGGGGATAATATTPihfbP1CTCTTCAAATGTAGCACCTGAAGTGGCGACGAAATCGCTGCAGTTGTTCTPihfbP2GTTCCGGACGCATATGTATATCTCCTTCTTCCGGTTCCTTAAAGGCAAATTAAGCGPfnrP1CTCTTCAAATGTAGCACCTGAAGTCATGGTGCAGCTGCTGGACATCCATTATPfnrP2GTTCCGGACGCATATGTATATCTCCTTCTTCAAGCCGTAATTGATATTTGTCAATTTTAPfkpaP1CTCTTCAAATGTAGCACCTGAAGTCGATCACGACCACGACGGTTGCTGCPfkpaP2GTTCCGGACGCATATGTATATCTCCTTCTTGGATCGGGGCATCTCACCCCAGGGTTPdnakP1CTCTTCAAATGTAGCACCTGAAGTCTTTGAAATAAACCGATGCACCGCTTAPdnakP2GTTCCGGACGCATATGTATATCTCCTTCTTCCACTATATATTCGGTCATCATGTGGTTGParcaP1CTCTTCAAATGTAGCACCTGAAGTGGTGATCACTGTCAACTTATTACGCParcaP2GTTCCGGACGCATATGTATATCTCCTTCTTAAATTGCCAACTAAATCGAAACAGGPrpoDP1CTCTTCAAATGTAGCACCTGAAGTCGCACGACCATGCGTATACTTATAGGPrpoDP2GTTCCGGACGCATATGTATATCTCCTTCTTCACTTATTTCATGAGGTTGGTGTTGGGPrpoFP1CTCTTCAAATGTAGCACCTGAAGTAACCACGGATCCGCTGAAAGCGCTGGACGATGCTATPrpoFP2GTTCCGGACGCATATGTATATCTCCTTCTTGCGTTATATGAGTTATCGGCATGATTATCCPgrosP1CTCTTCAAATGTAGCACCTGAAGTCGGCGGCAATTTGTAGTGCGGCAGGCAAACCCACGGPgrosP2TTCCGGACGCATATGTATATCTCCTTCTTTTGAGAAAGTCCGTATCTGTTATGGGTGACGCrtEBIP1AATAAGGAGATATACCATGGTCGAGGACATCACAGCACGGCCrtEBIP2TTAACTAATATACTAACTACAGCGCCGCCATCCAATCCTTCApACYCP1TTAGTATATTAGTTAAGTATAAGAAGGAGATATApACYCP2GGTATATCTCCTTATTAAAGTTAAACAAAATTATTT
PCR扩增条件为:95 ℃预变性5 min;98 ℃变性10 s;55 ℃退火15 s;72 ℃延伸30 s;共进行30个PCR循环;最后在72 ℃继续延伸10 min。
1.2.4 产番茄红素质粒的构建
将启动子片段、目的基因片段以及载体片段进行琼脂糖凝胶电泳并回收。通过重叠PCR方法将目的基因片段CrtEBI与启动子片段进行连接,切胶回收后获得PX-CrtEBI。使用CPEC等[13]的方法将PX-CrtEBI与载体pACYCDuet-1进行连接,连接体系:目的基因与载体各2.5 μL、Primer Star Max DNA polymerase 5 μL。连接条件:98 ℃预变性3 min;98 ℃变性10 s;55 ℃退火30 s;72 ℃延伸1 min,Dpn Ι消化质粒模板后转化E.coli DH5α。在含氯霉素抗性的平板上进行筛选,待培养约12 h后挑取单菌落进行菌落PCR验证。将验证正确的菌体进行培养,提取质粒,送上海美吉公司进行测序,经测序正确的重组质粒命名为pACYC-Px-CrtEBI。
1.2.5 重组菌株的构建及番茄红素的生产
将质粒pACYC-Px-CrtEBI转入E.coli BL21(DE3)中,同时以99aEBI菌株作为对照菌株,分别在含有氯霉素、氨苄青霉素的LB平板上进行筛选。挑取单克隆至5 mL含有相应抗生素的LB液体培养基中,37 ℃、200 r/min条件下进行培养,过夜培养后转接至50 mL含有相应抗生素的LB液体培养基中进行培养;99aEBI对照菌株待菌体长至OD值大约0.6~0.8,添加IPTG进行诱导,转至30 ℃、200 r/min条件下继续培养,约发酵20 h后检测番茄红素含量。
1.2.6 番茄红素的提取与测定
番茄红素的提取与测定参照SUN等[14]的方法。具体操作:取3 mL培养至一定时间的培养液,5 000 r/min离心3 min弃上清液;用无菌水清洗2次,加3 mL丙酮,于55 ℃水浴锅中萃取15 min,5 000 r/min离心5 min取上清液即为番茄红素萃取液,保留上清液以备检测。另外取9 mL培养液于8 000 r/min 离心5 min后弃上清液,菌体于70 ℃烘干,然后计算菌体干质量。
用超纯水配制质量浓度分别为1、2、4、6、12、14、16和18 μg/mL的番茄红素标准溶液,取一定量的番茄红素标准溶液和样品一起采用HPLC进行测定。色谱柱:反相色谱柱C18;流动相:V(乙腈)∶V(甲醇)∶V(异丙醇)=80∶15∶5;流速1.2 mL/min;检测波长472 nm;柱温40 ℃;进样量10 μL。以番茄红素标准品绘制标准曲线,根据标准曲线计算番茄红素的产量。
2 结果与分析
2.1 目的基因的获得
以本实验室保存的质粒或基因组DNA为模板,依次用表2中的引物,分别通过PCR扩增得到载体片段pACYCDuet-1、目的基因CrtEBI及启动子片段Pskp、Posmy、Phdea、Pyifa、Plpp、Pompf、Pmglb、Prpoh、Pmarr、Pihfb、Pfnr、Pfkpa、Pdnak、Parca、PrpoD、PrpoF、Pgros并用琼脂糖凝胶电泳回收,已知各基因大小分别为4008、3657、588、580、579、582、581、584、580、590、587、593、591、588、589、589、586、587和587 bp。再将启动子片段与CrtEBI进行连接获得PX-CrtEBI片段。PCR结果与启动子基因的大小吻合,所得的核酸电泳图如图1所示。
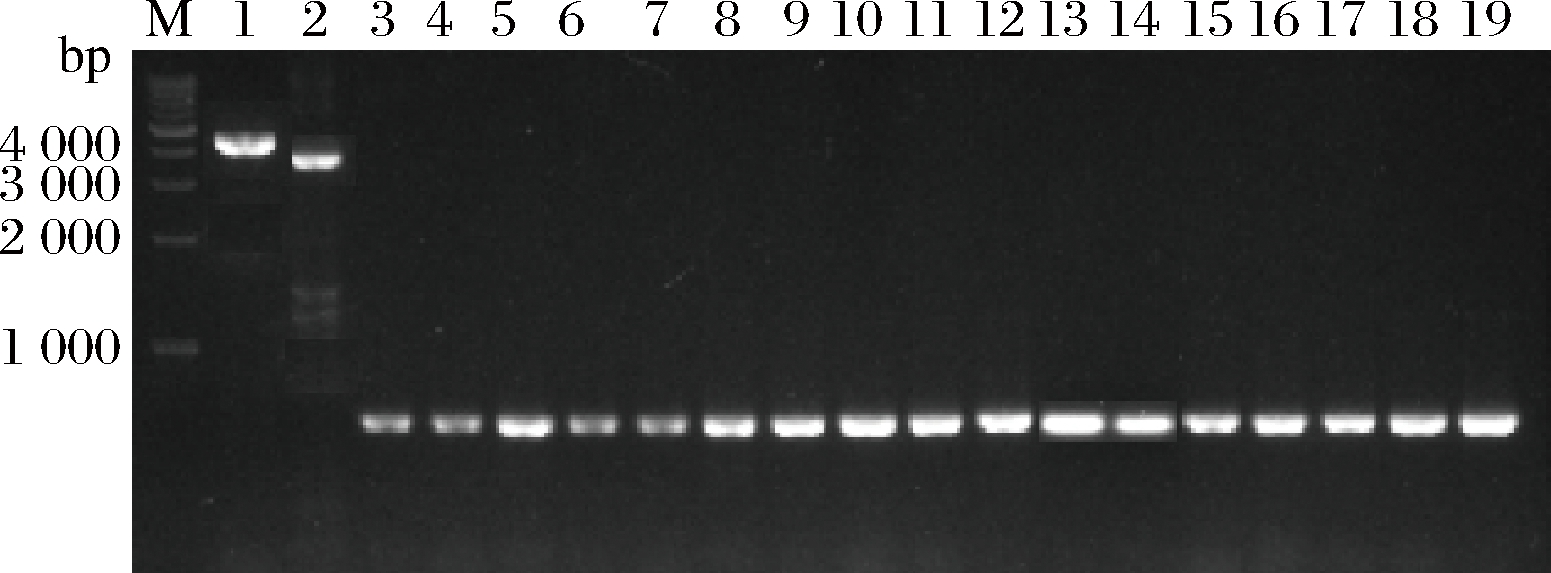
M-Marker;1-pACYCDuet-1; 2-CrtEBI; 3-Pskp; 4-Posmy; 5-Phdea; 6-Pyifa; 7-Plpp; 8-Pompf; 9-Pmglb; 10-Prpoh; 11-Pmarr; 12-Pihfb; 13-Pfnr; 14-Pfkpa; 15-Pdnak; 16-Parca; 17-PrpoD; 18-PrpoF; 19-Pgros
图1 目的基因及不同启动子PCR扩增产物核酸电泳图
Fig.1 Nucleic acid electrophoresis of the target genes and different promoters PCR products
2.2 重组质粒的构建
将切胶回收的PX-CrtEBI与载体pACYCDuet-1进行连接,构建合成番茄红素的pACYC-Px-CrtEBI质粒。将该质粒转化E.coli DH5α,待培养后提取质粒送测序,测序结果用软件Vector NT1进行比对,比对结果表明各个质粒均构建成功。
2.3 番茄红素标准曲线
根据相应质量浓度番茄红素样品对应的峰面积,可以得到其数学关系式为:Y=0.028 6X-0.196 8,R2=0.997 2,其中Y为番茄红素质量浓度,X为峰面积。
2.4 不同启动子对番茄红素产量的影响
将含有番茄红素合成基因的pACYC-Px-CrtEBI质粒转入E.coli BL21(DE3)中,同时以99aEBI菌株作为对照菌株。在LB培养基中培养约20 h后提取番茄红素。以番茄红素的产量作为指标,来比较不同启动子强度对番茄红素产量的影响。在大肠杆菌中表达不同启动子的重组质粒,番茄红素产量有一定的差异,有些效果较好的启动子会提高番茄红素产量,而也有一些效果较差的启动子会降低番茄红素产量。
经过摇瓶培养发酵后,挑取效果较好的Pskp、Plpp、Pmglb、Prpoh、Pihfb、Pfnr和Pgros菌株进行HPLC检测番茄红素产量,结果如图2所示。在重组菌株中,以Plpp和Pmglb为启动子的菌株番茄红素产量显著提高,产量分别可以达到7.03和7.20 mg/g DCW。与对照菌株99aEBI产量(4.76 mg/g DCW)相比,菌株番茄红素产量分别提高了约47.7%、51.3%。而以Pihfb、Pgros为启动子的菌株番茄红素产量显著降低,没有达到预期效果。以Pskp、Pfnr为启动子的菌株产量提升则不够显著。

图2 不同启动子菌株产番茄红素情况
Fig.2 Production of lycopene by strain with different promoter
注:NS表示P>0.05; *表示P<0.05; ***表示P<0.001
3 讨论
启动子是DNA链上一段能与RNA聚合酶结合并起始mRNA合成的序列,是基因表达不可缺少的重要调控序列[15]。强启动子可用于表达质粒载体的构建以及在工程菌中代替目标基因自身的启动子[16-19]。代谢工程关于启动子的研究中,胡于东[20]在氧化葡萄糖酸杆菌中发现了高强度启动子Pdnak,有效缩短了山梨醇的转化时间并使山梨糖产量提高了约11.2%;王玲玲等[21]通过在大肠杆菌中筛选高表达启动子来提高菌株生产维生素B12的能力,使其产量提高了39.7%;陈坤等[22]在地衣芽孢杆菌基因组中筛选获得1种新型组成型启动子,该启动子的表达强度分别是对照菌株的1.25和2 倍。
在提高类胡萝卜素产量的研究中,翁志明[23]通过对dxs基因启动子的置换将番茄红素的产量提高到15.6 mg/g DCW,相比于对照菌株提高了约13%;谢文平[24]利用类胡萝卜素的色度进行表征,比较了不同代谢途径相关启动子的强度,发现不同启动子之间的强度差距能够达到约20倍;YUAN等[25]利用同源重组的方法,将MEP 途径中关键基因dxs、idi、ispB和ispDF的启动子替换为T5强启动子,β-类胡萝卜素产量分别提高了100%、40%、20%和40%。再用T5启动子同时对这4个基因进行组合调控,产量提高了6.3 倍。SUH[26]也通过利用强启动子T5来调控MEP途经,使β-类胡萝卜素的产量提高了约4.5倍。
相比于文献报道中常用的诱导型启动子,采用组成型启动子可以不添加诱导物来控制目标基因的表达。因此,构建组成型质粒来过表达目标基因具有成本低、工艺简单的特点。但目前大肠杆菌中性能优良的组成型启动子较少,无法满足代谢调控的需求。因此,筛选组成型启动子成为提高番茄红素产量的重要环节。为了获得高产番茄红素的组成型启动子,本研究克隆大肠杆菌中转录因子相关基因的启动子区域,构建表达番茄红素合成基因的组成型质粒,提高合成番茄红素的表达水平,改良前期诱导型质粒的缺点,以达到提高番茄红素产量和优化生产工艺的目的。
4 结论
本研究从大肠杆菌基因组中筛选到具有高表达量且无需添加诱导剂的启动子Plpp、Pmglb,以编码番茄红素合成基因的CrtEBI为报告基因,对其表达活性进行研究。实验结果表明,重组菌Plpp、Pmglb番茄红素产量分别约为7.03、7.20 mg/g DCW,相较于对照菌株产量分别提高了47.7%、51.3%,实现了提高番茄红素产量的目标。同时,由于筛选到组成型启动子,省去了添加诱导剂的过程,达到了优化生产工艺的目的。
[1] 夏萍, 盛建军.番茄红素的提取工艺研究[J].应用化工,2007,36(10):975-979.
[2] CAROTHERS J M,GOLER J A,KEASLNG J D.Chemical synthesis using synthetic biology[J].Current Opinion in Biotechnology,2009,20(4):498-503.
[3] KIM S W,KIM J B,RYU J M,et al.High-level production of lycopene in metabolically engineered E.coli[J].Process Biochemistry,2009,44(8):899-905.
[4] 吴军林,吴清平,张菊梅,等.番茄红素的微生物合成及发酵生产研究进展[J].食品科学,2013,34(19):336-340.
[5] ZHU F,LU L,FU S,et al.Targeted engineering and scale up of lycopene overproduction in Escherichia coli[J].Process Biochemistry, 2015,50(3):341-346.
[6] JIN Y,STEPHANOPOULOS G.Multi-dimensional gene target search for improving lycopene biosynthesis in Escherichia coli[J].Metabolic Engineering,2007,9(4):337.
[7] 刘桂明,赵智,张英姿,等.谷氨酸棒杆菌10147基因组中启动子活性片段的克隆与分析[J].微生物学报,2009,49(7):972-977.
[8] SCHMITT E,KEMPKEN R,KUCK U.Functional analysis of promoter sequences of cephalosporin C biosynthesis genes from Acremonium chrysogenum:Specific DNA-protein interactions and characterization of the transcription factor PACC[J].Molecular Genetics & Genomics,2001,265(3):508-518.
[9] WOLFF A M,ARNAU J.Cloning of glyceraldehyde-3-phosphate dehydrogenase-encoding genes in Mucor circinelloides (Syn.Racemosus) and use of the gpd1 promoter for recombinant protein production[J].Fungal Genetics & Biology, 2002,35(1):21-29.
[10] 李妹芳,冯海霞,郭尚敬.植物热激蛋白启动子的特点及应用[J].安徽农业科学,2008,36(29):12 605-12 606.
[11] 蒋钰瑶,何嘉荣,王未未,等.新型大肠杆菌高效表达载体pHsh的构建与应用[J].微生物学通报,2012,39(3):394-400.
[12] 王卓,裴建军,李华钟,等.极耐热性β-葡萄糖醛酸酶的高效表达和酶学性质及其应用[J].生物工程学报,2008,24(8):1 407-1 412.
[13] QUAN J,TIAN J,Circular polymerase extension cloning for high-through put cloning of complex and combinatorial DNA libraries[J].Nature Protocols,2011,6(2):242-251.
[14] SUN T,MIAO L, LI Q,et al.Production of lycopene by metabolically engineered Escherichia coli[J].Biotechnology Letters, 2014,36(7):1 515-1 522.
[15] 余小霞,田健,刘晓青,等.枯草芽孢杆菌表达系统及其启动子研究进展[J].生物技术通报,2015,31(2):35-44.
[16] 贺飞燕,闫建俊,白云凤,等.启动子的类型及应用[J].山西农业科学,2017,45(1):115-120.
[17] MERFORT M,HERRMANN U,BRINGERNEYER S,et al.High-yield 5-keto-D-gluconic acid formation is mediated by soluble and membrane-bound 5-gluconatedehydrogenases of Gluconobacter oxydans[J].Microbiology&Biotechnology,2006,73(2):443.
[18] IKEDA M,MIZUNO Y,AWANE S,et al.Identification and application of a different glucose uptake system that functions as an alternative to the phosphotransferase system in Corynebacterium glutamicum[J].Applied Microbiology & Biotechnology, 2011,90(4):1 443-1 451.
[19] FUKUI K,KOSEKI C,YAMAMOTI Y,et al.Identification of succinate exporter in Corynebacterium glutamicum and its physiological roles under anaerobic conditions[J].Journal of Biotechnology, 2011,154(1):25-34.
[20] 胡于东.氧化葡萄糖酸杆菌梯度强度组成型启动子的筛选与应用[D].无锡:江南大学, 2015.
[21] 王玲玲,夏苗苗,董会娜,等.筛选脱氮假单胞菌启动子提高维生素B12产量[J].生物技术通报,2017, 33(8):159-166.
[22] 陈坤,袁飞燕,柴昊男,等.一种高效表达碱性蛋白酶的新型启动子的筛选及研究[J].生物技术通报,2018,34(1):208-214.
[23] 翁志明.利用代谢工程构建高产番茄红素大肠杆菌[D].广州:中山大学,2010.
[24] 谢文平. 代谢工程改造酿酒酵母生物合成类胡萝卜素的研究[D].杭州:浙江大学,2015.
[25] YUAN L Z,PIERRE E R,LAROSSA R A,et al.Chromosomal promoter replacement of the isoprenoid pathway for enhancing carotenoid production in E.coli[J].Metabolic Engineering,2006,8(1):79-90.
[26] SUH W.High isoprenoid flux Escherichia coli as a host for carotenoids production[J].Methods in Molecular Biology,2012,834:49.